氧化反应ppt课件
合集下载
氧化还原反应ppt课件

根据下列反应判断有关物质还原性强弱的顺序 A
H2SO3 + I2 + H2O === 2HI + H2SO4
2FeCl3 + 2HI === 2FeCl2 + 2HCl + I2 A.H2SO3 > I- > Fe2+ B.I- > Fe2+ > H2SO3 C.Fe2+ > I- > H2SO3 D.Fe2+ > H2SO3 >I-
电子的得失、共用电子对的偏移
氧化反应 还原反应 二者关系
元素化合价
电子的转移
升高
失电子(偏离)
降低
得电子(偏向)
二者是同时进行的
1.下列变化过程中,元素失去电子的是( D )
A.MnO2 → Mn2+
B.CuO → CuCl2
C.Ag+ → Ag2O
D.Sn2+ → Sn4+
2.下列说法正确的是( D ) A.有得、失氧的反应才是氧化还原反应 B.氧化还原反应中,氧化反应与还原反应是先后进行的 C.有电子得失的反应才是氧化还原反应 D.凡是有化合价升降的反应,都是氧化还原反应
高温
C + H2O ===== H2 + CO
CuO + H2 ==== Cu + H2O
物质 CuO
C H2O
C CuO H2
氧化(还原)反应 还原 氧化 还原 氧化 还原 氧化
化合价变化 降低 升高 降低 升高 降低 升高
化合价升高 —— 氧化反应
化合价降低 —— 还原反应
化合价升高,发生氧化反应
Zn + 2HCl ==== ZnCl2 + H2↑
化合价
得失电子
氧化反应课件-经典

重铬酸钠
Na2Cr2O7,H2SO4 Na2Cr2O7,H2SO4 CH3CH2CH2OH CH3CH2CHO CH3CH2COOH 0C HO,75
重铬酸钾
R R' CHOH
K2Cr2O7/CrO3
R R'
C=O
Sarrett试剂
CrO3+2 N
25° CH2Cl2 C
(C5H5N)2 CrO3
引发剂作用是缩短诱导期,是易产生自由基的物质, 一般是带有弱键、易分解成活性种的化合物,其中 共价键有均裂和异裂两种形式
(CH3)2C-N=N-C(CH3)2 CN CN
2CH3-C-CH3+N2 CN
R-H+CH3-C-CH3 CN
R +CH3-CH-CH3 CN
(1)引发剂和催化剂的影响
催化剂常采用过渡金属离子,常用的有Co和Mn,此外 还有Cr、Mo、Fe、Ni、V等。过渡金属离子并不参加 反应,而且可以通过空气氧化再生,可以保持持续的 催化作用:
R
H
3+ +Co
R
++Co2+ +H
Co2+
O2
Co3+
引发剂不能再生,其用量应为参与反应的剂 量。变价金属催化剂可被空气中氧氧化为高 价态,从而重复利用 但以有机过氧化氢物为产物时,不能采用催 化剂,只能采用引发剂来加速反应。
(2)被氧化物的结构的影响
叔碳上的氢最易被氧化,仲碳上的氢次之,伯碳上的 氢最难;
链引发
在能量、催化剂或引发剂的作用下
R
——
e
人教版化学必修一氧化还原反应ppt33张课件
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
第六章氧化反应130页PPT

二 、铬化合物
(二)三氧化铬-吡啶配合物(Collins试剂)
缺点在于该试剂很易吸潮,很不稳定,不 易保存,需要在无水条件下进行反应;同时为 了加快和反应完全,需用相当过量的试剂(≧ 五倍理论用量);另外配制时容易失火等。铬 化合物还有铬酰氯等。
2019/11/2
返回本节
三、含卤氧化剂
(一)卤素
2019/11/2
一、烃类化合物的氧化反应
(1)含烯键的羰基(与烯键共轭)化合物环氧化
O
O
H3C H3C
H2O2/NaOH/MeOH
CH3 15 20
H3C H3C
O CH3
2019/11/2
一、烃类化合物的氧化反应
(2)不与羰基共轭的烯键环氧化: ①过氧化氢或过氧化氢烷(或名烷基过氧
醇)作氧化剂 在过渡金属配合物的催化下, 用过氧化氢或过氧化氢烷作氧化剂,加入的催 化剂是过渡金属配合物,这些金属配合物包括 由钒、钼、钨、铬、锰和钛所构成的配合物。 对于非官能化烯键的环氧化最有效的催化剂是 M时o(,CO常)6 和用S过al氧en化-锰氢配烷合作物氧。化以剂M。o(CO)6作催化剂
全国高职高专药品类专业卫生部“十一五”
规划教材
供化学制药技术专业用 学习目标
药物合成技术 (配套光盘)
第一节 概述 第二节 常用氧化剂 第三节 药物合成中常用 的氧
第六章
化反应
第四节 催化氧化和生物 氧化
氧化反应
学习小结 目标检测
2019/11/2
下一页 首页
学习目标
学习目的 熟悉氧化反应的概念及类型、掌握烃类、醇、 醛、酮及芳烃氧化反应及相应的氧化剂。并了解 它们在药物合成中的应用。
(2)不与羰基共轭的烯键环氧化: 在非共轭不饱和酮中的双键是富电子的,不
氧化反应ppt课件

COOH
C
H C
K Mn 4,二 O环 已 基 -18-冠 -6
2
H
苯 , 250C
97%
O
OO
OO
O
K M4n /P h O H 200C
O
OO
K
OO
O
M O 4n -
R R 'C = C H 2H K + M H n O 2 O 4 R R 'C = O + C O 2
R R 'C = C H R K M n O 4R R 'C = O + O = C H R
O
m-ClC6H4CO3H CHCl3
C 2 P H h 5CC C C 3 3H H C 6 H 0 5 0 C C ,3 3 H 0 m O E i t n 2 O / C 2 P H h 5C O C C C 3 3H H
C 6 H 5 C H C H 2C 6 H 0 5 0 C C O ,3 H 2 4 / C h H C l 3 C 6 H 5 C HC H 2 O
O
RC + H O 2 O 2OH R O C O H + H 2 O
C 6 H 5 CO 2 O 2 O H c o r O H 3 S C A 3 H O H C 6 + H 5 C 3 H O H 2 O +
C 3 C HOO 2 O 乙 H H 酸 2 S 乙 4 酯 O C +3 C H 3 H H O2 O +
C 3 (2 C ) H 7 C H = H (C 2 C ) 7 C H H H K 室 M O 温 , 4 1 / 2 h 2 O H C O n 3 (O 2 C ) H 7 C O H - O H ( C H 2 C ) 7 C H O H O H H
氧化还原反应ppt课件

化合价降低,被还原,发生还原反应
+2
0 高温 0
+4
2CuO + C = 2Cu + CO2
有氧参与的反应
化合价升高,被氧化,发生氧化反应
一、氧化还原反应
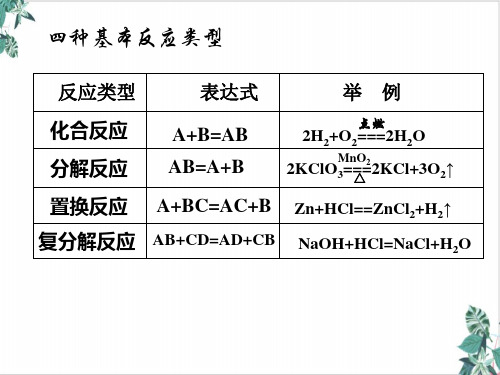
凡有元素化合价升降的化学反应都是氧化还原反应。
化合价降低,被还原,发生还原反应
+1
0
0
+2
无氧参与的反应
化合价升高,被氧化,发生氧化反应
(2019·抚顺高一期末)下列化学反应中,不属于氧化还原反应的是
解析 A项,氧化性:Z2>W2,不符合题给信息,反应不能发生; B项,氧化性:Z2>X2,符合题给信息,反应能发生; C项,氧化性:Y2>W2,不符合题给信息,反应不能发生; D项,氧化性:X2>Z2,不符合题给信息,反应不能发生。
二、氧化性、还原性强弱比较
(3)根据反应的难易(反应条件)比较下列物质的氧化性强弱
√A.CaCO3+2HCl===CaCl2+CO2↑+H2O
B.Fe+CuSO4===Cu+FeSO4 高温
C.Fe2O3+3CO===== 2Fe+3CO2 D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
判断正误
(1)氧化还原反应中一定有氧元素的得失(× ) (2)氧化还原反应中得电子的物质发生还原反应(√ ) (3)氧化还原反应中所有元素的化合价都一定发生变化(× ) (4)一个反应中可以只有元素化合价升高,而无元素化合价降低(× ) (5)有单质参加的反应一定是氧化还原反应(× )
②Fe+S
△ =====
FeS
可判断氧化性:氯气__>__硫。
1.下列微粒:①Al3+ ②Cl- ③N2 ④S2- ⑧MnO-4 。既具有氧化性又具有还原性的是
+2
0 高温 0
+4
2CuO + C = 2Cu + CO2
有氧参与的反应
化合价升高,被氧化,发生氧化反应
一、氧化还原反应
凡有元素化合价升降的化学反应都是氧化还原反应。
化合价降低,被还原,发生还原反应
+1
0
0
+2
无氧参与的反应
化合价升高,被氧化,发生氧化反应
(2019·抚顺高一期末)下列化学反应中,不属于氧化还原反应的是
解析 A项,氧化性:Z2>W2,不符合题给信息,反应不能发生; B项,氧化性:Z2>X2,符合题给信息,反应能发生; C项,氧化性:Y2>W2,不符合题给信息,反应不能发生; D项,氧化性:X2>Z2,不符合题给信息,反应不能发生。
二、氧化性、还原性强弱比较
(3)根据反应的难易(反应条件)比较下列物质的氧化性强弱
√A.CaCO3+2HCl===CaCl2+CO2↑+H2O
B.Fe+CuSO4===Cu+FeSO4 高温
C.Fe2O3+3CO===== 2Fe+3CO2 D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
判断正误
(1)氧化还原反应中一定有氧元素的得失(× ) (2)氧化还原反应中得电子的物质发生还原反应(√ ) (3)氧化还原反应中所有元素的化合价都一定发生变化(× ) (4)一个反应中可以只有元素化合价升高,而无元素化合价降低(× ) (5)有单质参加的反应一定是氧化还原反应(× )
②Fe+S
△ =====
FeS
可判断氧化性:氯气__>__硫。
1.下列微粒:①Al3+ ②Cl- ③N2 ④S2- ⑧MnO-4 。既具有氧化性又具有还原性的是
氧化反应PPT课件

在化工领域的应用
合成有机物
通过氧化反应将原料分子 中的碳-氢键转化为碳-氧 键或碳-碳键,合成多种有 机化合物。
制备高分子材料
通过氧化聚合反应将小分 子单体聚合成高分子材料, 如合成橡胶、塑料等。
化学工业过程
许多化学工业过程涉及到 氧化还原反应,如氧化铝 的制备、氨的合成等。
在生物领域的应用
生物氧化
燃烧反应是一种放热的、发光发热的氧化反应, 如燃料燃烧和爆炸等。
02 缓慢氧化
缓慢氧化是一种缓慢的、不易被察觉的氧化反应, 如铁生锈和酿酒等。
03 酶催化氧化
酶催化氧化是指在生物体内,由酶催化的氧化反 应,如细胞呼吸和乙醇代谢等。02氧化 Nhomakorabea应的化学原理
电子转移
电子转移是氧化反应的核心过程,其中物质失去 01 电子成为正离子,或得到电子成为负离子。
燃烧反应的速率取决于可燃物与氧气的接触面积和温度, 燃烧过程中会产生大量的热量和光能。
氧化还原反应
氧化还原反应是一种电子转移的反应,其中某些 原子或分子失去电子,而另一些原子或分子得到 电子。
氧化还原反应可以分为氧化反应和还原反应,两 者是相互依存的,一个物质被氧化,另一个物质 必定被还原。
氧化剂的种类与性质
氧化反应的重要性
01 能量转换
氧化反应是生物体内能量转换的重要过程,如细 胞呼吸和燃料燃烧等。
02 物质循环
氧化反应在自然界中是物质循环的重要环节,如 有机物的分解和矿物的氧化等。
03 生命过程
几乎所有的生命过程都涉及到氧化反应,如能量 代谢、细胞信号转导和免疫反应等。
氧化反应的类型
01 燃烧反应
氧化剂是一种能够夺取电子的物质,通常具有强氧化性。常见的氧化剂包括氧气、过氧化氢、 高锰酸钾等。 不同的氧化剂具有不同的氧化能力和选择性,使用时需要根据实际情况选择合适的氧化剂。
氧化还原反应PPT课件

第二章 化学反应及其变化
Part 01
二、氧化剂及还原剂
2、还原剂:失电子的物质。(化合价升高的物质)
1、氧化剂:得电子的物质。(化合 价降低的物质)
氧化剂
还原剂
e-
Zn + 2HCl == ZnCl2 + H2 ↑
分析:下列反应的元素化合价变化。
2Na + Cl2 = 2NaCl
+1
0
0
-1
虽然没有氧的得失,但元素的化合价发生了变化, 是氧化还原反应。
氧化还原反应
(特征)
定义: 凡有元素化合价升降的化学反应都是氧化还原反应。 判断一个反应是否为氧化还原反应的依据是否有元素化合价的改变。
练习:1、分析下列反应中各元素化合价在反应前后有无变化,如何变化。并判断是否是氧化还原反应。
电子转移及氧化还原关系的表示方法---双线桥法
再如:
升失 氧, 降 得还
化合价升高
是因为失去了电子
这种元素被氧化或 发生了氧化反应
规律:
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2 ② Zn + 2HCl == ZnCl2 + H2 ↑
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2
② Zn + 2HCl == ZnCl2 + H2 ↑
+4
+3
+2
0
化合价升高 失2e- × 3 被氧化
0
+1
+2
Part 01
二、氧化剂及还原剂
2、还原剂:失电子的物质。(化合价升高的物质)
1、氧化剂:得电子的物质。(化合 价降低的物质)
氧化剂
还原剂
e-
Zn + 2HCl == ZnCl2 + H2 ↑
分析:下列反应的元素化合价变化。
2Na + Cl2 = 2NaCl
+1
0
0
-1
虽然没有氧的得失,但元素的化合价发生了变化, 是氧化还原反应。
氧化还原反应
(特征)
定义: 凡有元素化合价升降的化学反应都是氧化还原反应。 判断一个反应是否为氧化还原反应的依据是否有元素化合价的改变。
练习:1、分析下列反应中各元素化合价在反应前后有无变化,如何变化。并判断是否是氧化还原反应。
电子转移及氧化还原关系的表示方法---双线桥法
再如:
升失 氧, 降 得还
化合价升高
是因为失去了电子
这种元素被氧化或 发生了氧化反应
规律:
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2 ② Zn + 2HCl == ZnCl2 + H2 ↑
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2
② Zn + 2HCl == ZnCl2 + H2 ↑
+4
+3
+2
0
化合价升高 失2e- × 3 被氧化
0
+1
+2
氧化还原反应ppt课件

VS
拉瓦锡 1743~1794 (法)
弗兰克兰 1825~1899(英)
1852年,弗兰克兰在研究金属有化合物时提出化合价的概念,并逐步得到完善后,人们把化合价升高的反应叫做氧化反应,把化合价降低的反应叫做还原反应。
得失氧的视角
化合价的视角
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
氧化还原反应
环节三:宏观辨识,归纳氧化还原反应和四大基本反应类型的关系
反应前后物质的类别和数目
反应前后有无元素化合价的变化
氧化还原反应
环节三:宏观辨识,归纳氧化还原反应和四大基本反应类型的关系
氧化还原反应
非氧化还原反应
本节小结
得氧、失氧
元素(宏观视角)
元素化合价升降
电子(微观视角)
电子转移(电子得失或共用电子对的偏移)
物质水平——得失氧的视角
在一个反应中同时发生
氧化还原反应
狭义
一种物质得到氧发生氧化反应,同时另一种物质失去氧发生还原反应的反应叫氧化还原反应。
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
1774年,拉瓦锡创立氧化学说(既燃烧是物质与氧气的反应)推翻了流行千年的燃素说,以解释燃烧等实验现象,指出动物的呼吸实质上是缓慢氧化。
化合价升高,
化合价降低,
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
氧化还原反应
非氧化还原反应
无元素化合价变化
有元素化合价变化
氧化还原反应的特征
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
拉瓦锡 1743~1794 (法)
弗兰克兰 1825~1899(英)
1852年,弗兰克兰在研究金属有化合物时提出化合价的概念,并逐步得到完善后,人们把化合价升高的反应叫做氧化反应,把化合价降低的反应叫做还原反应。
得失氧的视角
化合价的视角
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
氧化还原反应
环节三:宏观辨识,归纳氧化还原反应和四大基本反应类型的关系
反应前后物质的类别和数目
反应前后有无元素化合价的变化
氧化还原反应
环节三:宏观辨识,归纳氧化还原反应和四大基本反应类型的关系
氧化还原反应
非氧化还原反应
本节小结
得氧、失氧
元素(宏观视角)
元素化合价升降
电子(微观视角)
电子转移(电子得失或共用电子对的偏移)
物质水平——得失氧的视角
在一个反应中同时发生
氧化还原反应
狭义
一种物质得到氧发生氧化反应,同时另一种物质失去氧发生还原反应的反应叫氧化还原反应。
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
1774年,拉瓦锡创立氧化学说(既燃烧是物质与氧气的反应)推翻了流行千年的燃素说,以解释燃烧等实验现象,指出动物的呼吸实质上是缓慢氧化。
化合价升高,
化合价降低,
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
氧化还原反应
非氧化还原反应
无元素化合价变化
有元素化合价变化
氧化还原反应的特征
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
高一化学氧化还原反应优秀课件-PPT

第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应的基本概念及相互关系
回忆初中学过的氧化反应和还原反应
还原反应
CuO + H2 △ Cu + H2O
氧化反应
CuO + H2 △ Cu + H2O
一、从氧的得失角度分析
CuO + H2 △ Cu + H2O
CuO 失去氧 Cu
H2 得到氧 H2O
氧化剂 Cl2 还原产物 KCl
练习2:指出下列反应中哪种物质是氧化剂 、哪种物 质是还原剂以及氧化产物、还原产物。
(3) 2H2O =电=解= 2H2↑ + O2↑
还原剂 H2O
氧化剂 H2O
氧化产物 O2
还原产物 H2
(4) MnO2 + 4HCl =△= MnCl2 + Cl2↑+2H2O
还原剂 HCl 氧化产物 Cl2
+5 -2
2KClO3
=△=
-1
2KCl
+
0
3O2↑
练习6:下列说法下说法正确的是( BD )
A、氧化剂本身被还原,生成氧化产物。
B、氧化剂是在反应中得到电子(或电子对偏 向)的物质。
C、还原剂在反应时所含元素的化合价降低。
D、在一个反应中,氧化剂和还原剂可能是同 一物质。
练习7:下列反应中,HCl为还原剂的是( C ) HCl为 氧化剂的是( A ) HCl不是氧化剂也不是还原剂的是 ( BD )
被还原,得到e-,化合价降低
氧化还原反应的特征:化合价升降 氧化还原反应的实质:电子转移(得失或偏移)
通过以上分析,我们认识到:
1.有电子转移的反应是氧化还原反应。
第三节 氧化还原反应
氧化还原反应的基本概念及相互关系
回忆初中学过的氧化反应和还原反应
还原反应
CuO + H2 △ Cu + H2O
氧化反应
CuO + H2 △ Cu + H2O
一、从氧的得失角度分析
CuO + H2 △ Cu + H2O
CuO 失去氧 Cu
H2 得到氧 H2O
氧化剂 Cl2 还原产物 KCl
练习2:指出下列反应中哪种物质是氧化剂 、哪种物 质是还原剂以及氧化产物、还原产物。
(3) 2H2O =电=解= 2H2↑ + O2↑
还原剂 H2O
氧化剂 H2O
氧化产物 O2
还原产物 H2
(4) MnO2 + 4HCl =△= MnCl2 + Cl2↑+2H2O
还原剂 HCl 氧化产物 Cl2
+5 -2
2KClO3
=△=
-1
2KCl
+
0
3O2↑
练习6:下列说法下说法正确的是( BD )
A、氧化剂本身被还原,生成氧化产物。
B、氧化剂是在反应中得到电子(或电子对偏 向)的物质。
C、还原剂在反应时所含元素的化合价降低。
D、在一个反应中,氧化剂和还原剂可能是同 一物质。
练习7:下列反应中,HCl为还原剂的是( C ) HCl为 氧化剂的是( A ) HCl不是氧化剂也不是还原剂的是 ( BD )
被还原,得到e-,化合价降低
氧化还原反应的特征:化合价升降 氧化还原反应的实质:电子转移(得失或偏移)
通过以上分析,我们认识到:
1.有电子转移的反应是氧化还原反应。
氧化反应PPT课件

.
18
第一节 烃类的氧化 一苄位的氧化
2.2 氧化成酮
OO CrO3/HOAc
40℃
H 3C O
C rO 3/H O A c(75% ) 40℃ 、 2hr H 3C O
.
O
19
a. K MnO4 b. Na2C r2O7
c. H2N.O13 形成酮
NO2
NO2
O
a. C A N/HNO3/ 30℃, 90' b. C rO3/HOA c/ 20℃
O
.
8
第一节 烃类的氧化
一.苄位的氧化
1 氧化成醛
② 二氯铬酰(Etard埃塔试剂)
制备:HCl, H2SO4滴加到CrO3中,蒸馏除水
C r O 3 + H C l < H 1 2 S 0 ℃ O 4 O O G rC C ll b p 1 1 7 ℃
.
9
第一节 烃类的氧化 一.苄位的氧化
1 氧化成醛
CH3
O2/260℃
COOH
N
V2O5
N
C H 3 O 2 C o(O A c)2
B r
.
C O O H
B r
17
2.1 常用形成酸法的总结
C H3 a. K MnO4 b. Na2C r2O7
c. HNO3
COOH
NO2
NO2
O
a. C A N/HNO3/ 30℃, 90'
b. C rO3/HOA c/ 20℃
常用氧化剂:Na2Cr2O7, KMnO4, HNO3等
①铬酸:
Na2Cr2O7+H2O+H+ CrO3+H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧化方法
1.无机与有机氧化剂氧化 氧气(空气),臭氧,含高价原子的无机化合物等为无
机氧 化剂;硝基苯 ,有机过氧化物, 四 醋 酸铅,叔 丁醇铝, 二甲亚砜 等为有机氧化剂。最易获得且最价廉 的氧化剂为空气,在催化剂作用下的催化空气氧化广泛 应用于化工生产。
2.气相氧化和液相氧化。
3.在操作方式上, 又可分为应用化学试剂的化学氧化,应用电解
C3H CH=CC HH CO =
H H 3 C 3 CO O O CH 2 H C 2 O C H 2 5 M H 0 C H 丙 2 酮 n H H 3 C 3 C OO O O CH 2 C 2 O C H H
思考题
1.用C2以下的有机物为原料合成CH3CH2CH2COOH 2.以甲苯和C2以下有机物为原料合成3-苯基丙烯酸 3.以H2C=CHCH3为原料合成H2C=CHCH2CH2COOH
H + H 2 O
思考题
CH3
1.用C2以下的有机物为原料合成
H H
OH OH
CH3
O
O
2.用C3以下的有机物为原料合成 C H 3C C H 2C H 2C H 2C H 2C C H 3
O
O
CH3CCH2CH2CH2CH2CCH3
CH3
CH3
+
OH OH
2H3C C=O
H3C
(2) OsO4
Collins试剂 10份吡啶,在一面搅拌下一面徐徐加入l份铬酐(加料
2.有机过氧酸及其酯氧化
(1)过氧化酸不稳定,久置易分解,有杂质存在时,能加速分 解。 (2)能形成分子内氢键,因此,具有挥发性。 (3)过氧酸是重要的环氧化试剂,作用于双键即可形成环氧化 物。 (4)过氧酸对双键的氧化过程为亲电加成反应,双键电子云密 度越高或过氧酸的亲电性越强,氧化就越容易进行。对于电子云 密度较低的双键(如双键与强吸电子基相邻时)需采用亲电性较大 的过氧酸(如三氟过氧酸)为氧化剂.
方法的电解氧化,应用微生物的生化氧化,以及在 催化剂作用下的催化氧化等。 不同的氧化剂有不同的氧化特征。往往一种氧化剂可 以对几种不同基团发生氧化,反之,一种基团也可以 受多种氧化剂氧化。因此,选择适当的符合要求的氧 化剂是比较复杂的过程,需要对各种氧化剂的特性和 应用范围有一定的了解。
3.1 烯烃的氧化反应
O
O Os4,O H 2O 2
O
O
O
HO O
HO
OH
OH
O
思考题
1.比较KMnO4与OsO4氧化剂的特点。
2.用C2以下的有机物合成顺-1,2-环已二醇。
O H O H
+
3.用C4以下的有机物为原料合成已二醛。
3.1.2 烯烃臭氧化反应
RR'C=CHRO3
R
O C
O C
H
R' O R
Zn,H2O
OHC
CHO HOH2C
CH2OH
O
3.用C2以下的有机化合物为原料合成 CH 3C(CH 2)4CO O H
3.1.3 烯烃的环氧化反应
1.过氧化氢(H2O2)氧化
O
RCH CH C R'
R CHCH=CR'
HO-O -OH-
O RCH CH C
O
OOH OR'
特性:H2O2具有弱酸性、比较缓和。反应后不残留杂质,产品纯净。
R CN + CC O OH
CC+R CN 2H
O
O
C 2 + H P h C N H 2 O 2 /4 2 K 5 C 0 C 3 / M e O OH O C 2 + H P hC O N 2 H
C HCC NH 2O 2
N aO H
HH
CO O
CC
N H
O
P hCCCN H 2 HOP h
(2)在酸性介质 中,H2O2与有机酸作用,使有机酸氧化 成有机过酸,这也是有机过酸的制备方法 。
(提示:用MnO2氧化剂氧化)
3.2.3.叔丁基铬酸酯氧化
于冰浴中置无水叔丁醇,边搅拌边分批加入铬酐 即得到叔丁基铬酸酯[Me3COCrO2(OH)]。进行氧化 时多以石油醚为溶剂。它可将羟基氧化为碳基。例如:
OM H 3 C O e C r O 2 (O石 H 油 醚 ) O
3.2.4 Collins试剂氧化
(1)在碱性介质中,以HOO-的形式进行氧化反应。
O
O
H2O2/NaOeH OH/M
15~200C
O
过氧亚酰胺酸
RCN HO - O
RCN H 2ORCN OOH OOH
R CN + H O -O H O O H
R CN H 2+ O 2+ H 2 O O
过氧亚酰胺酸本身是一种很好的氧化 剂,能使烯烃氧化成 环氧化合物。
二、作业 1(1、3、5、6、8~16),2(1、2、3、4、5)
概念
氧化可以看作为被氧化的物质失去电子或发生部分 电 子转移的过程。对于以共价键结合的有机化合物,可将氧 化视为碳原子周围的电子云密度降低的过程。
氧化(Oxidation)是一类最普遍、最常用的有机化学 反应。 通过氧化可以合成出如醇、醛、酮、羧酸、酸酐、 酚、醌等含氧化合物。乙烯经催化氧化制备乙醛,丙烯经 氨氧化制备丙烯醛均为氧化反应的结果,被誉为近代石油 化工中突出成就之一。
C3H
C3H
C2H CC2 H O 5 F 3 C O 3 C H C O 2 /H N O 4 P /a Cl3 HC H 3 CCC2 H O 5 O
回 流
O
RC O3H
OH
OCO3CH
RC O3H
OH
反
O
应
发
OCO3CH
生
在
位
O
阻
小
的
一
思考题
O
CH3
1.用C3以下的有机物为原料合成
O H3C CCOOC2H5 O
1.由1-丁烯合成1-丁醛 2.由甲苯和C2以下的有机物为原料合成3-苯基丙醛。
3.1.5二氧化硒氧化
OH O
Se2O
+
C H = C H
O O Se 2 O C
2.以甲苯为原料合成
OO CC
3.2醇的氧化
3.2.1KMnO4氧化
伯醇: R H 2 C C 2 C H 2 H O K 室 M 温 H O , 4 1 / 2 h H nR O H 2 C C 2 H C O H O 8 4 % H
COOH
C
H C
K Mn 4,二 O环 已 基 -18-冠 -6
2
H
苯 , 250C
97%
O
OO
OO
O
K M4n /P h O H 200C
O
OO
K
OO
O
M O 4n -
R R 'C = C H 2H K + M H n O 2 O 4 R R 'C = O + C O 2
R R 'C = C H R K M n O 4R R 'C = O + O = C H R
O
Ph
2.以苯和C2以下的有机物为原料合成
C
C C NH2
H O Ph
(提示:参见在碱性条件下用H2O2氧化烯烃来制备该化合物。)
3.用C2以下的有机物为原料合成 C H 3C H C H C H O
HO
4.用C4以下的有机特为 原料合成 HO
O COOH
COOH
3.1.4铬酰氯氧化(Etard's剂)
仲醇:
R H 2 O C C C H 2 H R H K M O '4 /O n -R H H 2 O C C 2 R C'H R R H O 2 C C C O O + + 'C 2 C H O R H H O R O H O 'O
用作氧化剂的MnO2有两种,一种为 MnO2与硫酸的混合物,一种为活性的MnO2。
3.1.1烯烃与KMnO4、 OsO4 氧化
R
C H
R C+
O OMn
HR 顺式加成 C O
O-
Mn
HO O
CO O
OH - R
R
CC
H
H
OHOH
HR
烯烃与KMnO4反应在酸性介质中和较高温度下进行时,生成的 二醇会继续被氧化使碳碳键断裂生成两个酮,一个酮一个羧酸或 两个羧酸。因此,为获得二醇需保持介质的碱性并严格控制较为 温和的反应条件。例如:
制备: 将CrO3溶解在水中,在00C下加入一定量的浓HCl ,并在100C左右滴加硫酸,分层、分离、分馏。收集沸点 1170C馏分即为Etard’s试剂。
C 3 C 2 H C H H 2 C C C l O 4 , 2 0 C 0 C = 2 rC lC 3 C 2 H C C H H lH O H C 2 O C C H 3 C l2 H C C O H l 2 O H C
R R'
C
O+O=C
H R
H2/Pd-C R R'CHOH+HO-H2CR
LiAlH4 or NaBH4
RCHOH+ R'
HO-H2CR
H2O2/H2ORC O+ HOOCR R'
烯烃的臭氧化反应可以用于(1)烯烃双键结构的鉴定。 (2)用于醛、酮、酸的合成。
思考题 1.试设计戊二醛的合成路线。
2.用环戊二烯和C2以下的有机物为原料合成
