新课程高考中的新亮点“三大平衡常数”
三大常数.doc
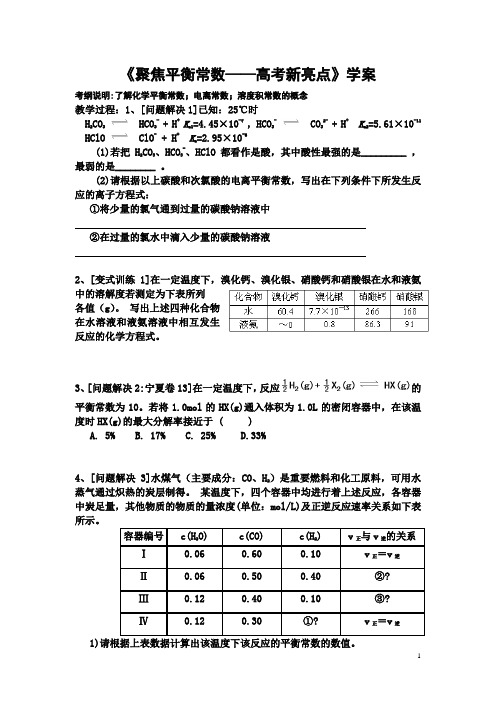
《聚焦平衡常数——高考新亮点》学案考纲说明:了解化学平衡常数;电离常数;溶度积常数的概念教学过程:1、[问题解决1]已知:25℃时H 2CO 3 HCO 3- + H + K a1=4.45×10-7 , HCO 3- CO 32- + H + K a2=5.61×10-11 HClO ClO - + H + K a =2.95×10-8(1)若把H 2CO 3、HCO 3-、HClO 都看作是酸,其中酸性最强的是_________ ,最弱的是________ 。
(2)请根据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:①将少量的氯气通到过量的碳酸钠溶液中②在过量的氯水中滴入少量的碳酸钠溶液2、[变式训练1]在一定温度下,溴化钙、溴化银、硝酸钙和硝酸银在水和液氨中的溶解度若测定为下表所列 各值(g )。
写出上述四种化合物在水溶液和液氨溶液中相互发生反应的化学方程式。
3、[问题解决2:宁夏卷13]在一定温度下,反应的平衡常数为10。
若将1.0mol 的HX(g)通入体积为1.0L 的密闭容器中,在该温度时HX(g)的最大分解率接近于 ( ) A. 5% B. 17% C. 25% D.33%4、[问题解决3]水煤气(主要成分:CO 、H 2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得。
某温度下,四个容器中均进行着上述反应,各容器中炭足量,其他物质的物质的量浓度(单位:mol/L)及正逆反应速率关系如下表所示。
1)请根据上表数据计算出该温度下该反应的平衡常数的数值。
2)填写表中相应的空格5、[变式训练3:广东卷18(多选)]硫酸锶(SrSO 4)在水中的沉淀溶解平衡曲线如下。
下列说法正确的是A .温度一定时,K sp (SrSO 4)随c(SO 42-)的增大而减小B .三个不同温度中,313K 时K s p (SrSO 4)最大C .283K 时,图中a 点对应的溶液是不饱和溶液D .283K 下的SrSO 4饱和溶液升温到363K 后变为不饱和溶液6、[学以致用]肾结石的主要成分及其相关数据如表所示:知识简介:尿酸(HUr)是一种微溶于水的物质,在37℃时1L 水中仅溶解0.5mmol,易形成白色晶体,尿酸在水、乙醇、乙醚中的溶解度不大。
高考的新宠——“三大平衡常数”

fHI r t l・I . 据 化 学 平 衡 常 数 公 式 K — ( )— o o 根
④ 化 学平衡 常数是指 某一 具 体化学 反 应 的平衡 常
当化学反应 方程式 的各物 质的化 学计 量数倍 增或倍 cNH ) 衡×(HI甲 = o ・I ×4to ・ , 答 数 , ( 3 ’ )衙=5t l ( =o 一 l L 故 o 减时, 化学平衡 常数也会 发生相 应 的变化 。 案选 ( 、 。
浓度 。
考
象 焦
c C 一0 1to ・ , ( O) . l I 在这 种情 况 下该 反应是 否 处 于 o
方法 要 点 ① 对 于 一 般 的可 逆 反 应 : A( ) g + 平衡 状 态 n () B g ̄ p g +q g , 中 Ⅲ、 P、 别 表 示 化 是 7 C( ) D( ) 其 q分 2 正
一口
- 粤 q 馨毒 羹 嚣 鏊誊。 鏊 ll - 疆 警 - 。 l 。 蠹 毫囊 ≥ 篱 ≮ l誊 鼍 鼍 | 0 l誊 | | 蠢 一! l鬈| 囊j i i|| 一 鬻 - 鼍 1 l i 。 警 罄甏鬣 褥转 n 静盛 懒 勰 翳 鹋
点评 本题 考查 的是应 用 化 学平 衡 常 数公 式 求 化
针对性 训练
1 .高 炉 炼 铁 中发 生 的 基 本 反 应 如 下 : e S + C ) F O( ) (
学平衡常 数 。答 题 者 易 错 选 D. 因是 将 ① 式 生 成 的 原
fHI= 5mo ・ 代入 了化 学平衡 常数公 式 中进行 了 ( )= l I = () g 呈 F ( ) C ( ) 正 反 应 为 吸 热 反 应 ) 已知 e s + O2 g ( ,
1t l I . o ・ 故①式生成 ( HI一f HI平 o ’ ) ( ) 衡+( HIe ( ’ )  ̄一 (
【参赛课件】化学高三二轮复习《三大平衡常数》(新课标必修1)

K值越大,表明反应进行得越
反应进行得越 不完全 。
完全 ;K值越小,表示
(2)弱酸、弱碱的电离平衡常数能够反映弱酸、弱 碱酸碱性的相对强弱。 越 电离常数越大,弱酸的酸性越 强 。
强 ,弱碱的碱性
(3)难溶电解质的Ksp的大小反映了难溶电解质在 水中的溶解能力。
三、平衡常数的影响因素
三大平衡常数都只与 温度 有关,与其他
例3:现将2mol SO2(g) 1mol O2(g)放入容积为1 L的密 闭容器中,反应 2SO2(g)+O2(g) 2SO3(g)在一定条 件下达到平衡。 2 1 ( ) c2(SO3) 2 2 2 勒沙特列原理 K= 2 2 1 1 2 c (SO2) · c(O2) ( )· 2 · 2 2 2 放热 (1)K(300℃)>K(350℃),该反应是________热反应
2013年高考二轮专题复习
高考的新宠——
三大平衡常数
知识整合
表达式 影响因素
概 念
表明反应 进行程度 意义 应用 判断反应进行方向 计算反应物转化率
平衡常数
化 学 平 衡 常 数
电 离 平 衡 常 数
溶 度 积 常 数
一、平衡常数的表达式: 对于可逆反应:a A(g)+ b B(g) c C(g)+d D(g),其中a、 b 、 c 、 d 分别表示化学方程式中个反应物和生成物的化学计量 数。当在一定温度下达到化学平衡时,这个反应的平衡常数表 达式为: 。 cc(C)• cd(D) K = ca(A)• cb(B) 若A为固体,a A(s)+ b B(g) 达式为: cc(C)• cd(D) K = cb(B) 如CH3COOH Fe(OH)3(s)
五大平衡常数的比较和应用

五大平衡常数的比较和应用五大平衡常数是指化学平衡常数、弱电解质的电离平衡常数、水解平衡常数及难溶电解质的溶度积常数,这部分知识为新课标中的新增内容,在高考题中频繁出现,特别是化学平衡常数及溶度积常数的应用更是考试的热点内容。
化学平衡常数(K) 电离平衡常数(K a、K b)水的离子积常数(K w)水解平衡常数难溶电解质的溶度积常数(K sp)概念在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数在一定条件下弱电解质达到电离平衡时,电离形成的各种离子的浓度的幂之积与溶液中未电离的分子的浓度的比值是一个常数,这个常数称为电离平衡常数水或稀的水溶液中c(OH-)与c(H+)的乘积水解平衡也是一种化学平衡,其平衡常数即水解常数在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之积为一常数表达式对于一般的可逆反应:m A(g)+n B(g)p C(g)+q D(g),在一定温度下达到平衡时:K=错误!(1)对于一元弱酸HA:HA H++A-,平衡常数K a=错误!;(2)对于一元弱碱BOH:BOH B++OH-,平衡常数K b=错误!K w=c(OH-)·c(H+)如NaA溶液中,A-(aq)+H2O(l)HA(aq)+OH-(aq) K h=错误!=K w/K aM m A n的饱和溶液:K sp=c m(M n+)·c n(A m-)影响因素只与温度有关只与温度有关,升温,K值增大只与温度有关,温度升高,K w增大温度(升温,K h增大)只与难溶物的种类和温度有关一、化学平衡常数常考题型(1)求解平衡常数;(2)由平衡常数计算初始(或平衡)浓度;(3)计算转化率(或产率);(4)应用平衡常数K判断平衡移动的方向(或放热、吸热等情况)注意事项从基础的地方入手,如速率计算、“三阶段式”的运用、阿伏加德罗定律及其推论的应用、计算转化率等,这些都与化学平衡常数密不可分(严格讲电离平衡、水解平衡、沉淀溶解平衡也是化学平衡,只是在溶液中进行的特定类型的反应而已),要在练习中多反思,提高应试能力高炉炼铁过程中发生的主要反应为13Fe2O3(s)+CO(g)23Fe(s)+CO2(g)。
新高考化学平衡知识点归纳

新高考化学平衡知识点归纳随着新高考的实施,各学科的考试内容也进行了一系列的调整和改革。
作为一门重要的基础学科,化学的考试内容也相应做出了一些改变。
在新高考中,化学的平衡知识点是重点考查的内容之一,下面将对新高考化学平衡知识点进行归纳和总结。
平衡是化学反应中的一种特殊状态,指在封闭容器中,反应物和生成物浓度保持一定比例的状态。
在新高考中,平衡是一个重要的概念,涉及到了反应速率、反应热力学以及化学平衡的常规表达式等方面的内容。
首先,我们需要了解平衡常数和平衡表达式的概念。
平衡常数是指在平衡状态下,反应物浓度和生成物浓度的比例,可由平衡表达式表示。
平衡表达式的形式为:aA+bB↔cC+dD,其中a、b、c、d分别表示反应物和生成物的摩尔数,在反应物和生成物浓度之间用方括号表示。
例如,对于反应物A和B生成产物C和D的反应,平衡表达式可表示为[A]^a[B]^b=[C]^c[D]^d。
其次,需要掌握平衡常数的计算方法。
平衡常数K的计算方法有两种:通过实验测定和利用反应物和生成物的摩尔比确定。
通过实验测定是指在实验室中通过一系列实验,测定出不同条件下反应物和生成物的浓度,然后利用平衡表达式计算平衡常数。
利用反应物和生成物的摩尔比确定是指根据平衡反应的化学方程式,得到平衡时反应物和生成物的摩尔比,然后利用摩尔比计算平衡常数。
平衡常数K的大小与反应物和生成物的浓度有关,与反应过程所需的能量有关。
进一步,需要了解平衡常数的意义和应用。
平衡常数K的大小反映了平衡反应的偏离程度,它是指数关系的,当K>1时,反应偏向生成物的方向,说明生成物浓度较大;当K<1时,反应偏向反应物的方向,说明反应物浓度较大;而当K≈1时,反应物和生成物的浓度基本相等。
平衡常数还可以用于计算反应物和生成物浓度的比例,以及预测反应物质的相对含量等。
最后,需要掌握影响平衡常数的因素。
影响平衡常数的因素有温度、浓度和压强等。
温度的升高会使平衡常数增大,反应偏向生成物的方向,温度的降低则会使平衡常数减小,反应偏向反应物的方向。
高考中亮点:三大平衡常数(wendang)

针对性训练: 1.高炉炼铁中发生的基本反应如下:FeO(s)+CO(g)= Fe(s)+CO2(g)(正反应为吸热反应),已知1100℃时, 该反应的化学平衡常数为0.263。若在1100℃时,测得高 炉中c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情 况下该反应是否处于平衡状态_______(填“是”或 “否”),此时化学反应速率是V正____V逆(填“大 于”、“小于”或“等于”),其原因 是 。 答:由于此时K/=c(CO2)/c(CO)= (0.025 mol· L-1) / (0.1 mol· L-1)=0.25≠K =0.263,所以 反应不处于平衡状态,又因为0.25<0.263,则v 正 > v逆,化学平衡向正反应方向移动。
度积常数,简称溶度积,它只受温度影响,不受溶液中物 质浓度的影响。 ③溶度积的应用:通过比较溶度积和溶液中有关离子浓度幂的 乘积(离子积QC)的相对大小,可以判断难溶电解质在给定条 件下沉淀能否生成或溶解。 QC >Ksp 溶液过饱和,有沉淀析出,直至溶液饱和达到新的平 衡状态 QC= Ksp 溶液饱和,沉淀与溶解处于平衡状态 QC <Ksp溶液未饱和,无沉淀析出,若加入过量难溶电解质, 难溶电解质溶解直至溶液饱和。
③对于多元弱酸来说,由于上一级电离产生的H+对下
一级电离起到抑制作用,一般是K1≥K2≥K3,即第二步电 离通常比第一步电离难得多,第三步电离又比第二步电 离难得多,因此在计算多元素弱酸溶液的c(H+)或比较 弱酸酸性相对强弱时,通常只考虑第一步电离。
三、沉淀溶解平衡常数
例5 (2008年山东卷)某温度时,BaSO4在水 中的沉淀溶解平衡曲线如图所示。下列说 法正确的是( ) 提示:BaSO4(s)= Ba2+(aq)+SO42-(aq) 平 衡常数Ksp=c(Ba2+)· c(SO42-),称为溶度 积常数。 A.加入Na2SO4可以使溶液由a点变到b点 B.通过蒸发可以使溶液由d点变到c点 C.d点无BaSO4沉淀生成 D.a点对应的Ksp大于c点对应的Ksp 解析:当加入Na2SO4溶液时,c(SO42-)增大,沉淀溶解平衡向 沉淀析出方向进行,则c(Ba2+)会减小,故A错;蒸发溶液时, 可使溶液的c(SO42-)和c(Ba2+)同时增大,而d→c显示c(SO42-)未 变,故B错;d状态点,因其在沉淀溶解平衡点c点的下方,说 明未达到沉淀溶解平衡状态,故无BaSO4沉淀生成,C正确;D 项,因a、c两点对应的都是在相同的温度下的Ksp,故二者的 Ksp相同,D错。本题答案选C。
新课标中平衡常数在高考中的运用
新课标中平衡常数在高考中的运用化学平衡常数、电离平衡常数、沉淀溶解平衡常数属于新课标的新增内容。
从近几年参加课改省份的高考试卷中发现,化学平衡常数、电离平衡常数和沉淀溶解平衡常数已成为高考的热点内容,如2011年得新课标全国卷、浙江卷、广东卷、海南卷中都有涉及。
主要考查内容为化学平衡常数的简单计算,应用化学平衡常数判断反应进行的方向。
一、化学平衡常数在人教版选修四《化学反应原理》中平衡常数占的篇幅比较少,在选修二化学反应限度的基础上能定量计算。
课标的要求也比较简单,一是要了解平衡常数的定义。
二是能根据平衡常数计算反应物的转化率。
新课标考纲也只要求能运用化学平衡常数进行简单计算。
如(2011新课标全国)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。
已知H 2(g )、CO (g )和CH 3OH (l )的燃烧热△H 分别为-285.8kJ ·mol -1、-283.0kJ ·mol -1和-726.5kJ ·mol -1。
请回答下列问题:(1)用太阳能分解10mol 水消耗的能量是_____________kJ ;(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;(3)在溶积为2L 的密闭容器中,由CO 2和H 2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T 1、T 2均大于300℃);下列说法正确的是________(填序号)①温度为T 1时,从反应开始到平衡,生成甲醇的平均速率为:v(CH 3OH)=A A n l mol·L -1·min -1 ②该反应在T 1时的平衡常数比T 2时的小③该反应为放热反应④处于A 点的反应体系从T 1变到T 2,达到平衡时23()()n H n CH OH 增大 (4)在T 1温度时,将1molCO 2和3molH 2充入一密闭恒容器中,充分反应达到平衡后,若CO 2转化率为a,则容器内的压强与起始压强之比为______;(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为________、正极的反应式为________。
不可忽视“三大平衡常数”在高考中的基本运用

解析 : 依 据 电荷守 恒式 c ( H ) +c ( NHl 十) ——
c ( C 1 一 ) +f ( OH一) , 由反应 平衡 时溶 液呈 中性 , c ( H ) —— f ( OH ) = = = 1 0 。 t oo l・I ~, 推 出 f ( NH +)一
c ( C 1 一) = = : o . 0 1 m o l ・ I ~, 电离平衡 常数 与化 学平 衡常
方程 式 : HS O + H O — H2 S O 。 + OH一, Kh 一
c ( CH。 C OOH) 和c ( C H。 C O O一) 均减 小 , 不 容 易 直接
旦
,
结合 2 5 ℃时 K 一 c ( H )・
判 断 常 数
— — — —
变化, 若 根据 c H。 C OOH 的 电离 K 一
电离常数 : K 一
0 . 0 1 oo t l・I 一 × 1 0~ oo t l・I ~
一
一
1 0 。
电离平衡常数( 2 5 ℃) 1 . 8 ×1 O 一 4 . 9 ×质的量浓度 的 N a C N、 Na 2 C ( J { 、 C H3 C ( X) Na三
旦 因温 度 不 变 , K 电离 平 衡 常 a ’ ’
1
已知 2 5  ̄ C时 , AI ( OH) 。的 K 。 一1 . 3 ×
数 K 是 定 值 , 稀 释 后 c ( H ) 减 小 , 则 戛
浓度 。
解析 : 根据 盐类 水 解 规 律—— 越 弱 越 水 解 。 首 先
要 判 断 Na C N、Na 2 C O 。 、 C H3 C OO Na 对 应 的 酸
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
不是其他时刻的.
②在进行K值的计算时,固体和纯液体的浓度 可视为“1”。例如: Fe3O4(s)+4H2(g) 3Fe(s)+4H2O(g), 在一定温度下,化学平衡常数:
③利用K值可判断某状态是否处于平衡状态。例如,在
某温度下,可逆反应mA(g)+nB(g)==pC(g)+qD(g),平
③对于多元弱酸来说,由于上一级电离产生的H+对下 一级电离起到抑制作用,一般是K1≥K2≥K3,即第二步电 离通常比第一步电离难得多,第三步电离又比第二步电 离难得多,因此在计算多元素弱酸溶液的c(H+)或比较 弱酸酸性相对强弱时,通常只考虑第一步电离。
三、沉淀溶解平衡常数
例5 (2008年山东卷)某温度时,BaSO4在水 中的沉淀溶解平衡曲线如图所示。下列说
A.加入AgNO3可以使溶液由c点变到d点 B.通过稀释可以使溶液由d点变到c点
C
C.d点有AgCl沉淀生成
D.b点对应的Ksp小于a点对应的Ksp
2.现代炼锌的方法可分为火法和湿法两大类。
火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧
使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风
炉中加热至1373-1573K,使锌蒸馏出来。主要反应为:
焙烧炉中:2ZnS+3O2=2ZnO+2SO2 ①
鼓风炉中:2C+O2=2CO
②
鼓风炉中:ZnO(s)+CO(g)== Zn(g)+CO2(g) ③
示t1时刻后Ag+和SO42-浓度随时间变化关系的是( )
在=液()<解cA中A(KA析ggcsg2+p(S:)+,O)/S因=4O溶2饱0=A4.液02和0g-3).204处S溶1mO=7于液mo04溶.l1未o/中LlL液/饱×,×L中;和0因0.存.01当状为1L7在/加态mc0(沉oA.入。2lg淀/L1故+L=0)溶0+=0答m.00解0.案.l1107平L03选m.4×0衡m2oB00loA/。.m0lLg/2o2,LmSl/,Oo此Ll4所/N时=La以==Q2S0c2cO.(A=041gc溶8S(+5OA液m+g42o+后-S))l/cO,(LS42,溶O- 4c,2-
(5)同一可逆反应的正、逆反应平衡常数互为 倒数
例2.二氧化硫和氮的氧化物是常用的化
工原料,但也是大气的主要污染物。综
合治理其污染是环境化学当前的重要研
究内容之一。硫酸生产中,SO2催化氧 化生成SO3:2SO2(g)+O2(g)=2SO3(g)。
某温度下,SO2的平衡转化率(α)与体系 总压强(p)的关系如图所示。根据图示回
例6 (2008年广东卷)已知Ag2SO4的Ksp 为2.0×10-5,将适量
Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和 SO42-浓度随时间变化关系如右图(饱和Ag2SO4溶液中
c(Ag+)=0.034mol·L-1)。若t1时刻在上述体系中加入
100mL0.020mol·L-1Na2SO4 溶液,下列示意图中,能正确表
一、化学平衡常数
例生1下、列将反固应体:NH4I置于密闭容器中,在一定温度下发
c的(H平2)衡=常0.5数m为ol·L
c(HI)=4mol·L1,则此温度下反应①
()
A.9 B.16 C.20
D.25
解析:由平衡时氢气的浓度可求得反应②分解消耗HI 的浓度,c(HI)= 0.5mol·L-1×2=1mol/L,故①式生成 c(HI)= c(HI)平衡+ c(HI)分解= 4mol·L-1+1mol/L
H2CO3 =HCO3-+H+ 的平衡常数 K1=
。
(已知:10-5.60=2.5×10-6)
解析:根据电离平衡常数公式可知: K1=c(H+)c(HCO3-)/c(H2CO3)
=10-5.60×10-5.60/l.5×10-5=4.2×10-7mol. L-1。
例4 下列有关电离平衡常数(K)的说法正确的是( ) A.相同条件下,电离平衡常数越小,表示弱电解质的
xx
K=
x2
(1-x)(1-x )
=1
解得 x = 0.5 α(CO)= 50%
α(H2O)= 50%
c(CO) : c(H2O) = 1:4 时
CO + H2O CO2 + H2
起始c 1 4
00
转化c -x -x
+x +x
平衡c 1-x 4-x
xx
K=
x2
(1-x)(4-x )
=1
解得 x = 0.8 α(CO)= 80%
电离能力越弱 B.电离平衡常数与温度无关 C.在CH3COOH的稀溶液中存在如下电离平衡: K值CH增3C大OOH==CH3COO-+H+,当再加入量冰醋酸时, D.多元弱酸各步电离平衡常数相互关系为K1<K2<K3
解析:K表征的是弱电解质的电离能力,它越大,表示弱电解质越 易电离,反之,就越难,故A正确;电离平衡常数与化学平衡一样, 只随温度的变化而变化,故B、C错误;多元弱酸各步电离平衡常 数的相互关系应为K1>K2>K3
CO2 (g) +H2 (g) 800℃ K = 1.0
求恒温恒容体系中,用c(CO):c(H2O)=1:1或1:4开始,达
到平衡时CO和H2O(g)的转化率。
c(CO) : c(H2O) = 1:1 时
CO + H2O CO2 + H2
起始c 1 1
0
0
转化c -x -x
+x +x
平衡c 1-x 1-x
=5mol·L-1,c(NH3)平衡= c(HI)①= 5mol·L-1,根据化 学平衡常数公式K= c(平衡×c(HI)平
=5mol/L×4mol·L-1,故答案选C。
方法规律:
①对于一般的可逆反应:mA(g)+ nB(g)==pC(g)+qD(g), 其中m、n、p、q分别表示化学方程式中个反应物和生 成物的化学计量数。当在一定温度下达到化学平衡时, 这个反应的平衡常数公式可以表示为:
炉中c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情 况下该反应是否处于平衡状态_______(填“是”或
“否”),此时化学反应速率是V正____V逆(填“大
于”、“小于”或“等于”),其原因
是
。
答:由于此时K/=c(CO2)/c(CO)= (0.025 mol·L-1) / (0.1 mol·L-1)=0.25≠K =0.263,所以 反应不处于平衡状态,又因为0.25<0.263,则v 正 > v逆,化学平衡向正反应方向移动。
方法规律:
①在一定温度下,弱电解质达到电离平衡时,各种离子浓 度之积与溶液中未电离的分子浓度之比是一个常数,该常 数K=就c(C叫H3电CO离O平-)c衡(H+常)/数c(C。H3如COCOHH3C)O. OH==CH3COO-+H+,
②电离平衡常数是描述弱电解质的电离平衡的主要参 数,也是弱酸、弱碱是否达到平衡状态的标尺。它只 受温度的影响,因电离过程是吸热过程,故它随温度 的升高而增大。
1 Ka (HF )
针对性训练:
1.已知25℃时,电离常数Ka(HF)=3.6×10-4 mmooll·3·LL--1,3。溶现度向积1L常0数.2 KmSoP(l·CLa-F12H)=F溶1.4液6×中1加0-入10 1L 0是.2D(mol·)L-1CaCl2溶液,则下列说法中,正确的
A.25℃时,0.1 mol·L-1HF溶液中pH=1
请写出反应③的平衡常数表达式
,若在
其它条件不变时,在鼓风炉中增大CO的浓度,平衡将
向
移动,此时平衡常数
(填“增大”、
“减小”或“不变”)。
答:⑴根据化学方程式和平衡常数的表达式进行书写: K=c(Zn).c(CO2)/c(CO) ,增大反应物CO的浓度,虽然化学平衡向 正反应移动,但平衡常数不变。
3: 已知CO(g) + H2O(g)
B.KSP(CaF2)随温度和浓度的变化而变化 C.该体系中KSP(CaF2)=1/Ka(HF) D.该体系中有CaF2沉淀产生
1 Ka (HF )
2.某温度时,AgCl (s)=Ag+(aq)+Cl-(aq)在水中的 沉淀溶解平衡曲线如图所示。下列说法正确的是(
提示:AgCl (s) = Ag+(aq)+Cl-(aq)的平衡常数Ksp= c(Ag+)·c(Cl-),称为溶度积常数。
法正确的是( )
提衡积示常常:数数Ba。KSsOp4=(sc)=(BBaa2+2)+·(ca(qS)O+42S-)O,42称-(a为q)溶平度
A.加入Na2SO4可以使溶液由a点变到b点 B.通过蒸发可以使溶液由d点变到c点 C.d点无BaSO4沉淀生成 D.a点对应的Ksp大于c点对应的Ksp
沉解淀析析:出当方加向入进N行a2,SO则4溶c(液Ba时2+),会c减(SO小4,2-)增故大A错,;沉蒸淀发溶溶解液平时衡,向 可变使,溶故液B错的;c(dS状O4态2-)点和,c(B因a其2+)在同沉时淀增溶大解,平而衡d→点cc显点示的c下(S方O4,2-)说未 明项未,达因到a、沉c两淀点溶对解应平的衡都状是态在,相故同无的Ba温SO度4沉下淀的生Ks成p,,故C正二确者;的D Ksp相同,D错。本题答案选C。
衡常数为K。若某时刻时,反应物和生成物的浓度关系
如下:
,则有以下结论:
K,=K ,V(正)=V(逆),可逆反应处于化学平衡状态; K,<K ,V(正)>V(逆),可逆反应向正反应方向进行; K,>K ,V(正)<V(逆),可逆反应向逆反应方向进行。
