过渡系元素的磁性
实验二十四:第一过渡系元素(二)(铁、钴、镍)
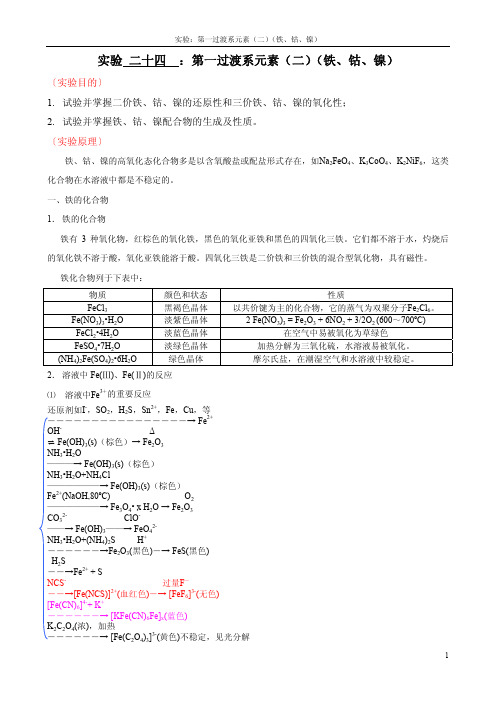
实验二十四:第一过渡系元素(二)(铁、钴、镍)〔实验目的〕1.试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性;2.试验并掌握铁、钴、镍配合物的生成及性质。
〔实验原理〕铁、钴、镍的高氧化态化合物多是以含氧酸盐或配盐形式存在,如Na2FeO4、K3CoO4、K2NiF6,这类化合物在水溶液中都是不稳定的。
一、铁的化合物1.铁的化合物铁有3种氧化物,红棕色的氧化铁,黑色的氧化亚铁和黑色的四氧化三铁。
它们都不溶于水,灼烧后的氧化铁不溶于酸,氧化亚铁能溶于酸。
四氧化三铁是二价铁和三价铁的混合型氧化物,具有磁性。
铁化合物列于下表中:物质颜色和状态性质FeCl3黑褐色晶体以共价键为主的化合物,它的蒸气为双聚分子Fe2Cl6。
Fe(NO3)3 = Fe2O3 + 6NO2 + 3/2O2 (600~700ºC) Fe(NO3)3•H2O 淡紫色晶体 2FeCl2•4H2O 淡蓝色晶体在空气中易被氧化为草绿色FeSO4•7H2O 淡绿色晶体加热分解为三氧化硫,水溶液易被氧化。
(NH4)2Fe(SO4)2•6H2O 绿色晶体摩尔氏盐,在潮湿空气和水溶液中较稳定。
2.溶液中Fe(Ⅲ)、Fe(Ⅱ)的反应⑴溶液中Fe3+的重要反应还原剂如I-,SO2,H2S,Sn2+,Fe,Cu,等――――――――――――――――→ Fe2+OH-Δ⇌ Fe(OH)3(s)(棕色)→ Fe2O3NH3•H2O———→ Fe(OH)3(s)(棕色)NH3•H2O+NH4Cl——————→ Fe(OH)3(s)(棕色)Fe2+(NaOH,80ºC) O2——————→ Fe3O4• x H2O → Fe2O3CO32-ClO-——→ Fe(OH)3——→ FeO42-NH3•H2O+(NH4)2S H+――――――→Fe2O3(黑色)―→ FeS(黑色)H2S――→Fe2+ + SNCS-过量F-――→[Fe(NCS)]2+(血红色)―→ [FeF6]3-(无色)[Fe(CN)6]4-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)K2C2O4(浓),加热――――――→ [Fe(C2O4)3]3-(黄色)不稳定,见光分解⑵溶液中Fe2+的重要反应氧化剂如Cr2O72-,浓HNO3等―――――――――――→ Fe3+OH-O2⇌ Fe(OH)2(s)(纯白色)→Fe(OH)3(s)(棕色)NH3•H2O――→ Fe(OH)2(s)(纯白色)NH3•H2O+NH4Cl――――――→无沉淀CO32-H2O + CO2 O2――→ FeCO3(白色)――→ Fe(HCO3)2―→Fe(OH)3(s)(NH4)2S―――→ FeS(黑色)NO――→[Fe(NO)( H2O)5]2+( 棕色)H2O2 +过量F-―――――→ [FeF6]3-(无色)NCS-――→无溶液、无颜色CN-过量CN-Cl2―→Fe(CN)2(s) (白色) ――→[Fe(CN)6]4-――→[Fe(CN)6]3-[Fe(CN)6]3-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)二、钴的化合物1. 钴的化合物钴的氧化物与铁的氧化物类似,为暗褐色的Co2O3•xH2O和灰绿色的CoO。
第二章 2.4 过渡金属配合物的磁性

中心原子的磁矩: 中心原子的磁性与电子Βιβλιοθήκη 轨道运动、自 旋运动存在如下关系:
L+S = 4S(S1) L(L 1) 对第一系列过渡金属,轨道运动对磁矩的贡献很小,故 可以忽略, S 可由唯自旋公式计算: S ={4S(S+1)}1/2 B, 这儿 B为玻尔磁子
在 VO43 - 、 CrO42 - 、 MnO4 - 系 列中, 中心金属离子氧化性逐渐增强, 电荷迁移所需能量逐渐降低, 所以含 氧酸根离子颜色逐渐加深:
如MnO4-中的Mn(Ⅶ)比CrO42- 中的Cr(Ⅵ)的氧化性强, 跃迁能量低, 跃迁容易, 所以MnO4-吸收500-560 nm(绿色)的光, 呈现紫红色;CrO42- 吸收480-490 nm(绿蓝色)的光, 呈 现橙色。
Co3+ 的八面体配合物的颜色
[Co(H2O)6]3+ [Co(NH3)6]3+
蓝色
黄棕色
[Co(NO2)6]3- [Co(en)3]3+
橙黄色
黄色
[Co(C2O4)3]3 - [Co(en)2 (C2O4)]+ [Co(EDTA)]- [Co(CN)6]3-
绿色
紫红色
紫色
黄色
2.5.2 电荷迁移光谱
配体内部的电子光谱
配位体如水和有机分子等在紫外区经常出现吸收谱带。形成配合物后, 这 些谱带仍保留在配合物光谱中, 但从原来的位置稍微有一点移动。
配位体内部的光谱包括以下三种类型:
① n→* 处于非键轨道的孤对电子到最低未占据的空轨道 σ*反键轨道的跃迁。水、醇、胺、卤化物等配体常发生这类跃 迁。
2.4 配合物的磁性
第九章 过渡元素

Cu(OH)2 氢氧化铜为浅兰色粉末,难溶于水,稍有两性,易溶于酸, 只溶于较浓的强碱。 Cu(OH)2 + 2OH[Cu(OH)]2-
9.2.3 银的化合物 银通常形成氧化值为+1的化合物,其中只有AgNO3易溶于水其他如Ag2O、 卤化银等均难溶。银的化合物有不同程度的感光性,银和许多配体易形成配合物。 硝酸银 AgNO3是最重要的可溶性银盐,用途广泛。它在干燥的空气中比较稳 定,潮湿状态下易见光分解,析出单质银而变黑
(1) 氧化铜和氢氧化铜 CuO 氧化铜为黑色粉末,难溶于水。它是偏碱性氧化物,溶于稀酸: CuO + 2H+ Cu2+ + H2O
由Cu(NO3)2或Cu2(OH)2CO3受热分解都能指得CuO:
2Cu(NO3)2 Δ Cu2(#43; 4NO2 + O2 2CuO + CO2 + H2O
第九章
过渡元素
9.1过渡元素的结构特点
过渡元素位于周期表中部d区ⅢB(3)—Ⅷ(8)族8个直列24个元素(不包括镧以 外的镧系,锕以外的锕系元素)。表9—1列出了第一过渡系列元素的电子构型
表9—1 第一过渡系列元素的电子构型
过渡元素电子结构的特点是具有未充满的d轨道(Pd例外),最外层 电子为1~2个,最外两个电子层都是未充满的,其特征电子构型为(n-1) d1-9ns1-2。也有把ds区的铜族,锌族元素作为过渡元素,其电子构型为 (n-1)d1-10ns1-2。最近有人只把铜族元素列入过渡元素(而锌族不列 入),因为铜的重要氧化态Cu(Ⅱ)为3d9、Ag(Ⅱ)为4d9、Au(Ⅲ) 为5d8构型,而且它们的性质与过渡元素极为相似,故过渡元素包括铜族 元素较合适。 过渡元素与典型元素不同,周期性变化规律并不明显。如同周期的金 属性递变不显著,原子半径,电离势等随原子序数增加,虽有变化但不显 著,都反映出各元素间从左至右的水平相似性(表4—6)。因之,将这些 过渡元素按周期分为三个系列。位于周期表中第四周期的Sc—Ni为第一过 渡系列元素;第五周期中的Y—Pd为第二过渡系列元素;第六周期中的 La—Pt为第三过渡系列元素。习惯上把第一过渡系列元素称为轻过渡元素, 把第二、第三过渡系列称为重过渡元素。本节主要讨论第一过渡系列元素。
原子的磁性及物质的顺磁性

P S S S 1
在外场方向分量:
P s H
m
s
2
(自旋磁量子数:
1
m
s
) 2
自旋磁矩与自旋角动量
的关系为:
μ
s
H
=-
e m Ps H
方向相反
μs
e m
P
=-
s
sP s
其中: s me ,为自旋磁力比:, s 且 2l s的绝对值:
s
SS1 e 2
m
SS1B
SmS
晶体中的晶体场效应 a、晶体场对磁性离子轨道的直接作用
引起能级分裂使简并度部分或完全解除,导致 轨
道角动量的取向处于被冻结状态。 b、晶体场对磁性离子自旋角动量的间接作用。
通过轨道与自旋耦合来实现。常温下,晶体中 自
旋是自由的,但轨道运动受晶体场控制,由于 自
旋-轨道耦合和晶体场作用的联合效应,导致 单
L= ∑ml III. 次壳层未半满时,
J=|L-S|;
IV.
次壳层半满或超过半满时,J=L+S
第三节 稀土及过渡元素的有效波 尔磁子
一、稀土离子的顺磁性 1、稀土元素的特征: 1s22s22p63s23p63d104s24p64d104f0~145s25p65d0~16s2 最外层电子壳层基本相同,而内层的4f轨道从La到
Cu2+(3d9),置于正八面体晶体中,电子组态为:
t2g6eg3 考虑d10电子组态,其电子云分布为球形对称。去
掉一个dx2-y2电子 (t2g6)(dz2)2(dx2-y2)1 (这种状态在x 与y轴方向,电子出现几率小)导致Cu2+原子核内正 电荷在x-y轴方向所受屏蔽较小从而Cu2+原子核吸
2020年高中化学·强化讲义 第53节 过渡元素简介

第53节过渡元素简介一、过渡元素简介过渡元素在元素周期表中的位置和外围电子层排布从元素周期表上可以看到,表的中部从ⅢB 族到ⅡB 族10个纵行,包括镧系和锕系,共有63种元素,这些元素包括了第VI 族和全部副族元素,人们习惯上把它们叫做过渡元素。
过渡元素的价层电子构型为1~101~2(1)ds n n (Pd 为0ns )。
在元素周期表中,它们处于s 区元素和p 区元素之间。
从性质上看,s 区元素的单质均为活泼元素,形成的化合物以离子型为主,其氧化数单一,离子没有颜色;p 区元素只有部分是金属元素,形成的化合物多为共价型,含有多种氧化数;d 区介于s 区和p 区之间。
因此,人们又称d 区元素为过渡元素。
它们分属于第四周期到第七周期,如图11-1所示过渡元素原子的电子层排布有共同的特征。
从图中可以看出,它们的最外电子层上都有1~2个s 电子(Pd 除外),随着原子序数的递增,增加的电子大多填充在次外层的d 轨道上其中镧系和锕系元素的原子,增加的电子主要填充在倒数第三层的f 轨道上,少数填充在次外层的d 轨道上。
过渡元素原子的外围电子层排布反映了它不同于主族元素原子的核外电子排布的特征。
例如,钪(Sc )的外围电子层排布为3d4s2,铀(U )的外围电子层排布为5f6d7s2。
过渡元素的许多性质,都跟它们的外围电子层排布有关。
二、过渡元素的通性过渡元素原子的最外层一般只有1~2个电子,在化学反应中较易失去,故它们都是金属元素。
相对于主族元素而言,过渡元素的特性及其性质变化规律主要表现在以下几个方面1.单质的物理性质过渡元素的单质有些是高熔点、高沸点、密度大、硬度大、导电和导热性良好的金属。
在金属元素中,熔点最高的是钨,密度最大的是锇,硬度最大的是铬。
例如:铂的密度是21.45g/cm 3,约是铝的8倍;钨的熔点是3410℃,是所有金属中最难熔的。
造成这些特性的原因是过渡元素的单质因原子半径小,采取最紧密堆积,原子之间除了有电子外,还用部分d电子参与成键,在金属键之外有部分共价键,因此结合牢固。
元素周期表中的过渡金属和内过渡金属

其他化合物的性质
这些化合物具有独特的物理和化 学性质,如光学活性、磁有序性 和导电性等。
其他化合物的应用
在化学工业、材料科学和新能源 领域中,这些化合物具有广泛的 应用前景,如太阳能电池、磁性 材料和药物等。
06
过渡金属和内过渡金属的工业应用
在冶金工业中的应用
钢铁生产
过渡金属如铁、钴、镍等是钢铁生产中的重 要元素,可以提高钢材的强度、韧性和耐腐 蚀性。
总结词
包括铜、银、金等元素,具有稳定的价电子构型和良好的导电性。
详细描述
第一过渡系列元素位于周期表的第4至第12族,具有稳定的价电子构型,表现出良好的导电性和延展 性。这些元素在工业和日常生活中有广泛应用,如铜用于电线、管道和硬币制造,金则用于珠宝和投 资。
第二过渡系列
总结词
包括铁、钴、镍等元素,具有磁性和催化活性。
有色金属冶炼
铜、铝、锌等有色金属的冶炼过程中,过渡 金属作为杂质需要进行控制和去除。
在化学工业中的应用
催化剂
过渡金属化合物如铂、钯、铑等广泛应用于各种化学反应的催化,如加氢反应、氧化反 应等。
颜料与染料
某些过渡金属化合物具有特殊的颜色和稳定性,用于制造颜料和染料。
在其他领域的应用
磁性材料
过渡金属如铁、钴、镍等及其合金具有优异 的磁性能,用于制造磁性材料和器件。
硫化物和硒化物的性质
硫化物和硒化物的应用
在电子工业、光学材料和催化领域中 ,硫化物和硒化物具有重要应用,如 半导体材料、红外探测器和催化剂等 。
这些化合物具有不同的物理和化学性 质,如颜色、熔点、导电性和磁性等 。
其他化合物
其他化合物的种类
除了氧化物和硫化物/硒化物外, 过渡金属和内过渡金属还可以形 成多种其他类型的化合物,如卤 化物、络合物和氢化物等。
过渡金属元素

低氧化态稳定性↗
例 第一过渡系列:
氧化性 稳定性
Sc3+ < TiO2+ < VO2+ < Cr2O72 - < MnO4- < FeO42Sc3+ > TiO2+ > VO2+ > Cr2O72- > MnO4- > FeO42-
其中:ΦA / V
Cr2O72 -/ Cr3+ MnO4- / Mn2+ FeO42- / Fe2+ NiO42- / Ni2+
按物质在外加磁场作用下性质,划分为
逆磁性物质:对外磁场磁力线排斥
物质
顺磁性物质:对外磁场磁力线吸引、聚集 铁磁性物质:强顺磁性,外磁场撤消后仍永久保留磁性如 Fe、
Co、Ni 及其合金 Nd-Fe-B(第三代永磁材料) 物质的顺磁性它存在“成单电子”有关:
磁矩 μm = n(n 2)B.M .
六、过渡元素氧化物水合物的酸碱性
与配体互相极化,使 M-L 键共价性↑。
八、形式多碱、多酸倾向
(一)多碱
是较高价态 Mn+在一定 pH 值下多步水解通过羟桥键而形成的多核配合物:
例:[Fe(H2O)6]3+ 水解形成 [Fe2(H2O)8(OH)2]4+ H2O H H2O
H2O O OH2 \ /\ /共棱
可见,同族,第二、三过渡系列元素性质更相似。
与主族相反。
§7-3 钛 Titanium
存在:金红石 TiO2,钛铁矿 FeTiO3
一、钛单质
(一)物性
银白色,m. p. 1680℃,b.p.3260℃,密度 d = 4.43g cm-3. (强度/质量)比:所 有金属材料中最大,且耐腐蚀(在 HCl、H2SO4、HNO3 中均“钝化”,R.T.与卤素, O2、H2O 均不以应)→ 广泛用于新造飞机、宇宙飞船、游艇、石油化工设备、人 造骨骼(人体不排斥)。高温下可作炼钢脱氧剂。
过渡元素

油状 绿色
MnO2+O2+O3
MnO42- +CO2 MnO2 + CO2 Mn2++CO2
由软锰矿制备KMnO4
软锰矿 粉碎
氧化剂
OH- △
K2MnO4 墨绿色
常用的氧化剂有O2、KNO3和KClO3。反应介质为KOH或K2CO3。
2MnO2+4KOH+O2 == 2K2MnO4+2H2O 3MnO2+6KOH+KClO3 == 3K2MnO4+KCl+3H2O MnO2+K2CO3+KNO3 == K2MnO4+KNO2+CO2↑
过渡元素的通性
具有部分填充d或f壳层电子的元素。 狭义:(n-1)d1~8ns1~2 ⅢB~Ⅷ 8列 10列
广义:(n-1)d1~10ns1~2 ⅢB~ⅡB
过渡元素全部为金属,其化合物颜色多、 变 价多、形成配合物多。
• (n-1)d1~10ns1~2 (Pd:4d105s0) • d电子数较多. • d电子可部分或全部成键. • d轨道未充满可接受孤电子
1.33V -0.41V -0.91V 2-————Cr3+————Cr2+————Cr
Ea
θ:
Cr2O7
酸性介质氧化性强,碱性介质还原性强
Cr2O7
酸 性 Cr3+ 介 质 MnO 4-+H+
Ag+
2- +ຫໍສະໝຸດ SO42-S2O82-
H2O2 碱 性 CrO2- 介 质 Br2
CrO42-+H2O
21第二十一章_过渡金属(II_)

Ni2+在过量的氨水中可生成蓝色[Ni(NH3)4(H2O)2] 2+以及紫色 [Ni(NH3)6] 2+ 。 Ni2+的配合物都比较稳定
2019/11/14
2
5、铁、钴,镍都是中等活泼金属,常温下,在没有水蒸气存在时,它 们与氧、硫、氯等非金属单质不起显著作用。但在高温,它们将和上述 非金属单质以及水蒸气发生剧烈反应。铁和铝、铬一样,与浓HNO3、浓 H2SO4会被“钝化”。铁在潮湿空气中会生锈,铁锈的成分通常简略用 Fe2O3.xH20表示。钴和镍在常温下对水和空气都较稳定。
O2+2H2O+4e=4OH—
φ0=+0.401V
Co(OH)2在空气中能慢慢地被氧化成棕色的Co(OH)3,Ni(OH)2不能 与空气中的氧作用,只能被强氧化剂如NaOCI、Br2等氧化而成 Ni(OH)3。
Fe(OH)3略有两性,但碱性强于酸性,只有新沉淀出来的Fe(OH)3能溶 于浓的强碱溶液中生成铁(Ⅲ)酸钾:
4、它们的可溶性盐类从溶液中析出时,常带有相同数目的结晶水。 例如,它们的硫酸盐都含7个结晶水为MⅡSO4.7H20(M=Fe、Co、 Ni),又如硝酸盐常含6个结晶水为MⅡ(NO3)2.6H2O;
5、 这些元素的+II水合离子都显一定的颜色,如[Fe(H2O)6]2+为浅 绿色,[Co(H2O)6]2+为粉红色,[Ni(H2O)6]2+为亮绿色。当从溶液 中析出结晶时,这些水分子成结晶水共同析出,所以它们的盐也有颜 色。但无水盐却有不同的颜色,如Fe(Ⅱ)盐为白色,Co(Ⅱ)盐为蓝色, Ni(Ⅱ)盐为黄色。
第一过渡系元素(一)(钛、钒、铬、锰)

第一过渡系元素(一)(钛、钒、铬、锰)第一过渡系元素是指周期表中第3至第12族的元素,它们在化学性质上有相似之处。
其中,钛(Ti)、钒(V)、铬(Cr)和锰(Mn)是第一过渡系元素中的前四个元素,它们具有一些共通的特性,同时也存在一些区别。
本文将从以下几个方面来介绍这四个元素:元素性质、物理性质、化学性质以及地质应用。
一、元素性质1.钛(Ti)钛是一种质轻、高强度、高耐腐蚀性、抗疲劳性能好的金属。
它具有优异的机械性能,被广泛应用于航空、航天、化工、海洋开发等领域。
同时,钛也是一种生物医用材料,被用于制作人体骨骼支架、人造关节、人工心脏瓣膜等。
2.钒(V)钒是一种银白色金属,比铁硬但稍加工艺处理后可以获得良好的延展性和强度。
它还有广泛的应用,用于制造钢、化学试剂和合金等。
不仅如此,钒还是一种强化剂,在钢铁生产过程中起到重要的作用。
3.铬(Cr)铬是一种具有高度耐腐蚀性的银白色金属,它主要应用于不锈钢、电子元器件、航空航天、制药等领域。
除此之外,铬还是一种环保型材料,可以用于净水和净化技术。
4.锰(Mn)锰是金属元素中的一种,它是一种银灰色的金属,具有良好的延展性和韧性。
锰还是钢铁生产中的一种重要元素,可以增强钢的硬度和韧性。
二、物理性质钛是一种具有低密度和高强度的金属,密度为4.54克/厘米立方。
它具有较高的熔点(1668℃)和沸点(3287℃),同时也具有较高的热导率和电导率。
三、化学性质钛是一种化性非常稳定的金属,在常温下不会被大多数酸和碱腐蚀。
它可以与氧、氮、氢反应,产生相应的氧化物、氮化物和氢化物。
此外,钛还可以和卤素反应,如氯、溴和碘等,生成相应的卤化物,例如TiCl4、TiBr3等。
锰可以和许多元素和化合物发生反应。
它可以与氧、氯、酸、弱碱等反应,生成各种不同的化合物。
在大气环境下,锰会逐渐氧化形成氧化锰,该过程是一种蓝黑色的化学反应。
四、地质应用钒是一种重要的工业金属,在地球上的丰度较低,但在一些特定的矿物中含量较高。
元素周期表中的过渡金属

元素周期表中的过渡金属元素周期表是描述元素的分类和性质的重要工具。
其中,过渡金属是指在周期表中位于主族元素和稀土金属之间的一组元素。
它们具有一系列独特的性质和应用,对我们的日常生活和科学领域都有重要影响。
过渡金属的定义在元素周期表中,过渡金属通常被定义为具有部分填充的d轨道的元素。
它们的原子结构特点是d电子层不是满电子层,即d轨道中存在未配对或未填满的电子。
这使得过渡金属具有许多独特的性质,例如可变的氧化态、良好的导电性和热导性等。
典型的过渡金属元素过渡金属包括铬(Cr)、锰(Mn)、铁(Fe)、钴(Co)、镍(Ni)、铜(Cu)、锌(Zn)等。
它们具有共同的特征,如高熔点、高密度、良好的导电性和热导性等。
这些元素在自然界中广泛存在,且大多数用途广泛。
性质和应用过渡金属具有许多重要的物理和化学性质,为它们带来了广泛的应用。
以下是一些常见的例子:1. 催化剂:过渡金属广泛用于催化反应,例如铂(Pt)催化剂在汽车尾气净化和氢气燃料电池中起着重要作用。
2. 磁性材料:铁、钴和镍等过渡金属是制造磁性材料的重要成分。
它们被广泛应用于电子设备、电动机和磁存储介质等领域。
3. 合金:过渡金属在合金制备中起着关键作用。
例如,钢是由铁和碳以及其他过渡金属组成的合金,拥有优异的强度和耐腐蚀性能。
4. 荧光材料:某些过渡金属离子在激发条件下能够发出明亮的荧光,例如钐(Sm)和铕(Eu)等离子常用于荧光显示器和照明装置中。
5. 生物学应用:许多过渡金属离子在生物体内具有重要的生理功能,如铁在血红蛋白中的运输氧气。
过渡金属的周期性和趋势过渡金属元素在元素周期表中按照原子序数的增加排列。
它们的性质和趋势在一定程度上与原子序数的变化相吻合,但也存在一些异常现象。
1. 电子结构:过渡金属的电子结构具有一定的规律性。
它们的原子结构中的d电子数目逐渐增加,从Sc(21)到Cu(29)的元素具有各自特定的电子组态。
2. 原子半径:在过渡金属族中,原子半径从左到右逐渐减小。
无机化学——过渡元素

3CH3CH2OH+2K2Cr2O7+8H2SO4=3CH3COOH+
2K2SO4+2Cr2(SO4)3+11H2O 应用于检验酒后开车。检验过氧化氢的存在,生成Cr(O2)2O。 实验室中常用的铬酸洗液是用热的饱和重铬酸钾溶液与浓硫
V2O5:为两性偏酸性的氧化物,是一种重要的催化剂。 2NH4VO3=V2O5+2NH3+H2O V2O5+Ca=V+CaO V2O5+NaOH=Na3VO4+3H2O V2O5+6HCl=2VOCl2+Cl2+H2O VO2++Fe2++H+=VO2++Fe3++H2O 2VO2++C2O42-+4H+=2VO2++2CO2+2H2O
三、Zr和Hf的分离 钾和铵的氟锆酸盐和氟铪酸盐在溶解度上有明显的差别,可利 用此性质来分离Zr和Hf。
金属钛
钛
钛合金
钛合金
镍钛合金
镍钛合金
蓝宝石含钛刚玉
蓝 宝 石 含 钛 刚 玉
四、金属钛的制备
工业上常用FeTiO3为原料来制金属钛 1、矿石中含有FeO、Fe2O3杂质,先用浓硫酸处理
FeTiO3+3H2SO4=FeSO4+Ti(SO4)2(TiOSO4)+3H2O FeO+H2SO4=FeSO4+H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 2、加入单质铁把Fe3+离子还原为Fe2+离子,冷却至273K以下 使FeSO4·7H2O结晶析出。加热煮沸Ti(SO4)2和TiOSO4 TiOSO4 (TiOSO4)+ H2O =H2TiO3↓+H2SO4 3、分离煅烧 H2TiO3=TiO2+H2O 4、碳氯法 TiO2+2C+2Cl2=TiCl4+2CO 5、在1070K用熔融的镁在氩气氛中还原TiCl4可得海棉钛,再 经熔融制得钛锭。TiCl4+2Mg=2MgCl2+Ti
过渡元素

(3)还原法
原理:用还原剂还原化合物(如氧化物等)来制取单 质,一般常用的还原剂是焦炭,CO、H2、活泼金属等。
例: 高炉炼铁: Fe2O3+3CO 2Fe+3CO2 铝热剂法: Fe2O3+2Al 2Fe+Al2O3 应用范围:用于制取活泼性不是很强的金属及以正氧 化值存在的非金属单质。 氧化物能否被还原,可以用消耗1mol O2生成氧化物过 程的△G变化对温度作图(见p322图8-5,Ellingham图)来 分析。 一些金属还可以从卤化物中用还原法提取,也可采用 电解、水溶液电积等方法提取。
0 5 10 15 20 24
3d
r/a0
8.2.2(n-1)d与ns轨道能级高低
▲ 电子组态:由n,l表示的电子排布方式。 ● 多电子原子核外电子的填充顺序:
1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d,7p…
▲ 过渡元素在周期表中为何延迟出现?3d排在4s之后,4d 在5s后,4f,5d在6s后,5f,6d在7s后。 ● 电子在原子轨道中的填充顺序,并不是原子轨道能级高低 的顺序,填充次序遵循的原则是使原子的总能量保持最低。 填充次序表示,随Z增加电子数目增加时,外层电子排布的规 律。(见 图8-4,p317)
2、单质的制取方法 通常有五种:物理分离法,热分解法,还原法,氧
化法和电解法。 (1)物理分离法 原理:单质与杂质在某些物理性质(如密度、沸
点等)上有显著差异的特点。 例: “沙里淘金”(密度差异);
应用范围:分离、提取以单质状态存在,且某些物理 性质与杂质差异较大的元素。
元素周期表中的过渡元素

元素周期表中的过渡元素元素周期表是化学家们用来组织和分类元素的基本工具。
其中,过渡元素是周期表中一个重要的类别,它们在化学和物理性质上都有着独特的特点。
本文将介绍过渡元素的概念、特性以及它们在日常生活中的应用。
一、过渡元素的概念元素周期表是按照原子核中的质子数(即原子序数)递增的顺序排列的。
而过渡元素是指周期表中的d区元素,这些元素具有不完全填充的d电子层。
具体来说,它们的最外层电子结构可表示为(n-1)d(n-2)fnp,其中n代表能级,np代表填充的外层电子。
过渡元素包括3d系、4d系、5d系和6d系,分别位于周期表的第3至12组、第4至12组、第5至12组和第6至12组。
由于它们的外层电子结构不同,导致了它们之间的化学特性差异。
二、过渡元素的特性1. 化学性质:过渡元素在化学反应中通常表现出多价性。
由于d电子的相对能量较高,容易参与化学反应,并能形成稳定的离子化合物。
此外,由于外层电子的分布情况不同,过渡元素在形成氧化物时可能会形成不同的氧化态,这也是其多价性的表现。
2. 金属性质:过渡元素大多数都是金属,具有良好的导电性和导热性。
此外,它们还具有韧性、延展性和磁性等金属特性。
3. 催化性质:许多过渡元素、尤其是过渡金属,具有良好的催化活性。
它们可以通过吸附、解离或转移电子等方式参与化学反应,从而降低反应活化能,加速反应速率。
4. 彩色离子:过渡元素离子在溶液中呈现出丰富的颜色。
这是由于过渡元素离子的d电子能级间的跃迁所引起的。
三、过渡元素的应用1. 催化剂:由于过渡金属的催化活性,它们被广泛应用于化学工业中的催化反应过程,如重要的工业过程氨合成、有机合成和汽车尾气催化转化等。
2. 电池材料:过渡金属在电池材料中具有重要作用。
例如,锂电池中的过渡金属氧化物可用作正极材料。
3. 金属合金:过渡金属常用于制备各种金属合金,如不锈钢、合金钢等。
这些合金通常具有较高的强度和耐腐蚀性能。
4. 彩色玻璃和陶瓷:某些过渡金属元素可以通过调节其氧化态来改变颜色。
过渡元素的一般定义及其分类d轨道的特征和过渡元素的价电子结构讲解

7.3 第一过渡系元素的化学
7.3.1 单质及化合物的制备 一 单质的提取 1 方法 (1) 以天然状态存在的单质的物理分离法 如淘金 (2) 热分解法 △ △ 2HgO 2Hg+O2 2Ag2O 4Ag+O2 (3) 热还原法 △ a 以C作还原剂 ZnO + C Zn+CO 1473K b 用氢作还原剂 WO3+3H2 W+3H2O c 用比较活泼的金属作还原剂 Cr2O3+2A1 2Cr+A12O3 TiC14+2Mg Ti+2MgC12 电解 (4) 电解法 NaC1 Na+1/2C12
7.2.1 d轨道的特征
1 d 轨道比s、p轨道的数目多,成键可能性大;
2 (n-1)d 轨道的能量与ns、np接近,是易参与成键的内层轨道。
据实验测定发现,(n-1)d与ns或np轨道的能量差远较主族元素 的ns与np轨道的能量差小得多。
3 d 轨道在空间的取向和角度分布
五条d 轨道的角度函数按其极大值在空间的分布可分为两组, 一组在轴上,包括dz2、dx2-y2,另一组在轴间夹角45°线上,包括 dxy、dxz、dyz。 d 轨道都有对称中心,是偶函数,具有g对称性。
ⅢBⅣBⅤBⅥBⅦB
ⅧB
IBIIB
超
新超
目前人们对过渡元素的认识并不一致。
现在,对“过渡元素”概念上的理解,大体有如下三种:
●认为“过渡元素”是指从ⅢB-ⅧB族的元素,即除了Cu、 Zn副族外的所有副族,共 8个竖行,其原子的电子结构特点是有 未充满的d电子亚层。电子构型为(n-1)d1-9ns1-2。 ●认为“过渡元素”是指从ⅢB-IB族的元素,包括Cu副族 (不包括Zn副族),共9个竖行,其原子的电子结构特点是原子及 其重要的氧化态有未充满的d亚层,电子构型是(n-1)d1-10ns1-2。 ●认为“过渡元素”是指从ⅢB - IIB 的全部副族元素,共 10个竖行。在这种划分中,“过渡” 的含义是指从金属元素到 非金属元素的过渡或由周期表 s区元素过渡到 p区元素,电子构 型为 (n-1)d1-10ns2。
过渡元素、歧化反应

含义周期表中从IIIB族到VIII族的元素。
共有三个系列的元素,电子逐个填入他们的3d、4d和5d轨道。
有时人们把过渡元素的范围扩大到包括镧系元素和(IIB)形成稳定配位化合物的能力上与过渡元素很相似,因此也有人建议把锌族元素归入过渡元素范围。
各系列概述过渡元素位于周期表中部,原子中d或f亚层电子未填满。
这些元素都是金属,也称为过渡金属。
根据电子结构的特点,过渡元素又可分为:外过渡元素(又称d区元素)及内过渡元素(又称f区元素)两大组。
● 外过渡元素包括镧、锕和除镧系锕系以外的其它过渡元素,它们的d轨道没有全部填满电子,f轨道为全空(四、五周期)或全满(第六周期)。
● 内过渡元素指镧系和锕系元素,它们的电子部分填充到f轨道。
d区过渡元素可按元素所处的周期分成三个系列:①位于周期表中第4周期的Sc~Ni------称为第一过渡系元素②第5周期中的Y~Pd称为第二过渡系元素③第6周期中的La~Pt称为第三过渡系元素一般性质特征,不同的过渡金属之间可形成多种合金。
②过渡金属的原子或离子中可能有成单的d电子,3。
③过渡元素的d,过渡元素原子的电子构型过渡元素原子电子构型的特点是它们的d 轨道上的电子未充满(Pd例外),最外层仅有1~2个电子,它们的价电子构型为(n-1)d1-9ns过渡元素的氧化态及其稳定性过渡元素最外层s电子和次外层d电子可参加成键,所以过渡元素常有多种氧化态。
一般可由+Ⅱ依次增加到与族数相同的氧化态(ⅧB族除Ru、Os外,其它元素尚无+Ⅷ氧化态)同一周期从左到右,氧化态首先逐渐升高,随后又逐渐降低。
随3d轨道中电子数的增加,氧化态逐渐升高;当3d轨道中电子数达到5或超过5时,3d轨道逐渐趋向稳定,高氧化态逐渐不稳定(呈现强氧化性),此后氧化态又逐渐降低。
三个过渡系元素的氧化态从左到右的变化趋势是一致的。
不同的只是第二、三过渡系元素的最高氧化态表现稳定,而低氧化态化合物并不常见。
同一族中从上至下,高氧化态趋向于比较稳定-----和主族元素不同。
过渡元素(1)

VO2 Fe2 2 H VO 2 Fe3 H 2O 2VO2 H 2C2O4 2 H VO 2 2CO2 2 H 2O VO2 2 I 4 H V 3 I 2 2 H 2O 2VO2 3Zn 8H 2V 2 3Zn 2 2 H 2O
在酸性溶液中,VO2+可被Fe2+,SO32-,H2C2O4,I-,Zn等还原剂还原,还原 产物具有丰富多彩的颜色。 Fe2+只能将V(V)还原为VO2+,I-只能将V(V)还原 为V3+,而Zn可将其还原为V2+。如在NH4VO3的酸性溶液中加入Zn,会依次 看到蓝色(VO2+)绿色(V3+)及紫色(V2+),这是一种分级还原的过程。 V(Ⅲ),V(Ⅱ)是强还原剂,尤其在碱性条件下,很容易被空气中的氧所氧化, V(Ⅱ)的化合物还能从水中置换出氢。
二、钛及其化合物
二氧化钛的制取
二氧化钛的工业生产,几乎包括了全部无机化学工艺过程,因而被喻 为“工艺艺术品”。
二氧化钛的生产可采用硫酸法或氯化法,以钛铁矿为原料的二氧化钛 生产常以硫酸法为主。该法主要过程有:(1)硫酸分解精矿制取硫酸氧钛溶 液(2)净化除铁(3)水解制偏钛酸(4)偏钛酸煅烧制二氧化钛。 钛铁矿精矿成分除FeTiO3外,还有Fe2O3以及SiO2, Al2O3, MnO, CaO, MgO等杂质。160~200°C下,用浓硫酸分解精矿的主要反应如下:
四、铬及其化合物
铬的价电子结构为3d54s1,可形成氧化值为+2、+3、+6的化合物,其中 +3、+6的化合物较常见。铬的化合物主要有氧化物、氢氧化物、含氧酸及其 盐类,呈现多种颜色。
d区和ds区元素的通性

d区和ds区元素的通性
氧化态变化表现有如下的规律性: (1)同一周期自左至右,随着原子序数的增加, 氧化态先是逐渐升高,但第四周期在锰以后,第五周期 在钌以后,第六周期在锇以后,氧化态又逐渐降低,最 后与第ⅠB族元素的低氧化态相同; (2)同一族自上而下,高氧化态趋向于稳定,即 第四周期元素一般容易出现低氧化态,第五、六周期的 相应元素趋向于出现高氧化态。
过渡金属由于空d轨道的存在,使它们更易形成配位键, 产生丰富多彩的配位化合物,并因此呈现五彩缤纷的颜色。
d区和ds区元素的通性
四、 氧化态
d区过渡元素基本上都具有多种氧化态。ds区元素除银(氧 化数为+1)、锌、镉(氧化数为+2)外,其余都显示变价。d区 元素最外层和次外层电子层未饱和的构型特点,使其具有可变的 氧化态。最外层的两个s电子容易失去,显示+2氧化态。另外, 次外层的d电子和最外层的s电子能量相近,而且未达到稳定的结 构,所以d电子也可部分或全部参加成键,故d区元素一般有可变 的氧化态。ds区铜族和锌族(部分)元素的ns和(n-1)d层电子处 于同一能级组,不仅s电子参加成键,且(n-1)d电子也因反应条件 的不同,部分地参加成键,因此表现出几种氧化态。
d区和ds区元素的通性
d区和ds区元素的通性
二、 单质的物理性质
d区和ds区元素的单质都有着典型的金属性质,如有金属光泽,延 展性高(锌族例外),有导电导热性。它们的密度比较大,除钪(2.99 g·cm-3)、钇(4.34 g·cm-3)和钛(4.5 g·m-3) 属轻金属外,其余元 素都为重金属(密度大于5 g·cm-3)。d区和ds区金属比主族金属有更大 的密度和硬度以及更高的熔点和沸点。例如,铬是所有单质金属中最硬 的,莫氏硬度为9,熔点、沸点最高的是钨,依次为3410 ℃和5930 ℃。 这是由于d电子也参与成键,成键价电子数增加,键强度增大。锌族元素 熔点、沸点均低,汞是常温下唯一的液体金属。以第一过渡系元素的物 理性质的递变说明上述规律性,如表9-2所示。
过渡系元素的磁性

一 磁性
不同物质的分子在磁场中表现出不同的磁性质。像H2、Cl2等, 在磁场中受到磁场的排斥, 称为反磁性或抗磁性物质;而NO、O2 等, 在磁场中受磁场的吸引, 称为顺磁性物质。
N
N
N
N
抗磁性物质在磁场中
顺磁性物质在磁场中
另外还有一些物质, 他们也是顺磁性物质, 只是磁场对他们的 作用要比对顺磁性物质的作用大得多, 称为铁磁性物质。
成对电子, 则由单电子的自旋产生的小磁场不能被抵消, 净磁 在多数情况下, 分子磁矩主要是由电子的自旋产生的, 纯的自旋磁矩可根据总自旋量子数进行计算。 eff=(1- /△) s
场不等于0, 则该物质具有顺磁性, 这种物质在外磁场中, 不仅 对第一过渡系, 因为旋-轨偶
研究表明:轨道角动量对分子磁矩是否有贡献, 取决于外磁场改变时电子能否自旋平行地在不同轨道之间再分配。
是,
矩作出贡献。但是当三条轨道各被一个或两个电子占 表明在多数情况下, 轨道角动量对分子磁矩的贡献很小或没有贡献。
其中基谱项为A2时, =4, 为A1时, =0 , 为E时 =2时。
如果加上轨道磁性对磁矩的贡献,则磁矩的计算公式变为:
在八面体场中, d轨道分裂为t2g和eg, 由于eg轨道是由形状不相同的两个简并轨道组成的, 两条轨道的对称性不同, 电子不能在这两条轨道
中, 所有的电子都已配对, 那么由配对的电子的自旋产生的小 中进行自旋平行的再分配, 所以对磁矩不能作出贡献;
但t2g轨道是由对称性和形状都完全相同的dxy、dxz、dyz所组成, 电子可以在这三条轨道中进行自旋平行的再分配, 因而能对磁矩作出贡
s=g S(S1)
其中S为总自旋量子数, 等于未成对电子数的一半, g为朗德 因子, 对于自由电子, g=2.0023, 通常取g=2, 于是上式变为:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
表14示出轨 道对八面体配合 物磁矩产生的贡 献, 可以发现:
t2g1 t2g2 t2g3
所有能 对磁矩产生 的贡献的电 子组态都具 有 T 基谱项, 为其他基谱 项的电子组 态都没有这 种贡献。
t2g3eg1
t2g4 t2g3eg2 t2g5 t2g4 eg2 t2g6 t2g5 eg2
t2g6 eg1
研究表明:轨道角动量对分子磁矩是否有贡献,
在八面体场中, d轨道分裂为t2g和eg, 由于eg轨道是 由形状不相同的两个简并轨道组成的 , 两条轨道的对 称性不同 , 电子不能在这两条轨道中进行自旋平行的 再分配, 所以对磁矩不能作出贡献;但t2g轨道是由对称 性和形状都完全相同的dxy、dxz、dyz所组成, 电子可以 在这三条轨道中进行自旋平行的再分配 , 因而能对磁 矩作出贡献。但是当三条轨道各被一个或两个电子占 据时, 这种再分配不能进行, 所以半满和全满的t2g轨道 的磁矩也被冻结。相反, t2g1、t2g2、t2g4、t2g5, 由于对同 一自旋方向的电子来说, 还存在有空轨道, 因而能进行 自旋平行的再分配, 所以可对磁矩作出贡献。
自旋和轨道相互作用 , 即产生了旋 —轨偶合使得 一定量的激发态T谱项混到了基谱项之中, 从而产生轨 道磁矩贡献之故。
一般说来, 对于第一过渡系的金属离子, 这种偶合作用较小, 可以忽略不予考虑。但对其他过渡系, 镧系和锕系, 这种偶合作 用较大, 必须加以考虑。
自由金属离子的旋-轨偶合作用可用单电子的旋轨偶合常 数nd或多电子的旋轨偶合常数来表示, nd与间的关系为: =± nd/n 式中n为未成对电子数, 当d电子数小于5时, 上式取正, 大于 5时取负, 等于5时, 等于0。 对于基态谱项为A或E对称性的配合物, 情况比较简单, 由旋 -轨偶合作用引起磁矩的变化可由下式计算: eff=(1- /△) s 其中基谱项为A2时, =4, 为A1时, =0 , 为E时=2时。 例如实验测得(NH4)2Ni(SO4)2· 6H2O的磁矩为3.30B.M., Ni2+ (d8)有两个单电子, 纯自旋磁矩为2.83B.M., 在Oh场中, 其基谱项 为3A2g, =4, 查表得=630, =-nd/n=-630/2=-315 (d电子 多于5, 取负), Ni2+的△o=8500cm-1, 于是, eff=(1- /△) s =(1-4×(-315)/8500)×2.83=3.25 B.M. 计算结果与实验值一致。
一 磁性
不同物质的分子在磁场中表现出不同的磁性质。像H2、Cl2等, 在磁场中受到磁场的排斥, 称为反磁性或抗磁性物质;而NO、O2 等, 在磁场中受磁场的吸引, 称为顺磁性物质。
N N N
N
抗磁性物质在磁场中
顺磁性物质在磁场中
另外还有一些物质, 他们也是顺磁性物质, 只是磁场对他们的 作用要比对顺磁性物质的作用大得多, 称为铁磁性物质。 在化学上主要感兴趣的是顺磁性物质和抗磁性物质。
分子中的电子在绕核的轨道运动和电子本身的自旋运动都 会产生磁效应。电子自旋运动产生自旋角动量 , 从而产生自旋 磁矩;电子的轨道运动产生的轨道角动量 , 产生轨道磁矩。当 把分子作为一个整体看时 , 构成分子的各个电子对外界产生的 磁效应的总和可用一个等效的环电流 ( 称为分子电流 ) 表示 , 这 个环电流具有一定的磁矩 , 称为分子磁矩。在多数情况下 , 分 子磁矩主要是由电子自旋产生的。如果物质的原子或分子轨道 中 , 所有的电子都已配对 , 那么由配对的电子的自旋产生的小 磁场两两大小相等、方向相反, 磁效应互相抵消, 净磁场等于0, 若将这种物质放在外磁场中 , 在其作用下 , 就要产生一个与外 磁场方向相反的诱导磁矩而受到外磁场的排斥 , 因此 , 没有未 成对电子的原子、分子或离子都具有抗磁性;如果物质具有未 成对电子 , 则由单电子的自旋产生的小磁场不能被抵消 , 净磁 场不等于0, 则该物质具有顺磁性 , 这种物质在外磁场中, 不仅 产生一个与外磁场方向相反的诱导磁矩 , 而且它的分子磁矩还 沿磁场方向取向 , 由于分子磁矩比诱导磁矩要大得多 , 总的结 果是产生了与磁场方向一致的磁矩 , 因而受到外磁场的吸引 , 因此, 具有未成对电子的物质大都具有顺磁性。
(二) 则磁矩的计算公式变为:
S+L= 4S(S 1) L(L 1)
按照这个公式计算出来的磁矩在大多数情况下也与实验值 不一致。表明在多数情况下, 轨道角动量对分子磁矩的贡献很 小或没有贡献。
取决 于外磁场改变时电子能否自旋平行地在不同轨道之间 再分配。这种分配必须在对称性相同的能级之间进行。
单电子的偶合常数值列于下表:
基态光谱项为 T的离子也 会产生旋-轨偶合作用, 这时 情况变得复杂起来, 因为, 一 产方面旋-轨偶合使基态谱 项生分裂, 同时, 这种作用还 强烈地与温度有关。 右图示出d1组态的八面体 配合物的分子有效磁矩eff与 温度和偶合常数之间的关系, 对第一过渡系, 因为旋-轨偶 合作用小, 处于图形的右边, 分子磁矩数值接近于纯自旋磁矩;而第二、第三过渡系, 旋-轨 偶合作用大, 处于图的左边, 分子磁矩反常地低。
二 磁矩的计算
(一) 纯自旋磁矩
在多数情况下, 分子磁矩主要是由电子的自旋产生的, 纯的 自旋磁矩可根据总自旋量子数进行计算。 s=g S(S 1) 其中S为总自旋量子数, 等于未成对电子数的一半, g为朗德 因子, 对于自由电子, g=2.0023, 通常取g=2, 于是上式变为: s= n(n 2) 式中n为未成对电子数。这个式子表明, 如果忽略了轨道角 动量对磁矩的贡献, 可由磁矩直接计算出某种离子的未成对电 子数。 按这个公式算出来的磁矩, 在少数情况下与实验值不一致, 这正是由于忽略了未成对电子的轨道运动对磁矩的贡献之故。
t2g6eg2 t2g6 eg3
(三) 旋-轨偶合对磁性的影响
研究表明, 在一些应当没有轨道磁矩贡献的物质中, 如d8、d9, 他们的基谱项分别为3A2g、2Eg, 应当没有轨道磁矩的贡献, 分子磁 矩应等于由自旋产生的磁矩。然而在实际上具有这两种电子组态 的分子所产生的磁矩却比由纯自旋磁矩算出的值要大。再如d4高 自旋, 基态谱项为5Eg, 也应没有轨道磁矩的贡献, 但具有这种电子 组态的分子的磁矩却比纯自旋磁矩小。这是由于
