总胆固醇测定试剂盒标准操作程序.
血清总胆固醇TC测定操作规程

血清总胆固醇TC测定操作规程.docx血清总胆固醇(TC)测定操作规程1. 目的本操作规程旨在规范血清总胆固醇(TC)的测定过程,确保检测结果的准确性和重复性。
2. 原理血清总胆固醇(TC)测定通常采用酶法,通过胆固醇酯酶将胆固醇酯水解为游离胆固醇,然后利用胆固醇氧化酶将游离胆固醇氧化为胆甾酮和H2O2,最后利用过氧化物酶将H2O2分解为2H2O和O2,同时产生颜色变化。
颜色的深浅与血清中胆固醇含量成正比,可通过比色法测定。
3. 试剂和材料酶试剂盒(含胆固醇酯酶、胆固醇氧化酶、过氧化物酶等)校准品和质控品血清样本蒸馏水移液枪及吸头比色杯恒温水浴箱自动生化分析仪或分光光度计4. 操作步骤4.1 准备工作确保所有试剂和样本均已在室温下平衡至25°C。
校准生化分析仪或分光光度计至适当的波长(通常为500-550nm)。
4.2 试剂准备根据试剂盒说明书,将酶试剂混合均匀,并预热至25°C。
4.3 样本处理取适量的血清样本,避免溶血和脂血样本。
如有必要,对样本进行离心,去除沉淀物。
4.4 加样使用移液枪准确取样,将血清样本加入比色杯中。
按照试剂盒说明书,加入等量的酶试剂至每个比色杯中。
4.5 反应将比色杯放入恒温水浴箱中,保持37°C反应一定时间(通常为5-10分钟)。
4.6 比色测定将反应后的比色杯放入自动生化分析仪或分光光度计中。
读取吸光度值,并根据标准曲线计算血清总胆固醇浓度。
5. 质量控制每次测定前,使用校准品进行仪器校准。
定期使用质控品进行质量控制,确保结果的准确性和稳定性。
6. 结果记录与报告记录所有测定结果,包括吸光度值、胆固醇浓度等。
根据医院或实验室的标准操作程序,编写并发布检测报告。
7. 安全注意事项操作时应穿戴适当的个人防护装备,如手套和实验服。
避免接触试剂和样本,尤其是避免吸入和摄入。
按照当地法规处理废弃物。
8. 维护和校准定期对生化分析仪或分光光度计进行维护和校准,确保仪器的准确性。
人总胆固醇(TC)ELISA试剂盒说明书

人总胆固醇(TC)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定人血清,组织及相关液体样本中总胆固醇(TC)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中人总胆固醇(TC)水平。
用纯化的人总胆固醇(TC)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入总胆固醇(TC),再与HRP标记的总胆固醇(TC)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的总胆固醇(TC)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人总胆固醇(TC)浓度。
试剂盒组成:试剂盒组成48孔配置96孔配置保存说明书1份1份封板膜2片(48)2片(96)密封袋1个1个酶标包被板1×48 1×96 2-8℃保存标准品:54nmol/ml 0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液 1.5ml×1瓶 1.5ml×1瓶2-8℃保存酶标试剂 3 ml×1瓶 6 ml×1瓶2-8℃保存样品稀释液 3 ml×1瓶 6 ml×1瓶2-8℃保存显色剂A液 3 ml×1瓶 6 ml×1瓶2-8℃保存显色剂B液 3 ml×1瓶 6 ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存浓缩洗涤液(20ml×20倍)×1瓶(20ml×30倍)×1瓶2-8℃保存样本处理及要求:1.血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2.血浆:应根据标本的要求选择EDTA、者柠檬酸钠或肝素作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。
总胆固醇测定试剂盒说明书

总胆固醇(total cholesterol,TC)含量测定试剂盒说明书分光光度法50管/48样注意:正式测定之前选择2-3个预期差异大的样本做预测定。
测定意义:TC包括游离胆固醇和胆固醇酯。
TC是指组织中所有脂蛋白所含胆固醇之总和。
测定原理:利用酯酶催化胆固醇酯水解生成游离胆固醇(FC)和游离脂肪酸(FFA),从而把胆固醇酯转化为FC;进一步利用胆固醇氧化酶催化FC氧化,生成△4-胆甾烯酮和H2O2;最后利用过氧化物酶催化H2O2氧化4-氨基安替比林和酚,生成红色醌类化合物;在500nm有特征吸收峰,其颜色深浅与TC含量成正比。
自备仪器和用品:可见分光光度计、水浴锅、可调式移液枪、1mL玻璃比色皿、异丙醇和蒸馏水。
试剂组成和配制:试剂一:异丙醇50mL(自备)。
试剂二:液体50mL×1瓶,4℃保存;试剂三:粉剂×1瓶,4℃保存;试剂四:液体100μL×1瓶,4℃保存TC标准品:液体1mL×1支,0.5μmol/mL,4℃保存。
TC的提取:1、组织中TC的提取:按照组织质量(g):试剂一体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL试剂一)进行冰浴匀浆,8000g 4℃离心10min,取上清,即TC待测液。
2、细胞、细菌中TC的提取:先收集400-500万细胞或细菌到离心管内,弃上清,加1mL试剂一,超声波破碎1min(强度20%,超声2s,停1s),即TC待测液。
3、血清(浆)等样品:直接测定。
测定操作:1. 分光光度计预热30 min,调节波长到500 nm,蒸馏水调零。
2. TC工作液的配制:临用前,吸取约0.8mL试剂二分别加入试剂三和试剂四瓶中,充分溶解后再全部转移回试剂二瓶中,充分混匀,TC工作液置于37℃水浴10min。
用不完的工作液4℃保存一周。
3. 标准管:依次在1mL玻璃比色皿中加入100μL FC标准液和900μL TC工作液,混匀,37℃静置3h后于500nm测定A标准管。
血清总胆固醇测定标准操作规程

血清总胆固醇测定标准操作规程1.检验原理:(氧化酶法)血清中总胆固醇(TC )包括游离胆固醇(FC )和胆固醇酯(CE )两部分。
血清中胆固醇可被脂蛋白酯酶水解为游离胆固醇和游离脂肪酸(FFA ),胆固醇在胆固醇氧化酶的氧化作用下生成胆甾烯酮和过氧化氢,过氧化氢在4-氨基安替比林和对羟基苯甲酸钠存在时,晶过氧化物酶(POD )催化,反应生成苯醌亚胺非那腙的红色醌类化合物,其颜色深浅与标本中TC 含量成正比。
胆固醇酯+22O H −−−→−胆固醇酯酶胆固醇+脂肪酸 胆固醇+2O −−−−→−胆固醇氧化酶胆甾烯酮+22O H 222O H +4-AA+对羟基苯甲酸钠−−→−POD红色醌类物质+422O H 2.试剂主要组成成分3.样本要求:新鲜无溶血血清。
在22~25℃保存8小时,2~8℃保48小时,-20℃可保存1年。
样本应避免反复冻融!4.检验方法;仪器法(详见DF-603/DI-600标准操作规程) 5参考范围:6.检验结果的解释:6.1样本含量超出线性范围时,建议用0.9%(W/V)的氯化钠溶液稀释样本。
6.2.单位换算:mg/dl=mmol/L×38.77.检验方法的局限性7.1结果的准确性依赖于仪器的校正和测定温度、时间的控制。
7.2若试剂浑浊,或以水空白在500nm处吸光度大于0.080时不能使用。
8.试剂性能指标8.1试剂外观:无色透明或淡黄色液体,无悬浮物及沉淀。
8.2装量:不低于标识值。
8.3空白吸光度:在500nm处,光径1cm时,空白吸光度A≤0.0808.4线性区间:试剂的线性区间为[0.5-20.0]mmol/L,在此线性区间内:a)线性相关系数r应不小于0.9900;b)[2.0-20.0]mmol/L区间内,线性相对偏差不超过±10%。
8.5准确度:使用具有溯源性的标准品进行测定,实测值与标识值的相对偏差应在±10%内。
8.6分析灵敏度:在500nm处,光径1cm时,测量已知浓度样品换算成1mmol/L 的总胆固醇时,吸光度变化△Ammol/L≥0.0028.7批内精密度:CV≤4.0%8.8批间差:R≤6.0%8.9稳定性:(2-8)℃下,原包装存放的试剂有效期为12个月.取到期后1个月的试剂进行测试,应满足1-8.7的要求。
总胆固醇检测试剂盒(COD-PAP 双试剂比色法)说明书

主波长/次波长 反应类型 反应方向
500/600nm 终点法
升反应(+)
计算公式:
血清、血浆等液体样本(空白调零): FC(mmol/L)=A 测定/A 标准×5
血清、血浆等液体样本(全自动生化分析仪):
FC(mmol/L)=(A 测定-A 空白)/(A 标准-A 空白)×5 组织样本(空白调零):
V1=细胞样本取样量(ml)
V2=样本匀浆液总体积(ml)
参考区间: 健康成年人理想范围:<5.2mmol/L(<200mg/dl)
边缘升高:<5.23~5.69mmol/L(201~219mg/dl)
升高:≥5.72mmol/L(≥220mg/dl)
备注:TC 标准(5mmol/L)=442.48mg/dl
产品组成:
名称
规格
保存条件
总胆固醇(TC)检测试剂盒(COD-PAP 双试剂比色法)
100T
4℃
试剂(A):
Good'sBuffer
Good's 溶液
显色剂
2×25ml
4℃
活性剂、稳定剂
试剂(B):
胆固醇氧化酶
COD-POD 溶液 4-氨基安替比林
2×25ml
-20℃避光
CEH、POD
临用前,按 A:B=1:1 混合,即为 COD-PAP 工作液,4℃保存。
FC(mmol/g)=A 测定/A 标准×5×V2/(m×1000) 组织样本(全自动生化分析仪):
FC(mmol/g)=(A 测定-A 空白)/(A 标准-A 空白)×5×V/(m×1000) 细胞样本(空白调零):
FC(mmol/L)=A 测定/A 标准×5×V2/V1
总胆固醇测定试剂盒标准操作程序.

总胆固醇测定试剂盒标准操作程序1. 摘要本试剂盒供医疗机构用于体外定量测定人血清或血浆样本中总胆固醇的含量。
2. 适用范围程序适用于AU5811自动生化分析仪检测血清样本中总胆固醇的含量。
3. 职责使用AU5811自动生化分析仪进行测定总胆固醇浓度的工作人员要严格按照本SOP 程序进行,室负责人监督管理;本SOP 的改动,可由任一使用本SOP 的工作人员提出,并报经生化室负责人、科主任签字批准生效。
4. 检测方法上海科华生物工程股份有限公司生产的总胆固醇测定试剂盒采用的是氧化酶法。
5. 原理OH ESPAS O H O H O O H 222222244+−−−→−+-+-∆+−−−−→−++−−−→−+醌亚胺氨基安替比林胆甾烯酮游离胆固醇脂肪酸游离胆固醇总胆固醇过氧化物酶胆固醇氧化酶胆固醇酯酶ESPAS:N-乙基-N-(3-磺丙基)-间-茴香胺血清中的总胆固醇在胆固醇酯酶的作用下水解成游离胆固醇和脂肪酸,游离胆固醇在胆固醇氧化酶的催化下,氧化成Δ4-胆甾烯酮和双氧水,最后双氧水在过氧化物酶的催化下与色原底物4-氨基安替比林和ESPAS 反应生成红色化合物醌亚胺。
由于醌亚胺在波长550nm 处有吸收峰,所以在一定底物浓度范围内,550nm 处吸光度的变化值与样本中总胆固醇的含量成正比6. 仪器AU5811自动生化分析仪7. 试剂7.1 试剂来源:上海科华生物工程股份有限公司提供7.2 试剂瓶内主要成分:R1:胆固醇酯酶、抗坏血酸氧化酶、过氧化物酶、ESPAS (ADPS );R2:胆固醇氧化酶、 -氨基安替比林;校准品:胆固醇7.3试剂稳定性:未打开试剂于2℃-8℃避光保存可至失效期。
校准品应密闭保存,以免液体挥发。
8.标准品和质量控制8.1校准程序:使用科华公司的校准品对自动分析仪进行校准。
按照公司标准品使用要求,并以9g/L氯化钠溶液或去离子水为空白,经校准测定,仪器自动对标准品通过合适的数学模型绘制校准曲线。
格锐思生物科技总胆固醇含量试剂盒说明书
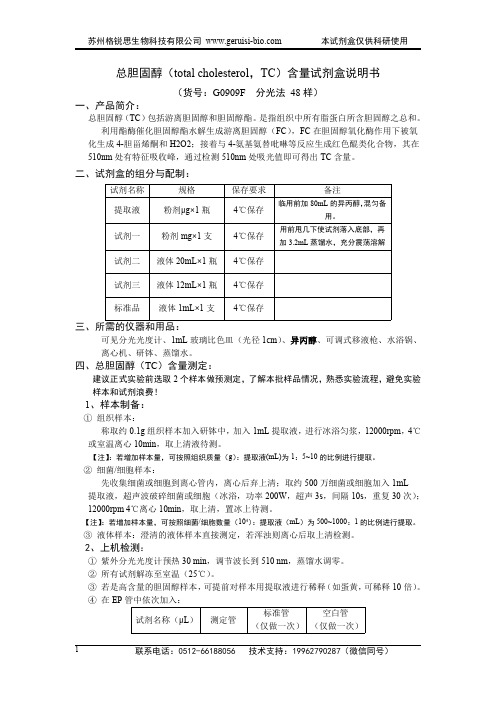
总胆固醇(total cholesterol,TC)含量试剂盒说明书(货号:G0909F分光法48样)一、产品简介:总胆固醇(TC)包括游离胆固醇和胆固醇酯。
是指组织中所有脂蛋白所含胆固醇之总和。
利用酯酶催化胆固醇酯水解生成游离胆固醇(FC),FC在胆固醇氧化酶作用下被氧化生成4-胆甾烯酮和H2O2;接着与4-氨基氨替吡啉等反应生成红色醌类化合物,其在510nm处有特征吸收峰,通过检测510nm处吸光值即可得出TC含量。
二、试剂盒的组分与配制:试剂名称规格保存要求备注提取液粉剂μg×1瓶4℃保存临用前加80mL的异丙醇,混匀备用。
试剂一粉剂mg×1支4℃保存用前甩几下使试剂落入底部,再加3.2mL蒸馏水,充分震荡溶解试剂二液体20mL×1瓶4℃保存试剂三液体12mL×1瓶4℃保存标准品液体1mL×1支4℃保存三、所需的仪器和用品:可见分光光度计、1mL玻璃比色皿(光径1cm)、异丙醇、可调式移液枪、水浴锅、离心机、研钵、蒸馏水。
四、总胆固醇(TC)含量测定:建议正式实验前选取2个样本做预测定,了解本批样品情况,熟悉实验流程,避免实验样本和试剂浪费!1、样本制备:①组织样本:称取约0.1g组织样本加入研钵中,加入1mL提取液,进行冰浴匀浆,12000rpm,4℃或室温离心10min,取上清液待测。
【注】:若增加样本量,可按照组织质量(g):提取液(mL)为1:5~10的比例进行提取。
②细菌/细胞样本:先收集细菌或细胞到离心管内,离心后弃上清;取约500万细菌或细胞加入1mL 提取液,超声波破碎细菌或细胞(冰浴,功率200W,超声3s,间隔10s,重复30次);12000rpm4℃离心10min,取上清,置冰上待测。
【注】:若增加样本量,可按照细菌/细胞数量(104):提取液(mL)为500~1000:1的比例进行提取。
③液体样本:澄清的液体样本直接测定,若浑浊则离心后取上清检测。
血清总胆固醇测定操作规程

血清总胆固醇测定操作规程《血清总胆固醇测定操作规程》一、目的本规程旨在规范血清总胆固醇测定的操作步骤,确保测定结果准确可靠。
二、适用范围本规程适用于各医疗机构进行血清总胆固醇测定的操作。
三、仪器与试剂1. 仪器:分光光度计2. 试剂:血清总胆固醇测定试剂盒四、操作步骤1. 准备工作a. 开机预热分光光度计,确保仪器处于工作状态。
b. 取出血清总胆固醇测定试剂盒,检查试剂有效期和存储条件。
c. 准备标准品和样本待测血清。
2. 操作流程a. 取出试剂盒中的标准品,按照说明书稀释成不同浓度。
b. 加标准品和待测血清分别加入试剂管中,混匀后置于恒温水浴中反应一定时间。
c. 反应结束后,使用分光光度计在特定波长下测定吸光值。
3. 结果计算a. 使用标准品的吸光值绘制标准曲线。
b. 读取待测血清的吸光值,根据标准曲线计算出血清总胆固醇的浓度。
五、结果判定根据患者血清总胆固醇的测定值,参照相关标准进行结果判定和医疗建议。
六、注意事项1. 操作人员应熟练掌握仪器和试剂使用方法,严格按照操作规程进行操作。
2. 试剂及仪器的质量控制应在每次实验前进行验证。
3. 操作过程中应注意个人防护,避免污染试剂和样本。
七、记录与保存1. 对每次测定的操作步骤、结果和质控记录进行详细记录,确保测定结果可追溯。
2. 相关记录资料应按规定保存,以备查。
八、附则对于特殊情况的处理和异常结果的分析,应根据实际情况进行相应操作,并记录详细的处理过程。
以上即为《血清总胆固醇测定操作规程》,希望操作人员严格按照规程执行,确保测定结果的准确性和可靠性。
TC文档,总胆固醇氧化酶法测定试剂盒(TC)检测标准操作规程

1、方法依据:深圳迈瑞生物医疗电子股份有限公司总胆固醇(TC)测定试剂盒(氧化酶法)测定方法2、适用范围:适用于人血清总胆固醇(TC)的测定。
3、试剂仪器:3.1 试剂:深圳迈瑞生物医疗电子股份有限公司原装试剂盒。
3.2未开启的试剂盒避光保存于2℃~8℃有效期为一年。
试剂开瓶后应避光保存,在2℃~8℃可稳定28天。
试剂不可冰冻。
3.3 仪器:迈瑞BS-2000M 全自动生化分析仪.4、操作程序4.1方法原理在胆固醇酯酶(CHE )和胆固醇氧化酶(CHO )的作用下,酯型胆固醇被催化产生过氧化氢(H 2O 2)。
过氧化氢在过氧化物酶(POD )的作用下,与4-氨基安替比林(4-APP )和酚缩合,生成醌系色素,通过测定此反应的吸光度可求得胆固醇的含量。
胆固醇酯 + H 2O胆固醇 + 脂肪酸胆固醇 + O 2 Δ4-胆甾烯酮 + H 2O 22H 2O 2 + 4-氨基安替比林+ 酚醌亚胺 + 4H 2O4.2样本要求 新鲜血清样本,采集后及时测定,应避免溶血和污染。
4.3上机操作4.3.1试剂装载、校准、样品和质控血清分析操作详见“《迈瑞BS-2000M 全自动生化分析PODCHE CHO仪标准操作、维护、保养规程》”。
4.3.2 校准:4.3.2.1 标准液的准备:校准品使用深圳迈瑞生物医疗电子股份有限公司配套冻干品,按说明书要求稀释后分装,-20℃冷冻保存,用前提前15分钟从冰箱中取出,复溶到室温后上机检测。
4.3.2.2 校准程序:首次使用校准。
当有以下情况时需重新校准:1)换试剂批号或出现质控漂移时;2)当仪器做完保养后;3)仪器进行零件更换时。
每次试验前用准备好的校准品进行校准,校准通过后进行检测。
4.3.2.3 质控:在标本开始之前做质控,质控通过后方能进行标本的检测。
4.3.3 测试基本参数4.4参考范围合适范围:≤ 5.17 mmol/L高度危险临界值: 5.6~6.6 mmol/L高度危险范围: > 6.6 mmol/L(注:各实验室应有自己的参考范围。
总胆固醇试剂盒使用说明书

原装试剂在 2~8℃避光保存,有效期 36 个月。 试剂复溶后在 2~8℃保存稳定 1 月,在 15~25℃保存稳定 3 天。 样品:
新鲜无溶血血清。
操作步骤:
波长:500nm (480~520nm)
反映温度:37℃
比色杯光径:1cm 取一定量 R2(参看 R1 瓶签)复溶 1 瓶 R1,溶解后即为工作液。
总胆固醇试剂盒使用说明书
Cholestero Kit (CHO) 酶比色法 通用型(冻干粉) 用途: 本试机用于测定人血清中总胆固醇的浓度。 测定原理:
总胆固醇+ H 2O ⎯C⎯E⎯OD→ Δ 4 -胆甾烯酮 + H 2O2
胆固醇+ O2 ⎯G⎯⎯PO→ 磷酸二羟丙酮+ H 2O2
2H 2O2 +4-氨基安替砒啉+4-氯酚 ⎯P⎯⎯OD→ 醌亚胺+ 4H 2O
试剂盒主要成分与浓度:
试剂
主要成分
实验浓度
R1
胆固醇酯酶(CEH)
≥1140U/L
胆固醇氧化酶(CHOD) 过氧化物酶(POD)
≥800U/L ≥6000U/L
R2
磷酸缓冲液(pH7.7)
100mmol/L
4-氯酚
3.5mmol/L
4-氨基安替砒啉
0.5mmol/L
ห้องสมุดไป่ตู้
总胆固醇校准液 (定值见标签)
试剂稳定性:
空白管
校准管
样品管
工作液
1.0ml
1.0ml
1.0ml
蒸馏水
10ul
——
——
校准
——
10ul
——
样品
——
——
10ul
血清总胆固醇(TC)测定操作规程

血清总胆固醇(TC)测定操作规程A1.2 原理血清中的胆固醇酯(CE)被胆固醇酯水解酶(CEH)水解成游离胆固醇(Chol),后者被胆固醇氧化酶(CHOD)氧化成△4—胆甾烯酮,并产生过氧化氢,再经过氧化物酶(POD)催化4—氨基安替比林与酚(三者合称PAP),生成红色醌亚胺色素(Trinder反应)。
醌亚胺的最大吸收在500nm 左右,吸光度与标本中总胆固醇呈正比。
反应式如下:胆固醇酯+H2O CEH 胆固醇+游离脂肪酸胆固醇+02 CHOD △4-胆甾烯酮十H2022H202+4-氨基安替比林+酚POD 昆亚胺+4H2OA1.3.1 受检者(体检对象或病人)的准备:除总胆固醇不一定用空腹血外,测定甘油三酯、脂蛋白与载脂蛋白的病人必须空腹12h,不饮酒24h后采集血样。
对于体检对象抽血前应有2周时间保持平时的饮食习惯,近期内体重稳定,无急性病、外伤、手术等意外情况。
妊娠后期各项血脂都会增高,应在产后或终止哺乳后3个月检验才能反映其基本血脂水平。
注意有无应用影响血脂的药物,如降血脂药、避孕药、噻嗪类利尿剂、β受体阻滞剂、免疫抑制剂、某些降压剂、降糖药、胰岛素及其他激素制剂等,检验以前应根据所用药物的特性停止用药数天或数周,否则应记录用药情况。
对体检对象及做前瞻性观察者,还应注意采血的季节,因为血脂水平有季节性变动,为了前后比较应在每年同一季节检验。
应嘱体检对象在抽血前24h内不作剧烈运动。
A1.3.2 静脉采血:除非是卧床的病人,一般在采血时取坐位。
体位影响水分在血管内外的分布,因此影响血脂水平。
例如站立5 min 可使血脂浓度提高5%,15 min提高16%,故在采血前至少应***5min。
一般从肘静脉取血,使用止血带的时间不超过1 min,穿刺成功后立即松开止血带。
静脉阻滞5min可使甘油三酯增高10%~15%。
A1. 3.3 抗凝剂:我国多用血清作血脂检验。
如用血浆,多主张用EDTANa2(1mg/mL)抗凝。
总胆固醇(TCHOL)检测标准操作规程5.0

迪安诊断总胆固醇(TCHOL) 检测标准操作规程(版本号Version:第5/0版)2013年 12 月 30 日颁布实施编制(Editor):审核(Checker):批准(Approver):修订履历(Revision History)1.目的指导正确进行血清总胆固醇(TC)检测。
2.实验原理胆固醇氧化酶法胆固醇酯+H2O 胆固醇酯水解酶胆固醇+脂肪酸胆固醇+O2 胆固醇氧化酶Δ4胆甾烯酮+H2O22H2O2+4-氨基安替比林 + 酚过氧化物酶醌亚胺色素+4H2O生成的苯醌亚胺的颜色深浅与胆固醇的浓度成正比。
3.适用系统:罗氏Cobas C8000全自动生化检测系统。
4.试剂4.1检测试剂4.1.1厂家:罗氏诊断公司生产4.1.2稳定性:未开封于2~8O C保存,可稳定至有效期末,Cobas C501上机后稳定4周Cobas C701上机后稳定4周4.1.3成分:试剂1:PIPES缓冲液:225mmol/L,PH 6.8;Mg2+:10mmol/L;胆酸钠:0.6mmol/L;;4-氨基比林:≥0.45mmol/L;酚:≥12.6mmol/L;脂肪醇聚乙二醇醚:3%;胆固醇酯酶(假单胞菌属):≥25μkat/L(≥1.5U/ml);胆固醇氧化酶(大肠杆菌):≥7.5μkat/L(≥0.45U/ml);过氧化物酶(辣根):≥12.5μkat/L(≥0.75U/ml);稳定剂;防腐剂4.1.4配制:无需配制,直接使用4.1.5规格:400T/盒,2100T/盒4.2校准品 C.f.a.s4.2.1厂家:罗氏诊断公司生产4.2.2稳定性:未开封于2~8O C保存,可稳定至有效期末;校准物复融后冷冻起来,盖紧盖子保存在-15~-25O C,可稳定4周。
4.2.3配制:每瓶使用时用3mL去离子水复溶,静置30分钟轻轻混匀后使用,剩余量根据需要分装于离心管中,于-15~-25O C保存。
4.2.4规格:12×3mL4.3质控品伯乐化学物质质控物1,24.3.1厂家:美国Bio-Rad laboratories.INC4.3.2稳定性:未开启的质控品保存在2~8O C时,可稳定至有效期末。
E1005 液体样本总胆固醇酶法测定试剂盒说明书

液体样本总胆固醇酶法测定试剂盒E1005描述:血浆总胆固醇包括2/3的胆固醇酯和1/3的游离胆固醇,是血脂的重要组分,二者与心脑血管疾病以及多种病理状态密切相关。
本试剂盒采用世界卫生组织(WHO)、美国FDA、中国《全国临床检验操作规程》推荐的总胆固醇和游离胆固醇检测方法,灵敏度高,检测范围20~5000 µmol/L。
可靠性和重复性俱佳。
原理:本试剂盒测定方法采用CHOD-PAP终点方法结合经典GPO Trinder酶学反应【1】【2】,其原理为:(1) 胆固醇酯酶分解胆固醇酯为游离胆固醇。
(2) 胆固醇氧化酶将游离胆固醇氧化,产生过氧化氢。
(3) 在过氧化物酶催化下生色底物转化为苯醌亚胺,光密度值与胆固醇浓度成正比。
参考文献1.Trinder, P. (1969). Annals of Clin. Biochem. 6: 24 – 272.Barham D and Trinder P. (1972). Analyst 97: 142 – 145测定样品范围:血清、培养基组成:(1) R1试剂40 ml (2) R2试剂10 ml (3) 5 mmol/L胆固醇标准品0.5 ml储存条件:4ºC保存,6个月有效所需设备:721、722型可见光分光光度计、酶标仪、生化分析仪。
最佳工作波长550-555nm,如仪器无此波长建议优先选用570 nm,次选530、490nm。
常规比色杯即可。
操作步骤:一、工作溶液配制: 按4:1比例,取4 ml R1试剂与1 ml R2试剂混合均匀,立即使用或4ºC保存<1天,变色弃去。
二、样本处理:培养基:取无酚红无血清细胞培养液,4ºC,10,000g离心5 min,取上清测定。
新鲜培养基4ºC存放不宜超过1小时,若暂时无法测定可70ºC加热10 min后冻存,测定前离心。
血液:新鲜血液4ºC,2000 g离心5 min得到血浆,非抗凝血4ºC放置2小时得到血清。
血清总胆固醇测定操作规程

血清总胆固醇测定操作规程A1.2 原理血清中的胆固醇酯(CE)被胆固醇酯水解酶(CEH)水解成游离胆固醇(Chol),后者被胆固醇氧化酶(CHOD)氧化成△4—胆甾烯酮,并产生过氧化氢,再经过氧化物酶(POD)催化4—氨基安替比林与酚(三者合称PAP),生成红色醌亚胺色素(T rinder反应)。
醌亚胺的最大吸收在500nm左右,吸光度与标本中总胆固醇呈正比。
反应式如下:胆固醇酯+H2O CEH 胆固醇+游离脂肪酸胆固醇+02 CHOD △4-胆甾烯酮十H2022H202+4-氨基安替比林+酚 POD 昆亚胺+4H2OA1.3 标本采集与处理对于血脂分析,特别需要强调“分析前”各个环节的质量管理。
A1.3.1 受检者(体检对象或病人)的准备:除总胆固醇不一定用空腹血外,测定甘油三酯、脂蛋白与载脂蛋白的病人必须空腹12h,不饮酒24h后采集血样。
对于体检对象抽血前应有2周时间保持平时的饮食习惯,近期内体重稳定,无急性病、外伤、手术等意外情况。
妊娠后期各项血脂都会增高,应在产后或终止哺乳后3个月检验才能反映其基本血脂水平。
注意有无应用影响血脂的药物,如降血脂药、避孕药、噻嗪类利尿剂、β受体阻滞剂、免疫抑制剂、某些降压剂、降糖药、胰岛素及其他激素制剂等,检验以前应根据所用药物的特性停止用药数天或数周,否则应记录用药情况。
对体检对象及做前瞻性观察者,还应注意采血的季节,因为血脂水平有季节性变动,为了前后比较应在每年同一季节检验。
应嘱体检对象在抽血前24h内不作剧烈运动。
A1.3.2 静脉采血:除非是卧床的病人,一般在采血时取坐位。
体位影响水分在血管内外的分布,因此影响血脂水平。
例如站立5 min可使血脂浓度提高5%,15 min提高16%,故在采血前至少应***5min。
一般从肘静脉取血,使用止血带的时间不超过1 min,穿刺成功后立即松开止血带。
静脉阻滞5min可使甘油三酯增高10%~15%。
A1. 3.3 抗凝剂:我国多用血清作血脂检验。
总胆固醇测定试剂盒

总胆固醇测定试剂盒(酶法)性能要求行业标准(氧化酶法)检测方法4.1 物理性质试剂R1应为无色透明液体;试剂R2应为淡黄色透明液体。
5.2物理性质用目测法检查试剂盒内各组分的外观,其结果应符合上述4.1项的要求。
3.1外观符合制造商规定的正常外观要求。
4.1外观目测检查,结果应符合3.1的要求。
4.2试剂质量标准4.2.5装量允差10~5.7装量允差取经过校准的量具对试剂量进行检测,其结果应符合上述4.2.5项的要求。
3.2装量液体试剂的装量应不少于标示量。
4.2装量用通用量具测量,结果应符合3.2的要求。
100ml规格试剂装量应控制在要求量的≥97%;其余规格试剂装量应控制在要求量的≥100%。
4.2.1试剂空白试剂的空白吸光度≤0.10A 5.6试剂空白吸光度在波长600nm处、37℃反应温度下、1cm比色杯光径、按蒸馏水:试剂R1:试剂R2=2.4:240:80的混合后;孵育5分钟,测吸光度值,应符合本标准4.2.1的要求。
3.3试剂空白吸光度在500~550nm波长下,双试剂型试剂盒应不大于0.080。
单试剂型试剂盒应不大于0.100。
4.3试剂空白吸光度在500nm~550nm波长下,测定指定空白样品的吸光度值,重复两次,均值即为试剂空白吸光度。
结果应符合3.3的要求。
4.2.2线性范围 要求试剂盒在样本浓度5-800mg/dL 范围内,整个反应呈线性,r 2≥0.9905.5线性范围取含TC 浓度约800mg/dl 的高值血清,再用生理盐水按1/5、2/5、3/5、4/5、5/5(原倍)稀释,以生理盐水和以上5个稀释度作为标本,按标准实验操作步骤各测定3次,以理论值为X 轴,以实际测试值为Y 轴,绘制线性曲线,计算r 2r 2=∑∑∑==--=---⋅-⎪⎭⎫ ⎝⎛--n i n i ni Y Yi X Xi X Xi Y Yi 112221)()())(( 其结果应符合上述4.2.2项的要求。
朗道总胆固醇测定试剂盒-TC(CHOD-PAP法)说明书

总胆固醇测定试剂盒-TC (CHOD-PAP 法)说明书通用名称:总胆固醇测定试剂盒(CHOD-PAP 法)包装规格:单一试剂:4×40mL 单一试剂:5×60mL 单一试剂:2×100mL预期用途本试剂用于体外定量测定人体血清中总胆固醇的含量。
血清中TC 水平升高是冠心病的主要危险因素之一。
病理状态下,高TC 有原发与继发两类。
原发的如家族性高胆固醇血症、家族性APOB 缺陷症、混合性高脂蛋白血症。
继发的见于肾病综合征、甲状腺功能减退、糖尿病等。
〔1〕临床测定总胆固醇用于冠心病、糖尿病等的辅助诊断。
检验原理脂化的胆固醇经酯酶水解成游离胆固醇,游离胆固醇与胆固醇氧化酶、过氧化物酶、4-氨基安替比林、对羟基苯甲酸反应,生成红色的敖合物。
该敖合物颜色的深浅与血清中的总胆固醇的含量成正比。
通过与同样处理的标准液比较即可求出血清中的总胆固醇的含量。
主要组成成份缓冲液100mmol/L CHO(胆固醇氧化酶)≥1KU LPL(酯酶)≥1.5KU POD(过氧化物酶)≥35KU 4-AA(4-氨基安替比林)0.5mmol/L 对羟基苯甲酸3mmol/L 表面活性剂2%注:不同批号试剂盒中各组分未经试验不可互换。
储存条件及有效期试剂原包装2~8℃储存,有效期为18个月。
开口后的试剂在试剂仓中可稳定30天。
适用仪器日立7020、东芝-40,7600,迈瑞300、奥林巴斯AU400、东软400、7170、AU640、贝克曼LX20全自动生化分析仪。
样本要求样本应为新鲜、不溶血血清。
在2℃~8℃可存放30天。
检验方法使用全自动生化分析仪时基本参数及操作:测定温度37℃波长520nm 吸光度范围0-2A 比色杯光径 1.0cm 试剂用量300μL 样本用量3μL 测试模式终点法测定时间300秒操作流程图:试剂:300µl 标本:3µl520nm 测定0秒300秒计算方法样本浓度校准品浓度(校准)样本)=⨯A A (校准品及质控品本产品使用朗道公司的校准品、质控品已进行了性能验证。
总胆固醇检测试剂盒说明书
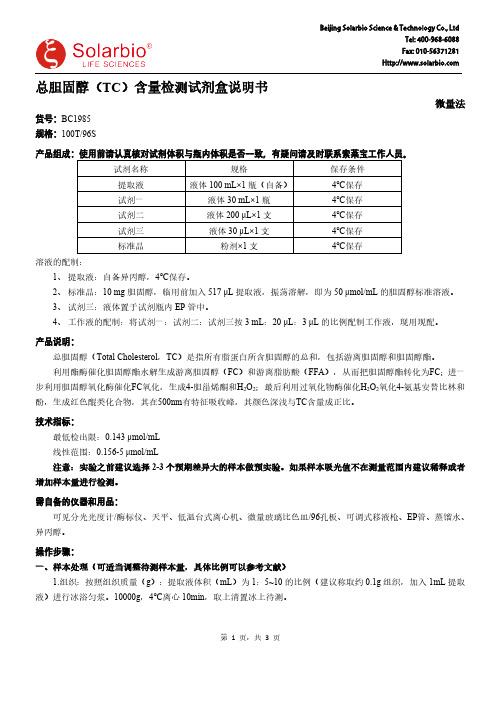
总胆固醇(TC )含量检测试剂盒说明书微量法货号:BC1985规格:100T/96S产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系索莱宝工作人员。
试剂名称规格保存条件提取液液体100 mL×1瓶(自备)4℃保存试剂一液体30 mL×1瓶4℃保存试剂二液体200 μL×1支4℃保存试剂三液体30 μL×1支4℃保存标准品粉剂×1支4℃保存溶液的配制:1、提取液:自备异丙醇,4℃保存。
2、标准品:10 mg 胆固醇,临用前加入517 μL 提取液,振荡溶解,即为50 μmol/mL 的胆固醇标准溶液。
3、试剂三:液体置于试剂瓶内EP 管中。
4、工作液的配制:将试剂一:试剂二:试剂三按3 mL :20 μL :3 μL 的比例配制工作液,现用现配。
产品说明:总胆固醇(Total Cholesterol ,TC )是指所有脂蛋白所含胆固醇的总和,包括游离胆固醇和胆固醇酯。
利用酯酶催化胆固醇酯水解生成游离胆固醇(FC )和游离脂肪酸(FFA ),从而把胆固醇酯转化为FC ;进一步利用胆固醇氧化酶催化FC 氧化,生成4-胆甾烯酮和H 2O 2;最后利用过氧化物酶催化H 2O 2氧化4-氨基安替比林和酚,生成红色醌类化合物,其在500nm 有特征吸收峰,其颜色深浅与TC 含量成正比。
技术指标:最低检出限:0.143 μmol/mL 线性范围:0.156-5 μmol/mL注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:可见分光光度计/酶标仪、天平、低温台式离心机、微量玻璃比色皿/96孔板、可调式移液枪、EP 管、蒸馏水、异丙醇。
操作步骤:一、样本处理(可适当调整待测样本量,具体比例可以参考文献)1.组织:按照组织质量(g ):提取液体积(mL )为1:5~10的比例(建议称取约0.1g 组织,加入1mL 提取液)进行冰浴匀浆。
总胆固醇测定的标准操作程序

总胆固醇(CHO)测定的标准操作程序【应用范围】体外检测血清、血浆总胆固醇浓度测定。
【适用仪器】Olympus AU-27全自动生化分析仪。
【程序改变】严格遵循仪器、试剂说明书及校准品使用说明。
【方法学原理】 反应式如下:CHE胆固醇酯+ H2O ^^ 胆固醇+脂肪酸 CHO胆固醇+O2 ^^A4-胆甾烯酮+ H2O2POD2H2O2 + 4-氨基安替比林+苯 ^醍亚胺(显色)+ 4H2O根据o-nitrophenol 在540nm 的吸光度的改变测定待测样本中的总胆固醇浓度。
103mmol/L 5 mmol/L0.31 mmol/L > 2 U/L >50 U/L > 30 U/L2. 校准品:Diasys TruCaL U3. 质控品:Randox Assayed Multiseral Level 2 and Level 3. 【标本收集与准备】 1. 血清或血浆标本根据实验室标准采集程序采集标本,适用标本为血清或肝素抗凝血浆(肝素钠抗凝结果高0.5mmol/l),不可从正在静脉滴注手臂上采血,上机标本不能有 凝块,样品采集后2天内离心标本,分离血清,血清或血浆标本室温保存4天,冷藏7天,冷冻保存6个月。
【操作步骤】1.仪器测定参数设置【试剂】 缓冲液 pH 6.5酚 4-氨基安替比林 胆固醇酯酶(CHE) 胆固醇氧化酶(CHO)过氧化物酶(POD)React ion Slope:+Last L0. Last H 2.50Dynamic Range:Measuring Point1: First |0〔Last27L05 H182. 试剂准备:将准备好的试剂置仪器试剂盘中(8C )。
3. 校准校准物的准备:将校准物从冰箱取出,冻干校准物按说明书加入蒸馏水复溶,轻轻颠倒混匀3次,不可用力震摇,室温放置30分钟至完全溶解;液体校准物从冰箱取出,室温放置15分钟以平衡至室温。
总胆固醇(TC)检测标准操作规程

深圳迈瑞生物医疗电子股份有限公司总胆红素测定方法
2、适用范围
适用于血清总胆红素的测定
3、试剂仪器
3.1试剂:深圳迈瑞生物医疗电子股份有限公司原装试剂盒
3.2未开启的试剂盒避光保存于2℃—8℃有效期一年。
试剂不可以冰冻。
4、操作程序
4.1方法原理
CHE
胆固醇酯+ H2O ——————→胆固醇+ 脂肪酸
CHO
胆固醇+ O2—————→H2O2 + ∆4-胆甾烯酮
POD
2H2O2 + 4-AAP +酚——————→醌亚胺+ 4H2O
4.2样本要求
新鲜血清或肝素血浆,样本收集后应尽快测定,必须避光保存,避免使用溶血样本。
4.3上机操作
4.3.1试剂装载、校准、样品和质控血清分析操作详见“《迈瑞BS-220全自动生化分析仪标准操作、维护、保养规程》”
4.3.2校准“
4.3.2.1 标准液的准备:校准品使用深圳迈瑞生物医疗电子股份有限公司配套冻干品,按说明书要求稀释后分装,-20℃冷冻保存,用前提前15分钟从冰箱取出,复溶到室温后上机检测。
4.3.2.2校准程序:每30天需要定标一次。
当有以下情况时需重新定标:
1)换试剂批号或出现质控漂移时;
2)当仪器做完保养后;
3)仪器进行零件更换时。
每次试验前用准备好的校准品进行定标,定标通过后进行检测。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
总胆固醇测定试剂盒标准操作程序
1. 摘要
本试剂盒供医疗机构用于体外定量测定人血清或血浆样本中总胆固醇的含量。
2. 适用范围
程序适用于AU5811自动生化分析仪检测血清样本中总胆固醇的含量。
3. 职责
使用AU5811自动生化分析仪进行测定总胆固醇浓度的工作人员要严格按照本SOP 程序进行,室负责人监督管理;本SOP 的改动,可由任一使用本SOP 的工作人员提出,并报经生化室负责人、科主任签字批准生效。
4. 检测方法
上海科华生物工程股份有限公司生产的总胆固醇测定试剂盒采用的是氧化酶法。
5. 原理
O
H ESPAS O H O H O O H 222222244+−−−→−+-+-∆+−−−−→−++−−−→−+醌亚胺氨基安替比林胆甾烯酮
游离胆固醇脂肪酸
游离胆固醇总胆固醇过氧化物酶胆固醇氧化酶胆固醇酯酶
ESPAS:N-乙基-N-(3-磺丙基)-间-茴香胺
血清中的总胆固醇在胆固醇酯酶的作用下水解成游离胆固醇和脂肪酸,游离胆固醇在胆固醇氧化酶的催化下,氧化成Δ4-胆甾烯酮和双氧水,最后双氧水在过氧化物酶的催化下与色原底物4-氨基安替比林和ESPAS 反应生成红色化合物醌亚胺。
由于醌亚胺在波长550nm 处有吸收峰,所以在一定底物浓度范围内,550nm 处吸光度的变化值与样本中总胆固醇的含量成正比
6. 仪器
AU5811自动生化分析仪
7. 试剂
7.1 试剂来源:
上海科华生物工程股份有限公司提供
7.2 试剂瓶内主要成分:
R1:胆固醇酯酶、抗坏血酸氧化酶、过氧化物酶、ESPAS (ADPS );
R2:胆固醇氧化酶、4-氨基安替比林;
校准品:胆固醇
7.3 试剂稳定性:
未打开试剂于2℃-8℃避光保存可至失效期。
校准品应密闭保存,以免液体挥发。
8.标准品和质量控制
8.1校准程序:
使用科华公司的校准品对自动分析仪进行校准。
按照公司标准品使用要求,并以9g/L氯化钠溶液或去离子水为空白,经校准测定,仪器自动对标准品通过合适的数学模型绘制校准曲线。
8.2质控品:
罗氏公司提供的生化复合定值质控血清作为室内质控品。
每日在测定前做一次质控,加试剂后做一次质控。
该质控品为干粉包装,在2-8℃冰箱可稳定到失效期,使用前用5ml去离子水复溶,待质控物充分溶解(大约30分钟)后使用。
8.3质控数据管理:
按程序对检验后的质控后结果进行转换,及时质控数据进行分析处理,如出现失控值,应及时分析失控原因,并填写好相关失控记录。
8.4质控判断规则:
按《Westgard多规则质控方法测定标准操作程序》
8.5室间质评:
分别参加河北省临检中心室间质评,对回报的室间质评结果按《室间质量评价程序》进行处理。
9.标本
9.1标本要求:
血清及肝素或EDTA抗凝血浆2-8℃保存可稳定7天,或冰冻保存,但不能反复冻融。
9.2标本拒收:
由实验室人员核收送来标本,如有溶血、已被污染、标识不清或与申请单不符状况,一律要求重新留取标本。
9.3标本处理:
收集编号后离心获取血清/血浆以备检测使用。
10.测定程序:
10.1分析参数:
详见参数表。
10.2操作步骤:
签收样本→离心→上机检测→审核报告→签发报告→标本保存。
10.3获取结果:
在AU5811仪器上或AU5811传送的中文系统电脑上查找相应结果。
10.4结果报告:
对检验后的结果进行审核,系统分析,判断结果的可报告性。
可报告的结果直接发报告,对不可报告结果进行复检后发报告。
11.计算
标准品校准项目后,测定室内质控,质控结果符合质控要求后方可测定样本。
无需手工计算,每个标本的结果自动打印。
12.废液处理
参阅检验科《安全手册》废液处理标准规程处理。
13.操作性能:
13.1可报告范围:
0.09-25.85mmol/L范围内线性相关系数r≥0.99,线性相对偏差应在±15%范围内。
13.2特异性/干扰:
样本中Vc≤4g/L,血红蛋白≤5g/L,胆红素≤684 mol/L,甘油三酯≤20mmol/L对测定结果的影响可忽略。
13.3精密度:
批内精密度CV≤6%;
批间相对极差≤6%
13.4准确度:
用质控品做样本,其测定结果应在该批质控品规定的范围内。
14.注意事项:
14.1试剂盒仅用于体外诊断,测定结果仅作为相关疾病的临床辅助诊断依据。
14.2使用试剂时请根据实际使用量多少,将试剂倒入干净容器内在测定,其余试剂盖紧
后放回冰箱。
14.3如试剂变浑浊,或以纯化水作空白,试剂在550nm处吸光度值大于0.08A,请勿使
用。
14.4本试剂中含有叠氮钠,切勿吞咽,避免与皮肤及粘膜接触。
如不慎接触,应用大量
清水冲洗,如误服,应立即上医院诊治。
15.参考范围:
《全国临床检验操作规程》第三版提出的判断标准:
理想范围:<5.2mmol/L(<200mg/dl)
边缘升高:5.23-5.69mmol/L(201-219mg/dl)
升高:≥5.72mmol/L(≥220mg/dl)
各实验室应建立自己的参考值范围。
16.临床意义:
临床上胆固醇浓度受年龄、饮食、遗传和工作状况影响。
高TC血症是冠心病的主要危险因素之一。
高TC有原发和继发两种,包括见于家族性高胆固醇血症、家族性ApoB 缺陷症、多源性高TC、混合性高脂血症以及其它的如肾综合症,胆总管阻塞,黏液性水肿和糖尿病,肥大性骨关节炎,老年性白内障和牛皮癣等血清胆固醇也会增高。
在恶性贫血,溶血性贫血以及甲状腺机能亢进时,血清胆固醇降低,其他如感染和营养不良等情况下,胆固醇总量常见降低。
17.支持性文件:
17.1AU5811自动生化分析仪使用说明书。
17.2AU5811自动生化分析仪分析参数。
17.3上海科华生物工程股份有限公司提供的试剂说明书。
18.参考文献
1.叶应妩等,全国临床检验操作规程》第三版
2.W.Richmond.Clin.Chem.19:1350(1973).
3.C.Allain.,et al.Clin.Chem.20:470(1974)。
