药典品种新老版对比(全)
新版药典变化

二、通则
• 新增:9205药品洁净实验室微生物监测和控制指导 原则 • 本指导原则是用于指导药品微生物检验用的洁净室 等受控环境微生物污染情况的监测和控制。 • 本指导原则包括人员要求、初次使用的洁净实验寁 参数确认、微生物监测方法、监测频次及监测项目 、监测标准、警戒限和纠偏限、数据分析及偏差处 理、微生物鉴定和微生物控制。 • (具体内容略)
注射用水
• 原标准:取本品至少200ml,采用薄膜过滤法处 理后,依法检查,细菌、霉菌和酵母菌总数每 100ml不得过10个。 • 2015版标准:取本品不少于100ml,经薄膜过滤 法处理,采用R2A琼脂培养基,30-35℃培养不少 于5天,1ml供试品中需氧菌总数不得过10cfu。 • 其它同纯化水。
• 1101无菌检查法 • 1.检验环境和人员要求
• 2010版要求:洁净度10000级下的局部洁净度 100级的单向流空气区域内或隔离系统内进行 • 2015版 要求:在无菌条件下进行,试验环境必须 达到无菌检查的要求。 • 删除了2010版中“无菌检查人员必须具备微生物 专业知识,并经过无菌技术的培训。”内容。
二、通则
• 1105非菌产品微生物限度检查:微生物计数 法 • 培养基:2015版中明确胰酪大豆胨琼脂培养 基或胰酪大豆胨液体培养基用于测定需氧菌 总数;沙氏葡萄糖琼脂培养基用于测定霉菌 和酵母菌总数。删除除了营养琼脂培养基和 玫瑰红钠琼脂培养基的使用
二、通则
• 1105非菌产品微生物限度检查:微生物计数 法 • 培养基温度和时间的变化:新版药典中规定 胰酪大豆胨琼脂培养基平板在30-35℃培养35天;沙氏葡萄糖琼脂培养基平板在20-25℃ 培养5-7天。2010版中的规定则分别是3035℃培养3天,23-28℃培养5天。
新、旧《中国兽药典3部》对比

产
9.6.3 规定用一种小动物或本动物进项效力检验的制品,可用小动物检验 2 次,
部 本动物检验 1 次。如果本动物检验不合格,不得再用小动物检验。
9.6.4 规定用本动物进行效力检验的制品,重检一次不合格,该批制品判为不
合格,不得在进行第 3 次效力检验。
9.6.5 对不规律的效力检验结果,高稀释度(或低剂量)合格,低稀释度(或
菌计数,蚀斑计数,安全检验,效力检验,效价测定,特异性检验,敏感性检验,
特异性检验,敏感性检验,缓冲能力测定,型特异性鉴定,克分子比值测定,
非型特异性鉴定,剩余水分测定,真空度测定,甲醛、苯酚或汞类防腐剂残留量测
QA
剩余水分测定,真空度测定,甲醛、苯酚或汞类防腐剂残留量测定,作用与用
定,规格,贮藏与有效期,附注等。
行。
质量标准的规定进行检验和判定。
10.2 规定可用本动物免疫攻毒法或其他方法任择其一进行效力检验时,可
9.2 检验用动物应选同品种、体重大致相同并符合实验动物标准的动物。外 从所列的几种方法中任意选择一种方法进行检验。
购动物应要求同来源并必须经过隔离饲养,观察适当时间证明符合实验动物标准
10.3 检验用动物应选同品种、体重大致相同并符合实验动物标准的动物。
6 甲醛、苯酚或汞类防腐剂残留量测定 6.1 含梭状芽孢杆菌的制品中,甲醛残留量不得超过 0.5%的甲醛溶液(含 40%甲醛)量;其他制品中不应超过 0.2%甲醛溶液(含 40%甲醛)量。 6.2 制品中的苯酚残留量应不超过 0.5%。 6.3 制品中的汞类防腐剂残留量应不超过 0.01%。 7 活菌计数 每批制品取样 3 个,分别计数,以其中最低菌数核定制品的每 头份菌数或头份数。
应判为不合格。
2020版药典(一部)与2015版药典(一部)内容对比

2020版药典(一部)与2015版药典(一部)内容对比本版药典进一步扩大药品品种和药用辅料标准的收载,本版药典收载品种5911种,新增319种,修订 3177种,不再收载10种,因品种合并减少6种。
一部中药收载2711种,其中新增117种、修订452种。
二部化学药收载2712种,其中新增117种、修订2387种。
三部生物制品收载153种,其中新增20种、修订126 种;新增生物制品通则2个、总论4个。
四部收载通用技术要求361个,其中制剂通则38个(修订35个)、检测方法及其他通则281个(新增35个、修订51个)、指导原则42个(新增12个、修订12个);药用辅料收载335种,其中新增65种、修订212种。
本版药典(一部)新增品种名单药材和饮片裸花紫珠成方制剂和单味制剂八珍丸(浓缩丸)芪明颗粒养血饮口服液大黄利胆胶囊芪参益气滴丸活血止痛软胶囊万灵五香膏芪珍胶囊恒制咳喘胶囊小儿扶脾颗粒芪黄通秘软胶囊冠脉宁胶囊小儿咳喘灵口服液芪蛭降糖片桂附地黄口服液无比山药丸苏黄止咳胶囊唇齿清胃丸五加生化胶囊杏苏止咳口服液柴胡滴丸五灵胶囊杞菊地黄口服液积雪苷片五福化毒片连参通淋片射麻口服液止痢宁片补肾益精丸凉解感冒合剂风湿骨痛片补虚通瘀颗粒益气通络颗粒丹灯通脑软胶囊坤宁口服液益气聪明丸丹灯通脑胶囊坤泰胶囊益心酮分散片丹鹿通督片苦甘颗粒益心酮滴丸正气片苦参软膏益肾化湿颗粒四方胃胶囊固肠止泻胶囊益脑片生白合剂(生白口服液)和血明目片消咳喘胶囊老年咳喘片和胃止泻胶囊消栓肠溶胶囊再造生血胶囊金嗓开音颗粒消癥丸西汉养生口服液(滋肾健脑液)金嗓清音胶囊通窍耳聋丸血栓通胶囊金蝉止痒胶囊黄芪生脉颗粒血滞通胶囊乳块消颗粒银杏叶口服液血塞通片乳康颗粒银杏叶软胶囊血塞通胶囊参芪五味子颗粒银黄丸血塞通颗粒参芪降糖片银黄清肺胶囊壮腰健身丸参芪降糖胶囊痔疮胶囊安胎丸厚朴排气合剂清降片安脑片胃疡宁丸清宣止咳颗粒妇宁栓复方双花口服液跌打七厘片妇科止带胶囊复方鱼腥草合剂喉疾灵片妇科养荣丸复方益母草胶囊舒肝丸(浓缩丸)妇康宝口服液(妇康宝合剂)脉络舒通丸舒肝解郁胶囊芩暴红止咳分散片脉络舒通颗粒舒泌通胶囊芪风固表颗粒养血当归胶囊痛风定片湿毒清片强力定眩胶囊镇咳宁口服液滋肾健脑颗粒疏风解毒胶囊镇咳宁颗粒强力天麻杜仲丸蒲元和胃胶囊癃清胶囊强力枇杷胶囊蒲地蓝消炎胶囊藤丹胶囊强力枇杷露增液颗粒本版药典(一部)未收载2015年版药典(一部)中的品种名单马兜铃穿山甲天仙藤黄连羊肝丸。
新旧药物典原辅料对比
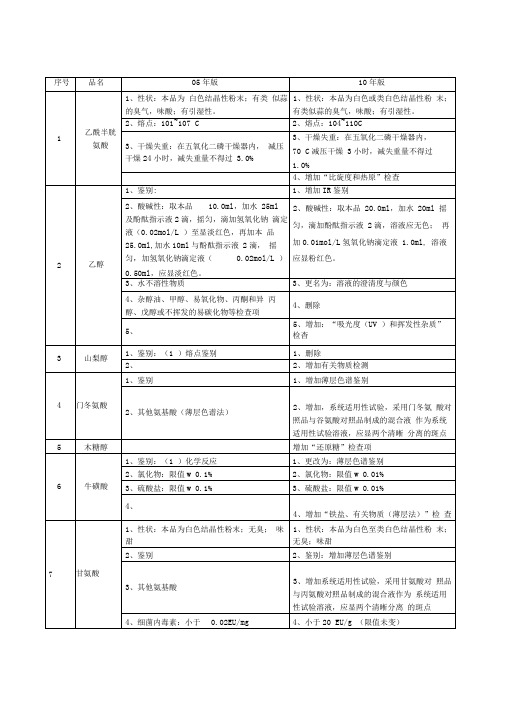
4、更名为“有关物质”:硝酸异山梨酯 与2—单硝酸异山梨酯按外标法计算,均
不得过0.25%;其他单个杂质峰面积不得 大于对照溶液中单硝酸异山梨酯峰面积
的0.5倍(0.25%),杂质总量不得过0.5%°
5、炽灼残渣
删除
27
注射用水
1、pH值:取本品检测
1、pH值:取本品100ml,加饱和氯化钾
2、鉴别
2、增加薄层色谱鉴别
3、其他氨基酸
3、增加系统适用性试验,采用色氨酸对 照品与酪氨酸对照品制成的混合液作为 系统适用性试验溶液,应显两个清晰分离 的斑点
15
异亮氨酸
1、鉴别
1、增加薄层色谱鉴别
2、其他氨基酸
2、增加系统适用性试验,采用异亮氨酸 对照品与缬氨酸对照品制成的混合液作 为系统适用性试验溶液,应显两个清晰分 离的斑点
与红霉素峰的分离度应不小于15.0,罗红
霉素峰与相对保留时间约为0.95处杂质
峰的分离度应不小于1.0,与相对保留时
间约为1.2处杂质峰的分离度不小于2.0°
24
乳酸
1、含量:应为85.0~90.0%(g/g)
1、含量:应为85.0~92.0%(g/g)
2、性状:本品为无色至微黄色的澄清黏 性液体;几乎无臭,味微酸;有引湿性,
5
木糖醇
增加“还原糖”检查项
6
牛磺酸
1、鉴别:(1)化学反应
1、更改为:薄层色谱鉴别
2、氯化物:限值w0.1%
2、氯化物:限值w0.01%
3、硫酸盐:限值w0.1%
3、硫酸盐:限值w0.01%
4、
4、增加“铁盐、有关物质(薄层法)”检 查
7
甘氨酸
药典品种新老版对比(全)

检查:三氧化二砷
含量:三硫化二砷: 雄黄粉:同药材
含量:三硫化二砷:
90.0
90.0
水分≤12.0
水分≤12.0
总灰分≤3.0
生甘遂、醋甘遂:同药 总灰分≤3.0
醇溶性浸出物:15.0 材
醇溶性浸出物:15.0
大戟二烯醇:0.12
大戟二烯醇:0.12
醇溶性浸出物:20
芫花:同药材
醇溶性浸出物:20
芫花素:0.20
制川乌: 检查:水分≤11.0
双酯型生物碱≤ 0.040 含量:苯甲酰乌头原碱 、苯甲酰次鸟头原碱及 苯甲酰新乌头原碱的总
水分≤12.0 总灰分≤9.0 酸不溶≤2.0 乌头碱、次乌头碱和新 乌头碱的总量:0.0500.17
制川乌: 检查:水分≤11.0
双酯型生物碱≤ 0.040 含量:苯甲酰乌头原碱 、苯甲酰次鸟头原碱及 苯甲酰新乌头原碱的总
清半夏:水分≤13.0 总灰分≤4.0 白矾限量≤10.0 水溶性冷浸出物:
7.0 琥珀酸:0.30
法半夏:水分≤13.0 总灰分≤9.0 水溶性冷浸出物:
5.0 姜半夏:水分≤13.0
总灰分≤7.5 白矾限量≤8.5 水溶性冷浸出物: 10.0
水分≤14.0 总灰分≤4.0 水溶性浸出物:9.0 琥珀酸:0.25
氯化物 氧化汞:99.0
—— ——
检查:生汞 汞珠 炽灼残渣≤0.1
氯化亚汞:99.0 检查:牙弓化合物
氯化物 氧化汞:99.0
—— ——
15 马钱子
16 白附子
附子 17 (黑顺
片)
18 洋金花
19 千金子 20 闹羊花 21 水银 22 天南星
水分≤13.0 总灰分≤2.0 士的宁:1.20-2.20 马钱子碱:0.80
2005与2010药典对比(药学概论)

药学概论⏹1对比2005药典,2010新增的内容和新的特点⏹ 1.1药典的概述《中华人民共和国药典》(简称《中国药典》),按照药典委员会确定的设计方案和要求编制而成。
经药典委员会执行委员会审议通过,并经国家食品药品监督管理局批准颁布实施。
⏹ 1.2 2005年版药典简介本版药典分一部、二部和三部。
药典一部收载药材及饮片、植物油脂和提取物、成方制剂和单味制剂等,这一部收载品种1146种,其中新增154种、修订453种;药典二部收载化学药品、抗生素、生化药品、放射性药品以及药用辅料等,这一部收载1967种,其中新增327种、修订522种;药典三部收载生物制品,这一部收载101种,其中新增44种、修订57种。
本版药典收载的品种有较大幅度的增加,共收载3214种,其中新增525种。
⏹ 1.3 2010年版新药典简介2010年版《中国药典》总共收载药品品种4567种,新增1386种,它也分为三部出版。
一部为中药,其中它收载品种2165种,其中新增1019种、修订634种;二部为化学药,它包括化学药品、抗生素、生化药品、放射性药品以及药用辅料等,它收载品种2271种,其中新增330种、修订1500种;三部为生物制品,它收载品种131种,其中新增37种、修订94种。
各部内容主要包括凡例、标准正文和附录三部分,其中附录由制剂通则、通用检测方法、指导原则及索引等内容构成。
新版药典在凡例、品种的标准要求、附录的制剂通则和检验方法等方面均有较大的改进和发展,特别是对药品的安全性、有效性和质量可控性方面尤为重视。
新版药典在继承前版药典的基础上,做了大量发展和创新性的工作。
总的来说,2010年版《中国药典》在2005年版的基础上,做了大幅度的增修订和新增品种的工作。
⏹ 1.4 2010年版新药典在2005版药典的基础上新增的内容⏹ 1.4.1无菌检查2005版药典与2010新版药典的区别1. 2010版药典增加对人员的要求2. 无菌检查人员必须具备微生物专业知识,并经过无菌技术的培训。
版药典变化(精选、)

2015版《药典》中药材标准的变化情况新药典变化概述:1.药典一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等,品种共计2598种,其中新增440种,修订517种,不收载7种。
2.重新建立规范的编码体系,并首次将通则、药用辅料单独作为《中国药典》四部。
3.完善了“药材和饮片检定通则”“炮制通则”和“药用辅料通则”。
4.制定了中药材及饮片中二氧化硫残留量限度标准,建立和完善重金属及有害元素、黄曲霉毒素、农药残留量等物质的检测限度标准。
5.中药材增加专属性的显微鉴别检查、特征氨基酸含量测定等。
6.不再新增处方中含羚羊角、豹骨、龙骨、龙齿等濒危物种和化石的中成药品种。
新药典增减药材情况:删除:紫河车新药典“来源”修订情况:新药典“性状”修订情况新药典“显微鉴别”增加品种三颗针、干漆、山楂、广金钱草、女贞子、马兜铃、天仙子、升麻、生姜、瓜子金、瓜蒌皮、老鹳草、西青果、红大戟、花椒、花蕊石、杜仲叶、豆蔻、牡蛎、余甘子、沙苑子、诃子、补骨脂、苦杏仁、苦楝皮、虎杖、知母、使君子、金果榄、金银花、鱼腥草、卷柏、油松节、韭菜子、骨碎补、钩藤、胖大海、夏枯草、浮萍、预知子、菊花、野木瓜、款冬花、棕榈、紫苏叶、紫苏梗、锁阳、蓝布正、槐角、锦灯笼、豨莶草、暴马子皮、薤白、瞿麦、翻白草新药典“检查”修订情况二氧化硫残留量通则规定,除另有规定外,中药材及饮片(矿物类除外)的二氧化硫残留量不得超过150mg/kg。
正文规定,山药、天冬、天花粉、天麻、牛膝、白及、白术、白芍、党参、粉葛10味中药及其饮片的二氧化硫残留量不得超过400mg/kg。
农药残留量注:•总六六六(α-BHC、β-BHC、γ-BHC、δ-BHC之和)不得过0.2mg/kg;•总滴滴涕(pp’-DDE、pp’-DDD、op’-DDT、pp’-DDT之和)不得过0.2mg/kg;•五氯硝基苯不得过0.1mg/kg;•六氯苯不得过0.1mg/kg;•七氯(七氯、环氧七氯之和)不得过0.05mg/kg;•艾氏剂不得过0.05mg/kg;•氯丹(顺式氯丹、反式氯丹、氧化氯丹之和)不得过0.1mg/kg。
新旧药典的七大变化与区别

新旧药典的七大变化与区别导读新的药典已经实施了,那么新旧药典到底有哪些变化与区别呢?小编在这里给您浅析下。
新药典变化概述:1.药典一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等,品种共计2598种,其中新增440种,修订517种,不收载7种。
2.重新建立规范的编码体系,并首次将通则、药用辅料单独作为《中国药典》四部。
3.完善了“药材和饮片检定通则”“炮制通则”和“药用辅料通则”。
4.制定了中药材及饮片中二氧化硫残留量限度标准,建立和完善重金属及有害元素、黄曲霉毒素、农药残留量等物质的检测限度标准。
5.中药材增加专属性的显微鉴别检查、特征氨基酸含量测定等。
6.不再新增处方中含羚羊角、豹骨、龙骨、龙齿等濒危物种和化石的中成药品种。
历届药典中药收载数量对比:新药典增减药材情况:新增:删除:紫河车新药典“来源”修订情况:新药典“性状”修订情况新药典“显微鉴别”增加品种三颗针、干漆、山楂、广金钱草、女贞子、马兜铃、天仙子、升麻、生姜、瓜子金、瓜蒌皮、老鹳草、西青果、红大戟、花椒、花蕊石、杜仲叶、豆蔻、牡蛎、余甘子、沙苑子、诃子、补骨脂、苦杏仁、苦楝皮、虎杖、知母、使君子、金果榄、金银花、鱼腥草、卷柏、油松节、韭菜子、骨碎补、钩藤、胖大海、夏枯草、浮萍、预知子、菊花、野木瓜、款冬花、棕榈、紫苏叶、紫苏梗、锁阳、蓝布正、槐角、锦灯笼、豨莶草、暴马子皮、薤白、瞿麦、翻白草。
新药典“检查”修订情况二氧化硫残留量通则规定,除另有规定外,中药材及饮片(矿物类除外)的二氧化硫残留量不得超过150mg/kg。
正文规定,山药、天冬、天花粉、天麻、牛膝、白及、白术、白芍、党参、粉葛10味中药及其饮片的二氧化硫残留量不得超过400mg/kg。
农药残留量15版药典对以下4中药材做农药残留量规定。
注:总六六六(α-BHC、β-BHC、γ-BHC、δ-BHC之和)不得过0.2mg/kg;总滴滴涕(pp’-DDE、pp’-DDD、op’-DDT、pp’-DDT之和)不得过0.2mg/kg;五氯硝基苯不得过0.1mg/kg;六氯苯不得过0.1mg/kg;七氯(七氯、环氧七氯之和)不得过0.05mg/kg;艾氏剂不得过0.05mg/kg;氯丹(顺式氯丹、反式氯丹、氧化氯丹之和)不得过0.1mg/kg。
中国药典2005版与2010版比较解读

鉴别(1)
1…调ph至 细化和调整 9~10… 检验参数 2展开剂预饱 和15分 钟
两版药典比较~元胡止痛片
修订项目 05版
10版
修订说明
薄层扫描法
高效液相法
含量测定
(延胡索乙素)
含量:不少于 含量:不少于 20ug 75ug
规格 (片重)
无
薄膜衣片:0.26g 糖衣片芯:0.25g
两版药典比较~复方丹参片
2010版药典简介
正文 分三部,收载品种4567种,新增1386种。 一部:品种共计2165种,新增1019种(包括439 个饮片标准),修订634种。 二部:品种共计2271种,新增330种,修订 1500种。 三部:品种共计131种,新增37种,修订94种。
2010版药典简介
两版药典比较~银黄颗粒
金银花提取物制法比较 内容 煎煮次数 煎煮时间 提取液精 制 提取物 性状 部颁第六册 2次 每次2h 10版 3次
第一、二次各1h, 第三次0.5h 石灰乳调节pH、 删除 沉淀、硫酸调节 pH 稠膏 清膏加淀粉制成 干浸膏
两版药典比较~银黄颗粒
黄芩提取物比较 内容 部颁第六册
四、对药品质量可控性、有效性的技术保障 得到进一步提升。
中药特点的专属性鉴别、有效活性的专属性检测;含量测定大 量应用液相色谱法、大部分口服制剂增订了溶出度检查等等。
2010版药典简介
五、药品标准内容更趋科学规范合理。
制剂通则新增药用辅料总体要求;可见异物检查法中 规定抽样要求、检测次数和时限;一部明确入药均 为饮片等等。
修订项目
制法
05版
无大片
10版
修订说明
增加大片 规范 规定片重 增加大片规 格
2020药典(一 ~ 四部),新增、变化全汇总!

020年版《中国药典》新增品种319种,修订3177种,不再收载10种,品种调整合并4种,共收载品种5911种。
一部中药收载2711种,其中新增117种、修订452种。
在中药安全性控制方面,新版药典要求有效控制外源性污染物的影响,并有效控制内源性有毒成分对中药安全性产生的影响。
在中药有效性控制方面,要求强化标准的专属性和整体性,重点开展了基于中医临床疗效的生物评价和测定方法研究。
新增了药材:裸花紫珠。
新增制剂:116个,具体清单如下:二部化学药收载2712种,其中新增117种、修订2387种。
在药品安全性控制方面,要求进一步完善杂质和有关物质的分析方法,推广先进检测技术的应用,重点强化了对有毒有害杂质(特别是基因毒性杂质)的控制,加强了对药品安全性相关控制项目和限度标准的研究制定。
在药品有效性控制方面,要求将药品质量和疗效一致性评价的成果体现在相关制剂的质量标准提高中,进一步完善了常规固体制剂溶出及释放度检测方法,且在整体质量控制方面进一步借鉴国际要求。
2020年版药典二部新增品种(117个),与一部新增品种居然一样!未收载品种(8个),名称变化的品种(5个)。
具体清单如下:未收载品种(8个)本版药典(二部)未收载2015年版药典(二部)中的品种名单:•鱼肝油•重组人生长激素•注射用重组人生长激素•重组人胰岛素•重组人胰岛素注射液•精蛋白重组人胰岛素注射液•盐酸吡硫醇注射液•注射用盐酸吡硫醇新增品种(117个)本版药典(二部)新增品种名单:1.注射用门冬氨酸鸟氨酸2.马来酸氟伏沙明3.马来酸氟伏沙明片4.扎来普隆5.乌苯美司片6.丙戊酸钠缓释片(I)7.丙泊酚乳状注射液(曾用名:丙泊酚注射液)8.丙酸氟替卡松9.左卡尼汀10.左甲状腺素钠11.左甲状腺素钠片12.右佐匹克隆13.右佐匹克隆片14.卡培他滨15.卡培他滨片16.甲钴胺片17.甲钴胺注射液18.甲磺酸多沙唑嗪19.甲磺酸多沙唑嗪片20.甲磺酸多沙唑嗪胶囊21.甲磺酸瑞波西汀22.甲磺酸瑞波西汀片23.甲磺酸瑞波西汀胶囊24.兰索拉唑肠溶胶囊25.矛头蝮蛇血凝酶(曾用名:蛇毒血凝酶、血凝酶)26.注射用矛头蝮蛇血凝酶(曾用名:注射用蛇毒血凝酶、注射用血凝酶)27.地红霉素肠溶片28.地红霉素肠溶胶囊29.西尼地平胶囊30.西吡氯铵31.西吡氯铵含漱液32.西咪替丁注射液33.西洛他唑片34.托拉塞米35.托拉塞米片36.托拉塞米胶囊37.注射用托拉塞米38.吗替麦考酚酯分散片39.伏格列波糖40.伏格列波糖片41.伏格列波糖胶囊42.米氮平43.米氮平片44.那他霉素45.那他霉素滴眼液46.坎地沙坦酯片47.克霉唑阴道膨胀栓[曾用名:克霉唑栓(指含膨胀棉条的克霉唑栓)]48.更昔洛韦胶囊49.来曲唑50.来曲唑片51.吲哚美辛片52.佐米曲普坦分散片53.阿托伐他汀钙54.阿利沙坦酯55.阿利沙坦酯片56.阿那曲唑片57.苯磺酸左氨氯地平58.苯磺酸左氨氯地平片59.拉西地平60.拉西地平片61.依巴斯汀62.依巴斯汀片63.草酸艾司西酞普兰64.草酸艾司西酞普兰片65.枸橼酸坦度螺酮66.枸橼酸坦度螺酮胶囊67.抗凝血用枸橼酸钠溶液[曾用名:(1)输血用枸橼酸钠注射液(适应症为仅用于单采原料血浆的体外抗凝血)K2)枸橼酸钠抗凝剂]68.枸橡酸钾颗粒69.氟尿苷(曾用名:氟脲苷)70.复方氨基酸(15)双肽(2)注射液71.美司钠72.美司钠注射液73.盐酸乙哌立松74.盐酸乙哌立松片75.盐酸左布比卡因76.盐酸左布比卡因注射液77.盐酸托烷司琼片78.盐酸托烷司琼胶囊79.盐酸曲普利啶80.盐酸伊达比星81.注射用盐酸伊达比星82.盐酸奈福泮胶囊83.盐酸度洛西汀84.盐酸度洛西汀肠溶片85.盐酸度洛西汀肠溶胶囊86.盐酸羟甲唑啉87.盐酸羟甲唑啉喷雾剂88.盐酸羟甲唑啉喷鼻液89.盐酸羟苄唑90.盐酸羟苄唑滴眼液(曾用名:羟苄唑滴眼液)91.盐酸奥布卡因92.盐酸奥布卡因滴眼液93.氨糖美辛肠溶片94.氨糖美辛肠溶胶囊95.脂肪乳注射液(C14~24)(曾用名:脂肪乳注射液)96.酒石酸溴莫尼定97.酒石酸溴莫尼定滴眼液98.酚磺乙胺99.注射用酚磺乙胺100.铝碳酸镁101.铝碳酸镁咀嚼片102.葡萄糖酸钙氯化钠注射液103.硝酸益康唑阴道膨胀栓[曾用名:硝酸益康唑栓(指含膨胀棉条的硝酸益康唑栓)] 104.氯沙坦钾105.氯沙坦钾片106.氯沙坦钾胶囊107.酮咯酸氨丁三醇108.酮咯酸氨丁三醇注射液109.腺苷110.腺苷注射液[曾用名:腺苷注射液(供诊断用)]111.去氨加压素片(曾用名:醋酸去氨加压素片)112.注射用去氨加压素(曾用名:注射用醋酸去氨加压素)113.磷酸氟达拉滨114.注射用磷酸氟达拉滨115.磷酸腺嘌呤(曾用名:维生素b4)116.磷酸腺嘌呤片(曾用名:维生B4片)117.碘帕醇注射液三部生物制品收载153种,其中新增20种、修订126种;新增生物制品通则2个、总论4个。
2010年版药典与2005年版药典差异

[2010-05-18 16:42]中国药典内容简介2010年版《中国药典》分为三部出版,一部为中药,二部为化学药,三部为生物制品。
各部内容主要包括凡例、标准正文和附录三部分,其中附录由制剂通则、通用检测方法、指导原则及索引等内容构成。
药典二部收载化学药品、抗生素、生化药品、放射性药品以及药用辅料等。
药典三部收载生物制品。
新版药典在凡例、品种的标准要求、附录的制剂通则和检验方法等方面均有较大的改进和发展,特别是对药品的安全性、有效性和质量可控性方面尤为重视。
新版药典在继承前版药典的基础上,做了大量发展和创新性的工作。
本版药典具有以下几个特点:新增与淘汰并举,收载品种有较大幅度的增加;二是药品检测项目和检测方法增加,标准提高;三是中药......[2010-05-18 16:32]药典升级大浪淘沙标准提高适者生存“《药典》是国家药品标准的核心,是保障药品安全的重要技术依据。
它更加注重基础性、系统性、规范性的研究,这意味着国家再次从标准上给药品安全以法律支持,从而达到药品更新与淘汰并举的目标。
”国家药典委员会副秘书长周福成日前对本报记者如是说。
随着民众对高质量药品需求的持续增长,注重质量可控性和药品安全性的内容在即将于2010年7月起正式实施的2010版《中国药典》(下称《药典》)中得到足够的强调。
据悉,《药典》已确定收载品种4615种,新增1358种,新增、修订比例达75%。
标准提高适者生存记者分析2010年版《药典》后发现,作为强制性法定药品标准,国家鼓励企业优胜劣汰的意......附件:《中国药典》2010年版二部拟修订附录和拟新增附录一、拟修订的附录附录Ⅰ制剂通则附录ⅠA 片剂附录ⅠB 注射剂附录ⅠC 酊剂附录ⅠG 眼用制剂附录ⅠK 糖浆剂附录ⅠL 气雾剂粉雾剂喷雾剂附录ⅠN 颗粒剂附录IT 搽剂涂剂涂膜剂附录ⅠU 凝胶剂附录Ⅳ分光光度法附录ⅣA 紫外-可见分光光度法附录ⅣC 红外分光光度法附录ⅣD 原子吸收分光光度法附录Ⅴ附录ⅤB 薄层色谱法附录ⅤD 高效液相色谱法附录Ⅵ附录Ⅵ H pH值测定法附录Ⅶ附录Ⅶ A 电位滴定法与永停滴定法附录Ⅷ附录Ⅷ H 重金属检查法附录Ⅷ L 干燥失重测定法附录Ⅷ M 水分测定法附录Ⅸ附录Ⅸ B 澄清度检查法附录Ⅸ C 不溶性微粒检查法附录Ⅸ G 渗透压摩尔浓度测定法附录Ⅸ J 质谱法附录Ⅹ附录Ⅹ F 最低装量检查法附录Ⅺ附录Ⅺ C 异常毒性检查法附录Ⅺ D 热原检查法附录Ⅺ E 细菌内毒素检查法附录Ⅺ G 降压物质检查法附录Ⅺ H 无菌检查法附录Ⅺ J 微生物限度检查法附录Ⅺ K 过敏反应检查法附录ⅩⅣ生物检定统计法附录ⅩⅤ试药、试液、试纸、缓冲液、指示剂与指示液、滴定液附录ⅩⅦ灭菌法附录ⅩⅨ附录ⅩⅨ B 药物制剂人体生物利用度和生物等效性试验指导原则附录ⅩⅨ C 原料药与药物制剂稳定性试验指导原则附录ⅩⅨ F 药品杂质分析指导原则附录ⅩⅨ J 药物引湿性试验指导原则二、拟新增的附录核磁共振波谱法离子色谱法指导原则拉曼光谱法指导原则化学药注射剂安全性检查法应用指导原则抑菌剂效力检查法指导原则药品微生物实验室规范指导原则∙【话题】黄芪药材含量测定【2010版页数】283【2005版页数】212【区别分析】2005年版含量测定只控制黄芪甲苷的含量限度,2010版除控制黄芪甲苷含量外,还增加了毛蕊异黄酮葡萄糖苷含量限度控制(HPLC方法梯度洗脱测定,梯度洗脱限度为含毛蕊异黄酮葡萄糖苷不少于0.020%)。
新旧药典不同ppt课件

内容创新
资源维护方面:例如,鉴于川贝母野生资源濒临枯竭,新增了两 个在四川有几十年栽培历史的种类;独一味为高原环境生长药 材,原规范规定药用部分为带根的全草,药农带根采挖不利于 资源维护,将其药用部分修订为“地上部分〞,保管根部使之得 以重新繁育。 绿色规范方面:新版药典尽能够减少规范执行过程中毒性溶剂 的运用,对规范中有毒、有害的溶剂尽量用无毒或低毒溶剂替 代,新修订规范全面思索运用无毒或低毒溶剂,实施低毒、低耗 、低排放规范。〔薄层展开剂尽量少用苯,放射性试剂和毒性试 剂尽量少用〕
BEA Confidential. | 22
新版药典二部凡例、附录的变化
2-乙基己酸测定法 本法系采用气相色谱法〔附录V E〕测定β-内酰胺类药物中 的2-乙基己酸测定法。
内标溶液的配制:称取3-环己丙酸100mg,置100ml 量瓶中,用环己烷溶解并稀释至刻度。
对照品溶液的制备:精细称取2-乙基己酸对照品 75mg,置50ml 量瓶中,用内标溶液溶解并稀…..
生命科学仪器: PCR仪:新版药典一部种类中某些动物药如蛇类、川贝母等,
都采用了PCR方法。
此外,2019年版<中国药典>中还采用了生物自显影技术定量分析方法如对易霉变的桃仁、杏仁等新增黄曲霉素检测, 方法和限制与国际一致。
BEA Confidential. | 20
种类规范方法中引入分别效能较高的离子色谱法作为法定方法, 这无疑将会促进该方法在药品规范中的运用。
毛细管电泳仪(CE):化药种类中采用了分别效能更高的毛细 管电泳法。
薄层色谱仪(TLC): 新版药典仅新增薄层色谱鉴别就达2494 项,药品规范中大量运用专属性较强的薄层色谱鉴别技术。 质谱类仪器:
中国药典新旧版质量标准对比
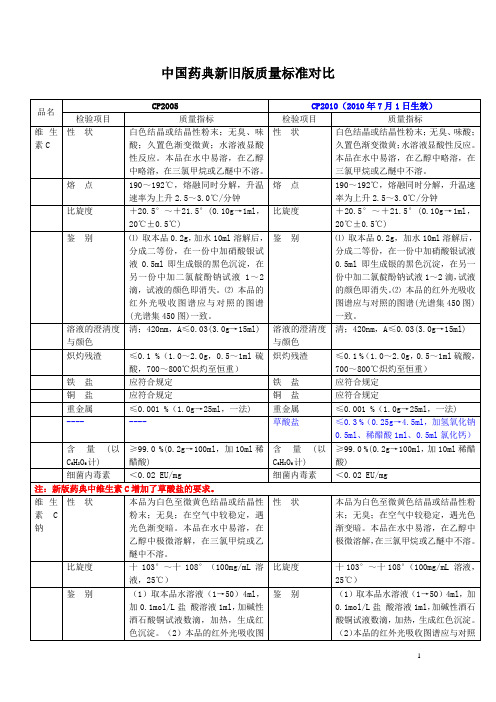
纯化水
定义:蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的供药用的水,不含任何附加剂。
定义:饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用水,不含任何添加剂。
性状
无色的澄清液体;无臭,无味。
性状
无色的澄清液体;无臭,无味。
酸碱度
符合规定
酸碱度
符合规定
氯化物、硫酸盐与钙盐
符合规定
----
----
硝酸盐
≤0.000 006%
硝酸盐
≤0.000 006%
亚硝酸盐
≤0.000 002%
亚硝酸盐
≤0.000 002%
氨
≤0.000 03%
氨
≤0.000 03%
二氧化碳
符合规定
----
----
----
----
电导率(25℃)
≤5.1μS·cm-1
比旋度
十103°~十108°(100mg/mL溶液,25℃)
比旋度
十103°~十108°(100mg/mL溶液,25℃)
鉴别
(1)取本品水溶液(1→50)4ml,加0.1mol/L盐酸溶液1ml,加碱性酒石酸铜试液数滴,加热,生成红色沉淀。(2)本品的红外光吸收图谱应与对照的图谱(光谱集1039图)一致。(3)本品的水溶液显钠盐的鉴别反应
重金属
≤20mg/kg(1.0g→25ml,二法)
重金属
≤20mg/kg(1.0g→25ml,二法)
pH值
7.0~8.0(1.0→10ml)
pH值
7.0~8.0(1.0→10ml)
----
药典05与10版比较

药物分析论文化工与能源学院制药工程一班罗明艳200903701132010 年版与2005年版药典的比较------ 中药及饮片方面2010年版《中国药典》已经在2010年7月1日正式实施。
《中国药典》是国家为保证药品质量可控、确保人民用药安全有效而依法制定的药品法典,是药品研制、生产、经营、使用和管理都必须严格遵守的法定依据,是国家药品标准体系的核心,是开展国际交流与合作的重要内容。
2010年版《中国药典》是新中国成立60年来组织编制的第九版药典,新版药典在总结历版药典的基础上,充分利用近年来国内外药品标准资源,注重创新与发展,实事求是地反映了我国医药产业和临床用药水平的发展现状,为进一步加强药品监督管理提供了强有力的技术支撑。
2010年版《中国药典》在2005年版的基础上,进行了大幅度的标准修订和新增收品种标准的工作。
2010年版《中国药典》注重质量可控性和药品安全性内容的增加和提高,注重基础性、系统性、规范性研究,尤其在薄弱的中药材和中药饮片标准的修订提高方面有所突破创新。
本文主要就中药材和中药饮片标准方面的不同进行分析:一、2010版药典简介:2010年版《中国药典》分为三部出版,一部为中药,二部为化学药,三部为生物制品。
2010年版《中国药典》收载品种4600余种,其中新增1300余种,基本覆盖国家基本药物目录品种和国家医疗保险目录品种。
其中,正文:分三部,收载品种4567种,新增1386种。
一部:品种共计2165种,新增1019种(包括439个饮片标准),修订634种。
二部:品种共计2271种,新增330种,修订1500种。
三部:品种共计131种,新增37种,修订94种。
附录:一部:新增14个、修订47个,总计112个。
二部:新增15个、修订69个,总计152个。
三部:新增18个、修订39个,总计149个。
二、在中药及饮片方面改变及其原因在中药标准有所突破和创新,更符合中药特点。
中药标准整体水平全面提升,尤其在过去比较薄弱的中药材和中药饮片标准的修订提高方面。
中国药典年版情况介绍、看

是检测方法选用的科学性原则。检测方法应 尽可能体现与真实值接近的准确性、最大限度减 小各种偏差的精密性以及准确检测被测药品的专 属性。
国家标准近期工作
• 药品标准制订的原则
• 简便实用
又是药品标准制定的合理性原则。药品标准的建立在 实现科学性的前提下,亦应考虑其合理性与否的一面,即 无必要制定操作繁琐、费用高昂的检测方法去控制不重要 的或用简单方法即可实现的检测项目。因此,良好的药品 标准的制定,应综合考虑上述的目标性原则、科学性原则 与合理性原则方可实现,三者为统一的整体,不可片面追 求。
凝胶剂
分类
2000年版 无
【粒度】 无
2005年版 乳液型基质——乳胶剂 天然高分子基质——胶浆剂
不得有大于180um
【检查】 装量、微生物
装量、微生物 增:无菌(严重损伤)
贴剂
【重量差异】 【面积差异】
【黏附力】 【微生物限度】
2000年版 有
无 无
2005年版 取消(因已有含量均匀 度检查)
体制剂(也)称为滴剂
10cm,4000转离心15’, 不得分层)
密封,遮光(删阴凉处 待酌)
单剂量要求
口服混悬液要求
同2000年版(确认单 剂量口服混悬液亦要求)
耳用制剂、鼻用制剂
分类
2000年版 滴耳(鼻)剂
2005年版
与眼用制剂类似,分为: 液体:滴耳(鼻)液 半固体:软膏、凝胶 固体:散、丸(棒)
胶囊剂
缓、控释胶囊定义 肠溶胶囊定义
微生物限度检查 残留溶剂 【水分】
2000年版 未明确 肠溶空心胶囊
卫生部文件 未明确
不超过9%(一部) 未明确(二部)
2005年版 明确—同片剂 肠溶空心胶囊 肠溶包衣颗粒、小丸
医疗器械2020版新药典与2015版药典变化

医疗器械2020版新药典与2015版药典变化《中国药典》每五年修订一次,2020版《中国药典》是第十一版药典,现在已经发布并将于2020年12月1日正式实施。
针对2020版《中国药典》的更新,作为医疗器械企业关注的纯化水、无菌检查和微生物计数,我们对比了2015版和2020版《中国药典》中关于纯化水、无菌检查和微生物计数的项目供大家参考。
1.2015版和2020版《中国药典》中纯化水、注射用水、灭菌注射用水的对比2015版和2020版《中国药典》中对于纯化水、注射用水、灭菌注射用水的要求没有变化,企业可根据原有的质量管理体系文件规定继续执行。
2.2015版和2020版《中国药典》中无菌检查和微生物计数法的对比.2015版和2020版《中国药典》中对于无菌检查和微生物计数法的主要变化详见后文附表,对于此次的变化我们将其分为:【一般变更】(企业需根据变化修改内部的检验文件)和【重要变更】(企业除了需根据变化修改内部的检验文件外,需更多的关注实际操作的变化),具体内容如下:a.①“医疗器具”改为“医疗器械”:《中国药典》对于医疗器械的适用性;【一般变更】②“监控”改为“监测”:除了对洁净环境进行日常监测外,无菌检查时还应对洁净工作台的沉降菌进行监测;【一般变更】b.制备好的培养基“密闭容器”保存改为“无菌密闭容器”,保存时间由“一般可在一年内使用”改为“经验证的保存期内使用”:企业可根据保存需要对制备好的培养基的保存期进行验证,经验证后方能按验证的保存期对制备好的培养基进行保存使用;【重要变更】c. “1/5”改为“1/3”:在供试品接种前,需检查硫乙醇酸盐流体培养基氧化层的高度,确保氧化层的高度不得超过培养基深度的1/3;【重要变更】d.新增“马铃薯葡萄糖琼脂培养基”:用于黑曲霉的培养;【重要变更】e.增加“和确认”:采购的菌种应采用适宜的菌种保藏技术进行保存,定期转种传代,并对其纯度、特性等进行确认,以保证试其生物学特性;【重要变更】f.①白色念珠菌的新鲜培养物培养时间“24〜48小时”改为“2〜3天”:增加培养时间更利于白色念珠菌的生长,获取所需的菌种新鲜培养物;【重要变更】②“每1ml含菌数小于100cfu(菌落形成单位)的菌悬液”改为“适宜浓度菌悬液”:企业可根据实际菌悬液的浓度进行操作,不再强制要求1ml菌悬液的含菌数小于100cfu;【一般变更】③“20〜25℃培养5〜7天”改为“20〜25℃培养5〜7天或直到获得丰富的孢子”;“3〜5ml”改为“适量”:不再强制要求黑曲霉洗脱液的容量和增加培养时间都为了确保最终能获取足够的黑曲霉孢子;【重要变更】④“0.9%无菌氯化钠溶液”改为“含0.05% (ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液”:更利于黑曲霉孢子的洗脱;【重要变更】⑤“每1ml含孢子数小于100cfu的孢子悬液”改为“适宜浓度的孢子悬液”:企业可根据实际孢子悬液的浓度进行操作,不再强制要求1ml孢子悬液的含孢子数小于100cfu;【一般变更】g.①“每管装量为12ml”“每管装量为9ml”改为“适宜装量”:不再强制要求培养基的每管装量;【一般变更】②“小于100cfu”改为“不大于100cfu”:不再强制要求接种的菌种数量小于100cfu;【一般变更】③培养时间“3天”“5天”改为“接种细菌的培养管培养时间不超过3天,接种真菌的培养管培养时间不得超过5天”:企业可根据实际细菌和真菌的生长情况选择培养时间;【重要变更】h. “滤清”改为“必要时滤过使澄清”:企业可根据需求选择是否需要滤过澄清;【一般变更】i.①“小于100cfu”改为“不大于100cfu”:不再强制要求加入的试验菌数量小于100cfu;【一般变更】j.②“加硫乙醇酸盐流体培养基或胰酪大豆胨液体培养基至滤筒内”改为“加培养基至滤筒内,接种金黄色葡萄球菌、大肠埃希菌、生孢梭菌的滤筒内加硫乙醇酸盐流体培养基;接种枯草芽孢杆菌、白色念珠菌、黑曲霉的滤筒内加胰酪大豆胨液体培养基”:明确接种不同菌种对应的培养基,更利于企业实际操作;【一般变更】k. “培养72小时”改为“培养不超过5天”:增加阳性对照菌的培养时间,确保某些生长较慢阳性菌的生长,更利于阳性对照结果的判断;【重要变更】l. “消毒液”改为“方法”:不再强制要求用消毒液对供试品容器表面进行消毒,企业可选择适用于实际的消毒方法对供试品容器表面进行消毒;【一般变更】m.①增加“若使用其他尺寸的滤膜,应对稀释液和冲洗液体积进行调整,并重新验证”:企业可选择其他尺寸的滤膜,但需对稀释液和冲洗液体积进行调整,并重新进行方法验证;【一般变更】②“总冲洗量不得超过1000ml”改为“总冲洗量一般不超过500ml,最高不得超过1000ml”:减少了每张滤膜的总冲洗量,但也考虑到产品的差异性,给定了最高冲洗量的限定;【重要变更】n.①“温度不得超过44°C”改为“加热温度一般不超过40℃,最高不得超过44℃”:降低了溶于十四烷酸异丙酯的膏剂和黏性油剂供试品的加热温度,但也给定了最高加热温度的限定;【一般变更】②增加“或其他适宜的灭菌方法”:除了薄膜过滤法过滤除菌,企业可选择其他灭菌方法制备十四烷酸异丙酯;【一般变更】o.增加“采用专用设备将供试品转移至封闭式薄膜过滤器中”、“迅速消毒供试品开启部位或阀门,正置容器,用无菌钢锥或针样设备以无菌操作迅速在与容器阀门结构相匹配的适宜位置钻一小孔,钻孔后应无明显抛射剂抛出,轻轻转动容器,使抛射剂缓缓释出”和“必要时用冲洗液冲洗容器内壁”:增加具体的操作细节,更利于企业实际操作;【一般变更】p. “同时应采用适宜的方法进行包装中所配带的无菌针头的无菌检查”改为“同时应采用适宜的方法对包装中所配带的针头等要求无菌的部件进行无菌检查”:增加了供试品中其他的无菌部件的无菌检查要求;【一般变更】q. “同时应采用直接接种法进行包装中所配带的针头的无菌检査”改为“同时应采用适宜的方法对包装中所配带的针头等要求无菌的部件进行无菌检查”:增加了供试品中其他的无菌部件的无菌检查要求,不再强制要求用直接接种法进行无菌部件的无菌检查;【一般变更】r.①“培养14天”改为“培养不少于14天”“培养3天”改为“将原始培养物和新接种的培养基继续培养不少于4天”:根据药典要求,如在加入供试品后或在培养过程中,培养基出现浑浊,培养14天后,不能从外观上判断有无微生物生长,可取该培养液不少于1ml转种至同种新鲜培养基中,将原始培养物和新接种的培养基继续培养不少于4天,因此原始培养物的培养改为不少于14天更合适;【重要变更】②“逐日观察”改为“定期观察”:不再强制要求逐日观察,企业可根据实际需求确定观察周期;【一般变更】s.删除“阳性对照管应生长良好,阴性对照管不得有菌生长。
新版药典二部与老版二部的不同处

1.性状:由白色片变为白色或类白色片 。2.含量:由代E值(650)计算含量变 为称对照品计算含量。
22 H22 72 5 16 H23
别嘌醇 别嘌醇片 丙二醇 丙酸倍氯米松 丙酸氯倍他索 布洛芬片
A B A A A B
Y Y Y Y Y Y
有关物质由TLC改HPLC 新增鉴别(3)红外,有关物质 新增含量测定气相、鉴别(1)气相、有关物 质、还原性物质、砷盐 鉴别(4)删去 熔点、含量测定、新增重金属 新增鉴别(3),溶出度,含量改为液相,新 增规格(3)
P332 P456
20 Y7 H6
芬布芬 A 复方醋酸地塞米 B 松乳膏 复方氢氧化铝片 B
Y Y Y
鉴别(4),有关物质由薄层改液相 含量 铝的限度、含量测定
红外图谱由107改为170 增加【含量测定】项下樟脑与薄荷脑含量 测定(气相色谱) 1.铝的限度由每片由含氢氧化铝按氧化铝 计算不得少于0.116g改为每片中含氢氧化 铝不得少于0.177g。2.含量铝的测定由氧 化铝变为氢氧化铝。
P225 P304 P426 P593 P432 P585
8 7 129
甘露醇 甘油 格列吡嗪
A A A
Y Y Y
新增比旋度、有关物质、还原糖、鉴别(1) 删去 检查丙希醛、葡萄糖、铵盐、易炭化物新增 二甘醇、乙二醇与其它物质、含量 鉴别、含量
P71 P87 丙希醛、葡萄糖、铵盐、易炭化物取样量 5.0ml改为4.0g,含量取样量加倍 鉴别项下删除最大吸收测定,改为吸光度 比值,增加与对照主峰一致、含量由滴定 改为HPLC、含量限度由不少于98.5%改为 98.0%~102.05 1.性状由本品为白色片或包衣片改为本品 为白色片或薄膜衣片。2.新增鉴别 (2),(3)有变化3.含量均匀度由由磷 酸盐稀释变为甲醇,4.溶出度对照溶液的 制备方法改变。 P68 P83 P596 P811
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水分≤13.0 总灰分≤10.0 醇性冷浸出物:12.0 挥发油:1.0
杂质≤4
杂质≤4
水分≤13.0
水分≤13.0
总灰分≤10.0
仙茅苷:0.080,其他 总灰分≤10.0
酸不溶≤2.0
同药材
酸不溶≤2.0
醇性浸出物:7.0
醇性浸出物:7.0
仙茅苷:0.10
仙茅苷:0.10
23 白芍
水分≤14.0 总灰分≤4.0 重金属及有害元素:详 见备注 水性浸出物:22.0 芍药苷:1.6
水分≤16.0 总灰分≤8.0 水性冷浸出物:65.0 杯苋甾酮:0.030
7 山药
8 山豆根 9 大黄 10 干姜 11 木香 12 牛膝 13 天麻
水分≤16.0(毛山药和
光山药)12.0(山药
片)
水分≤16.0 总灰分≤4.0 水性冷浸出物:7.0
山药:总灰分≤2.0 其他项目同药材 麸炒山药:水分≤12.0 总灰分≤4.0 水性冷浸出物:4.0
总灰分≤4.0 木香烃内酯和去氢木香 内酯总量:1.8
总灰分≤4.0 醇性浸出物:12.0 木香烃内酯和去氢木香 内酯总量:1.5
总灰分≤4.0 木香烃内酯和去氢木香 内酯总量:1.8
煨木香:鉴别同药材
水分≤15.0
水分≤15.0
总灰分≤9.0
总灰分≤9.0
牛膝:浸出物:5.0 二氧化硫残留量≤
醇性浸出物:6.5
10-15版药典品种标准汇总
类别一 根茎类
序号 品名 原料
10版药典检测标准 成品
原料
15版药典检测标准
1 人参
水分≤12.0
总灰分≤5.0 人参皂苷Rg1和Re:0.30
同药材
人参皂苷Rb1:0.20
水分≤12.0 总灰分≤5.0 农药残留量:详见备注 人参皂苷Rg1和Re:0.30 人参皂苷Rb1:0.20
水分≤14.0
水分≤14.0
总灰分≤6.0
总灰分≤5.0
总灰分≤6.0
醇性浸出物:15.0
其他项目同药材
醇性浸出物:15.0
欧前胡素:0.080
欧前胡素:0.080
水分≤15.0
水分≤15.0 总灰分≤5.0 色调:黄色9号比较,不 得更深 醇性浸出物:35.0
白术:同药材 麸炒白术:色调:黄色 10号比较,不得更深 其他项目同药材
醇性冷浸出物:17.0
白头翁皂苷B4:4.6
白头翁皂苷B4:4.6
30 甘草
水分≤12.0
总灰分≤7.0
酸不溶≤2.0
重金属及有害元素、 有机氯农药残留量:详
同药材
见备注
甘草苷:0.50
甘草酸:2.0
水分≤12.0 总灰分≤7.0 酸不溶≤2.0 重金属及有害元素、 有机氯农药残留量:详 见变更内容 甘草苷:0.50 甘草酸:2.0
总灰分≤5.0 二氧化硫残留量≤ 400mg/kg 色调:黄色9号比较,不 得更深
醇性浸出物:35.0
水分≤15.0
水分≤15.0 总灰分≤5.0
同药材
总灰分≤5.0 二氧化硫残留量≤
400mg/kg
杂质≤4
杂质≤4
水分≤11.0
水分≤11.0
总灰分≤13.0
同药材
总灰分≤13.0
酸不溶≤4.0
酸不溶≤4.0
游离蒽醌:0.10
性状、鉴别
同药材
性状、鉴别
45 远志 46 芦根 47 知母 48 麦冬 49 虎杖 50 明党参 51 板蓝根 52 苦参 53 郁金
水分≤12.0 总灰分≤6.0 醇性浸出物:30.0 细叶远志皂苷:2.0 远志口山酮Ⅲ:0.15 二芥子酰基蔗糖:0.50
远志:同药材 制远志:酸不溶:3.0
的总量:0.25
14 太子参 15 天花粉 16 巴戟天 17 升麻
18 丹参 19 片姜黄 20 乌药 21 石菖蒲 22 仙茅
水分≤14.0
水分≤14.0
总灰分≤4.0 水性冷浸出物:25.0
同药材
总灰分≤4.0 水性冷浸出物:25.0
太子参环肽B:0.020
太子参环肽B:0.020
水分≤15.0
水分≤15.0
延胡索、醋延胡索: 水分≤15.0
总灰分≤4.0
延胡索乙素:
总灰分≤4.0
醇性浸出物:13.0
0.040,其他项目同药 醇性浸出物:13.0
延胡索乙素:0.050 材
延胡索乙素:0.050
苍术:水分≤11.0
水分≤13.0 总灰分≤7.0 苍术素:0.30
总灰分≤5.0 苍术素:0.30 麸炒苍术:水分≤10.0 总灰分≤5.0
地榆:水分:12.0 地榆炭:浸出物:20.0 鞣质:2.0 没食子酸:0.60 其他项目同药材
水分≤14.0 总灰分≤10.0 酸不溶≤2.0 醇性浸出物:23.0 鞣质:8.0 没食子酸:1.0
水性冷浸出物:18.0 百合、蜜百合同药材 水性冷浸出物:18.0
水性浸出物:50.0
百部、蜜百部同药材 水性浸出物:50.0
龙胆苦苷:
总灰分≤7.0
酸不溶≤3.0
2.0(龙胆)
酸不溶≤3.0
水性浸出物:36.0
1.0(坚龙胆)
水性浸出物:36.0
龙胆苦苷:3.0(龙胆) 其他项目同药材
龙胆苦苷:3.0(龙胆)
1.5(坚龙胆)
1.5(坚龙胆)
水分≤15.0(生地黄)
水分≤15.0(生地黄)
总灰分≤8.0
地黄:同药材
总灰分≤8.0
酒牛膝:4.0
400mg/kg
β-蜕皮甾酮:0.030
醇性浸出物:6.5
β-蜕皮甾酮:0.030
水分≤15.0
水分≤15.0 总灰分≤4.5 醇性浸出物:10.0 天麻素:0.20
天麻:水分≤12.0 其他项目同药材
总灰分≤4.5 二氧化硫残留量≤ 400mg/kg 醇性浸出物:15.0 天麻素和对羟基苯甲醇
37 西洋参
38 当归
39 防风 40 延胡索 41 苍术 42 赤芍 43 何首乌 44 北沙参
水分≤13.0
水分≤13.0
总灰分≤5.0
总灰分≤5.0
人参:
人参:
重金属及有害元素:见 备注 醇性浸出物:30.0
浸出物:25.0 其他同药材
重金属及有害元素、农 药残留量:见变更内容 醇性浸出物:30.0
游离蒽醌:0.20
游离蒽醌:0.20
水分≤19.0 总灰分≤6.0 水性浸出物:22.0 挥发油:0.8 6-姜辣素:0.60
干姜:同药材 姜炭:水性浸出物: 26.0 6-姜辣素:0.50
水分≤19.0 总灰分≤6.0 水性浸出物:22.0 挥发油:0.8 6-姜辣素:0.60
木香:水分≤14.0
酸不溶≤3.0
熟地黄:含量:毛蕊花 酸不溶≤3.0
水性冷浸出物:65.0 糖苷:0.020,检查、 水性冷浸出物:65.0
梓醇:0.20
浸出物同地黄
梓醇:0.20
毛蕊花糖苷:0.020
毛蕊花糖苷:0.020
水分≤14.0 总灰分≤10.0 酸不溶≤2.0 醇性浸出物:23.0 鞣质:8.0 没食子酸:1.0
总灰分≤4.0(毛山药和 光山药)5.0(山药片) 二氧化硫残留量≤ 400mg/kg(毛山药和光 山药)10mg/kg(山药 片)
水性冷浸出物:7.0(毛
山药和光山药)10.0
(山药片)
水分≤10.0
水分≤10.0
总灰分≤6.0
苦参碱和氧化苦参碱的 总灰分≤6.0
醇性浸出物:15.0
总量:0.60,其他项目 醇性浸出物:15.0
总灰分≤4.0
酸不溶≤2.0 醇性浸出物:12.0
同药材
酸不溶≤2.0 醇性浸出物:12.0
乌药醚内酯:0.030
乌药醚内酯:0.030
去甲异波尔定:0.40
去甲异波尔定:0.40
水分≤13.0 总灰分≤10.0 醇性冷浸出物:12.0 挥发油:1.0
醇性冷浸出物:10.0 挥发油:0.7,其他同 药材
人参皂苷Rg1、人参皂苷
人参皂苷Rg1、人参皂苷
Re和人参皂苷Rb1的总
Re和人参皂苷Rb1的总
量:2.0
量:2.0
水分≤15.0
水分≤15.0
总灰分≤7.0
当归:同药材
总灰分≤7.0
酸不溶≤2.0
酒当归:水分:10.0 酸不溶≤2.0
醇性浸出物:45.0
浸出物:50.0,其他 醇性浸出物:45.0
醇性浸出物:19.0
醇性浸出物:19.0
水分≤12.0
白茅根:浸出物:28.0 水分≤12.0
总灰分≤5.0
茅根炭:浸出物:7.0 总灰分≤5.0
水性浸出物:24.0
其他项目同药材
水性浸出物:24.0
水分≤13.0
水分≤13.0
总灰分≤11.0
总灰分≤11.0
酸不溶≤6.0
同药材
酸不溶≤6.0
醇性冷浸出物:17.0
杂质≤5
杂质≤5
水分≤13.0
水分≤13.0
总灰分≤8.0 酸不溶≤4.0
同药材
总灰分≤8.0 酸不溶≤4.0
醇性浸出物:17.0
醇性浸出物:17.0
异阿魏酸:0.10
异阿魏酸:0.10
水分≤13.0
水分≤13.0
总灰分≤10.0
总灰分≤10.0
酸不溶≤3.0
丹参:酸不溶:2.0 酸不溶≤3.0
重金属及有害元素:详 醇性浸出物:11.0 重金属及有害元素:详
苦参碱和氧化苦参碱的 同药材
