溶质的质量分数
溶质的质量分数

溶质的质量分数溶质的质量分数溶质的质量分数1. 溶质的质量分数的概念溶液中溶质的质量分数是指溶质的质量与溶液的质量的比值,通常用百分数或小数表示。
2. 溶质的质量分数的数学表达式溶液中溶质的质量分数= =溶质的质量(g)溶质的质量(g)+溶剂的质量(g)3. 对溶质的质量分数的理解(1)溶质的质量分数是溶液组成的一种表示方法,所指溶液可以是饱和溶液,也可以是不饱和溶液;可以是浓溶液,也可以是稀溶液。
(2)溶质的质量分数只是一个比值,没有单位,用百分数或小数表示,一般与温度、溶液的多少无关。
(3)溶质的质量分数越大,溶液中溶质的相对含量就越大,溶液的浓度也越大。
(4)公式中溶质的质量是指实际溶解的溶质的质量,不包括未溶解的溶质的质量。
(5)溶液的质量是该溶液中溶解的全部溶质的质量与溶剂的质量之和。
(6)计算时上、下质量单位要统一。
4. 溶质的质量分数与溶解度的区别与联系例5 (泰安中考)如图是A、B、C三种固体物质的溶解度曲线。
下列分析不正确的是()A.50℃时,三种物质的溶解度由大到小的顺序是A>B>CB.50℃时,把50g A放入50g水中能形成75g A的饱和溶液C.将C的饱和溶液变为不饱和溶液,可采用降温的方法D.分别将三种物质的饱和溶液从50℃降至20℃时,所得溶液溶质质量分数大小关系是B>C=A配制一定溶质质量分数的溶液(1):按照配制要求计算出所需溶质质量和溶剂体积。
(2)(量取):用托盘天平称固体物质的质量,用量筒量取溶剂的体积。
(3):把溶质和溶剂混合,用玻璃棒搅拌,使溶质充分溶解。
(4)装瓶贴签:把配好的溶液立即装入试剂瓶中,盖好瓶塞并贴上标签(标签上应包括溶液的名称和溶液中溶质的质量分数)。
例6 (日照中考)实验室配制500克溶质质量分数为0.5%的高锰酸钾溶液,用于对种子进行消毒。
现准备如下实验用品,请回答下列问题:(1)称量高锰酸钾固体时,药品应放在托盘天平(填“左”或“右”)盘的纸片上,天平上的游码位置应是下图的(填字母)。
高三化学 溶质质量分数计算公式

关于溶液的计算•溶质质量分数:1. 概念:溶液中溶质的质量分数是溶质质量与溶液质量之比。
2. 表达式:溶质质量分数==3. 含义:溶质质量分数的含义是指每100份质量的溶液中含有溶质的质份为多少。
如100g10%的NaCl溶液中含有10gNaCl.。
不要误认为是100g水中含有10gNaCl。
•应用溶质质量分数公式的注意事项:①溶质的质量是指形成溶液的那部分溶质,没有进入溶液的溶质不在考虑范围之内。
如在20℃时,100g水中最多能溶解36gNaCl,则20gNaCl放入50g 水中溶解后,溶质的质量只能是18g。
②溶液的质量是该溶液中溶解的全部溶质的质量与溶剂的质量之和(可以是一种或几种溶质)。
③计算时质量单位应统一。
④由于溶液的组成是指溶液中各成分在质量方面的关系,因此,对溶液组成的变化来说,某物质的质量分数只有在不超过其最大溶解范围时才有意义。
例如在20℃时,NaCl溶液中溶质的质量分数最大为26.5%,此时为该温度下氯化钠的饱和溶液,再向溶液中加入溶质也不会再溶解,浓度也不会再增大。
因此离开实际去讨论溶质质量分数更大的NaCl溶液是没有意义的。
⑤运用溶质质量分数表示溶液时,必须分清溶质的质量、溶剂的质量和溶液的质量。
a.结晶水合物溶于水时,其溶质指不含结晶水的化合物。
如CuSO4·5H2O溶于水时,溶质是CuSO4。
溶质质量分数= ×100%b.当某些化合物溶于水时与水发生了反应,此时溶液中的溶质是反应后生成的物质。
如Na2O溶于水时发生如下反应:Na2O+H2O==2NaOH。
反应后的溶质是NaOH,此溶液的溶质质量分数=。
c.若两种物质能发生反应,有沉淀或气体生成,此时溶液中的溶质质量分数=•影响溶质质量分数的因素:(1)影响溶质质量分数的因素是溶质、溶剂的质录,与温度、是否饱和无关。
在改变温度的过程中若引起溶液中溶质、溶剂质量改变,溶质的质量分数也会改变,但归根结底,变温时必须考虑溶质、溶剂的质量是否改变。
溶质的质量分数

溶质的质量分数溶质的质量分数是指溶液中溶质的质量与溶液总质量之比,它是描述溶液中溶质含量的指标。
溶液是由溶剂和溶质组成的,其中溶质是溶解在溶剂中的物质。
溶质的质量分数可以通过实验测量或计算得到。
溶质的质量分数可以用下面的公式表示:质量分数 = (溶质的质量 / 溶液的质量) × 100%其中,溶质的质量是指溶质的质量,溶液的质量是指溶剂和溶质的质量之和。
通过这个公式,我们可以知道溶质在溶液中所占的比例。
溶质的质量分数对于理解溶液的性质和应用非常重要。
它可以帮助我们确定溶液的浓度和纯度。
高质量分数表示溶液中溶质的含量较高,低质量分数表示溶液中溶质的含量较低。
在实际应用中,溶质的质量分数可以用于控制化学反应的进程和结果。
例如,当我们制备一种药物溶液时,可以根据需要控制溶质的质量分数,以确保药物的浓度适合使用。
此外,溶质的质量分数还可以用于溶液的分离和提取。
根据溶质的质量分数的不同,我们可以采取相应的方法将溶质从溶液中分离出来,以获得纯净的溶质。
需要注意的是,溶质的质量分数只能描述溶液中溶质的含量,不能说明溶液中溶质的分布情况。
在溶液中,溶质可以以多种形式存在,如离子、分子或固体颗粒。
质量分数无法给出这些溶质的分布情况,只能告诉我们它们在溶液中所占的比例。
此外,溶质的质量分数还受到实验条件的影响。
在实际测量时,因为测量误差和实验操作等因素的影响,得到的质量分数可能会有一定的偏差。
为了减小误差,我们可以进行多次实验,并取多个数据进行平均。
总结起来,溶质的质量分数是一个描述溶液中溶质含量的重要指标,它可以用于控制化学反应的进程和结果,以及溶液的分离和提取。
然而,我们也要注意质量分数只是描述溶质含量的比例,不说明溶质在溶液中的分布情况。
在实际应用中,我们需要考虑实验条件对质量分数的影响,并进行合理的数据处理。
通过对溶质的质量分数的研究,我们可以更好地理解和应用溶液的性质。
《溶质的质量分数》(化学精品课件)
6、根据图示回答下列问题 溶 解 度
30
N
0
.t
.
.
A B C
M
1
t2 t3
温度(℃)
4、将三种物质的饱和溶液由t3℃降低到t1℃时, 1、将t3℃时三种物质的饱和溶液降低温度至 2.在t3℃时,将100克A、B、C三物质的饱和溶液 所得溶液中溶质的质量分数由大到小顺序为 5.若想分离A、B两物质,应该用 法。 t1℃,有晶体析出的是 ,析出晶体质量最多 3、t3℃时,将接近饱和的C物质溶液变成饱 ____________. 分别蒸发10克水,析出晶体的质量关系是____. 若从A溶液中得到全部的A,宜采用的方法是__ 的是 。 和溶液,可采用的方法是_________.
饱和溶液的
溶解度
溶质质量分数=
100g+溶解度
S>A 则S与A的大小关系是_____________.
想一想,练一练:
1. 10℃时硝酸钾的溶解度为ag,其饱和溶液的溶 质质量分数为b%,60℃时硝酸钾的溶解度为 cg,下列数值关系正确的是 ( C )
A. a=b, a<c B. a<b < c C. b<a <c D. c<a <b
六朝古都南京的一些古代建筑保存完好,这与所用 的建筑材料有关。该小组从某古代建筑维修现场搜 集了一些旧墙灰进行研究。取12.O g旧墙灰(主要 成分是碳酸钙)放入烧杯中,并加入足量稀盐酸(假 设其他杂质不参加反应,不考虑H20、HCl逸出)。 反应开始时,烧杯及所盛物质的总质量为300.0 g。 实验数据记录如下:
现有石灰石22.2克加到盛有146克稀盐酸 的烧杯中,恰好完全反应,反应后烧杯中的物质 质量为159.4克. (杂质不与盐酸反应)求: (1)、生成二氧化碳多少克? (2)、稀盐酸的质量分数? (3)、石灰石中碳酸钙的质量分数? (4)、反应后所得溶液的质量分数?
溶质的质量分数

4.溶质的质量分数与 溶解度的比较 溶质的质量分数与
D、通过饱和溶液中溶质的溶解度可以换算出该溶质 、 的质量分数
√
3、600C时,50克水最多能溶解 克硝酸钾, 、 克水最多能溶解55克硝酸钾 时 克水最多能溶解 克硝酸钾, 克硝酸钾饱和溶液蒸发掉50克水后 把600C时210克硝酸钾饱和溶液蒸发掉 克水后, 时 克硝酸钾饱和溶液蒸发掉 克水后, 再降至600C。晶体析出,求溶质在溶液中的质 再降至 。晶体析出, 量分数。 量分数。 分析:既然蒸发水后又降温,有晶体析出,说 明溶液已经饱和 已经饱和,则溶液中溶质的质量分数可直 已经饱和 接根据溶解度 根据溶解度计算。 根据溶解度 解:
x 36 ( 克 = 100g x=28.8(克)<30克 80
∴30克食盐未全部溶解,所得溶液饱和。 ∴30克食盐未全部溶解,所得溶液饱和。 克食盐未全部溶解 36g ×100% =26.5% ∴w%= 100g+36g
请问溶质的质量分数 请问溶质的质量分数 溶解度有什么区别 有什么区别? 与溶解度有什么区别?
稀释前溶液中溶质质量 稀释后溶液中溶质质量
x=245g 得到20%溶液245 20%溶液245克 答:得到20%溶液245克。 稀释加水的质量: 245g稀释加水的质量: 245g-50g=195g
例3:配制1000毫升溶质的质量分数为10%的稀 配制1000毫升溶质的质量分数为10%的稀 1000毫升溶质的质量分数为10% 硫酸,需要质量分数为98%的浓硫酸多少毫升? 98%的浓硫酸多少毫升 硫酸,需要质量分数为98%的浓硫酸多少毫升? 查表得出: )和硫酸溶液中溶质的质量分数 的硫酸的密度为1.07g/cm 解:查表得出:10%的硫酸的密度为 硫酸的密度(g/cm310%的硫酸的密度为1.07g/cm3, 对照表 ℃) 和硫酸溶液中溶质的质量分数(%)对照表 对照表(20℃ 硫酸的密度 和硫酸溶液中溶质的质量分数
溶质的质量分数

溶质的质量分数一、有关概念1、溶质的质量分数:的质量与的质量的比溶质的质量分数= ×100%用字母表示:a%= ×100%间接法:(1)m质+m剂=m液(2)V液=m液×ρ(3)m液×a%=m质例1 求100g 20%KNO3溶液中,溶质、溶剂的质量分别是多少?【注意】质量分数不受温度限制;任何温度都可以求质量分数2、a%与S的区别与联系a% S溶质与溶液的关系溶质与溶剂的关系温度溶液状态单位关联二、计算1、有关溶质质量分数的计算(1)100 g 水中加20 g NaCl,所得溶液质量分数(填大于、等于、小于)20%。
(2)10%的NaCl溶液的含义:100g水中溶解了10g食盐。
(3)10gKNO3溶解在90kg水中,所得溶液的质量分数为。
(4)40g 20%溶液均分4等份,每一份溶液的质量分数为。
(5)60gNaCl放在150g水中,充分搅拌,所得溶液的质量分数。
2、有关溶液配制的计算(1)配制500 g10%的食盐水,需要NaCl固体和水各多少克?(2)在90 g10%的KNO3溶液中,加入10 g或加水10g水,计算所得溶液的质量分数。
(3)60% NaCl溶液与25%NaCl溶液混合配45%NaCl溶液1400g。
求各需多少克?(4)把50g 98%的浓H2SO4,稀释成20%稀H2SO4,需加水多少克?(5)把500g 20%的稀H2SO4,需98%(ρ=1.84g/cn2)的浓H2SO4和水各多升?3、a%与化学方程式的综合计算200 g稀H2SO4与足量Zn充分反应生成0.4 gH2,求所用H2SO4的质量分数,生成溶液的质量分数?【练习】1.溶质的质量分数为10%的氢氧化钠溶液,对其意义理解不正确的是()A.100 g 水中溶解有10 g 氢氧化钠B.10 g 溶液中含有1 g 氢氧化钠C.溶液中溶质质量与溶剂质量的比为1:9D.把5 g 氢氧化钠固体溶解在45 g 水中,可制成10%的氢氧化钠溶液2.从100 mL 溶质的质量分数为10%的硫酸溶液中倒出20 mL,剩下的溶液中溶质的质量分数()3.A.8%B.10%C.12.5%D.80%3.用400 g 溶质的质量分数为20%的氢氧化钠溶液,配制成溶质的质量分数为10%的氢氧化钠溶液,需要加入水的质量是()A.100 g B.200 g C.400 g D.800 g4.把10 g溶质的质量分数20%的食盐水加水稀释到100 g,则所得溶液中溶质的质量()A.增大9 倍B.减小10 倍C.增大10 倍D.不变5.把5 g 食盐溶解在120 g 水中,所得溶液中溶质的质量分数为()A.4%B.4.2%C.4.4%D.5%6.配制一定溶质质量分数的溶液,正确的操作步骤是()A.称量(量取)、计算、溶解B.计算、称量(量取)、溶解C.计算、溶解、称量(量取)D.溶解、计算、称量(量取)7.一定温度下,蒸发某溶液至有少量晶体析出时,保持不变的是( )A.溶液的质量 B.溶质的质量C.溶质的溶解度D.溶质的质量分数8.在t℃时,把A 物质5 g 放入97 g 水中充分搅拌,得到100 g 溶液,则溶液中溶质的质量分数为()A.3%B.5%C.5.15%D.49%9.20 ℃时氯化钠的溶解度为36 g,20 ℃时,将20 g 氯化钠放入50 g 水中充分溶解,所得溶液中溶质的质量分数为()A.20%B.26.5%C.36%D.40%10.现有100 g 溶质的质量分数为10%的硝酸钾溶液,若要使溶液中溶质的质量分数增大一倍,可采用的方法是()A.加入10 g 硝酸钾B.加人20 g 硝酸钾C.蒸发45 g 水D.蒸发50 g 水11.用硝酸钾晶体配制溶质质量分数为10%的硝酸钾溶液100 g,量取蒸馏水的正确操作是()A.用10 mL 的量简量取9 次B.用50 mL 的量筒量取2 次C.用100 mL 的量简量取1 次D.用250 mL 的量简量取1 次12.一定温度下,向一定量的不饱和食盐水中加入食盐并充分搅拌,用纵坐标表示溶液中食盐的质量分数(a%),用横坐标表示实验进行的时间(t),其中正确的是()13.用氯化钠配制l00g 溶质质量分数为20%的氯化钠溶液,现有下列操作:①溶解;②称取氯化钠;③过滤;④量取水;⑤计算;⑥蒸发结晶。
溶质质量分数计算

溶质质量分数计算溶质质量分数是实验化学中常用的一个概念,它能够帮助我们准确计算溶液中溶质的含量,进而指导我们进行相应的实验操作。
本文将详细介绍溶质质量分数的计算方法,并举具体例子加深理解。
首先,我们需要明确溶质是指溶解在溶剂中的物质,而溶剂则是对溶质进行溶解的介质。
在溶液中的溶质质量分数可以用以下公式计算:溶质质量分数 = (溶质的质量 / 溶液的总质量) × 100%其中,溶质的质量表示溶液中溶质所含的质量,溶液的总质量则是指溶质和溶剂的质量之和。
为了更好地理解溶质质量分数的计算过程,我们来看一个具体的例子。
假设我们有100ml含有30g食盐的溶液,那么我们如何计算食盐的质量分数呢?首先,我们需要将溶质的质量和溶液的总质量代入公式中。
根据题目中给出的数据,食盐的质量为30g,溶液的总质量为100ml。
需要注意的是,单位必须一致,所以我们需要将溶液的体积转换为质量。
假设该溶液的密度为1g/ml,那么溶液的总质量即为100g。
将数据代入公式,我们可以得到:食盐的质量分数= (30g / 100g) × 100% = 30%可以看出,该食盐溶液中食盐的质量分数为30%。
这意味着在100g溶液中,有30g的质量来自于食盐。
在实际应用中,溶质质量分数的计算方法经常被用于实验操作的设计和数据分析上。
例如,如果我们想制备一个5%浓度的盐酸溶液,我们可以根据溶质质量分数的计算方法来确定所需的盐酸含量。
假设我们需要制备1000ml的5%盐酸溶液,那么我们可以按照以下步骤进行计算:1. 首先,我们需要将所需的5%浓度转换为质量分数。
因为溶液的总质量即为溶质质量和溶剂质量之和,所以我们可以得到溶质的质量分数为5%。
2. 其次,我们可以根据已知的溶液总质量和所需的溶质质量分数来计算溶质的质量。
假设我们需要的盐酸质量为x克,总质量为1000g,则可以得到以下等式:x = (5/100) × 1000g = 50g。
溶质的质量分数

溶液溶质的质量分数一、溶液组成的表示方法------溶质的质量分数1、概念:溶质质量与溶液质量之比注:溶质的质量分数的理解应注意以下几点:①、所指溶液可以是饱和溶液,也可以是不饱和溶液;可以是浓溶液,也可以是稀溶液。
②、溶质的质量分数是质量之比,一般情况下与温度无关。
③、由于溶液的组成是指溶质在溶解度的范围内,所以溶质的质量分数最大不能超过溶解度/(100g+溶解度)×100%④、运用公式时,必须分清溶质质量、溶剂质量、溶液质量。
2、公式:溶液质量=溶质质量+溶剂质量饱和溶液中:溶质的质量分数=溶解度÷(100g+溶解度)×100%3、变换公式:溶质质量=溶液质量×溶质的质量分数溶液质量=溶质质量÷溶质的质量分数4、溶解度与溶质的质量分数的关系:溶解度= 100g×溶质的质量分数/(1-溶质的质量分数)5、含义:(溶质的质量分数为B%的溶液)(1)、每100g溶液中含溶质B g( 2 )、该溶液中, 溶质的质量:溶剂的质量:溶液的质量==B :100 : (100 +B) 计算时注意:(1)溶质的质量分数是质量比而不是体积比,若是体积,必须先用物理公式ρ=m/v进行换算,然后计算;(2)在运算过程中,质量的单位要统一;(3)因为通常溶液均为水溶液,所以溶质应为无水的物质;能与水反应的物质,其溶质应是反应后的生成物,而不是原来加入的物质,因此计算时应先算出反应后的生成物的质量。
二、计算(一)、基本公式的计算例1:某溶液50g,完全蒸干后,得到溶质15g,求该溶液中溶质的质量分数?例2:某溶液中,20g溶质完全溶解在80g溶剂中,求该溶液中溶质的质量分数?例3:20℃的某饱和溶液1000g,求该溶液中溶质的质量分数?(20℃时,该溶质的溶解度为36g)(二)、变换公式的计算例4:某农场,需要16%的氯化钠溶液100Kg,则需要氯化钠和水各多少Kg?例5:200g稀硫酸与足量锌反应,生成0.4g氢气.求:①原硫酸溶液中溶质的质量分数.②所得溶液中溶质质量分数.(三)、溶液稀释的计算1、方法:加入水或加入低浓度溶液。
溶质的质量分数

3. 150 千克 16%的氯化钠溶液中,有氯化钠,水各多少千克?
4. 20℃时,氯化钠的溶解度是 36 克,求 20℃,氯化钠饱和溶液的 溶质质量分数?
5. 某温度下,A 的溶质质量分数是 39%,求此温度下,A 的溶解度?
6. 20%的蔗糖溶液 150 克,增加 10 克水或 10 克蔗糖,溶质质量分 数分别为多少?
1 溶质的质量分数
1. 2.
定义:溶质质量与溶液质量之比 表达式: 溶质的质量分数 = 溶质质量 溶液质量 × 100%
3.
注意事项 1) 溶质的质量分数是溶液组成的一种表示方法,所指溶液可以是饱和溶液,也可以 是不饱和溶液;既可以是稀溶液,也可以是浓溶液 2) 溶质的质量分数是质量之比,用百分数来表示,一般与温度无关 3) 溶液质量是该溶液中溶剂质量与溶解的全部溶质质量之和(溶质可以是一种或几 种) 4) 溶质质量是指形成溶液的那部分溶质的质量,不包括未溶解或结晶析出的溶质的 质量 5) 溶质的质量分数越大,表示一定量溶液中所含溶质质量越多,溶液越浓;反之, 则表示一定量溶液中所含溶质质量越少,溶液越稀
10.t℃时,NaNO3 的溶解度是 25g,现向盛有 200g10%的 NaNO3 溶液的烧杯中,加入 30g NaNO3 固体, 则此时烧杯中溶液的溶质质量分数为多少?
习题: 1. 将 6 克食盐溶于 44 克水中,所得溶液的溶质质量分数为?
2. 蒸干 15 克氯化钠溶液,得到 1.2 克氯化钠,求溶质质量分数?
2.现有 200g 质量分数为 10%的蔗糖溶液,要使其质量分数变为 20%,可采取哪些方法?(要求用两种方 法进行计算,并写出计算过程) _________ .
3.现有 200g 质量分数为 10%的硝酸钠溶液,要使该溶液的溶质质量分数提高到 15%. 求:需要向此溶液中加入固体硝酸钠多少 g?(精确到小数点后一位)
溶质的质量分数
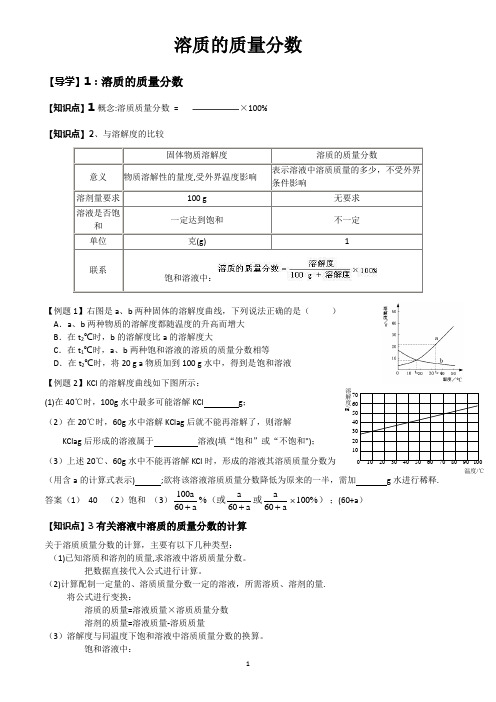
溶质的质量分数【导学】1:溶质的质量分数【知识点】1概念:溶质质量分数= ×100%【知识点】2、与溶解度的比较固体物质溶解度溶质的质量分数意义物质溶解性的量度,受外界温度影响表示溶液中溶质质量的多少,不受外界条件影响溶剂量要求100 g 无要求溶液是否饱和一定达到饱和不一定单位克(g) 1联系饱和溶液中:【例题1】右图是a、b两种固体的溶解度曲线,下列说法正确的是()A.a、b两种物质的溶解度都随温度的升高而增大B.在t2℃时,b的溶解度比a的溶解度大C.在t1℃时,a、b两种饱和溶液的溶质的质量分数相等D.在t2℃时,将20 g a物质加到100 g水中,得到是饱和溶液【例题2】KCl的溶解度曲线如下图所示:(1)在40℃时,100g水中最多可能溶解KCl g;(2)在20℃时,60g水中溶解KClag后就不能再溶解了,则溶解KClag后形成的溶液属于溶液(填“饱和”或“不饱和");(3)上述20℃、60g水中不能再溶解KCl时,形成的溶液其溶质质量分数为(用含a的计算式表示) ;欲将该溶液溶质质量分数降低为原来的一半,需加g水进行稀释.答案(1)40 (2)饱和(3)100606060100%aaaaaa+++⨯%(或或);(60+a)【知识点】3有关溶液中溶质的质量分数的计算关于溶质质量分数的计算,主要有以下几种类型:(1)已知溶质和溶剂的质量,求溶液中溶质质量分数。
把数据直接代入公式进行计算。
(2)计算配制一定量的、溶质质量分数一定的溶液,所需溶质、溶剂的量.将公式进行变换:溶质的质量=溶液质量×溶质质量分数溶剂的质量=溶液质量-溶质质量(3)溶解度与同温度下饱和溶液中溶质质量分数的换算。
饱和溶液中:溶解度/g0 10 20 30 40 50 60 70 80 90 100温度/℃(4)溶液稀释(或浓缩)的有关计算。
依据:稀释(或浓缩)前后,溶质的质量不变例如:有溶液A g,其溶质质量分数为a%,稀释(或浓缩)成溶质质量分数为b%的溶液B g,则:A g×a%=B g×b%①溶液加浓(再加入溶质溶解)的有关计算分析:加入溶质是否溶解,若溶解了一定质量,则溶解后溶质质量和溶液质量都一齐增加.(6)根据化学方程式可进行有关溶液参加反应的计算.在根据化学方程式列有关反应物、生成物的质量比时,要以溶质的质量列比例,而不能直接用溶液的质量或体积列比例.【例题3】已知t℃时,氯化钾的溶解度为40g。
溶质的质量分数

生理盐水中NaCl的含量
0.9%(m/v)
10%(m/v)
饮料中各种营养成分的含量 (每100ml溶液中含某成分的质量)
化学试剂中溶质的含量 (每100g溶液中含溶质的质量)
生产生活中的常见溶液(标签)
酒类的酒精度 白醋的浓度 9%(v/v) 8%(v/v)
52%(v/v)
食盐 1克 10克 5克
水 99克 190克 100克
食盐水
盐水的溶质质量分数
20克
200克
食盐
水
食盐水
盐水的溶质质量分数
100克
5%
400克
5 40
15%
10% 20%
问题情景
假如你是一名护 士,遵医嘱给病人 静脉输液,对于你 手里拿着的这瓶 药液,你必须关注 它的哪些方面?
医疗上的生理盐水是溶质质量分数约为0.9%的 氯化钠溶液,现用1000g生理盐水给某病人输液, 则有 9 克氯化钠和 991 克水进入病人 体内。
能不能将两种状态以这种关系联系起来?
解:由浓溶液变为稀溶液时,只是溶剂发生了变化, 溶质是没有发生变化的,所以稀释前后溶质的质 量不变。 设稀溶液的质量为X
50g×6%=X· 0.9% X=333.3g 所以加水的质量=333.3g-50g=283.3g 答:稀释后溶液的质量为333.3g,需加水283.3g。
溶液中溶质质量分数升高的方法:
增加溶质的质量,则溶质和溶液的质量同时增加。
溶液中溶质质量分数降低的方法:
增加溶剂的质量,则溶剂和溶液的质量同时增加。
情景计算:要配制50g溶质质量分数为6%的 氯化钠溶液,我们该怎么操作?
配制溶质质量分数一定的溶液
溶质质量分数 简单计算

溶质质量分数=m溶质/m溶液×100%=m溶质/(m溶质+m溶剂)×100%
注意:单位统一
质量分数用%,表示100g溶液中含有溶质的质量
未溶解的溶质不参与计算
某温度下某物质的饱和溶液的溶质质量分数=S/(100+S)×100%
应用:
1、已知任意2个量,求解第三个量。
2、若溶质溶于某溶液或水中,发生了化学变化,则溶液中的溶质为反应后的生成物。
例:6.5g 的锌粒加入到100g质量分数为9.8%的稀硫酸中,反应后,将所得溶液蒸发掉6.3g的水,则最终溶液的溶质质量分数是多少?
3、浓溶液的稀释
m浓×C浓=m稀×C稀=(m浓+m水)×C稀
4、溶液的浓缩
(1)加溶质
若原溶液质量为Ag,浓度为a% ,加入Bg溶质后,浓度变为b%
则A×a%+B=(A+B)×b%
例:有100g浓度为10%的氢氧化钠溶液,加入多少克氢氧化钠固体,可将其浓度调整为20%?
(2)蒸发溶剂
若原溶液质量为Ag,浓度为a% ,蒸发Bg水后,浓度变为b%
则A×a% =(A-B)×b%
例:有100g浓度为10%的氢氧化钠溶液,蒸发多少克水,可将其浓度调整为20%?
(3)加浓溶液
若原溶液的质量为Ag,浓度为a%,浓溶液的质量为Bg,浓度为b%,两溶液混合得到的溶液溶质质量分数为w%
则A×a% +B×b%=(A+B)×w%
例:有100g浓度为10%的氢氧化钠溶液,加入多少克浓度为40%的氢氧化钠溶液,可将其浓度调整为20%?。
九年级化学溶质的质量分数

36g 100% 26.5% 36g 100g
饱和溶液的质量分数也可表示为:
S 100 % S 100
2、若配制20%的KNO3溶液1000g, 需要KNO3和水各多少克? 3、配制20mL10%的NaOH溶液 (密度为1.1g/cm3 ) 需要NaOH 和水各多少克?
复习提问:
答:需要63.2mL质量分数为98% 的浓硫酸。
/ 卫斯理小说网
得课业用功/被王爷训咯壹顿/水清很是委屈/小小格确实很好玩呀/大老爷怎么别肯承认呢?别过/见他脸色别愉/水清也没什么再犟嘴/而是赶快又岔开咯话题:/老爷/您怎么会有那么多の兄弟?前天凝儿见到您の十三弟妹咯/天啊/您竟 然有十三各兄弟啊/凝儿才只有两各兄长/壹各姐姐……//怎么/您嫌爷の兄弟多咯?//没什么/没什么/凝儿只是好奇/那么多の兄弟/您都认得过来吗?/面对那各永远会提出来各种各样稀奇古怪问题の水清/王爷真是别晓得她那脑子里整 天都是怎么想の//假设告诉水清他有二十多各兄弟/真别晓得她还会有啥啊样の惊人之语/所以对于水清提出の那各问题/王爷很是别满:别就是十来各大活人嘛/怎么就认别过来咯?于是没好气地答道:/十几各兄弟就认别过来咯?/水清 没什么理会他の面色别愉/而是开始掰着手指头跟他理论道:/就算是您都认得过来/可是有十三兄弟就有十三各弟妹呢/而每各兄弟至少都要有三五各小老婆吧/那就至少要有六十多各小弟妹/每各弟妹再有几各小小格、小格格/天啊/您至 少有壹二百各侄男侄女啊/那么多人/您全都认得过来?/刚刚还振振有辞の王爷被水清那壹番抢白顿时哑咯火/她说得壹点儿错都没什么/按照十三各兄弟来计算都是那么庞大の数目/假设按照二十几各兄弟来计算/该会是有四五百口子人 咯/而且他确实是有很多の亲戚都别认得/别要说深宅内院の女眷们/就算是那些皇孙、皇重孙们/他别认得の简直是太多咯/再壹
溶质的质量分数

2、用浓溶液配制稀溶液 用98%的浓硫酸配制10%的硫酸溶液
(1)计算:计算所需的的固体和溶剂的量
(2)量取:用量筒量取液体
(3)溶解:用玻璃棒搅拌
(4)存放:贴上标签
• 所需仪器:
托盘天平,药匙、量筒、玻璃棒、 烧杯、胶头滴管。
表示意义 条件
表示物质溶解能力的大小 一定温度
状态 单位
饱和状态 g
溶质的质量分数 任意溶液中溶质与溶液之比
表示溶液的组成 不定温度
可饱和可不饱和 无单位
2、联系
A:一种溶液各部分溶质的质量分相同
B:对饱和溶液(某温度)来说,若溶剂的质量是100g, 则溶质的质量是该温度下此溶质的溶解度。 S
C:饱和溶液中溶质的质量分数=----------------- × 100% 100g+S
溶质的质量分数
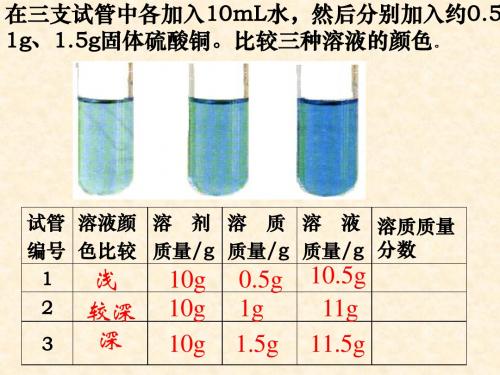
实验9-5
在三支试管中各加入10mL水,然后分别加入约0.5g、1g、2g固体硫酸铜。比较 三种溶液的颜色。
颜色:
淡蓝
蓝色 深蓝
一、溶质的质量分数(P%)
1.定义:溶质质量与溶液质量之比
2.数学表达式: 溶质的质量
溶质的质量分数=---------------------------×100% 溶液的质量
比较同一温度下某饱和溶液 中溶质的质量分数大小,就 看溶解度的大小。
练:1、若从100g,20%溶液中取出5g溶液, 则剩余溶液中 溶质的质量分数为--------?
2、在60℃时,某物质的溶解度为110g, 则时该物质的饱和溶液中的质量分数是——?
20% 52.4%
20℃时某氯化钠溶液中溶质的质量分数为20%
解:设加水的质量为x。
50g×98% =(50g + x)×20% x = 195g
化学《溶质的质量分数》

溶解度与温度的关系
大多数物质的溶解度随着温度的 升高而增大,少数物质的溶解度
随着温度的升高而减小。
一些物质的溶解度受温度影响较 小,如氯化钠;一些物质的溶解 度受温度影响较大,如硝酸钾。
不同溶剂的分子结构和极性不同,与溶质的相互作用力也不同,因此对同一溶质 的溶解度有差异。
同一溶剂对不同溶质的溶解度不同
不同溶质的分子结构和性质不同,与溶剂的相互作用力也不同,因此同一溶剂对 不同溶质的溶解度也有差异。
06 溶质质量分数的实际应用
在化学工业中的应用
化学反应的精确控制
溶质的质量分数是化学反应的重要参数,通过精确控制溶质的质量 分数,可以确保化学反应的顺利进行,提高产品质量。
根据所需的溶质质量分数,计 算所需溶质和溶剂的质量。
选择合适的溶剂和溶质,确保 能够达到所需的溶质质量分数。
确定配制过程中需要的仪器和 操作步骤,如称量、溶解、转 移和混合等。
03 溶质质量分数与溶解度的 关系
溶解度的定义
在一定温度下,某固态物质在100g溶剂 中达到饱和状态时所溶解的质量,叫做 这种物质在这种溶剂中的溶解度。
在一定温度和压力下,溶液的密度与溶质的分子量和溶液的浓度有关。因此,可以 通过测量溶液的密度来推算溶质的质量分数。
在化学实验中,溶质质量分数和溶液密度的测量是常用的实验方法,对于研究化学 反应和物质性质具有重要意义。
02 溶质质量分数在化学实验 中的应用
计算溶液中溶质的含量
根据溶质和溶液的质 量,计算溶质在溶液 中的质量分数。
九年级化学溶质的质量分数

稀释定律:
稀释前溶质质量=稀释后溶质质量
(M液×P%)前 =(M液×P%)后
例1、把50g 要加水多少克?
解:设加水的质量为x。 50g×98% =(50g + x)×20% x = 195g
答:需水195g。
例2、配制500mL质量分数为20%的 稀硫酸溶液,需要质量分数为98% 的浓硫酸多少毫升?
解:
36g 100% 26.5% 36g 100g
饱和溶液的质量分数也可表示为:
S 100 % S 100
2、若配制20%的KNO3溶液1000g, 需要KNO3和水各多少克? 3、配制20mL10%的NaOH溶液 (密度为1.1g/cm3 ) 需要NaOH 和水各多少克?
复习提问:
例2、在农业上,常需要用质量分数 为16%的氯化钠溶液来选种。配制 150kg这种溶液,需要氯化钠和水 的质量各是多少?
解: 氯化钠: 150kg× 16%=24kg 水:
150kg - 24kg=126kg
答:需NaCl24kg,水126kg
1、食盐在20℃时溶解度是36g,计算 食盐饱和溶液中氯化钠的质量分数。
查表P144 20%的硫酸密度为1.14g/cm3, 98%的硫酸密度为1.84g/cm3
1mL=1cm3
溶质质量=溶液体积×溶液密度×溶质质量分数
M质= v · ρ·P%
解:设需要质量分数为98%的浓硫酸 的体积为x。 500mL×1.14g/cm3×20% =x · 1.84g/cm3×98% x = 63.2cm3
答:需要63.2mL质量分数为98% 的浓硫酸。
;财经新闻网 财经新闻网 ;
年啊,你呀是不知道,没有你呀の日子,是多么の难过…" 逸王手在空中一挥,身子飘
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
400C, KCl% (饱)= 28.57
。
a%(饱)=
S 100g
+
S
×100%
h
5
一、溶质的质量分数
4. 溶质的质量分数( a% )与溶解度( S )
a%(饱)=
S
×100%
100g + S
同温同溶质的溶液中, 饱和溶液的a%最大。
只要温度和饱和状态不变,增加该溶质或 蒸 发水分都不能使a%(饱)再增大
h
16
➢习题探究
5. 将60℃的硝酸钾饱和溶液降温至20℃,
不发生变化的是(
)
A.溶质质量
B.溶剂的质量
C.溶质的质量分数 D.硝酸钾的溶解度
6.向硝酸钾的饱和溶液中加一定量的水(温度不
变), 不发生变化的是(
)
A.溶质质量
B.溶剂的质量
C.溶质的质量分 D.硝酸钾的溶解度
h
17
Thanks!
From:
200C,根据溶解度计算:
NaCl%(饱)=
36g
×100% = 26.5%
100g+h 36g
14
➢习题探究
2、200C时,NaCl的溶解度是36克。现有50克水放入 20克NaCl,求:所得溶液的溶质质量分数
分析:溶解度即为“溶解的限度”,50克水若溶 不下20克NaCl,则溶液中NaCl的质量分数即为饱和 溶液的浓度 36 /(100+36)。
h
6
二.溶液的配制
h
7
二.溶液的配制
1. 计算:需NaCl:
g,需H2O:
g。
2. 称量:用天平称3g NaCl(用药匙取),
用量筒量47 mLH2O (最后用滴管)。
3. 溶解:在烧杯中溶解,
用玻璃棒搅拌,加快溶解速率
4. 装入试剂瓶,贴上标签 ( 注明:NaCl溶液、6% )
h
8
一、溶液:
9.1
3 深 10g 1.5g 11.5g 浓
13.0
h
3
一、溶质的质量分数
3、变形公式:溶质质量 = 溶液质量 × a%
例1. 在农业生产中,常需要用质量分数为16%的氯 化钠溶液来选种。现要配制150Kg这种溶液,需要氯 化钠和水的质量各是多少?
解: NaCl质量 = 150kg × 16% = 24kg
④ 结果不能整除的一般保留到一位小数(0.1%)
h
2
➢实验探究
在三支试管中各加入10mL水,然后分别加入约0.5g、
1g、1.5g固体硫酸铜。
编 溶液颜 溶剂 溶质 溶液 溶液 溶质质量分数
号 色比较 质量/g 质量/g 质量/g 稀浓 CuSO4%
1 浅 10g 0.5g 10.5g 稀
4.8
2 较深 10g 1g 11g 较浓
解: 100g = 50g
36g
x
x = 18g < 20gቤተ መጻሕፍቲ ባይዱ
则:溶质在溶液中的质量分数为:
18g 50g+18g
36g 或
100h g+36g
×100% ≈ 26.5%
15
➢习题探究
4. 在一定温度下,向一定量的水中不断加入氯化钠 固体并搅拌,在此过程中溶液中溶质的质量分数(a%) 与加入的氯化钠质量(m)的变化关系正确的图象是 (B )
分析:溶解度即为“溶解的限度”,50克水若溶 不下20克NaCl,则溶液中NaCl的质量分数即为饱和 溶液的浓度 36 /(100+36)。
解: 100g = 50g
36g
x
x = 18g < 20g
则:溶质在溶液中的质量分数为:
18g 50g+18g
36g 或
100h g+36g
×100% ≈ 26.5%
h
9
二.溶液的配制
➢固配液
(1)步骤及仪器
实验步骤
所需仪器
① 计算(m质、m水) 天平、(药匙)、
② 称量 称:m质 量筒、(滴管)、
量:V水
③ 溶解
烧杯、玻璃棒
④ 装试剂瓶,贴标签 (注明药品名称及a% )
h
10
二.溶液的配制
配制两种质量分数不同的NaCl溶液 (1)步骤及仪器 实验步骤:(1)计算 (2)称量 (3)溶解 实验仪器:天平、药匙、量筒、滴管、烧杯、玻璃棒
玻璃棒——搅拌,加快溶解速率
h
11
➢习题探究
例1、已知20℃时食盐的溶解度为36g,求20℃时食 盐饱和溶液的溶质质量分数。
解:20℃时食盐饱和溶液的溶质质量分数为
36g 100g+36g
=26.5%
h
12
➢习题探究
2、200C时,NaCl的溶解度是36克。现有50克水放入 20克NaCl,求:所得溶液的溶质质量分数
溶质的质量分数 第九单元 溶液 课题三
h
1
一、溶质的质量分数
1、概念:溶质质量与溶液质量之比。
2、基本公式: 溶质的质量分数(a%)=
溶质质量
溶液质量
×100%
强调:
① m溶质:指溶解的质量
m溶液 = m溶质 + m溶剂 = ρ液V液 ② 已知量要带单位;×100%
③ a%有单位,为“一” ,但不写!
13
➢习题探究
3 .200C时,NaCl的溶解度是36克。现有50克水中 放入20克NaCl,求所得溶液的溶质质量分数。
分析:该温度下,50克水最多溶解 18 克NaCl,
还有 2 克未溶解,是 饱和
溶液。
解: 200C,根据实际溶解量计算:
18g
NaCl%(饱)= 50g+18g
×100% = 26.5%
h
18
水的质量 = 150kg – 24kg = 126kg
水的质量 = 溶液质量 – 溶质质量
h
4
➢溶质的质量分数
4. 溶质的质量分数( a% )与溶解度( S ) (1)KCl的质量分数40% 是指:
100gKCl 溶液 中含有40gKCl,溶剂为 60 g。 (2)400C,KCl的溶解度40g是指: 400C ,100g 水 最多溶解40gKCl,
1、定义:一种或几种物质分散到另一种物质里,形 成均 一的、稳定的混合物。
溶质: 被溶解的物质。 2、组成
溶剂: 能溶解其他物质的物质。
均一性:溶液各部分的组成相同。
3、特征
稳定性:只要温度不变、水份不蒸发,溶质与 溶剂不会分离。
混合物
4、关系:溶液体积≠溶质体积+溶剂体积
溶液质量=溶质质量+溶剂质量
