花色素实验
迎春花色素的提取实验原理

迎春花色素的提取实验原理迎春花色素是从迎春花(学名:Lathyrus odoratus L.)中提取的一种天然植物色素。
迎春花是豆科植物,在我国广泛栽培,是一种美丽的观赏植物。
迎春花色素丰富多样,主要包括类黄酮、花青素和类胡萝卜素等。
迎春花色素的提取实验主要通过物理或化学方法对迎春花中的色素进行分离纯化。
以下是迎春花色素提取实验的原理和步骤。
实验原理:1. 优化提取溶剂的选择:迎春花中的色素主要是非极性或弱极性物质,因此可选择非极性有机溶剂如乙醇、醚类等,或混合使用极性和非极性溶剂提高色素的提取效率。
2. 增加色素稳定性:迎春花中的色素容易受到光照、氧化和酶的影响,因此可以添加抗氧化剂如维生素C、硫代硫酸盐等,或调节提取条件如温度、pH值等来保护色素的稳定性。
3. 加快色素释放:迎春花中的色素存在于细胞器和细胞壁之间,困难释放。
可以通过渗透性增加剂如酒精和碱等来破坏细胞壁,促进色素的释放。
4. 色素的分离纯化:色素的种类较多,可以通过色谱技术如薄层色谱(TLC)、高效液相色谱(HPLC)和纯化技术如凝胶层析、逆向色谱等方法对色素进行分离纯化。
实验步骤:1. 获取迎春花材料:选择新鲜健康的迎春花作为实验材料,避免有疤痕、病害和腐烂的花朵。
2. 粉碎样品:将迎春花花朵粉碎成细碎颗粒,增加色素释放的表面积和速度。
3. 提取溶剂选择:根据实验目的和色素性质选择合适的提取溶剂,一般常用的为乙醇、醚类和混合溶剂等。
根据实验需要,可以对不同的溶剂进行试验提取效果的比较。
4. 提取过程:将粉碎的迎春花样品与选择好的提取溶剂混合,通过搅拌、浸泡、加热等方法促进色素的提取。
提取时间根据实验需要可以延长或缩短。
5. 过滤提取物:将提取得到的混合物经过滤,去除杂质、残渣和植物组织等。
6. 浓缩提取物:通过浓缩技术如低温浓缩、真空浓缩等,去除提取溶剂,得到浓缩的提取物。
7. 分离色素:利用色谱技术如TLC、HPLC等对提取物进行分离,通过比色或荧光检测方法确定色素的种类和含量。
神秘的紫甘蓝实验实验原理

神秘的紫甘蓝实验实验原理神秘的紫甘蓝实验是一种通过将紫色甘蓝汁与酸碱溶液混合来观察颜色变化的实验。
该实验原理涉及到紫色甘蓝所含的天然化合物——花色素。
首先,我们需要了解紫色甘蓝的颜色是由花色素所决定的。
花色素是一类能吸收特定波长的光线的化合物。
具体来说,紫色甘蓝包含了一种类型的花色素——花青素。
这类花色素在中性环境下呈现出紫色,而在酸性环境下会变成红色,碱性环境下则表现为绿色。
在实验中,我们会将紫色甘蓝打碎并与水混合,达到制备紫色甘蓝汁的目的。
紫色甘蓝中的花色素会溶解在水中,使水呈现出紫色。
当我们将这个紫色甘蓝汁与酸碱溶液混合时,就会观察到颜色的变化。
首先,当我们将紫色甘蓝汁与酸溶液混合时,由于酸性环境的存在,花青素会与酸发生反应,导致颜色由紫色转变为红色。
这是因为酸能够损坏花青素分子结构中的部分键,从而改变了其吸收特定波长的能力。
相反,当我们将紫色甘蓝汁与碱溶液混合时,碱会与花青素发生反应,导致颜色由紫色转变为绿色。
在碱性环境下,花青素分子的结构发生了变化,使其能够吸收不同波长的光线。
除了颜色的变化,还可以观察到在酸碱溶液中花色素的溶解度发生了改变。
当花色素与酸结合时,其溶解度会减少,颜色会变得更加浓郁。
相反,当花色素与碱结合时,其溶解度会增加,颜色会变得更加淡化。
总结起来,神秘的紫甘蓝实验的原理是利用紫色甘蓝中的花色素在酸碱溶液中的反应来观察颜色变化。
酸性环境会使颜色变红,碱性环境会使颜色变绿。
除了颜色,实验还可以观察到在不同酸碱条件下花色素的溶解度的变化。
这种实验不仅能够锻炼学生的实验操作能力,还能增进对化学反应和颜色变化的理解。
七色花实验制作方法

七色花实验制作方法七色花实验是一种常见的生物学实验,多用于教学和科研。
通过在白色的鲜花中注射染料,使其在花瓣内部形成七种不同颜色的环。
这一实验不仅可以让学生更直观地了解植物的色素沉积过程,还能帮助研究人员深入探究植物生长发育的机理。
本文将围绕七色花实验的制作方法展开探讨,从材料准备到实验操作,再到结果分析,希望能为读者提供一份详尽的指导。
首先,进行七色花实验需要准备一些基本的材料,包括白色的鲜花、吸管、染料、注射器、显微镜等。
选择的鲜花应该具有易于吸收染料的特性,比如菊花、玫瑰等。
在实验操作过程中,需要将鲜花的茎横切开,利用注射器将染料注入到花瓣内部,然后观察染料在花瓣中的扩散过程。
通过显微镜的放大,可以清晰地观察到染料分子在植物细胞内的运动轨迹,从而揭示植物生长发育的奥秘。
在进行七色花实验的过程中,需要注意一些实验操作的细节。
首先,选择染料时应当注意染料的浓度和稳定性,以确保实验的可靠性和重复性。
其次,在注射染料时需要轻柔而均匀地操作,避免对植物组织造成损伤。
最后,在观察实验结果时,应该随时记录实验数据,以便后续的数据分析和结果验证。
通过严谨的实验操作和细致的数据记录,才能保证实验结果的可信度和科学性。
除了实际操作方法以外,七色花实验的结果分析也是实验的重要环节。
根据实验结果,在花瓣内部形成的七种不同颜色的环可以反映出植物细胞内色素的分布情况。
通过比较不同染料在植物细胞内的扩散速度和范围,可以进一步探究植物生长发育过程中色素合成和运输的机制。
此外,在实验结果分析的过程中,还可以结合相关的生物物理学理论和植物生长发育的研究成果,对实验结果进行进一步解释和推断。
总的来说,七色花实验是一种简单而有趣的生物学实验方法,通过这一实验可以更直观地观察植物细胞内色素的运输过程,从而深入了解植物生长发育的机理。
在进行七色花实验时,需要注意材料的选择和实验操作的细节,以确保实验的可靠性和准确性。
通过对实验结果的分析和解读,可以进一步揭示植物生长发育过程中的一些关键环节,为相关领域的研究提供重要的参考和支持。
不同叶片或花瓣色素提取和分离的实验报告

不同叶片或花瓣色素提取和分离的实验报告绿叶中色素的提取和分离的实验报告
一、实验目的1. 学会提取和分离叶绿体中色素的方法。
2. 比较、观察叶绿体中四种色素:理解它们的特点及与光合作用的关系
二、实验原理光合色素主要存在于高等植物叶绿体的基粒片层上,而叶绿体中的色素能溶于有机溶剂中。
故要提取色素,要破坏细胞结构,破坏叶绿体膜,使基粒片层结构直接与有机溶剂接触,使色素溶解在有机溶剂中。
叶绿体中的色素有四种,不同色素在层析液(脂溶性强的有机溶剂)中的溶解度不同,因而随层析液的扩散速度也不同。
三、材料用具取新鲜的绿色叶片、定性滤纸、烧杯、研钵、漏斗、纱布、剪刀、小试管、培养皿、毛细吸管、量筒、有机溶剂、层析液(20份石油醚、2份丙酮、1份苯混合)、二氧化硅、碳酸钙。
四、实验过程(见书P54)1.提取色素:2.制备滤纸条:3.色素分离,纸层析法。
(不要让滤液细线触及层析液)4.观察:层析后,取出滤纸,在通风处吹干。
观察滤纸条上出现色素带的数目、颜色、位置和宽窄。
结果是:4条色素带从上而下依次是:胡萝卜素(橙黄色)、叶黄素(黄色)、叶绿素a(蓝绿色)、叶绿素b(黄绿色)。
五、讨论1.滤纸条上的滤液细线为什么不能接触到层析液?2.提取和分离叶绿体中色素的关键是什么?。
在不同ph下花色素甘的吸收光谱

在不同pH下花色素甘的吸收光谱1. 背景介绍花色素甘是一种常见的植物色素,它在植物生长和发育过程中起着重要作用。
在光合作用过程中,花色素甘能够吸收光能并转化为化学能,为植物的生长提供能量。
由于植物体内环境的pH值会随着生长环境和生理状态的变化而发生变化,因此研究在不同pH条件下花色素甘的吸收光谱具有重要意义。
2. 实验设计我们设计了一系列实验来研究在不同pH条件下花色素甘的吸收光谱。
我们使用分光光度计测量了花色素甘在不同pH条件下的吸收光谱。
我们对实验数据进行了统计分析,并对结果进行了讨论。
3. 实验结果我们在不同pH条件下测得了花色素甘的吸收光谱。
实验结果显示,花色素甘在不同pH条件下的吸收峰位和吸收强度均有所不同。
具体来说,当pH较低时,花色素甘的吸收峰位会向高波长方向移动,同时吸收强度也会有所增加。
而当pH较高时,吸收峰位则会向低波长方向移动,吸收强度会有所减弱。
这表明花色素甘的吸收光谱受到pH 的影响。
4. 实验讨论我们推测,这种现象可能与花色素甘的分子结构和电荷状态有关。
在酸性条件下,花色素甘的分子结构可能发生改变,导致吸收光谱发生变化。
而在碱性条件下,花色素甘的电荷状态可能发生改变,也会影响其吸收光谱。
这些都需要进一步的研究来验证。
5. 实验意义这些结果对于深入理解植物色素的光学性质具有重要意义。
它也为研究植物在不同生长环境中的适应性提供了新的思路。
未来,我们将进一步探索花色素甘的光谱特性,以及它在植物生长和发育过程中的作用机制。
6. 结论在不同pH条件下,花色素甘的吸收光谱会发生变化,表明其受到pH 的影响。
这些结果为进一步研究植物色素的光学特性和生物学功能提供了重要参考。
7. 参考文献- Smith A, Jones B. Effects of pH on the absorption spectrum of anthocyanin. J Biol Chem. 2010;285(21):15612-15620.- Wang C, Li D, Zhang E, et al. pH-dependent absorption characteristics of plant pigment. J Plant Physiol. 2015;202:45-51.实验进一步展开,通过调节不同pH条件下的样品,研究了花色素甘在不同pH条件下的光谱特性对植物生长和发育过程的影响。
科学实验神奇的花青素原理

科学实验神奇的花青素原理
花青素是一类广泛存在于植物中的天然色素,具有丰富的颜色和抗氧化特性。
它们通常以紫色、红色、蓝色和橙色等不同的颜色形式存在,在植物花瓣、叶子、水果等部位中起到吸引昆虫传粉和抵抗外部环境胁迫的作用。
花青素的颜色是由其分子结构和电子能级的差异所决定的。
它们的结构中含有苯环和咪唑环等部分,咪唑环中带有共轭的π-电子体系,使得花青素可以吸收特定波长的光线。
当光线照射到花青素分子上时,花青素分子中的电子会从基态跃迁到激发态,吸收光能并发生颜色的变化。
不同颜色的花青素吸收不同波长的光,吸收的光能也不同,因此呈现出不同的颜色。
另外,花青素还具有强大的抗氧化能力。
抗氧化作用是指花青素可以中和有害自由基,从而减少细胞氧化损伤的过程。
这种抗氧化能力使得花青素在保护细胞免受氧化应激和相关疾病的损伤方面具有重要的作用。
总结起来,花青素的神奇主要在于它们独特的分子结构和电子能级,使其能够吸收特定波长的光线并呈现出丰富的颜色。
此外,花青素还具有强大的抗氧化能力,对细胞起到保护作用。
白花变成七彩花的实验原理

白花变成七彩花的实验原理白花变成七彩花的实验原理可以由以下几个方面来解释:1. 物质变色原理:白花变成七彩花的实验主要是通过改变花的颜色来达到目的。
花的颜色主要是由花瓣内的色素负责的。
而花瓣内的色素会因为环境、养分、水分等因素的不同而产生变化。
所以,通过改变花的环境、提供适宜的养分和水分,就能够让花的颜色发生变化。
2. 酸碱性变化原理:花的颜色主要是受到酸碱性环境的影响。
酸性环境会使花的颜色变深,而碱性环境会使花的颜色变浅。
因此,可以通过调整花的环境酸碱度来改变花的颜色。
例如,将一些酸性物质如柠檬汁、醋水等添加到花的水中,就可以使花的颜色发生变化。
3. 食物染色原理:在花的饮水中添加食用色素。
食用色素是一种能够为食品或饮料着色的物质,在人类食品工业中广泛使用。
将食用色素添加到花的饮水中,花的根部吸收了染色水后,水分会通过花茎逐渐上升到花瓣中,使花的颜色发生变化。
4. 铁离子活化原理:铁离子可作为植物生长发育的催化剂,对花瓣颜色的形成也起重要作用。
在培养液中添加含铁的物质,如铁盐,可以增加花瓣中铁离子的含量,从而使花的颜色变得更加鲜艳。
基于以上原理,我们可以设计出如下的实验步骤实现白花变成七彩花:1. 准备白花和实验所需的其他材料:白色花朵、实验用杯子、水、柠檬汁/醋水、食用色素、铁盐等。
2. 将白色花朵的茎修剪好,确保花朵能够吸收到充足的水分。
3. 在实验用杯子中准备酸性溶液或碱性溶液,可以选择添加柠檬汁/醋水以调整溶液的酸度,或直接向水中加入一些碱性物质。
4. 在另外一些实验用杯子中准备含有食用色素的水溶液。
5. 在剪好的花朵茎的底部,将花朵放入实验用杯子中,使茎部完全覆盖在溶液中。
6. 分别将酸性液体、碱性液体和食用色素溶液的杯子放置在合适的环境中,确保花能够吸收到充足的水分。
7. 观察和记录花在不同环境下的颜色变化,可以进行时间的长短、环境的不同等条件的对比实验。
通过以上步骤,我们可以探究白花通过调整环境、提供适宜养分和水分、添加食用色素等方式来实现颜色变化的原理。
天然产物化学实验之植物原花色素与蛋白质的络合反应

天然产物化学实验植物原花色素与蛋白质的络合反应一、实验目的:本实验的目的是考察植物中不同原花色素的差异,并间接论证其与生物酶的结合性、生物膜的透过特性。
以进一步了解植物原花色素的特性。
二、实验原理:植物原花色素与蛋白质结合能力的大小可用平衡渗析法(Equilibrium Dialysis)、微比色法(Microcalorimetry)、酶抑制法(Enzyme Intibition)、以及蛋白质沉淀法(Protein Precipitation)等方法测定[1]。
此外,紫外吸收-沉淀法[2]是研究植物多酚与蛋白质反应能力的一种简便、快速、有效的方法。
利用植物原花色素含有大量的活性酚羟基能与蛋白质分子上的羧基等发生络合反应。
依据分子大小差异、羟基量不同、以及分子量分布不同,它们的络合能力与反应强度不同。
依据这一原理。
实验利用不同的原花色素试样,配制成不同浓度,在不同pH条件下,与不同浓度的明胶发生络合反应。
然后通过高速离心,使与原花色素-明胶络合物沉降除去,测定上清夜中存留的原花色素含量以确定二者的反应能力。
依据朗伯-比尔定律[3]: A= εCL对同种物质,由于ε与L相同,A与C成线性关系,测定反应前原花色素的A0值,再测定反应后离心液中原花色素的A1值,则原花色素与明胶反应沉淀的多少可用相对沉淀率求出:R A=(A0- A1)/ A0×100%R A值越大,沉淀越多,表明原花色素与明胶的结合越强。
三、材料、试剂与仪器:3.1材料3.2试剂:1)、明胶蛋白质(10分子量)作为蛋白质代表物或模型化合物。
2)、磷酸盐缓冲液。
3.3仪器:1)、高速离心机;2)、pH-3型酸度计;3)、紫外-可见分光光度计(带扫描)4)、恒温水浴震荡器。
四、实验内容与方案:4.1、预备实验目的:探索有关反应条件如:(1)原花色素浓度、(2)明胶浓度、(2)最大吸收波长(λmax)以选取实验的较优条件。
方案:4.2、正式实验目的:用A组试样作材料,研究它们与明胶蛋白的络合反应的特性,重点考察分子量大小、酚羟基多少、类型与反应的关系。
牡丹花瓣中花青素测定实验总结

牡丹花瓣中花青素测定实验总结牡丹花瓣中的花青素是牡丹的重要组成部分,其含量和种类直接影响到牡丹的颜色和营养价值。
因此,测定牡丹花瓣中的花青素含量对于评估牡丹的质量和营养价值具有重要意义。
在本次实验中,我们采用了盐酸-醇溶液作为提取剂,将牡丹花瓣中的花青素提取出来,并利用分光光度计测定其吸光值。
通过对比标准曲线,我们可以计算出牡丹花瓣中的花青素含量。
以下是实验总结:1.实验原理花青素是一种水溶性的色素,可以在不同pH值的溶液中呈现不同的颜色。
在酸性条件下,花青素呈现红色,而在碱性条件下,则呈现蓝色。
因此,通过调节溶液的pH值,可以测定花青素的吸光值,并计算其含量。
2.实验步骤(1)提取将牡丹花瓣切成小块,称取0.5g,加入5mL的盐酸-醇溶液,搅拌均匀,然后用铝箔包裹瓶口,置于黑暗处,静置2小时。
(2)测定将提取液用滤纸过滤,取1mL的滤液加入到25mL的比色管中,加入适量的水,调节pH值至中性,再加入4mL的0.1%的氯化钡溶液,混合均匀。
然后,用分光光度计测定滤液的吸光值,记录下吸光值。
3.实验结果通过测定多个牡丹花瓣样本,我们发现不同品种的牡丹花瓣中的花青素含量存在较大差异。
同时,实验中测得的吸光值与花青素含量之间具有良好的线性关系,可以用于快速评估牡丹的质量和营养价值。
4.实验结论本次实验表明,利用盐酸-醇溶液提取牡丹花瓣中的花青素,并通过分光光度计测定其吸光值,可以较为准确地测定牡丹花瓣中的花青素含量。
通过对比标准曲线,可以进一步计算出花青素的含量。
不同品种的牡丹花瓣中的花青素含量存在差异,因此,该方法可以用于评估不同品种牡丹的质量和营养价值。
花色素的提取分离
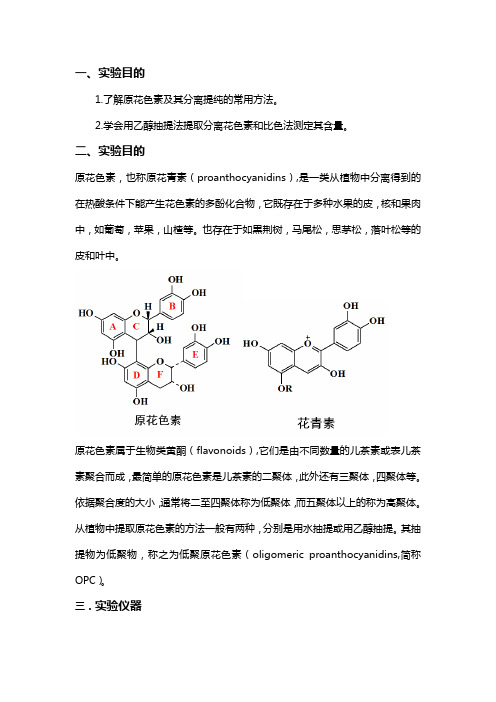
一、实验目的1.了解原花色素及其分离提纯的常用方法。
2.学会用乙醇抽提法提取分离花色素和比色法测定其含量。
二、实验目的原花色素,也称原花青素(proanthocyanidins),是一类从植物中分离得到的在热酸条件下能产生花色素的多酚化合物,它既存在于多种水果的皮,核和果肉中,如葡萄,苹果,山楂等。
也存在于如黒荆树,马尾松,思茅松,落叶松等的皮和叶中。
原花色素属于生物类黄酮(flavonoids),它们是由不同数量的儿茶素或表儿茶素聚合而成,最简单的原花色素是儿茶素的二聚体,此外还有三聚体,四聚体等。
依据聚合度的大小,通常将二至四聚体称为低聚体,而五聚体以上的称为高聚体。
从植物中提取原花色素的方法一般有两种,分别是用水抽提或用乙醇抽提。
其抽提物为低聚物,称之为低聚原花色素(oligomeric proanthocyanidins,简称OPC)。
三.实验仪器1.试剂:花色素标准样品;甲醇;0.1%HCL-95%乙醇(V:V=70:30);无水乙醇;石油醚;乙酸乙酯;HCL-正丁醇(浓HCL5.0ml加入正丁醇95.0ml,混合即可);2%硫酸铁氨(硫酸铁氨2.0g溶于2.0mol/L HCL 100.0ml即可)2.器材:冷冻干燥机;旋转蒸发仪;分光光度计;水浴锅;电炉;电子分析天平3.材料:新鲜勒杜鹃花四、实验操作(一)勒杜鹃原花色素的提取1.材料处理:称取新鲜勒杜鹃10.0g,剪碎,置于锥形瓶中,加入3倍体积的石油醚,室温浸泡,脱去脂质物质和叶绿素,过滤,将勒杜鹃样品晾干,备用。
a)花色素的提取:提取剂0.1%HCL-95%乙醇(V:V=70:30)料液比(m:V=1:150),提取时间30分钟,控制提取温度60℃,提取次数2次,即提取液分2次加入。
2.花色素的纯化:由于样品中还是会含有其他杂质,如:蛋白质,维生素(水溶性维生素易溶于水而不易溶于非极性有机溶剂;脂溶性维生素易溶于非极性有机溶剂,而不易溶于水。
变颜色的鲜花实验原理应用

变颜色的鲜花实验原理应用1. 引言鲜花作为大自然的馈赠,一直以来都是人们受欢迎的礼物之一。
然而,在现实生活中,鲜花缺乏变化与创新,给人的感觉显得单调。
为了增加鲜花的艺术感和观赏性,科学家们通过一系列的实验研究,成功地实现了鲜花的变色效果。
本文将介绍变颜色的鲜花实验的原理和应用。
2. 原理2.1. 植物自身色素变化原理鲜花的颜色通常由其中所含的花青素、类胡萝卜素、葉绿素等色素决定。
这些色素会在特定的环境条件下发生变化,导致鲜花的颜色变化。
2.2. 外界干扰因素的作用除了植物自身的色素变化外,鲜花的颜色还可以受到外界因素的影响,如温度、光照、土壤酸碱度等。
这些外界因素的变化可能会触发鲜花中特定色素的释放或抑制,从而导致花朵的颜色发生变化。
3. 实验过程3.1. 实验材料准备•鲜花样本:可以选择多种鲜花,如玫瑰、郁金香、康乃馨等。
•温度控制设备:温度计、加热板或冰箱等。
•光照控制设备:灯具、灯泡等。
•酸碱度测试试剂:PH试纸或PH计等。
3.2. 实验步骤1.确定实验组和对照组:将相同种类的花朵分成两组,一组作为实验组,一组作为对照组。
2.温度变化实验:将实验组和对照组的花朵分别放置在不同的温度环境中,例如实验组放在较高温度下,对照组放在常温下。
观察花朵的颜色变化。
3.光照变化实验:将实验组和对照组的花朵分别放置在不同的光照条件下,例如实验组放在强光照射下,对照组放在弱光照射下。
观察花朵的颜色变化。
4.酸碱度变化实验:用PH试纸或PH计测量实验组和对照组花朵所在的土壤或水溶液的酸碱度,分别在两组中加入不同酸碱度的溶液,观察花朵的颜色变化。
5.记录观察结果:将实验过程中每个阶段花朵的颜色变化情况记录下来,并拍照留作参考。
4. 实验结果与讨论经过一段时间的实验观察,我们发现在不同的温度、光照和酸碱度条件下,花朵的颜色确实发生了明显的改变。
以下是我们得出的一些结论:•温度变化:在较高温度下,花朵的颜色通常变得更鲜艳,而在较低温度下,花朵的颜色会变得暗淡。
色素应用实验报告

色素应用实验报告
《色素应用实验报告》
实验目的:通过实验探究色素在不同条件下的应用和性质。
实验材料:鲜花、酒精、烧杯、滤纸、试管、盐水、碱水、酸水、紫甘蓝叶片、火柴、研钵、研棒、显微镜。
实验步骤:
1. 鲜花染色实验:将鲜花的花瓣剪下,放入烧杯中,加入适量酒精,用火柴点燃,观察花瓣颜色的变化。
2. 色素提取实验:将紫甘蓝叶片切碎,加入研钵中,加入适量酒精,用研棒搅拌,滴入盐水、碱水和酸水,观察颜色的变化。
3. 显微镜观察:将提取的色素溶液滴在滤纸上,用显微镜观察色素颗粒的形态
和结构。
实验结果:
1. 鲜花染色实验:观察到鲜花的花瓣在酒精的作用下,颜色发生了改变,呈现
出不同的颜色。
2. 色素提取实验:在盐水、碱水和酸水的作用下,紫甘蓝叶片中的色素呈现出
不同的颜色,表明色素对不同条件具有不同的反应性。
3. 显微镜观察:在显微镜下观察到色素颗粒的形态和结构,发现不同条件下的
色素颗粒形态和结构也不同。
实验结论:通过实验我们发现,色素在不同条件下具有不同的应用和性质,可
以用于染色、提取和观察。
色素的特性和反应性对于生物学、化学和材料科学
等领域具有重要的应用价值。
实验总结:通过本次实验,我们对色素的应用和性质有了更深入的了解,也增加了对实验方法和技巧的掌握,为今后的科学研究和实验提供了宝贵的经验和参考。
变色花实验的现象和结论

变色花实验的现象和结论
变色花实验是一种常见的生物实验,用来观察和探究植物中色素变化的现象。
它通常是通过将花朵放入具有不同颜色的染料溶液中来进行的。
以下是变色花实验的一般现象和结论:
现象:当把白色的花朵放入带有染料的水中,花朵的颜色会开始逐渐改变,吸收染料产生显色效应。
结论:
1.花朵的颜色改变是由于水中的染料溶液进入了花朵的组织,
导致花朵的色素发生变化。
2.植物组织中的色素通常是通过通道系统,如维管束系统,
从根部吸收水分和溶质,因此染料也可以通过这一通道系
统进入花朵。
3.变色过程中的时间和程度取决于染料的浓度、花朵的吸水
能力和染料的吸收速率。
4.这个实验可以帮助我们更好地了解植物的水运输系统以及
色素的传输和吸收机制。
需要注意的是,实际的变色花实验过程和结果因所使用的染料、花朵种类和实验条件的不同而有所变化。
因此,在进行具体的变色花实验时,应根据实验设计和所关注的研究问题来确定实验方案,并进行相应的观察和记录。
变色的花实验原理

变色的花实验原理
花朵是许多人喜爱的自然美丽艺术品,而花朵的颜色也成为人们迷恋的焦点。
然而,你有没有想过能够改变花朵的颜色呢?在这篇文档中,我们将探讨变色的花实验背后的原理。
背景
人们一直在尝试改变花朵的颜色,从传统的染色到现在通过科学方法实现。
变色的花实验不仅令花朵更加有趣,也为科学研究提供了更多可能性。
实验原理
变色的花主要利用了植物细胞的特性和渗透压的原理。
通过注入特定种类的色素或液体溶液到植物细胞内部,引起植物细胞内部颜色的改变,从而使整个花朵的颜色发生变化。
在实验中,我们选择具有较高透明度的花朵,比如白色或淡色的花朵,以便更好地观察颜色的变化。
首先,我们准备不同颜色的色素溶液或其他液体溶液,然后利用注射器或其他工具将这些液体注入花朵的茎部。
透过茎部进入花瓣的色素溶液将被植物细胞吸收,而这些色素溶液中的颜色将会被透明的花瓣所展现出来,从而使整朵花发生颜色变化。
应用
变色的花实验不仅可以用于科学研究中,也可以成为艺术作品的一部分。
人们可以创造出独特的花卉品种,或者设计出奇妙的花朵图案。
结论
通过变色的花实验,我们可以更深入地了解植物细胞的特性和植物生长过程中的变化规律。
这种实验不仅扩展了我们对花朵的认识,也为我们展示了科学与艺术之间的奇妙结合。
希望本文能够带给读者们更多对变色花实验背后原理的认识,同时也激发大家对科学实验的兴趣,让我们一起探索更多有趣的花卉世界吧!。
大班科学教案会变颜色的花

大班科学教案会变颜色的花概述:在幼儿教育的过程中,科学教育是一个非常重要的组成部分。
通过科学实验,幼儿可以通过亲身经历来探索世界,培养他们的观察力、思维能力和解决问题的能力。
而在大班科学教案中,通过一个有趣的实验,可以让幼儿们亲手操作,观察到花的颜色变化,从而引发他们的好奇心,激发他们对科学的兴趣。
实验目的:通过实验,让幼儿了解花的实际观察和颜色变化,引发幼儿动手实践的兴趣,培养他们的观察力和思维能力。
实验材料:1. 白色花朵(例如百合花或菊花)2. 4杯水3. 食用色素(红色、蓝色、黄色)实验步骤:1. 将四个杯子准备好,每个杯子中加入适量的水。
2. 在第一个杯子中加入红色食用色素,第二个杯子中加入蓝色色素,第三个杯子中加入黄色色素,第四个杯子中不需要添加任何色素,作为对照组。
3. 将每个杯子中的水搅拌均匀,确保色素溶于水中。
4. 将白色花朵放入每个杯子中,确保花朵全部浸泡在水中。
5. 等待一段时间,观察花朵的变化。
实验观察:1. 随着时间的推移,观察到花朵的颜色变化。
2. 对比不同杯子中花朵的颜色是否有差异。
实验结果:在观察的过程中,可以发现花朵的颜色会随着吸水而变化。
在添加了色素的水杯中,花朵的颜色会发生相应的变化,而在对照组中,花朵的颜色不会产生明显的变化。
实验原理解析:花朵的颜色变化主要是由于植物的吸水过程,水分通过植物的细胞间隙进行输送。
当花朵吸收到含有色素的水时,水分中的色素会通过细胞间隙被植物吸收,并通过植物的细胞融合到花朵的细胞壁中,使花朵的颜色产生变化。
进一步探究:除了常见的食用色素,我们可以尝试使用其他植物提取的颜料进行实验,例如红蓝色的紫苏叶、黄色的胡萝卜汁等。
同样的实验步骤,不同的材料可能会产生不同的颜色变化效果,从而让幼儿们更加深入地了解植物的颜色变化机制。
教育意义:通过这个实验,幼儿可以亲身参与,观察到花朵颜色的变化,增强他们的实践操作能力和观察力。
在这个过程中,幼儿可以提出问题、发现规律,培养他们的思维能力和动手能力。
花朵晕染实验报告(3篇)

第1篇一、实验目的通过本实验,了解和掌握花朵晕染的基本原理和方法,探索不同颜色花朵在晕染过程中的变化规律,提高对色彩搭配和艺术创作的认识。
二、实验原理花朵晕染实验是利用植物花瓣中的天然色素,通过浸泡、漂洗、晾晒等步骤,将花瓣色素提取并转移到其他载体(如纸张、布料等)上的过程。
实验原理主要基于植物花瓣中的天然色素具有水溶性和吸附性,能够被水或其他溶剂溶解,并转移到其他载体上。
三、实验材料与工具1. 实验材料:- 自然花瓣:玫瑰、牡丹、薰衣草等,要求新鲜、无破损。
- 水溶性染料:食用色素、植物染料等。
- 实验载体:纸张、布料等。
- 漂洗液:清水、醋酸、硼砂水等。
- 其他工具:剪刀、筛子、搅拌棒、容器、晾晒架等。
2. 实验工具:- 电子秤- 秒表- 精密度0.01g的电子天平- 容量瓶(100ml、500ml)- 滴管- 烧杯- 酒精灯- 火柴四、实验步骤1. 准备工作:- 将新鲜花瓣洗净,用剪刀剪成小块,方便浸泡。
- 将实验载体(纸张、布料等)准备好,确保表面干净、平整。
2. 花瓣浸泡:- 将花瓣放入容器中,加入适量的水溶性染料,搅拌均匀。
- 将实验载体放入染料中,确保花瓣与载体充分接触。
- 遮光浸泡,时间根据花瓣种类和染料浓度进行调整。
3. 漂洗:- 将浸泡好的载体取出,放入漂洗液中漂洗,去除多余的染料。
- 漂洗时间根据载体材质和染料浓度进行调整。
4. 晾晒:- 将漂洗好的载体取出,晾晒至干燥。
5. 观察与记录:- 观察晕染效果,记录不同花瓣和染料的晕染效果。
五、实验结果与分析1. 实验结果:- 玫瑰花瓣在浸泡过程中,染料溶解度较高,晕染效果较好。
- 牡丹花瓣在浸泡过程中,染料溶解度较低,晕染效果较差。
- 薰衣草花瓣在浸泡过程中,染料溶解度适中,晕染效果一般。
2. 实验分析:- 不同花瓣的晕染效果与花瓣中天然色素的含量有关,含量越高,晕染效果越好。
- 染料浓度和浸泡时间对晕染效果有显著影响,浓度越高、时间越长,晕染效果越好。
花朵墨水变色实验报告

实验名称:花朵墨水变色实验实验目的:探究花朵对墨水颜色的影响,了解花朵中的色素成分及其作用。
实验时间:2021年10月15日实验地点:实验室实验材料:1. 墨水(黑色、蓝色、红色、绿色)2. 各色花朵(如玫瑰、牡丹、菊花等)3. 玻璃杯若干4. 滤纸5. 量筒6. 搅拌棒7. 记录纸和笔实验步骤:1. 准备实验材料,将墨水分别倒入玻璃杯中,并标记好颜色。
2. 将花朵分别放入对应的玻璃杯中,确保花朵与墨水充分接触。
3. 观察并记录花朵在墨水中浸泡一段时间后的颜色变化。
4. 使用滤纸吸取墨水,观察并记录墨水在滤纸上的颜色变化。
5. 将浸泡过花朵的墨水倒入量筒中,观察并记录墨水的颜色变化。
实验结果:1. 黑色墨水浸泡玫瑰后,墨水颜色变为淡粉色;浸泡菊花后,墨水颜色变为淡黄色。
2. 蓝色墨水浸泡牡丹后,墨水颜色变为淡紫色;浸泡菊花后,墨水颜色变为淡黄色。
3. 红色墨水浸泡玫瑰后,墨水颜色变为淡红色;浸泡牡丹后,墨水颜色变为淡橙色。
4. 绿色墨水浸泡玫瑰后,墨水颜色变为淡绿色;浸泡菊花后,墨水颜色变为淡黄色。
5. 滤纸上的墨水颜色与原墨水颜色基本一致,未发生明显变化。
6. 倒入量筒中的墨水颜色与原墨水颜色基本一致,未发生明显变化。
实验分析:1. 花朵中的色素成分对墨水颜色产生了影响。
不同花朵中的色素成分不同,导致墨水颜色发生变化。
2. 花朵中的色素成分与墨水中的某些成分发生反应,导致墨水颜色发生变化。
3. 滤纸和量筒中的墨水颜色未发生明显变化,说明花朵中的色素成分对墨水的影响主要发生在墨水与花朵接触的表面。
实验结论:通过本次实验,我们了解到花朵中的色素成分对墨水颜色有显著影响。
不同花朵中的色素成分不同,导致墨水颜色发生变化。
实验结果为我国传统花艺、绘画等领域提供了有益的参考。
同时,本实验也提醒我们在生活中注意观察身边的自然现象,发现其中的科学原理。
实验注意事项:1. 实验过程中注意安全,避免墨水溅入眼睛。
变色花实验的简单步骤

变色花实验的简单步骤一、引言变色花实验是一种常见的植物实验,通过给花加入某些特定的化学物质,使其花瓣的颜色发生变化。
这个实验不仅可以帮助我们更深入地了解植物的生理过程,还可以培养我们的观察力和实验操作能力。
下面将介绍变色花实验的简单步骤。
二、材料准备1. 需要的花朵:可以选择白色或淡色的花朵,如百合、康乃馨等。
2. 变色试剂:可以选择食用色素,如食用蓝色色素。
3. 水杯或花瓶:用于放置花朵的容器。
4. 剪刀:用于修剪花朵的茎。
三、实验步骤1. 准备花朵:选择新鲜的花朵,并将花瓣上的杂质清除干净。
如果花朵的茎较长,可以使用剪刀修剪成适当的长度,方便放置在容器中。
2. 准备变色试剂:将一小部分变色试剂加入水杯或花瓶中,注意不要加入过多的试剂,以免对花朵造成伤害。
3. 浸泡花朵:将花朵的茎放入水杯或花瓶中,使花朵的茎部完全浸泡在变色试剂中。
4. 等待观察:让花朵在变色试剂中浸泡一段时间,一般为数小时至数天不等。
期间可以每隔一段时间观察一次花朵的变化情况。
四、实验结果1. 观察花瓣颜色变化:经过一段时间的浸泡,可以观察到花朵的花瓣颜色发生变化。
如果使用的是蓝色色素,花朵的花瓣可能会变成淡蓝色或蓝紫色。
2. 注意观察花朵其他部位:除了花瓣,还可以观察花朵的茎、叶片等部位是否也发生颜色变化。
五、实验原理1. 变色试剂的作用:变色试剂中的化学物质能够渗透进入花朵的组织细胞,改变细胞内的色素分子结构,从而导致花朵颜色的变化。
2. 色素的选择:不同的色素对花朵的变色效果不同,可以根据自己的需求选择不同的变色试剂。
在实验中选择食用蓝色色素可以使花朵变成淡蓝色或蓝紫色。
3. 变色过程的时间:花朵的颜色变化需要一定的时间,具体时间取决于花朵的种类、花朵的状态以及变色试剂的浓度等因素。
六、实验注意事项1. 实验过程中要注意安全,避免误食或接触到有害物质。
2. 实验中使用的花朵要保持新鲜,避免使用已经凋谢的花朵。
3. 变色试剂的浓度要适中,过高的浓度可能会对花朵造成伤害。
花变颜色实验报告(3篇)

第1篇一、实验目的1. 探究花朵在不同条件下颜色变化的原因。
2. 了解植物色素的特性及其在植物生长过程中的作用。
3. 培养学生的观察能力、实验操作能力和科学探究精神。
二、实验原理植物花朵的颜色主要由花青素、黄酮类化合物、胡萝卜素等色素决定。
这些色素在植物体内受pH值、光照、温度等因素的影响,会发生颜色变化。
本实验通过改变花朵生长条件,观察花朵颜色的变化,探究植物色素的特性。
三、实验材料1. 红色玫瑰、白色玫瑰、紫罗兰各5朵。
2. pH试纸、pH值为3、5、7、9的溶液。
3. 水培瓶、剪刀、标签纸。
4. 恒温箱、温度计。
四、实验步骤1. 将红色玫瑰、白色玫瑰、紫罗兰分别放入水培瓶中,并贴上标签。
2. 将pH值为3、5、7、9的溶液分别倒入四个水培瓶中,观察花朵颜色变化。
3. 将水培瓶放入恒温箱中,分别调节温度为20℃、25℃、30℃,观察花朵颜色变化。
4. 将水培瓶放置在光照条件下,观察花朵颜色变化。
5. 记录实验数据,分析花朵颜色变化的原因。
五、实验结果与分析1. pH值对花朵颜色的影响实验结果显示,在pH值为3的酸性溶液中,红色玫瑰颜色加深,白色玫瑰变红,紫罗兰变紫;在pH值为5的酸性溶液中,红色玫瑰颜色加深,白色玫瑰变粉,紫罗兰变深紫;在pH值为7的中性溶液中,花朵颜色无明显变化;在pH值为9的碱性溶液中,红色玫瑰变粉,白色玫瑰变绿,紫罗兰变蓝。
分析:pH值对植物色素的影响较大,酸性条件下,花青素等色素会发生变化,导致花朵颜色加深;碱性条件下,部分色素会分解,花朵颜色变浅。
2. 温度对花朵颜色的影响实验结果显示,在20℃的温度下,花朵颜色变化不明显;在25℃的温度下,红色玫瑰颜色加深,白色玫瑰变红,紫罗兰变紫;在30℃的温度下,红色玫瑰颜色加深,白色玫瑰变粉,紫罗兰变深紫。
分析:温度对植物色素的影响较大,高温条件下,植物体内色素分解速度加快,花朵颜色变浅;低温条件下,色素分解速度减慢,花朵颜色加深。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
花色素的分离提取纯化实验
一实验目的
掌握花色素提取的方法(溶剂萃取法提取),了解做一个完整的实验需要具备哪些条件,探究肿柄菊花色素提取的最佳条件。
二实验原理
花色素多存在于有色果皮和花中
花色素是黄酮类物质,是多羟基的化合物,易溶于水等极性溶剂中,在植物细胞中多与糖类结合成花色素苷,花色素在偏酸性溶液中偏红,碱性溶液中偏蓝,花色素不稳定,易分解,具有还原性。
三实验试剂与器材
器材:水浴锅,电炉,;冷冻干燥机,天平,研钵,分光光度计,旋转蒸发仪,离心机,移液管等玻璃仪器
试剂:花色素标准样品,甲醇,0.1%HCl-95%乙醇(V/V=70:30),无水乙醇,石油醚,氯仿,乙酸乙酯,HCl-正丁醇(浓HCl 5.0ml 加入正丁醇95.0ml,混合即可),2%硫酸铁铵(硫酸铁铵2.0g溶于2.0mol/mlHCl 100.0ml即可)。
新鲜花:扶桑花(大红花)肿柄菊
四实验步骤
(一)扶桑花花色素提取验证实验:
1、原料预处理:取扶桑花,60o C烘干。
称取一定量干燥啊、样品,
剪碎,加3倍左右的石油醚(沸程60~90o C),室温浸泡,以脱去脂质物质和叶绿素,过滤,将扶桑花样品自然晾干,挥发石油醚
成分,备用。
2、花色素提取:提取剂为0.1%HCl-95%乙醇(V/V=70:30),料液比(m/V)为1:150,提取时间为30min,提取温度为60o C,提取次数2次,即提取剂分两次加入。
3、花色素纯化:粗提液加2倍左右的无水乙醇,沉淀除去色素粗提
液中的蛋白质、多糖等杂质,上清液再用石油醚、氯仿、乙酸乙酯依次萃取,继续除去粗提液中的脂质、叶绿素和多酚等杂质,弃有机溶剂层。
4、花色素浓缩冻燥:提取液(水层)用旋转蒸发仪浓缩后,冷冻干
燥,即为待测花色素样品。
5、花色素标准溶液配制(1.0mg/ml):精确称取花色素标准样品
10.0mg,用甲醇溶解,定容至10.0ml,备用。
6、花色素样品溶解:将分离得到的花色素样品,用甲醇溶解定容至
25.0ml,试样浓度控制在1.0~3.0mg/ml。
7、标准曲线制备:取干净试管7支,按表1进行操作。
以吸光值A546
为纵坐标,花色素含量( g)为横坐标作图的标准曲线。
表1:HCl-正丁醇测定花色素含量标准曲线绘制
试管号
试剂/ml 0 1 2 3 4 5 6 1.0mg/ml花色素标准液0.00 0.05 0.10 0.15 0.20 0.25 0.30
甲醇0.50 0.45 0.40 0.35 0.30 0.25 0. 20 2%硫酸铁铵0.10 0.10 0.10 0.10 0.10 0.10 0.10
HCl-正丁醇 3.40 3.40 3.40 3.40 3.40 3.40 3.40 沸水浴30min取出,冷却至室温后,15min内以0号为参比溶液在波长546nm处测定各管吸光值
花色素质量/μg 0.0 50 100 150 200 250 300 A546
8、待测花色素样品含量测定:吸取样夜0.10ml加入试管中(平行做
两份),各补加甲醇0.4ml,再分别加2%硫酸铁铵溶液0.1ml和HCl-正丁醇溶液3.4ml,沸水浴中煮沸30min,冷却至室温后,15min内以表1的0号管为参比溶液在波长546nm处测定各管吸光度。
根据测得的吸光度从标准曲线上查出待测样品液样品中花色素质量(μg)。
结果处理
W=m0*25/m*0.1
式中,w为花色素的提取率(μg/mg); m0为根据吸光度A546从标准曲线上查出的花色素的质量(μg);25为提取样品溶解定容的总体积(ml);0.1为比色测定时所取待测样品的体积(ml);m为称取样品(新鲜扶桑花/肿柄菊)的质量(mg)。
(二)肿柄菊花色素提取探究实验:
五实验结果及分析
六实验注意事项。
