乙酰水杨酸片溶出
阿司匹林肠溶片处方工艺筛选及实时释放度相似性考察

阿司匹林肠溶片处方工艺筛选及实时释放度相似性考察摘要】本文以阿司匹林肠溶片的溶出度/释放度为评价指标,优化片芯处方和工艺。
参照原研制剂,评价自制阿司匹林肠溶片实时释放度的相似性。
采用优化的工艺制备自制片在不同pH的溶出介质中溶出曲线与参比制剂相似。
【关键词】阿司匹林肠溶片处方工艺溶出曲线[ 中图分类号 ]R2[ 文献标号 ]A[ 文章编号 ]2095-7165(2018)19-0385-02阿司匹林(Aspirin,乙酰水杨酸) 作为医药史上三大经典药物之一,具有解热镇痛、抗炎抗风湿、抑制血小板聚集等作用。
阿司匹林肠溶片目前是心内科常用药物,用于心血管系统疾病的预防,降低心肌梗死、卒中的发病及死亡的风险[1]。
国内阿司匹林肠溶片有319个批文,目前仍没有仿制药一致性评价的申报申请。
而国内大部分阿司匹林肠溶片与参比制剂在释放度行为上存在差异[2]。
本次研究以上市的原研制剂为参比,选择实时释放度评价阿司匹林肠溶片释放曲线的相似性,筛选处方工艺,为仿制药一致性评价的研究提供重要依据。
1仪器与试药Rimek MiNi PRESS-II SF 压片机;O’HARA LABCOAT M 包衣机;Agilent Technologies 708DS Dissolution Apparatus/850-DS Dissolution Sampling Station/Cary60 UV-Vis 紫外联机溶出仪;FE20实验室pH计(梅特勒-托利多仪器(上海)有限公司);阿司匹林(山东新华制药股份有限公司);淀粉(辽宁东源药业有限公司);微晶纤维素(DFE Pharma);滑石粉(上海卡乐康包衣技术有限公司);肠溶包衣粉494O690008(上海卡乐康包衣技术有限公司);市售阿司匹林肠溶片(Bayer HealthCare Manufacturing S.r.l.,批号:BJ24849和BJ29231,规格:100mg,简称原研);自制阿司匹林肠溶片(批号:CC0907,规格:100mg,简称自制片);盐酸、磷酸钠、磷酸二氢钾(上海凌峰化学试剂有限公司,分析纯);氢氧化钠(国药集团化学试剂有限公司,分析纯)。
改善乙酰水杨酸片溶出度的研究

改善乙酰水杨酸片溶出度的研究
石强
【期刊名称】《西北药学杂志》
【年(卷),期】1994(000)004
【摘要】采用干法制粒制备乙酰水杨酸片,分别加入低取代-羟丙基纤维素(L5-HPC)、羧甲基淀粉钠(CMS-Na)及干淀粉作崩解剂^[^1^],以改善溶出度。
实验表明,内加CMS-Na及干淀粉,干法制粒压片,能够明显改善乙酰水杨酸片的溶出度。
【总页数】1页(P170)
【作者】石强
【作者单位】不详;不详
【正文语种】中文
【中图分类】R944.4
【相关文献】
1.改善氧氟沙星片溶出度的组方探讨 [J], 向延树
2.改善扑热息痛片崩解时限和溶出度的研究 [J], 王小明;赵满琼;李信
3.辅料泊洛沙姆在改善灰黄霉素片的溶出度中的应用 [J], 王子龙;王小兵
4.左炔诺孕酮片溶出度测定方法的建立及上市片溶出度的对比研究 [J], 李慧慧;余春梅;陈兰;陈仲祥
5.优化工艺处方,改善扑尔敏片溶出度质量 [J], 杜金芝
因版权原因,仅展示原文概要,查看原文内容请购买。
乙酰水杨酸片溶出

药剂学实验课
乙酰水杨酸片溶出度的测定
药剂学实验课
实验目的
• 掌握片剂溶出度的测定方法及其意义
药剂学实验课
理原验实
1.溶出度:药物从片剂等固体制剂中溶 出的速度和程度。 2.测定方法:① 转篮法 ② 浆法 ③ 小杯法
药剂学实验课
溶 出 过 程
实验原理
一般药物的溶出速度主要受扩散的影响。 溶解度小于0.1-1%的药物,药物的溶出是其 吸收的限制过程。
药剂学实验课
实验原理
崩解时限与体内的吸收并不都存在着平衡关系。 了解机体吸收的可靠方法是对该制品进行活体的 生物利用度测定,但测定血药浓度,尿药排泄速 率及其代谢物等方法比较复杂,代价太高,有实 际困难。实验证明,很多药物的体外溶出与吸收 有相关性,因此溶出度测定法作为反映或模拟体 内吸收情况的试验方法,在评定质量上有着重要 意义。
药剂学实验课
实验原理
片剂中还有些药物除规定有崩解时限外, 还要进行溶出度测定,发生相互作用的药物
③久贮后溶解度降低的药物
④剂量小、药效强、副作用大的药物片剂
药剂学实验课
溶出速率测定:
实验内容
1.配制人工胃液:
1000 ml蒸馏水+浓盐酸,调PH值至1.2~1.7.(约需要浓盐酸10ml) 2.放入大烧杯中,在水浴中加热至37±1℃,在操作中维持此温度。 3.放入已精密称定的片剂1片,开始运转计时。 4.按2′、4′、6′、10′、20′、30′、40′、50′定量取样,每次取样5ml,
药剂学实验4(片剂与溶出度)

实验12 片剂的制备一、实验目的1.初步掌握湿法制粒压片的过程和技术。
2.了解单冲压片机的调试,能正确使用单冲压片机。
3.会分析片剂处方的组成和各种辅料在压片过程中的作用。
4.掌握片剂的质量检查方法。
二、实验指导片剂系指药物与适宜的辅料均匀混合,通过制剂技术压制而成片状的固体制剂。
片剂由药物和辅料二部分组成。
辅料是指片剂中除主药外一切物质的总称,亦称赋形剂,为非治疗性物质。
加入辅料的目的是使药物在制备过程中具有良好的流动性和可压性;有一定的黏结性;遇体液能迅速崩解、溶解、吸收而产生疗效。
辅料应为“惰性物质”,性质稳定,不与主药发生反应,无生理活性,不影响主药的含量测定,对药物的溶出和吸收无不良影响。
但是,实际上完全惰性的辅料很少,辅料对片剂的性质甚至药效有时可产生很大的影响,因此,要重视辅料的选择。
片剂中常用的辅料包括填充剂、润湿剂、黏合剂、崩解剂及润滑剂等。
通常片剂的制备包括制粒压片法和直接压片法二种,前者根据制颗粒方法不同,又可分为湿法制粒压片和干法制粒压片,其中湿法制粒压片较为常用。
湿法制粒压片适用于对湿热稳定的药物。
其一般工艺流程如下:三、实验内容(一)片剂成品的制备1.阿咖酚片的制备[处方] 每片用量(g)制100片乙酰水杨酸 0.230咖啡因 0.030对乙酰氨基酚 0.126淀粉 0.03g10%PVP乙醇溶液适量滑石粉 0.01g[制法]混合――制软材――制粒――干燥――整粒――压片取乙酰水杨酸、咖啡因、对乙酰氨基酚混合均匀,加入10%PVP乙醇溶液拌和制成软材,将软材通过20-24目筛制湿颗粒,湿颗粒于60-700C烘干30分钟,得到干颗粒通过24-28目筛整粒,然后加入淀粉、滑石粉混合均匀,压片。
[附注](1)粘合剂用量要适当,使软材达到以手握之可成团,手指轻压又能分裂但不成粉状为度,即“团而不粘,裂而不散”。
湿颗粒以无长条、块状和细粉为宜。
(2)本品采用湿法制粒,但乙酰水杨酸易水解,所以采用PVP乙醇溶液,防止主药水解。
新水杨酸溶出度标准片的标定与评价

新水杨酸溶出度标准片的标定与评价目的对新水杨酸溶出度标准片A样和B样进行标定和评价。
方法分别采用篮法、桨法、小杯法对标准片进行溶出度试验,以紫外分光光度法对水杨酸的浓度进行测定。
结果A样与B样的平均溶出度为26.81%、24.21%(篮法);28.95%、26.56%(桨法);22.50%、20.33%(小杯法)。
A样与B样的RSD为1.1%、1.2%(篮法);1.3%、2.1%(桨法);3.7%、3.9%(小杯法)。
结论两种水杨酸片均可作为标准片使用。
标签:标准片;溶出度;评价溶出度标准片是用来检定溶出度仪是否良好和实验操作是否规范的依据,即在规定的条件下,测定标准片的溶出度,并与标准片说明书中规定的溶出范围进行比较,确定溶出仪的性能指标是否符合药典要求。
水杨酸片属于非崩解型标准片,一方面要求片子间的性能差异要小,另一方面又要求针对溶出条件的改变有一定的灵敏度,从而真正达到校正的目的。
本文将中国食品药品检定研究院提供的水杨酸溶出度校正A样和B样分别采用篮法、桨法、小杯法测定,并改变了部分溶出条件,对其进行再次测定,从而达到了标定和评价的目的。
1 仪器与样品1.1 仪器溶出仪:天津大学无线电厂ZRS-8G智能溶出试验仪,紫外分光光度计:美国PE公司Lambda35UV/VIS分光光度计,天平:瑞士Mettler Toledo公司XS205电子天平,针筒式微孔滤膜过滤器(水系0.8 μm)[1]。
1.2 样品水杨酸溶出度标准片(批号100103-200610,规格300 mg),水杨酸对照品(批号:100106-200404,含量100%),水杨酸溶出度校正A样(规格300 mg),水杨酸溶出度校正B样(规格300 mg)均由中国食品药品检定研究院提供。
2 方法与结果2.1 溶出方法2.1.1 篮法,桨法溶剂:磷酸盐缓冲液(pH=7.4,取磷酸二氢钾6.80 g,加氢氧化钠1.58 g,先用尽量少的水溶解,加煮沸并冷却至约41℃的水稀释至1000 ml,即得),体积900 ml,温度(37.0±0.5)℃,取样时间30 min,转速100 r/min。
乙酰水杨酸片的制备

年易学老难成.一寸光阴不可轻-百度文库乙酰水杨酸片的制备一、实验目的掌握湿法制粒压片的一般工艺、单冲压片机的使用方法及片剂质量的检查方法。
通过本实验,使学生对工业药剂学、药物分析课程的知识进一步加深理解,达到温故知新,提高学生动手能力的目的。
二、实验要求要求学生认真预习实验讲义;复习片剂常用的辅料、片剂的制备工艺与常用设备、片剂生产的洁净度要求、片剂成品质量检查的标准与方法等内容;掌握压片机、片剂四用仪等的使用方法;认真记录原始数据;填写实验报告,包括试验目的、实验原理、实验内容(仪器与试剂、方法与步骤)、实验结果与讨论、思考题等内容。
三、实验原理片剂是应用最广泛的剂型之一,压片的工艺流程中各工序都直接影响片剂的质量。
1、优点:剂量准确、质量稳定、服用方便、成本低。
2、制片的方法:制颗粒压片、结晶直接压片、粉末直接压片等。
3、制颗粒的方法:干法和湿法。
湿法制料压片的工艺流程:主药+辅料(填充剂或吸收剂、崩解剂)混合均匀'混合粉料湿润剂或粘合剂软材过筛.湿颗粒干燥.干颗粒整粒打润滑剂、崩解剂.压片原、辅料均应符合有关标准。
必要时,原、辅料应经粉碎、过筛,以利于混合均匀,并利于难溶性药物的溶出。
处方中个组分用量差异大,应采用递加稀释法或溶剂分散法以保证混合均匀。
颗粒的制造是制片的关键。
在湿法制粒压片工艺中,欲制好颗粒,首先必须根据主药的性质选好粘合剂或润湿剂,制软材时要控制粘合剂或润湿剂的用量,使之“握之成团,轻压即散”,并握后掌上不沾粉为度。
过筛制得的颗粒一般要求较完整,可有一部分小颗粒。
如果颗粒中含细粉过多,说明粘合剂用量太少,若呈现条状,则说明粘合剂用量太多这两种情况制出的颗粒烘干后,往往出现太松或太硬,都不能符合压片的颗粒要求,从而不能制好片剂。
颗粒大小根据片剂大小由筛网孔径来控制,一般大片(0.3〜0.5g)选用14〜16目筛,小片(0.3g以下)选用18〜20目筛制粒。
颗粒一般宜细而圆整。
乙酰水杨酸片的制备

实训步骤: 一、乙酰水杨酸片的制备
1、处方:
乙酰水杨酸 淀粉 糊精 糖粉 10%淀粉浆 滑石粉 20g (主药) 280g (填充剂) 80g (填充剂) 40g (填充剂) 适量 (粘合剂) 5g (润滑剂)
校内实训
----乙酰水杨酸片的制备
2、制法:
取20g淀粉制成10%淀粉浆 200ml;取乙酰水杨酸细粉与淀粉、糊精、 糖粉(用等量递加法)于研钵中研磨混合、 混合均匀后,加淀粉浆制软材,通过14目 筛制粒,将湿颗粒于80℃干燥,再通过14 目筛网整粒,整粒后的颗粒与硬脂酸镁混合 均匀后压片。
药物制剂技术 校内实训
实验室 乙酰水杨酸片的制备
实训目的:
1、通过乙酰水杨酸片的制备,掌握湿
法制粒生产片剂的工艺流程。 2、掌握片剂质量的检查方法。 3、考察压力、粘合剂、润滑剂、崩解 剂以及表面活性剂等对片剂质量的影 响。
实训仪器与设备:
压片机 崩解剂 碎脆度仪 硬度仪 溶解仪
脆碎度检查数据结果
主压刻度 项目 克
791 6.5682 6.5079
812 6.5074 6.4633
838 6.5296 6.4877
测量前m1 测量后m2
减失重量%
0.9181%
0.6777%
0.6477%
注:减失重量<1%,合格
实训结果与讨论
1.从所得的数据可知压力越大, 硬度也越大,脆碎度越小 2.片剂的影响因素有哪些 3.片剂制备
硬度检查数据结果
主压刻 度 791 硬度(N) 1 33.1 2 35.8 3 39.3 4 38.0 5 40.7
直径(mm) 9.53
812 硬度(N) 38.9
9.55
阿司匹林片溶出度的测定及结果分析

5 0 % ( ba e y2 0 h r cui l l s ,2 . 8 41 . 2 ( ba e y2 0 h r c l s ,al f es . 3 o ti db 0 5p a n mae t a ca ) 9 6 % - 14 % oti d b 0 5 p a c s n mayca ) I o ls s
典 规定溶 出度 不得小于标示量 的 8 % 。学生 实验 中所制备 的 0 阿 司 林 片 进 行 溶 出度 测 定 , 定 的 的结 果 是 :0 5级 药 物 制 剂 测 20 班 制 备 的 阿 司 匹 林 片 测 得 数 据 为 4 .3 ± .3 ,0 5级 药 学 9 0 % 5 0 % 20 班制 备的阿 司 林 片 测 得 数 据 为 2 . 8 ±1 . 2 , 小 于 9 6% 14% 均 8 % , 照 药 典 的规 定溶 出 度 不 合 格 , 业 生 产 部 门 或 以 后 的 实 0 按 企
8 % , 到 溶 出 度 合 格 的产 品 。 0 得
关 键 词 : 林; 阿司 溶出度 ; 影响因素
The Dis l i n Te t o pi i Ta l t nd t s t s o uto s f As rn b e s a he Re uls Ana y i l ss
MIO J l n A G C eg- u ,G O Ja A u— i ,W N hn jn U in—w iai nvr t , u n nD l6 0 ,C ia C l g f amay D lU iesy Y n a a 7 0 0 hn ) e P i i 1
wa u lfe s q ai d.a d t e a p rn wa d y sud n si a a y i n h s ii sma e b t e t n Ph r c .Th is l to t fa pi n t b eswe e4 0 m e d s ou i n daa o s r a lt r 9. 3% ± i
阿司匹林溶出度实验

• • • •
平均片重W=0.3478g 样品片重Wi=0.4233g A=0.541 溶出量F(t),%=Ai × W × 100
A Wi
• 实验结果:
• 计算求解:Kr=? • 作图求解:m=? T50=? Td=?
四、实验内容
(一)测定比较值A(吸收度) • 取药片20片,精密称定总重量,求得平均片重W。 将药片研细,精密称取相当于平均片重的量,置 1000ml量瓶中,加0.1mol/L盐酸液适量,摇匀, 置37℃水浴加热使溶解完全,冷至室温,加 0.1mol/L盐酸液至刻度,摇匀。量取5ml,过滤, 精密量取滤液1ml置10ml量瓶中,加入1mol/L氢 氧化钠溶液5ml,摇匀,静置30分钟。加蒸馏水 至刻度,摇匀,照分光光度法,于303nm波长处 测定吸收度A值。
(二)样品测定
• 照中国药典溶出度测定第一法,以0.1mol/L盐酸液 1000ml为溶剂,转速为每分钟100转,调整好转篮 和溶出度仪。取精密称定重量的1片药片(Wi), 投入转篮内,将转篮降入溶剂(37℃±5℃)中, 即开始计时,然后按间隔5、10、15、25、30、 45min定时取样(取样位置固定在转篮正中距杯壁 1cm处)。每次取样5ml(并同时补入溶出介质 5ml),将样液滤入试管中,再精密量取1ml滤液 置10ml量瓶中,加入1mol/L氢氧化钠溶液5ml,摇 匀,静置30分钟。加蒸馏水至刻度,摇匀,照分光 光度法,于303nm波长处测定吸收度Ai值。
(三)实验数据处理
• 1、将上述测定值记录入表1,并按下式计算百分 溶出量和残留待容量的对数。
Ai--t时刻样液的吸收度 A--按平均片重配制的样液的吸收度 Wi--溶出样品片重 A*--根据下式计算的吸收度:A*=Wi/W ×A
药物分析:片剂含量均匀度和溶出度的检查

1.含量均匀度(contentuniformity)系指小剂量片剂、膜剂、胶囊剂或注射用无菌粉末等制剂每片(个)含量偏离标示量的程度。
凡检查此项不再检查装量差异。
1)含量均匀度检查所用方法为含量测定方法时检查结果判定除另有规定外,取供试品10片(个),按照各药品项下规定的方法,分别测定每片(个)以标示量为100的相对含量X,求其均值X和标准差S以及标示量预均值之差的绝对值A(A=100-X);如A+1.80S≤15.0,则供试品的含量均匀度符合规定;若A+S>15.0,则不符合规定;若A+1.80S>15.0,且A+S<15.0,则应另取20片(个)进行复试,根据初试结果计算30片(个)的均值X、标准差S和标示量与均值之差的绝对值A;如A+1.45S≤15.0,则供试品的含量均匀度符合规定;若A+1.45S>15.0,则不符合规定。
若该药品项下规定含量均匀度的限度为+_20%或其他百分数,应将上述各式判断式中的15.0改为20.0或其他相应值,但各判断式中的系数不变。
2)含量均匀度检查所有的方法与含量测定方法不同时,且未能从响应值(如吸收度)求出每片(个)含量时检查结果的判定,可取供试品10片(个)照该药品含量均匀度项下规定的方法,分别测定,得仪器测定法的响应值Y(可为吸收度、峰面积等),求其均值Y。
另由含量测定法测得以标示量为100的含量XA,由XA除以响应值的均值Y,得比例系数K(K=XA/Y)。
将上述诸响应值Y与K相乘,求得每片标示量为100的相对百分含量X(X=KY),同上法求得X 和S以及A,计算,判定结果,即得。
2.溶出度检查溶出度(dissolution)系指药物从片剂或胶囊剂等固体制剂在规定溶剂中溶出的速度和程度。
检查此项不检查崩解时限。
评介药物制剂质量的一个内在指标,是一种模拟口服固体制剂在胃肠道中崩解和溶出的体外试验法。
实验一 APC片中阿司匹林溶出速率的测定

实验一APC片中阿司匹林溶出速率的测定一、实验内容及目的:APC片中阿司匹林为弱酸性溶解度较小的药物,本实验采用释放仪来测定APC片剂中阿司匹林(乙酰水杨酸)再人工胃液中的溶出速率。
并将实验所得的数据进行计算绘图,求出溶出速率常数Kr,并从威布尔分布概率纸上,求出T50、Tα、m三个参数。
实验目的:了解片剂溶出速率测定的意义,掌握片剂释放仪的使用。
二、实验仪器、试剂及样品:(一)仪器1、片剂释放仪(转篮式、循环式)2、分析天平3、721型分光光度计4、吸量管、容量瓶、试管、烧杯、漏斗、滤纸、电炉、温度计等(二)试剂:APC片(两个厂家的)、0.5N NaOH溶液、人工胃液(1:100HCl)、0.5N HCl 溶液、5%硝酸铁试液、pH(1-14)试纸三、测定方法:(一)测出平均片重(W)的E值取样品20片精密测定,计算出平均片重(W),将称定的片子研细,再精密称取相当于W的量,置于1000ml容量瓶中,加1:100HCl适量,摇匀,以37℃水浴加热1小时使溶,冷至室温,加1:100HCl至刻度,摇匀,精密吸取5ml,过滤,吸取1ml滤液置10ml容量瓶中,加蒸馏水5ml,用0.5NNaOH溶液调pH 至9-10(约加6滴),置沸水浴煮沸5分钟,放冷,用0.5NHCl调pH至3-5(约加1滴),加5%硝酸铁试液5滴,用蒸馏水加至刻度,摇匀,最后于721型分光光度计波长540nm处测读E值。
(二)溶出实验操作量取1000ml人工胃液(1:100HCl)作为释放介质,加热至37℃(并在操作过程中保持恒温(37±0.5℃)装置好释放仪调节转速150rpm(转篮式)或流量150ml/min(循环式)。
再接入已精密称定的一片药片时,同时开动电机和秒表,然后氨5、10、15、20、30、40、60分钟定时取样(取样位置应固定距杯壁1cm 处),取样可直接通过滤器吸取(即在吸量管下系一尼龙袋),每次取样1ml ,同时补入释放介质(人工胃液)1ml 。
水杨酸片溶出度测定能力验证的结果分析

全国31个 省 (市)、自 治 区 共 40 家 实 验 室 报 名参加本次 能 力 验 证 计 划,40 家 实 验 室 反 馈 了 结 果。其 中, 中 检 院 2 个 实 验 室 (占 5.0%), 省 (市 )、 自 治 区 (食 品 ) 药 品 检 验 所 31 家 (占 77.5%),武警药检所1 家 (占 2.5%), 市 级 (食 品) 药品检验所6家 (占 15.0%), 实 验 室 所 在 地 区 分 布 见 表 1。
本次能力 验 证 方 法 为 参 照 《中 国 药 典 》2010 年版二部附录 ⅩC 溶 出 度 测 定 法 中 所 涉 及 的 篮 法、 桨法和小杯法3种方法进行,因此,除药物溶出仪 的各项机械性能应符合药典附录要求外,在进行样 品测定前还应用溶出度标准片对仪器进行性能确认 试验,按照标准片的说明书操作,试验结果应符合 标准片的规定。 1.4 统 计 方 法
参照 CNAS-GL02:能力验 证 结 果 的 统 计 处 理 和 能 力 评 价 指 南 并 [3] 结 合 药 物 溶 出 度 测 定 的 特 点, 采用 EXCEL 分别对篮法、桨法和小杯法溶 出 度 测 定能力验证结果进行了结果总数、剔除离群值后结 果的平均值、平均值 ±3 标 准 偏 差 (SD)、 最 大 值 (Max)、最 小 值 (Min)、 极 值 (Max "Min)、 相 对标准偏差 (RSD) 进行了统计分析。 1.5 结 果 判 定 标 准
乙酰水杨酸片剂及胶囊剂的制备及其溶出度的测定 2

xxx 大学生命与环境科学学院药剂学实验报告2014年6月15日乙酰水杨酸片剂及胶囊剂的制备及其溶出度的测定Preparation and Dissolution Rate Determination of Acetyl Salicylic Acid ’s Tablet and Capsule乙酰水杨酸片剂及胶囊剂的制备及其溶出度的测定Xxx(xxx大学生命与环境科学学院,北京,100081)摘要:目的制备乙酰水杨酸的片剂及胶囊剂,并测定两种乙酰水杨酸剂型溶出度。
方法:《中国药典》2005年版中溶出度测定的基本操作和数据处理方法,用紫外分光光度仪在303nm下测定不同时间溶出度。
结果:乙酰水杨酸的片剂溶出度大于其胶囊剂。
关键词:乙酰水杨酸;片剂;胶囊剂;溶出度Preparation and Dissolution Rate Determinationof Acetyl Salicylic Acid’s Tablet and Capsulexxx(College of Life and Environmental Science, xxx, Beijing, 100081)Abstract:Objective: To prepare the Acetyl Salicylic Acid’s tablet and capsule, and determine their dissolution rate. Method: Dissolution rate was determined according to Pharmaeopoeia of China (2005) by testing the light absorption value (A) spectrophotometrically at 530 nm. Result: the Acetyl Salicylic Acid tablet’s dissolution rateis more than that of capsule. Conclusion: provide the scientifical data for choosing the form of Acetyl Salicylic Acid.Keywords: Acetyl salicylic acid;tablet and capsule;dissolution rate前言【研究背景】药物的有效性,不仅取决于药物的有效成分及药物的化学结构,口服固体制剂的溶出度也是影响人体生物利用度的一个重要因素,两者有着明显的相关性,特别是难溶性药物,如乙酰水杨酸,由于颗粒大小或加入赋型剂不同,尽管口服剂量相同,疗效却存在很大差异。
水杨酸溶出度标准片(校正片)说明书

水杨酸溶出度标准片(校正片)说明书一、产品概述水杨酸溶出度标准片(校正片)是用于测定药物中水杨酸溶出度的标准样品。
该产品具有准确的水杨酸溶出度,可用于药物制剂质量控制和药物溶出度测试仪器的校正。
本说明书将详细介绍水杨酸溶出度标准片的使用方法和注意事项。
二、产品规格1. 外形:圆片状2. 直径:10 mm3. 厚度:2 mm4. 片重:约5 g5. 溶出度:每片含水杨酸约100 mg ± 5%三、使用方法1. 准备工作:a. 检查包装是否完好,确认标准片未损坏。
b. 确保药物溶出度测试仪器已校准,并符合相关要求。
2. 实验操作:a. 将水杨酸溶出度标准片放入溶液中,确保片面与溶液完全接触。
b. 将溶液温度控制在37℃±0.5℃,并保持恒定。
c. 按照相关标准测试方法,测定水杨酸的溶出度。
3. 结果计算:a. 测定水杨酸的溶出度后,使用相关计算公式计算溶出度百分比。
b. 比较实际测得的溶出度与水杨酸溶出度标准值的百分比偏差,评估药物制剂的质量控制是否合格。
四、注意事项1. 使用前请检查水杨酸溶出度标准片是否完好,如有损坏请勿使用。
2. 建议使用前先测定水杨酸溶出度标准片的初始溶出度,确定其符合相关要求。
3. 在实验操作中,请确保标准片与溶液的充分接触,避免气泡产生。
4. 在测定水杨酸溶出度时,应按照规定的温度和时间进行实验,确保结果的准确性和可比性。
5. 存放水杨酸溶出度标准片时,请避免阳光直射和高温环境,确保产品质量不受损害。
五、产品包装和储存1. 包装:水杨酸溶出度标准片采用密封包装,每包含1片。
2. 储存条件:储存在干燥、阴凉处,避免高温和阳光直射。
六、售后服务与技术支持如果对本产品的使用方法或其他方面有任何疑问,敬请联系我们的售后服务部门。
我们将竭诚为您提供解答和支持。
七、免责声明本说明书仅供参考,使用者需按照相关法规和规定,结合实际情况进行操作。
对于因使用不当或未能遵循指示造成的任何损失,本公司概不负责。
水杨酸片溶出度测定篮法

水杨酸片溶出度测定篮法水杨酸片溶出度测定篮法是一种常用于药物质量控制的重要方法。
下面将详细介绍该方法的操作步骤,以及一些需要注意的实验技巧。
首先,准备实验所需材料和仪器。
我们需要水杨酸片样品、溶出度测定篮、适量的溶剂、恒温槽、磁力搅拌器和紫外可见分光光度计。
然后,取一定数量的水杨酸片样品,称重并将其放入溶出度测定篮中。
注意,所取样品的数量应当与实际服用剂量相匹配,以确保测试结果的可靠性。
接下来,将溶出度测定篮放入预先加热至37℃的恒温槽中,并加入适量的溶剂。
溶剂的选择需根据水杨酸片所需的理化特性和药物溶出度条件而定,常见的溶剂有磷酸氢二钠溶液、仿生介质等。
然后,开启恒温槽并设置合适的搅拌速度,通常为100 rpm。
在放置恒温槽中一定时间后,取出溶出度测定篮,并将篮内溶剂进行混合均匀。
接下来,用紫外可见分光光度计检测溶液中水杨酸的浓度。
通过比较不同时间点的测定结果,就可以获得水杨酸片的溶出度,并绘制出溶出曲线。
在进行水杨酸片溶出度测定篮法实验时,需要注意以下几点。
首先,确保使用的仪器和材料完好无损,并且事先进行必要的校准操作,以保证结果的准确性。
其次,恒温槽的温度应稳定在37℃,并且固定搅拌速度不变。
此外,测定的时间点应选择合适,以便获取准确的溶出度数据。
水杨酸片溶出度测定篮法是一种成熟、可靠的测定方法,广泛应用于药物质量检测和研发领域。
通过该方法可以评估药物的溶出速率和溶出度特性,为制定合理的药品质量标准提供参考。
同时,该方法也为药物设计与开发提供了重要的信息。
总之,水杨酸片溶出度测定篮法是一种简单实用、全面可靠的药物质量控制方法。
在进行实验时需要注意操作规范,确保仪器和材料的质量以及实验条件的准确性。
这一方法为药物行业的研发和质量控制提供了重要的技术支持。
片剂的制备及影响片剂质量因素的考察
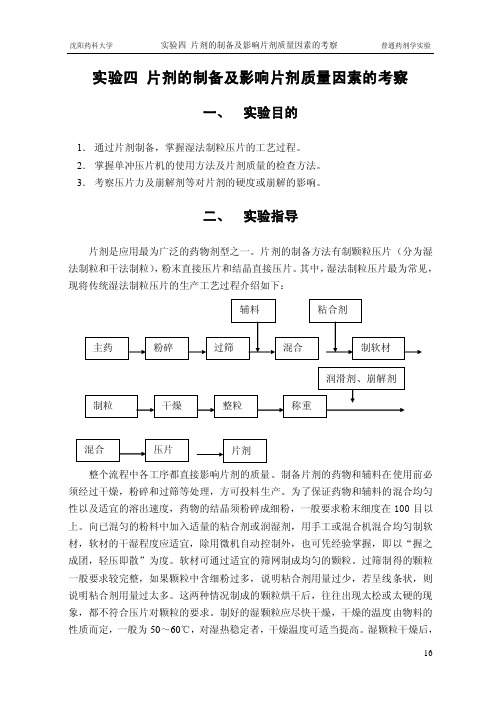
实验四片剂的制备及影响片剂质量因素的考察一、实验目的1.通过片剂制备,掌握湿法制粒压片的工艺过程。
2.掌握单冲压片机的使用方法及片剂质量的检查方法。
3.考察压片力及崩解剂等对片剂的硬度或崩解的影响。
二、实验指导片剂是应用最为广泛的药物剂型之一。
片剂的制备方法有制颗粒压片(分为湿法制粒和干法制粒),粉末直接压片和结晶直接压片。
其中,湿法制粒压片最为常见,现将传统湿法制粒压片的生产工艺过程介绍如下:整个流程中各工序都直接影响片剂的质量。
制备片剂的药物和辅料在使用前必须经过干燥,粉碎和过筛等处理,方可投料生产。
为了保证药物和辅料的混合均匀性以及适宜的溶出速度,药物的结晶须粉碎成细粉,一般要求粉末细度在100目以上。
向已混匀的粉料中加入适量的粘合剂或润湿剂,用手工或混合机混合均匀制软材,软材的干湿程度应适宜,除用微机自动控制外,也可凭经验掌握,即以“握之成团,轻压即散”为度。
软材可通过适宜的筛网制成均匀的颗粒。
过筛制得的颗粒一般要求较完整,如果颗粒中含细粉过多,说明粘合剂用量过少,若呈线条状,则说明粘合剂用量过太多。
这两种情况制成的颗粒烘干后,往往出现太松或太硬的现象,都不符合压片对颗粒的要求。
制好的湿颗粒应尽快干燥,干燥的温度由物料的性质而定,一般为50~60℃,对湿热稳定者,干燥温度可适当提高。
湿颗粒干燥后,需过筛整粒以便将粘结成块的颗粒散开,同时加入润滑剂和需外加法加入的崩解剂并与颗粒混匀。
整粒用筛的孔径与制粒时所用筛孔相同或略小。
压片前必须对干颗粒及粉末的混合物进行含量测定,然后根据颗粒所含主药的量计算片重。
()测得值干颗粒中主药百分含量标示量每片应含主药量片重=根据片重选择筛目与冲膜直径,其之间的常用关系可参考表1。
根据药物密度不同,可进行适当调整。
表1 根据片重可选的筛目与冲膜的尺寸 筛目数片重 冲膜直径(mg ) 湿粒 干粒 (mm ) 50 18 16-20 5-5.5 100 16 14-20 6-6.5 150 16 14-20 7-8 200 14 12-16 8-8.5 300 12 10-16 9-10.5500 10 10-12 12制成的片剂需按照中国药典规定的片剂质量标准进行检查。
水杨酸溶出度标准片(校正片)说明书

水杨酸溶出度标准片(校正片)说明书为使同一药品的溶出度测定结果得到良好的重现性,对新安装的溶出度仪应采用溶出度标准片进行性能确认,对当前使用的溶出度仪也应定期(或在出现异常情况时)进行性能确认,溶出度标准片的溶出数据是检定溶出度仪是否良好和实验操作是否规范的依据。
水杨酸片是非崩解型溶出度标准片。
1.试验方法1.1 调试所用溶出度仪按照中国药典2005年版二部附录Ⅹ C 要求进行1.2 溶出介质的制备取磷酸二氢钾6.80g,加氢氧化钠1.58g,用水稀释至1000ml,即得磷酸盐缓冲液( pH =7.4±0.05 )。
将配制好的磷酸盐缓冲液加热至约45℃,趁热减压过滤(0.45µm)。
减压条件下电磁搅拌5分钟(最大体积4000ml)。
即得。
或取磷酸二氢钾6.80g,加氢氧化钠1.58g,先用尽量少的水溶解(约50ml),加煮沸并冷却至约41℃的水稀释至1000ml,即得。
也可采用其他等效的脱气方法,溶出介质中的溶解氧应不超过2.8mg/L。
1.3 对照品溶液的制备取水杨酸对照品约15mg,精密称定,置200ml量瓶中,加溶出介质适量,使水杨酸溶解并稀释至刻度,摇匀。
作为对照品溶液(1)(供篮法和桨法使用);取对照品溶液(1)10.0ml,置50ml量瓶中,用溶出介质稀释至刻度,摇匀,作为对照品溶液(2)(供小杯法使用)为了加快水杨酸的溶解速度,也可先用少量乙醇溶解后再用溶出介质稀释至刻度。
但是乙醇的用量应不超过总体积的1%。
1.4供试品溶液的制备1.4.1篮法和桨法方法A取溶出介质各900ml,分别置各溶出杯内,注意不要将空气带入溶出介质中,不要搅拌,温度平衡后,保持在37±0.5℃,调整转速为100转/分钟。
用吹风机(冷风)、洗耳球或软刷小心除去片子表面的粉尘,选取水杨酸溶出度标准片6片称重后分别置于干燥的转篮中(篮法)或同时投入六个杯中(桨法)。
自标准片接触溶出介质时开始计时,经30分钟时取样(误差应不超过20秒),用不大于0.8µm孔径的滤膜滤过,取续滤液为供试品溶液。
实验八_乙酰水杨酸肠溶片的制备

实验八乙酰水杨酸肠溶片的制备一、目的和要求1.通过乙酰水杨酸肠溶片的制备,熟悉片剂的基本工艺过程。
2.熟悉薄膜衣材料的组成及其特性;掌握薄膜衣的基本操作。
3.了解单冲压片机的基本构造、使用方法;了解包衣机的基本结构及使用方法。
二、基本概念和实验原理片剂系指药物与辅料均匀混合,通过制剂技术压制而成的圆片或异形片状的固体制剂。
通常片剂的制备包括有湿法制粒压片、干法制粒压片和直接压片,其中应用较广泛的是湿法制粒压片,其适用于对湿热稳定的药物。
制备要点如下:(1)原料药与辅料应混合均匀。
含量小的药物可根据药物的性质采用等量递增法使药物分散均匀。
(2)凡遇热易分解的药物,在制片过程中应避免受热分解;凡具有挥发性的药物,可采用空白颗粒法制备。
(3)凡具有不良嗅味、刺激性、易潮解或遇光易变质的药物,制成片剂后,可包糖衣或薄膜衣,对一些遇胃酸易破坏、对胃有较强刺激性或为治疗结肠部位疾病需在肠内释放的药物,制成片剂后应包肠溶衣。
为减少某些药物毒副作用,减少用药频率,避免或减少血浓峰谷现象,提高患者的顺应性并提高药物药效和安全性,可制成缓、控释制剂。
目前常用的压片机有撞击式单冲压片机和旋转式多冲压片机。
薄膜衣与糖衣相比具有生产周期短、效率高、片重增加不大(一般增加3%~5%)、包衣过程可实行自动化、对崩解的影响小等特点。
三、仪器和材料仪器:电子天平,单冲压片机、包衣机,乳钵(中号),喷枪,空气压缩机,烘箱,电吹风,搪瓷盘,不锈钢筛网(40目,80目),尼龙筛网(16目,18目),冲头(5.5mm浅凹冲)等。
材料:乙酰水杨酸(粒状结晶),微晶纤维素,羟丙甲纤维素,酒石酸,滑石粉,Ⅱ号丙烯酸树脂,邻苯二甲酸二乙酯,蓖麻油,柠檬黄,吐温-80等。
四、实验内容(一)乙酰水杨酸片芯的制备1.处方:每片用量(mg)500片用量(g)乙酰水杨酸25.012.5淀粉36.018.0微晶纤维素30.015.0羧甲基淀粉钠5.02.5酒石酸(或枸橼酸)0.80.42%HPMC醇水液QSQS4%滑石粉QSQS2.制法将乙酰水杨酸(80目)与淀粉、微晶纤维素、羧甲基淀粉钠用40目不锈钢筛混合均匀。
乙酰水杨酸肠溶制剂的溶出度考察

乙酰水杨酸肠溶制剂的溶出度考察
徐榕青;徐士尧;陈成辉
【期刊名称】《中国医药工业杂志》
【年(卷),期】1996(27)7
【摘要】对国内7个生产厂家的乙酰水杨酸肠溶片及胶囊进行了体外耐酸性能及溶出度对比实验。
结果表明各产品耐酸性能均符合规定,但溶出参数存在显著差异(p<0.01),T50最大相差6.1倍。
空心肠溶胶囊质量对溶出度有极显著影响。
【总页数】3页(P304-306)
【关键词】乙酰水杨酸;肠溶制剂;溶出度
【作者】徐榕青;徐士尧;陈成辉
【作者单位】福建省医学科学研究所
【正文语种】中文
【中图分类】R971.1
【相关文献】
1.不同厂家小剂量阿司匹林肠溶制剂溶出度比较 [J], 叶宇红;刘玉雯
2.不同厂家奥美拉唑肠溶制剂在不同溶出介质中的溶出曲线比较研究 [J], 陈芳晓;孙志;赖庆宽
3.国产不同厂家肠溶乙酰水扬酸片的溶出度测定 [J], 陈文; 韩蓉
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乙酰水杨酸片溶出度的测定
药剂学实验课
实验目的
• 掌握片剂溶出度的测定方法及其意义
药剂学实验课
理原验实
1.溶出度:药物从片剂等固体制剂中溶 出的速度和程度。
2.测定方法:① 转篮法 ② 浆法
③ 小杯法
药剂学实验课
溶 出 过 程
实验原理
一般药物的溶出速度主要受扩散的影响。
溶解度小于0.1-1%的药物,药物的溶出是其 吸收的限制过程。
药剂学实验课
实验原理
崩解时限与体内的吸收并不都存在着平衡关系。 了解机体吸收的可靠方法是对该制品进行活体的 生物利用度测定,但测定血药浓度,尿药排泄速 率及其代谢物等方法比较复杂,代价太高,有实 际困难。实验证明,很多药物的体外溶出与吸收 有相关性,因此溶出度测定法作为反映或模拟体 内吸收情况的试验方法,在评定质量上有着重要 意义。
思 考
题
测定片剂容出度的意义?
药剂学实验课
实验原理
片剂中还有些药物除规定有崩解时限外, 还要进行溶出度测定,以控制片剂的质量
①含有在消化液中难溶的药物 ②与其他成分容易发生相互作用的药物 ③久贮后溶解度降低的药物 ④剂量小、药效强、副作用大的药物片剂
药剂学实验课
实验内容
溶出速率测定: 1.配制人工胃液:
1000 ml蒸馏水+浓盐酸,调PH值至1.2~1.7.(约需要浓盐酸10ml) 2.放入大烧杯中,在水浴中加热至37±1℃,在操作中维持此温度。 3.放入已精密称定的片剂1片,开始运转计时。 4.按2′、4′、6′、10′、20′、30′、40′、50′定量取样,每次取样5ml,
同时补足人工胃液5ml。 5.将取品过滤后,精密量取滤液2ml于带塞刻度试管中,加水4ml,用0.1NNaOH调
PH至9~10,于沸水浴中加热,5分钟,冷却至室温,用0.1NHCI调PH至3~4,加 入硝酸铁试液5滴显色,加水至10ml,在540nm处
药剂学实验课
