第七章 卤代烃
合集下载
第七章_卤代烃_有机金属化合物

CHF3 氟仿(fluroform) CHCl3 氯仿 (chloroform) CHBr3 溴仿(Bromoform) CHI3 碘仿(Iodoform)
一级卤代烷: (CH3)2CHCH2Cl Br 二级卤代烷: CH3CH2CHCH3 三级卤代烷: (CH3)3C-I
CH3 H CH3CH2CH C2H5
三 偶极矩与有机分子的极性 有机分子的偶极矩大,极性大。
四 电负性与键的分类
C (2.5) F (4.0) Cl (3.16) Br (2.96) I (2.66)
差值
1.5
0.66
0.46
0.16
极性共价键,极性逐渐减弱
五、卤代烷的构象
Cl H H H Cl H
1,2-二氯乙烷的构象
Cl H H Cl H H
应用一:制备高级炔烃
CH3CH2CH2MgBr + CH3CCH CH3C C MgBr + CH3CH2CH3 CH2=CHCH2X CH3CCCH2CH=CH2
应用二:在分子中引入同位素 RMgX + D2O RD
3. 格氏试剂、有机锂试剂、二烃基酮锂 与卤代烃的偶联
(1) RMgX + R’X
I + C4H9Li
Li + C4H9I
(3) 二烃基铜锂的制备
RLi + CuX RLi + RCu
RCu + LiX R2CuLi
2. 格氏试剂、有机锂试剂 与O2、CO2、H2O的反应。
(1) 与O2的反应 RMgX + O2 RMgX RLi + O2 ROOMgX
2ROMgX
ROOLi
R X
最新大学有机化学重点知识总结第七章 卤代烃

C H 2 C l + H 2 O
§7.5 卤代烷的化学性质
δ+
C C
HH
消除反应 :B
亲核取代 反应
δ-
X Nu-:
极性共价键 断裂
一、亲核取代反应
C–X 的极化:
δδ
CX
亲核试剂, Nu 负电荷或未共用电子对 RO-, OH-, CN-, NH3 离去基团, L
Nu + δ C Lδ
C Nu + L
B r
C H 2C H C H C H 3 C H 3
C 2H 5O N a C 2H 5O H
C HC H C H C H 3 C H 3
若能形成共轭体系,以形成稳定的共轭体系 为主要产物。注意不是脱含H少的碳上的H
c.邻二卤代烷脱卤化氢
Hβ X + 2NaOH 乙 醇 X
Hβ'
+ 2NaX + 2H2O
2–甲基–3–氯丁烷
B rC H 2C H 2 C HC H 2C H 2C H 3 3–乙基–1–溴己烷
C 2H 5
CH3CH2CHCH2 CH3 CH2Cl
3–氯甲基戊烷
卤代烷的命名
Cl 2-氯乙基环己烷
Cl
CH3 H Br
C 3H 7
1-氯二环[2.2.1]庚烷 (S)-2-溴戊烷
3、卤代烯烃的系统命名法
叔 卤 烷 仲 卤 烷 伯 卤 烷
易
难
b. 对于含不同β–H的RX, 消除方向遵循Saytzeff
(萨伊切夫)规则:
生成双键C原子上取代较多的烯烃
C H 3C H C H C H 2C 2H 5C O 2N H a5O 或 H N aO H HBrH
有机化学-第七章 卤代烃
1 加NaOH是为了加快反应的进行,使反应完全。 2 此反应是制备醇的一种方法,但制一般醇无合成价值,可用 于制取引入OH比引入卤素困难的醇。
2.与醇钠(RONa)反应—醇解—制备(混合)醚(称为威廉森合成)
' R-X + RONa
R-O R' + NaX 醚
R-X一般为1°RX,(仲、叔卤代烷与醇钠反应时,主要发生消 除反应生成烯烃)。 3.与氨反应
二、消除反应 从分子中脱去一个简单分子生成不饱和键的反应称为消除反应, 用E表示。 卤代烃与NaOH(kOH)的醇溶液作用时,脱去卤素与β碳原子 上的氢原子而生成烯烃。
R-CH-CH2 + NaOH H X
KOH- 醇 R-CH=CH-CH=CH-R + 2NaX + 2H2O
醇
R-CH=CH2 + NaX + H2O
CH3 叔丁基溴 tert-butyl bromide 叔溴丁烷
2、IUPAC命名法
(1)饱和卤代烃
CH 3-CH2-CH--CH-CH 3 H3C Cl
Cl 3- 甲基 -5- 氯庚烷 3- 氯 -5- 甲基庚烷 × 4- 甲基 -2- 氯己烷 CH 3-CH2-CH-CH -CH-CH -CH3 2 2 CH 3
亲核取代反应机理小结
卤代烃亲核取代的两种机理: SN2 和 SN1 机理
SN2 机理:双分子取代,一步机理
反应速率 = k[RX][Nu-]
手性底物反应发生构型转换 反应速率:1º RX>2º RX>3º RX (空间位阻效应)
SN1 机理:单分子取代,二步机理
反应速率 = k[RX] 手性底物反应发生消旋化
第7章 卤代烃-SN1、SN2亲核取代

带部分正电荷,易 被带负电荷或带孤 对电子的分子进攻
(一)亲核取代反应 SN
Nucleophilic substitution
δδδ+
δδ+
δ+
δ-
CH3
Substrate
CH2
CH2 Nu:
Cl
Cl-
Leaving group 离去基团
底物
特点:
Nucleophile
亲核试剂
带负电荷或 孤对电子
诱导效应可沿共价键在碳链上传递,随着距离的增加
而迅速减弱,一般通过三根单键以后,已基本消失 。
与C-H键相比
H H
Cg
ddd+
H
C
b
dd+
H C
d+
a
Cl
极性共价键
d-
H
H
H
三、化学性质
诱导效应,易 断裂,“消除” d+ d- X吸电子,且C-X键键 能较小(C-F除外), 易断裂,且生成的X-更 稳定。X被“取代”
CH2
CH
CH 2Cl
3-氯-1-丙烯
CH2
CH
CH
CH3
CH2 Cl
3-甲基- 4 -氯-1-丁烯
二、结构(structure)
卤代烷中所有的键都是 σ 键,碳原子为 sp3 杂化, C-X 共价键为极性键。
H
H
ห้องสมุดไป่ตู้
d+
C
d-
X
C-F 139pm
C-H 110pm
H
C-Cl 176pm
C-Br 194pm C-I 214pm
C
O-
• 5)中心原子为同种元素,受溶剂影响较大
第七章 卤代烃

• 常将卤烷与强碱(NaOH、KOH)的水溶液共热
NaOH
ROH + NaX
• 一般的卤烷是由醇制得。
• 但在实际上在一些比较复杂的分子中要引入一个 羟基常比引入一个卤素原子困难。因此,对这类分 子的合成往往可以先引入卤素原子,然后通过水解 再引入羟基。
•卤烷水解反应的速度与卤烷的结构、使用的 溶剂及反应条件等都有关。
NHR'2(H)
R R NH2 伯胺 R NHR' 仲胺 R NR'2 叔胺
SH R SR' 硫醇(硫醚)
R-X为重要有机中间体(intermediates)
3. 还原反应 卤原子被氢取代的反应:
——在卤烃的取代反应中,卤原子也能被氢原子取代。 例如:在卤烃在催化化加氢或用碘化氢还原时,卤烃 上的卤原子被氢取代:
偕二卤代烷
X R R C R
X C R R
R
卤代烯烃
卤代芳烃 X与sp2碳相连 性质特殊
邻二卤代烷
3. 卤代烷的命名
普通法和俗称:
CH3 CH3 Br CH3CHCH2 异丁基溴 isobutyl bromide 异溴丁烷 Br Br CH3CH2CH 仲丁基溴 sec-butyl bromide 仲溴丁烷
CH2Cl
( 8)
•
3. 一卤代芳烃的异构(卤素在苯环上的异构,卤素在侧链上的异构)
第二节 卤代烷的物理性质
1. 卤代烷的物理性质简介
物态:一般为液体,高级为固体,少量为气体(溴甲烷,氯乙烷) 比重: 一氯代物通常 d < 1。 溶解度:不溶于水,易溶于有机溶剂
其它:多卤代物一般不燃烧
卤代烯烃和卤代芳烃的命名:将卤素作为取代基,其余与烯烃、芳烃类同
(有机化学课件)第七章 卤代烃

7.3.1 烃的卤代
烷烃的卤化、烯烃的α–卤代、芳烃的α–卤代:
7.3.2 由不饱和烃制备
烯烃与Br2或HX的加成:
7.3.3 由醇制备
常用的卤化试剂:HX, PX3, PX5, SOCl2(亚硫酰氯).
7.3.4 卤原子交换反应
在适当条件下,卤代烃与含卤负离子的盐类可以发生卤原子的交换反应。
(2) 烯丙型和苄基型卤代烃 卤原子与碳碳重键或苯环相隔一 个饱和碳原子。 特点:C–X键活性高,易发生异 裂,产生烯丙型(苄型)正离子 活性中间体,具有p,π–共轭效应。
(3) 隔离型卤代烃
卤原子与碳碳重键或苯环相 隔两个或多个饱和碳原子,与 一般卤代烷性质接近。
7.2 卤代烃的命名
普通命名法
简单卤代烃的命名,一般是由烃基的名称加上卤原子的名称而成。
(有机化学课件)第七章 卤代烃
内容
卤代烃 —— 烃分子中的氢原子被卤原子取代后的化合物。
卤代烃的分类、命名、制法和物理性质 卤代烃的亲核取代、消除反应及与活泼金属的反应 亲核取代反应机理及邻基参与 消除反应机理 亲核取代反应及消除反应的影响因素 卤代烯烃和卤代芳烃的化学性质 氟代烃
CH3
14% 2%
86% 98%
偕二卤代烃与连二卤代烃
CX X
偕二卤代烃
偕二卤代烃与连二卤代烃脱卤化氢得卤代烯烃;
PCl5 O
(C2H5)3N Cl
Cl
Cl
XX
连二卤代烃
开链偕二卤代烃与连二卤代烃脱二分子卤化氢得炔;
(2) 脱卤素
CH3 CH CH CH3 Br Br
Zn, CH3CH2OH 或 NaI, 丙酮
注:英文命名不按次序规则,而是按取代基名称的第一个字母的顺序,所 以有时与中文命名结果不一致
第七章卤代烃

CH3CH2OH + HBr
在一般情况下,此反应很慢。为增大反应速率,提高醇的产 率,常加入强碱(氢氧化钠),使生成的HX与强碱反应,可 加速反应并提高了醇的产率。
CH3CH2Br + NaOH
CH3CH2OH + NaBr
• 此反应工业用途不大,因卤烷在工业上是由醇制取,但可用 于有机合成中官能团的转化。用于复杂分子中引入羟基(先 卤代,再水解)。
醇 R-X + AgNO3
R-O NO2 + AgX 硝酸酯
反应通式如下:
R - L + :Nu RCH2X + -OH 反应物 亲核试剂 (底物) 进攻基团
R - Nu + L-
RCH2-OH + X-
产物
离去基团
1. 卤烃的水解
• 卤代烷与水作用,水解为醇,反应是可逆反应。如:
CH3CH2Br + H2O
• 查依采夫规则: • 卤代烷脱HX时,总是从含H较少的碳上脱去H原子。
Saytzeff规则应用
CH3
CH3
KOH / 醇
CH3 CH C CH2
CH3 CH C CH3 71%
CH3
H Br H
CH3 CH2 C CH2 29%
• Saytzeff规则的实质上是生成一个较稳定的烯烃。
• 总是要生成共轭效果较好的结构(较稳定)。如:
•而仲卤烃和叔卤烃在碱(氰化钠、氰化钾)的作用
下易发生消除反应,生成烯烃,此反应一般不用仲、 叔卤烃反应。
•产物腈还可转化为胺、酰胺和羧酸。
4. 卤烃的氨解
• 此反应既可用氨反应,也可用氨的衍生物反应,来 制取伯、仲、叔胺。
第七章 卤代烃1

此反应的优点是,产率高,易提纯。
三、卤素置换反应
RCl RBr + NaI
丙酮
RI
+
NaCl NaBr
第三节 卤代烃的性质
一、物理性质
1. 偶极矩
R-F
1.82
R-Cl
1.94
R-Br
1.79
R-I
1.64
2.沸点:分子极性较大,沸点比相应烷烃高 3.溶解度:不溶于水
4.密度:除一氯代烃和一氟代烃比水轻外,密度 均大于1
ν = k [R L][Nu]
二级反应
其反应机理为:
Nu + R'CH2 L
δ
H H
δ
Nu C L R'
R'CH2 Nu +L-
T 亲核试剂 接近 背后 -从离去基团的背面 与此同时 中心碳原子
离去基团也正在逐步地离开底物分子 新键的形成与旧键的断裂是同时发生的,旧键断裂 时所需的能量,是由新键形成所放出的能量提供的。 两者达到平衡时,体系能量最高。其状态为过渡态 T.
2). 单分子亲核取代 (Substitution Nucleophilic Unimolecular) ( SN 1)反应机理
R L + Nu
-
+ LR Nu
ν = k1 R L
反应分两步进行 第一步 正碳离子的生成:
δ
R L
慢
R L
δ
LR +
+
第二步 亲核试剂进攻正碳离子:
R + Nu
+
- 快
RI
键能 极化度
RBr
RCl
RF
亲核取代 活性
第七章 卤代烃
1
2
Br
Br
FH
Cl
对氯苯酚
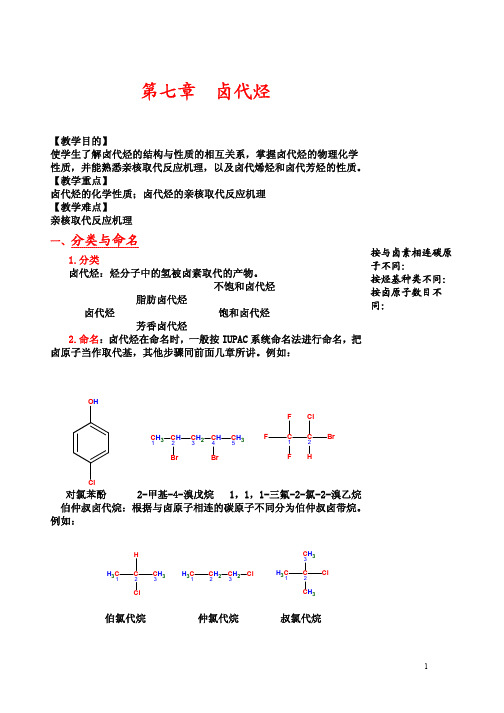
2-甲基-4-溴戊烷 1,1,1-三氟-2-氯-2-溴乙烷
伯仲叔卤代烷:根据与卤原子相连的碳原子不同分为伯仲叔卤带烷。
例如:
H
H3C1
C
2
C3 H3
Cl
H3C1
C2 H2 C3 H2 Cl
伯氯代烷
仲氯代烷
H3C1
C3 H3 C Cl
2
CH3
叔氯代烷
1
有些卤代烃常用俗名例如:
H2N- >HO- >F-
R3C- > R2N- > RO- > F-
⑶同一族元素中,周期高的原子亲核性大,碱性则降低。例如:
亲核性:
I- >Br- > Cl- >F-
RS- > RO-
碱性:
I- <Br- < Cl- <F-
RS- < RO-
在质子溶剂中,一些常见的亲核试剂的亲核性的顺序大概如下:
亲核取代:由于亲核试剂的进攻而发生的取代反应。
(elimination
⑴ 卤代烃的水解: ⑵ 威廉姆逊合成(williamson) ⑶ 卤代烃的氨解:
reaction); ⑴ 脱 HX 的能力: ⑵ 札依采夫规律: 在反应中,主要产
与过量的氨作用,卤原子被氨基取代生成胺。
物为双键上烷基取
⑷ 被氰基取代: 氰可进一步水解,生成酸,这是制备酸的一个重要方法,在合成 中非常有用。
脱氢。
⑵ 脱卤素
3.与金属反应
格氏试剂性质活波,与含活波氢的化合物反应,如:H2O、RCOOH、
RCH3OH、NH3、RC≡CH 等等
其中 Y= —OH、—OR、—NH2、—C≡CR
第七章 卤代烃

CH3COCH3
R
I + BrRelative Rate
Relative Rate
Compound
CH3Br CH3CH2Br (CH3)2CHBr (CH3)3CBr
30 1 0.02 ~0
CH3CH2Br CH3CH2CH2Br (CH3)2CHCH2Br (CH3)3CCH2Br
100 28 3 0.00001
相反的过程。构型转化是SN2反应的立体化学特征。
为什么亲核试剂总是从离去基团的背面进攻中心碳原子?
.
sp3 sp2
Nu:- +
C L
Nu
C
L
p轨道
Nu C + :L- .
基团的排斥;过渡态能量;亲核试剂与离去基团的距离。
2. 单分子亲核取代反应(SN1)机理及其立体化学
CH3 CH3 C Br + OH CH3
R2CHX R3CX
卤代烃的命名 a.普通命名法
一些分子中的烃基部分有简单的非系 统名称的卤代烃可采用普通命名,即在相 应烃基名前加卤素名称。
CH3 CH3 CH2CH2CH 2Br
正丁基溴 溴代正丁烷
H3C H
CH2Br
异丁基溴 溴代异丁烷
系统命名法,把卤素作为取代基。其它 的命名原则与烷烃的命名基本相同。 当烷基和卤素相同编号时,优先考虑烷 基。当双键和卤素并存时,优先考虑给 双键以尽可能小的编号 。
-
CH3COCH3 H2O
CH3 CH3 C OH + BrCH3
V= k1[(CH3)3CBr]
反应分步进行:
CH3 (1) CH3 C Br CH3 CH3 (2) CH3 C + OH CH3
有机化学ppt-卤代烃

四、氟利昂 是一类含氟及氯的烷烃。具有无色、无臭、无腐蚀性、不 能燃烧的性质。沸点为-29.9℃,易压缩成液态,解除压力后 立即气化,且吸收大量的热,因此,常用作冷冻剂。 五、氯乙烯及聚氯乙烯
氯乙烯又名乙烯基氯(Vinyl chloride)是一种应用于高分 子化工的重要单体,可由乙烯或乙炔制得。为无色、易液化气 体,沸点-13.9℃。氯乙烯是有毒物质,肝癌与长期吸入和接触 氯乙烯有关。
三、密度 1.RCl < RBr < RI(烃基相同) 2. 一氯代烃<水,而溴代烃、碘代烃>水(多数) 3.卤原子的数目增多,卤代烃的密度增大 4. 烃基分子量增大,密度减少(卤原子相同)
四、沸点 1. 卤素的原子序数增加,沸点升高(烃基相同) 2. 碳链增长,沸点升高(同种卤原子) 3. 直链卤代烃沸点较高,支链越多沸点越低(同分异构体)
聚氯乙烯,英文简称PVC(Polyvinyl chloride),是氯乙烯 单体在过氧化物、偶氮化合物等引发剂,或在光、热作用下按 自由基聚合反应机理聚合而成的聚合物。氯乙烯均聚物和氯乙 烯共聚物统称之为氯乙烯树脂。
各种卤代烃与硝酸银的反应活性不同,活性顺序: RI >RBr >RCl
叔卤代烷(3º)>仲卤代烷(2º)>伯卤代烷(1º)
(二)亲核取代反应机理
由亲核试剂(如试剂的负离子OH−、CN−、RO−、ONO2−等或 具有孤对电子的分子NH3、RNH2等)进攻带部分正电荷的中心而 引起的取代反应,称为亲核取代反应(SN )。
第四节 卤代烃中卤原子反应活性
按照卤原子和 p 键的相对位置可将卤代烯烃及卤代芳烃分为 三类:
> > CH2=CHCH2-X C6H5-CH2-Cl
CH2=CHCH2-CH2-X CH2=CH-X
第七章 卤代烃

与卤化氢或卤素加成
CH2=CH2 CH CH
+ +
Br2 HCl HgCl2
CH2Br
150 - 160 oC
CH2Br
CH2=CHCl
烯烃α-氢或苄基氢被卤原子取代
H2C CHCH3
+ +
Cl2 O
500~530 0C
H2C
CHCH2Cl
H2C
CHCH3
NBr
H2C
CHCH2 Br
(NBS) O
三、由醇制备
(S)-(+)- 2- 辛醇 [α ]D =+9.9°
产物的构型与底物的构型不一样,此过 程叫构型反转(Walden转化)。
SN2的特点
*1.这是一个一步反应,只有一个过渡态。过渡态的结 构特点是:中心碳是sp2杂化,它与五个基团相连,与 中心碳相连又未参与反应的三个基团与中心碳原子处于 同一平面上,进入基团 (亲核试剂) 和离去基团处在与 该平面垂直,通过中心碳原子的一条直线上,分别与中 心碳的p轨道的二瓣结合。 *2.所有产物的构型都发生了反转。 *3.反应在大多数情况下,是一个二级动力学控制的反应。
2-甲基-4-苯基-1,3-二氯戊烷
5
4 3 2 1
Cl
H CH 3
CH3CH2CH2CCH2-CHCH3
(4R)-2-甲基-4-氯庚烷
芳卤化合物:当卤原子连在芳烃侧链上时, 母体:脂肪烃;取代基:芳基、卤原子。
CHCl2
CHCH2CH2Cl CH3
对甲苯二氯甲烷
CH3 C
CH3
3–苯基–1–氯丁烷 (1-chloro-3-phenyl butane)
RCl
SO2
CH2=CH2 CH CH
+ +
Br2 HCl HgCl2
CH2Br
150 - 160 oC
CH2Br
CH2=CHCl
烯烃α-氢或苄基氢被卤原子取代
H2C CHCH3
+ +
Cl2 O
500~530 0C
H2C
CHCH2Cl
H2C
CHCH3
NBr
H2C
CHCH2 Br
(NBS) O
三、由醇制备
(S)-(+)- 2- 辛醇 [α ]D =+9.9°
产物的构型与底物的构型不一样,此过 程叫构型反转(Walden转化)。
SN2的特点
*1.这是一个一步反应,只有一个过渡态。过渡态的结 构特点是:中心碳是sp2杂化,它与五个基团相连,与 中心碳相连又未参与反应的三个基团与中心碳原子处于 同一平面上,进入基团 (亲核试剂) 和离去基团处在与 该平面垂直,通过中心碳原子的一条直线上,分别与中 心碳的p轨道的二瓣结合。 *2.所有产物的构型都发生了反转。 *3.反应在大多数情况下,是一个二级动力学控制的反应。
2-甲基-4-苯基-1,3-二氯戊烷
5
4 3 2 1
Cl
H CH 3
CH3CH2CH2CCH2-CHCH3
(4R)-2-甲基-4-氯庚烷
芳卤化合物:当卤原子连在芳烃侧链上时, 母体:脂肪烃;取代基:芳基、卤原子。
CHCl2
CHCH2CH2Cl CH3
对甲苯二氯甲烷
CH3 C
CH3
3–苯基–1–氯丁烷 (1-chloro-3-phenyl butane)
RCl
SO2
第七章卤代烃(修改)

CH3CH2CH2OH
CH3CH2CH2 O CH2CH3 + NaI 混合醚
该法是合成不对称醚的常用方法, 该法是合成不对称醚的常用方法,称为 Williamson (威廉逊)合成法。该法也常用于合成硫醚或芳醚。 威廉逊)合成法。该法也常用于合成硫醚或芳醚。 采用该法以伯卤烷效果最好,仲卤烷效果较差, 采用该法以伯卤烷效果最好,仲卤烷效果较差,但 伯卤烷效果最好 不能使用叔卤烷,因为叔卤烷易发生消除反应生成烯烃。 不能使用叔卤烷,因为叔卤烷易发生消除反应生成烯烃。 卤代醇在碱性条件下,可以生成环醚。 卤代醇在碱性条件下,可以生成环醚。
X +
H
OH
H2O
R OH +
R OH +
HX (该反应为什么是可逆的?) 该
NaX (为什么?) 为
7
NaOH
离去基 X 的碱性越弱,越容易被 OH 取代。
水解反应的相对活性: RI>RBr>RCl>RF (烷基相同) > > > 烷
2. 醇解 醇解:
CH3CH2CH2ONa + CH3CH2I
6
(1) 有机锂化合物的生成: 有机锂化合物的生成:
R X + 2 Li
醚
RLi
+ LiX
活性顺序:
RI >RBr > RCl >RF
(2)有机镁化合物的生成: (2)有机镁化合物的生成: 有机镁化合物的生成
R X + Mg
醚
R
MgX
亲核取代反应 一、反应: 反应: 1. 水解: 水解:
R
R
X +
到外消旋化合物。 到外消旋化合物。 然而, 然而,100 % 的外消旋化是很少 见的, 见的,经常是外消旋化伴随着构型反 转,且构型反转要多些。 且构型反转要多些。
CH3CH2CH2 O CH2CH3 + NaI 混合醚
该法是合成不对称醚的常用方法, 该法是合成不对称醚的常用方法,称为 Williamson (威廉逊)合成法。该法也常用于合成硫醚或芳醚。 威廉逊)合成法。该法也常用于合成硫醚或芳醚。 采用该法以伯卤烷效果最好,仲卤烷效果较差, 采用该法以伯卤烷效果最好,仲卤烷效果较差,但 伯卤烷效果最好 不能使用叔卤烷,因为叔卤烷易发生消除反应生成烯烃。 不能使用叔卤烷,因为叔卤烷易发生消除反应生成烯烃。 卤代醇在碱性条件下,可以生成环醚。 卤代醇在碱性条件下,可以生成环醚。
X +
H
OH
H2O
R OH +
R OH +
HX (该反应为什么是可逆的?) 该
NaX (为什么?) 为
7
NaOH
离去基 X 的碱性越弱,越容易被 OH 取代。
水解反应的相对活性: RI>RBr>RCl>RF (烷基相同) > > > 烷
2. 醇解 醇解:
CH3CH2CH2ONa + CH3CH2I
6
(1) 有机锂化合物的生成: 有机锂化合物的生成:
R X + 2 Li
醚
RLi
+ LiX
活性顺序:
RI >RBr > RCl >RF
(2)有机镁化合物的生成: (2)有机镁化合物的生成: 有机镁化合物的生成
R X + Mg
醚
R
MgX
亲核取代反应 一、反应: 反应: 1. 水解: 水解:
R
R
X +
到外消旋化合物。 到外消旋化合物。 然而, 然而,100 % 的外消旋化是很少 见的, 见的,经常是外消旋化伴随着构型反 转,且构型反转要多些。 且构型反转要多些。
第七章卤代烃

2、消除反应(β-消除反应) 、消除反应( 消除反应--这种由一个分子中脱去一些小分子,同时形成双键 消除反应--这种由一个分子中脱去一些小分子,同时形成双键 --这种由一个分子中脱去一些小分子 的反应, 的反应,用E表示。 表示 R-CH-CH2 + KOH H X
C2H5OH
R-CH = CH2 KX + H2O
5 4 3 2 1 1 2 3 4
CH3CHCH=CHCH3 Br 4-溴-2-戊烯 溴 戊烯
1 2 3 4 5
CH2=C-CH2CH2-Cl CH2CH2CH3 2-丙基-4-氯丁烯 2-丙基-4-氯丁烯 丙基
CH3-C≡C-CHCH2-Br CH3 4-甲基 溴-2-戊炔 甲基-5-溴 戊炔 甲基
CH2CH2Cl
Br Br
1-苯基 氯乙烷 苯基-2-氯乙烷 苯基
1, 3-二溴苯 二溴苯
二、卤代烃的物理性质
•大多数卤代烃为液体,高级卤代烃为固体。 大多数卤代烃为液体,高级卤代烃为固体。 大多数卤代烃为液体 •沸点随碳原子增加而升高,其中碘代烷 >溴代烷 氯 沸点随碳原子增加而升高, 溴代烷>氯 沸点随碳原子增加而升高 溴代烷 代烷>氟代烷 氟代烷。 代烷 氟代烷。 •一氟代烃、一氯代烃比重<水;溴代烃、 碘代烃比重 一氟代烃、一氯代烃比重 水 溴代烃、 一氟代烃 >水。 水 •卤代烃不溶于水,与烃类任意混溶。 卤代烃不溶于水,与烃类任意混溶。 卤代烃不溶于水 CH2Cl2、 CHCl3、 CCl4等是常用的有机溶剂。 等是常用的有机溶剂。
5 4 3 2 1 1 2 3 4
CH3CHCH=CHCH3 Br 4-溴-2-戊烯 溴 戊烯
1 2 3 4 5
有机化学第七章卤代烃

① 饱和卤烃(卤代烷) C2H5Cl ② 不饱和卤烃(卤代烯、卤代炔)CH2=CHCl ③ 卤代芳烃 Ar-X
卤烃 5
3. 按分子中是否有不饱和键可分为:
有机化学
卤代烯烃和卤代芳烃的分类:
(1) 乙烯型和苯基型卤代烃
H2C CH Cl
Br
p-π共轭
氯乙烯
溴苯
X 原子直接与sp2杂化的C原子相连
一般只适用于制备伯碘烷
7.3.6 氯甲基化
+ HCHO + HCl
冰醋酸,H3PO4
CH2Cl + H2O
7.3.7 由重氮盐制备
有机化学
卤烃
18
7.4 卤代烃的物理性质
1. 状态 2. 熔沸点
氯甲烷、溴甲烷、氯乙烷及氟烷为气态, 卤代烷的分子量和分子极性比相应烷
其它卤烃为液体,含碳数更多的是固体。
常加入强碱(氢氧化钠),使生成的HX与强碱反应, 可加速反应并提高了醇的产率。
CH3CH2Br + NaOH CH3CH2OH + NaBr
水解反应的相对活性: RI>RBr>RCl>RF (烷基相同)
此反应工业用途不大,因卤烷在工业上是由醇制取, 但可用于有机合成中官能团的转化。用于复杂分子 中引入羟基(先卤代,再水解)。
不同卤原子的反应活性: RI>RBr>RCl 烃基的反应活性: 烯丙基卤烃、苄基卤烃>叔卤烃>仲卤烃>伯卤烃
有机化学
卤烃
33
RI (CH3)3C X RCH=CHCH2X PhCH2X RCH2X R2CHX RCH=CH(CH2)n X RCH=CHX PhX CHCl3 CCl4
卤烃 5
3. 按分子中是否有不饱和键可分为:
有机化学
卤代烯烃和卤代芳烃的分类:
(1) 乙烯型和苯基型卤代烃
H2C CH Cl
Br
p-π共轭
氯乙烯
溴苯
X 原子直接与sp2杂化的C原子相连
一般只适用于制备伯碘烷
7.3.6 氯甲基化
+ HCHO + HCl
冰醋酸,H3PO4
CH2Cl + H2O
7.3.7 由重氮盐制备
有机化学
卤烃
18
7.4 卤代烃的物理性质
1. 状态 2. 熔沸点
氯甲烷、溴甲烷、氯乙烷及氟烷为气态, 卤代烷的分子量和分子极性比相应烷
其它卤烃为液体,含碳数更多的是固体。
常加入强碱(氢氧化钠),使生成的HX与强碱反应, 可加速反应并提高了醇的产率。
CH3CH2Br + NaOH CH3CH2OH + NaBr
水解反应的相对活性: RI>RBr>RCl>RF (烷基相同)
此反应工业用途不大,因卤烷在工业上是由醇制取, 但可用于有机合成中官能团的转化。用于复杂分子 中引入羟基(先卤代,再水解)。
不同卤原子的反应活性: RI>RBr>RCl 烃基的反应活性: 烯丙基卤烃、苄基卤烃>叔卤烃>仲卤烃>伯卤烃
有机化学
卤烃
33
RI (CH3)3C X RCH=CHCH2X PhCH2X RCH2X R2CHX RCH=CH(CH2)n X RCH=CHX PhX CHCl3 CCl4
07 第七章_卤代烃

二、命名 1.普通命名法:以分子中与卤素相连的烃基为母 体,卤素为取代基,称为卤代某烃或某基卤。
CH3CH2Br 溴乙烷 (乙基溴) (CH3)3C-Cl 叔丁基氯 CH2=CH-Cl 氯乙烯 (乙烯基氯) CH2= CHCH2Cl 烯丙基氯 溴苯 (苯基溴) CH3CH=CHBr 丙烯基溴 Br
重排反应 甲基迁移
CH3 CH3-C-CH2CH3
三级碳正离子
+
OH-
CH3 CH3-C-CH2CH3 OH
SN1反应的特征之二:有重排产物生成
碳正离子稳定性顺序:
R3C+>R2CH+ >RCH2 +>CH3+ SN1活泼性:烯丙基型、苄基型卤代烃> R3C—X >R2CH—X >RCH2—X >CH3—X >乙烯型卤 代烃和卤苯 卤代烃的卤素不同,进行SN1反应的活性不同: RI > RBr > RCl > RF
CH 3 中间体 H
C6H5 CH 3 构型转化 +
HO
C
C6H5
C OH CH 3 构型保持
快
亲核试剂从两面进攻几率相等,因而得外消旋体
因SN1反应经过碳正离子中间体,会发生分子重排 生成一个较稳定碳正离子。
CH3 CH3-C-CH2Br CH3
慢
CH3 CH3-C-CH2 CH3
一级碳正离子
+
(2)双分子亲核取代 ( SN 2)反应机理
动力学研究表明:有一类亲核取代反应的速率与 底物的浓度和试剂的浓度同时相关:
r=kc(R-X)c(Nu)
其反应机理为(以溴甲烷水解为例):
H
HO + δ δ HO … C … Br
H
7第七章 卤代烃

(70%)
+ NaI
制备醚的常用方法——Williamson 合成法 制备醚的常用方法 RX: 伯卤代烷 反应活性: 反应活性:RI > RBr > RCl > RF
(3) 与 氰化钠作用 NaCN, KCN
X CN 腈
NC(CH2)5CN + 2KBr
(4) 与氨作用 X NH2 胺 NH3
C2H5OH (CH3)2CHCH2Cl + 2NH3 △
苄基氯 苄基氯 (benzyl chloride)
2、系统命名法 、
复杂的卤代烃 烃基作为母体 卤原子作为取代基。 母体, 烃基作为母体,卤原子作为取代基。
2-甲基 氯丁烷 甲基-3-氯丁烷 甲基 2-chloro-3-methylbutane
Br CH3
Cl Br F Cl CH3 CH3-CH2-CH2-C-CH-CH-CH3 CH3-CH-CH-CH3 CH(CH3)2
O + O NBr
CCl4, 回流
Br + (80%)
O NH O
CH3 + Br2 Cl
h υ
98%
CH2Br + HBr Cl
二、由不饱和烃制备
CH3CH2C CCH2CH3 + Br2
CH3COOH
CH3CH2 Br
C
C
Br CH2CH3
三、由醇制备
OH + HBr
回流6h
Br + H2O (74%)
R X + AgNO3
反应活性: 反应活性:
C2H5OH
R O NO2 + AgX
硝酸酯
RX: RI > RBr > RCl 3° > 2° > 1° ° ° °
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3
HNO3 H2SO4
CH3
CH3
+ 主
NO2
NO2
少
2
萘环上的定位规则
如萘环上β位有第一类定位基,第二个取代基主要进入1 如萘环上β位有第一类定位基,第二个取代基主要进入1位。
NO2 CH3
HNO3 H2SO4 75% H2SO4
CH3
2-甲基-1-硝基萘
CH3 例外情况
80%
HO3S
如萘环上α 位上有第二类定位基, 如萘环上 α 或 β 位上有第二类定位基 , 第二个取代基主要进入另一个苯环 的5、8位。
H+ ∆
R
CN + NaX
RCOOH
(5)被硝酸根取代
R X + AgNO3 ROH R ONO2 + AgX
此反应可用于卤代烷的定性鉴定。
20
卤代烷的亲核取代反应历程
单分子亲核取代SN1 双分子亲核取代SN2 1.单分子亲核取代历程 1.单分子亲核取代历程—SN1 单分子亲核取代历程 叔丁基溴在氢氧化钠水溶液中的水解反应速度仅与 叔丁基溴的浓度成正比,与亲核试剂OH-的浓度无关, 在动力学上属于一级反应。 υ = k [ (CH3)3 CBr ] 反应分两步完成,第一步是C-Br键断裂生成正碳离子 和溴负离子,第二步是正碳离子和OH-结合生成醇。
+
H H
δ
C H H
25
δ
Br
HO
C H H
+ Br
卤代烷的亲核取代反应历程
H3C H OH
+
H C H Cl [HO C H
C H3 Cl ]
过渡态
C H3 H
构型转化
HO
C H
水解反应速度与卤代烷和亲核试剂的浓度都 有关系,称为SN2取代 S 取代。
26
卤代烷的亲核取代反应历程
SN2反应历程中的能量变化
第六章 芳香烃
2011-10-10
1
萘
1.结构 分子式:C10H8 . 分子式:
α β β
7 6 8
α
1 2β 3β
0.142nm 0.136nm 0.141nm 0.142nm
α
5
α
4
0.136nm
2
CH3
CH3
CH3
1,4-二甲基萘
CH3
1,5-二甲基萘
CH3
1 、6 - 二甲基萘
CH3
3
萘的分子结构
21
卤代烷的亲核取代反应历程
CH3 CH3 C CH3 Br
慢
CH3 CH3 δ+ C CH3 δBr CH3
CH3 C
+
+
Br
CH3
过渡态1
CH3 CH3 C
+
碳正离子
CH3 δOH CH3 C CH3 OH
CH3 + OH 快 CH3 δ+ C CH3
CH3
过渡态2 反应速度仅与叔丁基溴的浓度成正比,与亲核试 剂OH-的浓度无关,称为SN1反应。 22
11
普通命名法
根据卤原子连接的烷基,称为“某基卤”或 “卤(代)某烷”。
CH3Cl
CH3CH2Br
C(CH3)3Cl
Br
甲基氯 乙基溴 (氯甲烷) (溴乙烷)
叔丁基氯 环已基溴 (氯代叔丁烷) (溴代环已烷)
12
系统命名法
选择含有卤原子最长的碳链作为主链,称为 “某烷”;从靠近支链的一端给主链编号,把支 链的位次和名称写在母体名称前,并按次序规则 将较优基团排列在后。
(CH3) CBr + C2H5OH 3
25oC
81%
(CH3)3C
19 %
萘中电子云分布不均匀,α位电子云密度较大, 芳香性比苯差。
4
萘的性质
① 氧化反应 比苯容易
特点
O
+ 9O2
V2O5 + KSO4
385~390℃
C O C O
②
加成反应
Na+ EtOH
1,4-二氢化萘
2H2
Ni
Na+ EtOH
Pd/C
十氢化萘
四氢化萘
5
萘的性质
③ 取代反应
特点
Br
卤代
Br2
100℃
SN1和SN2历程同时并存,相互竞争 SN1增加
H H C X H H H3C C X H H H3C C X CH3 CH3 H3C C X CH3
SN2增加 卤原子对亲核取代反应速度有影响
卤原子半径大小次序为I > Br > Cl,原子半径越大, 可极化性越大,反应活性越大活性次序 R- R- R-I > R-Br > R-Cl
36
取代反应和消除反应的竞争
① 伯卤代烷易发生取代反应,叔卤代烷易发生消除 反应,仲卤代烷则介于二者之间。 试剂的亲核性强( 有利于取代反应, ② 试剂的亲核性强(如CN-)有利于取代反应, 试剂的碱性强而亲核性弱有利于消除反应。 试剂的碱性强而亲核性弱有利于消除反应。 ③ 溶剂的极性强有利于取代反应。 溶剂的极性强有利于取代反应。 ④ 反应的温度升高有利于消除反应 。
俗名或商品名
Cl CHCl 3 CHI 3 CCl 2F2 Cl Cl
Cl Cl Cl
氯仿
碘仿
氟利昂-1,2 六六六(林丹)
15
卤代烃的物理性质
在常温常压下,氯甲烷、氯乙烷和溴甲烷是气体, 在常温常压下,氯甲烷、氯乙烷和溴甲烷是气体, 其余的卤代烃是液体或固体。 其余的卤代烃是液体或固体。 一元卤代烃的沸点随着碳原子数目的增加而升高。 一元卤代烃的沸点随着碳原子数目的增加而升高。 在同碳原子的一元卤代烷中,碘烷的沸点最高, 在同碳原子的一元卤代烷中,碘烷的沸点最高, 氯烷的沸点最低。 氯烷的沸点最低。 卤代烷的密度大多大于1 卤代烷的密度大多大于1。 卤代烷不溶于水,溶于醇和醚等有机溶剂。 卤代烷不溶于水,溶于醇和醚等有机溶剂。
CH3 CH3CH2-C-CH3 Br
KOH, 乙醇
CH3C;
CH3CH2CH=CH2
29%
32
消除反应历程
单分子消除(El) 双分子消除(E2) (1)单分子消除反应历程- El 反应分两步完成
(CH3)3CBr
CH3 C+ CH2 H
慢
(CH3)3C + Br+
快
CH3
27
SN2 历程反应的活性次序
α−C原子上的烃基越多,进攻的空间阻碍越大, 反应速度越慢;烷基具有斥电子性,α−C原子上 的烷基越多,该碳原子上的电子云密度也越大, 越不利于亲核试剂的进攻,反应速度越慢。
CH- CH3-X > RCH2-X > R2CH-X > R3C-X
28
SN1和SN2 历程反应的活性次序
29
反应与S SN1反应与SN2反应的区别
SN1 单分子反应 V = K [ R-X ] 两步反应 有中间体碳正离子生成 构型翻转 + 构型保持 有重排产物
30
SN2 双分子反应 V = K [ R-X ] [ Nu:] 一步反应 形成过渡态 构型翻转(瓦尔登转化) 无重排产物
(二)卤代烷烃的消除反应
具有β 的卤代烷和氢氧化钠或氢氧化钾的乙醇溶液共热时, 具有β-H的卤代烷和氢氧化钠或氢氧化钾的乙醇溶液共热时, 卤代烃脱去一分子的卤化氢生成烯烃。 卤代烃脱去一分子的卤化氢生成烯烃。 在这个反应中,卤代烷除失去X 在这个反应中,卤代烷除失去X外,还从β-碳原子上脱去一 还从β 个氢。因此,称其为β 消除反应。 个氢。因此,称其为β-消除反应。
NO2
硝化
HNO3 H2SO4
萘的硝化α -位比β -位快50倍,比苯快750倍
SO3H
60℃
磺化
+ H2SO4
165℃
165℃ H2SO4
SO3H
6
萘环上的定位规则
如萘环上的α位上已有一个第一定位基, 如萘环上的α位上已有一个第一定位基,第二 个取代基进入萘环的4 个取代基进入萘环的4位(多)和2位(少)。
R
X + NH3
ROH
R
NH2 + HX
产物具有亲核性,生成各种取代的胺以及季 铵盐。
RX RX RX
+
RNH2
ROH
R2NH
ROH
R3N
ROH
R4N X
-
使用大过量的氨,可以得到伯胺(RNH2)
19
(一)亲核取代反应
(4)被氰基取代——增长碳链的方法之一
R
R
X + NaCN
CN + H2O
ROH ∆
R-CH-CH2 + NaOH H X
KOH- 醇 R-CH=CH-CH=CH-R + 2NaX + 2H2O
醇
R-CH=CH2 + NaX + H2O
R-CH-CH-CH-CH-R H X X H
31
消除反应的取向
在多数卤代烷中, 在多数卤代烷中,可能有两种以上的氢原子可供 消除反应,生成两种或两种以上的烯烃, 消除反应,生成两种或两种以上的烯烃,即存在 着反应的取向问题。 着反应的取向问题。 氢原子主要上从含氢较少的碳原子上脱去, 氢原子主要上从含氢较少的碳原子上脱去,生成 双键碳原子上连有最多烃基的烯烃。 双键碳原子上连有最多烃基的烯烃。这一规律称 查依采夫规则。 为查依采夫规则。
10
卤代烃的种类
(1)卤代烷 R-X R:1°、2°、3° CH3CH2CH2CH2I (2) 卤代烯(炔)烃 CH2=CHCl CH3C≡CCl BrCH2CH=CHCH2Br F2C=CF2 (3) 卤代芳烃
HNO3 H2SO4
CH3
CH3
+ 主
NO2
NO2
少
2
萘环上的定位规则
如萘环上β位有第一类定位基,第二个取代基主要进入1 如萘环上β位有第一类定位基,第二个取代基主要进入1位。
NO2 CH3
HNO3 H2SO4 75% H2SO4
CH3
2-甲基-1-硝基萘
CH3 例外情况
80%
HO3S
如萘环上α 位上有第二类定位基, 如萘环上 α 或 β 位上有第二类定位基 , 第二个取代基主要进入另一个苯环 的5、8位。
H+ ∆
R
CN + NaX
RCOOH
(5)被硝酸根取代
R X + AgNO3 ROH R ONO2 + AgX
此反应可用于卤代烷的定性鉴定。
20
卤代烷的亲核取代反应历程
单分子亲核取代SN1 双分子亲核取代SN2 1.单分子亲核取代历程 1.单分子亲核取代历程—SN1 单分子亲核取代历程 叔丁基溴在氢氧化钠水溶液中的水解反应速度仅与 叔丁基溴的浓度成正比,与亲核试剂OH-的浓度无关, 在动力学上属于一级反应。 υ = k [ (CH3)3 CBr ] 反应分两步完成,第一步是C-Br键断裂生成正碳离子 和溴负离子,第二步是正碳离子和OH-结合生成醇。
+
H H
δ
C H H
25
δ
Br
HO
C H H
+ Br
卤代烷的亲核取代反应历程
H3C H OH
+
H C H Cl [HO C H
C H3 Cl ]
过渡态
C H3 H
构型转化
HO
C H
水解反应速度与卤代烷和亲核试剂的浓度都 有关系,称为SN2取代 S 取代。
26
卤代烷的亲核取代反应历程
SN2反应历程中的能量变化
第六章 芳香烃
2011-10-10
1
萘
1.结构 分子式:C10H8 . 分子式:
α β β
7 6 8
α
1 2β 3β
0.142nm 0.136nm 0.141nm 0.142nm
α
5
α
4
0.136nm
2
CH3
CH3
CH3
1,4-二甲基萘
CH3
1,5-二甲基萘
CH3
1 、6 - 二甲基萘
CH3
3
萘的分子结构
21
卤代烷的亲核取代反应历程
CH3 CH3 C CH3 Br
慢
CH3 CH3 δ+ C CH3 δBr CH3
CH3 C
+
+
Br
CH3
过渡态1
CH3 CH3 C
+
碳正离子
CH3 δOH CH3 C CH3 OH
CH3 + OH 快 CH3 δ+ C CH3
CH3
过渡态2 反应速度仅与叔丁基溴的浓度成正比,与亲核试 剂OH-的浓度无关,称为SN1反应。 22
11
普通命名法
根据卤原子连接的烷基,称为“某基卤”或 “卤(代)某烷”。
CH3Cl
CH3CH2Br
C(CH3)3Cl
Br
甲基氯 乙基溴 (氯甲烷) (溴乙烷)
叔丁基氯 环已基溴 (氯代叔丁烷) (溴代环已烷)
12
系统命名法
选择含有卤原子最长的碳链作为主链,称为 “某烷”;从靠近支链的一端给主链编号,把支 链的位次和名称写在母体名称前,并按次序规则 将较优基团排列在后。
(CH3) CBr + C2H5OH 3
25oC
81%
(CH3)3C
19 %
萘中电子云分布不均匀,α位电子云密度较大, 芳香性比苯差。
4
萘的性质
① 氧化反应 比苯容易
特点
O
+ 9O2
V2O5 + KSO4
385~390℃
C O C O
②
加成反应
Na+ EtOH
1,4-二氢化萘
2H2
Ni
Na+ EtOH
Pd/C
十氢化萘
四氢化萘
5
萘的性质
③ 取代反应
特点
Br
卤代
Br2
100℃
SN1和SN2历程同时并存,相互竞争 SN1增加
H H C X H H H3C C X H H H3C C X CH3 CH3 H3C C X CH3
SN2增加 卤原子对亲核取代反应速度有影响
卤原子半径大小次序为I > Br > Cl,原子半径越大, 可极化性越大,反应活性越大活性次序 R- R- R-I > R-Br > R-Cl
36
取代反应和消除反应的竞争
① 伯卤代烷易发生取代反应,叔卤代烷易发生消除 反应,仲卤代烷则介于二者之间。 试剂的亲核性强( 有利于取代反应, ② 试剂的亲核性强(如CN-)有利于取代反应, 试剂的碱性强而亲核性弱有利于消除反应。 试剂的碱性强而亲核性弱有利于消除反应。 ③ 溶剂的极性强有利于取代反应。 溶剂的极性强有利于取代反应。 ④ 反应的温度升高有利于消除反应 。
俗名或商品名
Cl CHCl 3 CHI 3 CCl 2F2 Cl Cl
Cl Cl Cl
氯仿
碘仿
氟利昂-1,2 六六六(林丹)
15
卤代烃的物理性质
在常温常压下,氯甲烷、氯乙烷和溴甲烷是气体, 在常温常压下,氯甲烷、氯乙烷和溴甲烷是气体, 其余的卤代烃是液体或固体。 其余的卤代烃是液体或固体。 一元卤代烃的沸点随着碳原子数目的增加而升高。 一元卤代烃的沸点随着碳原子数目的增加而升高。 在同碳原子的一元卤代烷中,碘烷的沸点最高, 在同碳原子的一元卤代烷中,碘烷的沸点最高, 氯烷的沸点最低。 氯烷的沸点最低。 卤代烷的密度大多大于1 卤代烷的密度大多大于1。 卤代烷不溶于水,溶于醇和醚等有机溶剂。 卤代烷不溶于水,溶于醇和醚等有机溶剂。
CH3 CH3CH2-C-CH3 Br
KOH, 乙醇
CH3C;
CH3CH2CH=CH2
29%
32
消除反应历程
单分子消除(El) 双分子消除(E2) (1)单分子消除反应历程- El 反应分两步完成
(CH3)3CBr
CH3 C+ CH2 H
慢
(CH3)3C + Br+
快
CH3
27
SN2 历程反应的活性次序
α−C原子上的烃基越多,进攻的空间阻碍越大, 反应速度越慢;烷基具有斥电子性,α−C原子上 的烷基越多,该碳原子上的电子云密度也越大, 越不利于亲核试剂的进攻,反应速度越慢。
CH- CH3-X > RCH2-X > R2CH-X > R3C-X
28
SN1和SN2 历程反应的活性次序
29
反应与S SN1反应与SN2反应的区别
SN1 单分子反应 V = K [ R-X ] 两步反应 有中间体碳正离子生成 构型翻转 + 构型保持 有重排产物
30
SN2 双分子反应 V = K [ R-X ] [ Nu:] 一步反应 形成过渡态 构型翻转(瓦尔登转化) 无重排产物
(二)卤代烷烃的消除反应
具有β 的卤代烷和氢氧化钠或氢氧化钾的乙醇溶液共热时, 具有β-H的卤代烷和氢氧化钠或氢氧化钾的乙醇溶液共热时, 卤代烃脱去一分子的卤化氢生成烯烃。 卤代烃脱去一分子的卤化氢生成烯烃。 在这个反应中,卤代烷除失去X 在这个反应中,卤代烷除失去X外,还从β-碳原子上脱去一 还从β 个氢。因此,称其为β 消除反应。 个氢。因此,称其为β-消除反应。
NO2
硝化
HNO3 H2SO4
萘的硝化α -位比β -位快50倍,比苯快750倍
SO3H
60℃
磺化
+ H2SO4
165℃
165℃ H2SO4
SO3H
6
萘环上的定位规则
如萘环上的α位上已有一个第一定位基, 如萘环上的α位上已有一个第一定位基,第二 个取代基进入萘环的4 个取代基进入萘环的4位(多)和2位(少)。
R
X + NH3
ROH
R
NH2 + HX
产物具有亲核性,生成各种取代的胺以及季 铵盐。
RX RX RX
+
RNH2
ROH
R2NH
ROH
R3N
ROH
R4N X
-
使用大过量的氨,可以得到伯胺(RNH2)
19
(一)亲核取代反应
(4)被氰基取代——增长碳链的方法之一
R
R
X + NaCN
CN + H2O
ROH ∆
R-CH-CH2 + NaOH H X
KOH- 醇 R-CH=CH-CH=CH-R + 2NaX + 2H2O
醇
R-CH=CH2 + NaX + H2O
R-CH-CH-CH-CH-R H X X H
31
消除反应的取向
在多数卤代烷中, 在多数卤代烷中,可能有两种以上的氢原子可供 消除反应,生成两种或两种以上的烯烃, 消除反应,生成两种或两种以上的烯烃,即存在 着反应的取向问题。 着反应的取向问题。 氢原子主要上从含氢较少的碳原子上脱去, 氢原子主要上从含氢较少的碳原子上脱去,生成 双键碳原子上连有最多烃基的烯烃。 双键碳原子上连有最多烃基的烯烃。这一规律称 查依采夫规则。 为查依采夫规则。
10
卤代烃的种类
(1)卤代烷 R-X R:1°、2°、3° CH3CH2CH2CH2I (2) 卤代烯(炔)烃 CH2=CHCl CH3C≡CCl BrCH2CH=CHCH2Br F2C=CF2 (3) 卤代芳烃
