第7章卤代烃
《邢其毅 基础有机化学 第3版 上册 笔记和课后习题 含考》读书笔记思维导图

思维导图PPT模板
本书关键字分析思维导图
习题
有机化学
考生
基础
考研
邢其毅
内容
真题
笔记
复习 教材
知识
名校
第版
免费
参考书目 书
命题
电子书
01 第1章 绪论
目录
02 第2章 有机化合物的 分类 表示方式命名
13.1 复习笔记
13.3 名校考研真 题详解
读书笔记
谢谢观看
4.1 复习笔记
4.3 名校考研真题 详解
第5章 紫外光谱 红外光谱 核磁 共振和质...
5.2 课后习题详解
5.1 复习笔记
5.3 名校考研真题 详解
第6章 脂肪族饱和碳原子上的亲 核取代反应...
6.2 课后习题详解
6.1 复习笔记
6.3 名校考研真题 详解
第7章 卤代烃 有机金属化合物
10.1 复习笔记
10.3 名校考研真 题详解
第11章 苯和芳香烃 芳香亲电取 代反应
11.2 课后习题详 解
11.1 复习笔记
11.3 名校考研真 题详解
第12章 醛和酮 亲核加成 共轭 加成
12.2 课后习题详 解
12.1 复习笔记
12.3 名校考研真 题详解
第13章 羧酸
13.2 课后习题详 解
目录
011 第11章 苯和芳香烃 芳香亲电取代反应
013 第13章 羧酸
012
第12章 醛和酮 亲核 加成 共轭加成
本书特别适用于参加研究生入学考试指定考研参考书目为邢其毅《基础有机化学》(第3版)(上册)的考 生。也可供各大院校学习邢其毅《基础有机化学》(第3版)(上册)的师生参考。《邢其毅主编的《基础有机化 学》(第3版)是我国高校化学类广泛采用的权威教材之一,也被众多高校(包括科研机构)指定为考研考博专业 课参考书目。为了帮助参加研究生入学考试指定参考书目为邢其毅主编的《基础有机化学》(第3版)的考生复习 专业课,我们根据该教材的教学大纲和名校考研真题的命题规律精心编写了邢其毅《基础有机化学》(第3版)辅 导用书(均提供免费下载,免费升级):1.[3D电子书]邢其毅《基础有机化学》(第3版)(上册)笔记和课后 习题(含考研真题)详解[免费下载]2.[3D电子书]邢其毅《基础有机化学》(第3版)(下册)笔记和课后习题 (含考研真题)详解[免费下载]3.[3D电子书]邢其毅《基础有机化学》(第3版)(上册)配套题库【名校考研 真题+课后习题+章节题库+模拟试题】[免费下载]4.[3D电子书]邢其毅《基础有机化学》(第3版)(下册)配 套题库【名校考研真题+课后习题+章节题库+模拟试题】[免费下载]本书是邢其毅主编的《基础有机化学》(第3 版)的配套e书,主要包括以下内容:(1)梳理知识脉络,浓缩学科精华。本书每章的复习笔记均对该章的重难 点进行了整理,并参考了国内名校名师讲授该教材的课堂笔记。因此,本书的内容几乎浓缩了该教材的所有知识 精华。(2)详解课后习题,巩固重点难点。本书参考大量相关辅导资料,对邢其毅主编的《基础有机化学》(第 3版)的课后思考题进行了详细的分析和解答,并对相关重要知识点进行了延伸和归纳。(3)精编考研真题,培 养解题思路。本书精选详析了部分名校近年来的相关考研真题,这些高校均以该教材作为考研参考书目。所选考
第7章 卤代烃-SN1、SN2亲核取代

带部分正电荷,易 被带负电荷或带孤 对电子的分子进攻
(一)亲核取代反应 SN
Nucleophilic substitution
δδδ+
δδ+
δ+
δ-
CH3
Substrate
CH2
CH2 Nu:
Cl
Cl-
Leaving group 离去基团
底物
特点:
Nucleophile
亲核试剂
带负电荷或 孤对电子
诱导效应可沿共价键在碳链上传递,随着距离的增加
而迅速减弱,一般通过三根单键以后,已基本消失 。
与C-H键相比
H H
Cg
ddd+
H
C
b
dd+
H C
d+
a
Cl
极性共价键
d-
H
H
H
三、化学性质
诱导效应,易 断裂,“消除” d+ d- X吸电子,且C-X键键 能较小(C-F除外), 易断裂,且生成的X-更 稳定。X被“取代”
CH2
CH
CH 2Cl
3-氯-1-丙烯
CH2
CH
CH
CH3
CH2 Cl
3-甲基- 4 -氯-1-丁烯
二、结构(structure)
卤代烷中所有的键都是 σ 键,碳原子为 sp3 杂化, C-X 共价键为极性键。
H
H
ห้องสมุดไป่ตู้
d+
C
d-
X
C-F 139pm
C-H 110pm
H
C-Cl 176pm
C-Br 194pm C-I 214pm
C
O-
• 5)中心原子为同种元素,受溶剂影响较大
第七章卤代烃

CH3CH2OH + HBr
在一般情况下,此反应很慢。为增大反应速率,提高醇的产 率,常加入强碱(氢氧化钠),使生成的HX与强碱反应,可 加速反应并提高了醇的产率。
CH3CH2Br + NaOH
CH3CH2OH + NaBr
• 此反应工业用途不大,因卤烷在工业上是由醇制取,但可用 于有机合成中官能团的转化。用于复杂分子中引入羟基(先 卤代,再水解)。
醇 R-X + AgNO3
R-O NO2 + AgX 硝酸酯
反应通式如下:
R - L + :Nu RCH2X + -OH 反应物 亲核试剂 (底物) 进攻基团
R - Nu + L-
RCH2-OH + X-
产物
离去基团
1. 卤烃的水解
• 卤代烷与水作用,水解为醇,反应是可逆反应。如:
CH3CH2Br + H2O
• 查依采夫规则: • 卤代烷脱HX时,总是从含H较少的碳上脱去H原子。
Saytzeff规则应用
CH3
CH3
KOH / 醇
CH3 CH C CH2
CH3 CH C CH3 71%
CH3
H Br H
CH3 CH2 C CH2 29%
• Saytzeff规则的实质上是生成一个较稳定的烯烃。
• 总是要生成共轭效果较好的结构(较稳定)。如:
•而仲卤烃和叔卤烃在碱(氰化钠、氰化钾)的作用
下易发生消除反应,生成烯烃,此反应一般不用仲、 叔卤烃反应。
•产物腈还可转化为胺、酰胺和羧酸。
4. 卤烃的氨解
• 此反应既可用氨反应,也可用氨的衍生物反应,来 制取伯、仲、叔胺。
有机化学-卤代烃

(4)被硝酸根取代
RX + AAgg+NOONO32— 醇
R ONO2 + AgX
硝酸酯
•卤化银沉淀产生,反应可作为卤代烃的鉴别反应。
卤代烃反应活性: 烯丙基卤>叔卤代烃>仲~>伯~
(5)卤素交换
丙酮
R-Br(Cl) + KI
R-I + NaBr(Cl)
难溶于丙酮
难溶于丙酮
(6)被氨基(-NH2)取代
三、命名
普通命名法 俗名 系统命名法
1.普通命名法
在烃基名称之前(或后)加上卤素的名 称,称为卤(代)某烃或某烃基卤。
CHCl3
三氯甲烷 氯 仿 (俗名)
C2H5Cl
氯乙烷 乙基氯
(CH3)3CBr
叔丁基溴
CH2=CHBr 溴乙烯
H2C CH CH2 烯丙基溴
Br
Br
溴苯
CH3
Br
邻-溴甲苯(2-溴甲苯) 2-bromotoluene
3-甲基-5-氯庚烷 3-chloro-5-methylheptane
H2C C CH3
Cl
2-氯丙烯 2-chloro-propene
CH3CH CHCH2Cl
1-氯-2-丁烯 1-chloro-2-butene
H37C
CH
6
CH
5
C4H2
CH
3
CH
2
C1H3
CH3 I
Cl CH3
2,6-二甲基-3-氯-5-碘庚烷
•(一) 亲核试剂:具有孤对电子的物质, 能与底物中带部分正电荷的碳发生反应, 这 种 物 质 称 为 亲 核 试 剂 。 ( 也 是 Lewis 碱)。
卤代烃

第五章卤代烃一、学习要求1、理解卤代烃的概念、分类,掌握卤代烃的命名。
2、掌握卤代烃的结构和化学性质。
3、了解卤代烃亲核取代反应、消除反应的机制和两种反应的关系。
4、了解有机氟化物的基本特点和一些氟代烷在医药及其它方面的应用。
二、本章要点(一)卤代烃的定义、分类卤代烃(halohydrocarbon)是烃分子中一个或多个氢原子被卤原子取代所生成的化合物,用通式RX(X=F、Cl、Br、I)表示。
(二)卤代烃的命名卤代烃常用系统命名法命名,即以X作取代基,相应的烃作母体,书写形式与烃相同。
简单卤代烃也可采取普通命名法,即卤素名+ 烃的名称或烃基名+ 卤素名。
(三)卤代烃的结构卤代烃的结构特点是碳卤键具有极性Cδ+-Xδ-,α-C带部分正电荷。
(四)卤代烃的化学性质1、卤代烷的化学性质带部分正电荷的α-C易受亲核试剂的进攻而发生亲核取代反应;X的-I效应使β-H酸性增强,可与强碱发生消除反应。
(1)亲核取代反应:α-C受亲核试剂的进攻,X带着一对电子离去,亲核试剂取代X的位置,生成各种取代物。
常见的亲核试剂有-OH、-OR、-CN、NH3、-ONO2等。
亲核取代反应的机制有S N1、S N2两种,反应按何种机制进行,影响因素有烷基的结构、试剂的亲核性、溶剂的极性、离去基团的离去能力等。
(2)消除反应:卤代烷的β-H与碱作用,最终X和β-H从分子中脱去,发生消除反应。
当仲卤代烷或叔卤代烷有不同类型的β-H时,产物取向遵循Saytzeff(查依切夫)规则,即消除反应的主产物是双键碳原子上连烃基最多的烯烃或对称性最好的烯烃。
消除反应也有两种机制,即E 1、E 2。
反应机制同样受反应条件的影响。
(3)亲核取代反应和消除反应的关系:亲核取代反应和消除反应往往同时发生,相互竞争。
发生S N 1的条件也有利于E 1发生;发生S N 2的条件也有利于E 2发生。
同一卤代烷按不同机制进行反应生成产物的比例由烷基的结构、溶剂的极性、试剂的亲核性和碱性、反应的温度所决定。
《有机化学-结构和性质相关分析与功能》第三版_课本答案全

4.π键的成键方式:成键两原子的p轨道沿着与连接两个原子的轴垂直的方向“肩并肩”重叠而形成。π键特点:①电子云平面对称;②与σ键相比,其轨道重叠程度小,对外暴露的态势大,因而π键的可极化度大,在化学反应中易受到亲电试剂的进攻而发生共价键的异裂;③由于总是与σ键一起形成双键或叁键,所以其成键方式必然限制σ键单键的相对旋转。
思路3见第六章
第五章旋光异构
问题五参考答案
5-1
5-2(3)代表图4-5中乳酸(B)的构型。
习题五参考答案
1.(1)旋光性:使偏振光振动平面发生旋转的性质。
(2)比旋光度:一定波长和一定温度下,测得单位浓度、单位盛液管长度某物质的旋光度。
(3)手性:实物和镜像不能完全重合的特征。
(4)手性碳原子:连有不相同的四个原子或基团的饱和碳原子。
7-4由于硝基是极强的致钝间位定位基,所以2,4-二硝基苯酚和2,4,6-三硝基苯酚与大多数的酚不同,其酸性比碳酸强,所以能溶于碳酸氢钠水溶液。
7-5得到的仲丁醇构型与原料相同。因为该反应机理为SN2,空间位阻小反应活性大的CH3—O键异裂,生成溴甲烷,不涉及O—CH(CH3)CH2CH3的断裂,所以仲丁醇构型构型不变。
(6) 2-甲基-3-异丙基-1,4-萘醌(7) 3-(4-甲基苯基)-2-丁酮
4.*无机试剂和一个碳的有机试剂任选(溶剂例外)
或
(5)用(1)的中间产物和最终产物合成
5.能发生碘仿反应的是:(2) (4) (5) (8) (10);
能与NaHSO3加成的是:(1) (6) (8) (9) (10);
5.(1) (2) (5)易溶于水;(5) (4) (6)难溶于水。
(有机化学课件)第七章 卤代烃

(3) 隔离型卤代烃
卤原子与碳碳重键或苯环相 隔两个或多个饱和碳原子,与 一般卤代烷性质接近。
7.2 卤代烃的命名
普通命名法
简单卤代烃的命名,一般是由烃基的名称加上卤原子的名称而成。
反应
Cl CH2 CH2 OH
Ca(OH)2
CH2 CH2 O
机理
Cl CH2 CH2 OH
HO– – H2O
Cl CH2 CH2 O-
分子内类SN2
CH2 CH2 O
邻基参与 例2
H2O
CH3CH2 S CH2CH2Cl k
CH3CH2 S CH2CH2OH
H2O
CH3CH2 CH2 CH2CH2Cl
亲核试剂的进攻与离去基团的离去同时发生; Nu从L的背后沿着C-L键轴线进攻中心C原子; 中心C原子为手性时,发生Walden 转化,即构型反转。
SN2反应的立体化学特征
SN2反应的立体化学特征为中心C原子的构型反转。
(S)–2–碘辛烷
(R)–2–碘(128I)辛烷
7.6.2 单分子亲核取代反应(SN1)机理
亲核取代反应 (II)
(3) 与氰化钠作用
(4) 与氨作用
C2H5OH (CH3)2CHCH2Cl + 2 NH3
110 oC, 3 h, 84%
(5) 卤离子的交换反应
(CH3)2CHCH2NH2 + NH4Cl 异丁胺
CH3CH CH3 + NaI Br
丙酮 室温
CH3CH CH3 + NaBr I 63%
大学《有机化学》课后习题答案

第一章绪论2. (1) (2) (5)易溶于水;(3) (4) (6)难溶于水。
4.80*45%/12=3 80*7.5%/1=6 80*47.5%/19=2 C3H6F2第二章有机化合物的结构本质及构性关系1.(1) sp3(2) sp (3) sp2(4) sp (5) sp3(6)sp2第四章开链烃1.(1) 2-甲基-4,5-二乙基庚烷(2) 3-甲基戊烷(3) 2,4-二甲基-3-乙基戊烷(4) (顺)-3-甲基-3-己烯or Z-3-甲基-3-己烯(12) 3-甲基-1-庚烯-5-炔2.7.11.14. (5) > (3) > (2) >(1) > (4) 即: CH 2=CHC +HCH 3 >(CH3)3C +>CH 3CH 2C +HCH 3 >CH 3CH 2CH 2C +H 2> (CH 3)2CHC +H 216. (1)(2)(3)17.21AB.10.(1)CH 3-CH=CH 2−−−−−→−+H /KMnO 4CH 3COOH(2)CH 3-C ≡CH+HBr (2mol ) CH 3CBr 2CH 3(3)CH 3-C ≡3-C=CH 2−−→−2Br CH 3CBr 2CH 2Br Br第四章 环 烃 2.1-戊烯 1-戊炔 戊 烷Br 2/CCl 4室温,避光√ 溴褪色√ 溴褪色× × √灰白色1-丁炔 2-丁炔 丁 烷Br 2/CCl 4 室温,避光√溴褪色 × Ag(NH 3)2+√灰白色↓ × × 1,3-丁二烯 1-己炔 2,3-二甲基丁烷Br 2/CCl 4√ 溴褪色 √ 溴褪色 × Ag(NH 3)2+×√ 灰白色↓C(CH 3)3CH 3(1)(2)(3)3.(1)反式CH 3Br(3)顺式4.C H 3B rC lC l +C l C lC O O HH 3CO 2N (C H 3)3C C O O H(1)(2)(3)(4)(5)(6)(7) B rC 2H 5C 2H 5B r +C H 3C O C H 3(C H 3)2C C H (C H 3)2B r(8) 1molCl 2 / h , 苯/无水AlCl 3N H C O C H 3N O 2C H 3C H 3S O 3H (9) (10)7. (2)有芳香性 10.第六章 旋光异构6-32. (1)× (2)× (3)× (4)√ (5)√ (6)√7.2.66120678.58.18][20+=⨯÷+=⨯=l c Dαα第七章 卤 代 烃2、C l C lC l (2)4、第八章 醇、酚、醚1. (1) 3-甲基-3-戊烯-1-醇 (2) 2-甲基苯酚 (3) 2,5-庚二醇 (4) 4-苯基-2-戊醇 (5) 2-溴-1-丙醇 (6) 1-苯基乙醇(7) 2-硝基-1-萘酚 (8) 3-甲氧基苯甲 (9) 1,2-二乙氧基乙烷(乙二醇二乙醚)(1)(2)3、4. (1) 甲醇 分子间氢键 (6) 邻硝基苯酚 分子内氢键、分子间氢键 5、(1)CH 2IH 3COOH(5)(6)HOOCH 3H(7)6、AgNO 3/乙醇,室温白↓× ×AgNO 3/乙醇,加热白↓×OH+OHBrBr(1)(2)10、OH O ClA B C D第九章醛、酮、醌一、命名下列化合物。
第七章 卤代烷1-每页4片

不饱和卤代烃 Cl CH2=CHBr 溴乙烯 Cl 3-氯环己烯
一元卤代烃
CH2=C-CH=CH2 2-氯1,3-丁二烯
F2C=CF2 四氟乙烯
多元卤代烃
伯
1
卤代烯烃 R-CH=CH-X R-CH=CH-CH2-X 乙烯型 烯丙型
CH2=CHCl
CH2=CHCH2Cl 3- 氯丙烯
二. 卤代烃的命名
91%
CH2CH3
卤原子连在芳烃侧链上的,常以脂肪烃(烷烃、烯 烃)为母体,卤原子和芳环作为取代基
α
Br, 光 100%
CHCH3 Br
CH=CHBr
β
β -溴代苯乙烯
烯烃α-H的高温卤代
2. 不饱和烃的加成
3. 氯甲基化反应、芳烃的亲电取代
CH2Cl + 70% CH2Cl CH2Cl + H2O
R-X + Nu亲核试剂
δ
R-Nu + X离去基团
反应物 底物
① 分子中C—X 键为极性共价键,碳带部分正电荷,易受 带正电荷或孤电子对的试剂的进攻。 ②分子中C—X 键的键能(C—F除外)都比C—H键小。 键 C—H C—Cl C—Br C—I 键能KJ/mol 414 339 285 218 C—X 键比C—H键容易断裂。
第七章
卤代烃(1)
一. 卤代烃类型
卤代烃通式: 主要内容
n n n
R
X ( X = F, Cl, Br, I)
卤代烷的类型和命名 卤代烷的亲核取代,取代产物的类型 亲核取代反应的两种机理——SN1和SN2机理, 两种机理在反应动力学和立体化学上的不同之处 碳正离子,碳正离子的稳定性,碳正离子的重排
R Cl , R Br , R I 性质接近 通常总称卤代烷 通常总称卤代烷
《有机化学》(第四版)第七章 卤代烃(习题答案)

第七章卤代烃相转移催化反应邻基效应思考题P235 习题7.1 用普通命名法命名下列各化合物,并指出它们属于伯、仲、叔卤代烷中的哪一种。
(1) (CH3)3CCH2Cl (2) CH3CH2CHFCH3(3) CH2=CHCH2Br解:(1) 新戊基氯(伯卤代烷) (2) 仲丁基氟(仲卤代烷) (3) 烯丙基氯(伯卤代烷) 习题7.2 用系统命名法命名下列各化合物,或写出结构式。
(1)CH3CHCHCH2CHCH3CH3CH3Cl2,3-二甲基-5-氯己烷(2)CH3CHCH2C CHCH3CH3ClClCl2-甲基-3,3,5-三氯己烷(3) BrCH2CH2CHCH2CH2CH3C2H53-乙基 -1-溴己烷(4) CH3CH2CHCH2CH3CH2Cl3-氯甲基戊烷(5) Cl1-环戊基-2-氯乙烷或 氯乙基环戊烷(6)CH3Cl1-甲基-1-氯环己烷(7) CH3CH3CH2Cl1,1-二甲基-2-氯甲基环戊烷(8)Cl1-氯双环[2.2.1]庚烷(9)CH 3CH CH 2CH 2BrCH 3异戊基溴 (10)CH 3CH 2CH 2CH 3H Br(R)-2-溴戊烷P236 习题7.3 命名下列各化合物:(1) Cl 2CHCH=CH 23,3-二氯-1-丙烯(2) CH 3CHCH=CHCH 3Cl4-氯-2-戊烯(3)CH 3Br1-甲基-4-溴-2-环戊烯(4)BrCl 1-氯-4-溴苯(5)CH=CHCH 2CH 2Br 1-苯-4-溴-1-丁烯(6)CH 2CH=CH 2ClBr2-氯-4-溴烯丙基苯3-(2-氯-4-溴苯基)-1-丙烯P236 习题7.4 写出下列各化合物的构造式或结构式:(1)4-溴-1-丁烯-3-炔CH 2=CH C CBr(2) 反-1,2-二氯-1,2-二苯乙烯C=C Cl ClPhPh(3)对氯叔丁苯ClC(CH 3)3(4)-溴 代乙苯CHCH 3BrP239 习题7.5 试预测下列各对化合物哪一个沸点较高。
第七章 有机金属化合物

3. 卤代烷的构象
在气相中,对交叉构象比邻交叉构象稳定 5kJ· mol-1,而在液相中两种构象稳定性接近相等。因为,在气相中,偶极矩间的排斥力占主导地位,故 对位交叉构象稳定;而在液相中,由于其它分子的接近而降低了分子内偶极矩的排斥力,这时两种构象稳定性接近相等。
4. 卤代烷的物理性质
4 个碳以下的氟代烷两个碳以下的氯代烷以及溴甲烷是气体,一般卤代烷为液态,高级的为固体。 四氟甲烷与甲烷相对分子质量相差很大,而沸点却较接近。六氟乙烷沸点与乙烷沸点更接近。如形成稳定的全氟化物,其沸点与相应的烷烃接
( 4)卤仿的分解反应 :氯仿遇空气或日光分解成剧毒光气的反应,所以通常要将氯仿储存在棕色瓶中,储存时要加入 1%的乙醇以破坏已生成的光 气。
二卤代烃水解产生醛,三卤代烃水解产生酸(卤仿反应)
6. 有机金属化合物
( 1)命名 1)在金属名称之前,加相应的有机基团 2)看作硼烷( Borane) 、硅烷(Silane) 、锡烷(Stannane)等 的衍生物 3)还可与无机原子相连,看作带有机基团的无机盐。 ( 2)结构 1)碳与金属形成具有离子性的键。碱金属 K、Na、 Li 与碳的电负性差值在 1.5 个单位以上,同时碱金属用于成键的轨道高度扩散,与碳原子 的成键轨道不能有效重叠,因此形成的键是离子性的,具有类盐的性质。 2)碳与第Ⅱ A、Ⅲ A 族原子 Mg、B、 Al 等形成具有极性的共价键 ——三中心两电子键(这些金属按正常方法成键后,金属周围不足 8 电子构
( 6)卤代烃与有机金属化合物的偶联反应 有机金属化合物中的烃基带有负电性,具有很强的亲核性和碱性。作为一个碱性试剂,它能与含有活泼氢的化合物发生酸碱反应,也可以 使三级卤代烃发生消除反应。
卤代烃与金属有机化合物的偶联反应 通过亲核取代机理完成(生成 AgX 的反应一般都是 S N1 机理) 。格氏试剂、烷基锂试剂很容易与三级 卤代烃、烯丙型、苯甲型发生偶联反应,所以这类反应要严格控制低温进行。而格氏试剂与一级、二级卤代烃的偶联反应需要在零价钯催化下 才能发生。 二烃基铜锂与卤代烃的偶联反应 : 卤代烃中的烃基可以是一级、二级烷基,也可以是乙烯基,芳基、烯丙基和芳甲基,二烃基铜锂中的烃基可以是一级烷基,也可以是其他
7 卤代烃

7 卤代烃本章要点:卤代烃的取代反应;卤代烃的消除反应;亲核取代反应机理、消除反应机理,竞争反应;亲核取代反应和消除反应的立体化学。
一、卤代烃的基本概念1,卤代烃的分类⑴按烃基分类①卤原子与饱和碳原子连接;卤原子连接在饱和碳原子上的卤代烃一级卤代烃(伯卤代烃):碳原子上连有一个烃基;二级卤代烃(仲卤代烃):碳原子上连有两个烃基;三级卤代烃(叔卤代烃):碳原子上连有三个烃基。
②卤原子与不饱和碳原子连接:卤代烯烃与卤代苯,卤原子连接在不饱和碳原子上。
③卤原子与烯丙基、苄基连接:烯丙基卤代烃与卤苄,卤原子连接在不饱和碳原子的邻位饱和碳原子上。
⑵按卤原子分类氯代烃、溴代烃、碘代烃等。
2,卤代烃的命名两种观点⑴ 以含有卤原子的最长碳链为主链;⑵ 选择最长碳链时不考虑是否含有卤原子;CH 3CH 22CH 3CH 2Cl3-氯甲基戊烷or 。
2—乙基—1-氯丁烷 3-(chloromethyl )pentane系统法命名时,卤原子总是取代基,不视为官能团;习惯法命名时,有时视卤原子为官能团,如叔丁基氯等。
Cl 氯(代)苄 or 苄基氯3,碳-卤键的结构特征⑴碳-卤键的极性: C Cl CF C Br C I > > > C X δ+δ- ×10—30C •m 6.472 6。
072 5.971 5。
471⑵卤原子电负性大,碳卤键是极性键,α-碳原子上带有部分正电荷,容易受到给电子试剂作用,发生亲核反应。
二、卤代烃的性质—化学反应1,取代反应卤原子被其它原子或原子团取代的主要反应有⑴ 羟基取代卤原子(水解反应,卤原子转换成羟基,一种制备醇的方法) R X +H 2O/OH R OH +X 碱性水溶液中反应,活泼卤代烃(叔卤代烃、烯丙式卤代烃、苄卤代烃)容易反应。
CH 3CH 2Cl +H 2O/NaOH CH 3CH 2OH(CH 3)3C Cl +H 2O/Na 2CO 3(CH 3)3C OH CH 2Cl +H 2O/Na 2CO 3CH 2OH⑵ 烷氧基取代卤原子(醇解反应,卤原子转换成烃氧基,制备醚的方法)R X +R O R /+R /ONaNaX R /OH 反应称为Williamson 缩合,引入烃氧基的试剂通常是醇钠,醇钠是强有机碱,也是有效的亲核试剂.醇解反应是制备混合醚的重要方法,醚的两个烃基分布来自于醇(醇钠)和卤代烃。
7第七章 卤代烃

(70%)
+ NaI
制备醚的常用方法——Williamson 合成法 制备醚的常用方法 RX: 伯卤代烷 反应活性: 反应活性:RI > RBr > RCl > RF
(3) 与 氰化钠作用 NaCN, KCN
X CN 腈
NC(CH2)5CN + 2KBr
(4) 与氨作用 X NH2 胺 NH3
C2H5OH (CH3)2CHCH2Cl + 2NH3 △
苄基氯 苄基氯 (benzyl chloride)
2、系统命名法 、
复杂的卤代烃 烃基作为母体 卤原子作为取代基。 母体, 烃基作为母体,卤原子作为取代基。
2-甲基 氯丁烷 甲基-3-氯丁烷 甲基 2-chloro-3-methylbutane
Br CH3
Cl Br F Cl CH3 CH3-CH2-CH2-C-CH-CH-CH3 CH3-CH-CH-CH3 CH(CH3)2
O + O NBr
CCl4, 回流
Br + (80%)
O NH O
CH3 + Br2 Cl
h υ
98%
CH2Br + HBr Cl
二、由不饱和烃制备
CH3CH2C CCH2CH3 + Br2
CH3COOH
CH3CH2 Br
C
C
Br CH2CH3
三、由醇制备
OH + HBr
回流6h
Br + H2O (74%)
R X + AgNO3
反应活性: 反应活性:
C2H5OH
R O NO2 + AgX
硝酸酯
RX: RI > RBr > RCl 3° > 2° > 1° ° ° °
大学《有机化学》课后习题答案

第一章绪论2. (1) (2) (5) 易溶于水;(3) (4) (6) 难溶于水。
4.80*45%/12=3 80*7.5%/1=6 80*47.5%/19=2 C 3H6F2第二章有机化合物的结构本质及构性关系1. (1) sp 3(2) sp (3) sp 2 (4) sp (5) sp 3 (6)sp2第四章开链烃1. (1) 2- 甲基-4,5- 二乙基庚烷(2) 3- 甲基戊烷(3) 2,4- 二甲基-3- 乙基戊烷(4) ( 顺)-3- 甲基-3- 己烯or Z-3- 甲基-3- 己烯(12) 3- 甲基-1- 庚烯-5- 炔2.CH3(1)CH3CH2CH C H (CH2)4CH3 (2) (CH3)2CHCH2CH2CH3C2H5CH3C H3(3) (CH3)2CHC CH(CH3)2 (4) CH3CH2CH C(CH2)3CH3C2H5 (5) (CH3)2CHC CH(CH2)3CH3C2H5H3C(6) C CHHCH2CH2CH3H3C CH2CH3(7) (8) (CH3)2CHC C C CCH(CH3)2C CH CH3(9)H3CC CCH2 CHC CH HHCH3H5C2 C2H5(1 0) C CH3CCH37.(1)Br BrBr H HCl Cl H(2) (3)HBrH H H HH HBrBr11.(1) CH3CHCH2CH2CH3 (2) (CH3)2CCH2CH3Br BrCH3(3) (CH3)2CCH( C H3)2(4) C H3CH2CC2H5BrBr 12.(1) (2) CH3CH2CH2CH3 (3) CH3CHCH2CH3(CH3)2CCH2CH3ClOHH3C (4) CH3COOH + C OH3C (5) C H3CH2CHCH3OSO3HOC H3CH2CHCH3OH(6) CH3CH2CH2CBr2C H3 (7)C H3CCH2CH3Br(8) ( C H3)2CCH CH2 + (CH3)2C CH C H2BrCH CH2CHO (9) ( CH2C CH C H2 ) n (10)+ ( CH2 C ) nClCl14. (5) >(3) >(2) >(1) >(4) 即:+HCH + CH2=CHC 3 >(CH3) 3C+HCH +H +H>CH3CH2C 3 >CH3CH2CH2C 2>(CH3) 2CHC216. (1)1-戊烯√溴褪色+ ×Ag(NH 3)21-戊炔B r 2/CCl 4室温,避光√溴褪色√灰白色戊烷×(2)1-丁炔+Ag(NH 3)2√灰白色↓√溴褪色Br2/CCl 42-丁炔×室温,避光×丁烷×(3)1,3-丁二烯√溴褪色+ ×Ag(NH 3)2Br2/CCl 4 1-己炔√溴褪色√灰白色↓2,3-二甲基丁烷×17.(2)H2OCH CH [CH2 CHOH]H2SO4,H g SO4C H3CHO21 A B.10.(1)CH3-CH=CH2KMnO / H4 CH3COOH(2)CH3- C≡CH+HB(r 2mol)CH 3CBr2CH3HBr (1mol )(3)CH3- C≡CH CH3-C=CH2 Br2 CH3CBr2CH2BrBr第四章环烃2.C(CH 3 )3(1) (2) (3)CH 33.(1)(3)C H 3Br反式顺式4.Br ClCl +Cl(1)(2)(3)( C H 3)2CCH (CH 3)2 O 2NC H 3BrClB r(4)(5)H 3CCOOHC 2H 5+ Br C 2H 5(6) (CH 3)3CCOOH(7) CH 3COCH 3(8) 1molCl2/ h, 苯/ 无水 AlCl 3CH 3N H COCH 3NO 2(9) (10)SO 3HC H 37. (2) 有芳香性 10.第六章 旋光异构6-32. (1) × (2) × (3) × (4) √ (5) √ (6) √7. [ ] 20 Dc l18.85.678 20 166.2第七章卤代烃2、Cl白↓ClAgNO 3/乙醇,室温(2)×白↓AgNO 3/乙醇,加热××Cl4、第八章醇、酚、醚1. (1) 3- 甲基-3- 戊烯-1- 醇(2) 2- 甲基苯酚(3) 2,5- 庚二醇(4) 4- 苯基-2- 戊醇(5) 2-溴-1- 丙醇(6) 1- 苯基乙醇(7) 2- 硝基-1- 萘酚(8) 3- 甲氧基苯甲(9) 1,2- 二乙氧基乙烷(乙二醇二乙醚)3、(2)(1)4. (1) 甲醇分子间氢键(6) 邻硝基苯酚分子内氢键、分子间氢键5、(1)H3 CO OH(5) (6) (7)H OHCH2I OCH 36、(1)OH+O,△浓硫酸,△H 3OHBr(2)浓硫酸,△Br2/CCl4OHBrKOH/EtOH△10、OH O ClA B C D第九章醛、酮、醌一、命名下列化合物。
有机化学(第四版)习题解答

page 3
量较高 而不稳定,而后者不存在较大的键角改变,因此能量较低较稳定。 (七)题答案: 题答案: (1 ) 稳定性由大到小是(CH3)C 3 (C) + CH3CHCH3 (A) + Cl3CCHCH3 (B) + ( 2 ) 稳定性由大到小是 (CH3) 2CCH2CH3 (B) . (CH3) 2 CHCHCH3 (C) . (CH3) 2CHCH2CH2 (A) . (八)题答案: 题答案: ( 1 ) 重排后的碳正离子结构是 CH3CHCH3 。 ( 2 ) 重排后的碳正离子结构是(CH3)CCH2CH3 。 2 + + 5 ( 3 ) 重排后的碳正离子结构是 (CH3)2C CHCH3 。 CH3 + + ( 4 ) 重排后的碳正离子结构是 CH3 。 (十一)题解答: 十一)题解答: (1 ) HCl HgCl2 CH3 CHCH2C CH Cl 双键比三键容易进行亲电加成。 (2 ) H2 Pd CaCO3 喹啉 CH2=CHCH2CH=CH2 降低催化活性的钯只能被三键吸附,所以 Lindlar 催化剂只能催化三 键部分加 氢。 (3) C2H5OH KOH CH2 CH2=CHCH2C OC2H5 在强碱中,乙醇与 KOH 作用形成有强亲核能力的乙氧基,三键可与 乙氧基发生 亲核加成,但双键只能进行亲电加成而不能进行亲核加成。 (4 ) C6H5CO3H CH2 O CH CH2 C
page 2
C6H5 C C H O H C6H5 : (五)用化学方法鉴别下列各组化合物(解答) 用化学方法鉴别下列各组化 合物(解答) 鉴别下列各组化合物 ( 1 ) (A) (B) (C) ( 2 ) (A) (B) (C) Br2 CCl4 不褪色者为(A) Br2 CCl4 褪色 KMnO4 褪色 溴的红棕色褪去 溴的红棕色 褪去 不褪色者为(C) 有MnO2沉淀者为(B) 无现象者为(C)。 无现象者为(A) 有Ag沉淀者为(B) H + Ag(NH3)2NO3 (则 AgNO3 NH4OH) 4 (六)题解答: 题解答: H H C CH3 C CH (CH3) 2 CH3 H C C H (1 ) 稳定性是 CH (CH3) 2 这是因为后者两个烃基分别在双键的两边,相互空间排斥力较小,能量较低而稳 定; 前者两个烃基在双键的同侧,相互空间排斥力大,能量较高而不稳定。 (2 ) 稳定性是 CH3 > CH3 这是因为前者两个不饱和双键碳上,共连有三个烃基,后者两个双键碳上,共只 连有 两个烃基,连有烃基越多,烃基与不饱和双键发生超共轭效应(第四章)和给电 子效应(+I 效应)越明显,使其结构能量越低越稳定。 ( 3) 稳定性是 > > 原因同(2) ;超共轭效应(第四章)由强到弱也是按上述顺序排列,超共轭效 应越强, 结构的能量越低,越稳定。 (4 ) 稳定性是 SP2杂化碳的正常成键键角应是 120°角, 而前者双键在小环上, 意味着杂化 碳成键键角 变形较大,能量较高而不稳定;后者 SP2杂化碳成键键角是正常键角,能 量较低而稳定。再 是前者双键上的超共轭效应也比后者弱,这也是能量稍高不如后者 稳定的原因。 (5) 稳定性是 > > 这是因为环越小,键角张力和键的扭转张力都大。因此,能量越高,越不稳定。
有机化学(北大版)第7章卤代烃(习题)
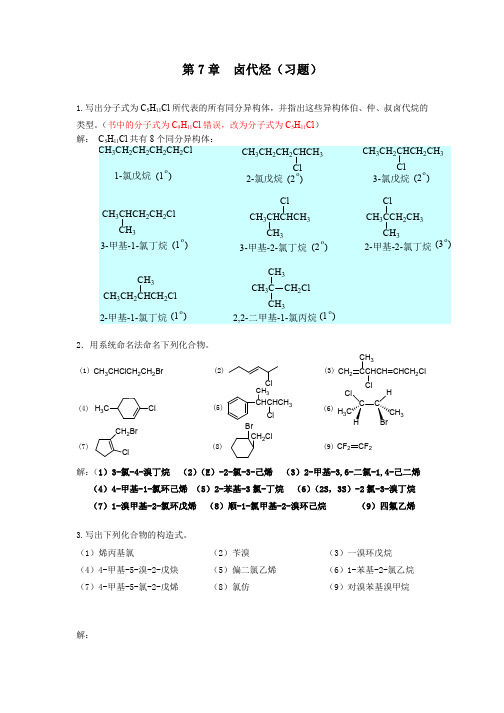
OH
乙醇
Br
(11) I
CH3
Cl2 光照
? CH CNa
?
HgSO4 H2SO4 ,H2O
?
(12) Cl (13) Cl (14)
CH2CH3
Br2 光照
? NaOH C2H5OH
?
HBr ROOR
? NaCN
?
Cl
Fe Br2
?
CH3OH CH3ONa
?
NO2
Cl NaOH C2H5OH
? Cl2
CH3CH2CHCH2CN Cl
CH3 (B) CH3CH2CH2CH2Cl CN
CH3 CH3CH2CH2CH2CN Cl
(2) (A) CH3I NaOH
CH3OH NaI
(B) CH3I NaSH
CH3SH NaI
(3) (A) (CH3)2CHBr H2O (CH3)2CHOH
HBr
(B) (CH3)3CBr H2O CH3)3COH
CH CH
HBr BrCH2CHBr2
BrCH=CHBr
(6) CH3CH2CH2Br
HBr
Cl2 CH3CH=CH2
CH3CHClCH2Cl
2KOH/C2H5OH CH3C CH Na CH3C CNa
CH3CH2CH2Br CH3C CCH2CH2CH3
(7) Cl
HCl
Cl2 500 0C
Cl
OH
NaOH,H2O
(8)
CH3
CH3CH2CH2Cl AlCl3
CH3
CH3
Br2 光照
NaOH C2H5OH,
CH(CH3)2 Br C(CH3)2
第7章 卤代烃

有机化学(理论篇)
对于烯丙型或苄甲基型化合物可直接卤化得到,反应条件 不同产物不同。
<200℃,加成
H3C CH CH2
H3C CH Cl CH2 Cl
+
Cl 2
>300℃,取代
H2C Cl
CH
CH2
具有烯丙基结构的化合物在高温下发生α-H的自由基取代反应, 但有机化合物在高温下一般不稳定,因此对于化工生产不利。
6
第7章 卤代烃
有机化学(理论篇)
2.某些多卤代烃常用俗名或商品名进行命名。如: CHX3 CHBr3 CHCl3 CHI3 CCl2F2
卤仿 溴仿 氯仿 碘仿 氟利昂-1,2
CH3 Cl Cl
Cl Cl
Cl
CCl4
四氯化碳
六六六(林丹)
大连理工大学出版社
7
第7章 卤代烃
二、系统命名法
1.卤代烷烃的命名
H3C CH2 CH CH3 CH2 CH CH3 CH2 CH3 H2C Br CH2 CH CH3 CH2 CH3
3-甲基--5-溴庚烷
3-甲基-1-溴戊烷
8
大连理工大学出版社
第7章 卤代烃
有机化学(理论篇)
当有两个或多个不相同卤素时,卤原子之间的优先次序从低到 高是氟、氯、溴、碘。例如:
CH3 BrH2C CHFCH CH2I
大连理工大学出版社
12
第7章 卤代烃
三、不饱和烃的加成
有机化学(理论篇)
烯烃和炔烃与卤化氢或卤素加成,可得到一卤代烃和多卤 代烃。例如:
H3C CH2 CH CH2
+
CH3COOH HBr H3C CH2
有机化学考研复习资料-卤代烃

第九章卤代烃一、基本内容1.定义和分类烃分子中的一个或多个氢原子被卤原子取代所形成的化合物称卤代烃。
本章重点讨论单卤代烃。
单卤代烃用通式RX表示,R为烃基;X为卤原子(F、Cl、Br、I),是卤代烃的官能团。
用RX表示单卤代烷烃时,R为烷基,如:1-溴丁烷、2-氯丙烷、氟代环己烷等。
其结构特征为和卤原子成键的碳原子是sp3杂化的。
X连结在烯烃碳碳双键碳原子(sp2杂化)上的称作乙烯基卤代烃(简称烯卤),如氯乙烯、1-氯丙烯等。
X连结在芳基上的称作卤代芳烃(简称芳卤),如溴苯。
卤原子连结在烯丙基的亚甲基碳原子(sp3杂化)上的卤代烃被称为烯丙基卤代烃,如:3-溴丙烯(简称烯丙基溴)、苄基氯等。
在单卤代烷烃中(氯甲烷除外),将卤原子分别连结在伯、仲、叔碳原子上的卤代烷分别称作伯、仲、叔卤代烷。
2.反应卤代烃可以用于多种反应,如碳碳键的形成和官能团的转换等。
因此,卤代烃多用作有机合成试剂或有机合成的中间体,在有机合成中起着重要的作用。
卤代烃的主要反应有:亲核取代反应、消除反应、和活泼金属的反应、还原反应等。
单卤代烷烃的反应活性为:RI>RBr>RCl>RF(请注意,和其他卤代烃相比,氟代烃的性质比较特殊)。
卤原子相同时,不同烃基的单卤代烃的反应的活性为:烯丙基卤代烃>卤代烷烃>乙烯基卤代烃或卤代芳烃。
3.制备主要制备方法:烯烃和卤化氢及卤素(Cl2、Br2)的加成;烃的卤代;醇与氢卤酸、卤化磷、及与亚硫酰氯的反应;卤原子互换;芳烃的亲电取代等。
二、重点与难点评述本章的重点是卤代烃的重要反应及其应用和亲核取代反应历程。
重要反应有亲核取代反应、消除反应、和活泼金属的反应等。
历程主要是指S N1和S N2历程。
难点是对结构与性质的关系、影响亲核取代反应的因素、亲核取代和消除反应的竞争等的认识和理解。
1.结构与性质卤代烃的性质主要取决于碳卤键和烃基的结构。
碳卤键越容易断裂,愈易发生反应。
1卤原子的电负性为F>Cl>Br>I,均大于碳原子的电负性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7.2 卤代烷的结构
1. 碳卤键的特点
极性共价键,成 键电子对偏向X
成键轨道
Csp3
等性杂化
X
C—Br C— I 194 284.5 214 (pm) 217.6 (kJ/mol)
2. 键长与键能
C—H 110 C—F C—C 139 154 347.3 C—Cl 176 339.0
414.2 485.3
作业: 7-10, 18, 26
7.1 卤代烃的分类和命名
按烃基的 结构分类 按卤素数 目分类
CH3CH2X
饱和卤代烃
CH2=CHX CH2=CHCH2X
不饱和卤代烃
X
CH2X
芳香卤代烃 三卤代烃
CHF3 氟仿(fluroform) 二卤代烃 CHCl3 氯仿(chloroform) ClCH2CH2Cl 连二卤代烃 CHBr3溴仿(Bromoform) CH2Br2 偕二卤代烃 CHI3 碘仿(Iodoform)
7.9 卤代烃与金属的反应
卤代烃可以和许多金属元素作用,生成 金属与碳直接相连的一类化合物,称为有机 金属化合物。用R−M表示,M为金属。
7.9.1 有机金属化合物的命名
有机金属化合物可以按下面三种模式命名
CH3Li 甲基锂
methyllithium
(CH3CH2)2Hg 二乙基汞
diethylmercury
3. 偶极矩与有机分子的极性
qd
偶极矩的大小大体上可以表示有机分子的极性大小。
C–F
偶极矩
C–Cl 1.56D
C–Br 1.48D
C–I 1.29D
1.51D
4. 电负性与键的分类
C (2.5) F (4.0) 差值 1.5 Cl (3.2) 0.7 Br (3.0) 0.5 I (2.7) 0.2
催化氢解
用催化氢化法使碳与杂原子(O、N、X)之间的 键断裂,称为催化氢解。苯甲型(苄型)化合物特别 容易发生催化氢解。
CH2Cl
H2 / Pd C 90%
CH3
*OH,NH2
3 碱性还原剂 (1)硼氢化钠(NaBH4)—— 温和还原剂
NaBH4
(CH3)3CX
(CH3)3CH
特点:还原能力差,选择性好。 范围:2oRX、3oRX、醛、酮、酰卤、酸酐。 注意:必须在碱性水溶液中进行。
卤代烷可极化性次序为: RI > RBr > RCl > RF
可极化性大的分子易发生化学反应。
7.4 亲核取代反应
卤代烃亲核取代反应用于合成
底物 CH3Br I亲核试剂 (碘负离子) 生成物 CH3I CH3OH (碘甲烷)
H2O (水) HO- (羟基负离子) CH3O-(甲氧基负离子) CH3COO- (乙酰氧基负离子) NH3 (CH3)3N (氨) (三甲胺)
E1反应机理和SN1反应机理的比较
E1反应机理
CH3 CH3 C CH3 Br
进攻-H
慢 -Br
-
CH2 CH3 C+ CH3
H C2H5OH
CH3 CH3
快
+ C =CH2 + C2H5OH2 -H+ C2H5OH
SN1反应机理
CH3 CH3 C CH3 Br
慢 -Br-
CH3 CH3 C
+
进攻C+
极性共价键
共价键
5. 1,2-二氯乙烷的构象
Cl
有范德华吸引力 有偶极-偶极排斥力
H H H
Cl H
Cl H H Cl H H
无范德华吸引力 无偶极-偶极排斥力
气相: 排斥力占主导地位。所以: 对交叉 > 邻交叉 液相: 吸引力 排斥力。
Cl H H Cl CH3 CH3
所以: 对交叉 邻交叉
(CH3)4Si 四甲基硅烷
tetramethylsilane
CH3CH2HgCl 氯化乙基汞
ethylmercuric chloride
7.9.2 有机金属化合物的结构
CH3 CH3 CH3 Al CH3 Al CH3 CH3
R X
Mg
O(C2H5)2 O(C2H5)2
三中心两电子键
格氏试剂
7.9.3 有机金属化合物的物理性质(自学)
NaNH2 C6H5NH2
C
CH
Cl Cl C2H5ONa C2H5OH
Cl Cl C2H5ONa C2H5OH
Cl
关于卤代烃消除反应的机理、区域选择性和立体选择性参见6.9。
7.6 亲核取代反应和消除反应的共存与竞争
一级卤代烃与亲核试剂发生SN2反应速率很快,因此消除反应很少, 只有存在强碱时才可发生。但在β位上有活泼氢的一级卤代烃,例如苯 甲型和烯丙型卤代烃则会提高E2反应的速率。见表7−4 二级卤代烃及β位上有侧链的一级卤代烃,由于空间位阻增大和β氢 增多,SN2反应速率变慢而E2反应的竞争力增大,此时试剂和溶剂对反应 的方向影响很大。低极性溶剂、强亲核试剂有利于SN2反应,低极性溶剂、 强碱性试剂有利于E2反应。见表7−5 三级卤代烃在无强碱存在时,进行单分子反应,一般得到SN1和E1 的 混合产物。在单分子反应中 SN1 和 E1 反应混合物之比,主要决定于烷基的 结构,取代基的空间体积大,有助于进行消除反应。 但如有强碱甚至弱碱存在,三级卤代烷主要发生E2反应,见表7−6
7.9.4 格氏试剂和有机锂试剂的制备和性质 1 格氏试剂、有机锂试剂与O2、CO2、H2O的反应。 与H2O的反应
RMgX + HOH RLi + H2O RH + HOMgX RH + LiOH
其它含活泼氢的化合物也能发生同样的反应。
ROH,RSH, RCOOH, RNH2, RCONH2,RCCH, RSO3H
碘代烷与三级卤代烷在室温即可与硝酸银的酒精溶液反应生成卤代银沉淀, 一级、二级氯代烷和溴代烷则需要温热几分钟才能产生卤代银沉淀。 苯甲型及烯丙型卤化物的卤素非常活泼,与硝酸银的醇溶液能迅速地发生反应; 卤素直接连接于双键及苯环上的卤化物则不易发生此反应。 两个或多个卤原子在同一碳上的卤代烷,也不起反应。
2 中性还原剂
RX (or ArX)
O
催化氢化
H2 / Pd*
RH (orArH)
OH CH2CHCH3 H2N CH3 N
* PdC, Ni, Pt
CH2CCH3
O2N C N H / Pd C 2
特点: 选择性差。
CH2NH2 H
H3C
N
Cl
适用范围:芳香卤代烃、苯甲型、烯丙型卤代烃、 三级卤代烃、RI。
C2H5OH
CH3 CH3 C CH3
CH3
快
+ OC2H5 H
离去基团的离去能 力影响反应速率。 试剂亲核性强弱影 响产物比例。
-H
+
CH3 CH3 C CH3 OC2H5
碱性强,升温对 E1有利。 亲核性强, 极性 溶剂对SN1有利。
E2反应机理和SN2反应机理的比较ห้องสมุดไป่ตู้
E2反应机理
CH3 C2H5O + CH3
7.5 消除反应
卤代烃的消除反应可以用来制备烯烃、炔烃和共轭烯烃。例如:
CH3CHCH3 Br NaOH C2H5OH CH3CH CH2 ClCH2CH2Cl NaOH C2H5OH ClCH CH2
CH3CHCH2 KOH(足量) C4H9OH Br Br
CH3C
CH3
CHCH2 Br Br
7.9 卤代烃与金属的反应
7.9.1 有机金属化合物的命名 7.9.2 有机金属化合物的结构 7.9.3 有机金属化合物的物理性质(自学) 7.9.4 格氏试剂和有机锂试剂的制备和性质 1 格氏试剂、有机锂试剂与O2、CO2、H2O的反应。 2 格氏试剂、有机镉试剂、有机锂试剂、二烃基铜 锂的制备 3 卤代烃与有机金属化合物的偶联反应
进攻-C
7.7 卤代烷的还原
方程式: R-X
还原剂
R-H
RX被还原的难易:RI (易) > RBr > RCl (难)
1 酸性还原剂:HI, Zn + HCl
CH3(CH2)14CH2I RX
HI -HX Zn + HCl
注意干扰基团, 例如:NO2 CH3(CH2)14CH3
RI
HI
RH + I2
第7章
卤代烃 有机金属化合物
7.1 卤代烃的分类和命名 7.2 卤代烃的结构 7.3 卤代烃的物理性质 卤代烃的反应 7.4 亲核取代反应 7.5 消除反应 7.6 亲核取代反应和消除反应的共存与竞争
7.7 卤代烷的还原 7.8 卤仿的分解反应 7.9 卤代烃与金属的反应 卤代烃在合成中的作用 卤代烷的制备(自学)
-
进攻-H
CH3
C Br
[
C 2H 5O
-
H CH 2
CH 3 C Br CH
3
]
=
CH3 CH3 C =CH2 + C2H5OH + Br-
试剂亲核性强,碱性弱,体积小,利于SN2。 试剂碱性强,浓度大,体积大,升温利于E2。
SN2反应机理
HO- + CH3Br
[
H HO C H
H
Br
]
=
CH3OH + Br-
-
SCH3 (甲硫基负离子)
SCN (硫氰基负离子)
:S(CH3)2 (二甲硫醚) :P(CH3)2 (三甲膦)
卤代烃亲核取代反应用于鉴别
R X + AgNO3
C2H5OH
RONO2 + AgX
