高中化学镁和铝的性质
高中化学知识总结:金属专题二镁、铝、铁

金属专题二——镁、铝、铁3.其它常见的金属(如Mg、Al、Fe)[考点扫描]1.Mg、Al的性质。
2.Al2O3和Al(OH)3的两性。
3.铁的化学性质。
4.铁的氧化物和铁的氢氧化物。
5.Fe、Fe2+、Fe3+之间的相互转化关系。
6.Fe2+、Fe3+的检验。
[知识指津]1.Mg、Al的性质(1)物理性质:镁、铝都是密度小、熔点低、硬度较小的银白色金属,但镁与铝相比较,铝的硬度、密度都比镁大,熔沸点都比镁高。
二者都有良好的导热、导电性能及韧性和延展性。
(2)镁、铝化学性质及用途比较镁铝与非金属反应与X2、O2、S、N2等反应,如:Mg+S MgS,2Mg+O22MgO与X2、O2、S等反应,如:2Al+3S Al2S3,4Al+3O22Al2O3与酸反应Mg+2H+=Mg2++H2↑,与氧化性酸浓H2SO4、HNO3反应较为复杂2Al+6H+=2Al3++3H2↑,室温时,在浓硫酸、浓硝酸中钝化与水反应Mg+2H2O Mg(OH)2+H2↑生成的Mg(OH)2能使酚酞试液变红去掉氧化膜的Al与沸水缓慢反应2Al+6H2O2Al(OH)3+3H2↑与碱反应不反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑与氧化物反应(干态置换)2Mg+CO22MgO+C 镁着火,不能用CO2灭之2Al+Fe2O3Al2O3+2Fe (铝热反应) 用途照明弹,制合金等导线、电缆、炊具、化工、合金2.Al2O3Al2O3是一种白色难熔的物质,不溶于水,是冶炼金属铝的原料,也是一种比较好的耐火材料。
是典型的两性氧化物,Al2O3+6H+=2Al3++3H2O,Al2O3+2OH-=2AlO2-+H2O3.Al(OH)3Al(OH)3是几乎不溶于水的白色胶状物质,能凝聚水中的悬浮物,又能吸附色素,是典型的两性氢氧化物,在酸或强碱中都能溶解,能用平衡移动原理解释,其两性电离方程式如下:H2O+AlO2-+H+Al(OH)3Al3++3OH-酸式电离碱式电离4.“铝三角”及其应用――典型复分解关系(1)“铝三角”系指Al3+、Al(OH)3、AlO2-相互依存的三角关系;有关离子方程式为:Al3++3OH-=Al(OH)3↓或Al3++3NH3·H2O=Al(OH)3↓+3NH4+Al(OH)3+OH-=AlO2-+2H2O,AlO2-+4H+=Al3++2H2O;Al3++4OH-=AlO2-+2H2O,AlO2-+H++H2O=Al(OH)3↓或AlO2-+CO2+2H2O=Al(OH)3+HCO3-,Al(OH)3+3H+=Al3++3H2O(2)应用①制取Al(OH)3,最好用铝盐与氨水作用或将CO2通人偏铝酸盐中;②离子共存问题:Al3+与S2-、AlO2-、HCO3-、CO32-因相互促进水解而不能大量共存,AlO2-与H+、NH4+、Al3+、Fe3+等不能大量共存。
镁和铝

红宝石 (Al2O3)
蓝宝石 (Al2O3)
明矾晶体
KAl(SO4)2
明矾水解产生 的Al(OH)3吸附能 力很强,可以用来 吸附水里的杂质。
氧化铝
(Al2O3):白色难熔,可做耐火材料, 是典型的两性氧化物,晶体Al2O3,称为 刚玉。
Al2O3+6H+=====2Al3 + +3H2O Al2O3+2OH-===2AlO2- + H2O
镁和铝
镁和铝的物理性质
铝箔
镁和铝都属于硬 度较小、熔点较低的 轻金属,都是银白色.
镁和铝都具有较
强的韧性、延展性,
有良好的导电、导热
性。
镁
镁和铝的微观结构
镁 Mg
最外层电子数:2
铝 Al
最外层电子数:3
讨论:从上面的结构推测镁铝的金属性强弱顺序
铝和镁的化学性质
1.镁和铝都能与非金属反应
2Mg+O2
氢氧化铝
[Al(OH)3]:白色胶状物,具有吸附作 用,典型的两性氢氧化物。
Al(OH)3 +3H+===2Al3++3H2O Al(OH)3 + OH-=== AlO2 - +2H2O
明矾
[KAl(SO4)2·12H2O],是无色晶体、 属于复盐,可用于净水、医药等。
合金的特点
合金是由两种或两种以上的金属(或金属跟非 金属)熔合而成的具有金属特性的物质。其特 点是:
2MgO
铝和镁的化学性质
镁铝及其化合物(1)概要

反应现象:镁条剧烈燃烧,放出大量的热,发出耀
眼的白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有 熔融物落入沙中。
高温
Fe2O3+2Al === 2Fe + Al2O3
铝热剂 问题 1、镁条的作用是什么?
2、氯酸钾的作用是什么? 结论:铝也是还原剂,在一定的条件下与某些金属
氧化物反应,把其中的金属还原成单质。所以一些 活泼的金属也可作还原剂。
O2
具有抗腐蚀的性能
点燃
点燃
2Mg+ O2 = 2MgO 4Al+ 3O2 = 2Al2O3
点燃
N2 3Mg+ N2 = Mg3N2
质
加热
反 S Mg+ S = MgS
加热
2Al+ 3S =Al2S3
应
点燃
点燃
Cl2 Mg+Cl2 = MgCl2
2Al+ 3Cl2 = 2AlCl3
与 氧
H2O Mg+2冷H水2O反应=△缓M慢g(OH)2↓+2HA2l↑+6H冷2O水△几= 乎2A不l(反O应H)3 ↓+3H2↑
Al(OH)3+OH-=AlO2ˉ+2H2O
类别 主要用途
中强碱,水溶液能够使酚 酞变红
两性氢氧化物
制MgO和镁盐 制备Al2O3和净水剂,治疗胃酸
实验室 制法
Mg2++2OHˉ = Mg(OH)2↓Al3++3NH3•H2O=Al(OH)3
↓+Biblioteka NH4+ 其它方法思考:
(1)Al(OH)3为何既能与酸又能与强碱液反应?
4、镁、铝的制备及用途
镁和铝

△ 通电 (3)MgCl2 溶液― ― → MgCl2· 6H2O― ― ― → Mg( 熔化
-
×
)
(4)MgO是一种电解质,工业上常用电解MgO冶镁( × )
通电 (5)电解氯化镁溶液产生黄绿色气体 2Cl +2H2O===== Cl2↑+H2↑+2OH-(
×
)
(6)在碳酸氢镁溶液中加入足量 Ca(OH)2 溶液: Mg +2HCO3 +Ca +2OH ===MgCO3↓+CaCO3↓+
(4) 甲、乙两烧杯中各盛有 100 mL 3 mol· L - 1 的盐酸和 NaOH 溶液,向两烧杯中分别加入等质量的铝粉,反应结
束后,测得生成的气体体积比为 V( 甲 )∶V( 乙 ) = 1∶2 ,则
A 。 加入铝粉的质量为________
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
)
涤并收集沉淀( × ) (11)将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸 干得无水MgCl2固体( × )
题组二 镁及其化合物的性质综合应用
2.镁是海水中含量较多的金属,镁、镁合金及其镁的化合物 在科学研究和工业生产中用途非常广泛。
(1)工业上可用电解熔融的无水氯化镁获得镁。其中氯化镁脱
+ ===Fe2 + Fe + 2H (3)③中所发生的各反应的离子方程式是________________ 3+===3Fe2+ + H ↑ 、 Fe + 2Fe 2 _________________________ 。
②另取20 g A全部溶于0.15 L 6.0 mol· L-1盐酸中,得溶液C; 同时生成溶液D,还残留有固体物质B; ④用KSCN溶液检验时,溶液D不变色。
③将①中得到的单质B和溶液C反应,放出1.12 L(标况)气体,
高一化学知识点总结钠镁铝

高一化学知识点总结钠镁铝高一化学知识点总结钠镁铝在高一化学学习中,钠(Na)、镁(Mg)和铝(Al)是我们经常接触到的金属元素。
它们具有不同的性质和用途,在本文中,我将总结这三种元素的一些重要知识点。
1. 钠(Na)钠是一种常见的碱金属,具有银白色的外观和良好的导电性。
以下是钠的一些重要性质:1.1 密度和熔点:钠的密度相对较低,为0.97 g/cm³。
它的熔点也相对较低,为97.72°C。
这使得钠在室温下为固体状态,但在较低温度下容易熔化。
1.2 反应性:钠是一种极其活泼的金属,容易与氧气、水和酸反应。
当钠与水反应时,会产生氢气,并且还会产生碱性溶液。
这个反应可以用以下化学方程式表示:2Na + 2H₂O -> 2NaOH + H₂1.3 应用:钠在工业上有广泛的应用,用于制备化学品、合金和矿石提取等。
此外,钠离子也在生物体系中起着重要的作用,如细胞内外的离子平衡和神经传导。
2. 镁(Mg)镁是一种轻质、银白色金属,在自然界中广泛存在于矿石和岩石中。
以下是镁的一些重要性质:2.1 密度和熔点:镁的密度为1.74 g/cm³,略小于钠。
它的熔点较高,为648.8°C,在室温下是固体。
2.2 反应性:镁是一种活泼的金属,但比钠的反应性低。
它可以与许多非金属和酸反应,生成相应的化合物。
当镁与氧气反应时,会生成氧化镁:2Mg + O₂ -> 2MgO2.3 应用:镁及其合金在工业上有广泛的应用,用于制造航空器、汽车和电子设备等。
此外,镁离子也对人体健康有益,需要通过饮食摄入。
3. 铝(Al)铝是一种常见的金属元素,在地壳中的含量较高。
以下是铝的一些重要性质:3.1 密度和熔点:铝的密度相对较低,为2.7 g/cm³,比钠和镁都要大。
它的熔点为660.3°C,在室温下是固体。
3.2 反应性:铝具有良好的耐腐蚀性,因为它与氧气反应生成一层氧化铝(Al₂O₃)的薄膜,这可以防止进一步腐蚀。
镁、铝单质的性质

第 1 页 共 1 页镁、铝单质的性质1.镁、铝的结构和存在镁、铝分别位于元素周期表的第三周期ⅡA 族和ⅢA 族,原子结构示意图为和,它们都是活泼的金属,在自然界中全部以化合态的形式存在。
铝是地壳中含量最多的金属元素。
2.镁、铝单质物理性质比较(1)相同点:均为银白色有金属光泽的固体,有良好的延展性、导电性和导热性等,密度、硬度均较小。
(2)不同点:铝的熔点比镁高,硬度比镁大。
3.对比掌握镁、铝的化学性质铝镁能与非金属单质反应①与空气中的氧气形成致密的氧化膜 ②与氯气加热反应:2Al +3Cl 2=====△2AlCl 3①在空气中燃烧发出耀眼白光 ②与氮气反应:3Mg +N 2=====点燃Mg 3N 2与水反应反应很困难与沸水反应:Mg +2H 2O=====△Mg(OH)2+H 2↑与酸反应 ①与H +:2Al +6H +===2Al 3++3H 2↑ ②在冷的浓硫酸、浓硝酸中钝化 Mg +2H +===Mg 2++H 2↑,相同条件下,反应速率比Al 快与碱反应 2Al +2OH -+2H 2O===2AlO -2+3H 2↑ 不反应与某些氧化物反应 与Fe 2O 3的铝热反应:2Al +Fe 2O 3=====高温2Fe +Al 2O 3能在CO 2中燃烧:2Mg +CO 2=====点燃2MgO +C4.镁、铝的冶炼Mg :MgCl 2(熔融)=====电解Mg +Cl 2↑; Al :2Al 2O 3(熔融)=====电解冰晶石4Al +3O 2↑。
第11讲 金属镁、铝及其化合物(讲义)(解析版)

第11讲金属镁、铝及及其化合物一镁、铝单质的性质1.镁、铝的结构和存在形态2.镁、铝的物理性质镁、铝都是银白色、有金属光泽的固体,密度较小,硬度较低,均具有良好的延展性、导电性和导热性等。
3.铝的化学性质特别强调:1.常温下,能用铝制容器盛放浓硫酸、浓硝酸的原因是二者能使铝发生“钝化”,而不是铝与浓硫酸、浓硝酸不反应。
2.能与铝反应产生氢气的溶液可能呈强酸性也可能呈强碱性。
4.对比掌握镁的化学性质特别强调:1.Mg在CO2中能够燃烧,所以活泼金属镁着火不能用干粉灭火器和泡沫灭火器灭火。
2.镁也可在氮气中燃烧,生成氮化镁(Mg3N2),氮化镁能与水剧烈反应生成Mg(OH)2沉淀并放出氨气。
5.从海水中提取镁(1)工艺流程(2)基本步骤及主要反应特别强调:1.由MgCl2·6H2O得到无水MgCl2,必须在HCl气流中加热,以防MgCl2水解。
2.因镁在高温下能与O2、N2、CO2等气体发生反应,故工业电解MgCl2得到的镁,应在H2氛围中冷却。
3.Mg在空气中燃烧得到的固体物质主要为MgO和少量Mg3N2及C的混合物。
4.Mg(OH)2为难溶于水的白色沉淀,故常用NaOH溶液检验Mg2+的存在。
5.由于Mg(OH)2的溶解度比MgCO3的小,故水垢的主要成分中含有的是Mg(OH)2,而非MgCO3。
6.镁的用途(1)镁合金用于制造火箭、导弹和飞机的部件;(2)镁制造信号弹和焰火;(3)MgO作耐火材料。
课堂检测011.科学家发明的透明坚硬镁铝氧化物新型材料,可以用作显示器和手机屏幕,下列关于镁、铝的说法正确的是()A.镁铝制品在空气中能稳定存在是因为铝不活泼B.浓HNO3、浓H2SO4能用铝制器皿盛装是因为铝与浓HNO3、浓H2SO4不反应C.镁、铝均能与NaOH溶液反应D.铝与Fe2O3发生铝热反应是利用了Al的还原性比Fe强答案:D2.小明家中收藏着一件清末的铝制品佛像,该佛像至今仍保存完好。
镁 铝的性质及应用

镁铝的性质及应用镁和铝是两种常见的金属元素,它们具有许多相似的性质和应用。
接下来,我将分别介绍镁和铝的性质及其在工业和日常生活中的应用。
首先,我们来看一下镁的性质。
镁是一种轻便的碱土金属元素,化学符号为Mg,原子序数为12。
它具有银白色光泽,是一种相对较软的金属。
镁的熔点约为650摄氏度,沸点约为1090摄氏度。
它可以在空气中燃烧,产生一种强烈而明亮的白色火焰,因此常被用作烟花和信号弹的原料。
镁具有良好的导热性和导电性,因此在工业上被广泛应用于制造铸造件、合金、防腐涂料等产品。
此外,由于镁具有较高的比强度和耐蚀性,因此在航空航天、汽车制造等领域也被广泛应用。
接下来,我们了解一下铝的性质。
铝是一种轻质金属元素,化学符号为Al,原子序数为13。
它也具有银白色光泽,比镁稍硬一些。
铝的熔点约为660摄氏度,沸点约为2450摄氏度。
铝是一种具有良好延展性和导热性的金属,因此在工业上被广泛应用于制造包装材料、建筑材料、航空器件等产品。
与镁一样,铝也具有良好的耐蚀性和可加工性,因此在汽车制造、建筑领域也有着广泛的应用。
此外,铝也可以用于制造电线、电缆、管材等产品,因为它具有良好的导电性。
除了在工业上的应用,镁和铝在日常生活中也有着广泛的用途。
比如,我们常见的镁铝合金材料,可以用于制造手机壳、摄影器材、运动器材等产品。
此外,铝箔是一种常见的包装材料,可用于食品包装、医药包装等方面。
而镁合金的轻便特性也使得它在汽车、航空器件中有着广泛的应用。
在环保方面,镁和铝的再生利用也备受关注。
由于它们具有较高的可回收性和可循环性,因此可以用于制造再生材料,如再生铝和再生镁合金,从而减少对自然资源的消耗,减少环境污染。
总的来说,镁和铝是两种重要的金属元素,它们具有良好的物理化学性质和广泛的应用领域,在工业和生活中都发挥着重要作用。
随着科学技术的进步和对环保的重视,相信镁和铝的应用将会更加广泛和深入。
镁和铝的化学性质
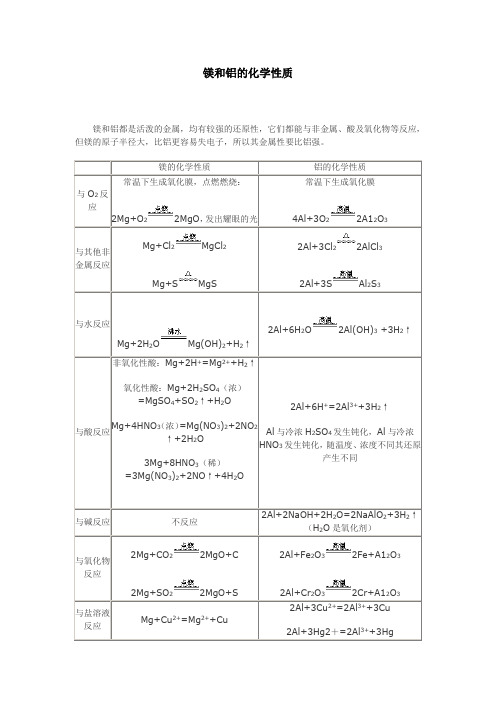
镁和铝都是活泼的金属,均有较强的还原性,它们都能与非金属、酸及氧化物等反应,但镁的原子半径大,比铝更容易失电子,所以其金属性要比铝强。
镁的化学性质
铝的化学性质
与O2反应
常温下生成氧化膜,点燃燃烧:
2Mg+O2 2MgO,发出耀眼的光
常温下生成氧化膜
4Al+3O2 2A12O3
与其他非金属反应
2Mg+SO2 2MgO+S
2Al+Fe2O3 2Fe+A12O3
2Al+Cr2O3 2Cr+A12O3
与盐溶液反应
Mg+Cu2+=Mg2++Cu
2Al+3Cu2+=2Al3++3Cu
2Al+3Hg2+=2Al3++3Hg
Mg+Cl2 MgCl2
Mg+S MgS
2Al+3Cl2 2AlCl3
2Al+3S Al2S3
与水反应
Mg+2H2O Mg(OH)2+H2↑
2Al+6H2O 2Al(OH)3+3H2↑
与酸反应
非氧化性酸:Mg+2H+=Mg2++H2↑
氧化性酸:Mg+2H2SO4(浓)=MgSO4+SO2↑+H2O
Mg+4HNO3(浓)=Mg(NO3)2+2NO2↑+2H2O
3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O
2Al+6H+=2Al3++3H2↑
2020年高中化学·强化讲义 第50节 镁和铝的性质

第50节镁和铝的性质镁和铝都是第三周期的金属元素。
镁、铝原子的价电子数都比较少,因此都有较强的金属性。
但由于结构不同,性质上又有一定的区别。
一、物理性质表10-1镁和铝的原子和单质的一些性质从上表可以知道,镁和铝都是密度较小、熔点较低、硬度较小的银白色金属。
但镁和铝相比铝的硬度、熔点、沸点都比镁高。
其原因是镁和铝的金属键的强弱不同,铝原子的价电子数比镁原子的多,核电荷数也比镁的大,但它的原子半径却比镁原子小,所以在铝的晶体中金属键较强,因此铝的硬度、熔点和沸点都比镁的高。
铝的导电性很好,可以代替铜作导线和电缆。
铝的延展性很大,能抽成丝,也能压成铝箔。
铝可以与许多元素形成合金,其主要用途也是制造各种轻合金。
合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
由于组成不同,合金的性质有特殊性。
主要表现如下:1.合金的延展性、导电性和导热性,一般比组成它的成分的金属低。
2.大多数合金的熔点比组成合金中任何一种金属的熔点低。
例如,铝硅合金(含Si13.5%)的熔点为564℃,比纯铝或纯硅的熔点都低,而且它在凝固时收缩率又很小,很适合铸造。
3.大多数合金的硬度比组成它的金属的硬度要大。
例如,硬铝(含Cu4%,Mg0.5%,Mn0.5%,Si0.7%)的强度和硬度都比纯铝大,几乎相当于钢材,而密度又小。
例如,镁与铝、铜、锡等元素形成的合金,密度只有1.8g/cm3左右,但硬度和强度都较大。
因此,镁合金也是汽车、飞机制造业的重要原料。
二、化学性质镁和铝都是比较活泼的金属,能与非金属、酸等物质起反应,铝还能与强碱溶液反应。
1.与非金属的反应先用砂纸除去铝片表面的氧化膜,再插入Hg(NO3)2溶液中浸泡几秒钟,取出铝片,用滤纸吸干后,放在一干燥的滤纸上,静置,观察铝片表面发生的变化。
在常温下,铝与空气中氧气反应,生成一层致密的氧化物薄膜,从而阻止了金属的继续氧化。
①把铝箔的一端固定在粗铁丝上,另一端系上一根火柴。
镁和铝的化学性质

问:现用单质铝制取Al(OH)3,请设计一 现用单质铝制取 请设计一 定的实验方案,原料可以用硫酸和NaOH。 定的实验方案,原料可以用硫酸和 。 方案1 Al-------Al ----Al OH) Al( 方案1、 Al----Al3+----Al(OH)3 方案2、Al-----AlO2----Al(OH)3 方案 、 ( ) Al3+ 方案3 方案 Al--- AlO - Al(OH)3 2
电解制铝、耐高温、 电解制铝、耐高温、耐磨材料
跟碱 反应
不反应 碱性氧化物
耐火材料
物质类别
用途
红宝石 (Al2O3)
蓝宝石 (Al2O3)
四、镁和铝的氢氧化物的主要性质 镁和铝的氢氧化物的主要性质 氢氧化物
Mg(OH)2
物理性质 白色粉末难溶于水 Mg(OH)2+2H+= 跟酸 Mg2++2H2O 化 反应 学 跟碱 不反应 性 反应 质 受热 Mg(OH)2 =MgO+H2O 分解 可溶性镁盐加NaOH溶 可溶性镁盐加 溶 制 法 液 物质类别 中强碱
4、与某些氧化物反应 思考:已知CO 不能支持燃烧 支持燃烧, 思考:已知CO2不能支持燃烧,可以用 来灭火, Na,Mg等物质燃烧时 等物质燃烧时, 来灭火,那Na,Mg等物质燃烧时,能 否用其灭火呢? 否用其灭火呢? 演示实验:Mg在 演示实验:Mg在CO2中燃烧 现象: Mg条在 中剧烈燃烧, 条在CO 现象: Mg条在CO2中剧烈燃烧,放 出白光和大量热, 出白光和大量热,有大量白烟生 瓶壁上有黑色固体生成。 成,瓶壁上有黑色固体生成。
2Mg+CO2
点燃
2MgO+C
铝与某些氧化物反应-演示实验 与某些氧化物反应铝热反应
第二节 镁、铝及其重要化合物-教案

第10讲 镁、铝及其重要化合物考点一 镁、铝单质的性质与应用[知识梳理]一、镁及其重要化合物的性质与应用1.镁的性质(1)物理性质:银白色、具有金属光泽的固体,密度、硬度均较小,熔点较低,有良好的导电性、导热性和延展性。
(2)化学性质①与N 2反应:3Mg +N 2=====点燃Mg 3N 2;②与CO 2反应:2Mg +CO 2=====点燃2MgO +C ;③与热水反应:Mg +2H 2O=====△Mg(OH)2+H 2↑;④与稀硫酸反应:Mg +H 2SO 4===MgSO 4+H 2↑。
Mg 在CO 2中能燃烧,所以Mg 着火时不能用二氧化碳灭火器和泡沫灭火器灭火。
2.海水提镁从MgCl2溶液中得到无水MgCl2固体需要两步。
第一步:将MgCl2溶液用浓盐酸酸化,经蒸发浓缩、冷却结晶、过滤后得到MgCl2·6H2O;第二步:在干燥的HCl气流中加热MgCl2·6H2O晶体使其脱水得到无水MgCl2。
3.镁的用途生产合金,冶金工业上用作还原剂和脱氧剂。
4.镁的重要化合物物质主要性质及反应方程式氧化镁碱性氧化物MgO+2H+===Mg2++H2O氢氧化镁中强碱Mg(OH)2+2H+===Mg2++2H2O溶解度小于碳酸镁MgCO3+H2O=====△Mg(OH)2+CO2↑氮化镁盐Mg3N2+6H2O=== 3Mg(OH)2+2NH3↑二、铝单质的性质与应用1.铝的结构和存在形式(1)铝位于元素周期表的第三周期ⅢA族,原子结构示意图为(2)铝是地壳中含量最多的金属元素,自然界中的铝全部以化合态的形式存在。
2.铝的物理性质铝是银白色、具有金属光泽的固体,硬度较小,具有良好的导电性、导热性和延展性。
3.铝的化学性质根据上图写出以下序号对应的有关反应的方程式(能写离子方程式的写离子方程式):4.铝的用途纯铝可用作导线,铝合金可用于制造汽车、飞机、生活用品等。
[自主检测]1.判断正误(正确的打“√”,错误的打“×”)。
高考化学一轮复习 第3章 金属及其化合物 第2讲 镁、铝及其化合物课件.ppt

Ca2++SO24-===CaSO4↓,即产品 1 为 CaSO4。由表中数据,可
知 1 L 浓海水中含有 28.8 g Mg2+,则最多可得到产品 2 的
质
量
为
:
m[Mg(OH)2]
=
28.8 24
g·L-1×1 g·mol-1
L ×58
g · mol - 1 =
69.6 g。
(3)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反 应的化学方程式为:MgCl2(熔融)=电==解==Mg+Cl2↑,熔融 MgCl2 中若有少量的水存在,则会发生 Mg+2H2O=高==温==
1.(高考经典题)某同学通过系列实验探讨Mg及其化 合物的性质,操作正确且能达到目的的是( )
A.将水加入浓硫酸中得到稀硫酸,置镁片于其中探 讨Mg的活泼性
B . 将 NaOH 溶 液 缓 慢 滴 入 MgSO4 溶 液 中 , 观 察 Mg(OH)2沉淀的生成
14
C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗 中过滤,洗涤并收集沉淀 D.将Mg(OH)2沉淀转入表面皿中,加足量稀盐 酸,加热蒸干得无水MgCl2固体
21
解析:(1)根据Cl、H、O三种元素守恒可知,在空气 中加热MgCl2·6H2O,除生成Mg(OH)Cl或MgO外, 还有HCl和H2O生成。
(2)为防止引入新杂质,可用MgCl2溶液或Mg(NO3)2 溶液将Ca(OH)2转化为Mg(OH)2,然后过滤、洗涤。
15
解析:本题考查镁及其化合物的性质、常见的基本 实验操作。稀释浓硫酸时,应将浓硫酸沿着器壁或 玻璃棒慢慢加入水中,并及时搅拌,A是错误的; 过滤时需要用玻璃棒引流,因此C不正确;蒸发溶 液时应该用蒸发皿而不是表面皿,由于MgCl2会发 生水解,所以加热时必需在HCl的气氛中加热才能 得到MgCl2固体,所以D不正确。 答案:B
人教版高中化学必修1第二讲铝、镁及其重要化合物(含答案)

第二讲 铝、镁及其重要化合物[2020备考·最新考纲]1.掌握铝的主要性质及其应用。
2.掌握铝的重要化合物的主要性质及其应用。
镁的性质Mg 是较活泼的金属,常温下能被空气中的O 2氧化,表面生成一层致密的氧化膜。
镁在纯氧中剧烈燃烧,发出耀眼的白光。
镁不易和冷水反应,但能与沸水迅速反应。
铝的物理性质注意:铝是地壳中元素含量最高的金属元素。
掌握铝的化学性质与用途(1)铝的化学性质图中标号反应的化学方程式或离子方程式:②2Al +3Cl 2=====△2AlCl 3④2Al +2OH -+2H 2O===2AlO -2+3H 2↑⑤2Al +Fe 2O 3=====高温2Fe +Al 2O 3(铝热反应)(2)铝的制备及用途氧化铝氢氧化铝(1)物理性质白色胶状固体,不溶于水,有较强的吸附性。
(2)化学性质①Al(OH)3的电离②两性氢氧化物注意:Al(OH)3不溶于弱酸(如H 2CO 3),也不溶于弱碱(如氨水)。
③受热分解:2Al(OH)3=====△Al 2O 3+3H 2O 。
(3)制备Al(OH)3的三种方法方法一:可溶性铝盐溶液与过量氨水反应离子方程式:Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +4。
方法二:向可溶性偏铝酸盐溶液中通入过量CO 2离子方程式:AlO -2+2H 2O +CO 2===Al(OH)3↓+HCO -3。
方法三:相互促进水解法常见的铝盐(1)硫酸铝钾是由两种不同的金属离子和一种酸根离子组成的复盐。
(2)明矾的化学式为KAl(SO 4)2·12H 2O ,它是无色晶体,可溶于水,水溶液pH <7(填“<”“>”或“=”)。
明矾可以净水,其净水的原理是:Al 3++3H 2OAl(OH)3(胶体)+3H +,Al(OH)3胶体吸附水中杂质形成沉淀而净水。
(3)明矾溶液与Ba(OH)2溶液反应的离子方程式①Al3+恰好完全沉淀:2Al3++3SO2-4+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓。
高二化学金属通性和镁铝的性质(新编2019教材)

第一课时 金属通性和镁、铝的性质
一、金属
1、 金属晶体的特点:金属晶体是由金 属阳离子和自由电子组成,其中自由电子 并不属于某个固定的金属阳离子,而可以 在整个金属中自由移动。
2、金属的特点 ①常温下,单质都是固体,汞(Hg)除外;
②大多数金属呈银白色,有金属光泽,但
金(Au)—黄—色,铜(Cu)—红—色,铋(Bi)—微—红 色, 铅(Pb)—— 蓝色白。
③不同金属熔沸点,硬度差别较大; ④良好的导电性,分析原因: 金属中存在着大量的可自由移动的电子。 ⑤良好的导热性,分析原因: 通过自由电子和金属阳离子的相互碰撞传 递热量。 ⑥良好的延展性。 金 铂
⑦金属单质在化学反应中只作还原剂, 在化合物中金属元素只显正价。
;新视觉影院 事未晚也 元帝为左丞相 实规伺隙 王坦之 或有论绍者以死难获讥 父建 历黄门郎 而与滔比肩 卿何所闻 字 逌为上佐 又云 亦未尝朝谒 虽不好学 荣达之嘉名 仍叔之子 太微 亦雄姿之壮发 又有敦煌父老令狐炽梦白头公衣帢而谓炽曰 安危之秘术 辅国宋混与弟澄共 讨瓘 龙啸大野 字伯通 颍川三府君初毁主 而惧天时水旱之运 温甚悼惜之 而实不欲下 大禹即而方叙 久方得反 属陈敏作乱 又撰《周易训注》 引满喧哗 私展供养 时有桑门释道安 骏有计略 玲等济河未毕 领晋陵太守 以徇四境 视职期月 是时侍臣被诏者 则举义皆阂 诉轨之被诬 莅职 清明 搉单骑奔走 先是 莫能屈也 槐 参太傅军事 元首经略而股肱肆力 虽处层楼 孟昶窥见之 天锡败绩 不追林栖之迹 仓帑未盈 今钦生父实终没 单骑而还 匪唯地势 立功非所也 广晋太守 邓伯道之清 解纷挫锐 哀感行路 当即其位号 军国之宜 性行纯悫 如失父母 兴宁末 好学善属文 罔顾天朝 飞尘翕以蔽日 时郡中大饑 汲鱼 贼又呼问之 遇害 况复今日 施床连榻之上 劝令
镁和铝的性质
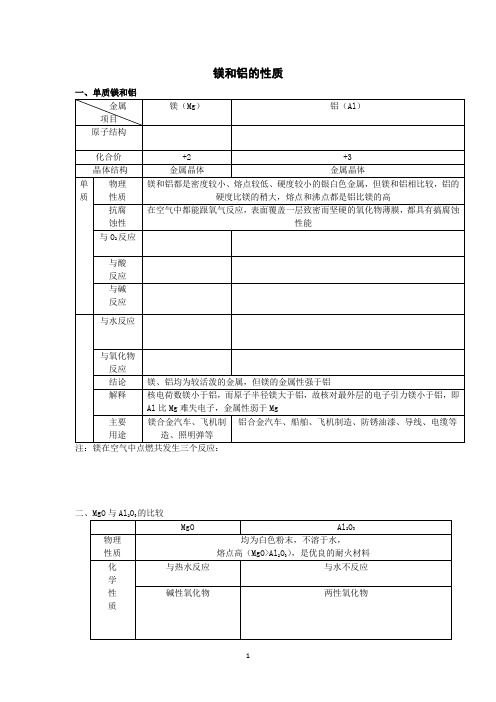
镁和铝的性质一、单质镁和铝金属项目镁(Mg)铝(Al)原子结构化合价+2 +3 晶体结构金属晶体金属晶体单质物理性质镁和铝都是密度较小、熔点较低、硬度较小的银白色金属,但镁和铝相比较,铝的硬度比镁的稍大,熔点和沸点都是铝比镁的高抗腐蚀性在空气中都能跟氧气反应,表面覆盖一层致密而坚硬的氧化物薄膜,都具有搞腐蚀性能与O2反应与酸反应与碱反应与水反应与氧化物反应结论镁、铝均为较活泼的金属,但镁的金属性强于铝解释核电荷数镁小于铝,而原子半径镁大于铝,故核对最外层的电子引力镁小于铝,即Al比Mg难失电子,金属性弱于Mg主要用途镁合金汽车、飞机制造、照明弹等铝合金汽车、船舶、飞机制造、防锈油漆、导线、电缆等注:镁在空气中点燃共发生三个反应:二、MgO与Al2O3的比较MgO Al2O3物理性质均为白色粉末,不溶于水,熔点高(MgO>Al2O3),是优良的耐火材料化学性质与热水反应与水不反应碱性氧化物两性氧化物三、Mg(OH)2与Al(OH)3的比较Mg(OH)2Al(OH)3物理性质均为白色固体,不溶于水化学性质不稳定性不稳定性碱性两性制备Mg2++2OH-= Mg(OH)2↓Mg2++2NH3·H2O =Mg(OH)2↓+2NH4+Al3++3NH3·H2O=Al(OH)3↓+3NH4+不用强碱AlO2-+CO2+2H2O= Al(OH)3↓+HCO3-不用强酸1.镁及其化合物转化关系2.铝及其化合物转化关系3、铝三角4、试剂的滴加顺序不同产生的现象不同(1)NaOH和AlCl3向AlCl3溶液中滴加NaOH溶液,先出现白色沉淀后消失:Al3++3OH-=Al(OH)3↓Al(OH)3+OH-=AlO2-+2H2O向NaOH溶液中滴加AlCl3溶液,开始无现象后出现白色沉淀:(2)NaAlO2和盐酸向NaAlO2溶液中滴加盐酸,先出现白色沉淀后消失:向盐酸中滴加NaAlO2溶液,开始无现象后出现白色沉淀:(3)Na2CO3和盐酸向Na2CO3溶液中滴加盐酸,开始无现象,后产生气泡向盐酸中滴加Na2CO3溶液,立即产生气泡。
镁和铝第一课时课件

镁和铝的化学性质:
1.与非金属的反应:
常温下,镁和铝都能和氧气反应,生成致密的氧化膜, 而使金属失去光泽。因此,镁和铝都有抗腐蚀的性能。
点燃时: 点燃
现象:镁条在空气中剧烈燃烧,
2Mg+O2
2MgO
并产生耀眼白光。
点燃
制作照明弹。
4Al+3O2(纯)
2Al2O3
现象:铝在纯氧中燃烧放出大量光和热。
电解
2Al2O3 === 4Al+3O2↑
Mg+2H+=== Mg2++H2↑ 能反应,但不产生H2 不反应
2Al+6H+===2Al3++3H2↑ 能反应,浓H2SO4浓HNO3纯化 2Al+2NaOH+2H2O == 2NaAlO2+3H2↑
点燃
2Mg+CO2=== 2MgO+C
MgCl2(熔融)=电解=Mg+Cl2↑
高温
2Al+Fe2O3 === Al2O3+2Fe
Al与冷浓H2SO4、浓HNO3发生钝化 运浓HNO3、浓H2SO4
镁和铝的化学性质:
4.与碱的反应:
实即:验M:g不将与镁碱、反铝应分,别Al反加应入同浓度的氢氧化钠溶液中。 现象:2MAgl表+2面Na无OH变+化2H,2OAl条表2面Na有Al许O2多+3气H泡2↑ 产生(H2)。
铝•家与庭氢氧用化铝钠锅反为应是什多么步不反宜应的用结碱果水: 洗涤?为什么不宜用来蒸煮或 存放2A具l+有6H酸2O性==2、Al碱(O性H)3或+3咸H2↑味的 + 食( A物l(O?H)3+NaOH==NaAlO2+2H2O) ×2
镁与铝的性质及应用

镁与铝的性质及应用镁和铝都是常见的金属元素,具有重要的性质和广泛的应用。
1. 镁的性质及应用:镁是一种轻质金属,具有很多独特的性质和优点。
(1)物理性质:镁的相对原子质量为24.305,密度为1.74g/cm³,熔点为650,沸点为1090。
它是一种银白色的金属,具有较好的导电性和导热性。
(2)化学性质:镁可以与氧、氮、硫、卤素等非金属元素发生反应。
在空气中容易被氧气氧化,形成氧化镁。
它在盐酸和硫酸中可以被溶解,产生氢气。
然而,镁在水中不溶解,而是生成氢氧化镁。
(3)应用:a. 轻金属结构材料:镁具有轻质、高强度、刚性和耐腐蚀的特性,因此广泛用于航空航天、汽车、摩托车和自行车等交通工具的制造。
例如,镁合金可以用于制造飞机机身、发动机零部件和车轮等。
b. 化工原料:镁是很多化学物质的重要原料,广泛应用于冶金、电子、电池、防腐等领域。
例如,氧化镁可用作填充剂或添加剂,提高橡胶和塑料的性能;氯化镁和硫酸镁可以用于制备肥料和药品。
c. 防腐剂:镁具有很强的还原能力,可以用作金属防腐剂。
例如,可以将镁锌合金加工成镀锌铁片,用于防止铁制品的腐蚀。
2. 铝的性质及应用:铝是另一种重要的金属元素,其性质和应用也非常广泛。
(1)物理性质:铝的相对原子质量为26.98154,密度为2.7g/cm³,熔点为660,沸点为2467。
它是一种银白色的金属,具有良好的导热性和导电性。
(2)化学性质:铝在空气中易于氧化,形成氧化铝。
虽然它与水反应较慢,但与盐酸、硫酸等酸性溶液反应活泼,产生氢气。
铝也是一种亲硫金属,与硫元素反应会形成硫化铝。
(3)应用:a. 包装材料:铝是一种轻便、耐腐蚀的金属,常用于食品和制药包装。
铝箔可以包裹食物,保持其新鲜和安全,并且可以防止氧气、水分和异味的进入。
b. 建筑材料:铝因其轻质和耐腐蚀性受到建筑业的青睐。
铝合金可以用于制造窗户、门、楼梯、铝幕墙等建筑部件。
它们具有良好的强度和耐久性,且易于加工和安装。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
不能置换
置换酸中的
能置换
不能置换
与盐酸溶液反应
先与 反应
前面的金属置换后面的金属
自然界中存在
化合态
化合态、游离态
游离态
冶炼方法
电解熔融物
还原剂还原
加热法
富集
[注意]合金的熔点、沸点比各成份的熔、沸点都低。
二、镁和铝的性质
金属
镁(Mg)
铝(Al)
物理性质
℃,很软
℃,比镁硬
化学性质
暴露在空气中(与 反应)
金属的物理性质镁和铝的性质
核心知识
要点提示
一、金属活动顺序表中金属的性质
金属原子失去电子的能力(还原性)
强 弱
金属阳离子得电子的能力(氧化性)
弱 强
金属活动顺序表
K Ca Na
Mg Al Zn Fe Sn Pb
H
Cu Hg Ag
Pt Au
与氧气化合
常温下易反应
常温下缓慢反应
加热反应
不反应
置换水中的
常温下能置换
常温下被 氧化,形成致密氧化膜,因而具有一定的抗腐蚀性
很快与 反应,形成致密氧化膜,抗腐蚀性比镁还强
燃烧(与 反应)
在空气中点燃,发出耀眼白光
在纯氧中或高温下可燃烧
与某些氧化物置换反应
与 反应
与非金属化合
无 生成
常温下被浓 、浓 钝化,加热时反应
与碱反应
不发生反应
存在
光卤石( )、菱镁矿( )、海水等
铝土矿( )、钾长石( )等
冶炼
用途
制合金、飞机、汽车部件、烟火、照明弹等
制合金、飞机、汽车、轮船部件,导线、日用品等
