有机化学课件(药学专业)-醇和醚共109页
合集下载
有机化学课件8 醇、醚

H CH3 C C+CH3 CH3 C+
H CCH3
CH3 H
CH3 H
(2)与HNO3反应 生成硝酸酯 与 反应: 生成硝酸酯.
ROH + HO NO2 RONO2 + H2O
多数硝酸酯受热后因能猛烈分解而爆炸,是常用的炸药 多数硝酸酯受热后因能猛烈分解而爆炸,是常用的炸药, 如硝酸甘油酯等。此外还可作为医药和其它重要的化工原料. 如硝酸甘油酯等。此外还可作为医药和其它重要的化工原料 C6H11ONO2(硝酸戊酯) 柴油十六烷值增进剂 硝酸戊酯) 硝酸戊酯 CH3ONO2(硝酸甲酯) 硝酸甲酯) 硝酸甲酯 火箭燃料
CH3 CH3 C OH
OH K 2Cr 2O 7 /H + O HNO 3 CO 2H CO 2H
[O] CH3
[O] CH3COCH3 + HCHO
己二酸
常见的氧化剂为Cr(VI): Sarret试剂 : 常见的氧化剂为 试剂
C rO 3 /C 5 H 5N C H 3(C H 2 ) 8 C H 2 O H 0 oC C H 3 (C H 2 ) 8C H O
CH2 OH CH OH 丙三醇
乙醇
乙二醇
CH2 OH
2) 依据烃基的类别,可将醇分为脂肪醇、芳香醇及指环醇等; 依据烃基的类别,可将醇分为脂肪醇、芳香醇及指环醇等;
CH2OH CH2 CH CH2OH
OH
烯丙醇
苯甲醇
环己醇
3) 依据羟基的位置,一元醇又可分为伯、仲、叔醇。 依据羟基的位置,一元醇又可分为伯、 叔醇。
1. 物理性质
2. 化学性质 1) 酸碱性 似水性 酸碱性(似水性 似水性) (1) 与金属反应
有机化学课件-第五章醇和醚

4.醇的制备
第 五
格氏试剂制备醇: 格氏试剂可与醛、酮加成,水解得到伯醇、仲醇和叔醇。
章
R MgX
R1 CO
R1
R C OMgX H2O
R1 R C OH
醇
无水醚
R2
R2
H
R2
✓ 格氏试剂制备醇的同时,会使碳链增长一个碳原子。
和
✓ 当使用格氏试剂制备醇法逆向分析一个醇的合成时,可能有2种醛或
醚
酮与格氏试剂组合的合成路线,这时需要考虑格氏试剂本身制备的要 求,即伯、仲卤代烷可制备格氏试剂,而叔卤代烷因易发生消除而难
3.醇的化学性质
第 五 章
➢ 选择性氧化剂
欧芬脑尔氧化法:异丙醇铝或叔丁醇铝与丙酮一起,温和氧化仲醇羟基 为酮,不伤及双键三键等活性基团;
H R CR
异丙醇铝/叔丁醇铝
H3C C CH3
R CR
H H3C C CH3
醇
OH
O
O
OH
沙瑞特试剂或琼斯试剂:三氧化铬吡啶或硫酸水溶液(CrO3 /
和
H2SO4 / H2O),温和氧化羟基为醛或酮,且不氧化双、三键;
3.醇的化学性质
第
与活泼金属反应:
五
醇羟基可与活泼金属钠、钾等反应生成醇钠或醇钾
章
ROH
Na
与无机酸成酯:
R ONa
H2
醇 和
醇与有机酸或无机酸都能成酯
2 CH3OH
亲核取代反应:
H2SO4
硫酸二甲酯(CH3O)2SO2
醚
R O H HX
RX
醇与氢卤酸反应的活性顺序为 叔醇 > 仲醇 > 伯醇 可用于鉴别
l2
有机化学课件醇和醚

H
• LiAlH4(负氢离子转移试剂,强还原剂)
1o 醇(R' = H) 2o 醇 1o 醇
1o 醇
从碳基化合物制备
例:
CH3CH2CH2CHO
NaBH4 H2O
CH3CH2CH2CH2OH
O
CH3COH + LiAlH4
无水乙醚
H2O
CH3CH2OH
O
Na
CH3COC2H5 C2H5OH 2 CH3CH2OH
正丁醇 异丁醇 仲丁醇 叔丁醇
b.P. 117℃ b.P. 108℃ b.P. 99.5℃ b.P. 82℃
④ 碳数相同,-OH , b.P.
CH3CH2OH
b.P. 78.5℃
HOCH2CH2OH b.P. 198℃
原因: 醇分子之间能生成氢键
R
R
R
O HH
O HH
O H
O
O
R
R
§10.3 醇的物理性质 3. 水溶性
解二:
O
(CH3)2CHMgX +
无水醚
(CH3)2CHCH2CH2OMgX H2O
(CH3)2CHCH2CH2OH
用环氧乙烷在分子中引入羟乙基
从格氏试剂制备
实例二
OH
制备
C CH3
C2H5
O + CH3CCl
AlCl3
OMgX CCH3 CH2CH3
H+/H2O
用酮制备叔醇
O
CH3CH2MgX
CCH3
醇分子中含有羟基,与水相似,显示一定的酸性。
快,剧烈
1
H-OH + Na
NaOH + H2↑2
• LiAlH4(负氢离子转移试剂,强还原剂)
1o 醇(R' = H) 2o 醇 1o 醇
1o 醇
从碳基化合物制备
例:
CH3CH2CH2CHO
NaBH4 H2O
CH3CH2CH2CH2OH
O
CH3COH + LiAlH4
无水乙醚
H2O
CH3CH2OH
O
Na
CH3COC2H5 C2H5OH 2 CH3CH2OH
正丁醇 异丁醇 仲丁醇 叔丁醇
b.P. 117℃ b.P. 108℃ b.P. 99.5℃ b.P. 82℃
④ 碳数相同,-OH , b.P.
CH3CH2OH
b.P. 78.5℃
HOCH2CH2OH b.P. 198℃
原因: 醇分子之间能生成氢键
R
R
R
O HH
O HH
O H
O
O
R
R
§10.3 醇的物理性质 3. 水溶性
解二:
O
(CH3)2CHMgX +
无水醚
(CH3)2CHCH2CH2OMgX H2O
(CH3)2CHCH2CH2OH
用环氧乙烷在分子中引入羟乙基
从格氏试剂制备
实例二
OH
制备
C CH3
C2H5
O + CH3CCl
AlCl3
OMgX CCH3 CH2CH3
H+/H2O
用酮制备叔醇
O
CH3CH2MgX
CCH3
醇分子中含有羟基,与水相似,显示一定的酸性。
快,剧烈
1
H-OH + Na
NaOH + H2↑2
徐寿昌《有机化学》 课件 第十章 醇、醚

CH3 CH CH2 C H C CH2 CH3 CH3
Z-5-甲基-4-庚烯-2-醇
若烯烃有顺反异构,但没有写出其立体结构,则不必标 出其构型。例:
CH3 CH3 CH CH CH OH CH3 CH CH CH2 CH3
3,7-二甲基-5-辛烯-4-醇
对于多元醇,编号时应使羟基的位次和较小,命名时,分别 标出羟基的位次。
CH3CH2ONa + H2O
CH3CH2OH + NaOH
金属镁可以与醇发生相似的反应,但其反应速度比钠慢。 CH3CH2OH + Mg (CH3CH2O) 2Mg + H2
(CH3CH2O) 2Mg + H2O CH3CH2OH + Mg(OH)2
2、取代反应
卤代烷可以发生水解反应生成醇,但这个反应是可逆的。
HO
CH3
OH
CH3
CH2
OH CH3 CH2
CH2 OH
甲醇
乙醇
正丙醇
CH2 OH
OH CH3 CH CH3
异丙醇
OH CH3 CH CH2 CH3
CH3 CH2 CH2
正丁醇
CH3 CH3 CH CH2 OH
CH3 CH3 C OH CH3
仲丁醇
异丁醇
叔丁醇
一些早期发现且常用的醇也有用俗名表示。例:
3、脱水反应
在加热、酸作用下,醇可发生分子内和分子间脱水,分 别得到烯烃和醚。 H+ CH CH OH HC CH
3 2
170℃
2
2
CH3 CH2 OH
H+
140℃
CH3 CH2 O
CH2 CH3
当酸过量,且反应温度升高时,有利于发生分子内脱水生 成烯烃,低温有利于分子间脱水生成醚。 若反应物含有二种类型的 – H,当发生分子内脱水时服从 查依采夫规则。
Z-5-甲基-4-庚烯-2-醇
若烯烃有顺反异构,但没有写出其立体结构,则不必标 出其构型。例:
CH3 CH3 CH CH CH OH CH3 CH CH CH2 CH3
3,7-二甲基-5-辛烯-4-醇
对于多元醇,编号时应使羟基的位次和较小,命名时,分别 标出羟基的位次。
CH3CH2ONa + H2O
CH3CH2OH + NaOH
金属镁可以与醇发生相似的反应,但其反应速度比钠慢。 CH3CH2OH + Mg (CH3CH2O) 2Mg + H2
(CH3CH2O) 2Mg + H2O CH3CH2OH + Mg(OH)2
2、取代反应
卤代烷可以发生水解反应生成醇,但这个反应是可逆的。
HO
CH3
OH
CH3
CH2
OH CH3 CH2
CH2 OH
甲醇
乙醇
正丙醇
CH2 OH
OH CH3 CH CH3
异丙醇
OH CH3 CH CH2 CH3
CH3 CH2 CH2
正丁醇
CH3 CH3 CH CH2 OH
CH3 CH3 C OH CH3
仲丁醇
异丁醇
叔丁醇
一些早期发现且常用的醇也有用俗名表示。例:
3、脱水反应
在加热、酸作用下,醇可发生分子内和分子间脱水,分 别得到烯烃和醚。 H+ CH CH OH HC CH
3 2
170℃
2
2
CH3 CH2 OH
H+
140℃
CH3 CH2 O
CH2 CH3
当酸过量,且反应温度升高时,有利于发生分子内脱水生 成烯烃,低温有利于分子间脱水生成醚。 若反应物含有二种类型的 – H,当发生分子内脱水时服从 查依采夫规则。
《化学第九章醇和醚》PPT课件

CH3
CH3
C
CH3
O
H OH
3oROH负离子空阻 大,溶剂化作用小。
精选PPT
33
三 碳氧键的断裂,羟基的亲核取代反应
1. 醇和氢卤酸的反应 2. 醇与磺酰氯反应 3. 醇与卤化磷的反应 4. 与氯化亚砜的反应
精选PPT
34
1. 醇和氢卤酸的反应
反应式
ROH + HX
RX + H2O
醇的活性比较: 苯甲型, 烯丙型 > 3oROH > 2oROH > 1oROH > CH3OH
精选PPT
40
4 与氯化亚砜的反应
(1) 反应方程式
R O H+SO C l2
R C l +SO 2 +H C l
该反应的特点是: 反应条件温和,反
精选PPT
13
2、利用格利雅试剂合成
(1)与甲醛合成增加一个碳的伯醇
RMgBr + HCHO 干醚 R-CH2-OMgBr H2O R-CH2-OH
(2) 与其它醛合成仲醇
O
OMgBr
R1-CH + RMgBr 干醚 R1-CH-R H2O R1-CH-R
(3)与酮合成叔醇
O
① RMgBr,干醚
OH
-CH2Cl Na2CO3
H2O
-CH2OH
精选PPT
23
9.3 醇的物理性质、光谱特征
一 物理性质
醇分子之间能形成氢键,沸点较相应分子量的烷烃高。
由于醇分子与水分子之间能形成氢键,三个碳的醇和叔丁醇能 与水混溶。
随着碳原子数的增大氢键减弱,沸点向相应的烷烃靠近;在水 中的溶解性也下降,甚至不溶,高级脂肪醇是表面活性剂。
有机化学醇和醚

* 同分异构 由于烃基的异构和官能团位置的
不同,可引起同分异构现象,另外相 同碳原子的醇和醚也互为构造异构体 ,这种异构体是属于官能团不同的构 造异构体。
2024/6/22
二、 醚的制法 * 醇分子间脱水(详见醇的性质)
此法适合于制取单醚 * 卤烷与醇金属作用(威廉森合成) ● 这是一个双分子亲核取代反应,叫做威廉森 合成法,可用于合成单醚或混醚,但主要用来 合成混醚。
2024/6/22
2024/6/22
* 醇的分类 ● 按羟基所连的碳原子类型: 伯醇(1°醇)
仲醇(2°醇) 叔醇(3°醇)
● 按羟基所连的烃基不同:饱和醇 不饱和醇 芳醇
● 按羟基数目: 一元醇 二元醇 多元醇
2024/6/22
* 异构和命名 ● 异构:醇的构造异构包括碳链异和官能团位
置异构。
2024/6/22
甘油三硝酸酯是一种炸药;磷酸三丁酯用 作萃取剂和增塑剂。
2024/6/22
* 氧化和脱氢(α—H的氧化)
叔醇无α—H,一般氧化剂不能氧化,上述反应 氧化剂可为KMnO4 + H2O、K2Cr2O7 + H2SO4。
由于伯、仲、叔醇氧化后所生成的产物不同,因 此根据氧化产物的结构,可以区别它们。
2024/6/22
* 化学性质 醚的化学性质比较不活泼,在常温下不与
金属钠发生作用,对碱、氧化剂和还原剂都十 分稳定,但能发生下列反应:
● 盐的生成 醚 R-O-R 的氧原子上有未共用电子对,它是
一个路易斯碱,在常温时能溶于强酸,形成 盐, 但醚的碱性很弱,所以生成的 盐遇水很快分解为 原来的醚。此反应可用于醚的提纯和分离。
2024/6/22
2024/6/22
有机化学课件-第五章醇和醚

03
醚不溶于水,但可溶于 有机溶剂。
04
醚的稳定性相对较高, 但在强酸或强碱的作用 下可以发生水解反应。
04
醇和醚的反应
醇的反应
氧化反应
醇可以被氧化生成醛、酮、羧酸等化合物, 如用氧化剂如铬酸、硝酸或过氧化氢等处 理醇,可将其转化为相应的醛或酮。
脱水反应
醇在浓硫酸或高温下可发生脱水反应,生 成烯烃。例如,乙醇在170℃下脱水生成
醛和酮是含有羰基的有机化合物,而醌则是一种具有特殊结 构的有机化合物。这些化合物在化学性质和反应方面有着重 要的应用。
第七章 羧酸及其衍生物
羧酸是含有羧基的有机化合物,其衍生物包括酯、酸酐、酰 胺等。这些化合物在化学工业、食品、医药等领域有着广泛 的应用。
THANKS
感谢观看
醇和醚的结构多样,可以根据 连接的碳原子数、取代基的类 型等进行分类。
醚的性质和反应
醚也是一类含有氧的有机化合物 ,其化学性质与醇类似,但也有 其独特之处,如稳定性较高。
醇和醚的应用
醇和醚在日常生活和工业生产中有 着广泛的应用,如乙醇可以用于消 毒、燃料等,而乙醚则常用于麻醉 。
下章预告
第六章 醛、酮和醌
有机化学课件-第五章醇 和醚
• 引言 • 醇的分类和结构 • 醚的分类和结构 • 醇和醚的反应 • 醇和醚的应用 • 结论
01
引言
醇和醚的简介
醇
是含有羟基的有机化合物,其官能团 为$- OH$。根据与羟基所连碳原子的 类型,醇可分为伯醇、仲醇和叔醇。
醚
是含有醚键的化合物,其官能团为 $R-O-R'$。根据醚键所连碳原子的个 数,醚可分为单醚和双醚。
醇和醚的重要性
醇在日常生活和工业生产中具有广泛 的应用,如乙醇可作为消毒剂、燃料 添加剂和溶剂,而某些高级醇可用于 化妆品和润滑剂的制造。
醇、酚、醚—醚(药学有机化学课件)

三、醚的化学性质
醚的化学性质较稳定,其稳定性仅次于烷烃,常温下不与 稀酸、稀碱、氧化剂、还原剂发生反应。 (一)醚与浓酸作用:生成 盐 醚的氧原子具有孤对电子,可以接受质子生成可溶于强酸的 盐。
生成的盐不稳定,遇水易分解成原来的醚。 此现象可区别醚与烷烃,烷烃不溶于强酸。
(二)醚键的断裂 在浓氢卤酸(HI或HBr)存在下,醚键断裂,生成醇和卤代烃
有机化学/ 醚
醚的结构和命名
•一、醚的结构特征
醚可以看作是醇或酚羟基的氢原子被烃基取代的产物。 醚的通式为:(Ar) R–O -R' (Ar') 醚的官能团是醚键(C-O-C)
醚中氧原子是sp3杂化,C-O-C之间有角度,醚有极性
醚分子间不能形成氢键
•二、醚的分类
单醚
根据与氧原子相连的烃基的结构或方式 混醚
在强酸性环境中形成氧正离子后, C-O键极性加大, 容易断裂。 混醚醚键的断裂发生在小烷基一端; 空阻小的烃基生成卤代烷;空阻大的烃基生成醇或酚
(三)过氧化物的生成
CH3CH2-O-CH2CH3 + O2
hγ
CH3CH2-O-CHCH3
OOH
过氧化物在受热或摩擦等情况下,易发生爆炸。 过氧化乙醚
蒸馏乙醚前,必须检查是否存在过氧化物。 检验方法:淀粉碘化钾试纸。(兰色) 去除过氧化物的方法:用FeSO4、Na2SO3或KI等处理。
乙醚的沸点低,易挥发,易着火,周围要避免明火,以防 引起火灾;乙醚易氧化,贮存时,应放在棕色瓶中。
环醚
【例如】 CH3 O CH3
CH3 O C2H5
• 单醚
混醚
醚
根据与氧原子相连的烃基的不同可分为
CH2 CH2 O
有机化学课件(药学专业)-醇和醚共111页文档

有机化学课(药学专业)-醇和醚
46、法律有权打破平静。——马·格林 47、在一千磅法律里,没有一盎司仁 爱。— —英国
48、法律一多,公正就少。——托·富 勒 49、犯罪总是以惩罚相补偿;只有处 罚才能 使犯罪 得到偿 还。— —达雷 尔
50、弱者比强者更能得到法律的保护 。—— 威·厄尔
46、我们若已接受最坏的,就再没有什么损失。——卡耐基 47、书到用时方恨少、事非经过不知难。——陆游 48、书籍把我们引入最美好的社会,使我们认识各个时代的伟大智者。——史美尔斯 49、熟读唐诗三百首,不会作诗也会吟。——孙洙 50、谁和我一样用功,谁就会和我一样成功。——莫扎特
46、法律有权打破平静。——马·格林 47、在一千磅法律里,没有一盎司仁 爱。— —英国
48、法律一多,公正就少。——托·富 勒 49、犯罪总是以惩罚相补偿;只有处 罚才能 使犯罪 得到偿 还。— —达雷 尔
50、弱者比强者更能得到法律的保护 。—— 威·厄尔
46、我们若已接受最坏的,就再没有什么损失。——卡耐基 47、书到用时方恨少、事非经过不知难。——陆游 48、书籍把我们引入最美好的社会,使我们认识各个时代的伟大智者。——史美尔斯 49、熟读唐诗三百首,不会作诗也会吟。——孙洙 50、谁和我一样用功,谁就会和我一样成功。——莫扎特
醇和醚精品PPT课件
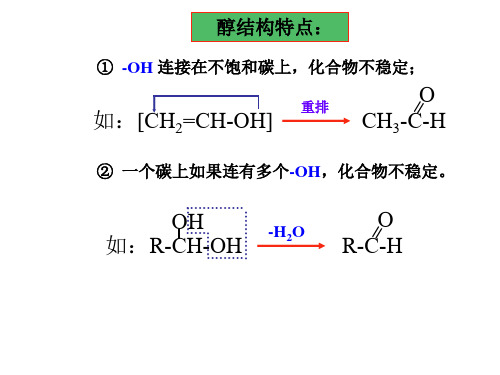
CH3
9 8 % OH
② 有高度的立体选择性——反应属顺式加成
(BH3)2
CH3
H2O2 HO-
OH 8 5 % CH3
2、由醛、酮制备 1) 醛、酮与格氏试剂反应
通式:
C
δ-
O
R MgX
无水乙醚
C
OMgX
H2O H+
Mg(OH)X
R
格氏试剂与甲醛反应制伯醇
C OH R
H
无水乙醚
H C O + R MgCl
4. 与某些无机盐形成结晶醇化合物
MgCl2·6CH3OH 故:
CaCl2·4C2H5OH
① 有机物中有少量醇时,可加无机盐提纯。
② 不能用无水MgCl2、CaCl2、CuSO4 等无机盐干 燥醇。
§10.4 醇的化学性质
1. 与活泼金属反应
快,剧烈
H-OH + Na
NaOH
+
1 2
H2↑
R-OH + Na
慢
RONa +
(共轭碱)
1 2
H2↑
反应活性:
H2O NaOH + R-OH
CH3OH > 1°R-OH > 2°R-OH > 3°R-OH
R OH
CH3 CH OH CH3
从下列数据可以看到醇的酸性比水弱,但醇的共轭 碱RO﹣的碱性却比OH﹣还要强。
pka:
酸性
HOH > CH3OH > CH3CH2OH > (CH3)2CHOH > (CH3)3COH
二元醇: CH2—CH2 OH OH
多元醇: CH2—CH—CH2 OH OH OH
② 按烃基结 构分类:
