第3章 表面活性剂在溶液表(界)面上的吸附
【胶体和界面化学】研究生课件3

H2COOCR
CH2OH 3RCOONa + CHOH
CH2OH
2. R-OSO3M硫酸酯盐 (烷基硫酸盐)R为8~22,M为Na、K , (如十二烷基硫酸钠)
是润湿、乳化分散及去污最好的表面活性剂之一,是在肥 皂之后最老的阴离子表面活性剂,是以用高级醇经硫酸化、 碱中和后制成。由于高表面活性而得到广泛应用,但有两 方面缺点,一是在酸性条件下易水解还原为醇,二是碳原 子数为14-16时室温溶度很小。
第三章:表面活性剂作用原理
§第一节 表面活性剂的分类和化学结构 §第二节 表面活性剂在界面上的吸附 §第三节 表面活性剂在溶液中的状态 §第四节 表面活性剂有序结构 §第五节 表面活性剂的化学结构和性能
的关系
§第一节 表面活性剂的分类和化学结构
1.1 表面活性和表面活性剂 1.2 表面活性剂的分子结构特点 1.3 表面活性剂的分类和化学结构
纺织、印染、农药等工业中常用的调湿剂“拉开粉”即为 一
种烷基(二丁基或二异丙基)萘磺酸盐。萘和丁醇在浓硫酸 石油的磺作酸用盐下即生成二丁基萘磺酸,以碱中和即得萘磺酸盐。
石油磺酸过去常为提炼、纯化白矿油的副产品,与废酸一起 被抛弃。近年来应用越来越广泛。石油磺酸不再作为废品被 弃去,而是在市场上供不应求。实际应用的石油磺酸大部分 是油溶性的,其平均分子量大约在400与580之间(石油磺酸钠)
烷基苯磺酸盐,十二烷基苯磺酸钠,是大多数洗衣粉中的主要 成分,在硬水中一般不生成皂垢,耐酸碱。制造的主要原料是 石油,合成路线:
C10H24CH4 = CH2 +
[HF] C12H25
or[H2SO4]
C12H25
[H2SO4] [SO3]
表面活性剂在溶液表界面上的吸附

04
表面活性剂在溶液表界面 上的应用
乳化与破乳
乳化
表面活性剂能够降低油水界面张力, 使互不相溶的油和水形成稳定的乳浊 液。乳化作用在化妆品、食品、制药 等领域广泛应用。
破乳
在某些情况下,如油水分离、废水处 理等,需要将形成的乳浊液进行破乳 ,使油水分离。表面活性剂可以通过 改变界面性质实现破乳。
感谢您的观看
THANKS
表面活性剂分子在溶液表面上的定向 排列能够降低表面张力,使得液体更 容易润湿固体表面,提高液体的分散 性和乳化性。
表面活性剂的分类
根据分子结构,表面活性剂可分为阴离子型、阳离子型、非离子型和两性离子型 等。
阴离子型表面活性剂如肥皂、烷基硫酸盐等,阳离子型表面活性剂如季铵盐等, 非离子型表面活性剂如聚氧乙烯醚等,两性离子型表面活性剂如甜菜碱等。
润湿与反润湿
润湿
表面活性剂能够降低固体表面与气体 或液体间的界面张力,使固体表面容 易被液体润湿。在涂料、油墨、化妆 品等领域,润湿作用至关重要。
反润湿
与润湿相反,反润湿是指使已被润湿 的表面重新变得不润湿。在某些加工 过程中,如纸张涂层、玻璃镀膜等, 需要控制表面的润湿性,这时就需要 利用反润湿技术。
减阻与起泡
减阻
表面活性剂可以降低流体在管道中的流动阻力,从而提高流体输送的效率。在石油工业、化学工业等领域,减阻 作用具有重要的应用价值。
起泡
表面活性剂可以在液体中形成稳定的泡沫。起泡作用在食品工业(如啤酒、奶制品等)、制药工业(如泡沫灭火 器、泡沫硬化剂等)等领域有广泛应用。
05
表面活性剂在溶液表界面 上的研究进展
新型表面活性剂的开发
总结词
随着科技的发展,新型表面活性剂的开发已成为研究的热点。
《表面活性剂化学》题集

《表面活性剂化学》题集第一章绪论一、选择题1. 关于界面与表面的定义,下列哪项是正确的?()A. 界面是指不同物质相接触的线,表面是指液体与气体接触的面B. 界面是指不同物质相接触的面,表面是指液体与气体接触的线C. 界面是指不同物质相接触的面,表面是指液体与气体接触的面D. 界面和表面都是指液体与气体接触的面2. 表面张力是以下哪个现象的表现?()A. 液体表面层的分子受到向内的吸引力大于向外的吸引力B. 液体表面层的分子受到向外的吸引力大于向内的吸引力C. 液体表面层的分子受到均匀的吸引力D. 液体表面层的分子受到均匀的排斥力3. 下列哪种物质不属于表面活性剂?()A. 肥皂B. 洗发水中的活性成分C. 食盐D. 洗洁精4. 表面活性剂的HLB值代表的是:()A. 氢键长度B. 氢键能量C. 亲水亲油平衡D. 氢键数量5. 关于表面活性剂的活性,以下哪项描述是正确的?()A. 表面活性剂的活性与其分子量成正比B. 表面活性剂的活性与其分子量成反比C. 表面活性剂的活性与其分子结构无关D. 表面活性剂的活性取决于其在界面上的吸附能力二、填空题1. 界面是指两种不同______相互接触的区域,表面是指液体与气体接触时在液体表面形成的一个______薄层。
2. 表面张力是液体表面层的分子间作用力______液体内部,使液体表面具有______收缩的趋势。
3. 表面活性剂是一类能够显著降低液体表面张力的物质,其分子结构通常具有一个或多个______和一个或多个______。
4. 表面活性剂的HLB值反映了其分子的______程度,HLB值越高,亲水性越______,HLB值越低,亲油性越______。
5. 表面活性剂在生活和工业中有广泛的应用,如______、______、______等。
三、简答题1. 请简述界面张力与表面张力的区别。
2. 为什么液体表面层的分子会表现出比内部分子更大的相互作用力?3. 简述表面活性剂如何通过改变分子结构来降低液体表面张力。
(完整word版)表面活性剂

第三章表面活性剂表面活性剂在药物制剂的制备中被广泛应用,其结构特征是具有亲水性与亲脂性两种基团,其作用是能显著降低分散系的表面(界面)张力,因此可用作乳化剂、助悬剂、增溶剂、促吸收剂、润湿剂、起泡剂与消泡剂、去污剂等,是药用乳剂、悬浊剂、脂质体等的重要辅料.本章重点讨论表面活性剂的基本性质(如CMC值、HLB值、Krafft点与昙点等)与测定方法等。
第一节表面活性剂分类一、表面活性剂(surfactant):具有很强表面活性,加入少量就能使液体表面张力显著下降的物质。
1.①纯液体在一定温度有一定的表面张力,是液体的物理常数.②当在水中加入无机盐或糖类物质时,则水的表面张力略有升高;③当在水中加入低级脂肪醇、脂肪酸时,则水的表面张力下降,称此类物质为水的表面活性物质。
④当在水中加入油酸钠、十二烷基硫酸钠(高级脂肪酸)时,则水的表面张力能够显著的降低,称此类物质为该溶剂的表面活性剂(surfactant)。
2.表面活性剂分子的结构特征:是由具有极性的亲水基和非极性的亲油基组成,而且两部分分处两端。
因此,表面活性剂具有既亲水又亲油的两亲性质,但具有两亲性的分子不一定都是表面活性剂。
3.表面活性剂的吸附性:表面活性剂由于其特殊结构可以在两相界面发生定向排列,来改变两相界面性质。
从而起到润湿、乳化、增溶、絮凝、反絮凝、起泡、消泡的作用。
(1)在溶液中的正吸附:表面活性剂在溶液表面层聚集的现象为正吸附,正吸附改变了溶液表面的性质。
最外层疏水,表现低表面张力,产生较好的润湿性、乳化性、增溶性、起泡性.(2)在固体表面的吸附:表面活性剂溶液与固体接触时,表面活性剂分子可能在固体表面发生吸附,使固体表面性质发生改变,易于润湿.二、表面活性剂的类型1。
表面活性剂分类方法有多种,根据来源可分为天然表面活性剂与合成表面活性剂;2。
根据溶解性质可分为水溶性表面活性剂与油溶性表面活性剂;3。
根据极性基团的解离性质分为离子型表面活性剂与非离子型表面活性剂两大类;再根据离子型表面活性剂所带电荷,又分为阳离子、阴离子、两性离子表面活性剂。
第三章 表面活性剂的界面吸附

当:
C2
<<
C2 dγ bγ 0C2 (1) a, Γ = − = , Γ2 ~ C2 成线性关系 RT dC2 RTa
(1) 2
C2 >>
bγ 0 a, Γ = = Γm , RT
(1) 2
称为极限吸附量或饱和吸附量。 Γm 称为极限吸附量或饱和吸附量。 令 k = 1 , Γ (1 ) = Γ k C 2 2 m a 1 + kC 2
0 2 0 1
a2是溶质2的活度,dγ/da2是在等温下,表面张力γ 随 溶质活度的变化率。
吉布斯吸附等温式的推导: 吉布斯吸附等温式的推导:
根据公式 无体积但有表面, 由于表面相 SS 无体积但有表面,因此
在恒定所有强度量的条件下积分上式得: 在恒定所有强度量的条件下积分上式得
上式微分得dU 两个dU 相减,可得: 上式微分得 s,两个 s相减,可得:
s i
n i = n iα + n iβ + n is = c iα V
α
+ c iβ V
β
+ n is
2 吉布斯吸附等温式
• 由于表面吸附,造成在溶液与气相的交界处存在着一个 浓度和性质与两体相不同的表面薄层,它的组成和性质 是不均匀的。此表面层也可理解为是两体相的过渡区域。 如下图(a)所示。 • 吉布斯从另一角度定义了表面相,他将表面相理想化为 一无厚度的几何平面SS,如下图(b)所示,即将表面层 与本体相的差别,都归结于发生在此平面内。根据这个 假设,吉布斯应用热力学方法导出了等温条件下溶液表 面张力随组成变化关系,称为"吉布斯吸附等温式"。
4.2 表面活性剂在固 液界面的吸附等温线 表面活性剂在固-液界面的 液界面的吸附等温线
表面活性剂在溶液表界

降低表面张力
表面活性剂分子具有两亲性,一端亲水,另一端疏水,可以吸附在气-液或液-液 界面上,降低界面张力,使原本不溶的物质得以在表面活性剂的作用下形成乳浊 液或泡沫。
表面张力的大小反映了液体分子在界面上整齐排列的程度,表面张力越低,液体 分子在界面上排列越不整齐,越容易扩展,从而有助于物质的溶解和分散。
形成界面膜
01
当表面活性剂分子吸附在界面上 时,会形成一层分子膜,这层膜 具有稳定性,能够阻止液滴或泡 沫的合并和破裂。
02
在工业生产和日常生活中,利用 表面活性剂形成的界面膜可以起 到防腐蚀、防污、防水等作用, 例如涂层、涂料、润滑油等。
改变界面性质
表面活性剂分子在界面上的吸附可以 改变界面的物理性质,如表面黏度、 摩擦系数、光学性质等。
05
表面活性剂的发展趋势与 未来展望
高性能表面活性剂的研发
高分子表面活性剂
随着高分子化学的发展,高分子 表面活性剂的研发成为新的趋势, 其具有更好的界面活性、更低的 临界胶束浓度和更好的稳定性。
低温和高温表面活
性剂
针对不同温度环境下的应用需求, 研发低温和高温环境下仍能保持 良好性能的表面活性剂。
表面活性剂在溶液表界
目录 CONTENT
• 表面活性剂简介 • 表面活性剂在溶液表界的作用 • 表面活性剂在工业中的应用 • 表面活性剂对环境的影响 • 表面活性剂的发展趋势与未来展
望
01
表面活性剂简介
定义与分类
定义
表面活性剂是一种能够显著降低溶液 表面张力的物质,具有亲水基和疏水 基两部分组成的分子。
表面活性剂在油田开采中用于提高采油效率和降低采油成本。
详细描述
在油田开采过程中,表面活性剂可以用于增加采油量,提高采油效率。通过降低油水界面张力,表面活性剂能够 改善油藏的润湿性,提高原油的流动性,从而有助于提高采收率。此外,表面活性剂还可以用于油田污水处理和 酸化液制备等方面,降低采油成本。
大学表面活性剂复习资料(考试用)

大学表面活性剂复习资料(考试用)表面活性剂化学复习资料名词解释题目第一章表面活性剂的概述1.表面:液体或固体和气体的接触面。
(物质和它产生的蒸汽或者真空接触的面)2. 界面:液体与液体,固体与固体或液体的接触面。
(物质相与相之间的分界面称之为界面)3. 表面张力:指垂直通过液面上任一单位长度、与液面相切的收缩表面的力(N/m)。
4. 表面自由能:指液体增加单位表面上所需做的可逆功,或恒温恒压下增加单位表面积时体系自由能的增值,或单位表面上的分子比体相内部同分子量所具有的自由能过剩值,称为表面自由能(J/m2)。
5. 表面活性:在液体中加入某种物质使液体表面张力降低的性质叫表面活性。
如肥皂中的脂肪酸钠,洗衣粉中的烷基苯磺酸钠等。
6. 表面活性剂:是指在某液体中加入少量某物质时就能使液体表面张力急剧降低,并且产生一系列应用功能,该物质即为表面活性剂。
第二章表面活性剂的作用原理1. 吸附:表面上活性剂这种从水内部迁至表面,在表面富集的过程叫吸附。
2. 低表面能固体:表面活性剂的表面能<100mJ/m2的物质3. 高表面能固体:表面活性剂的表面能>100mJ/m2的物质。
4. 胶束:两亲分子溶解在水中达一定浓度时,其非极性部分会互相吸引,从而使得分子自发形成有序的聚集体,使憎水基向里、亲水基向外,减小了憎水基与水分子的接触,使体系能量下降,这种多分子有序聚集体称为胶束。
(2)反胶束:表面活性剂在有机溶剂中形成极性头向内,非极性头尾朝外的含有水分子内核的聚集体,称为反胶团。
(3)临界胶束浓度:表面活性剂溶液的表面张力随着活性剂浓度的增加而急剧地降低,但是当浓度增加到一定值后,表面张力随溶液浓度的增加而变化不大,此时表面活性剂从分子或离子分散状态缔合成稳定的胶束,从而引起溶液的高频电导、渗透压、电导率等各种性能发生明显的突变,这个开始形成胶束的最低浓度称为临界胶束浓度(CMC)。
(4)亲水-亲油平衡值(HLB):系表面活性剂中亲水和亲油基团对油或水的综合亲合力,是用来表示表面活性剂的亲水亲油性强弱的数值。
表面活性剂化学复习

33
复习要点:1非离子表面活性剂的吸附量计算。 2表面活性剂的吸附固体表面的影响
第四章
表面活性剂溶液体相性质
35
4.2表面活性剂在溶液中的胶团化作用
(a)极稀溶液;(b)稀溶液;(c)临界胶团浓度的溶液;(d)大于临界胶团浓度的溶液
胶团:表面活性剂分子中的亲油基通过分子间的吸引力
相互缔合在一齐,而亲水基朝向水中的胶态聚集物。 临界胶团浓度:形成胶团时的浓度 (cmc)。
44
4.7临界胶束浓度性质特点
cmc愈小,表面活性愈高; cmc愈低,改变界面状态起到润湿、乳化、加溶、起 泡、洗涤等作用所需的表面活性剂浓度愈低; cmc是表面活性剂的—个重要物理化学参数
45
4.8加溶作用
加溶作用:在水溶液中表面活性剂的存在能使难溶 于水的有机物的表观溶解度高于纯水中的溶解度,此
3.1Gibbs公式
C 2
Γ2
(1 )
C2 RT
(
)T
若 γ 单 位 是 dyn.cm-1(erg.cm-2) , R 的 单 位 是 8.31×107erg.mol-1.K-1,Γ单位是mol.cm-2;若γ单 位是mN.m-1(mJ.m-2),R的单位是8.31J.mol-1.K-1 , Γ单位是mol.m-2 22
HLB
W A HLB
A
W B HLB
.B
....
W A W B ...
Example:
含30%Span80(HLB=4.3)和70%Tween80(HLB=15) 的混合乳化剂的HLB值:
HLB=0.30×4.3十0.70×15.0=1.8
9
第二章表面活性剂分类 2.1阴离子表面活性剂
表面活性剂在溶液表界面上的吸附

线,用任意溶质的浓度或总浓度作γ- lgc曲线, 再用前述方法算出体系的总吸附量。
18
3.1 表面活性剂在气-液界面的吸附
3.1.2 Gibbs公式在表面活性剂溶液中的应用 2.表面吸附量的计算 (2)混合体系 ② 单组分吸附量 欲求一种表面活性剂(i)的吸附量Γi,可固定其
(γ),由γ- c曲线(常用γ- lgc)得某一浓度(c) 时的曲线斜率dγ/dc 应用吉布斯公式,即可求出某一浓度(c)时的表面 吸附量Γ。
17
3.1 表面活性剂在气-液界面的吸附
3.1.2 Gibbs公式在表面活性剂溶液中的应用 2.表面吸附量的计算 (2)混合体系 对于表面活性剂混合物,可利用Gibbs吸附公式计
2
引言
例如:活性炭给液体脱色,分子筛催化剂起催化作用,肥 皂有乳化作用。
表面活性剂在溶液表面、油水界面或固体表面上的吸附, 会改变表面或界面状态,影响界面性质,从而产生一系列 在应用中很重要的现象,如润湿、乳化、起泡、洗涤作用。
对表面活性剂在界面上的吸附作溶液研究,是非常重要的。 吸附现象发生在各种界面上,溶液的吸附量不像固体的吸
第3章 表面活性剂在溶液表 (界)面上的吸附
1
引言
吸附 溶质从水溶液内部迁至表(界)面,在表(界)面富集的过程叫吸附。 广义地讲,凡是组分在界面上的浓度出现差异的现象统称为吸附。 若组分在界面浓度高于体相中的,称为正吸附,反之为负吸附。 一般无特别说明,均为正吸附。 吸附可发生在各种界面上。
相同的物理化学性质。而实际上,溶液从液相到气相的界 面部分,存在一个平均密度连续变化区。 也就是说,两种完全不混溶物两相在接触时,交界处并非 有一个界限分明的几何面将两相分开,而是存在一个界线 不很清楚的薄薄一层,其成分和性质皆不均匀。 我们将此与体相不同的且组成不断变化的只有几个分子厚 度的区域称为表(界)面相,通常以σ表示。 组分在表面和体相内部浓度的差异用表面过剩来表示。
表面活性剂

绪论1.表面活性物质:凡是能降低溶剂表面张力的物质——有机酸、醇、醛溶液2.非表面活性物质:不能降低溶剂表面张力的物质——NaCl、Na2SO4等3.表面活性剂:在浓度很低时能大大降低溶剂的表面张力,在浓度达到一定值时,随浓度的增加,表面张力不再变化或变化不明显的物质——C8以上有机酸、有机胺盐、磺酸盐、苯磺酸盐4.表面活性剂的功能:①在表(界)面上吸附,形成吸附膜②在溶液内部自聚,形成胶团5.表面活性剂分类:⑴阴离子型:极性基带负电——羧酸盐(RCOO-M+)、磺酸盐(RSO3-M+)、硫酸酯盐(ROSO3-M+)、磷酸盐(RPO4-M+)⑵阳离子型:极性基带正电——季铵盐(RN+R’3 A-)、胺盐(RnNHm+A-,m=1~3,n=1~3)⑶两性型:正电性基团主要为氨基、季铵基,负电性基团主要是羧基和磺酸基。
氨基酸型:R-NH(CH2)n-CH2COO- 甜菜碱型:RN+(CH3)2CH2COO-咪唑啉型:N----CH2----CH2|| |R——C————-N+——CH2CH2OH|CH2COO-⑷非离子型:极性基不带电①多元醇类化合物(蔗糖酯型、甘油酯型、失水山梨醇脂肪酸酯——司盘)②聚乙二醇型(OP型——烷基酚聚氧乙烯醚平平加型——脂肪醇聚氧乙烯醚吐温型——聚山梨酯)⑸混合型:两种亲水基团,一种带电,一种不带电醇醚硫酸盐 R(C2H4O)nSO4Na6.表面张力:作用于液体表面单位长度上使表面收缩的力(N/m)第一章表面活性剂的功能及其作用1.临界溶解温度(Tk 克拉夫特点):离子型表面活性剂在水中的溶解度随温度的上升逐渐增加,当达到某一特定温度时,溶解度急剧陡升,该温度称为临界溶解温度2.Sa的浊点:非离子表面活性剂在水中的溶解度随温度的上升而降低,升至某一温度,溶液出现浑浊,经放置或离心可得到富胶团和贫胶团两个液相,这个温度称为该Sa的浊点(Tp)亲水基相同时,亲水基增加,亲水性升高,浊点升高;亲水基加成数固定,碳增加,亲油性升高,浊点降低。
表面活性剂
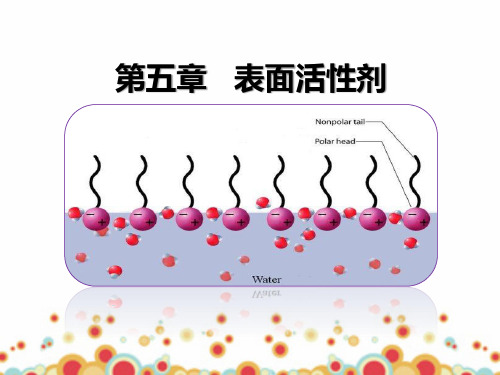
·表面活性剂 ·表面活性剂在界面上的吸附
·胶束理论
·表面活性剂亲水亲油平衡问题
·表面活性剂作用及应用
第一节 表面活性剂概述
一、溶液的表面张力
2 cos h gr
H2O
C2H5OH (aq)
NaCl (aq)
溶液的表面张力不仅与温度、压力有关, 并且还与溶液的种类和浓度有关。
(三)两性表面活性剂
• 两性表面活性剂基本不刺激皮肤和眼睛;在相当宽的pH值 范围内都有良好的表面活性作用;它们与阴离子、阳离子、 非离子型表面活性剂都可以兼容。由于以上特性,可用作 洗涤剂、乳化剂、润湿剂、发泡剂、柔软剂和抗静电剂。
• 主要品种:甜菜碱衍生物、咪唑啉衍生物等。
(四)非离子表面活性剂 • 非离子表面活性剂因在水中不电离以及能够精细地改变分 子结构而具有独特的性质。 • 非离子表面活性剂去除油性污垢的能力很强,而且具有防 止污垢在合成纤维表面再沉积的能力。它们的临界胶束浓 度也比离子型表面活性剂低一到二个数量级。
B、脂肪醇聚氧乙烯醚硫酸盐(AES) • 脂肪醇聚氧乙烯醚硫酸盐又称脂肪醇硫酸盐。由于分 子中加入了乙氧基使其具有很多优点,如抗硬水性强, 泡沫适中而稳定,溶解性好。缺点是在酸性和强碱性 条件下不稳定,易于水解。 • AES采用C12~C14的椰油醇为原料,有时也用C12~C16 醇,与2 ~4分子环氧乙烷缩合。再进一步进行硫酸化, 中和可用氢氧化钠、氨或乙醇胺。
0 与c成对数关系 0
②当浓度小时
cB / c o cB ln(1 ) a a 0 cB =b =kcB 0 a
0 与c成线性关系 0
表面活性剂的分子结构: ①具有长碳链(碳原子数大于8)的极性有机化合物。 ②从结构上看,表面活性物质是两亲分子,一端亲水(-OH, -COOH,-SO3Na等),另一端亲油(憎水)(-R等)。 虽然表面活性剂分子是两亲性分子,但并不是所有的两亲 性分子都是表面活性剂,只有亲油部分足够长的两亲性物质 才是表面活性剂。
《表面活性剂化学》第三章习题

第三章表面活性剂在界面上的吸附一、选择题1. 表面活性剂在界面上的吸附主要是由于其分子结构中的哪两部分之间的相互作用?()A. 亲水头部和疏水尾部B. 疏水头部和亲水尾部C. 两个亲水头部D. 两个疏水尾部2. Gibb吸附公式中,ΔG代表什么?()A. 吸附过程中的吉布斯自由能变化B. 吸附过程中的焓变C. 吸附过程中的熵变D. 吸附过程中的活化能3. 在气-液界面上,表面活性剂的吸附通常导致以下哪种现象?()A. 表面张力降低B. 表面张力增加C. 溶液粘度降低D. 溶液粘度增加4. 下列哪种因素不影响表面活性剂在固-液界面上的吸附?()A. 固体表面的性质B. 溶液的pH值C. 溶液的温度D. 溶液的体积5. 表面活性剂在界面上吸附达到平衡时,以下哪个描述是正确的?()A. 吸附速率等于脱附速率B. 吸附速率大于脱附速率C. 吸附速率小于脱附速率D. 吸附速率和脱附速率都不变二、填空题1. 表面活性剂在界面上的吸附是由于其分子结构中的______和______两部分之间的相互作用,这种相互作用使得表面活性剂分子在界面上形成______排列。
2. Gibb吸附公式是______,其中ΔG是______,R是______,T是______,π是______,c是______。
3. 在气-液界面上,表面活性剂的吸附会导致表面张力______,这是由于表面活性剂的______部分覆盖了液体表面,减少了表面分子的______。
4. 表面活性剂在固-液界面上的吸附受到多种因素的影响,包括______、______和______,这些因素共同决定了吸附的______和______。
5. 当表面活性剂在界面上吸附达到平衡时,吸附层中的表面活性剂分子会形成一种______结构,这种结构称为______,它对界面的性质有显著影响。
三、简答题1. 简述表面活性剂在界面上的吸附过程,包括吸附的初始阶段、中间阶段和平衡阶段的特点。
表面活性剂化学知识点

表面活性剂化学知识点第一讲 表面活性剂概述1、降低表面张力为正吸附,溶质在溶液表面的浓度大于其在溶液本体中的浓度,此溶质为表面活性物质。
增加表面张力为负吸附,溶质在溶液表面的浓度小于其在溶液本体中的浓度,此溶质为表面惰性物质。
2、表面张力γ :作用于单位边界线上的这种力称为表面张力,用 γ表示,单位是N ·m-1。
影响纯物质的γ的因素(1) 物质本身的性质(极性液体比非极性液体大,固体比液体大)(2) 与另一相物质有关。
纯液体的表面张力是指与饱和了其本身蒸汽的空气之间的界面张力。
(3)与温度有关:一般随温度升高而下降.(4)受压力影响较小.3、表面活性剂的分子结构特点“双亲结构”亲油基:一般是由长链烃基构成,以碳氢基团为主亲水基:一般为带电的离子基团和不带电的极性基团疏水基的疏水性大小:脂肪烷基>脂肪烯基>脂肪烃-芳基>芳基>带有弱亲水基的烃基。
相同的脂肪烃疏水性强弱顺序:烷烃>环烷烃>烯烃>芳香烃。
从HLB 值考虑,亲水基亲水性的大小排序: -SO4Na 、-SO3Na 、-OPO3Na 、-COONa 、—OH 、—O -极性头 8-18C 长链烷基等非极性基团4、离子表面活性剂(一)阴离子表面活性剂:起表面活性作用的部分是阴离子。
1)高级脂肪酸盐:①通式:(RCOO)n-Mn+脂肪酸盐②分类:一价金属皂(钾、钠皂);二价或多价皂(铅、钙、铝皂);有机胺皂(三乙醇胺皂)③性质:具有良好的乳化能力,易被酸及多价盐破坏,电解质使之盐析。
④应用:具有一定的刺激性,只供外用。
2)硫酸化物:①通式:R-OSO3-M+②分类:硫酸化油(硫酸化蓖麻油称土耳其红油);高级脂肪醇硫酸脂(十二烷基硫酸钠) 。
③性质:可与水混溶,为无刺激的去污剂和润湿剂;乳化性很强,稳定、耐酸、钙,易与一些高分子阳离子药物发生沉淀。
④应用:代替肥皂洗涤皮肤;有一定刺激性,主要用于外用软膏的乳化剂。
有时也用于片剂等固体制剂的润湿剂或增溶剂。
第三章表面活性剂

a M
2RTA d ln aA
(1) 2
1 2RT
(d
d
ln
a)T
2RT形式
0.059 z z
I
1 2
式中a f c;lg f
1
1 0.33I 2
z :离子强度 :离子间距离
若在溶液中加入过量的,与表面活性离子具有共 同反离子的中性无机盐。如:Na+A-中加入NaCl, 并使其浓度远远大于SAa浓度
形成浊点的原因: 非离子型表面活性剂的 极性基团易与水形成氢键而提高其溶解能 力。温度升高至一定程度时,SAa与水间 的氢键作用削弱而不足以维持其溶解状态。
④在cmc以上表现出可以溶油的特性(加溶作用)
上述特性可归结为表面活性剂的两大特点: 即易在表面发生吸附和在一定浓度形成胶团 等分子有序组合体有关。
(3)聚氧乙烯烷基酰胺 O
CR
H(OC2H4)x O
O(C2H4O)zH
OH
OH
R-CONH(C2H4O)nH
常用作起泡剂、增粘剂
O(C2H4O)yH
OH
(4)多元醇型 主要是失水山梨醇的脂肪酸酯及其聚氧乙烯加成物
Span类 及 Tween类表面活性剂即属此类
具有低毒的特点,广泛用于医药工业、食品工业以及生化实验
极性基团:大的基团γcmc也大(一般) ②决定降低表面张力的因素是最外层基团(吸附层) 的结构、组成
-CF3>-CF2>-CH3>-CH2->-CH=CH- ③链长对γcmc影响不大,一般CH链增长,γcmc↓ ④具有分枝结构的γcmc小(CH3变多,CH2减少)
C:表面活性剂溶液表面吸附之效用
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1
引言
吸附 溶质从水溶液内部迁至表(界)面,在表(界) 面富集的过程叫吸附。 广义地讲,凡是组分在界面上的浓度出现 差异的现象统称为吸附。 若组分在界面浓度高于体相中的,称为正 吸附,反之为负吸附。 一般无特别说明,均为正吸附。 吸附可发生在各种界面上。
32
*Langmuir单分子层吸附理论
33
*Langmuir单分子层吸附理论
兰缪尔关系式是一个理想的吸附公式(均 匀的表面及被吸附的分子之间没有作用 力),它在吸附理论中起的作用相当于理 想气体状态方程在气体理论中起的作用 不同的是理想气体实际并不存在,而理想 吸附实际是存大的。 有了这个公式,就可以以它对基础,提出 其它对的吸附理论。所以,它对吸附理论 的发展起着非常重要的作用。
3.1.2 Gibbs公式在表面活性剂溶液中的应用
5. 饱和吸附层的厚度 从Гm可以求出饱和吸附层的厚度:
m M
M为吸附物的摩尔质量,ρ溶液密度
22
3.1 表面活性剂在气-液界面的吸附
3.1.3 表面活性剂在溶液表面的吸附等温线
1.吸附等温线 测定恒温时不同浓度溶液的表面张力,应用吉布 斯公式求得吸附量Γ,作Γ-c曲线,即得吸附等温 线。 表面活性物质在液体表面层吸附已经很多实验证 明是单分子层吸附,因此可用朗格缪尔 (Langmuir)单分子层吸附方程描述。
3.1 表面活性剂在气-液界面的吸附
Langmuir
25
3.1 表面活性剂在气-液界面的吸附
Langmuir
26
3.1 表面活性剂在气-液界面的吸附
Langmuir
27
3.1 表面活性剂在气-液界面的吸附
Langmuir
28
3.1 表面活性剂在气-液界面的吸附
Langmuir
23
3.1 表面活性剂在气-液界面的吸附
Langmuir 1881 年1 月31 日出生于纽约的一个贫民家庭,1903 年毕业于哥伦比亚大学矿业学院。1906 年在德国格廷根 (Gottingen)大学获化学博士学位。 1909 年起在纽约的通用电气(GE)实验室工作。1912 年研制成功高真空电子管,使电子管进入实用阶段。 1913 年研制出充氮、充氩白炽灯。随后发明氢原子焊枪 和其它声学器件。在电子发射、空间电荷现象、气体放电、 原子结构及表面化学等科学研究方面也做出了很大贡献。 因在原子结构和表面化学方面取得的成果,荣获1932年 度诺贝尔化学奖。 1940 年起对气象物理学、人工降雨(越战)试验开展了许 多重要的研究工作。1957 年8 月16 日在马萨诸塞州的 24 法尔默斯逝世。
3.1.2 Gibbs公式在表面活性剂溶液中的应用 1. 表面活性剂在溶液表面吸附时的Gibbs公式 表面活性剂溶液的浓度一般很小,可用浓度代替活度,由 此可得出表面性剂的吸附通式:
d i d ln ci RT
由此可推出各类单一和混合表面活性剂的吸附公式。
13
3.1 表面活性剂在气-液界面的吸附
胶体与界面化学-陈宗淇等
31
*Langmuir单分子层吸附理论
基本假设 1.气体分子碰撞在已吸附的分子上是弹性碰撞, 只有碰撞在空白表面上时才被吸附,就是说,吸 附层是单分子层的。 2.吸附分子从表面跃回气相的概述不受周围环境 和位置的影响,这表明吸附质(被吸附物质)分子 间无作用力,而且表面是均匀的。 3.吸附速率与解吸速率相等时,达到吸附平衡。
2
引言
例如:活性炭给液体脱色,分子筛催化剂起催化作用,肥 皂有乳化作用。 表面活性剂在溶液表面、油水界面或固体表面上的吸附, 会改变表面或界面状态,影响界面性质,从而产生一系列 在应用中很重要的现象,如润湿、乳化、起泡、洗涤作用。 对表面活性剂在界面上的吸附作溶液研究,是非常重要的。 吸附现象发生在各种界面上,溶液的吸附量不像固体的吸 附量那样易于直接测量。通常通过表面张力测定结果来推 算。 1875年,Gibbs用热力学方法推导出表面张力、溶液浓 度和吸附量之间的关系,是各种计算的基础。
4
3.1 表面活性剂在气-液界面的吸附
3.1.1 吸附的表征-表面过剩和吉布斯 (Gibbs)吸附公式 1. 表面过剩(Γ) 设在σ面以上(或下)的浓度
是全体一致的,而且就是体 相的浓度。如果界面上实际 溶质的量为n, α 和β 相的 溶质量分别为nα和nβ,则三 者之间的关系为:
n =nα+nβ + nσ
34
* 其它等温式
由于大多数体系都不能在较宽广的θ范围内符合 Langmuir等温式,因此后人提出了一些其他等温式。 Freundlich等温式 Freundlich等温式只是一个经验式,它所适用的范围, 一般来说比Langmuir 等温式要大一些,但它也只能代 表一部分事实。 Freundlich等温式的特点是它没有饱和吸附值,它广泛 应用于物理吸附,化学吸附,也可应用于从溶液中的吸附。 乔姆金方程式 乔姆金方程式 这个公式也只适用于覆盖率不大的情况。在处理一些工业 上的催化过程如合成氨过程,造气变换过程中,常使用这 个公式。 BET等温式
18
3.1 表面活性剂在气-液界面的吸附
3.1.2 Gibbs公式在表面活性剂溶液中的应用
2.表面吸附量的计算 (2)混合体系 ② 单组分吸附量 欲求一种表面活性剂(i)的吸附量Γi,可固定其它 表面活性剂的浓度,即配制只有一种溶质(i)的浓 度改变,其余溶质浓度皆保持恒定的系列溶液, 测定γ- lgc曲线, 自此求得分吸附量。
3
3.1 表面活性剂在气-液界面的吸附
3.1.1 吸附的表征-表面过剩和吉布斯(Gibbs)吸附公式 1. 表面过剩(Γ) 对一个溶液相而言,通常人们认为它是均匀的,并且具有 相同的物理化学性质。而实际上,溶液从液相到气相的界 面部分,存在一个平均密度连续变化区。 也就是说,两种完全不混溶物两相在接触时,交界处并非 有一个界限分明的几何面将两相分开,而是存在一个界线 不很清楚的薄薄一层,其成分和性质皆不均匀。 我们将此与体相不同的且组成不断变化的只有几个分子厚 度的区域称为表(界)面相,通常以σ表示。 组分在表面和体相内部浓度的差异用表面过剩来表示。
17
3.1 表面活性剂在气-液界面的吸附
3.1.2 Gibbs公式在表面活性剂溶液中的应用
2.表面吸附量的计算 (2)混合体系
对于表面活性剂混合物,可利用Gibbs吸附公式 计算总吸附量和单组分吸附量。
① 总吸附量: 测定溶液各组分浓度按比例改变时的表面张力曲 线,用任意溶质的浓度或总浓度作γ- lgc曲线, 再用前述方法算出体系的总吸附量。
其意义为:相应于相同量的溶剂时,表面层中单位面积上 溶质的量比溶液内部多出的部分,而不是单位面积上溶质 的表面浓度。
10
3.1 表面活性剂在气-液界面的吸附
3.1.1 吸附的表征-表面过剩和吉布斯(Gibbs)吸附公式 3. Gibbs公式验证: 20世纪30年代,McBain和他的学生们精心设计了一个装 置,让一个刀片以每秒钟11m的速度从溶液表面刮下一薄 层液体,其厚度大约为0.1mm。 根据被刮下液体的质量m和溶质的质量分数ω,以及原用 溶液溶质的质量分数ω 0和刮过的液面面积A,可按下式计 算出表面吸附量:
3.1.1 吸附的表征-表面过剩和吉布斯(Gibbs)吸 附公式 1. 表面过剩(Γ) 意义: 其意义是若自1cm2的溶液表面和内部各取一 部分,其中溶剂的数目一样多,则表面部分的溶 质比内部所多的摩尔数,单位为mol/cm2。 ①Г是过剩量; ② Г的单位与普通浓度的不同; ③ Г可以是正的,也可是负的。
2
(1)
m( 0 ) A(1 )
表列出他们的一些典型的结果,并与应用Gibbs吸附公式 自表面张力曲线计算的数值相比较。
11
3.1 表面活性剂在气-液界面的吸附
3.1.1 吸附的表征-表面过剩和吉布斯(Gibbs)吸附公式 3. Gibbs公式验证:
-
12
3.1 表面活性剂在气-液界面的吸附
5
3.1 表面活性剂在气-液界面的吸附
3.1.1 吸附的表征-表面过剩和吉布斯 (Gibbs)吸附公式 1. 表面过剩(Γ)
nσ = n –(nα+nβ)
nσ表示在表面相某一平面ss’上溶质的过剩
量,如果该表面相的面积为A,则单位面积上 溶质的过剩量可表示为:
n A
=Γ
6
3.1 表面活性剂在气-液界面的吸附
29
*Langmuir单分子层吸附理论
Θ为表面覆盖率
30
*Langmuir单分子层吸附理论
Langmuir(朗缪尔)在研究低压下气体在金属上 的吸附时,根据实验数据发现了一些规律,然后 又从动力学的观点提出了一个吸附等温式,并总 结出Langmuir单分子层吸附理论。 他认为当气体分子碰撞固体表面时,有的是弹性 碰撞,有的是非弹性碰撞。若是弹性碰撞,则分 子跃回气相,并且与表面没有能量交换;若是非 弹性碰撞,则分子就逗留在表面上,经过一段时 间后才跃回气相。 吸附现象就是气体分子在固体表面上的逗留。
3.1.2 GibБайду номын сангаасs公式在表面活性剂溶液中的应用 1. 表面活性剂在溶液表面吸附时的Gibbs公式
14
3.1 表面活性剂在气-液界面的吸附
3.1.2 Gibbs公式在表面活性剂溶液中的应用 1. 表面活性剂在溶液表面吸附时的Gibbs公式
15
3.1 表面活性剂在气-液界面的吸附
3.1.2 Gibbs公式在表面活性剂溶液中的应用 1. 表面活性剂在溶液表面吸附时的Gibbs公式
