《共价键原子晶体oy》PPT课件
合集下载
苏教版化学选修3《共价键 原子晶体》ppt课件6

3. 共价键的特征
(1)具有饱和性
在成键过程中,每种元素的原子有 几个未成对电子通常就只能形成几个 共价键,所以在共价分子中每个原子 形成共价键数目是一定的。
形成的共价键数 未成对电子数
(2)具有方向性 p
▪ 在形成共价键时,两个参与成键的原子轨道总 是尽可能沿着电子出现机会最大的方向重叠成 键,而且原子轨道重叠越多,电子在两核间出 现的机会越多,体系的能量下降也就越多,形 成的共价键越牢固。因此,一个原子与周围的 原子形成的共价键就表现出方向性( s 轨道与 s 轨道重叠形成的共价键无方向性,例外)。
能量降低
5.成键的条件: 电负性相同或差值小的非金属原子之
间且成键的原子最外层未达到饱和状态, 即成键原子有未成对电子。
6.存在范围: 非金属单质
共价化合物
离子化合物
7.影响共价键强弱的主要因素
键长(成键原子的核间距)
一般键长越 小 ,键能越 大 ,共价键 越 牢固 ,分子就越 稳定 。
只 共价化合物:相邻的原子之间 以共价键相连的化
旋从 方核 向间 来距 情观和 况察成 。能键 量电 的子 变的 化自 相距很远的两个核外电子自旋方向相反的氢原子相互
逐渐接近,在这一过程中体系能量将 先变小后变大
1. 共价键的形成条件
电子配对原理
最大重叠原理
两原子各自提供 1个自旋方向相 反的电子彼此配 对。
两个原子轨道重叠部分越 大,两核间电子的概率密 度越大,形成的共价键越 牢固,分子越稳定。
4.双个氢原子如何形成氢分子?
两个核外电子自旋方向相反的氢原子靠近
v
V:势能 r:核间距
0
r
r0
v
V:势能 r:核间距
化学课件《共价键、原子晶体》优秀ppt 苏教版

2、2个氢原子一定能形成氢分子吗?
3、未成对电子是怎样形成共用电子对的? 形成时有何要求?
4、为什么C、N、O、F与H形成简单的化合 物(CH4、NH3、H2O、HF)中H原子数不等?
三、共价键的特点
1、具有饱和性 形成的共价键数 = 未成对电子数
2、具有方向性
p
①头碰头重叠——σ键
H·+ H·
知识拓展-石墨 石墨晶体结构
石墨
• 石墨为什么很软?
– 石墨为层状结构,各层之间是范德华力结合,容 易滑动,所以石墨很软。
• 石墨的熔沸点为什么很高(高于金刚石)?
– 石墨各层均为平面网状结构,碳原子之间存在很 强的共价键(大π键),故熔沸点很高。
• 石墨属于哪类晶体?为什么?
– 石墨为混合键型晶体
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
H:H
相互 靠拢
s—s
H·+ ·C····l··
H ····C··l··
p—s
··C····l·+ ··C···l··
···C···l····C··l··
+
p—p
②肩并肩重叠——π键
乙烷、乙烯和乙炔分子中 的共价键分别由几个σ键和几 个π键组成?
乙烷: 7 个σ键;乙烯: 5 个σ键 1个 π键;乙炔: 3 个σ键 2 个π键
–碳化硅(SiC)晶体、氮化硼(BN)晶体
• 某些氧化物:
3、未成对电子是怎样形成共用电子对的? 形成时有何要求?
4、为什么C、N、O、F与H形成简单的化合 物(CH4、NH3、H2O、HF)中H原子数不等?
三、共价键的特点
1、具有饱和性 形成的共价键数 = 未成对电子数
2、具有方向性
p
①头碰头重叠——σ键
H·+ H·
知识拓展-石墨 石墨晶体结构
石墨
• 石墨为什么很软?
– 石墨为层状结构,各层之间是范德华力结合,容 易滑动,所以石墨很软。
• 石墨的熔沸点为什么很高(高于金刚石)?
– 石墨各层均为平面网状结构,碳原子之间存在很 强的共价键(大π键),故熔沸点很高。
• 石墨属于哪类晶体?为什么?
– 石墨为混合键型晶体
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
H:H
相互 靠拢
s—s
H·+ ·C····l··
H ····C··l··
p—s
··C····l·+ ··C···l··
···C···l····C··l··
+
p—p
②肩并肩重叠——π键
乙烷、乙烯和乙炔分子中 的共价键分别由几个σ键和几 个π键组成?
乙烷: 7 个σ键;乙烯: 5 个σ键 1个 π键;乙炔: 3 个σ键 2 个π键
–碳化硅(SiC)晶体、氮化硼(BN)晶体
• 某些氧化物:
3-3共价键、原子晶体[1]
![3-3共价键、原子晶体[1]](https://img.taocdn.com/s3/m/7b887a6d1a37f111f0855bbd.png)
C、配位键---由一个原子提供一对电子与另一个接受电 子的原子形成教的材共第价4键7页;交--流-特与殊讨的论共价键
信息提示:一般情况下,两个成键原子间的电负性差 值越大,两个成键原子间形成的共价键的极性越强。
简单介绍
A、σ键:“头碰头”
s—s px—s px—px
++Leabharlann -++
-
++
形成σ键的电子
X
成键本质
金属离子和自 由电子间的静
电作用
阴阳离子间的 静电作用
成键原子轨道 的最大重叠
键的方向性 和饱和性
没有方向性 和饱和性
没有方向性 和饱和性
有方向性和 饱和性
影响键强弱 的因素
金属原子半 径和价电子
数
离子半径和 离子电荷数
键长
称为σ电子。
原子轨道沿核间
X
连线重叠(即头碰
头方式)形成的共
-
价键,叫σ键。
X
pZ—pZ
I
+
I
+
B、π键:“肩并肩”
ZZ
X
原子轨道在核间连线 两侧进行重叠(即采用 肩并肩)方式形成的共 价键,叫π键。
形成π键的电子 称为π电子。
教材第46页问题解决
有机物中的共价键类型
①C — H 是σ键; ②C — C 是σ键; ③C = C 一个σ键,一个π键; ④ C ≡C一个σ键,两个π键;
[问题解决]根据表中所示原子的电子排布式和轨道表 示式,结合你对共价键的理解,说明为什么它们与氢 原子形成的简单化合物分别为NH3、H2O和HF?
请写出氮气、氧气、氟气的电子式与结构式?
共价键的几种重叠方式
信息提示:一般情况下,两个成键原子间的电负性差 值越大,两个成键原子间形成的共价键的极性越强。
简单介绍
A、σ键:“头碰头”
s—s px—s px—px
++Leabharlann -++
-
++
形成σ键的电子
X
成键本质
金属离子和自 由电子间的静
电作用
阴阳离子间的 静电作用
成键原子轨道 的最大重叠
键的方向性 和饱和性
没有方向性 和饱和性
没有方向性 和饱和性
有方向性和 饱和性
影响键强弱 的因素
金属原子半 径和价电子
数
离子半径和 离子电荷数
键长
称为σ电子。
原子轨道沿核间
X
连线重叠(即头碰
头方式)形成的共
-
价键,叫σ键。
X
pZ—pZ
I
+
I
+
B、π键:“肩并肩”
ZZ
X
原子轨道在核间连线 两侧进行重叠(即采用 肩并肩)方式形成的共 价键,叫π键。
形成π键的电子 称为π电子。
教材第46页问题解决
有机物中的共价键类型
①C — H 是σ键; ②C — C 是σ键; ③C = C 一个σ键,一个π键; ④ C ≡C一个σ键,两个π键;
[问题解决]根据表中所示原子的电子排布式和轨道表 示式,结合你对共价键的理解,说明为什么它们与氢 原子形成的简单化合物分别为NH3、H2O和HF?
请写出氮气、氧气、氟气的电子式与结构式?
共价键的几种重叠方式
3.2.2《原子晶体》课件(新人教版选修3)(共28张PPT)
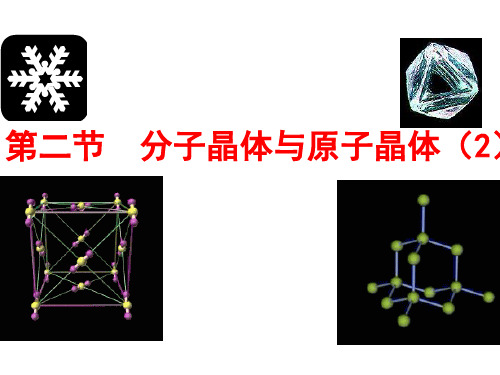
109º28´
共价键
109º28´ 共价键
温馨提示:为更好地满足您的学习和使用需求,课件在下载后可以自由编辑,请您根据实际情况进行调整!Thank you for
7、典型的原子晶体
(1) 金刚石
①每个C周围有 4 个C,围成空间 正四面体 图形
C的杂化轨道类型是 SP3杂化 。 这些正四面体向空间 发展,构成一个坚实的,彼此联结的空间网状晶体。
观察·思考
• 对比分子晶体和原子晶体的数据,原子晶体 有何物理特性?
5. 原子晶体的物理特性
①熔点和沸点高; ②硬度大; ③一般不导电; ④难溶于一些常见的溶剂。
【归纳晶】体熔沸点的高低比较
①对于分子晶体,一般来说,对于组成和结 构相似的物质,相对分子质量越大,分子间 作用力越大,物质的熔沸点也越高。
②对于原子晶体,一般来说,原子间键长越 短,键能越大,共价键越稳定,物质的熔沸 点越高,硬度越大。
6. 常见的原子晶体
(1)某些非金属单质:
金刚石(C)、晶体硅(Si)、晶体硼(B)、晶体 锗(Ge)等
(2)某些非金属化合物:
碳化硅(SiC)晶体、氮化硼(BN)晶体
(3)某些氧化物:
二氧化硅( SiO2)晶体、Al2O3
②C原子与碳碳键之比为( 1:2 ) ③最小碳环为( 六元环 )且不共面
Si
o
180º
109º28´
共价键
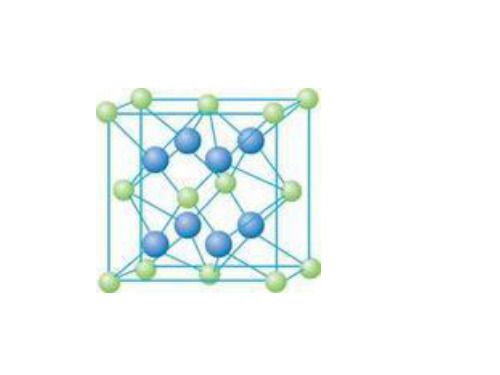
(2)SiO2原子晶体 ①每个Si周围有 4 个O,每个O周围有 2 个Si ②Si周围的Si围成空间 正四面体 图形
③ 1mol SiO2中共价键为( 4 )mol ④最小环上有(12 )个原子
第二节 分子晶体与原子晶体(2)
原子晶体
课件: 专题3 3.3.2第三单元共价键 原子晶体第2课时

3.特性 由于原子晶体中原子间以较 强 的共价键相结合,故原子晶体:①熔、沸点 很高, ②硬度 大 ,③一般不 导电,④ 难 溶于溶剂。 4.常见的原子晶体 常见的非金属单质,如金刚石(C)、硼(B)、晶体硅(Si)等;某些非金属化合物,如 碳化硅(SiC)、氮化硼(BN)、二氧化硅(SiO2)等。
二、原子晶体
1.概念及组成 (1)概念:相邻原子间以 共价键 相结合形成的具有空间立体网状结构的晶体,称为 原子晶体。 (2)构成微粒:原子晶体中的微粒是 原子 ,原子与原子之间的作用力是 共价键 。
2.两种典型原子晶体的结构 (1)金刚石的晶体结构模型如图所示。回答下列问题:
①在晶体中每个碳原子以 4个共价单键 对称地与相邻的4个碳原子相结合,形成 正四面体 结构,这些正四面体向空间发展,构成彼此联结的立体 网状 结构。 ②晶体中相邻碳碳键的夹角为109.5°。 ③最小环上有 6 个碳原子,晶体中C原子个数与C—C键数之比为 1∶2 。 ④每个金刚石晶胞中含有 8 个碳原子。
1.共价键的键能 (1)键能:在101 kPa、298 K条件下,1 mol气态AB分子生成 气态A原子和B原子 的 过程中所 吸收 的能量,称为AB间共价键的键能。其单位为 kJ·mol-1。
(2)应用:
共价键 H—F H—Cl H—Br H—I
键能/kJ·mol-1 567 431 366 298
(2)二氧化硅晶体结构模型如图所示。回答下列问题:
①每个硅原子都以 4 个共价单键与 4 个氧原子结合,每个氧原子与 2 个硅原子结合,向 空间扩展,构成空间网状结构。 ②晶体中最小的环为 6 个硅原子、 6个氧原子组成的12 元环,硅、氧原子个数比为1∶2 。 ③每个二氧化硅晶胞中含有 8 个硅原子和 16 个氧原子。
《共价键》教学课件

二、共价键
氢氧化钠晶体中,钠离子与氢氧根离子以离子 键结合;在氢氧根离子中,氢与氧以共价键结合。
如:NaOH Na+[ ··O ··H ] -
﹕﹕
过氧化钠晶体中,过氧根离子 O22-与钠离子 以离子键结合;在过氧根离子中,两
个氧原子以共价键结合。
பைடு நூலகம்
::
·O ·
Na2O2
Na+[ ··O · ·]2-Na+
第一章 物质结构 元素周期律 第三节 化学键 第2课时
二、共价键
问题: 1.活泼的金属元素和活泼非金属元素化合时形成 离子键,非金属元素之间化合时,能形成离子键 吗?为什么? 不能,因非金属元素的原子均有获得电子的偏向 2.非金属元素之间化合时,核外电子排布是通过什 么方式到达稳定结构的?
探讨: 以H2、HCl分子的形成为 例
物
::
·· ··
以NaCl为例
Na+ [ ··Cl ··]-
以为HCl例
H C··l ··
三、化学键
讨论 用化学键的观点来分析化学反
应的本质是什么?
化学反应的本质:就是旧化学键的 断裂和新化学键的形成的过程。
二、共价键
二、共价键
探讨: 以H2、HCl分子的形成为例
共用电子对
用一根短线表示 一个共用电子对
·· ·· ··
H ·+ ·H → H H
H﹣H(结构式)
H ·+ ·C··l:→ H
·· Cl
··
··
H﹣Cl(结构式)
结论: 在H2、HCl分子的形成过程中,没有产生电子的
得失,而是通过形成共用电子对 到达稳定结构的
三、化学键
[设计P42表]
离子键和共价键的比较
苏教版共价键原子晶体ppt课件

共价键
.
37
Si o
104º30´ 109º28´
共价键
.
38
探究思考
1、怎样从原子结构的角度理解金刚石、 硅和锗的熔点和硬度依次下降?
2.“具有共价键的晶体叫做原子晶体 ”。这种说法对吗?为什么?
.
39
知识拓展-石墨
一种结晶形碳,有天然出产的矿物。铁黑 色至深钢灰色。质软具滑腻感,可沾污手指成 灰黑色。有金属光泽。六方晶系,成叶片状、 鳞片状和致密块状。密度2.25g/cm3,化学性 质不活泼。具有耐腐蚀性,在空气或氧气中强 热可以燃烧生成二氧化碳。石墨可用作润滑剂, 并用于制造坩锅、电极、铅笔芯等。
化学键 成键本质
结论: 键长越短,键能越大,共价键越稳定。
.
23
(二)、键能与反应过程中能量变化的关系
P49 问题解决
吸收能量
946KJ/ mol
+
吸收能量
498KJ/ mol
N2
O2
反应物
.
放出能量 2×632K J/mol
NO
生成物
24
吸收能量 243KJ/m ol
Cl2
+
吸收能量 436KJ/m ol
H2
晶体硅.
碳化硅
17
板 二、配位键 书 1、定义
由一个原子提供一对电子(孤对电子)与另一个接受 ( 有空轨道)电子对的原子形成共价键,这样的共价键 称为配位键
2、表示方法
用箭头“→”指向接受孤对电子对的原子H
[H N H]+
H
.
18
已知水电离成为氢氧根离子和水合氢离 子,试写出阳离子的结构式 .
H [H O ]+
共价键原子晶体-PPT精品文档42页
4、共价键的类型——σ键和π键
S轨道和p轨道形成稳定共价键的几种重叠方式
(1)头碰头重叠——σ键
H·+ H·
H:H
相 互
靠 拢
s—s σ键
··C····l·+ ·C····l··
+
··C····l ··C····l··
p—p σ键
H·+ ···C··l··
H · · · C· · · l · ·
p — s σ键
(2)π键:原子轨道以“肩并肩”方式
相互重叠导致电子在核间出现的概率增大
而形成的共价键
σ键的类型
s—s(σ键)
s—p(σ键)
π键的类型
p—p(π键)
p—p (σ键) p—p (π键)
氮分子中原子轨道重叠方式示意图
【归纳】σ键与π键的对比
σ键
重叠方式 “头碰头”
π键
“肩并肩”
重叠方向 沿键轴的方向 与轨道对称轴相互
小结:
(1)层状结构,最小碳环为平面正六边形,即为六 元环(在同一平面上)。 (2)每个碳原子为3个六元环所共有,每个C-C 键为2个六元环所共有。
(3)每个六元环中平均含有碳原子 =6×1/3=2 每个六元环中平均含有C-C键 =6×1/2=3
即碳原子数:C-C键键数 =2:3
谢谢你的阅读
知识就是财富 丰富你的人生
平行的方向
重叠形状 轴对称
牢固程度
重叠程度较大,比较牢固
镜面对称
重叠程度较小,较易断裂
成键规律 共价单键为σ键;
共价双键中有一个σ键,另一个是π键。 共价三键由一个σ键和两个π键组成。
乙烷: 7 个σ键 乙烯: 5 个σ键 乙炔: 3 个σ键
苏教版化学选修3《共价键原子晶体》课件

03
共价键原子晶体的结构与性质
结构特点
原子晶体是由原子通过 共价键结合形成的晶体 。
原子晶体中,原子以共 价键相互结合,形成空 间网状结构。
原子晶体中,每个原子 都以共价键与其他四个 原子相连,形成正四面 体结构。
原子晶体中,每个原子 都以共价键与其他四个 原子相连,形成正四面 体结构。
结构特点
未来发展方向
未来共价键原子晶体的研究将更加注重跨学科的合作,涉及物理、化学、材料科学 等多个领域。
随着实验和理论研究的深入,共价键原子晶体的合成和性质将得到更深入的揭示, 为新材料的发现和应用提供更多可能性。
共价键原子晶体的应用领域将进一步拓展,特别是在能源存储和转化、光电材料、 生物医用材料等领域。
研究意义与价值
共价键原子晶体的研究对于推动化学、 材料科学等学科的发展具有重要意义, 有助于揭示物质的基本性质和规律。
共价键原子晶体的研究对于解决能源、 环境等全球性问题也具有积极意义, 有助于推动可持续发展和人类社会 材料的开发和应用提供理论支持和实 践指导,促进相关领域的技术进步和 产业发展。
能力目标
能够分析共价键原子晶体的结构特点,理解其在材 料科学中的应用。
情感态度与价值观
培养学生对化学和材料科学的兴趣,提高科学素养 。
教学目标
知识目标
掌握共价键原子晶体的基本概念、性质和分类。
能力目标
能够分析共价键原子晶体的结构特点,理解其在材 料科学中的应用。
情感态度与价值观
培养学生对化学和材料科学的兴趣,提高科学素养 。
应用等方面。
研究现状
共价键原子晶体在材料科学、能 源、医药等领域具有广泛应用, 目前国内外研究者对其进行了大
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例如用电子式表示共价键HCl、Cl2 的形成过程
Cl + H
H Cl
C l + Cl
Cl Cl
编辑ppt
9
又如 N2、H2O的形成过程
N2: N + N
NN
O H H2O:2
+
HOH
请与离子化合物的形成过程的电子式 进行比较
编辑ppt
10
思考:含有共价键的物质是 否一定是共价分子?
编辑ppt
11
++
X
形成σ键的电子 称为σ电子。
-
++
X 原子轨道沿核
间连线方向以
-
++
-
“头碰头”方
X 式重叠形成的
编辑ppt
共价键,叫σ1键8 .
相互靠拢
s-s
s-p
p-p 编辑ppt
19
编辑ppt
20
σ键的类型
编辑ppt
21
课堂练习
σ键的常见类型有(1)s-s,(2)s-p,(3)p-p,请
指出下列分子σ键所属类型:
变自从 化旋核 情方间 况向距 。来和
观成 察键 能电 量子 的的
编辑ppt
3
1、形成共价键的要点
电子配对原理
最大重叠原理
两原子各自提供1 个自旋方向相反的 电子彼此配对。
两个原子轨道重叠部分越
大,两核间电子的密度越
大,形成的共价键越牢固,
分子越稳定。 编辑ppt
4
2、共价键的本质
当成键原子相互接近时,原子轨道发生 重叠,自旋方向相反的未成对电子形成 共用电子对,两原子核间的电子密度增 加,体系的能量降低.
编辑ppt
37
交流与讨论
1、极性键: HCl CO H2O 非极性键: Cl2 N2 H2
2、键的极性由强到弱的顺序: F—H O– H N—H C—H
键
在+ 水溶液中,NH3能与H+结合生成NH4 请用电子式表示N和H形成NH3的过程 并讨论NH3和H+是如何形成NH4+的?
A、HBr
s-p
B、NH3
s-p
C、F2
p-p
D、H2
s-s
编辑ppt
22
2.π键:“肩并肩”
pZ—pZ
ZZ
+
+
I
X
原子轨道在核间连线两 侧以“肩并肩”方式重 叠形成的共价键,叫π键.
编辑ppt
I
形成π键的电子 称为π电子。
23
3、σ键和π键的比较
σ键
π键
成键方向 “头碰头” “肩并肩”
电子云形状 轴对称
根据元素电负性的强弱,你能判断F2 和HF分子中共用电子对是否发生偏移吗?
编辑ppt
32
1、非极性键:两个成键原子吸引电子的能 力 相同 (电负性相同 ),共 用电子对不发生偏移的共价键
2、极性键:两个成键原子吸引电子的能 力不同 (电负性不同 ),共 用电子对发生 偏移的共价键
编辑ppt
33
编辑ppt
编辑ppt
6
(2)方向性:
问题:是不是所有的共价键都具有方向性?
因为S轨道是球形对称的,所以S轨道 与S轨道形成的共价键没有方向性。
编辑ppt
7
成键原子轨道只有采用最大重叠才能形成
稳定的共价键,由于p ,d,f轨道在空间有
不同的伸展方向,即有方向性,因此共价
键有方向性。
编辑ppt
8
4、用电子式表示共价键的形成过程
写出N2、HF 、F2、乙烯、乙 炔的电子式和结构式
编辑ppt
12
拓展视野
共价键理论的发展 路易斯价键理论 现代价键理论(VB法) 分子轨道理论(MO法)
编辑ppt
13
二、共价键的类型
z
z
πz
y
y
x
N
σ N
πy
编辑ppt
14
问题探究一: σ键和π键
氮气的化学性质很不活泼,通常很难与其它物质发生化学 反应。结合氮分子的电子式和结构式思考氮分子中氮原子 的轨道是如何重叠形成化学键的?形成什么类型化学键?
34
编辑ppt
35
3、一般情况下,同种元素的原子之间形
成 非极共性价键,不同种元素的原子之间形 成 共极价性键。
4、在极性共价键中,成键原子吸引电子 能力的差别越大,即电负性差值越大,共 用电子对的偏移程度越大 ,共价键的极 性 越大。
编辑ppt
36
练习: 1、指出 Cl2、HCl、CO、N2、H2O、H2 等分子中存在的共价键,并说明哪些是极 性键,哪些是非极性键。 2、根据电负性大小,将C-H、N-H、OH和F-H键按极性由强到弱的顺序排列。
z
z
πz
y
y
σ
N x
N
πy
编辑ppt
15
问题探究一:σ键和π键
氮气的化学性质很不活泼,通常很难 与其他物质发生化学反应。请你写出氮分 子的电子式和结构式,并分析氮分子中氮 原子的轨道是如何重叠形成共价键的。
编辑ppt
16
z
z
y
y
x
πz
σ
N
N
πy
编辑ppt
17
1.σ键:“头碰头”
s—s px—s px—px
1、C – H 是σ键。 2、C—C 是σ键。 3、C=C 一个σ键,一个π键。
4、 C ≡C 一个σ键,两个π键。
乙烯、乙炔分子中C-C σ键比较稳 定不容易断裂, π键比较容易断裂。
编辑ppt
29
拓展视野
编辑ppt
30
拓展视野 苯分子中的共价键
编辑ppt
31
问题探究二:极性键和非极性键
根据氢原子和氟原子的核外电子排布, 你知道F2和HF分子中形成的共价键有什 么不同吗?
编辑ppt
5
3、共价键的特点
(1)饱和性:与离子键不同,共价键具有饱 和性。
这是因为只有成键原子中自旋方向相反 的未成对电子才能形成共用电子对。成键过 程中,每种元素的原子有几个未成对电子, 通常就只能和几个自旋方向相反的电子形成 共价键,所以在共价分子中,每个原子形成 共价键的数目是一定的,这就是共价键的饱 和性。
第三单元
共价键 原子晶体
编辑ppt
1
一、共价键的形成
通常哪些元素的原子之间能形成共价键?
元素的电负性相差小于1.7。非金属元素原 子之间形成的化学键就是共价键。某些金 属与非金属元素原子之间形成的化学键也 是共价键。
以氢分子的形成为例:
自旋方向相反的两个电子之间可以形成化学键。
编辑ppt
2
氢气分子形成过程的能量变化
个1π键 个2π键
编辑ppt
26
乙烯、乙炔分子中轨道重叠方式示意图
编辑ppt
27
问题探究
请写出乙烯、乙炔与溴发生加成反应 的反应方程式。并思考:在乙烯、乙炔 和溴发生的加成反应中,乙烯、乙炔分 子断裂什么类型的共价键?
π键的重叠程度小于σ键,所以π键不如σ键稳定。
编辑ppt
28
有机物中的共价键
镜像对称
牢固程度
强度大, 不易断裂
强度较小 易断裂
共价单键是σ键,共价双键
成键判断规律 中一个是 键σ,另一个是 键,π共价三键中一个是 键,
另σ两个为 键 π
编辑ppt
24
问题探究
乙烷、乙烯和乙炔分子 中的共价键分别由几个σ键 和几个π键组成?
编辑ppt
25
乙烷: 7个σ键 乙烯: 5个σ键 乙炔: 3个σ键
Cl + H
H Cl
C l + Cl
Cl Cl
编辑ppt
9
又如 N2、H2O的形成过程
N2: N + N
NN
O H H2O:2
+
HOH
请与离子化合物的形成过程的电子式 进行比较
编辑ppt
10
思考:含有共价键的物质是 否一定是共价分子?
编辑ppt
11
++
X
形成σ键的电子 称为σ电子。
-
++
X 原子轨道沿核
间连线方向以
-
++
-
“头碰头”方
X 式重叠形成的
编辑ppt
共价键,叫σ1键8 .
相互靠拢
s-s
s-p
p-p 编辑ppt
19
编辑ppt
20
σ键的类型
编辑ppt
21
课堂练习
σ键的常见类型有(1)s-s,(2)s-p,(3)p-p,请
指出下列分子σ键所属类型:
变自从 化旋核 情方间 况向距 。来和
观成 察键 能电 量子 的的
编辑ppt
3
1、形成共价键的要点
电子配对原理
最大重叠原理
两原子各自提供1 个自旋方向相反的 电子彼此配对。
两个原子轨道重叠部分越
大,两核间电子的密度越
大,形成的共价键越牢固,
分子越稳定。 编辑ppt
4
2、共价键的本质
当成键原子相互接近时,原子轨道发生 重叠,自旋方向相反的未成对电子形成 共用电子对,两原子核间的电子密度增 加,体系的能量降低.
编辑ppt
37
交流与讨论
1、极性键: HCl CO H2O 非极性键: Cl2 N2 H2
2、键的极性由强到弱的顺序: F—H O– H N—H C—H
键
在+ 水溶液中,NH3能与H+结合生成NH4 请用电子式表示N和H形成NH3的过程 并讨论NH3和H+是如何形成NH4+的?
A、HBr
s-p
B、NH3
s-p
C、F2
p-p
D、H2
s-s
编辑ppt
22
2.π键:“肩并肩”
pZ—pZ
ZZ
+
+
I
X
原子轨道在核间连线两 侧以“肩并肩”方式重 叠形成的共价键,叫π键.
编辑ppt
I
形成π键的电子 称为π电子。
23
3、σ键和π键的比较
σ键
π键
成键方向 “头碰头” “肩并肩”
电子云形状 轴对称
根据元素电负性的强弱,你能判断F2 和HF分子中共用电子对是否发生偏移吗?
编辑ppt
32
1、非极性键:两个成键原子吸引电子的能 力 相同 (电负性相同 ),共 用电子对不发生偏移的共价键
2、极性键:两个成键原子吸引电子的能 力不同 (电负性不同 ),共 用电子对发生 偏移的共价键
编辑ppt
33
编辑ppt
编辑ppt
6
(2)方向性:
问题:是不是所有的共价键都具有方向性?
因为S轨道是球形对称的,所以S轨道 与S轨道形成的共价键没有方向性。
编辑ppt
7
成键原子轨道只有采用最大重叠才能形成
稳定的共价键,由于p ,d,f轨道在空间有
不同的伸展方向,即有方向性,因此共价
键有方向性。
编辑ppt
8
4、用电子式表示共价键的形成过程
写出N2、HF 、F2、乙烯、乙 炔的电子式和结构式
编辑ppt
12
拓展视野
共价键理论的发展 路易斯价键理论 现代价键理论(VB法) 分子轨道理论(MO法)
编辑ppt
13
二、共价键的类型
z
z
πz
y
y
x
N
σ N
πy
编辑ppt
14
问题探究一: σ键和π键
氮气的化学性质很不活泼,通常很难与其它物质发生化学 反应。结合氮分子的电子式和结构式思考氮分子中氮原子 的轨道是如何重叠形成化学键的?形成什么类型化学键?
34
编辑ppt
35
3、一般情况下,同种元素的原子之间形
成 非极共性价键,不同种元素的原子之间形 成 共极价性键。
4、在极性共价键中,成键原子吸引电子 能力的差别越大,即电负性差值越大,共 用电子对的偏移程度越大 ,共价键的极 性 越大。
编辑ppt
36
练习: 1、指出 Cl2、HCl、CO、N2、H2O、H2 等分子中存在的共价键,并说明哪些是极 性键,哪些是非极性键。 2、根据电负性大小,将C-H、N-H、OH和F-H键按极性由强到弱的顺序排列。
z
z
πz
y
y
σ
N x
N
πy
编辑ppt
15
问题探究一:σ键和π键
氮气的化学性质很不活泼,通常很难 与其他物质发生化学反应。请你写出氮分 子的电子式和结构式,并分析氮分子中氮 原子的轨道是如何重叠形成共价键的。
编辑ppt
16
z
z
y
y
x
πz
σ
N
N
πy
编辑ppt
17
1.σ键:“头碰头”
s—s px—s px—px
1、C – H 是σ键。 2、C—C 是σ键。 3、C=C 一个σ键,一个π键。
4、 C ≡C 一个σ键,两个π键。
乙烯、乙炔分子中C-C σ键比较稳 定不容易断裂, π键比较容易断裂。
编辑ppt
29
拓展视野
编辑ppt
30
拓展视野 苯分子中的共价键
编辑ppt
31
问题探究二:极性键和非极性键
根据氢原子和氟原子的核外电子排布, 你知道F2和HF分子中形成的共价键有什 么不同吗?
编辑ppt
5
3、共价键的特点
(1)饱和性:与离子键不同,共价键具有饱 和性。
这是因为只有成键原子中自旋方向相反 的未成对电子才能形成共用电子对。成键过 程中,每种元素的原子有几个未成对电子, 通常就只能和几个自旋方向相反的电子形成 共价键,所以在共价分子中,每个原子形成 共价键的数目是一定的,这就是共价键的饱 和性。
第三单元
共价键 原子晶体
编辑ppt
1
一、共价键的形成
通常哪些元素的原子之间能形成共价键?
元素的电负性相差小于1.7。非金属元素原 子之间形成的化学键就是共价键。某些金 属与非金属元素原子之间形成的化学键也 是共价键。
以氢分子的形成为例:
自旋方向相反的两个电子之间可以形成化学键。
编辑ppt
2
氢气分子形成过程的能量变化
个1π键 个2π键
编辑ppt
26
乙烯、乙炔分子中轨道重叠方式示意图
编辑ppt
27
问题探究
请写出乙烯、乙炔与溴发生加成反应 的反应方程式。并思考:在乙烯、乙炔 和溴发生的加成反应中,乙烯、乙炔分 子断裂什么类型的共价键?
π键的重叠程度小于σ键,所以π键不如σ键稳定。
编辑ppt
28
有机物中的共价键
镜像对称
牢固程度
强度大, 不易断裂
强度较小 易断裂
共价单键是σ键,共价双键
成键判断规律 中一个是 键σ,另一个是 键,π共价三键中一个是 键,
另σ两个为 键 π
编辑ppt
24
问题探究
乙烷、乙烯和乙炔分子 中的共价键分别由几个σ键 和几个π键组成?
编辑ppt
25
乙烷: 7个σ键 乙烯: 5个σ键 乙炔: 3个σ键
