生物化学-氨基酸的合成
生物化学第八章氨基酸代谢教材课程

二、蛋白质的消化 ▪蛋白质消化的生理意义:
(1)由大分子转变为小分子,便于吸收。 (2)消除种属特异性和抗原性,防止过敏、毒性反应。
消化道内几种蛋白酶的专一性
氨肽酶
(Phe.Tyr.Trp)
(s)
羧羧肽肽酶酶
(四)、尿素的生成 1、生成部位: 主要在肝细胞的线粒体及胞液中。
2、生成过程
尿素的生成过程由Hans Krebs 和Kurt Henseleit 提出,称为鸟氨酸循环(orinithine cycle),又称尿素 循环(urea cycle)或Krebs- Henseleit循环。
CO2 + NH3 + H2O
5
* FH4携带一碳单位的形式: 如:
N5—CH3—FH4
N5、N10=CH—FH4
(二)一碳单位的生理功能
*作为合成嘌呤和嘧啶的原料 *把氨基酸代谢和核酸代谢联系起来
本章内容结束,谢谢!
2、转氨基偶联嘌呤核苷酸循环
腺苷酸代琥
氨
α-酮戊
珀酸合成酶
基
二酸 天冬氨酸
酸
转
氨 酶
转
氨 酶
1
2
腺苷酸 代琥珀酸
谷氨酸 α-酮酸
草酰乙酸 苹果酸
延胡索酸
次黄嘌呤 核苷酸 (IMP)
NH3 腺苷酸 脱氢酶
H2O
腺嘌呤 核苷酸 (AMP)
二、氨基酸的脱羧基作用
脱羧基作用(decarboxylation)
• 依赖ATP • 降解异常蛋白和短寿命蛋白
泛素?
*76个氨基酸的小分子蛋白(8.5kD); *普遍存在于真核生物而得名; *一级结构高度保守。
氨基酸分解代谢

O
H2N C O ~ PO32- + 2ADP + Pi
氨基甲酰磷酸
② 瓜氨酸的合成
NH2 CO
O ~PO32-
氨基甲酰磷酸
NH2
(CH2)3
+
CH NH2
COOH
鸟鸟氨氨酸酸
鸟氨酸氨基甲酰转移酶
H3PO4
NH2 CO
NH (CH2)3
含S氨基酸
甲硫氨酸
S CH3 CH2 CH2 CHNH2 COOH
半胱氨酸
CH2SH CHNH2 COOH
① Met与转甲基作用
+
Met
ATP
腺苷转移酶
PPi+Pi
甲基的直 接供体
S-腺苷甲硫氨酸(SAM)
① Met与转甲基作用
RH
RH—CH3
腺苷
甲基转移酶
SAM
S-腺苷同型半胱氨酸
同型半胱氨酸
Gly 的代谢与一碳单位的生成
-
CH2NH2 COOH
+ FH4
Gly 氨解酶
N5, N10-CH2-FH4
NAD+
NADH+H+ CO2+NH3
-
CH2NH2 氧化 COOH 脱氨基
-
CHO COOH
CO2
HCOOH
HCOOH
FH4
FH4甲酰化酶
ATP
ADP+Pi
N10-CHO-FH4
(3)含S氨基酸代谢
COOH
CH2 H-C-NH2
COOH
腺苷酸代
琥珀酸合成酶 (IMP)
氨基酸代谢和氨基酸衍生物的生物功能

氨基酸代谢和氨基酸衍生物的生物功能氨基酸是构成蛋白质的基本单位,除了在蛋白质合成中起到重要的作用之外,氨基酸还参与了许多生物化学反应和生理功能。
本文将探讨氨基酸代谢以及氨基酸衍生物的生物功能。
一、氨基酸代谢氨基酸代谢是维持生物体正常运作的重要过程之一。
氨基酸的代谢可以分为两个主要方向:氨基酸的合成和氨基酸的降解。
1. 氨基酸的合成氨基酸的合成主要通过两个途径进行:脱羧途径和转氨途径。
脱羧途径是通过脱羧酶将酸中的羧基去除,并生成氨基酸。
这种途径是典型的反应为脱羧反应的过程,产生的氨基酸可以用于合成蛋白质或者进行其他生物化学反应。
转氨途径是通过转氨酶将一种氨基酸中的氨基转移到另一种含有氨基酸的分子中,从而合成新的氨基酸。
这种途径是细胞中调节氨基酸浓度和种类的重要方式。
2. 氨基酸的降解氨基酸的降解是将氨基酸分解为无机氮和碳骨架的过程。
这个过程主要通过氨基酸酶进行,将氨基酸中的氨基和羧基分解开。
氨基酸降解后,无机氮可以通过尿素循环等途径被排泄掉,碳骨架可以被进一步氧化产生能量。
二、氨基酸衍生物的生物功能氨基酸代谢产生的氨基酸衍生物在生物体中具有多种重要的生物功能。
1. 焦磷酸氨基酸焦磷酸氨基酸是一类重要的代谢产物,是维生素和辅酶的前体。
它们参与多种生物化学反应,如能量代谢、DNA和RNA合成等。
2. 生理活性物质氨基酸代谢产生的一些物质具有生理活性。
例如,赖氨酸和色氨酸是神经递质的前体,可以影响中枢神经系统功能。
谷氨酸和天冬氨酸是神经兴奋性氨基酸,在神经传导过程中发挥重要作用。
3. 抗氧化剂一些氨基酸衍生物具有抗氧化剂的活性,可以保护细胞免受自由基的损伤。
例如,谷胱甘肽是一种含有巯基的氨基酸,具有强效的抗氧化活性。
4. 调节免疫功能氨基酸代谢产生的某些物质可以调节免疫功能。
例如,精氨酸和谷氨酰胺是免疫细胞活化和增殖的重要信号物质。
结论氨基酸代谢和氨基酸衍生物的生物功能在维持生物体正常运作和生命活动中起着重要作用。
生物化学第3章 氨基酸

一、氨基酸——蛋白质的构件分子
氨基酸(amino acid) :α-氨基酸是一切蛋白质的组成单位。氨基酸是与羧酸 相邻α-碳原子上连有一个氨基,故称α-氨基酸。 利用酸水解、碱水解、酶解可把蛋白质分子水解释放氨基酸。
不变部分(除脯氨酸) 可变部分 L型 α -氨基酸
氨基酸
芳香族氨基酸 Phe、Tyr、Trp 杂环氨基酸 His、Pro
脂肪族氨基酸:一氨基一羧基(中性氨基酸)
甘氨酸
丙氨酸
缬氨酸
亮氨酸
异亮氨酸
脂肪族氨基酸:一氨基一羧基(中性氨基酸):含有羟基
丝氨酸Ser的-OH在生理条件下不解离,但是个极性基团,能与其 他基团形成氢键,常出现在酶的活性中心; 苏氨酸Thr的-OH是仲醇,具有亲水性;
水中心)
极性氨基酸侧链能与水形成氢键,易溶于水 带电荷和极性氨基酸一般位于蛋白表面 蛋白的活性中心:His,Ser,Cys
2.3氨基酸的分类——不常见蛋白质氨基酸
2.4氨基酸的分类——非蛋白质氨基酸
150 多种,不是蛋白质组成,但是有特定生理功能
(1)大多是L型α氨基酸衍生物
(2)有D型氨基酸 (3)还有β-、γ-、δ-氨基酸
/view/e845c4c8a1c7aa00b52acb47.html
用强酸型阳离子交换树脂分离氨基酸
氨基酸与树脂的亲和力取决于:
气液层析
高效液相层析
蛋白质的水解条件及优缺点
第一章糖课后题 第6题
高碘酸及其盐可以定量的氧 化断裂邻二羟基、α-羟基醛等 的碳碳键,产生相应的羰基 化合物。该反应可以用来区 分糖苷是呋喃还是吡喃型的。 侧翼测定直连多糖的相对分 子量和支链淀粉的非还原末 端残基数,即分支数目。
氨基酸的生物化学特性和生物合成途径

氨基酸的生物化学特性和生物合成途径氨基酸是构成蛋白质的基本单位,对生命体起着至关重要的作用。
它不仅可以作为代谢产物参与生物化学反应,还可以作为合成其他生化物质的前体。
本文将介绍氨基酸的生物化学特性以及生物合成途径。
一、氨基酸的生物化学特性1. 化学结构:氨基酸一般由一个氨基(-NH2)、一个羧基(-COOH)和一个侧链基团组成。
侧链基团的不同决定了氨基酸的特性和功能。
2. 光学活性:除了丙氨酸外,其他氨基酸都存在手性中心,存在两种光学异构体,即L-和D-型。
在自然界中,生物体主要合成和利用L-型氨基酸。
3. 酸碱特性:由于存在氨基和羧基,氨基酸显示酸碱特性。
在中性pH条件下,氨基酸呈现出等电点(pI),即其电荷净值为0。
4. 缓冲作用:由于氨基酸具有酸碱特性,它们可以在生物体内起到缓冲作用,维持体内pH的稳定。
5. 水溶性:氨基酸具有不同的水溶性,与侧链基团的性质有关。
极性侧链的氨基酸溶解度较高,非极性氨基酸溶解度较低。
二、氨基酸的生物合成途径氨基酸的生物合成途径主要包括脱氨酶途径、反应序列途径和转氨基酸途径。
1. 脱氨酶途径:脱氨酶途径是氨基酸合成的主要途径,通过脱氨酶酶的作用,从酮酸骨架上去除氨基团,形成氨基酸。
例如,谷氨酸脱氨酶催化谷氨酸转化为α-酮戊二酸和游离氨。
2. 反应序列途径:反应序列途径是通过多个酶催化氨基酸的合成,其中每个酶只催化整个反应序列中的一步。
例如,鸟氨酸的生物合成途径就包括丝氨酸合成酶、半胱氨酸合成酶等多个酶的催化。
3. 转氨基酸途径:转氨基酸途径是通过转氨酶的作用,在不同的氨基酸之间进行转化。
例如,天冬酰-丙酰谷氨酸转氨酶催化谷氨酸和苹果酸转化为天冬氨酸和α-酮戊二酸。
除了通过合成途径合成氨基酸,细菌和植物还可以通过自养合成氨基酸,这些生物体内拥有完整的氨基酸生物合成途径。
综上所述,氨基酸具有多种生物化学特性,其生物合成途径丰富多样。
了解氨基酸的特性和合成途径,对于进一步理解蛋白质合成和生物代谢过程具有重要意义。
生物化学代谢化学背诵口诀

生物化学代谢化学背诵口诀生物化学代谢化学是生物学中一个重要的分支,它研究的是生物体内的化学反应,以及这些反应如何影响生物体的生长和发育。
生物化学代谢化学的口诀是:“氧化还原,糖酵解,氨基酸合成,脂质代谢,核酸合成,蛋白质合成,维生素代谢,矿物质代谢,激素代谢,毒素代谢。
”氧化还原是生物体内最基本的化学反应,它涉及到氧化物和还原物的交换,是生物体内能量的重要来源。
糖酵解是指糖分解成糖原和乙醇,这是生物体内最重要的代谢过程之一,也是能量的重要来源。
氨基酸合成是指氨基酸的合成,它是生物体内蛋白质的重要组成部分,也是生物体内重要的代谢物。
脂质代谢是指脂肪的代谢,它是生物体内能量的重要来源,也是生物体内重要的组成部分。
核酸合成是指核酸的合成,它是生物体内遗传物质的重要组成部分,也是生物体内重要的代谢物。
蛋白质合成是指蛋白质的合成,它是生物体内重要的组成部分,也是生物体内重要的代谢物。
维生素代谢是指维生素的代谢,它是生物体内重要的组成部分,也是生物体内重要的代谢物。
矿物质代谢是指矿物质的代谢,它是生物体内重要的组成部分,也是生物体内重要的代谢物。
激素代谢是指激素的代谢,它是生物体内重要的组成部分,也是生物体内重要的代谢物。
毒素代谢是指毒素的代谢,它是生物体内重要的组成部分,也是生物体内重要的代谢物。
生物化学代谢化学是一门重要的学科,它研究的是生物体内的化学反应,以及这些反应如何影响生物体的生长和发育。
它的口诀涵盖了生物体内的各种代谢过程,如氧化还原、糖酵解、氨基酸合成、脂质代谢、核酸合成、蛋白质合成、维生素代谢、矿物质代谢、激素代谢和毒素代谢等。
这些代谢过程不仅是生物体内能量的重要来源,而且也是生物体内重要的组成部分,对生物体的生长和发育起着重要的作用。
生物化学笔记氨基酸的合成代谢

一、概述20种基本氨基酸的生物合成途径已基本阐明,其中人类不能合成的10种氨基酸,即苯丙氨酸、甲硫氨酸、苏氨酸、色氨酸、赖氨酸、精氨酸、组氨酸、缬氨酸、亮氨酸和异亮氨酸称为必须氨基酸。
氨基酸的合成途径主要有以下5类:1. 谷氨酸类型,由a-酮戊二酸衍生而来,有谷氨酸、谷氨酰胺、脯氨酸和精氨酸,蕈类和眼虫还可合成赖氨酸。
2. 天冬氨酸类型,由草酰乙酸合成,包括天冬氨酸、天冬酰胺、甲硫氨酸、苏氨酸和异亮氨酸,细菌和植物还合成赖氨酸。
3. 丙酮酸衍生类型,包括丙氨酸、缬氨酸、亮氨酸,为异亮氨酸和赖氨酸提供部分碳原子。
4. 丝氨酸类型,由3-磷酸甘油酸合成,包括丝氨酸、甘氨酸和半胱氨酸。
5. 其他,包括苯丙氨酸、酪氨酸、色氨酸和组氨酸。
二、脂肪族氨基酸的合成(一)谷氨酸类型1. 谷氨酸:由a-酮戊二酸与氨经谷氨酸脱氢酶催化合成,消耗NADPH,而脱氨时则生成NADH。
2. 谷氨酰胺:谷氨酰胺合成酶可催化谷氨酸与氨形成谷氨酰胺,消耗一个ATP,是氨合成含氮有机物的主要方式。
此酶受8种含氮物质反馈抑制,如丙氨酸、甘氨酸等,因为其氨基来自谷氨酰胺。
谷氨酰胺可在谷氨酸合成酶催化下与a-酮戊二酸形成2个谷氨酸,这也是合成谷氨酸的途径,比较耗费能量,但谷氨酰胺合成酶Km小,可在较低的氨浓度下反应,所以常用。
3. 脯氨酸:谷氨酸先还原成谷氨酸g-半醛,自发环化,再还原生成脯氨酸。
可看作分解的逆转,但酶不同,如生成半醛时需ATP活化。
4. 精氨酸:谷氨酸先N-乙酰化,在还原成半醛,以防止环化。
半醛转氨后将乙酰基转给另一个谷氨酸,生成鸟氨酸,然后与尿素循环相同,生成精氨酸。
5. 赖氨酸:蕈类和眼虫以a-酮戊二酸合成赖氨酸,先与乙酰辅酶A缩合成高柠檬酸,异构、脱氢、脱羧生成a-酮己二酸,转氨,末端羧基还原成半醛,经酵母氨酸转氨生成赖氨酸。
(二)天冬氨酸类型1. 天冬氨酸:由谷草转氨酶催化合成。
2. 天冬酰胺:由天冬酰胺合成酶催化,谷氨酰胺提供氨基,消耗一个ATP 的两个高能键。
生物化学8 氨基酸代谢与合成

蛋白质降解和氨基酸的分解代谢蛋白质的降解细胞总是不断地从氨基酸合成蛋白质,又把蛋白质降解为氨基酸。
从表面上看,这样的变化过程看似是一种浪费,实际上它有二重功能,其一是排除那些不正常的蛋白质,它们一旦积聚,将对细胞有害;其二是通过排除积累过多的酶和调节蛋白使细胞代谢的井然有序得以进行。
蛋白质降解的特性蛋白质有选择地降解非正常蛋白质,例如血红蛋白与缬氨酸类似物结合,得到的产物在网织红细胞中的半存活期约10min,而正常血红蛋白可延续红细胞的存活期最终可达120天。
正常的胞内蛋白被排除的速度是由它们的个性决定的,绝大多数快速降解的酶都居于重要的“代谢控制”位置,而较稳定的酶在所有生理条件下有较稳定的催化活性。
降解速度还因它的营养及激素状态而有所不同。
在营养条件被剥夺的情况下,细胞提高它的蛋白质降解速度,以维持它的必需营养源使不可或缺的代谢过程得以进行。
蛋白质降解的反应机制真核细胞对于蛋白质降解有两种体系,一个是溶酶体的降解体质和一种ATP-依赖性的以细胞溶胶为基础的机制。
溶酶体溶酶体是具有单层被膜的细胞器,其中个含有50多种水解酶,包括不同种的蛋白酶,称之为组织蛋白酶。
溶酶体保持其内部PH在5左右,而它含有的酶的最适PH就是酸性。
如此可以抵制偶然的溶酶体渗漏从而保护了细胞,因此在细胞溶胶PH下,溶酶体的大部分酶都是无活性的。
溶酶体对细胞各组分的再利用是通过它融合细胞质的膜被点块即自(体吞)噬泡,并随即分解其内容物实现的。
溶酶体的阻断剂有抗虐药物——氯代奎宁(是一种弱碱,在不带电形式随意穿透溶酶体,在溶酶体内积累形成特电荷型,因此增高了溶酶体内部的pH,并阻碍了溶酶体的功能。
溶酶体降解蛋白质是无选择性的,而rong'mei't'抑制剂对于非正常蛋白或短寿命酶无快速的降解效应,但是它们可以防止饥饿状态下蛋白质的加速度崩溃。
许多正常的和病理活动都伴随溶酶体活性的升高。
ATP-依赖真核细胞蛋白质的降解主要是溶酶体的作用,但是缺少溶酶体的网织红细胞却可选择性的降解非正常蛋白质,这里有ATP-依赖的蛋白质水解体系存在ATP依赖蛋白质需要有泛肽存在。
[王镜岩生物化学第三版笔记]第十章 氨基酸代谢
![[王镜岩生物化学第三版笔记]第十章 氨基酸代谢](https://img.taocdn.com/s3/m/433ff601b52acfc789ebc9ff.png)
第十章氨基酸代谢植物、微生物从环境中吸收氨、铵盐、亚硝酸盐、硝酸盐等无机氮,合成各种氨基酸、蛋白质、含氮化合物。
人和动物消化吸收动、植物蛋白质,得到氨基酸,合成蛋白质及含氮物质。
有些微生物能把空气中的N2转变成氨态氮,合成氨基酸。
第一节蛋白质消化、降解及氮平衡一、 蛋白质消化吸收哺乳动物的胃、小肠中含有胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶、羧肽酶、氨肽酶、弹性蛋白酶。
经上述酶的作用,蛋白质水解成游离氨基酸,在小肠被吸收。
被吸收的氨基酸(与糖、脂一样)一般不能直接排出体外,需经历各种代谢途径。
肠粘膜细胞还可吸收二肽或三肽,吸收作用在小肠的近端较强,因此肽的吸收先于游离氨基酸。
二、 蛋白质的降解人及动物体内蛋白质处于不断降解和合成的动态平衡。
成人每天有总体蛋白的1%~2%被降解、更新。
不同蛋白的半寿期差异很大,人血浆蛋白质的t1/2约10天,肝脏的t1/2约1~8天,结缔组织蛋白的t1/2约180天,许多关键性的调节酶的t1/2均很短。
真核细胞中蛋白质的降解有两条途径:一条是不依赖A TP的途径,在溶酶体中进行,主要降解外源蛋白、膜蛋白及长寿命的细胞内蛋白。
另一条是依赖A TP和泛素的途径,在胞质中进行,主要降解异常蛋白和短寿命蛋白,此途径在不含溶酶体的红细胞中尤为重要。
泛素是一种8.5KD(76a.a.残基)的小分子蛋白质,普遍存在于真核细胞内。
一级结构高度保守,酵母与人只相差3个a.a残基,它能与被降解的蛋白质共价结合,使后者活化,然后被蛋白酶降解。
三、 氨基酸代谢库食物蛋白中,经消化而被吸收的氨基酸(外源性a.a)与体内组织蛋白降解产生的氨基酸(内源性a.a)混在一起,分布于体内各处,参与代谢,称为氨基酸代谢库。
氨基酸代谢库以游离a.a总量计算。
肌肉中a.a占代谢库的50%以上。
肝脏中a.a占代谢库的10%。
肾中a.a占代谢库的4%。
血浆中a.a占代谢库的1~6%。
肝、肾体积小,它们所含的a.a浓度很高,血浆a.a是体内各组织之间a.a转运的主要形式。
氨基酸合成过程

氨基酸合成是生物体内生物化学反应的过程之一,通过特定的代谢途径,生物体可以合成所需的氨基酸。
以下是氨基酸合成的一般过程:
糖酵解和糖异生:氨基酸的合成通常从糖酵解和糖异生途径开始。
在糖酵解中,葡萄糖分解为丙酮酸或丙酮酸的衍生物。
在糖异生中,非糖物质,如乳酸或丙酮酸,可以通过途径转化为丙酮酸。
三羧酸循环(Krebs循环):丙酮酸进入三羧酸循环,产生能量和中间代谢产物。
在这个过程中,一些氨基酸的前体分子(如谷氨酸和丙氨酸)可以通过一系列反应合成。
转氨作用:转氨作用是氨基酸合成的重要步骤。
在这个过程中,氨基酸的氨基被转移到另一个分子上,生成新的氨基酸。
常见的氨基酸合成途径包括谷氨酸转氨酶途径、天门冬氨酸转氨酶途径等。
氨基酸修饰和修饰:一些氨基酸需要特定的修饰过程,以形成最终的功能性氨基酸。
这些修饰包括甲基化、酰化、磷酸化、糖基化等。
需要注意的是,不同的氨基酸具有不同的合成途径和代谢路径。
此外,人体无法自行合成所有的氨基酸,一部分必需氨基酸需要通过饮食摄入。
大专生物化学课件(新)-氨基酸的性质和制备

定性鉴别溶液中是否含有某种氨基
酸/样品是不是某种氨基酸
利用某些氨基酸的特殊反应、特殊性质, 如:
脯氨酸,羟脯氨酸与茚三酮反应呈黄色 酪氨酸,色氨酸,苯丙氨酸在280nm左右有光吸 收 其他化学反应
1. 米伦反应:酪氨酸与米伦试剂(硝酸汞溶于含有少量亚硝酸的 硝酸中)反应即生成白色沉淀,加热后变成红色。含有酪氨酸 的蛋白质也有此反应; 2. 坂口反应:在碱性溶液中,胍基与含有萘酚及次溴酸盐的试 剂反应,生成红色物质。这是对于精氨酸专一性较强、灵敏度
会产生吸引作用。
国外膜分离工艺已应用于乳制品工业。采用反渗 透浓缩乳清,使用超滤法从乳清中制备浓缩蛋白质, 使用微米膜分离乳清中的蛋白质,去除脱脂乳中的 细菌,使用纳滤膜去除乳清中的矿物质。近些年, 又开始研究膜过滤分离蛋白质、肽和氨基酸的可行 性。在人体的新陈代谢过程中存在大量生物膜渗透 现象。研究氨基酸的膜分离不仅可以找出有效的生 物分离技术,而且有助于加深对这些新陈代谢过程 的了解。
(4)特殊试剂沉淀法 :采用某些有机或无机试 剂与相应氨基酸形成不溶性衍生物的分离方法。
精氨酸与苯甲醛生成沉淀,盐酸去除苯甲醛
是最早应用于混合氨基酸分离的方法之一。某些氨基酸可以 与一些有机化合物或无机化合物结合,形成结晶性衍生物沉 淀,达到与其它氨基酸分离的目的,但是,特殊沉淀法的沉 淀剂回收困难,排放废液中参杂有沉淀剂,加重了污染,残 留在氨基酸产品中的沉淀剂还会影响纯度。
紫外吸收光谱性质
构成蛋白质的20种氨基酸在可见光区
都没有光吸收,但在远紫外区 (<220nm)均有光吸收。
在近紫外区(220-300nm)只有酪氨酸、
苯丙氨酸和色氨酸有吸收光的能力
专业课生物化学第三章 氨基酸

此反应可被巯基试剂逆转
6、半胱氨酸侧链上的巯基:
反应性能很高,在微碱性条件下,巯基发生解离形 成硫醇阴离子(-CH2-S-),能与卤化烷例如碘乙酸,碘 乙酰胺,甲基碘等迅速反应,生成相应的稳定烷基衍 生物。
半胱氨酸的巯基能打开乙撑亚胺,即氨丙啶的环.
第3章:氨基酸
第一节:氨基酸的结构与分类
第二节:氨基酸的酸碱化学
第三节:氨基酸的化学性质
第四节:氨基酸的光学活性和光谱性质
第一节(一):氨基酸的结构
一、氨基酸—— 组成蛋白质的基本单位
1、酸水解: 盐酸或硫酸回流煮沸20小时。 不引起消旋作用,得到L-氨基酸。色氨酸完全被破坏;羟基氨 基酸、天冬酰胺、谷胺酰胺部分被破坏。 2、碱水解:氢氧化钠共煮10—20小时。 产物是D型和L型氨基酸的混合物。产生消旋现象。多数氨基酸 遭到破坏。色氨酸稳定。 3、酶水解: 胰蛋白酶、糜蛋白酶、胃蛋白酶水解。 不产生消旋作用,也不破坏氨基酸。水解不彻底。
反应中1分子的半胱氨酸引起1分子的硫硝基苯甲酸的 释放。它在pH8.0时,在412nm波长处有强烈的光吸收, 因此可利用比色法定量测定-SH基。
二硫键的形成和打开 1、二硫键的形成
在痕量的金属离子如Cu2+,Fe2+,C02+和Mn2+ 存在下,巯基在空气中氧化显著提高。这些离子 可能是反应所需的催化剂。
3. 碱性氨基酸(+)
1、非极性R基(中性-非极性氨基酸)
共8种氨基酸,4种带脂肪烃侧链的氨基酸;2种含芳香环 氨基酸;1种含巯基氨基酸和1种甘氨酸。它们在水中的溶 解度比极性氨基酸小。
2、不带电荷的极性R基(中性-极性氨基酸)
β-氨基酸的合成方法

β-氨基酸的合成方法β-氨基酸是一类具有β-羧基和β-氨基的氨基酸,其合成方法有多种途径。
本文将就几种常见的β-氨基酸合成方法进行介绍。
一、Strecker合成法Strecker合成法是一种常用的合成β-氨基酸的方法。
该方法以α-氨基酸和醛类或酮类化合物为原料,在酸性条件下进行反应。
首先,醛类或酮类化合物与氨氰酸反应生成氨基酮,然后与α-氨基酸进行缩合反应,生成对应的β-氨基酸。
二、Enzymatic合成法Enzymatic合成法是利用酶催化反应合成β-氨基酸的方法。
其中一种常用的酶是氨基酸转氨酶。
该酶能够将α-氨基酸转化为β-氨基酸。
在反应中,氨基酸转氨酶与α-氨基酸和酮类底物反应,生成对应的β-氨基酸。
三、Decarboxylation合成法Decarboxylation合成法是一种通过羧基的脱羧反应合成β-氨基酸的方法。
在该合成方法中,β-氨基酸的合成可通过α-氨基酸经过一系列反应得到。
首先,α-氨基酸经过酸催化下的羧基脱羧反应形成亚胺酸,然后亚胺酸经过还原反应生成相应的β-氨基酸。
四、Michael加成反应Michael加成反应也是一种常用的合成β-氨基酸的方法。
该反应是以α,β-不饱和羧酸为底物,与胺类化合物进行加成反应,生成β-氨基酸。
在反应中,羧酸底物的α,β-不饱和键与胺类化合物发生加成反应,生成β-氨基酸。
以上是常见的几种合成β-氨基酸的方法,每种方法都有其适用的场景和优缺点。
在实际应用中,选择合适的方法取决于目标化合物的结构和合成要求。
通过不同的合成方法,可以合成多种不同的β-氨基酸,为药物研发和生物化学研究提供了重要的工具和基础。
同时,随着合成方法的不断发展和改进,对于合成β-氨基酸的效率和选择性也得到了显著提高。
β-氨基酸的合成方法有多种途径,包括Strecker合成法、Enzymatic合成法、Decarboxylation合成法和Michael加成反应等。
这些方法在合成β-氨基酸中发挥着重要的作用,为相关领域的研究提供了有效的手段。
生物化学8 氨基酸代谢与合成

蛋白质降解和氨基酸的分解代谢蛋白质的降解细胞总是不断地从氨基酸合成蛋白质,又把蛋白质降解为氨基酸。
从表面上看,这样的变化过程看似是一种浪费,实际上它有二重功能,其一是排除那些不正常的蛋白质,它们一旦积聚,将对细胞有害;其二是通过排除积累过多的酶和调节蛋白使细胞代谢的井然有序得以进行。
蛋白质降解的特性蛋白质有选择地降解非正常蛋白质,例如血红蛋白与缬氨酸类似物结合,得到的产物在网织红细胞中的半存活期约10min,而正常血红蛋白可延续红细胞的存活期最终可达120天。
正常的胞内蛋白被排除的速度是由它们的个性决定的,绝大多数快速降解的酶都居于重要的“代谢控制”位置,而较稳定的酶在所有生理条件下有较稳定的催化活性。
降解速度还因它的营养及激素状态而有所不同。
在营养条件被剥夺的情况下,细胞提高它的蛋白质降解速度,以维持它的必需营养源使不可或缺的代谢过程得以进行。
蛋白质降解的反应机制真核细胞对于蛋白质降解有两种体系,一个是溶酶体的降解体质和一种ATP-依赖性的以细胞溶胶为基础的机制。
溶酶体溶酶体是具有单层被膜的细胞器,其中个含有50多种水解酶,包括不同种的蛋白酶,称之为组织蛋白酶。
溶酶体保持其内部PH在5左右,而它含有的酶的最适PH就是酸性。
如此可以抵制偶然的溶酶体渗漏从而保护了细胞,因此在细胞溶胶PH下,溶酶体的大部分酶都是无活性的。
溶酶体对细胞各组分的再利用是通过它融合细胞质的膜被点块即自(体吞)噬泡,并随即分解其内容物实现的。
溶酶体的阻断剂有抗虐药物——氯代奎宁(是一种弱碱,在不带电形式随意穿透溶酶体,在溶酶体内积累形成特电荷型,因此增高了溶酶体内部的pH,并阻碍了溶酶体的功能。
溶酶体降解蛋白质是无选择性的,而rong'mei't'抑制剂对于非正常蛋白或短寿命酶无快速的降解效应,但是它们可以防止饥饿状态下蛋白质的加速度崩溃。
许多正常的和病理活动都伴随溶酶体活性的升高。
ATP-依赖真核细胞蛋白质的降解主要是溶酶体的作用,但是缺少溶酶体的网织红细胞却可选择性的降解非正常蛋白质,这里有ATP-依赖的蛋白质水解体系存在ATP依赖蛋白质需要有泛肽存在。
生物化学王镜岩第三版第31章 氨基酸的生物合成
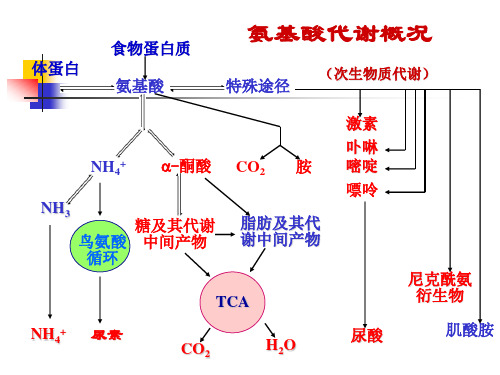
氨基酸代谢概况
特殊途径
(次生物质代谢)
NH4+ NH3
-酮酸
CO2
胺
激素 卟啉 嘧啶 嘌呤
糖及其代谢 鸟氨酸 中间产物 循环
脂肪及其代 谢中间产物 尼克酰氨 衍生物
TCA NH4+ 尿素 CO2
H2O
尿酸
肌酸胺
第31章
氨基酸及其重要衍生物的生物合成
一、概论
(一)不同生物合成氨基酸的能力不同,合成氨基 酸的种类不同,利用的原料也不同。 从合成的种类: 有的能合成构成蛋白质的全部氨基酸,有的能 合成部分氨基酸。如高等植物能合成构成蛋白质的 全部氨基酸,不同微生物合成氨基酸的能力有很大 的差别,人与动物则必需氨基酸不能合成。
四、氨基酸转化为其它氨基酸及其它代 谢物
1.氧化氮的形成
脊椎动物体内的一种重要的信息分子,在 信号传导过程中起重要作用。它是由精氨酸在 氧化氮合酶(NOS)的催化下形成的,产物为 氧化氮和瓜氨酸。
E2
O C OH HN O 5-氧代脯氨酸
2.谷胱甘肽
O H2N CH C OH CH 2 R
+
CH NH 3
CH
COO-
O H2N CH C OH CH 2 CH 2 C O OH
O H2N CH C OH CH 2 SH O
外
内
E5
ATP
H2N CH C OH O H2N CH C OH H CH 2 CH 2 C O O HN CH C OH CH 2 SH γ -谷氨酰半胱氨酸
3.肌酸的生物合成
O H2N CH C OH OH O C NH H2 H2 H2 H CH C C C N C NH 2 NH 2 CH 2 OH O C H2 H2 CH C C C NH 2 H2 NH 2 H3C CH 2 S + CH 2 O H H O H2N CH C OH H H2N C NH 胍基乙酸 O H N CH 2 C OH O H2N CH C OH CH 2 CH 2 CH 3 H2N C NH S O O H H OH H H OH CH 2 N N N NH 2 N OH H H OH N N N NH 2 N
生物环境中氨基酸的生物合成和合成途径

生物环境中氨基酸的生物合成和合成途径生物界中,氨基酸是一种重要的营养物质,是构成蛋白质的基本单位。
氨基酸的生物合成过程,既涉及到物质的转化也涉及到能量的转移,是非常复杂的生物化学反应过程。
本文将简要介绍氨基酸的生物合成和合成途径。
1. 氨基酸的生物合成氨基酸是人体必需的营养物质,除了必需氨基酸外,其他氨基酸可以通过转化合成生成。
氨基酸的合成通常是在蛋白质降解和代谢途径中完成,而氨基酸的合成通常是由其他代谢物质经过途径杂合生成。
在真核生物体内,氨基酸代谢是一个复杂的途径网络,包含氨基酸的合成、降解、转化和转运等过程。
氨基酸合成主要有两种途径,即格林-紫杉醇途径和逆转录糖途径。
2. 格林-紫杉醇途径格林-紫杉醇途径是通向氨基酸生物合成的主途径之一,也是氨基酸生物合成的主要途径之一。
该途径产生的氨基酸是非必需氨基酸,包括丝氨酸、蘖氨酸、甘氨酸、谷氨酸和组氨酸等。
该途径的过程包括多种酶催化反应,其中主要的反应包括:(1)磷酸巴塞吡啶转移酶催化磷酸核糖清除酶和5-磷酸核糖转移酶转化成5-磷酸巴塞吡啶核苷酸。
(2)5-磷酸巴塞吡啶转换成L-核糖-5-磷酸巴塞吡啶。
该步骤由多种酶催化,包括PrtM催化将ATP转换成AMP和PPi,以及GlnBMT催化ATP和L-谷氨酰胺形成L-谷氨酰胺羧甲基酯。
(3)L-核糖-5-磷酸巴塞吡啶将L-组氨酸分别转化成L-组氨酸和L-蘖氨酸,通过分别形成2-氨基-3-酮丙酸和3-氨基-2-羟丁酸。
3. 逆转录糖途径逆转录糖途径是另一种通向氨基酸生物合成的途径,也是氨基酸合成的主要途径之一。
逆转录糖途径产生的氨基酸是非必需氨基酸,包括丙氨酸、酪氨酸和色氨酸等。
该途径的过程包括多种酶催化反应,其中主要的反应包括:(1)第一步是L-糖基酮酸转换成L-谷氨酰胺。
该步骤由多种酶催化,包括Dao和PhnY等催化酶。
(2)第二步是L-谷氨酰胺分别将赖氨酸、蛋氨酸和色氨酸等转化成对应的氨基酸。
4. 结论氨基酸生物合成是一项复杂的生物化学反应过程,在生物体内通过多种途径和酶催化完成。
氨基酸生物合成

一碳基团
在代谢过程中,某些化合
物(如氨基酸)可以分解产生 -CH=NH
具有一个碳原子的基团(不包 括CO2),称为一碳基团。一碳 基团的转移除了和许多氨基酸 的代谢直接有关外,还参与嘌 呤和胸腺嘧啶的生物合成。
H-CO-CH2OH -CH= -CH2-CH3
硝酸还原作用
(1)硝酸还原作用的化学本质
2e-
6e-
NO-3 硝酸还原酶 NO-2亚硝酸还原酶 NH+4
(2)硝酸还原酶 (3)亚硝酸还原酶
硝酸还原酶
a、铁氧还蛋白——硝酸还原酶
NO-3 + 2Fd还原态 + 2H+
NO-2 + 2Fd氧化态 + H2O
b、NAD(P)H-硝酸还原酶
NO3- +NAD(P)H + H+
参与嘌呤合成
六、蛋白质的酶促降解和氨基酸代谢 1 蛋白质的酶促降解
(1)肽酶和蛋白酶的类别 (2)蛋白酶的专一性 2 氨基酸代谢概况
3 氨基酸降解与转化 (1)脱氨基作用 氧化脱氨基作用:转氨基作用;联合脱氨基 (2)脱羧基作用,脱羧产物—胺类物质的生理功能 (3)氨基酸分解产物的转化
4 氨和氨基酸的生物合成
NO-2+ NAD(P)+ + H2O
亚硝酸还原酶
a、铁氧还蛋白——亚硝酸还原酶
NO-2 + 6Fd还原态 + 8H+
NH+4 + 6Fd氧化态 + 2H2O
b、NAD(P)H——亚硝酸还原酶
NO-2+ 3NAD(P)H + 5H+
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甘氨酸的合成方法
应化1001班李清水 0121014450109
甘氨酸是一种重要的氨基酸,它是重要的有机化工产品,世界年产量
6X103kg左右·主要用作制药的原料,如氨基酸制剂,L一多巴,谷胧甘肤,催产素,马尿酸的原料;亦用作合成其它氨基酸的原料,如苯丙氨酸,苏氨酸的原料,用作食品添加剂,如糖精去苦剂,味精增鲜剂等,农药工业中亦可用作除
草剂草甘麟,增甜剂增甘麟的原料.
甘氨酸的工业化生产主要有两种方法,一种是Strecke法,其工艺较成熟,成本低,收率高(70%左右).但该法以KCN为原料,反应中有HCN逸出,因而对
设备和三废处理要求高,另一种是我国工业化生产采用的氯乙酸胺化法.该法对设备和三废处理要求低,但收率低伟。
%一6。
%),反应周期长(60一70h),从
而使生产成本上升,此两种方法各有利弊.
本合成工艺以提高收率,缩短反应周期,采用合理的工艺流程,以减少三
废为目的,对氯乙酸胺化法进行了较大的改进.我们采用的方法是氯乙酸先制成氯乙酸按,然后在高浓度的催化剂乌洛托品存在下,控制反应液pH值,滴加氯乙酸按和氨水,使反应迅速且较完全地进行.此法提高收率达%%(以氯乙酸计),缩短周期仅需5h,副产物NH4CI回收,溶剂循环使用,从而基本上无三废(见
反应式和工艺流程图).
合成方法:
将0.471kg氯乙酸(纯度>98%)在缓慢搅拌下溶于0.42L氨水(浓度>25%)中,溶解放热可用水冷却.此氯乙酸按溶液酸度应为pH6.5一7.5,备用.
在ZL三颈瓶中,将0.175kg乌洛托品(纯度>99%)溶于0.125L水中,成糊状,中间装搅拌器,两边装滴液漏斗,开动搅拌并升温至内温60℃左右,保持
内温65一70℃.同时滴加氯乙酸按溶液和氨水(浓度>25%)0.38L,反应立即开
始.保持反应液pH7一8,内温不超过70℃,2h滴完,继续保持内温65一70℃,搅拌反应3h.
反应完毕后,在激烈搅拌下趁热倒入1.70L工业甲醇(浓度为80%),水浴
冷却,有大量白色固体析出;抽滤,在90~10。
℃下烘干Zh,得粗产品o,
422kg;其收率为89,6写(以氯乙酸计),纯度为85.5%,熔点为180℃(分解).
抽滤下来的甲醇溶液回收.
两次回收的甲醇经蒸馏可重复使用.蒸馏回收率为70%一80%,回收甲醇后
剩余液经活性炭脱色、浓缩、析晶,可得到氯化铵.
参考文献
【1】张震元.氨基酸的酶法合成【M】.
【2】法户井法二,江口新比古,浅井壮一郎氨.基酸的合成方【M】.。
