人体血浆PH调节机制ppt
高中生物 第一章 人体的内环境与稳态 第2节 内环境稳态的重要性课件 新人教版必修3

(4)健康人内环境能保持稳态,内环境保持稳态时人一定健 康。( × )
(5)内环境的变化会引起机体通过神经系统自动调节器官和 系统的活动。( × )
1133
2.内环境稳态的调节机制的现代观点是( )
A.神经调节
B.体液调节
C.神经—体液调节
D.神经—体液—免疫调节
解析:选 D 随着分子生物学的发展,人们普遍认为神经—
吸运动强度的调节有利于维持血液 pH 的相对稳定 ⑤食物中的
碱性物质与新陈代谢产生的酸性物质所构成的缓冲对调节了血
液 pH
A.①
B.①②③
C.①②③④
D.①②③⑤
3355
解析:选 C 血液中含有许多对酸碱度起缓冲作用的物质; 血液中的二氧化碳会刺激控制呼吸运动的神经中枢,促进呼吸运 动增强,增加通气量,从而将二氧化碳排出体外,使血浆 pH 变 化不大;当碳酸钠进入血液后,会与血液中的碳酸发生作用,形 成碳酸氢盐,而过多的碳酸氢盐可以经肾脏随尿液排出,使血浆 酸碱度不会发生很大的变化。
66
2.对稳态调节机制的认识过程
77
3.稳态的失调 人体维持内环境稳态的能力是有 8 _一__定__限__度___的。
① 9 _外__界__环__境___的变化过于剧烈时 原因②某种器官的功能 10 _出__现__障__碍___时
88
4.稳态的意义 (1)内环境稳态是机体进行 11 _正__常__生__命__活__动___的必要条件。 (2)实例: ①只有 12 __血__糖__含量和血液中的 13 __含__氧__量__保持在正常范 围内,才能保证为细胞代谢提供充足的反应物。 ②适宜的 14 _温__度___和 15 _p_H__等是酶正常发挥催化作用的基 本条件。
《外科护理学》水电解质酸碱平衡失调病人的护理 ppt课件

细胞内液向细胞外液转移,导致细胞内
渗透压高
缺水重于细胞外,高渗状态刺激口渴中 枢,病人感到口渴,高渗状态刺激ADH分 泌增多,尿量减少、尿比重增高,细胞 外液量及渗透压得以恢复
ppt课件
20
护理评估
(一) 健康史 病因主要有三种: 1.水丢失过多 2.水分摄入不足 3.高渗性溶质摄取过多
ppt课件
21
护理评估
(二)身心状况 依据缺水程度和临床症状轻重不同可分为三度
程度 轻度缺水 身体状况 除口渴外,无其他症状 缺水量 约是体重的2%—4%
中度缺水
除极度口渴外,出现缺水体征: 唇舌干燥,皮肤弹性差,眼窝 约是体重的4%—6% 凹陷。伴有乏力、尿少和尿比 重增高。常有烦躁现象。 除缺水症状和体征外,出现脑 功能障碍的症状,如躁狂、幻 约是体重的6%以上 觉、谵妄,甚至昏迷。
︶
23
护理评估
(四) 辅助检查 1.尿液检查 尿量减少,尿比重增大,大于1.025
2.血液检查
⑴血电解质:血清钠离子浓度大于150mmol/L。
⑵血常规:血浆渗透压大于 310mmol/L ; RBC 、 Hb 、
PCV(Hct)轻度增高
ppt课件 24
护理评估
(五) 处理原则
尽早去除病因,鼓励饮水,
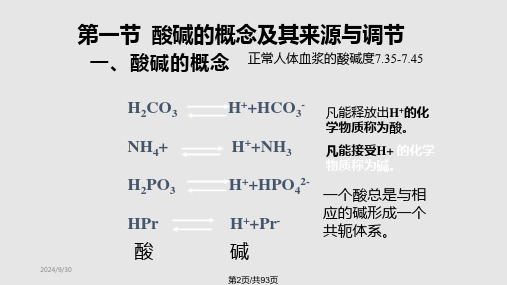
(1)血液缓冲系统 HCO3-/H2CO3 是最重要的缓冲对,调节的特点是作用迅速,但不持久。
(2) 肺的调节
肺是排出体内挥发性酸的主要器官 (3)肾调节 肾是调节酸碱平衡的最重要器官,具有调节作用强大而持久的特点
ppt课件
15
三、酸碱平衡及调节
分母的调节:通过肺
正常pH7.35~7.45
酸碱平衡紊乱护理.ppt

4. 细胞内的缓冲(细胞内外离子交换) H+进入细胞,K+流出细胞,血钾
5. 骨骼缓冲作用 骨质脱钙
若能维持在20/1,则pH保持正常下 限,为代偿性代谢性酸失代偿性代谢性酸中毒。
血气分析: HCO3- 、AB、SB均,
5. 血液稀释,使血液HCO3-稀释,缓冲降低
6. 高血钾
(二) 分类
(三)机体的代偿调节
1. 细胞外液(血液)的缓冲作用 H+ + HCO3- H2CO3 CO2 + H2O 随着H+ 被HCO3- 缓冲,SB、AB均
2. 呼吸(肺)的代偿调节 呼吸深快,排CO2 PaCO2=[HCO3-]×1.22
上述各调节因素的比较
发挥作用时间
作用效果
立刻(10分钟内)
不持久
数分钟(30分钟达高峰)
仅对CO2
3~4小时
强,但导致血钾异常
数小时 (3-5天达高峰) 持续时间长
三、常用指标及其意义:
1 血浆pH值
Henderson-Hasselbaclch公式
pH = pKa + log [HCO3-] = 6.1+
log24/1.2
[H2CO3]
=6.1+log20/1=7.401
2 动脉血二氧化碳分压 (PaCO2): 溶解于动脉血浆的CO2所产生的张
力,正常值5.3KPa(40mmHg),反映呼 吸性(肺泡通气量)的因素
3、碳酸氢盐
标准碳酸氢盐(SB):指全血在标准条件下
(38℃,血氧饱和度100%,PCO2 40 mmHg )所 测得的血浆HCO3-浓度。 --- 反映代谢性因素指标
人教版高中生物学选择性必修1稳态与调节精品课件 第1章 人体的内环境与稳态 第2节 内环境的稳态

)
A.外界环境的变化和体内细胞的代谢活动均可以影响内环境的稳态
B.内环境的稳态就是指内环境的各种理化性质处于相对稳定的状态
C.肾上腺、甲状腺、唾液腺产生的分泌物,均直接排放到内环境中
D.草履虫通过内环境与外界环境进行物质交换,从而实现稳态
答案 A
解析 外界环境的变化和体内细胞代谢活动均可影响内环境的稳态,但在神
肺部毛细血管。
在肾脏形成尿液。
④循环系统:由上述内容可看出 血液
是所有生命活动的中转站,它的成
分能充分反映机体的健康状况。
(2)间接参与调节稳态的系统:神经系统、 内分泌系统
和免疫系统。
2.对稳态调节机制的认识
神经系统
神经调节
神经—体液—免疫
体液调节
3.人体维持稳态的调节能力特点:
有一定限度
4.稳态遭破坏的原因
(2)人体剧烈运动后,由于无氧呼吸产生乳酸,使血浆pH明显降低。( × )
提示 人体剧烈运动后,产生的乳酸与血浆中的缓冲物质NaHCO3发生反应,
使血浆pH基本不变。
2(3)内环境中有许多缓冲对,如 HCO3 /H2CO3、HPO4 /H2PO4 等,可以使内环
境的pH维持在一定范围内。( √ )
(4)肺气肿患者由于呼吸不畅,血液中的pH将略有降低。( √ )
细胞内液和细胞外液渗透压均发生较大变化,D项错误。
视角2模拟生物体维持pH的稳定
2.(2021江苏宿迁高二期中)取甲、乙两支试管,向甲试管内加入血浆,乙试
管内加入等量的蒸馏水,用pH试纸检测;然后,向甲、乙试管内各滴入几滴
等量的盐酸或NaOH溶液,摇匀后,再用pH试纸检测。下列关于此实验的过
程和结果的分析,不正确的是(
人体内环境pH值缓冲调节原理分析

2020年第9期(x )寸?4i 抬各f ⑯教学链接----------------人体内环境p H 值缓冲调节原理分析甘肃省临夏中学(731100) 杜永新摘要人体血液的pH 通常维持在7. 35 ~7.45之间,存在多种缓冲溶液,结合实例说明缓冲溶液中抗酸成分和抗城成分是如何调节酸城度的。
关键词缓冲溶液;抗酸成分;抗域成分;p H调节 文章编号 1005 - 2259(2020)9x -0065 - 02人体新陈代谢过程中,会产生许多代谢产物,这 些酸性或碱性的物质进人血液,会使血液的pH 发生 变化。
但是通过实际测定发现,正常人体血液的PH 通常维持在7. 35 ~7.45之间,变化范围很小,这种相 对稳定的环境依赖于血液中的缓冲溶液,缓冲溶液有 抗酸成分和抗碱成分,能够抵抗外来少量的酸和碱, 维持人体内环境的pH 稳定,下面就缓冲溶液及缓冲 机理进行分析。
1缓冲物质人体内缓冲溶液中含有抗酸成分和抗碱成分,称 为缓冲对。
常见的缓冲对有5种类型:弱酸和弱酸 盐,如H 2C 03 -NaHC 03;多元酸的两种盐,Na 2HP 04 -NaH 2P 04;弱碱和弱碱盐,NH 3 • H 20-NH 4C 1;氨基酸 溶液;蛋白质溶液。
制作临时装片:剪取根尖2 ~3 mm —解离3 ~5 min — 清水漂洗约1〇 min —染色3 ~5 min —压制装片—显 微镜观察。
需要注意的是:加盖玻片时,防止产生气 泡;压片时尽可能使细胞分散开。
参考文献[1] 刘为华.高中生物实验教学中模式生物的系统构建[J ].中学生物教学,2017(5) :50 -52.[2] 江东海,罗琦.高中生物实验材料的佼佼者:洋葱[J ].中学生物学,2011,27(2) :49 - 50.[3] 于伟东.以洋葱为素材的高中生物实验及相关试题[J ].中学生理科应试,2016(8) :52 -54. A2缓冲机理人体血浆缓冲溶液能抵抗外来的酸和碱,依赖于 缓冲溶液中的抗酸成分和抗碱成分,当血浆中进入从 食物吸收或代谢产生的酸(H +)时,血浆中抗酸成分 与酸(H +)起反应,形成难电离的弱酸或其它化合物, 使血浆中的[H + ]几乎没有增大,血浆的PH 几乎没 有变化。
人体血浆PH调节机制ppt课件

正是由于血液中含有这些对酸碱起缓冲作用的物质,
才使血液的酸碱度不会发生很大的变化,从而维持在相对
稳定的状态。
人体血浆PH调节机制
9
缓冲物质
概念:对酸碱度其缓冲作用的物质,也叫缓冲 对。
组成:每一对缓冲物质都是由一种弱酸和相应 的一种强碱盐组成 。(NaH2PO4/Na2HPO4、 H2CO3/NaHCO3等 )
马铃薯匀浆 6.0 5.5 5.5 4.8 4.6 4.6 4.4 6.0 6.0 6.5 6.5 7.0 7.0 7.5
鸡蛋清 7.0 7.0 6.5 6.0 6.0 6.0 6.0 7.0 7.5 8.0 8.0 8.5 9.0 10
黄瓜匀浆 6.0 5.5 5.1 4.6 4.1 4.1 3.8 6.0 6.0 6.5 6.5 7.5 7.5 8.5
实验试剂
自来水
0 5 10 15 20 25 30 0 5 10 15 20 25 30 5.5 5.1 4.6 4.1 3.5 3.0 2.5 5.6 6.6 7.5 8.5 7.0 10 11
肝匀浆 6.0 6.0 5.5 4.8 4.6 4.6 4.6 6.0 6.0 6.5 6.5 7.0 7.5 7.5
测定pH 取一小块试纸放在表面皿上,用沾有待测液的玻璃棒或胶头滴
管滴于试纸的中部,观察颜色的变化,得出pH并作记录。 试纸不可直接伸入溶液;测试溶液的pH值时,不可事先用蒸馏
水润湿,这就相当于稀释了。
人体血浆PH调节机制
4
试剂 PH
加入0.1mol/L的HCl 加入不同数量液滴后的的PH
加入0.1mol/L的NaOH 加入不同数量液滴后的的PH
生物材料中含有缓冲物质,在加入酸或碱时, 能使pH的变化减弱.
酸碱平衡和酸碱平衡紊乱课件.pptx
标准碳酸氢盐和实际碳酸氢盐
标准碳酸氢盐 (standard bicarbonate,SB)
正常值:22-27mmol/L(24) 意义: ✓反映代谢性酸碱紊乱
✓呼吸性酸碱紊乱后的肾代偿
标准条件:PaCO2为40mmHg,温度38,血氧饱和度100%。
2024/9/30
第27页/共93页
代酸的分类
AG增高型代酸(血氯正常)
常 除了含氯以外的任何固定酸的血浆浓度增大时的代酸。
见 HCO3-缓冲固定酸H+而消耗,其酸根增高。 原 见于:乳酸,酮症酸,水杨酸中毒。
因
硫酸,磷酸排泄障碍。
AAGG
Na+ HHCCOO33-Cl -
2024/9/30
AG正常型代酸(高血氯)
HCO3 -浓度降低,同时伴有 Cl-浓度
2024/9/30
第18页/共93页
酸碱平衡紊乱
(acid-base disturbance)
概念:病理情况下可引起酸碱超负荷或调 节机制障碍,导致体内酸碱度稳态性破坏, 形成酸中毒或碱中毒,称酸碱平衡紊乱。
2024/9/30
第19页/共93页
酸碱平衡紊乱的类型
酸中毒 pH= 碱中毒
HCO3H2CO3
食物在体内转化或经氧化后生成
第3页/共93页
H+
H ++HCO3-
CA
H2CO3
CO2 + H2O
CA: 碳酸酐酶,------肾小管上皮细胞;红细胞; 肺泡上皮细胞;胃粘膜上皮细胞
CO2:成人安静状态下每天可产生300-400L, 可释放15mol左右H +。 碳酸:体内酸性物质的主要来源。
成人每日固定酸释放出H+达50—100mmol
4-1酸碱平衡失调精品PPT课件

[ H+ ]↑:H+ + HCO3﹣ → H2CO3 → H2O + CO2↑
[OH﹣]↑:OH﹣ + H2CO3 → H2O + HCO3﹣ 缓冲作用发生最快,立即反应;但作用不持久,
而且不能缓冲挥发性酸。
肺: 迅速、强大, 只能调节挥发酸、不能缓冲固定酸
组织细胞:较强、2-4小时后发挥作用, 可致血钾、血氯紊乱
肾: 缓慢、有效、强大、持久, 排酸保碱同时进行
四大调节体系共同作用,维持pH在微小范围内波动。
三、反映酸碱平衡的常用指标
(一)动脉血pH
概念:血浆中H+浓度的负对数。 正常值:pH=7.35~7.45,平均值 7.4。 意义:区分酸、碱中毒。(不能区分原因)
PaCO2 > 46mmHg
通气不足,呼吸性酸中毒 代偿后的代谢性碱中毒
PaCO2 < 33mmHg
通气过度, 呼吸性碱中毒 代偿后的代谢性酸中毒
(三)标准碳酸氢盐(SB) 和 实际碳酸氢盐(AB)
1、标准碳酸氢盐(SB) 概念:全血在标准条件下(38℃、血氧饱和度100%
、PCO2 40mmHg)测得的血浆中HCO3-浓度。 正常值:22~27mmol/L,平均24mmol/L。 意义:是判断代谢性因素的指标。
2、实际碳酸氢盐(AB) 概念:隔绝空气的全血标本,在实际PaCO2、实际体
温和血氧饱和度条件下测得的血浆中HCO3-浓度。 正常值:SB=AB。 意义:①是判断判断呼吸及代谢双因素的指标;
② AB与SB的差值反映呼吸性因素的变化 。
AB=SB:表示正常。
人体血浆PH调节机制ppt课件

精选课件
2
【实验原理】
精选课件
3
注意事项:
安全
盐酸和氢氧化钠有强腐蚀性,要避免接触。 量筒的使用
使用量筒量液时,应把量筒放在水平的桌面上,使眼的视线和 液体凹液面的最低点在同一水平面上,读取和凹面相切的刻度即可。 量取指定体积的液体时,应先倒入接近所需体积的液体,然后改用 胶头滴管滴加。
测定pH 取一小块试纸放在表面皿上,用沾有待测液的玻璃棒或胶头滴
更像缓冲液
精选课件
7
2、对生物材料维持pH稳定的机制进行解释。
生物材料中含有缓冲物质,在加入酸或碱时, 能使pH的变化减弱.
此外,机体还可以通过对生理活动进行调节来 维持pH稳定。
精选课件
8
内环境的理化性质会不会经常发生剧烈变化呢?
乳酸
由肾脏排处 碳酸氢钠
H2CO3 / NaHCO3 血浆
乳酸钠 H2CO3
作用:使酸碱度不会发生很大变化,从而维持 在相对稳定的状态。
精选课件
10
用传感器完成实验
结论: 1)加入HCI 或NaOH后pH的变化,生物材料更像缓冲液。 2)生物材料中有缓冲物质,有利于维持pH的稳定。
精选课件
11
感谢亲观看此幻灯片,此课件部分内容来源于网络, 如有侵权请及时联系我们删除,谢谢配合!
探究实验 ——生物体维持PH稳定的机制
精选课件
1
【实验目的】 1.比较自来水、缓冲液和生物材料在加入酸或碱后
PH的变化; 2.根据实验结果推测生物体是如何维持PH稳定的。
【实验器材】 50ml烧杯 量筒 PH计或万用PH试纸 镊子 彩色
铅笔 物质的量浓度为0.1mol/L的HCl 物质的量浓度为
血气分析与酸碱平衡课件

•血气分析与酸碱平衡
•8
一·代谢性酸中毒(metabolic acidosis)
1·固定酸生成过多: 缺氧时乳酸增加(如低氧血症、微循环功能障碍等); 脂肪分解增加、酮体产生过多(如糖尿病酮症和饥饿酮症、
以及各种原因引起的组织分解代谢亢进等)。
[概 述]
1·定义: 血气分析:定量测定血液中气体等、分析其临床意义。
氧合状态:PaO2 酸碱平衡:pH、HCO3-、PaCO2、BE 2·意义: 呼吸功能:通气与氧合状态、 呼吸衰竭及呼吸衰竭的类型 酸碱平衡:酸碱失衡、酸碱失衡的类型(复合型)、 酸碱失衡有无代偿及代偿的程度等。
动脉血的气体及其成分全身各部位相同,主要反映肺功能状况。 静脉血的气体随身体各部位组织的成分及其代谢率、血流灌注的不同而异,
正常值约为0.7~2.0kPa(5~15mmHg)。
主要临床意义:PA-aDO2是肺换气功能指标。 增大:换气功能下降,氧合不全,常压供氧难以提高PaO2(如ARDS)。
影响PA-aDO2因素:吸入氧浓度、通气/血流比值、肺内分流量、 肺弥散功能、氧耗量、心输出量和氧离曲线部位等。
•血气分析与酸碱平衡
•血气分析与酸碱平衡
•17
4·动脉血氧含量(CaO2)
CaO2:O2mmol/L动脉血或O2ml/100ml动脉血, 血液中RBC和血浆含O2的总和 (HbO2结合氧和物理溶解氧)
CaO2=Hb(g/dl)×1.34×SaO2 + PaO2(mmHg)×0.0031。 正常值约9.0±0.45mmol/L(20±1.0ml/dl)。主要为Hb结合的氧
•血气分析与酸碱平衡
•3
模拟生物体维持pH的稳定ppt课件

3. 运用所学评价“酸碱体质理论”科学性,用知识指 导自己及他人的健康生活。
生物体内环境的pH
食物 酸碱 性性 物物 质质
细胞 代谢
酸性物质
(H2CO3)
模拟实验
模拟生物体维持pH的稳定 原型与模型
加入不同体积后的pH (mL)
材料
0
0.1
0.2
0.3
0.4
0.5
0.6
蒸馏水1
7.0
6.3
3.8
3.4
3.2
3.1
3.0
蒸馏水2
7.0
6.3
3.7
3.5
3.2
3.1
3.0
蒸馏水3
6.5
4.7
3.5
3.3
3.1
3.0
2.9
蒸馏水
pH计探头、盛放蒸馏水的烧杯未清洗干净或蒸馏水 被污染等。
模拟生物体维持pH的稳定 注意事项
3 无关变量 实验材料的体积、实验时的温度, 检测pH的方法等
模拟生物体维持pH的稳定 材料用具
0.1mol/L HCl
0.1mol/L NaOH
模拟生物体维持pH的稳定 材料用具
任务一 设计实验,模拟生物体维持pH的稳定
对照原则 重复原则 科学性原则
材料用具:物质的量浓度 0.1mol/L HCl、0.1mol/L NaOH、 血浆、蒸馏水、pH为7的磷酸缓 冲液、烧杯、量筒、手套、护目 镜、移液器、磁力搅拌器等。
模拟生物体维持pH的稳定 实验步骤
A组:量取25mL蒸馏水,加入50mL烧杯,置于磁力搅拌 器上,pH计检测初始pH值并记录,移液器缓慢加入0.1mL 的0.1mo1/L的HCl溶液,检测并记录pH值,重复这个步骤 直到加入0.6mL为止。用缓冲溶液、血浆重复操作。 B组:将A组中的HCl换为0.1mol/L的NaOH溶液,进行同 样的操作。用缓冲液、血浆重复操作。 重复上述实验三次,取平均值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水润湿,这就相当于稀释了。
-
试剂 PH
加入0.1mol/L的HCl 加入不同数量液滴后的的PH
加入0.1mol/L的NaOH 加入不同数量液滴后的的PH
实验试剂
自来水
0 5 10 15 20 25 30 0 5 10 15 20 25 30 5.5 5.1 4.6 4.1 3.5 3.0 2.5 5.6 6.6 7.5 8.5 7.0 10 11
探究实验 ——生物体维持PH稳定的机制
-
【实验目的】 1.比较自来水、缓冲液和生物材料在加入酸或碱后
PH的变化; 2.根据实验结果推测生物体是如何维持PH稳定的。
【实验器材】 50ml烧杯 量筒 PH计或万用PH试纸 镊子 彩色
铅笔 物质的量浓度为0.1mol/L的HCl 物质的量浓度为
0.1 0.1mol/L的NaOH 生物材料(肝匀浆、马铃薯匀浆等) PH=7的磷酸
肝匀浆 6.0 6.0 5.5 4.8 4.6 4.6 4.6 6.0 6.0 6.5 6.5 7.0 7.5 7.5
马铃薯匀浆 6.0 5.5 5.5 4.8 4.6 4.6 4.4 6.0 6.0 6.5 6.5 7.0 7.0 7.5
鸡蛋清 7.0 7.0 6.5 6.0 6.0 6.0 6.0 7.0 7.5 8.0 8.0 8.5 9.0 10
CO2 H2O
呼吸 排出
呼吸中枢调节
正是由于血液中含有这些对酸碱起缓冲作用的物质, 才使血液的酸碱度不会发生很大的变化,从而维持在相对 稳定的状态。
-
缓冲物质
概念:对酸碱度其缓冲作用的物质,也叫缓冲 对。
组成:每一对缓冲物质都是由一种弱酸和相应 的一种强碱盐组成 。(NaH2PO4/Na2HPO4、 H2CO3/NaHCO3等 )
作用:使酸碱度不会发生很大变化,从而维持 在相对稳定的状态。
-
用传感器完成实验
结论: 1)加入HCI 或NaOH后pH的变化,生物材料更像缓冲液。 2)生物材料中有缓冲物质,有利于维持pH的稳定。
-
更像缓冲液
-
2、对生物材料维持pH稳定的机制进行解释。
生物材料中含有缓冲物质,在加入酸或碱时, 能使pH的变化减弱. 此外,机体还可以通过对生理活动进行调节来 维持pH稳定。
-
内环境的理化性质会不会经常发生剧烈变化呢?
乳酸
由肾脏排处 碳酸氢钠
H2CO3 / NaHCO3 血浆
乳酸钠 H2CO3
碳酸钠
缓冲液
-
【实验原理】
-
注意事项:
安全
盐酸和氢氧化钠有强腐蚀性,要避免接触。 量筒的使用
使用量筒量液时,应把量筒放在水平的桌面上,使眼的视线和 液体凹液面的最低点在同一水平面上,读取和凹面相切的刻度即可。 量取指定体积的液体时,应先倒入接近所需体积的液体,然后改用 胶头滴管滴加。
测定pH 取一小块试纸放在表面皿上,用沾有待测液的玻璃棒或胶头滴
黄瓜匀浆 6.0 5.5 5.1 4.6 4.1 4.1 3.8 6.0 6.0 6.5 6.5 7.5 7.5 8.5
缓冲液
7.0 7.0 7.0 7.0 7.0 7.0 7.0 7.0 7.0 7.0 7.0 7.0 7.0 7NaOH后的pH的变化来说, 生物材料是更像自来水还是更像缓冲液?
