经典:有机化学-第17章-协同反应
有机化学协同反应

四 前线轨道理论对电环化反应选择规则的解释
前线轨道理论认为: 一个共轭多烯分子在发生电环合反应时,必须掌握二项原则: (1)电环化反应中,起决定作用的分子轨道是共轭多烯的
HOMO,反应的立体选择主要取决于HOMO的对称 性。 (2)当共轭多烯两端的碳原子的p轨道旋转关环生成σ键 时,必须发生同位相的重叠(因为发生同位相重叠使 能量降低)。
光照条件下,到处于激发态的乙烯分子中的一个电子跃迁π*轨道 上去,因此,乙烯的HOMO是π*,另一乙烯分子基态的LUMO也 是π*,两者的对称性匹配是允许的,故环加成允许。
24
[4+2] 环加成 以乙烯与丁二烯为例
从前线轨道来看,乙烯与丁二烯HOMO和LUMO如下图:
LUM Oπ* HOM π O 乙 烯 的 前 线 轨 道 图
+
a b - c
a + = b - c
例如:
+
-C N -C
+
-CN -O
+
N N -C
+
-C = N -C (腈叶利德) -C += N -O(氧化腈)
N += N -C(重氮烷)
31
1,3-偶极化合物的结构特点
这类化合物都具有“在三个原子范围内包括4个电子的体系”
O3
-OO-O CH2N2
2C-H N-N RN3
1,3-偶极化合物的分子轨道的特点:
-N-RN-N
LUMO HOMO
与烯丙基负离
子具有类似的分
子轨道的特点。
32
2. 1,3-偶极环加成反应
定义:1,3-偶极化合物和烯烃、炔烃或相应衍生物生成五元 环状化合物的环加成反应称为1,3-偶极环加成反应。
有机化学课件——周环反应

+
环状过渡态
在周环反应中,旧键的断裂与新键的形成是同时进行的,反应不经过自由基或离子等活 性中间体阶段;周环反应一般受反应条件加热或光照的制约,而且加热和光照所产生的结果 也是不同的;此外,周环反应还具有高度的立体专一性的特点。
1965 年 R.B.Woodward 和 R.Hoffmann 在总结了大量反应规律的基础上,把分子轨道理 论引入周环反应的机理研究中,提出了分子轨道对称守恒原理,并推导出一系列选择规律, 用以推测协同反应能否进行及其立体化学过程,这是近代有机化学最大成就之一。
顺旋
H
H
H Me H Me
Me
Me
顺旋 Me
Me
H Me H Me
H
H
顺,反-2, 4-己二烯
顺-3, 4-二甲基环丁烯
如果 C2—C3 和 C4—C5 键是对旋,则 C2 上 p 轨道或 sp3 轨道的一叶能够只能与 C5 上 p 轨道 或 sp3 轨道相位相反的一叶接近,故不能重叠成键而生成反-3, 4-二甲基环丁烯:
分子轨道对称守恒原理把分子轨道理论用于研究化学反应的动态过程,能够很好的解 释和预测周环反应的立体化学过程以及反应进行的条件,其具体表述方法有前线轨道理论、 能级相关理论等,其中前线轨道理论最为简单而且形象,已被普遍接受。下面以共轭二烯和 共轭三烯为例,介绍这一重要原理。
有机化学 第17章 周环反应

Diels-Alder反应
W +
W
W
例:
+
O
O O
H H O O O + H H
O O O
顺式加成
endo(内型) 动力学控制产物
exo(外型) 热力学控制产物
[3, 3]s迁移(Claisen重排、Cope重排)
X H X
X
X=O or CH2
例:
H CH3 H CH3 225oC
Z型 CH3 E 型 CH3 CH3 H CH3 H 椅式构象过渡态 H
The Nobel Prize in Chemistry 1981
"for their theories, developed independently, concerning the course of chemical reactions"
Kenichi Fukui
Japan Kyoto University Kyoto, Japan (1918 – 1998)
CH3 hv
对旋 a
3 H H 1 CH3
H
a b
H hv CH3 CH3 2 H
1与2为 对映体
CH3 H
cis, trans
对旋 b
trans-二取代
trans-二取代
CH3 H CH3 H 3
cis-二取代
CH3 hv H H CH3
a
b hv
H
对旋 a
对旋 b
4
CH3 H CH3
3与4 相同
Roald Hoffmann USA Cornell University Ithaca, NY, USA 1937 -
李景宁《有机化学》(第五版)笔记和课后习题(含考研真题)详解-周环反应【圣才出品】

HOMO 决定。
17.2 课后习题详解
1.推测下列化合物电环化反应产物的结构。
((11))
(2) HH
(1)
(2)(1)
(2)
HH
((12))
(2)
)
H H3C
H CH3
H
(3)
H3C
CH3
hv
(2)
HH
H CH3
hv
(3) H(4) H
(3) H3HC HCH3
(3) H3CHH3C CHHC3H3 (5)
8 / 18
圣才电子书
答:
十万种考研考证电子书、题库视频学习平台
9.通过什么反应和条件,完成下面的反应。
Ph
O
O
O
Ph
O
O
Ph
Ph
O
答:通过光照和加热能得到给出的结果,反应过程如下:
Ph
hv
对旋
Ph
Ph
O
O
O
Ph
Ph
Ph
O
O O
10.如何使反-9,10-二氢萘转化为顺-9,10-二氢萘?
圣才电子书
十万种考研考证电子书、题库视频学习平台
第 17 章 周环反应
17.1 复习笔记
一、电环化反应 1.电环化反应 (1)电环化反应的概念 电环化反应是指在加热或光照条件下,共轭多烯烃环合形成环烯烃的反应及其逆反应。 (2)电环化反应的规律性 共轭多烯烃电环化反应有高度的立体选择性,反应与共轭体系的π电子数目有关,主要 分为 4n 型共轭多烯和 4n+2 型共轭多烯。其关系见表 17-1。
子的 HOMO 与另一个反应分子的 LUMO 对称性符合正正重叠或者负负重叠,形成化学键,
协同反应专业知识讲座

(Z、E)-2,4-己二烯
CH3 H
CH3 CH3
(Z、Z)-2,4-己二烯
H
CH3
H H
(E、E)-2,4-己二烯
电环合 与开环 是逆反 应,遵 守同一 规则
CH3
第二节 环加成反应
一、 环加成反应和环消除反应
• 环加成反应:在光或热旳作用下,分子间旳加成形 成环烯烃旳反应,以及它旳逆反应——一种环烯烃 分子裂解为两个或多种小分子旳反应(环消除反 应)。例如:Diels-Alder反应。
π
*
3
(丁二烯)
HOMO
π
*
3
(原来的 LUMO)
HOMOπ * (乙烯)
(原来的 LUMO)
LUMO π *(乙烯)
对称性禁阻旳乙烯和丁二烯旳环加成(光作用)图
大量旳试验事实证明了这个推断旳正确性,例如D-A反应 就是一类非常轻易进行且空间定向很强旳顺式加成旳热反应。 例如:
CHO 1 0 0 ℃
练习
H
H
H
对 旋
H H
10 H
对 旋
H H
H
h v 顺 旋 H
C H 3
对 旋 C H 3
H H
C H 3 C H 3
两种顺旋:
CH3
CH3
175℃
顺旋
CH3
CH3
175℃
顺旋
CH3 175℃ 顺旋
CH3
CH3 175℃ 顺旋
CH3
H
CH3 (Z、E)-2,4-己二烯 H
CH3
H
成果一样
CH3 H
π 2
π * 3
对[1,5]σ键氢迁移,则要用戊二烯自由基π体系旳分子轨道来 分析。
协同反应

A
SS
AS
SA
AA
环丁烷中两个 键轨道组合的对称性
* 1* 2 * 1* 2
AA AS SA SS
AA SA AS SS
* 1* 2
* 1* 2
1 2
1 2
1
2
1 2
乙烯环加成(加热)构成环丁烷的相 关图
* 1* 2 * 1* 2
CH3
H
1750C
CH3 CH3
CH3
1750C
CH3 CH3
H
CH3
H
1750C
CH3 CH3
H
CH3
CH3
CH3
H H
CH3
h
CH3
CH3 CH3
前线轨道理论
HOMO
LUMO
LUMO
HOMO
丁二烯
顺旋
HOMO
对旋
1965年Woodward—Hoffmann提出轨道对称 守恒原理.用于预测协同反应能否进行及其立体化 学进程. 反应物和产物分子轨道的对称性一致时反应 就易易于进行,反之反应就难于进行。即在一步 的反应中, 分子总是倾向于保持轨道对称性不变的 方式发生反应,而得到轨道对称性不变的产物。
S 1 2 SA
A * 2 AS
* 1
A * 2 AA
* 1
两分子乙烯轨道组合及对称性
反应的结果是失去两个 键, 生成两个 键,两个 键也有四种可能的组合,
m1
m1 m1 m1
m2
S
S
A
A
m2
1 2
S
1
有机化学课件第十七章

H
CH3
CH3
H
H3C H H
H
CH3
CH3
CH3
顺旋
H3C
激发态HOMO
CH3 H H
CH3
H
基态HOMO
2 含6个π 电子的体系
ψ 6
ψ 5
LUMO
HOMO
ψ 6
LUMO
ψ 5
ψ 4
HOMO
ψ 4
ψ 3
ψ 2
ψ 3
ψ 2
激发态
基态
ψ 1
ψ 1
在基态(加热)时HOMO为ψ3
EDG EDG EWG + EDG EWG D-A EDG EWG
电环化
ECR
CH3 CH3
CH3
环加成
EDG 环状过渡态
EDG
s迁移
1
2
3
O 环状过渡态
[3, 3] s 迁移
1
2 3
O 3' 1' 2'
O 3' 1' 2'
2 分子轨道对称守恒原理
化学反应是分子轨道重新组合的过程,分子轨道的对称 性控制化学反应的进程,在一个协同反应中,分子轨道 对称性守恒(不变)
1918~1998
1937~
"for their theories, developed independently, concerning the course of
chemical reactions"
3 前线轨道理论
分子间或分子内的反应与原子间相互作用类似。分子中的 前线电子类似于单个原子的价电子,起决定作用的是前线 电子和前线轨道。前线轨道是指HOMO (Highest Occupied Molecular Orbital)和LUMO (Lowest Unoccupied Molecular Orbital) 轨道。
10-协同反应-环加成反应

(2)内型加成规律
[4+2]环加成的另一立体化学特征是主要得到内型加成产物,如丁烯二酸酐
与环戊二烯的加成。
O
H
+
O
O
H O+
O O
O H HO O
endo
exo
内型加成时,几乎参与分子的所有双键重叠在一起,反应ห้องสมุดไป่ตู้碳氧双键可与 环戊二烯的双键作用形成较稳定的过渡态。
O O O
内型过渡态
O
O O
外型过渡态
B
LUMO
LUMO
HOMO
HOMO
B LUM O A HOMO
热反应两分子间轨道对称禁 阻不能以协同的方式成环
A
LUMO
HOMO
B
HOMO
B HOMO A LUMO
光反应两分子间轨道对称允 许能够以协同的方式成环
H C
H3C
H C
CH3
+
H
H
CC
H3C
CH3
H3C
CH3
hν
H
H
H
H
H3C
CH3
顺-1,2,3,4-四甲基环丁烷
+
O
O
O
O
4-环己烯-1,2-二甲酸酐
CHO
+
CHO
3-环己烯基甲醛
+
产率较低
1 反应特点
(1)同面/同面加成
H
COOCH3
+
H
COOCH3
顺式
H +
CH3OOC
COOCH3 H
反式
H COOCH3
COOCH3 H
周环反应 大学有机化学

1
2
3
1
2
3
CH2 CH CH2 CH2 CH CH2
1' 2' 3'
CH2 CH CH2 CH2 CH CH2
1' 2' 3'
ψ2
ψ2 柯普(Cope)重排,加热时是对称允许的
(2)克莱森(Claisen)重排
在热的作用下,烯丙基苯基醚分子中的烯丙基 CH CH=CH CH2 2 CH=CH2 2 CH CH HH2C CH CH2 2 2C 从氧原子转移到苯环碳原子上生成烯丙基酚的反应。
C C C
基态
C
加热时,同 面[1,5]σ 键 氢迁移允许
二、碳σ键迁移
1. [1,3 ]碳σ键迁移
H 1' CH3 3 2 1 1500C 2 3
H 1' CH3
1
2. [1,5 ]碳σ键迁移
CH3 1
2 3 4 5
CH3 2 1 5 CH3 4 3
CH3
3. [ 3,3 ]σ键迁移
(1)柯普(Cope)重排 在热的作用下,1,5-己二烯及其衍生物经过 六元环过渡态发生的重排。
CH CH2 3' CH2 H
CH2CH=CH2
1'
2'
CH2 CH=CH-CH 3 CH2 CH=CH-CH 3 1O
3 2 3
3' 1'
2'
3'
1 OH 2 3
2' 3' 1 OH 1' 2' 3' 2 CH-CH=CH 2 CH-CH=
CH3
3
CH3
OH CH2 CH2 CH=CH2 CH=CH2 OH OH OH O O Me Me Me Me Me Me Me Me Me e Me CH2-CH=CH2 CH2-CH=CH2 CH -CH=CH
有机化学协同反应PPT课件

顺旋 允许的
对旋 禁阻的
2021/5/3
11
第11页/共46页
丁二烯在激发态(光照)环化时,起反应的前线 轨道HOMO是ψ3 ,所以丁二烯在激发态(光照) 环化时,对旋允许,顺旋是禁阻。
hυ 对旋(允许)
hυ 顺旋(禁阻)
2021/5/3
12
第12页/共46页
其他含有4n 个π电子的共轭多烯烃体系的电 环化反应的方式也基本相同。 例如:
CH3
CO2CH3
顺式
CH3O2C N
CH3
N
+
CH2
CH3
CO2CH3
N N
CH3
CO2CH3 CH3 CO2CH3
顺式
N N
CO2CH3
CH3 CH3 CO2CH3
反式
反式
2021/5/3
28
第28页/共46页
3) 分子内环加成反应
O CH(CH3)3
O CH(CH3)3
2021/5/3
29
第29页/共46页
乙烯与丁二烯在加热条件下(基态)进行环加 成时,乙烯的HOMO与丁二烯的LUMO作用或丁 二烯的HOMO与乙烯的LUMO作用都是对称性允 许的,可以重叠成键。所以,[ 4+2 ]环加成是加热 允许的反应。如下图:
2021/5/3
LUMO
π
*
3
(丁二烯)
HOMO π (乙烯)
HOMO π 2 LUMO π *
HOMO
(原 LUNO )
[ 2+2 ]环加成是光作用下允许的反应。
2021/5/3
32
第32页/共46页
18.3 σ迁移
一、一般概念 在共轭π体系中, 处于烯丙位的一个 σ-键断裂, 在π 体系另一端生成一个新的σ-键,同时伴随π键的转 移, 这类反应叫做σ-移位反应, 也叫做σ-移位重排。
第17章_材料有机化学胺

罗氏化学 出品
CH3
CH3
A
H3C
CH3
B
H3C
NH H3C
H3C N(CH3)2
H3C
H3C
H3C
N H
N H3C CH3
CH3
CH3
N H
罗氏化学 出品
CH3 N(CH3)2
17.7 胺的氧化和科普消除
1 氧化胺
(1)氧化胺的制备:
R3N
H2O2 or RCO3H
(2)性质:
R3N→O (R3N+-O-)
第 17 章 胺
罗氏化学 出品
17.1 胺的分类
本
17.2 胺的结构
章
17.3 胺的物理性质
提
胺的反应
纲
17.4 胺的成盐反应 四级铵盐的应用
17.5 四级铵碱和霍夫曼消除反应
17.6 胺的酰化、兴斯堡反应
17.7 胺的氧化和科普消除
17.8 胺与亚罗硝酸氏的化反学应出品17.9 重氮甲烷
本
胺的制备
CH3(CH2)7CN 95%
相转移催化剂的用处:提高产率、降低反应 温度、缩短反应时间。
罗氏化学 出品
(3)相转移催化剂的使用原理(参见第十章) 请同学分析下面的实例:
罗氏化学 出品
17.5 四级铵碱和霍夫曼消除反应
1 四级铵碱
2 霍夫曼消除反应 (1)定义 (2)霍夫曼消除的规律 (3)霍夫曼消除反应的机理 (4)霍夫曼消除反应的机理和霍夫曼规则的关系
胺的光谱特征
胺的红外和核磁共振谱见第5章。
罗氏化学 出品
胺的反应 17.4 胺的成盐反应 四级铵盐的应用
17.4.1 胺的碱性 17.4.2 胺与酸的成盐反应 17.4.3 四级铵盐及其相转移催化作用
9-协同反应-电环化反应

HOMO
ψ3
FMO
ψ2
ψ1
激发态
2. 电环化反应立体选择性的解释
(1) 4n体系
1,3-丁二烯型化合物加热环合时能量较高 的电子在HOMO(ψ2)上.
HOMO
1,3-丁二烯HOMO只有顺旋才能保持对称 性不变,从而使1,4两端符号相同才能交盖 形成σ键。对旋则符号相反,对H3
CH3 Z,E-2,4-己二烯在加热条件下顺旋环合
生成顺-3,4-二甲基环丁烯。
H
H
图 取代1,3-丁二烯加热条件下电环化
HOMO
1,3-丁二烯型化合物光照环合时能量较高 的电子在HOMO ( ψ3 )上.
1,3-丁二烯HOMO只有对旋才能保持对称 性不变,从而使1,4两端符号相同才能交盖 形成σ键。顺旋则符号相反,对称性禁阻。
为什么在 4n体系以及4n+2体系的开链共轭多烯转变成环烯烃反应中,在加 热以及光照的情况下生成产物的构型不一样呢?
1. 前沿轨道的理论解释
1,3 — 丁二烯的π分子轨道
LUMO
LUMO ψ4
ψ3
HOMO
ψ2
LUMO则对电子有较强 的亲和力,具有电子接 受体的性质。
FMO
HOMO对其电子的束缚 较为松弛,具有电子给 予体的性质
第16讲 协同反应
协同反应: 是指在反应过程中有两个或两个以上的化学 键的断裂和形成,相互协调地在同一步骤中完成的反应。
+
常见的类型
电环化反应 环加成反应 σ–迁移反应
16.1 电环化反应
在加热或光照下,开链共轭多烯转变成 环烯烃,或其逆反 应环烯烃开环转变成开链共轭多烯的反应就叫电环化反应。
根据反应所涉及的电子的数目,可将反应分为: 4n体系 4n+2两种体系
有机化学 第十七章 周环反应

下面我们采用前线轨道理论进行讲解。
Organic Chemistry
© 2015 05 11
第十八章 周环反应
§18.1 电环化反应
在加热或光照条件下,共轭多烯烃转变成环烯烃或 环烯烃转变成共轭多烯烃的反应叫电环化反应。
例1
CH3
例2
CH3 H
第十八章 周环反应
3. 3,3-C 迁移 假定在加热条件下,C-C键断裂后生成自由基,其HOMO为
π2 ,反对称A。
例
· ·
Organic Chemistry
© 2015 05 11
第十八章 周环反应 例
例
Organic Chemistry
© 2015 05 11
4
第十八章 周环反应
例 Claisen 重排
π2
(HOMO)
简称
化性
问。
π1
题
Ground
state
基态 △
Organic Chemistry
分子轨道
A
S
(HOMO)
A
S
Excited state
激发态 hv 对称性
© 2015 05 11
第十八章 周环反应
CH3
CH3 H
HH CH3
H
CH3
hv
H
H CH3
CH3
加热,基态,HOMO π2 对称性 A 顺旋。
Organic Chemistry
© 2015 05 11
外型
Organic Chemistry
6+4
内型
© 2015 05 11
有机化学 周环反应

C C
C C
C C
C C
C
1
C
2
C
3
C
4
C
5 [ 1, 5 ] 迁移
C Z C
[ i , j ] 迁移
i
C C
1'
1
C C
2'
2
C C
3'
2
3
C C
4'
4
C C
5'
5
[ 3, 3 ] 迁 移
C C
1'
2
1
C C
2'
2
C C
3'
3
C C
4'
4
C C
5'
5
j
1 1' 2'
3 3'
1 1' 2'
3 3'
[ 3, 3 ] 迁 移
两分子烯烃或共轭多烯烃加成成为环状化合物的反应叫环加成反应。
环加成反应可以根据每一个反应物分子所提供的反应 电子数来分类.
+
[ 2 + 2 ]环加成
+
[ 2 + 4 ]环加成
O
+
O + O O
O O
1,3-偶极环加成反应
二、[ 2 + 2 ]环加成
+
h
H 3C H H
H C CH3 C CH3 H
△
4n+2体系 对旋允许
H
H
△
H H
H
△
H
4n体系 顺旋允许
4n+2体系 对旋允许
协同反应化学反应方程式反应路径
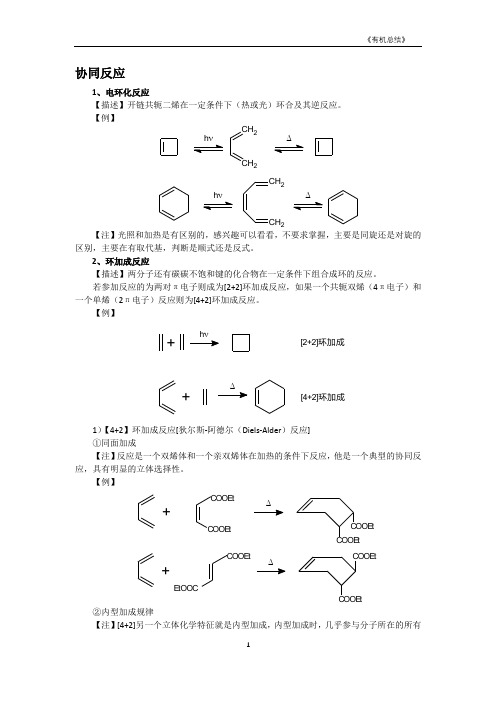
协同反应1、电环化反应【描述】开链共轭二烯在一定条件下(热或光)环合及其逆反应。
【例】CH 2CH2CH 2CH2【注】光照和加热是有区别的,感兴趣可以看看,不要求掌握,主要是同旋还是对旋的区别,主要在有取代基,判断是顺式还是反式。
2、环加成反应【描述】两分子还有碳碳不饱和键的化合物在一定条件下组合成环的反应。
若参加反应的为两对π电子则成为[2+2]环加成反应,如果一个共轭双烯(4π电子)和一个单烯(2π电子)反应则为[4+2]环加成反应。
【例】++[2+2]环加成[4+2]环加成1)【4+2】环加成反应[狄尔斯-阿德尔(Diels-Alder )反应] ①同面加成【注】反应是一个双烯体和一个亲双烯体在加热的条件下反应,他是一个典型的协同反应,具有明显的立体选择性。
【例】+COOE tCOOE tCOOE tCOOEt +E tOOCCOOE tCOOE tCOOE t②内型加成规律【注】[4+2]另一个立体化学特征就是内型加成,内型加成时,几乎参与分子所在的所有双键(包括羰基)重叠在一起,反应中碳氧双键也可与环戊二烯π键相互作用形成稳定的过渡态。
【例】O O++O OO OO O内型过渡态外型过渡态③其他双烯体和亲双烯体的环加成【描述】除碳碳双键外很多具有其他不饱和官能团的化合物均可作亲双烯体。
【双烯体】C C O OCC CN NN CC CC CO NC CC ,,,,等【亲双烯体】 CNCNC ON NN O,,,,等【例】CH 2CH 2CH 3CH 3+C C COOE tCOOE t CH 3CH 3COOE tCOOEt-H CH 3CH 3COOE tCOOEtNN COOE tCOOE t+N COOE ttOO+OCHO+NOC6H5ONC6H5N NE tOOC COOE t+NE tOOC COOEt 2)[2+2]环加成【描述】[2+2]环加成是两个烯分子组成四圆环。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3
基态 激发态
相同
15
例:
CH3 H H CH3
hv
CH3
CH3
CH3 H CH3 H
H 3C H H
CH3
H 3C H H
CH3
LUM O
LUMO HOMOLeabharlann H 3C H HCH3
hv 顺旋
H 3C H H
CH3
HOM O
对旋
H 3C H H
CH3
1
H 3C H H
CH3
基态 激发态
外消旋体
H H 3C
8
四 直链共轭多烯的分子轨道的一些特点
1. π分子轨道的数目与参与共轭体系的碳原子数是一致 的。
2. 对镜面(δv)按对称--反对称--对称交替变化。对二 重对称轴(C2)按反对称--对称--反对称交替变化。
3. 结(节)面数由0→1→2…逐渐增多。 4 轨道数目n为偶数时,n /2为成键轨道,n /2为反键
第十七章 周环反应 (协同反应)
1
第一节 周环反应和分子轨道对称守恒原理 一 周环反应概况简介 二 分子轨道对称守恒原理简介 三 前线轨道理论的概念和中心思想 四 直链共轭多烯π分子轨道的一些特点
2
一 周环反应概况简介
1. 定义
周环反应 在化学反应过程中,能形成环状过渡态的协同反应。
协同反应 协同反应是指在反应过程中有两个或两个以上的化学 键破裂和形成时,它们都相互协调地在同一步骤中完成。
4n+2电子体系?
HH
18
第三节 环加成反应
一 环加成反应的定义、分类和表示方法 二 环加成反应的选择规则 三 前线轨道理论对环加成反应选择规则的
证明 四 环加成反应选择规则的应用实例 五 1,3-偶极环加成反应
19
一 环加成反应的定义、分类和表示
1 定义 两个或多个带有双键、共轭双键或孤对
电子的分子相互作用,形成一个稳定的环状 化合物的反应称为环加成反应。
+
环状过渡态
3
2. 周环反应的特点:
1. 反应过程中没有自由基或离子这一类活性中间体产生; 2. 反应速率极少受溶剂极性和酸,碱催化剂的影响,也 3. 不受自由基引发剂和抑制剂的影响; 3. 反应条件一般只需要加热或光照,而且在加热条件下 4. 得到的产物和在光照条件下得到的产物具有不同的立 5. 体选择性,是高度空间定向反应。
轨道。n为奇数时,(n-1)/2为成键轨道,(n-1)/2为反 键轨道,1个为非键轨道。
9
第二节 电环化反应
一 电环化反应的定义 二 电环化反应描述立体化学过程的方法 三 电环化反应的选择规则 四 前线轨道理论对电环化反应选择规则的证明 五 电环化反应选择规则的应用实例
10
一 电环化反应定义
共轭多烯烃末端两个碳原子的π电子环合成一个σ键, 从而形成比原来分子少一个双键的环烯的反应及其逆反 应统称为电环化反应。
C3H H
H C3H
C3H h
H H C3H
H H
C3H C3H
11
二 电环化反应描述立体化学过程的方法
R
R
R
R
R
R
R
R
顺时针顺旋 反时针顺旋 内向对旋 外向对旋
12
三 电环化反应的选择规则
共轭体系电子数
顺旋
对旋
4n+2
h
禁阻 允许
h
允许 禁阻
4n
h
允许 禁阻
h
禁阻 允许
共轭体系电子数是指链型共轭烯烃的电子数。 允许是指对称性允许,其含义是反应按协同机理进行时活化能较低。 禁阻是指对称性禁阻,其含义是反应按协同机理进行时活化能很高。
+
CH3 H
CH3 H
H
CH3
H
H
+
CH3 CH3
C H 3 H 3C
H
H
相同
16
五 应用实例
如何实现下列转换
CH 3
H
?
CH 3
H
CH 3 H H CH 3
CH 3
H
h
CH 3 对
H
H
H 3 C CH 3 顺
H
CH 3 H H CH 3
17
更多例子:
hv
1.
HH
4n电子体系
2.
trans
4n电子体系
13
四 前线轨道理论对电环化反应选择规则的解释
前线轨道理论认为: 一个共轭多烯分子在发生电环合反应时,必须掌握二项原则: (1)电环化反应中,起决定作用的分子轨道是共轭多烯的
HOMO,反应的立体选择主要取决于HOMO的对称 性。 (2)当共轭多烯两端的碳原子的p轨道旋转关环生成σ键 时,必须发生同位相的重叠(因为发生同位相重叠使 能量降低)。
14
例:
C H 3 H H
C H 3
hv
C H 3 H C H 3
H
C H 3 H C H 3
H
H
CH3 H
CH3
LUMO
hv
H
H
CH3 H
CH3 LUMO HOMO 对旋
H3C
H
CH3 H
CH3 HOMO
H3C
顺旋
H
外消旋体
CH3
H3C
+
H
H
CH3
H
+
H
H3C
H CH3 H CH3
H CH3 H
环加成反应的逆反应为环消除反应。
20
2. 分类和表示
根据每一个反应物分子所提供的反应电子数来分类
同面
+
异面
4+2
21
二 环加成反应的选择规则
环加成反应的Woodward-Hoffmann选择规则
参与反应的电子数
4n + 2
4n
同面同面
h
h
允许
4
3. 周环反应的主要反应类别: 电环化反应 环加成反应 -迁移反应
5
二 分子轨道对称守恒原理简介
分子轨道对称守恒原理的中心内容及内涵:
化学反应是分子轨道重新组合的过程,分 子轨道的对称性控制化学反应的进程,在一 个协同反应中,分子轨道对称性守恒。(即 在一个协同反应中,由原料到产物,轨道的 对称性始终保持不变)。因为只有这样,才 能用最低的能量形成反应中的过渡态。
包括两种理论:前线轨道理论,能级相关理论 6
三 前线轨道理论的概念和中心思想
1. 前线轨道和前线电子
已占有电子的能级最高的轨道称为最高占有轨道,用 HOMO表示。未占有电子的能级最低的轨道称为最低未 占有轨道,用LUMO表示。HOMO、LUMO统称为前线 轨道,处在前线轨道上的电子称为前线电子。
有的共轭体系中含有奇数个电子,它的已占有电子 的能级最高的轨道中只有一个电子,这样的轨道称为单 占轨道,用SOMO表示,单占轨道既是HOMO,又是 LUMO。
7
2. 前线轨道理论的中心思想
前线轨道理论认为:分子中有类似于单个原子的 “价电子”的电子存在,分子的价电子就是前线电子, 因此在分子之间的化学反应过程中,最先作用的分子 轨道是前线轨道,起关键作用的电子是前线电子。
这是因为分子的HOMO对其电子的束缚较为松弛, 具有电子给予体的性质,而LUMO则对电子的亲和力 较强,具有电子接受体的性质,这两种轨道最易互相 作用,在化学反应过程中起着极其重要作用。
