第五章新药研制与开发NewDrugResearchandDevelopment
新药的研发概论演示文稿

确定了所研究的靶分子后,对靶 分子的结构、配基的结合部位、 结合强度以及所产生的功能等所 进行的研究。通过研究要弄清楚 酶或受体和配基结合后产生功能 的强度和持续时间以及激动剂和 拮抗剂之间的活性差别。
先导化合物的寻找和发现
在对靶分子研究和认识的基础上开展的工作。在选定靶分子后, 接着要寻找对靶分子有较高亲和力、能产生较高活性和选择性的 先导化合或生理影响能力;而选择性表示配基识别所作用,靶分 子,而不喝其他分子产生相互作用的能力。
第二节 新药研究与开发的过程和方法 (Process and Methods of New Drug Research and Development)
现代新药开发,一条漫长的通路
临床数据 分析
注册
充分研究
100-300患 者研究(II期) 候选药物测试30010,000患者 (III期) 候选化 合物
O
NH2
NH
Cl
O
COCl
R Cl O NHFmoc
FmocHN
一、药物发现的过程(Process of Drug Discovery)
● 新药的研究实际是新药发现的过程; ● 在确定了所针对疾病的类型或药物作用受体以后,需要进行先导 化合物的确定和优化; ● 在确定了所针对疾病的类型或药物作用受体以后,需要进行先导 化合物的确定和优化;
● 简单地说,就是发现具有特定治疗作用的新化学实体,将其作为 候选药物进行进一步研究。
对于受体来讲,当一个配体与之相结合发生作用时,可能表现为 激动剂或拮抗剂,但有时也会表现为部分激动剂,这些对新药现 在来讲都是非常重要的。
先导化合物的优化 在确定先导化合物后所展开的进一步研究。对于先导化合物,不 仅要求其具有亲和性、一定的活性和选择性,还应该具有较好的 生物利用度、化学稳定性以及对代谢的稳定性。影响这些特性的 是化合物内在的理化性质。开展对先导化合物的结构优化,目的 是为了获得药效最佳、副作用最少的新化学实体。
新型药物的研究和开发

新型药物的研究和开发一、引言随着科技的不断进步,新型药物研究和开发正成为医药行业的重要领域。
目前,全球新药开发正面临着许多挑战,如新药研究周期长、开发成本高、临床试验难度大等问题。
为了解决这些问题,医药企业不断推陈出新,探寻新的药物研究和开发方法,并借助大数据、先进的技术手段和创新的治疗方法来提高新药开发效率和研究质量。
二、新型药物的定义和分类1. 新型药物的定义新型药物是指在药物研究开发过程中采用了新的化学结构、新的药理作用机制或新的剂型或新的适应症,以及已上市药物的改进品种。
新型药物具有更好的疗效、更少的不良反应和更好的安全性。
2. 新型药物的分类按照疾病分类:治疗心血管疾病、肿瘤、代谢疾病、神经系统疾病、感染和免疫性疾病等。
按照研发状态分类:临床前研究、临床I、II、III期研究、注册申请和上市后监测。
按照技术分类:基因工程药物、细胞治疗药物、抗体药物等。
三、新型药物研究流程新型药物研究流程分为临床前研究、临床试验和上市申请三个阶段。
1. 临床前研究临床前研究是新型药物研究的第一步,包括发现药物、药理学和安全性评价、药物代谢动力学和毒理学研究等。
临床前研究是为后续的临床试验提供科学依据的重要环节。
2. 临床试验临床试验是新型药物研究的核心环节,主要包括药物安全性、疗效和药代动力学研究。
临床试验分为I、II、III期研究和申报注册,其中I期研究主要评价药物的安全性和耐受性,II期和III期研究则主要评价药物的疗效和安全性。
完成临床试验的药物进入申报注册,交给药监部门进行评审。
3. 上市申请药物获得上市批准后,进入上市推广阶段。
上市后的药物需要进行长期的监测和临床研究,以确定药物的使用安全性和效果。
四、新型药物研究和开发面临的挑战1. 研发周期长新型药物研究和开发周期长达10年以上,其间的成本和风险巨大,为了降低成本和风险,研究人员不断探索新的研究方法和技术手段。
2. 公司品管制度不严格研发中需要频繁试验,如果公司品管制度不严格,就很容易发生不及时发现问题导致延迟交付。
新药研制与开发PPT课件

高通量筛选
虚拟筛选
02
03
组合化学
利用高通量技术从大量化合物库 中筛选出具有活性的先导化合物。
基于计算机模拟技术预测化合物 与靶点的相互作用,提高筛选效 率。
通过化学合成方法制备具有结构 多样性的化合物库,增加发现机 会。
候选药物优化策略
结构优化
01
通过化学修饰、构效关系分析等手段提高候选药物的活性及选
新药分类
中药、天然药物注册分类,化学 药品注册分类,生物制品注册分 类。
国内外新药研发现状
国内新药研发现状
近年来我国新药研发虽取得显著进展 ,但创新能力仍显不足,药品研发低 水平重复现象比较严重,存在“多、 小、散、乱”的状况。
国外新药研发现状
发达国家由于药品研发基础好、技术 先进,在新药研发领域处于领先地位 ,其研发的新药数量和质量都远高于 我国。
保密技术运用
采用加密技术、访问控制技术等手段, 确保商业秘密不被泄露。
泄密应急处理
制定泄密应急预案,及时采取补救措 施,降低损失。
市场推广策略制定
市场调研
产品定位
了解目标市场、竞争对手、客户需求等信 息,为制定推广策略提供依据。
根据产品特点和市场需求,明确产品的目 标用户和市场定位。
推广渠道选择
营销策略制定
辅料选择
选择适宜的辅料,提高制剂的稳 定性和生物利用度,同时降低不 良反应的发生。
处方优化
通过对比实验和数据分析,对制 剂处方进行优化,提高产品质量 和生产效率。
质量标准建立及稳定性考察
1 2
质量标准制定
根据药物的性质和临床需求,制定合理的质量标 准,包括鉴别、检查、含量测定等项目。
新药研究开发新药研究过程课件
新
任务:药物的主要药效学、一般药理学、药物代谢
药
研 动力学研究,以阐明药物作用的靶器官、主要药物作
究 开
用特征、对机体重要系统(神经、心血管、呼吸系统)
发 的影响,并研究机体对受试药物的处置规律。
—
新
新药毒理学研究包括全身性用药的毒性试验、局
药 研
部用药的毒性试验、特殊毒性试验和药物依赖性试验
究 等。 过
开 室内进行。
发
—
1、药学研究:化学原料药要确证药物的化学结构;
研 究
多组分药物,确定其主要药效成分的结构。在此基础
过 程
上研究:制备工艺、制剂处方、药物理化常数、纯度
检查、含量测定、质量稳定性研究。
新药研究开发新药研究过程
7
New Drug Research and Development
2、临床前药理学与毒理学评价
程
目的:是保证临床用药的安全有效。
新药研究开发新药研究过程
8
New Drug Research and Development
一般毒性试验
新
(1) 急性毒性试验 :动物一次经口接受单剂量或24h内接受多次
药 研
剂量受试物,动物在短期内出现毒性反应的试验。LD50
究
(2) 重复给药毒性试验(长期毒性试验): 血液学、生化学、组
基本要求:安全,有效、可控和稳定,其中有效性或疗效确切 是新药治病救人的首要条件。
开 新药有效性评价方法:实验部分(药效学试验)和临床部分
发 重要性和局限性:
—
新 药
A. 发现研制新药及对药物进行再评价; B. 为新药的临床研究奠定基础;
研
C. 补充临床研究的不足;
drug research and development

流动化学合成
流动化学又被称为微化学或连续流动化学, 他的出现为化学研究和发 展提供了一个崭新的,高产的并且快速的手段. 由于采用的是微米尺寸的混合器, 流动化学合成是非常理想的纳米颗 粒合成技术. 流动化学合成的优势: 系统具有对反应条件优异的控制功能.如时间,温度,试剂,混合等条件进 行控制.并且使一些放热反应在无冷却的条件下进行. 增加反应速度:提高系统的压力(300 psi)和加热可以使反应速度比回流 反应快几百倍. 可以达到微波的反应速度, 但又克服了微波反应的放大问题. 合成和分析同时进行: 反应通过取样器和稀释器快速流动到HPLC进行 检测. 自动化:反应和分析通过软件来自动控制进行。
生物反应器
更为实用的是生物反应器。如我国科学家提出的乳腺反应 器。 最近,核糖体人工合成又告成功。 “信使RNA”把DNA的遗传指令传输给细胞的核糖体,核 糖体根据指示,制造出符合要求的蛋白质。哈佛大学医学 院的遗传学教授乔治· 丘奇带领的科研组并不是寻找在试 管里制造生命的方法,而是寻找在实验室器皿里制造设计 蛋白(designer protein)的方法。他说:“如果你要制造一 种跟现在的生命一样的合成生命,那么你必须获得这种生 物机器(biological machine)。”而且这项发现还具有非 常重要的工业应用价值,尤其是制药业和制造自然界没有 的蛋白质的产业。
迭代结构活性关系检测示意图。假说驱动的新药 研究通常是根据这一周期性模式来执行的。
筛选
筛选模型 筛选机器人 筛选的效率并不高。 最近桑迪亚仅仅用了2.5年他们就得到了4 个(可能是6个 )候选化合物。相比一般的 筛选手段,研究效率和结果是提高了10倍。
以基因为靶标筛选药物,各阶段的筛选结果以几何级数的形式递减。
制药工程_专业英语_Unit_5

2、研发计划 对候选药物是否有可能提供有竞争力的优势方面的评估,首先
需要强调的是应达到一整套的产品目标或目标产品的特性。应当 特别注意竞争者(指药物)之间的差异。随着对有限的处方、医 疗保健费用以及药品经济学的日益关注,这种情况变得越来越重 要(本章稍后讨论)。
A target profile will define the indication(s) that a drug candidate will be develope d for along with goals such as once a day dosing,faster onset of action, better side effect profile than a major competitor. The target profile can be refined and revised as a drug candidate moves through development and new data on the drug candidate or competitors become available. The logical next steps are to defin e the development strategy,for example,which indications to develop first which countries to aim to market the drug in and then to define the core clinical st udies necessary to achieve regulatory approval and commercial success.
新药研究开发—新药研究过程教材

过 上研究:制备工艺、制剂处方、药物理化常数、纯度 程
检查、含量测定、质量稳定性研究。
New Drug Research and Development
2、临床前药理学与毒理学评价
新
任务:药物的主要药效学、一般药理学、药物代谢
药
研 动力学研究,以阐明药物作用的靶器官、主要药物作
究 开
用特征、对机体重要系统(神经、心血管、呼吸系统)
药 研
2、Ⅱ期(phase Ⅱ ):是随机盲法对照临床试验。对
究 新药有效性及安全性作出初步评价,推荐临床给药剂 开 发 量。
—
新 3、Ⅲ期(phase Ⅲ ):是扩大的多中心临床试验。应
药 遵循随机对照原则,进一步评价有效性、安全性。
研 究
4、Ⅳ期(phase Ⅳ ):是新药上市后监测。注意罕见
过 不良反应。
研 究
用三种剂量做药物浓度-时间曲线。明确是否有
开
线性关系。
发
—
(2)提供初步数学模型及吸收速率常数、消除速率
新 药
常数、Cmax、Tmax、清除率、t 1/2 等参数。
研 究
(3)测定血浆蛋白结合率;
过
程
(4)分布试验至少测定心、肝、脾、肺、肾、脑、 胃肠道、生殖腺、体脂、骨骼肌等组织中的 分布。
近年来也出现了基因水平的药物筛选模型,使药物筛选的范
围更加广泛。
New Drug Research and Development
HTS筛选的基本步骤
第一步是选择分子靶。选择的依据是来源于国际上
新 医学生物学的新成果。目前国际常用的分子靶有以下
药 几类:A、细胞膜受体;B、离子通道蛋白;C、酶蛋
新药研究与开发范文

新药研究与开发范文新药的研究与开发是医药行业的重要环节,也是推动医药行业发展的关键因素之一、新药的研发涉及到多个领域,需要投入大量的资源和精力。
本文将从新药研究的意义、新药研发的步骤和挑战等方面进行探讨。
新药的研究与开发对于医药行业的发展有着重要的意义。
首先,新药的研发可以满足人们不断增长的医疗需求。
随着人口的增长和老龄化程度的提高,人们对于治疗疾病的需求也越来越迫切。
新药的研发可以开发出更加高效、低毒、低副作用的药物,提高疾病的治愈率和生存质量。
其次,新药的研发也是医药行业持续发展的重要保障。
医药行业是一个高风险、高回报的行业,需要不断推陈出新以应对市场的竞争。
只有不断推动新药的研发,不断提高药物的疗效和安全性,才能在激烈的市场竞争中立于不败之地。
新药的研发通常包括以下步骤:药物发现、药物开发、临床试验和上市许可。
药物发现是新药研究的起点,主要通过药物筛选、分离和鉴定来寻找具有潜在药物活性的物质。
药物开发是指将具备潜力的化合物进行药理学、药代动力学等相关实验,确定适合的剂型和给药途径。
临床试验是新药研发的重要环节,分为三期试验,分别是安全性和耐受性试验、疗效和安全性试验、安全性和有效性试验。
上市许可是指通过国家相关部门的审查,获得将新药上市销售的许可。
新药研发过程中的主要挑战包括科学技术的限制和研发成本的问题。
首先,新药的研发需要借助先进的科学技术手段,但目前科学技术的限制仍然存在。
例如,一些疾病的病因和发病机制尚不清楚,给新药的研发带来了困难。
其次,新药的研发成本很高。
数据显示,一款新药的研发投入可达数亿美元,而只有少数新药能够赚回研发成本。
这给企业带来了巨大的经济压力,也阻碍了新药的研发进程。
为了克服新药研发中的挑战,各方应共同努力。
政府应加大对新药研发的支持,提供资金和政策支持。
同时,加强科学研究和创新能力的培养,推动科学技术的发展,提高科研人员的水平,以提高新药研发的成功率和效率。
企业应加大研发投入,建立完善的管理机制,加强国际合作,降低研发成本,并提高新药的创新性和竞争力。
5单元 药物研发

Unit 5 Drug Development药物研发1、简介药品开发是一个非常复杂的过程,需要一个协调和沟通不同功能之间的群体广泛很大。
它是昂贵的,特别是在临床开发的后期阶段,在研究涉及的数百名病人。
据估计,目前约2.3亿美元(1987美元)的新药开发成本,并采取介于7和10多年的临床前开发阶段开始,首先市场(不包括监管滞后)。
药物开发是一项高风险业务,虽然利率不断上升,大约只有每十个新的化学研究在人类首次实体开展会不会成为一个产品。
作为候选药物的进步,通过发展'的失败降低风险hurdles'are克服前进的道路上。
失败的典型原因包括不可接受的毒性,缺乏有效性,或不能提供比其他竞争产品的优点(图1)损耗率的新化学实体(竞争性考试的)进入发展。
平均只有约400 1000我在化合物合成进入发展。
原因的罗富国教育学院的发展终止(不包括抗感染药)1:缺乏疗效2:药代动力学3:动物毒性4:杂项5:在人的不良影响6:商业上的原因图1磨损率和终止的原因2、发展规划候选药物是否有可能提供有竞争力优势的评估首先需要强调的地方有一个产品'的目标,目标产品或配置文件集。
应特别注意支付给竞争者形成差异。
这已成为55个,并与有限的处方,医疗费用,以及药物经济学(本章稍后讨论)日益重视更为关键。
配置文件将确定一个目标指示(县),将候选药物开发以及诸如每日一次给药的目标,起效更快的行动,更好地侧比主要竞争对手效应特征。
目标配置文件可以通过完善和发展为移动和候选药物的候选药物或竞争对手成为可用的新数据修改。
合乎逻辑的下一个步骤是确定发展战略,例如,有适应症先发展,哪些国家向市场为目标的药物,然后确定要达到的核心监管机构的批准和商业成功的临床研究。
本章将描述一个成功的新药开发所需的主要活动。
所有这些活动,其中许多是相互依存,需要认真规划和协调。
速度与高品质的数据收集到的市场是成功的关键。
该活动确定的时间会去登记被称为项目管理方面,关键路径,路径。
《新药研制与开发》课件

目录
• 新药研制概述 • 新药发现与靶点验证 • 临床前研究与药学研究 • 新药临床试验与审批上市 • 新药上市后的监测与评价
01
新药研制概述
新药的定义与分类
总结词
明确新药的定义,了解新药的分类标 准。
详细描述
新药是指未被批准上市的药物,包括 创新药物和改良型药物。根据新药的 来源和特点,可以分为化学药、生物 药和中成药等不同类型。
试验提供科学依据。
药学研究还需要进行药物制剂的工艺验证和质量控制 ,以确保药物制剂的稳定性和一致性。
药学研究是新药研制过程中的重要阶段,主要 涉及药物的理化性质、药效学、药代动力学等 方面的研究。
药学研究需要综合考虑药物的稳定性、安全性和 有效性,以确保药物在临床应用中的安全性和有 效性。
药效学研究
药代动力学研究还需要进行药 物相互作用的研究,以了解药 物与其他药物或食物相互作用 的可能性。
04
新药临床试验与审批上市
Ⅰ期临床试验
总结词
初步安全性评估
总结词
小规模试验
详细描述
Ⅰ期临床试验是新药研发的早期阶段,主要目的是评估新 药在人体中的安全性和耐受性,确定药物的有效剂量范围 ,以及初步探索药物的治疗效果。
药物体外活性评价
细胞模型
建立靶点相关的细胞模型,模拟药物作用环境,评估候选药物在细胞水平上的活性。
药效学评价
通过药效学实验,如细胞增殖、凋亡、信号转导等实验,对候选药物的疗效和作用机制进行评估。
03
临床前研究与药学研究
药学研究
药学研究的目标是确定药物的剂型、给药途径 、制备工艺和质量控制标准等,为后续的临床
据。
药物经济学评价
新药物研究与开发

新药物研究与开发近年来,医学领域的快速发展对新药物研究与开发提出了更高的要求。
新药物的研发是一项极其复杂的过程,需要经过多个阶段,从实验室的试验中逐渐走向临床实验,再到上市,整个过程需要耗费大量的时间和资源。
但是,对于患者和医疗行业来说,成功开发出新药物将意味着更好的疾病预防、治疗和康复。
新药物研究的第一阶段是药物发现。
在这一阶段中,药物研究人员需要探索新的生物分子,寻找可以治疗各种疾病的化合物。
有许多不同的方法可以用于药物发现,其中最常见的是高通量筛选技术。
这种技术利用计算机控制的仪器,可以快速测试成千上万种化合物的反应,以寻找能够作用于特定生物分子的化合物。
此外,还可以使用计算机模拟技术进行药物发现,该技术可以预测新的化合物是否具有治疗潜力。
这些方法的主要目的是发现安全、有效且有潜力的药物。
一旦新的化合物被发现,就需要对其进行评估。
这个过程被称为药物优化,其目的是进一步改进化合物的特性。
药物优化可以通过结构改变,调整剂量和优化药物制剂来实现。
以癌症为例,药物优化可以降低其毒性,同时提高其对癌症细胞的选择性。
药物优化需要耗费大量的时间和资源,并需要进行多次实验室测试和临床试验,以确定药物对人体的效果和安全性。
一旦药物经过了临床试验,并证明具有治疗潜力,就需要通过严格的监管程序进行审批和上市。
对于新药物的审批和上市,各国有着不同的程序和标准。
在美国,FDA(美国食品和药品监督管理局)是负责药物审批的主要机构。
FDA的审批程序包括多个阶段,从药物的安全性和有效性评估开始,到最终的临床试验结果分析,最终确定药物是否能够上市。
相比之下,在亚洲,中国药监局和日本厚生劳动省负责药物审批。
这些机构都需要类似的临床试验数据,以评估药物的安全性和有效性。
新药物研究的投资和风险通常都很高。
为了提高成功率,许多公司使用定向药物开发策略,这种策略允许公司开发能够高度专注于特定疾病的药物。
通过利用新的研究方法和技术,这些公司可以最小化药物开发的风险,并使其更快地逐步来到市场。
新药理5新药药效学-新药研究与开发PPT课件

新药研发的风险与投资
01
02
03
04
风险评估与管理
对新药研发过程中可能 出现的风险进行评估和 管理,降低风险对项目 的影响。
投资回报分析
对新药研发项目的投资 回报进行评估,确保项 目的经济可行性。
融资渠道
为新药研发项目提供多 元化的融资渠道,包括 政府资助、企业自筹、 风险投资等。
合作与联盟
通过与其他企业和研究 机构的合作与联盟,共 同分担新药研发的风险 和成本,提高项目的成 功率。
05
新药的药效学研究展望
新药药效学研究的未来发展方向
精准医疗
随着基因组学、蛋白质组学和代 谢组学等研究的深入,新药药效 学研究将更加精准,针对特定基 因型或表型的患者进行个性化治 疗。
免疫疗法
免疫疗法是新药研发的重要方向, 通过调节人体免疫系统来治疗疾 病,具有广阔的应用前景。
数据分析
对实验数据进行统计分析,运用统计学方法对实验结果进行科学评估。数 据分析应包括数据的描述性统计、方差分析、回归分析等方法的应用。
结果解读
根据数据分析结果,结合实验目的和评价指标,对药物的药效 进行评价和解读,为药物的进一步研究和开发提供科学依据。
04
新药的研发过程与管理
新药研发的流程与阶段
新药理5新药药效学新药研究与开发ppt课件 Nhomakorabea目录
• 新药药效学概述 • 新药的发现与筛选 • 新药的药效学评价 • 新药的研发过程与管理 • 新药的药效学研究展望
01
新药药效学概述
新药药效学的定义与重要性
定义
新药药效学是新药研究与开发过程中, 对药物作用机制、药效特性以及药物 与机体相互作用的研究。
新药研究与新型药物开发

新药研究与新型药物开发科技的发展与人类的健康息息相关。
药品的研究与开发一直是医学领域发展的核心之一。
随着人类社会的进步和医学技术的发展,新药的研究与新型药物的开发也越来越引起人们的重视。
一、新药研究的意义新药研究是提高人口健康水平的重要手段。
它可以解决目前现有药品治疗不足或无法治疗的疾病,寻找对人体有益的化学物质。
由于疾病的类型和症状各异,新药研究的难度也不同。
因此,在进行新药研究的过程中,有必要进行充分的试验和研究,这需要大量的时间和资金投入。
二、新药研究的流程新药的研究和开发工作是一个复杂的过程,需要经历多个阶段。
一般来说,新药的研究流程可以分为以下几个阶段:1. 发现和探索阶段在这个阶段中,科学家需要从各种来源中寻找具有潜在药效的化合物。
这可能需要在数以千计的化合物中进行筛选,以找到最有前途的化合物。
科学家必须评估这些化合物是否具有治疗作用,并评估它们对人体的毒性、药代动力学和药物相互作用等方面的影响。
2. 预临床试验阶段在这个阶段中,科学家需要对新化合物进行更深入的研究和验证,以确定其在治疗上的潜力和用途。
在这个阶段中进行的试验包括仪器测试、体内实验和体外实验。
这可以帮助确定新化合物的剂量和最佳用途,同时确定该化合物是否安全、可行和具有反复的治疗效果。
3. 临床试验阶段在预临床试验阶段取得了积极的结果后,必须开始临床试验。
这是一种包括人类患者的试验,以确定新药对人体的影响。
这个阶段包括三个阶段的临床试验,分别是:第Ⅰ期试验:了解化合物在人体内的安全性和剂量;第Ⅱ期试验:评估化合物的有效性和治疗效果,并确定最佳剂量和用法;第Ⅲ期试验:根据丰富的回溯性数据严格证明药物的效力、安全性和特效性,并提供大量证据以支持其上市授权。
新药的临床试验需要进行大规模的人体研究,可能需要花费数年时间,因此需要充分的资金和人力资源。
4. 上市审批阶段在临床试验完成并提交审批申请后,药品监管机构将进行审核并决定该化合物是否可以在市场上销售。
新药研制与开发

也应视为药品不良反应。
与药品应用有因果关系的反应,
定时,所有的有害而非期望的、
临床试验中,如治疗剂量尚未确
在一种新药或药品新用途的
D
C
B
A
E
不良事件(adverse event):
01
一定与治疗有因果关系。
04
病人或临床试验受试者接受一种药
02
品后出现的不良医学事件,但并不
03
严重不良事件
(serious adverse event):
1)急性毒性试验
*
水溶性好的一、二类新药应测定
01
二种给药途径的LD50。给药后至少
02
观察7天,记录动物毒性反应情况、
03
体重变化及动物死亡时间分布。对
04
死亡动物应及时进行肉眼尸检,当
05
尸检发现病变时应对该组织进行镜
06
检。
07
2)最大给药量试验
如因受试药物的浓度或体积限制,
无法测出半数致死量(LD50)时,可
进行临床研究应具备的条件
*
临床试验(Clinical Trials) 生物等效性试验 (Bio-equivalent Study) 新药临床实验 Clinical Study of New Drugs
临床试验分期 Clinical trials
Байду номын сангаас
II期
IV期
I 期
III期
I期临床试验
为初步的临床药理学及人体安全性评价试验,主要观察人体对新药的耐受性(tolerance)和药动学规律,为制定给药方案提供依据。
04
特殊毒性实验(Special Test) 致癌实验(Carcinogenesis test) genetic mutation 致突变实验(Mutagenesis test) cancer induction 致畸癌实验(Teratogenesis test) congenitally deformed baby or congenital malformation Drug dependence Test: addiction
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
China Medical University Wang Huai-Liang Ph.D.
1
第一节 新药的概念和分类 Concept of New Drugs 新药( new drug )指我国未生产 过的药品。已生产的药品改变剂型、 改变给药途径、增加新的适应证或 制成新的复方制剂,亦按新药管理。 国家鼓励研究创制新药。
按国家《新药审批办法》规定分类:
中药(传统药,天然药物)
(traditional Chinese medicine)
化学药品(西药、现代药) (western drug、chemicals) 生物制品(biologicals)
7
(一)中药、天然药物分类 1、未在国内上市销售的从中药、天然 药物中提取的有效成份及其制剂。 2、未在国内上市销售的来源于植物、 动物、矿物等药用物质制成的制剂。 3、中药材的代用品。 4、未在国内上市销售的中药材新的药 用部位制成的制剂。
8
5、未在国内上市销售的从中药、天然
药由中药、天然 药物制成的复方制剂。 7、未在国内上市销售的由中药、天然 药物制成的注射剂。
9
8、改变国内已上市销售药品给药途 径的制剂。 9、改变国内已上市销售药品剂型的 制剂。 10、改变国内已上市销售药品工艺的 制剂。 11、已有国家标准的中成药和天然药 物制剂。
18
其实,世上最温暖的语言,“ 不是我爱你,而是在一起。” 所以懂得才是最美的相遇!只有彼此以诚相待,彼此尊重 ,相互包容,相互懂得,才能走的更远。 相遇是缘,相守是爱。缘是多么的妙不可言,而懂得又是多么的难能可贵。否则就会错过一时,错过一世! 择一人深爱,陪一人到老。一路相扶相持,一路心手相牵,一路笑对风雨。在平凡的世界,不求爱的轰轰烈烈;不求誓 言多么美丽;唯愿简单的相处,真心地付出,平淡地相守,才不负最美的人生;不负善良的自己。 人海茫茫,不求人人都能刻骨铭心,但求对人对己问心无愧,无怨无悔足矣。大千世界,与万千人中遇见,只是相识的 开始,只有彼此真心付出,以心交心,以情换情,相知相惜,才能相伴美好的一生,一路同行。 然而,生活不仅是诗和远方,更要面对现实。如果曾经的拥有,不能天长地久,那么就要学会华丽地转身,学会忘记。 忘记该忘记的人,忘记该忘记的事儿,忘记苦乐年华的悲喜交集。 人有悲欢离合,月有阴晴圆缺。对于离开的人,不必折磨自己脆弱的生命,虚度了美好的朝夕;不必让心灵痛苦不堪, 弄丢了快乐的自己。擦汗眼泪,告诉自己,日子还得继续,谁都不是谁的唯一,相信最美的风景一直在路上。 人生,就是一场修行。你路过我,我忘记你;你有情,他无意。谁都希望在正确的时间遇见对的人,然而事与愿违时, 你越渴望的东西,也许越是无情无义地弃你而去。所以美好的愿望,就会像肥皂泡一样破灭,只能在错误的时间遇到错的人 。 岁月匆匆像一阵风,有多少故事留下感动。愿曾经的相遇,无论是锦上添花,还是追悔莫及;无论是青涩年华的懵懂赏 识,还是成长岁月无法躲避的经历……愿曾经的过往,依然如花芬芳四溢,永远无悔岁月赐予的美好相遇。 其实,人生之路的每一段相遇,都是一笔财富,尤其亲情、友情和爱情。在漫长的旅途上,他们都会丰富你的生命,使 你的生命更充实,更真实;丰盈你的内心,使你的内心更慈悲,更善良。所以生活的美好,缘于一颗善良的心,愿我们都能 善待自己和他人。 一路走来,愿相亲相爱的人,相濡以沫,同甘共苦,百年好合。愿有情有意的人,不离不弃,相惜相守,共度人生的每 一个朝夕……直到老得哪也去不了,依然是彼此手心里的宝,感恩一路有你!
4
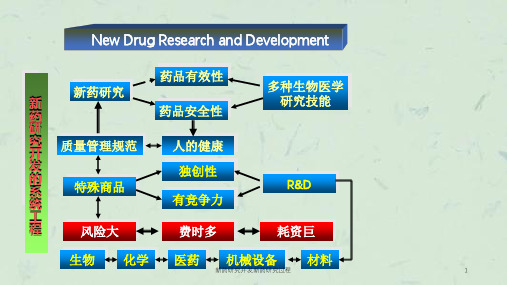
新药研制过程和周期 药品是特殊商品,除了具有商品价 值外还于公众的健康乃至生命紧密联 系在一起,普遍消费者难以识别,因 此把握药品的特性,保障公众用药的 安全有效至关重要。 新药研制,尤其创新药研制是创造 性劳动,从发现新化合物新活性开始 的创新药物研究具有高投入、长周期、 高风险、高回报特点。
2
我国新药研究现状
㈠ 国内外比较,我国属第二世界
㈡ 国内研究现状: 新药不新,新药研究主要仍以仿制国 外已上市产品为主。这种现象是我国 现阶段医药市场现状的客观反映。
3
2. 新药研制重规范,轻创造性 国家制定的法规与规章是对于普遍 性问题的规范,新药研制应在对其精神 实质实质领悟的基础上结合自己研制项 目特点创造性地进行研究。而非“作业” 式的僵化执行。 因此,创新意识是必须高度关注的 问题,创新是新药研究的灵魂,此外, 存在重复申报,盲目追求效益等。
感谢您对文章的阅读跟下载,希望本 篇文章能帮助到您,建议您下载后自 己先查看一遍,把用不上的部分页面 删掉哦,当然包括最后一页,最后祝 您生活愉快!
5
国外资料,一种新药从申请专利 到产品上市通常需8—12年。 我国,两阶段模式,即临床审批 和生产上市审批。 药审中心的技术审评一般需180天, 对补充资料审评工作时间是120天,对 创新药和一些急需药品采取加快程序, 工作时间是45天和75天。
6
新药的分类
Classification of New Drugs
但不改变给药途径的制剂。 6、已有国家药品标准的原料药或者 制剂。
14
三、生物制品
生物制品是应用普通的或以基因
工程、细胞工程、蛋白质工程、发酵
工程等生物技术获得的微生物、细胞 及各种动物和人源的组织和液体等生 物材料制备,用于人类疾病预防、治 疗和诊断的药品。
15
新生物制品系指我国未批准上市 的生物制品;已批准上市的生物制 品,当改换制备疫苗和生物技术产 品的菌毒种、细胞株及其他重大生 产工艺改革,对制品的安全性、有 效性可能有显著影响时按新生物制 品审批。
10
(二)化学药品注册分类 1、未在国内外上市销售的药品: (1)通过合成或者半合成的方法制得 的原料药及其制剂; (2)天然物质中提取或者通过发酵提 取的新的有效单体及其制剂;
11
(3)用拆分或者合成等方法制得的已 知药物中的光学异构体及其制剂; (4)由已上市销售的多组份药物制备 为较少组份的药物; (5)新的复方制剂。 2、改变给药途径且尚未在国内外上 市销售的制剂。
12
3、已在国外上市销售但尚未在国内上 市销售的药品: (1)已在国外上市销售的原料药及 其制剂; (2)已在国外上市销售的复方制剂; (3)改变给药途径并已在国外上市 销售的制剂。
13
4、改变已上市销售盐类药物的酸根、
碱基(或者金属元素),但不改
变其药理作用的原料药及其制剂。
5、改变国内已上市销售药品的剂型,
16
新生物制品实行国家一级审批制度, 大致分五类
第一类:国内外尚未批准上市的生物制品。
第二类:国外已批准上市,尚未列入药典
或规程,我国也未进口的生物制品。
第三类:疗效以生物制品为主的新复方制剂。
第四类:改变剂型或给药途径的生物制品。
第五类:增加适应证的生物制品。
17
新药研究基本要求
⒈ 试验主要负责人和研究队伍。 ⒉ 受试药物应处方固定、制备工艺及 质量基本稳定。 ⒊ 从事新药安全性研究的实验室应符合 《药品非临床研究质量管理规范》 (Good Clinical Practice, GLP) 的要求。
