酵母菌BIOLOG 96孔板介绍 2
微生物鉴定仪法国

竭诚为您提供优质文档/双击可除微生物鉴定仪法国篇一:biolog微生物鉴定仪biolog微生物鉴定仪产地;美国biolog公司型号:eLx808bLg主要附件:浊度仪、微孔板、接种液biolog微生物鉴定系统测试的是微生物在鉴定板中利用或氧化化和物的能力。
测试会产生特征性的紫色孔模式,组成代谢指纹。
鉴定步骤如下:纯化分离到的菌株经扩大培养,再制成接种液加到鉴定板中。
在培养过程中,一些孔中的化学物质能被氧化并将显色物质成紫色,对照孔(A-1)和阴性孔仍然为无色。
鉴定板在相应的培养条件下培养4-6小时或16-24小时即可形成代谢模式。
系统软件自动和数据库对比,得出一个鉴定结果。
biolog鉴定板分五种类型,分别是革兰氏阴性鉴定板(gn2)、革兰氏阳性鉴定板(gp2)、厌氧菌鉴定板(An)、酵母鉴定板(YT)和丝状真菌鉴定板(FF)。
鉴定微生物时应使用相应的鉴定板。
技术指标(主要功能)1)革兰氏阴性、阳性细菌、酵母、丝状真菌的鉴定。
以微孔板(microplates)作为载体,每个微孔板一般均包含96个微孔,除了对照孔其他孔中均有一种碳源和四唑燃料,微生物接种到微孔中后,如果微生物利用孔中的碳源发生氧化还原反应使燃料变色,通过对透光率(细菌)或是浑浊度(真菌)进行检测,就可以分析细菌或真菌利用碳源的程度.简单的说,是利用微生物对不同碳源的利用程度,鉴定微生物的种类。
2)微生物群落功能多样性研究。
以群落水平碳源利用类型为基础的biolog氧化还原技术来表述土壤样品微生物群落特征,运用主成分分析(pcA)或相似类型的多变量统计分析方法展示不同微生物群落产生的不同代谢多样性类型。
其理论依据是:bIoLog代谢多样性类型的变化与群落组成的变化相关。
篇二:VITeK2-compct全自动微生物鉴定仪维护保养规程VITeK?2-compact全自动微生物鉴定仪维护保养标准操作规程目的建立维护保养规程,保证菌种鉴定结果的可靠性,并延长VITeK?2-compact全自动微生物鉴定仪的使用寿命。
氨基酸菌株的96孔板筛选方法

氨基酸菌株的96孔板筛选方法1.首先需要准备96孔板和氨基酸菌株。
First, you need to prepare a 96-well plate and the strain of amino acid bacteria.2.将96孔板分成不同的组,每组添加不同的氨基酸。
Divide the 96-well plate into different groups and add different amino acids to each group.3.在每个小孔中接种氨基酸菌株。
Inoculate the strain of amino acid bacteria in each well.4.确保每个小孔中的细菌数量相同。
Ensure that the number of bacteria in each well is the same.5.将96孔板放置在培养箱中培养一段时间。
Incubate the 96-well plate in a culture chamber for a period of time.6.观察每个小孔中的细菌生长情况。
Observe the growth of bacteria in each well.7.测定每个小孔中细菌的生长曲线。
Measure the growth curve of bacteria in each well.8.比较不同组之间氨基酸菌株的生长情况。
Compare the growth of amino acid bacteria strains between different groups.9.选择生长良好的氨基酸菌株进行进一步研究。
Select well-growing strains of amino acid bacteria for further research.10.分析不同氨基酸对氨基酸菌株生长的影响。
Analyze the effects of different amino acids on the growth of amino acid bacteria.11.优化氨基酸的组合比例,以提高氨基酸菌株的生长速度。
Biolog使用手册1

Biolog使用手册目录1 启动................ (4)1.1 系统需要................ . (4)1.2 安装软件和数据库 (4)1.3 软件配置................ (4)2 系统介绍................ .. (5)2.1 原理................ (5)2.2 鉴定程序................ . (5)2.3 使用简单的软件 (5)2.4软件背后的数学 (5)2.5 鉴定微生物和管理数据 (6)3 进入系统................ (7)3.1 限制性进入模式....................... (7)3.2 创建使用者列表 (7)3.3 使用记录................ . (7)3.4 改变进入模式 (7)4 准备样品................ (8)4.1 分离一个纯培养物 (8)4.2 革兰氏染色 (8)4.3 Wet Prep................ (8)4.4 定义好氧菌特征 (8)4.5 定义厌氧菌特征 (8)4.6 定义丝状真菌和酵母菌特征 (9)4.7 培养................ (9)4.8 准备接种物................ (9)4.9 革兰氏阳性产芽孢杆菌的处理 (9)4.10 丝状真菌的处理 (9)4.11 接种鉴定板................ (9)4.12 培养鉴定板................ .. (9)4.13 厌氧鉴定板的处理 (10)4.14 丝状真菌的准备 (10)4.15 GN,GP,AN的准备 (10)5 读结果................ (11)5.1 登录................ . (11)5.2 选择人工,读数仪或文件输入模式 (11)5.3 选择打印方法................ (11)5.4 人工读结果................ (11)5.5 用读数仪读结果 (11)5.6 从文件读结果 (11)5.7 设置一个工作表 (11)5.8 设置保存文件................ (11)5.9 使用工作表来读多个平板 (11)5.10 人工调整域值 (11)5.11 选择数据库................ (12)5.12 退出................ .. (12)6 结果解释................ (13)6.1 读结果................ . (13)6.2 评估鉴定结果的准确性 (13)6.3 解释不好的鉴定结果的可能原因.. (13)6.4 种的比较................ . (14)6.5 查找并评估种的信息 (14)6.6 使用真菌的宏观和微观图片 (15)6.7 查看更多的种................ (15)6.8 评估原始OD值 (15)7 数据管理和编辑数据库 (16)7.1 文件备份................ . (16)7.2 文件合并................ . (16)7.3 文件浏览和编辑 (16)7.4 自定义数据文件 (16)7.5 输入/输出ASCII数据 (17)7.6 输出为ACCESS (17)7.7 群落分析 (17)8 技术注解 (19)8.1 材料列表 (19)8.2 培养基和接种液准备 (19)8.3 特殊用途的微孔板 (22)9 经常问到的问题 (23)10 故障处理 (25)10.1 革兰氏染色 (25)10.2 培养微生物 (25)10.3准备接种物 (26)10.4接种微板 (26)10.5培养微板 (26)10.6 读数仪 (27)11 术语表 (28)12 附录 (30)附录1 微孔板的数据统计.附录2 样品准备的流程表附录3 真菌样品准备的流程表附录4 数据库表及特性附录5 结果打印输出的格式附录6 危险病原菌数据库附录7 产品注册表1 启动1.1 系统需要计算机(Windows95,98,2000或NT, 有光驱和软驱),显示器,鼠标,键盘,读数仪,浊度仪,菌落放大灯,八头电动加液器,系统软件。
培养皿培养瓶种类选择及规则尺寸说明

28
8 21 49 55 25 75 19 37.5
5.0
3.0 5.0 10.0 10.0 5.0 15~30 4.0 10.0
7×106
2.0×106 5.2×106 12.2×106 13.7×106 5×106 2×107 3×106 cm旋转培养瓶
78
430167
430293 430599 431110 431112
规格:100mm;高度:20mm;生长面积:55cm2
规格:100mm;高度:20mm;生长面积:55cm2 规格:150mm;高度:25mm;生长面积:148cm2 规格:245mm(方形);高度:25mm;生长面积:500cm2 规格:245mm(方形);高度:25mm;生长面积:500cm2
225cm矩形斜颈透气盖45ml细胞培养选择哪种器皿培养器皿底面积cm加培养液量ml可获细胞量96孔培养板03201101051012孔培养板4520106孔培养板962525104孔培养板28507103020106cm培养皿215052109cm培养皿491001221010cm培养皿551001371025cm塑料培养瓶255051075cm塑料培养瓶75153021025cm玻璃培养瓶1940310100cm玻璃培养瓶375100610250cm玻璃培养瓶781502102500cm旋转培养瓶700100250251024孔板使用方法pll100200l200l即可铺板2h后吸出pll回收pbs冲洗2次晾干备用或不晾干直接用
700
15.0
100~250
2×107
2.5×108
24孔板使用方法
PLL 100-200μl(200μl)即可,铺板2h后,吸出PLL(回收), PBS冲洗2次,晾干备用或不晾干直接用。加培养液量1ml ,注意 调整细胞密度。 25cm2(5ml)→(1:2)50cm2(10ml)——(1:3)75cm2(15ml) 2cm2(1ml)→1/25——1/40总细胞悬液
Biolog微生物鉴定步骤

氧化酶阳性或氧化酶阴性但三糖铁实验为K/K或K/Aw
则该菌株为非肠道菌(GN-NENT)
氧化酶阴性以及三糖铁实验为A/A或K/A
则该菌株为肠道菌(GN-ENT)
如果菌株①需要在巧克力培养基上或需要6.5% CO2培养
②在BUG+B培养基上生长非常差
形成针尖大小的菌落
那么可以认为这些菌是苛生菌(GN-FAS)
非肠道菌 GN-ENT
肠道菌 GN-FAS
苛生菌 GP-COCCUS-ROD杆球菌、GP-COCCUS球菌、GP-ROD杆菌 GP-ROD
(芽孢杆菌) AN
厌氧菌 YT
酵母菌 FF
丝状真菌 扩大培养基 BUG+B BUG+B 巧克力培养基 BUG+B BUG+M+T BUA+B BUY 2%ME 培养温度 30℃ 35-37℃ 35-37℃ 35-37℃ 30℃ 35-37℃ 26℃ 26℃ 培养气体 空气 空气 6.5% CO2 空气或6.5% CO2 空气 无氢气的厌氧环境 空气 空气 接种液类型 GN/GP-IF GN/GP-IF+T GN/GP-IF+T GN/GP-IF+T GN/GP-IF AN-IF 水 FF-IF 接种浊度/
应把鉴定板拿出冰箱
让鉴定板恢复到常温
因为有些菌种(如Neisseria )对温度的快速变化很敏感
6. 仔细校正浊度计
接种菌悬液的浊度应在规定的范围内
7. 鉴定板中包含多种对温度和光照敏感的物质
如果个别孔出现棕黑色
说明碳源已经被降解
有时候
在保质期内或超过保质期不长的时间里
BIOLOG

9、许多Microlog1和Microlog2的用户用自己的酶标仪读数,是否可 行?读出的数据如何处理? 答:用其它酶标仪读出的数据也是吸光度值,但必须通过一定的算 法转换。 也可根据A1孔的读数直接判断阴性或阳性。一般来说吸光度值 小于0.2则判断为阴性,大于0.2则判断为阳性,这是一种粗略的判 断方法,如需准确判断,应采用陈列图方法,确定边界值,将干扰 的反应排除,才能得到较佳的结果。 10、有些用户单独购买微孔鉴定板用于研究,对获得的数据如何进行分析? 答:一般这类用户多用鉴定板做微生物群落分析和营养特性研究,其 接种的菌悬液甚至是混合菌液,如有BIOLOG的软件,可采用Cluster 分析功能模块,对不同试验的结果进行比较。也可用PCA软件(主要化 合物分析)或CLPP软件对数据进行分析,这两种软件由其它公司提供, 可以在网上找到,但需支付一定费用。
5、为什么一定要严格控制接种液的浊度?
答:BIOLOG的鉴定原理与氧含量关系较大,而菌悬液的浓度又决定 了氧的含量,而且其数据库是在一定的菌悬液浓度下建立的,为获得
准确的鉴定结果,务必严格控制接种菌悬液的浊度。
6、BIOLOG的浊度标准品是否与McFarland标准品有无可比性?
答:BIOLOG的浊度标准品与Mcfarlands浊度标准品无可比性,BIOLOG 标准品用于校准接种液的细胞浓度,它关系到鉴定结果的准确性。 7、非肠道菌和肠道菌分别在 30 ℃和35-37 ℃培养,可否用32-33℃ 的培养箱代替二者? 答:微生物有其最佳的培养温度,如果采用上述方法,极可能得不 到好的鉴定结果。 8、手工读数时,如果有些微孔有些颜色,但不明显,如何判断? 答:将颜色不明显的孔与A1孔比较,如明显深于A1孔,则判断为 阳性。或者将其判断为边界值,即在进行数据库比对时不予以考虑。
利用96孔板和酿酒酵母生长圈复合筛选高产管囊酵母

利用96孔板和酿酒酵母生长圈复合筛选高产管囊酵母蔡万华;丁少鹏;叶蕊芳;耿丽云;倪琳;苏阳措【摘要】野生酿酒酵母不能利用木糖作为碳源,但是可以利用乙醇作为碳源和能源.管囊酵母可以利用木糖生产乙醇.酿酒酵母可以利用管囊酵母生产的乙醇作为碳源.本研究将管囊酵母进行紫外诱变后,利用96孔板培养,选取OD值较高的孔进行酿酒酵母生长圈筛选.管囊酵母在木糖(5%)为唯一碳源的YNB培养基上生长并产生乙醇.产生的乙醇越多,指示菌酿酒酵母的生长圈相对越大.利用酿酒酵母生长圈法筛选的正变率为35.22%,筛出1株菌UV171,乙醇产量为10.7 g/L,比对照高25.9%,对菌株UV171进行稳定性实验,传至3代其产量稳定.【期刊名称】《酿酒科技》【年(卷),期】2011(000)004【总页数】3页(P36-38)【关键词】微生物;管囊酵母;96孔板培养;酿酒酵母生长圈;木糖乙醇发酵【作者】蔡万华;丁少鹏;叶蕊芳;耿丽云;倪琳;苏阳措【作者单位】华东理工大学生物反应器国家重点实验室,上海,200237;华东理工大学生物反应器国家重点实验室,上海,200237;华东理工大学生物反应器国家重点实验室,上海,200237;华东理工大学生物反应器国家重点实验室,上海,200237;华东理工大学生物反应器国家重点实验室,上海,200237;华东理工大学生物反应器国家重点实验室,上海,200237【正文语种】中文【中图分类】Q93-3;TS261.1由于化石燃料的不可再生性、短缺性以及污染性,作为生物燃料的乙醇的研究逐步显得重要。
在纤维素水解液中,木糖约占了单糖的30%。
如果将水解液里面的木糖充分利用,那么木质纤维素乙醇生产的成本将会降低约20%[1]。
因此,得到高效利用木糖产乙醇的菌株变得尤为重要。
目前发酵木糖产乙醇的微生物主要有基因工程菌和天然微生物两种。
一般后者代谢木糖产乙醇的效率较前者低[3]。
但天然微生物的稳定性有利于提高工艺的可靠性,本文采用了96孔板方法,结合酿酒酵母生长圈法对管囊酵母紫外诱变后的突变株进行定向筛选,并研究了酿酒酵母生长圈和管囊酵母菌落两者直径的比值i(ds/dp)与管囊酵母乙醇生产能力的关系。
酵母菌表面展示实验步骤与注意事项

酵母菌表面展示实验步骤与注意事项酵母菌表面展示实验是一种常用的生物学实验技术,通过将外源蛋白在酵母菌表面展示出来,可以用于研究蛋白质结构和功能,以及开发生物技术应用等领域。
本文将介绍酵母菌表面展示实验的步骤和注意事项。
一、实验步骤:1.菌种培养:首先,需要选择合适的酵母菌菌株进行实验。
常见的菌株有Saccharomyces cerevisiae等。
通过前期的菌种预培养和传代培养,确保菌株的纯度和生长状态。
2.构建表面展示载体:将目标蛋白基因与表面展示载体连接,并将构建好的载体导入酵母菌中。
其中,表面展示载体通常包括信号肽序列、连接序列和表面展示蛋白的表达和定位序列等。
3.表达融合蛋白:在含有表面展示载体的培养基中培养酵母细胞,促使表面展示载体进行表达。
根据不同的实验要求,可以选择不同的培养温度和培养时间。
4.检测表面展示:通过荧光显微镜观察酵母细胞表面展示的融合蛋白,并利用流式细胞术等方法进行定量分析。
根据实验需要,可以选择不同的检测方法,如免疫荧光染色、酶联免疫吸附实验等。
5.功能鉴定:通过酵母菌表面展示蛋白的功能鉴定,来进一步研究目标蛋白的功能和相互作用。
常见的功能鉴定方法包括酵母两杂交实验、亲和纯化、结构分析等。
二、注意事项:1.菌种选择:在实验前,需要根据实验的目的选择合适的酵母菌菌株。
不同的菌株对表面展示载体的表达和定位能力有所差异,需根据实验要求进行选择。
2.载体设计:合理设计表面展示载体的组成和序列,确保目标蛋白的正确表达和定位。
选择适当的载体启动子、信号肽序列和连接序列等,有助于提高表面展示效率和稳定性。
3.培养条件:酵母菌培养需要注意适宜的培养温度、培养基成分和培养时间等因素。
不同的菌株和表面展示载体可能对培养条件有不同的要求,需根据实验材料的要求进行优化。
4.检测方法选择:根据实验需求,选择适合的检测方法进行表面展示效果的检测和分析。
不同的方法有各自的优劣势,需结合实验要求进行选择。
Biolog微生物鉴定步骤
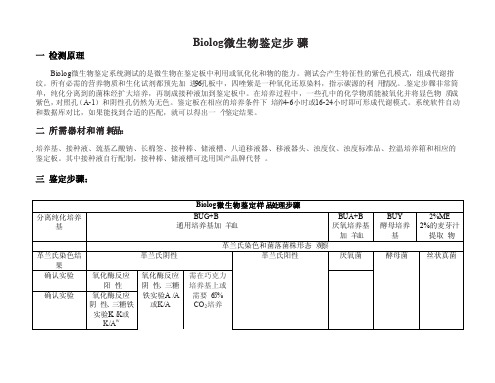
通用培养基加 羊血
厌氧培养基
加 羊血
革兰氏染色和菌落菌株形态 观察
革兰氏染色结
革兰氏阴性
革兰氏阳性
厌氧菌
果 确认实验
确认实验
氧化酶反应 阳 性
氧化酶反应 阴 性、三糖铁
实验K /K或 K/Aw
氧化酶反应 阴 性、三糖 铁实验A /A
或K/A
需在巧克力 培养基上或 需要 6.5%
如果是革兰氏阳性菌,用革兰氏染色可以很容易的区分球菌和杆菌,推荐再做一个过氧化氢酶实验,最终 确定是球菌还是杆菌。通过革兰氏染色或观察菌落形态可以区分 出芽孢杆菌。
微生物的扩大 培养应该用B iolog推荐的培养基和 培养条件,以便使微生物达到最佳的代谢活性,进而准确的 和数据库中的代 谢模式匹配。
FF 丝状真菌
2%ME 26℃ 空气 FF-IF 75%T FF
FF 100μ l 24,48,72,96
第一步:
在用户自己的培养基上纯化菌株,如果菌株为冻干或冷冻样品,需要传代培养 2-3代,让菌株恢复活 力。 对纯化好的菌株做革兰氏染色,确定菌株是革兰氏阴性还是阳性。观察菌落外部形态或用显微镜观察菌株 形态,确定是酵母还是丝状真菌,是球菌还是杆 菌。
二 所需器材和消 耗品:
培养基、接种液、巯基乙酸钠、长棉签、接种棒、储液槽、八道移液器、移液器头、浊度仪、浊度标准品、控温培养箱和相应的 鉴定板。其中接种液自行配制,接种棒、储液槽可选用国产品牌代替 。
三 鉴定步骤:
Biolog 微生物鉴定样 品处理步骤
分离纯化培养 基
BUG+B
96孔板高通量筛选多杀菌素高产菌株的研究

136中国农业科技导报12卷图2不同培养时间下刺糖多孢菌的菌丝形态Fig.2MycelialmorphologyofSaccharopolysporaspinosaatdifferentculturetime空气的接触面积,装液量越大,发酵液与空气的接触面积越小,导致96孔板微环境中的供氧能力随装液量的增大而降低,从而影响多杀菌素的合成。
装液量为O.2mL和0.4mL时,多杀菌素的发酵单位均高于摇瓶发酵对照(CK),考虑到0.2mL的发酵液体积较少,不利于多杀菌素的仪器检测,故选择96孔板每孔装液量为0.4mL。
表196孔板发酵培养基装量体积对多杀菌素发酵单位的影响TablelTheeffectofdifferentvolumeoffermentationin96一wellplatestheyieldsofspinosad.96孔板发酵培养基装液量(mL)Thevolumeoffermentationmediumin96-wellplates(mL)多杀菌素发酵单位(斗g/mL)Theaverageyieldofspinosad(彬mL)0.2O.4O.6O.8CK136。
15±5.39a123.90±9.5lab87.95±9.47e64.374-8.85d109.43±0.76b注:表中同列数据后不同字母表示差异显著(P<O.05)。
Note:Valuesfollowedwithdifferent8Ⅻmletlerinthe∞tlllecolumnmeansignificantdifferent(P<O.05).2.496孔板高通量筛选多杀菌素高产菌株按照本文建立的方法,采用96孔板对经N+注入诱变后获得的突变株进行初筛,初筛挑取了500个单菌落,根据初筛结果,选择了50株多杀菌素发酵单位提高的突变株进行摇瓶复筛,部分复筛结果如表2所示。
表2结果显示,不同菌株在96孔板中多杀菌素的发酵单位均略高于摇瓶中的发酵单位,这说明96孑L板的通氧量要优于摇瓶,更适合菌株发酵产多杀菌素。
腐败葡萄中酵母菌的分离及鉴定

腐败葡萄中酵母菌的分离及鉴定王洁;胡然;姜虹伶;钟凯;高鸿【摘要】采用传统的微生物分离手段,从腐败的葡萄中分离纯化得到了4株酵母菌。
采用形态学观察、生理生化试验、26S rDNA D1/D2区序列分析、系统进化树的构建及生长曲线的测定,对该4株酵母菌进行菌种鉴定和生长特性研究。
26S rDNA D1/D2序列分析结果表明,该4株酵母菌均为酿酒酵母(Saccharomyces cerevisiae),但其碱基序列存在一定的差异。
形态观察发现菌株G19和G42较为相似,但生长曲线结果表明G19较G42菌株生长缓慢。
G25菌株的形态与其余3株有所不同,其菌落呈微黄色,子囊孢子含量较多。
G34的菌落表面和边缘粗糙且无光泽,生理生化特征表明,G34是4株菌株中唯一不能利用蔗糖作为碳源的菌株,且经26S rDNA D1/D2区序列分析发现与其他3种菌株不在同一分支上。
%In this study, four yeast strains were isolated and purified from rotten grapes by traditional yeast isolation methods. The four strains were then identified by morphological observation, physiological and biochemical experiment, 26S rDNA D1/D2 sequence analysis and their growth characteristics were determined by Neighbor-Joining tree construction and growth curve measurement. The results of 26S rDNAD1/D2 sequence analysis indicated that the four strains were all Saccharomyces cerevisiae, but there were certain differences in their base sequence. Morphological observation suggested that strain G19 was relatively similar to strain G42, however, the growth curve results indicated G19 grew more slowly than G42. The colony of strain G25 was quite different from others, it was faint yellow and contained more ascospore inthe cell. The colony surface and edges of strain G34 were rough and lackluster, and the physiological and biochemical test results indicated that strain G34 was the only one incapable of using sucrose as carbon source among all four strains, and 26S rDNA D1/D2 area sequence analysis found that it was not on the same branch with other three strains.【期刊名称】《酿酒科技》【年(卷),期】2015(000)005【总页数】5页(P29-33)【关键词】腐败葡萄;酵母菌;26S rDNA D1/D2;分离鉴定【作者】王洁;胡然;姜虹伶;钟凯;高鸿【作者单位】四川大学轻纺与食品学院,四川成都610065;中国农业大学资源与环境学院,北京100094;四川大学轻纺与食品学院,四川成都610065;四川大学轻纺与食品学院,四川成都610065;四川大学轻纺与食品学院,四川成都610065【正文语种】中文【中图分类】TS261.1;Q93-3我国葡萄种植分布广泛,由于不同产区生态条件差异较大,葡萄品种较多,其所含酵母菌种类也有较大差异。
Biolog GN2 微生物鉴定微孔板使用手册

次以上的划线分离,取单菌落纯化。如果菌株为冻干或冷冻样品,需要传代培养2-3代,让菌株恢复活力。
第二步: 对纯化好的菌株做革兰氏染色,确定菌株是否是革兰氏阴性。观察菌落外部形态或用显微镜观察菌株形
态,确定是球菌还是杆菌。 如果是革兰氏阴性菌,还需要最终确认是肠道菌(GN-ENT)、非肠道菌(GN-NENT)或苛生菌(GN-FAS)。方
Biolog GN2 微生物鉴定板使用手册
用途
GN2鉴定板提供了标准化的95种反应用于鉴定一大类肠道菌、非肠道菌和苛生菌等革兰氏阴性好氧细菌。 Biolog的MicroLog1、MicroLog 2、MicroLog 3或OmniLog软件根据GN2鉴定板的代谢模式对该种微生物进行鉴 定。
描述
Biolog鉴定板检测微生物利用或氧化预先选择好的不同碳源的能力。该检测产生了紫色孔的特征模式,进 而构成了微生物利用不同碳源的代谢指纹。所有必需的营养物质和生化试剂都预先加入并冻干在各个孔内, 四唑紫作为氧化还原染料在颜色上指示微生物对碳源利用的情况。整个鉴定过程非常简单。需要鉴定的菌株 在固体培养基上生长,然后在推荐的浓度下用特殊的接种液制成菌悬液。菌悬液以每孔150µl接种到鉴定板上, 接种的时候所有的孔都是无色的。在培养期间,在一些孔(阳性孔)里微生物利用相应的碳源进行代谢,而 显色物质会被还原成紫色。阴性孔和对照孔(A-1:不含碳源)保持无色。鉴定板培养4-6个小时和/或16-24个 小时,让微生物充分的利用碳源,以形成稳定的碳源代谢指纹。软件自动将鉴定板的数据和数据库进行对比, 得出和数据库中最相似的菌株名称。
相似的孔划为阴性反应(-),所有具有明显紫色(和A-1相比)的孔都划为阳性孔(+),具有微弱颜色或紫色斑点 结块的孔都划为边界值(\)。大多数菌都会形成明显的深紫色阳性反应,然而某些属的阳性反应为浅紫色也是正 常的。 假阳性反应是指在A-1或其它阴性孔里出现明显阳性反应。这种现象主要是由于在接种液里没有添加巯基 乙酸钠时,某些细菌(会存在于Klebsiella、Enterobacter、Serratia、Salmonella typhimurium和少部分GN-NENT 菌株)利用自身的胞外多聚糖引起的。如果出现这种现象,该菌株应该按照第三步的程序向接种液里添加巯 基乙酸钠。一些菌株会出现浅紫色的假阳性,这种假阳性不会影响鉴定结果,因为真正的阳性反应是可以辨 别出来的。
96孔板的介绍

不常用96孔板介绍我们在平时实验中,最多应用96孔板,无非是96孔PCR板、细胞培养板和ELISA板,这些常见的我就不一一介绍;今天和大家一起了解一些,比较不常用的96孔微孔板,了解了以后也许能应用上。
有什么问题可交流;QQ:1294004728首先介绍相关参数:96孔聚苯乙烯微孔板*U型底微孔底为圆形,适用于进行凝聚实验;无死角,适用于移取液体;直径:6.94mm,孔高:10.3mm, 板高:14.2mm总体积:323 μl ;工作体积:40-280 μl*V 型底微孔底部为V型,适用于精准取样;适用于存储微量样品。
直径:6.18mm,孔高:10.8mm, 板高:14.1mm总体积:324 μl ;工作体积:40-200 μl*平底底部是水平的,光透底部不会发生偏折,适用于精密光学实验(底部读取信号);口直径:6.96mm,底直径:6.39mm;孔高:10.9mm, 板高:14.6mm总体积:382 μl ;工作体积:25-340 μl ;底面积:32mm2.*平底/独立柱状孔与孔之间距离大些,独立分开,能最大程度地减少交叉污染;口直径:6.96mm,底直径:6.58mm;孔高:10.9mm, 板高:14.4mm总体积:392 μl ;工作体积:25-340 μl ;底面积:34mm2.* μClear®(软)底为透明,底部厚度为190μm+20μm,自发荧光极小,在激发波长470nm----590nm之间,最大自发荧光值是10100RFU;适用于荧光显微镜技术,偏振光透过板子时只有极少部分去偏振化。
*白色板主要用于自发光分析检测,底物显色(如双荧光素酶报告基因分析);*黑色板主要用于荧光检测分析,观察带荧光蛋白标签细胞(如绿色荧光检测分析);*LUMITRACTM 是白色微孔板,主要用于自发光检测分析;*FLUOTRACTM 是黑色微孔板,主要用于荧光检测分析;LUMITRACTM200,FLUOTRACTM200 中结合力板,聚苯乙烯微孔板中结合力比高结合力表面更疏水,故更适用于无极性的蛋白质和多肽,在ELISA实验中具有高度一致性和可重复性。
96孔微平板中含有3个重复的31种碳源BIOLOG 分析代谢指纹技术

L-Phenylalanine
D4 L-Serine
Tween 80 -Cyclodextrin
F1
D3 D-Mannitol 4-Hydroxy Benzoic Acid
D1 Tween 80
E1
E2 E3 E4 N-Acetyl-D- -Hydroxy- L-Threonine Glucosamine butyric Acid
Ecoplate平板:96孔微平板中含有3个重复的 31种碳源
Biolog 测定原理
• 微生物利用不同的碳 源物质,产生电子传 递体烟酰胺腺嘌呤二 核苷酸 (NADH); • 四氮唑接受电子,转 变为紫色的甲僭 (音同 建); • 颜色的深浅及形成速 度,反映不同类型微 生物的数量及活性
A1 Water
4℃振荡1 h(200 rpm / min)
取上清液用无菌水做成10-3的土壤稀释液
吸取150 μl 接种至ECO板的微孔中
25 ℃ 下培养72h 在Emax自动读盘机上 每24 h 读取一次590 nm 处光密度值,直至不再变化。
数据分析
采用孔平均染色程度法(Average Well Color Development, AWCD ) 或曲线积分法(CI),得出终点数据的标准转换 值,AWCD或CI。 AWCD=∑(C-R)/n C:每一个微孔的光密度值 R:空白微孔的光密度值 n :碳源底物的数目(ECO板 n =31)
(Mü ller et al., 2001. FEMS Microbiology Letters, 204, 49-53)
主 成 份 1
Biolog 方法评价
优点
简单、快速,适用于大量样品的测定
尤其适合对于根际微生物群落结构的分析
BIOLOG

调整浊度 接种至鉴定板,培养 读取结果
返
回
第34页/共132页
OVERVIEW
Gram-positive, spore-forming Bacilli (GP-Rod SB) have traditionally been difficult to speciate. They begin to sporulate within minutes of being introduced in a growth-limiting medium. Sporulation slows the organism metabolism, which results in loss of activity on biochemical test media. They grow readily on enriched media, but tend to clump, slime, harden, become grainy, and form pellicles (skin-like films). These factors make it difficult to prepare uniform suspensions for identification in commercial test kits.
主要功能
微生物鉴定 微生物群落结构
第1页/共132页
On应e T用ec领hn域ology
With a Vast Family of Applications And Products
Industrial QC
Clinical
Veterinary
Food
Biolog’s Fundamental Technology
第11页/共132页
酵母菌鉴定板条中文说明书-2012

孔号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 试验代码 GLU MAL SUC TRE RAF LIP NAGA αGLU βGLU ONPG αGAL βFUC PHS PCHO URE PRO HIST LGY 反应成分 葡萄糖 麦芽糖 蔗糖 海藻糖 棉子糖 脂肪酸酯 对 硝 基 苯 -N- 乙 酰 基 -β,D 氨基半乳糖苷 对硝基苯-α,D-葡糖苷 对硝基苯-β,D-葡糖苷 邻 硝 基 苯 -β,D- 半 乳 糖 苷 对 硝 基 苯 -α,D- 半 乳 糖 肝 对 硝 基 苯 -β,D- 墨 角 藻 糖苷 对硝基苯磷酸 对硝基苯磷酸胆碱 尿素 脯氨酸-β-萘胺 组氨酸-β-萘胺 亮氨酰-甘氨酸 β-萘胺 剂量 1.0% 1.0% 1.0% 1.0% 1.0% 1.0% 0.05% 0.05% 0.05% 0.05% 0.05% 0.05% 0.05% 0.05% 0.3% 0.01% 0.01% 0.01% 原理 参考文献
无 酵母菌鉴定试 剂B
红色或深红橙 色 紫色、 红色或深 粉色
黄色、黄橙色或 橙色 无色、稻草色、 橙色或淡粉至 中粉色
只有出现红色或深红橙色才应评为 阳性。 其它色调的橙色应评为阴性。 只有出现明晰的紫色、红色或深粉 色才应评为阳性。浅色调应评为阴 性。
*备注:应将反应板对着白色背景,从上方观察反应孔来读取结果。
酵母菌鉴定板条评分实例 以检测含白色念珠菌的样本为例,按说明书进行加样培养操作后,根据“板条试验的结果解”表 检测颜色变化,在检测报告表(Report Form,见下图)对应板孔下方空格处填写“-/+” , “-” 表示阴性, “+”表示阳性。下图中红框一列为各孔的加权分数,并按照表格设计对标记为“+” 的空格相加(如蓝框中三格进行计算,第三孔为阴性不做计算,第一、二空为阳性,对应加权分 数分别为 1 和 2,故三孔总和为 3) 。
普洛麦格 - celltiter 96

普洛麦格(北京)生物技术有限公司地址: 北京市东城区北三环东路36号环球贸易中心B座907-909电话:CellTiter 96® AQ ueous One SolutionCell Proliferation AssayI. 描述 (1)II. 产品组分和保存条件 (4)III. 操作步骤 (5)A. 一般操作步骤 (5)B. 应用举例:用B9细胞检测IL-6生物活性的操作程序 (5)IV. 通常需考虑的因素 (6)A. 背景吸光度值 (6)B. 读取数据的可选波长 (6)C. 淋巴细胞检测 (7)D. 试剂优化 (7)E. 细胞数的优化 (7)V. 相关产品 (8)VI. 参考文献 (11)I. 描述CellTiter 96® AQ ueous One Solution Cell Proliferation Assay(a)是一种用比色法来检测细胞增殖和细胞毒实验中的活细胞数量的检测试剂。
此试剂含有一个新型的四唑化合物[3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium, inner salt; MTS(a)]和一种电子偶联剂(phenazine ethosulfate; PES)。
PES具有增强的化学稳定性,这使它可与MTS混合形成稳定的溶液。
这种方便的“单溶液”模式,是在第一代CellTiter 96®AQ ueous Assay的基础上的改进,CellTiter 96®AQueous Assay中使用的电子偶联剂PMS与MTS溶液是分开提供的。
MTS (Owen’s reagent) 被细胞生物还原成为一种有色的甲臜产物,可直接溶解于培养基中(图1, 1)。
这种转化很可能是在代谢活跃的细胞中的脱氢酶产生的NADPH或NADH的作用下完成的(2)。
干细胞因子(SCF)检测试剂盒 SEA120Mu使用说明书

SEA120Mu96T干细胞因子(SCF)检测试剂盒(酶联免疫吸附试验法)适用生物:小鼠使用说明书仅供体外研究使用,不用于临床诊断!第12版(2016年05月修订)[预期应用]本试剂盒运用双抗体夹心ELISA法定量测定小鼠血清、血浆、组织匀浆、细胞裂解液、细胞培养上清或其它相关生物液体中SCF含量。
[试剂盒内容]试剂名称数量试剂名称数量96孔板(预包被)196孔板覆膜4标准品2标准品稀释液1×20mL检测溶液A1×120μL检测溶液A稀释液1×12mL检测溶液B1×120μL检测溶液B稀释液1×12mLTMB底物1×9mL终止液1×6mL洗涤液(30×)1×20mL使用说明书1[需自备的设备及试剂]1、450±10nm滤光片的酶标仪(建议仪器使用前提前预热)2、单道或多道微量移液器及吸头3、稀释样品的EP管4、蒸馏水或去离子水5、吸水纸6、盛放洗液的容器7、0.01mol/L(或1×)磷酸缓冲盐(PBS),pH=7.0-7.2[试剂盒的储存及有效期]1、未开封的试剂盒:所有试剂均按试剂瓶标签上所示保存。
请注意,收到试剂盒后请尽快将标准品、检测溶液A、检测溶液B以及96孔板保存于-20o C,其余试剂请置于4o C保存备用。
2、使用后的试剂盒:剩余试剂仍需按照试剂瓶标签所示的温度保存,此外,请将未使用酶标条用包含干燥剂的铝箔袋装好,并拉紧密封铝箔袋,置于-20o C保存。
注意:试剂盒内酶标条可拆卸,按实验需求可分多次使用;使用后的剩余试剂盒建议在首次实验后1个月内使用完毕。
产品过期时间以盒子上的标签为准,保质期内所有组分都确保是稳定的。
[标本的采集与保存]1、血清:将收集于血清分离管中的全血标本在室温放置2小时或4o C过夜,然后1,000×g离心20分钟,取上清即可,将上清置于-20o C或-80o C保存,避免反复冻融。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
YT 鉴定使用
YT鉴定板提供94个生化测试反应来鉴定/特征化一系列酵母菌。
A—C行测定是颜色,以A1孔作为参照孔。
D—H行测定的是浊度,以D1孔作为参照孔。
鉴定板培养24,48,或/和72h,形成特定图谱,读取获得鉴定结果。
注意事项:
1 用纯化后的菌落
2 用特定的培养基,最好转接2代
3 无菌操作,避免污染
4 尽量用一次性玻璃器皿
5 使用前预热接种用无菌水和鉴定板至室温
6 校正浊度仪,配制特定浓度范围的菌悬液
7 biolog的化合物包含对光和温度敏感的成分。
鉴定板孔颜色变为深褐色表明碳源也变质。
一些孔显示黄色或粉红色是正常的。
8 鉴定板测试的是活体细胞的代谢特性,一些菌在受到一些压力选择,如温度,PH,渗透压即使几秒也会失去代谢活力。
为得到最好的结果,一定确保细胞有活性,操作时也要注意。
无菌水自己制备无菌水,在无菌间将其转入biolog提供的相同的规格的玻璃管中。
(20ml 容量,20×150mm),每管放入12-15ml无菌水
测试步骤
1 在BUY培养基上26℃培养待鉴定的酵母菌。
凡能用YT鉴定板鉴定的菌都可以在该条件下培养生长。
2 样品准备及观察特征
利用湿法制备(水片法)或革兰氏染色(如果需要的话)来确认待鉴定菌株是酵母菌。
转到BUY培养基培养,最好培养两代。
细胞需要新鲜培养,平板培养基上培养时间为24-48h
如果菌量较少不足以接种鉴定板,多接几块平板,培养24-48h
3 接种准备
以装有空白无菌水玻璃管调100%T透光率
用标准比浊管校正,应为47%T
制备特定浓度菌悬液
接种上鉴定板,不要操作20min,每孔100ul
4 培养
放于26℃培养鉴定板
将板放入一个密闭的塑料袋或其他盒中,加入浸湿的纸团或毛巾,用以保持湿度,避免在培养过程中使鉴定板中菌悬液因蒸发而减少影响结果。
培养鉴定板24,48或72h,直到得到鉴定结果。
结果
A1孔作为A-C行的参照孔,
D1孔作为D-H行的参照孔。
以590nm处峰值用来分别测试A-C行的颜色变化,D-H行的浊度变化。
一般酵母菌鉴定板的图谱很难用肉眼来判读。
“假阳性”是指A1,D1 还有其他本该阴性的孔显示阳性反应。
(A1孔显紫色,D1孔产生浊度变化)。
可能的原因包括细胞利用了自身的胞外多糖,储存的内源底物,或细胞裂解的物质。
不正确使用鉴定板也可能产生假阳性。
一些酵母菌利用碳源生成带有颜色的(如褐色)的副产物。
这种情况下应看作“阳性”反应。
对于YT鉴定板,24H培养SIM阈值0.75,
48或72H培养SIM阈值0.5。
Trouble shooting
如果各孔全为阳性,确保以下因素:
1 确保该菌株适于用YT鉴定板来鉴定。
2 不要将培养基(含N源)的挑进接种液中(无菌水)
3 浓度控制在特定范围内
4 菌悬液均一,不含块状物
5 A1和D1不要少加菌悬液(not under-filled),各孔保持一致
如果各孔全为阴性,
1 确保该菌株适于用YT鉴定板来鉴定。
2 利用了BUY培养基,并新鲜培养
3 用作制备菌悬液的无菌水预热到室温,有合适的PH,不含防腐剂。
4 培养温度合适。
5 处理细胞使用的是一次性玻璃器皿(残留的肥皂会对细胞产生毒害)
6 A1和D1不要加多菌悬液(not under-filled),各孔保持一致
YT数据库的构建是在临床和环境微生物作大量代谢特征验证后做成的。
首先鉴定纯的菌株,只能对数据库中包括的菌鉴定。
非典型菌株培养72h
SIM低于0.5 都将报告为NO Identification。
质控菌株
1 Candida albicans A TCC 10231白色念珠菌(白色假丝酵母)
2. Candida geochares A TCC 36852
3. Kluyveromyces marxianus马克斯克鲁维酵母(酵母型)(Candida kefyr) ATCC 2512乳酒
假丝酵母(菌丝体型)
4. Galactomyces geotrichum (Geotrichum candidum) ATCC 34614白地霉(菌丝体型)。
