第13章-5氧硫硒碲-氧
元素周期表拼音记忆口诀(精编)

3化学元素周期表口诀在背诵之前先用2分钟时间看一个不伦不类的小故事:侵害从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,这家有个很美丽的女儿,叫桂林,不过她有两颗绿色的大门牙(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命。
刚嫁入门的那天,就被小姑子号称“铁姑”狠狠地捏了一把,亲娘一生气,当时就休克了。
这下不得了,娘家要上告了。
铁姑的老爸和她的哥哥夜入县太爷府,把大印假偷走一直往西跑,跑到一个仙人住的地方。
这里风景优美:彩色贝壳蓝蓝的河,一只乌鸦用一缕长长的白巾牵来一只鹅,因为它们不喜欢冬天,所以要去南方,一路上还相互提醒:南方多雨,要注意防雷啊。
看完了吗?现在我们把这个故事浓缩一下,再用6分钟时间,把它背下来。
侵害鲤皮捧碳蛋养福奶那美女桂林留绿牙嫁给康太反革命铁姑捏痛新嫁者生气休克如此一告你不得了老爸银哥印西提地点仙(彩)色贝(壳)蓝(色)河但(见)乌(鸦)(引)来鹅一白巾供它牵必不爱冬(天)防雷啊!好了,现在共用去8分钟时间,你已经把元素周期表背下来了,不信?那你再用余下的2分钟,对照一下:第一周期:氢氦---- 侵害第二周期:锂铍硼碳氮氧氟氖---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩---- 那美女桂林留绿牙第四周期:钾钙钪钛钒铬锰---- 嫁给康太反革命铁钴镍铜锌镓锗---- 铁姑捏痛新嫁者砷硒溴氪---- 生气休克第五周期:铷锶钇锆铌---- 如此一告你钼锝钌---- 不得了铑钯银镉铟锡锑---- 老爸银哥印西提碲碘氙---- 地点仙第六周期:铯钡镧铪----(彩)色贝(壳)蓝(色)河钽钨铼锇---- 但(见)乌(鸦)(引)来鹅铱铂金汞砣铅---- 一白巾供它牵铋钋砹氡---- 必不爱冬(天)第七周期:钫镭锕---- 防雷啊!唉,没办法,这么难记的东东,又必须要背,就只能这样了。
以上是横着按周期背。
下面是竖着按族背:氢锂钠钾铷铯钫请李娜加入私访(李娜什么时候当皇上啦)铍镁钙锶钡镭媲美盖茨被累(呵!想和比尔.盖茨媲美,小心累着)硼铝镓铟铊碰女嫁音他(看来新郎新娘都改名了)碳硅锗锡铅探归者西迁氮磷砷锑铋蛋临身体闭氧硫硒碲钋养牛西蹄扑氟氯溴碘砹父女绣点爱(父女情深啊)氦氖氩氪氙氡害耐亚克先动化合价可以这样记忆:一家请驴脚拿银,(一价氢氯钾钠银)二家羊盖美背心。
氧、硫、硒和碲

斜方硫
单斜硫
四、单质硫
硫的晶体形状
弹性硫
四、单质硫
单质硫加热到503K熔化时,S8分子破裂并聚合,形成长 硫链,此时液态硫颜色变深,黏度增加;
熔融硫
急速倾入冷水中
弹性硫
弹性硫放置后逐渐转变成晶状硫;晶状硫能溶解在CS2中, 而弹性硫只能部分溶解;
四、单质硫
硫能形成2、+6、+4、+2、+1氧化态的化合物,2价 的硫有较强的还原性,+6价的硫有氧化性,+4价的硫既 有氧化性也有还原性。硫是很活泼的非金属元素;
0
八面体 SF6
S原子
3d
3s
3p
3d
3s
3p
3. 多硫链
S有形成长硫链 -Sx-的习性,这是其他元素少 见的,长链也可以成为形成化合物的结构基础;
多硫离子S32-
多硫离子S42-,BaS4
3. 多硫链
长硫链 -Sx-,当x=2 时,称为过硫化物,类 似过氧化物;当x≥2~6 时,称为多硫化物;
Na2SO4 + 4H2 1000℃ Na2S + 4H2O
(1)硫化物的溶解性
硫化铵 (NH4)2S
黄色晶体,常用的水溶性硫化物试剂,将H2S 通入氨水 中制备,硫化铵仅存在于水溶液中:
2NH3·H2O + H2S → (NH4)2S + 2H2O
硫化钠或硫化铵溶液能够溶解单质硫生成多硫化物,像碘 化钾溶液可以溶解碘一样。
第13章-5 氧、硫、硒和碲
教学要求:
1. 熟悉氧和硫单质同素异形体的结构和性质;
2. 掌握金属硫化物溶解性的一般规律,多硫化物的 结构和氧化性质;
氧族元素
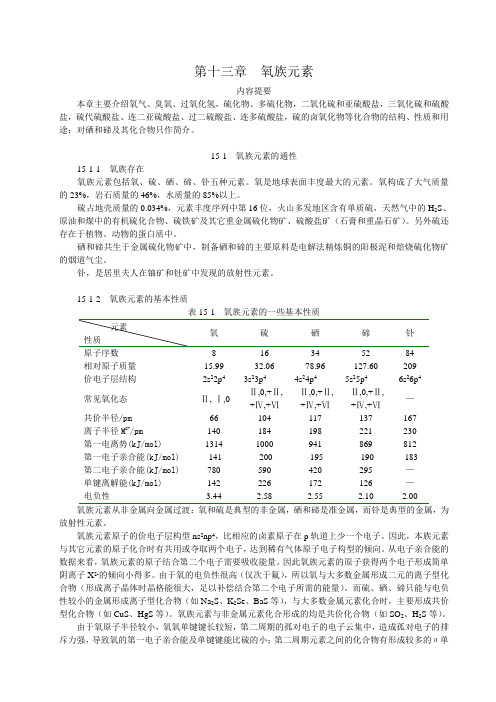
第十三章氧族元素内容提要本章主要介绍氧气、臭氧、过氧化氢,硫化物、多硫化物,二氧化硫和亚硫酸盐,三氧化硫和硫酸盐,硫代硫酸盐、连二亚硫酸盐、过二硫酸盐、连多硫酸盐,硫的卤氧化物等化合物的结构、性质和用途;对硒和碲及其化合物只作简介。
15-1 氧族元素的通性15-1-1 氧族存在氧族元素包括氧、硫、硒、碲、钋五种元素。
氧是地球表面丰度最大的元素。
氧构成了大气质量的23%,岩石质量的46%,水质量的85%以上。
硫占地壳质量的0.034%,元素丰度序列中第16位,火山多发地区含有单质硫,天然气中的H2S、原油和煤中的有机硫化合物、硫铁矿及其它重金属硫化物矿、硫酸盐矿(石膏和重晶石矿)。
另外硫还存在于植物、动物的蛋白质中。
硒和碲共生于金属硫化物矿中,制备硒和碲的主要原料是电解法精炼铜的阳极泥和焙烧硫化物矿的烟道气尘。
钋,是居里夫人在铀矿和钍矿中发现的放射性元素。
15-1-2 氧族元素的基本性质表15-1 氧族元素的一些基本性质原子序数8 16 34 52 84相对原子质量15.99 32.06 78.96 127.60 209价电子层结构2s22p43s23p44s24p45s25p46s26p4常见氧化态-Ⅱ,-Ⅰ,0 -Ⅱ,0,+Ⅱ,+Ⅳ,+Ⅵ-Ⅱ,0,+Ⅱ,+Ⅳ,+Ⅵ-Ⅱ,0,+Ⅱ,+Ⅳ,+Ⅵ—共价半径/pm66 104 117 137 167离子半径M2-/pm140 184 198 221 230第一电离势(kJ/mol)1314 1000 941 869 812第一电子亲合能(kJ/mol)-141 -200 -195 -190 -183第二电子亲合能(kJ/mol) 780 590 420 295 —单键离解能(kJ/mol) 142 226 172 126 —电负性 3.44 2.58 2.55 2.10 2.00氧族元素从非金属向金属过渡:氧和硫是典型的非金属,硒和碲是准金属,而钋是典型的金属,为放射性元素。
高一化学氧族元素

}
减
弱
氧( O)、硫( S)、硒( Se)、碲(Te)、钋( Po)
金属性 还原性 失电子能力
}
增
强
主要化合价:
-2、+4、+6
(O只有-2价)
根据各元素的化学性质,你 能推断出元素最高价氧化物 对应的水化物的酸、碱性的 强弱吗?气态氢化物的稳定 性又怎样?
元素最高价氧化物对应的水化物: 酸 性 逐 渐 减弱
更强
1000℃左右分解
与Fe、Cu反应 的难易程度
Fe+S ==FeS △ Cu+S ==Cu2S
△
2Fe+3Cl2==2FeCl3
Cu +Cl2==CuCl2
点燃
点燃
Fe与S反应
氧族元素单质的化学性质
课堂练习: 1.碲元素及其化合物不可能具有的性质是( (A)碲的氧化物有和 (B)碲的化合物有-2、+4、+6价 (C)碲能与氢气直接化合,且比稳定 (D)单质碲为银白色、导电性比硒强的固体
H2SO4,H2SeO4,H2TeO4
气态氢化物的稳定性:
稳定 性 逐 渐 减弱
H2O
H2S
H2Se
H2Te
巩固复习
VIA族与同周期的 VIIA族元素的对比:
元素
最外层电子
S
6
Cl
7
位置
最高价氧化物对应的 水化物的酸性 气态氢化物的稳定性
第三周期,VIA族 第三周期,VIIA族 强
300℃以上分解
Gibco胎牛血清 /xueqing/Gibco-xueqing.html Gibco胎牛血清
vzg91wcv
已经无法继续开店,也没有条件坚持等到十月以后了,只能现在就带着三个孩子过江南去另谋生路。希望张老乡携家眷来到汉 口镇的时候,这里的情况已经有所好转。倘若在这里无法立足,也下江南来吧。如果苍天有眼,希望大家还能在江南再次相遇, 共叙友情,云云。耿英把剩余的白面全部打成大饼,用包裹包好了放到箩筐内,作为父子四人路上吃的干粮。次日清晨,天气 完全放晴了,但街道上大量尚未清理掉的厚淤泥踩上去仍然还有点儿陷脚。耿家父子四人饱餐一顿之后,先将剩余的粮油米面 和锅碗瓢盆等规整好了放在箩筐内,再把所有的衣物被褥等打了大小三包,耿正将开店以来一直没有再拉的二胡用一块儿厚厚 的布包好了别在最大的行李卷上。至于木床、桌子、水缸、铁炉子和橱柜什么的大家什儿是没有办法带的,只能是丢弃了。然 后,父子四人把所有能够带着走的东西全部搬到楼外。耿老爹和耿英恋恋不舍地又返回店铺内转了一圈。耿老爹把称米面用的 盘秤和秤砣拿起来看看,说:“这个以后也许还用得着呢,带上吧!”说罢,用扫把清理了一番,拿出来放到箩筐里。耿英拿 下挂在抽屉拉环上的小铁锁,又用力拉开抽屉欲拿起销售账本再看看,但那个字迹早已模糊不清的账本,稍微一翻动就立刻变 作支离破碎的纸片了。耿英轻轻叹一口气走出来拉上店门。锁店门的大铁锁也是耿老爹租赁下这座小二楼以后自己买的,于是, 耿英也把这把大铁锁从门环上取下来拿在手里。然后,再细细看一遍爹爹贴的留言。耿直抬起头来问爹爹:“张伯伯能看到你 写的留言吗?”耿老爹没有说话。耿正拍拍弟弟的肩膀说:“但愿张伯伯能够早点儿听到这儿遭水灾的消息,先不要来了。即 使是两、三个月之后,这里的条件也好不到那里去。万一他们真的来了,全家人举目无亲的,可如何安身立命啊!”耿英看着 爹爹留在店门上的一纸情真意切的留言,满怀深情地说:“真想再见到张伯伯啊!”想一想,耿英又推开店门走进店内,确认 后门已经关上了,这才又走出店门。由于房东原来用的那两把旧铁锁一直搁在店铺里边的窗台上,父子们前两日在清理窗台上 的淤泥时已经都给扔掉了,耿英就用手里的这把大铁锁锁上了店门。耿直不解,嘟哝了一句:“姐姐还锁门干啥呢?以后没有 人住了。”耿正说:“还是锁上的好,免得这无主的房子过早地荒废了。那样,即使两、三个月以后张伯伯真得来了,也不太 可能看到咱爹写的留言了。”耿老爹赞许地点点头没有说话。然后,父子们仰头望望二楼上紧闭着的窗户,看一眼已经没有了 院墙和院门的小后院儿,痛心地想一想为父子们南下立足而立下了汗马功劳的老朋友——那只高大的黑灰色毛驴和它拉的那挂 再熟悉不过的平板车,一阵说不上来的悲切感一
知识点氧族元素氧气臭氧过氧化氢硫硫化氢PPT精选文档

极强
O3+2KI+H2O=2KOH+I2+O2 (易氧化Ag、Hg等不活泼金属)
漂白性
无
有(作消毒剂和脱色剂)
同素异形体:由同一种元素形成的几种性质 不同的单质,叫做这种元素的同素异形体。 20
四 双氧水的知识归纳
分子式
电子式
结构式
㈠双氧水的实验室制法
Na2O2+HCl=H2O2+NaCl (强酸制弱酸) ㈡物理性质: 无色粘稠液体,水溶液俗称双氧水,
的热稳定性
氧化物
最高价氧化 物的水化物
元素的非 金属性
氧(O) 硫(S) 硒(Se) 碲(Te)
8
16
34
52
-2(无正价) 燃烧或爆炸
-2,+4,
+6 加热时能
化合
-2,+4,
+6 加热时能
化合
-2,+4,
+6 不直接化
合
很稳定, 1000℃
以上分解
300℃以上 不稳定,加 不稳定,
分解
热即分解 0℃即分解
淡兰色液氧 淡兰色雪花状 活泼的单质 无漂白性
催化剂
2O3 = 3O2 不吸收紫外线
深兰色液态臭氧 紫黑色固体 更活泼的单质
有漂白性,是脱色剂消毒剂
放电
3O2 = 2O3
能吸收紫外线 19
O3与O2比较 不稳定性:2O3 = 3O2
O2
颜色
无色
O3
气态—淡蓝色
气味
无
刺激性特殊气味
氧化性
强 (不易氧化 Ag、Hg等)
15
3 氧气参与反应的规律
碳元素:烃、C 硫元素:H2S、S 氮元素:NH3、N2
第13章氧族元素讲解

氧族元素
13-1 氧及其化合物 13-2 硫及其化合物 13-3 硒、碲及其化合物
13-1 氧族元素概述
(1) 氧族元素: 氧O 硫S 硒Se 碲Te 钋Po
(2) 价电子层结构:
ns2np4
(3) 单质性质: (4) 存在:
典型非金属 单质或矿物
准金属 放射性金属
共生于重金 属硫化物中
在溶液中,氧在酸性溶液或碱性溶液中都显示出一定 的氧化性,其的标准电极电势如下:
O2 + 4 H+ + 4 e- —— 2 H2O EAθ=1.229 V O2 + 2 H2O + 4 e- —— 4 OH- EBθ=0.401 V
由标准电极电势可见,氧在酸性溶液中的氧化性比在 碱性溶液中的氧化性强得多。
(二)难点
1 硫的含氧化合物的杂化方式、空间构型以及离域Π键的应 用。
2 含氧酸的类型与结构(普通含氧酸、过氧酸、连酸、硫代 酸、同多酸等)。
3 过氧链转移反应。
(6) 氧族元素的电势图
EA / V
O3 2.07 O2 + H2O
1.23 O2 0.68 H2O2 1.78 H2O
S2O82- 2.01 SO42- 0.22 S2O62- 0.57 H2SO3 0.17
H2SO3
0.51
S2O62- 0.08
S2O32-
0.50 S
0.14 S2-
0.45
EB / V
O3 1.24 O2+OH- -0.08
O2 -0.56 O2- -0.41 HO2- - 0.87 OH-
-0.66 S2O82- 2.00 SO42- -0.93SO32--0.57S2O32--0.41 S 0.87 S2-
第13章-5氧硫硒碲-硫硒碲

(1)硫化物的溶解性
硫化物在不同酸中的溶解性
难溶于水 易溶于水
溶于稀盐酸 0.3 mol· -1 L
难溶于稀盐酸
溶于浓盐酸 难溶于浓盐酸 溶于浓硝酸 溶于王水
(NH4)2S Na2S K2 S MgS CaS SrS BaS
均为白色
*Al2S3 白色 *Cr2S3 黑色 MnS 肉色 ZnS 白色 Fe2S3 黑色 FeS 黑色 CoS 黑色 NiS 黑色
七、硫的含氧酸及其盐
1. 二氧化硫和亚硫酸
2. 三氧化硫和硫酸
3. 硫的其他含氧酸及其盐 4. 硫含氧酸的衍生物
1. 二氧化硫和亚硫酸
二氧化硫
无色有刺激臭味的气体,大气污 染物;极性分子,易溶于水; 较 易液化,液态SO2是一种良好的 非水溶剂,做溶剂时既不放出质
3d
1. 离子键
2. 共价键 3. 多硫链
1. 离子键
2. 共价键
(1)sp杂化 (2)sp2杂化 (3)sp3杂化 (4)sp3d杂化
(5)sp3d2杂化
2. 共价键
杂化态 键 键 孤电子对 分子构型 举例
sp
1
1
1
直线形
CS2
Π34 Π34
S原子
3p 3d
3s
2. 共价键
杂化态 键 键 孤电子对 分子构型 举例
SF6
S原子
3d 3s 3p
3d 3s 3p
3. 多硫链
S有形成长硫链 -Sx-的习性,这是其他元素少 见的,长链也可以成为形成化合物的结构基础;
2多硫离子S3
2多硫离子S4 ,BaS4
3. 多硫链
长硫链 -Sx-,当x=2 时,称为过硫化物,类 似过氧化物;当x≥2~6 时,称为多硫化物;
第13章 氧族元素

O S S O-
无色透明,易溶于水,碱性。
制备: (1)Na2SO3+S == Na2S2O3
或(2)Na2S+Na2CO3+4SO2 ==
3Na2S2O3+CO2↑
(由哪三个反应组成) (1)遇酸不稳定
S2 O + 2H
2- 3
+
H2 S 2O3
S + SO2 + H 2O
(2)中等强度还原剂 2Na2S2O3+I2 == Na2S4O6+2NaI 分析化学上有重要的应用 Na2S2O3+4Cl2+5H2O == 2H2SO4+2NaCl+6HCl (3)配合剂 用途
硫化物都会产生一定程度的水解,而使溶液呈碱性。
Na2S + H2O == NaHS + NaOH
PbS + H2O == Pb2+ + HS- + OH-
常见硫化物的颜色及溶解性
可溶于水:Na2S(白),K2S(白) 在水中易水解分解:Al2S3 ,Cr2S3 能溶于稀酸: ZnS(白) , FeS (黑),MnS(肉红) 能溶于浓HCl: CdS(黄),SnS(灰) ,PbS(黑) 能溶于氧化性酸: Ag2S(黑),Cu2S,CuS(黑) 能溶于王水 :HgS(黑或红)
水相: 2CrO5+ 7H2O 2+ 6H+ == 7O2+ 10H2O + 2Cr3+(蓝绿)
Cr2O72- + H2O2 + H+ == Cr3++ H2O + O2
Cr3+ + H2O2 + OH- →CrO42- + H2O
13章硫及其化合物

S5O62-
0.49
0.08 -0.88 S O 2- 0.50 S 0.14 H S S2O82- 2.01 SO 2- 0.22 S2O62- 0.57 2 H2SO3 HS2O42 3 4 0.08 0.51 S4O620.04
0.36
0.45
碱性溶液:ФøB
0.75
-0.66 SO42-0.93
Melted sulfur obtained from under ground deposits by the Frasch process
(2) 硫的化学性质
能与许多金属 直接化合 能与氢、氧、碳、 卤素(碘除外)、磷 等直接作用
2Al 3S Al2S3 Hg S HgS
硫
n=2~6 O
O
S
H2SnO6 连多硫酸
OH
链
-Sn-
-Sx-
H2Sx
H2S·x-1 S
H2Sx2-
硫 在 空 气 中 燃 烧
§13-4 硫化氢和硫化物
4.1硫化氢 燃烧 S (g) + H2(g) H2S 1、制法: FeS + 2 HCl (稀) ==== H2S↑ + FeCl2 实验室用启普发生器,以块状FeS 与酸反应
硫化氢是无色有腐蛋臭味的有毒气体,有麻醉中枢神经
作用,吸入大量H2S时会因中毒而造成昏迷甚至死亡!!! 工业上H2S在空气中的最大允许含量为0.0lmg· -1。 L
2、性质:
恶臭,有毒,水中溶解度不大,(v\v)1:4.7=
H2O:H2S,因此饱和H2S水溶液为氢硫酸,浓度
达0.1mol•l-1
a.氢硫酸H2S:Ka1=1.3×10-7 Ka2 =7.1×10-15
化学元素周期表读音

化学元素周期表读音1氢(qīng) 2氦(hài) 3锂(lǐ) 4铍(pí)5 硼(péng) 6碳(tàn) 7氮(dàn)8 氧(yǎng) 9氟(fú)10 氖(nǎi)11钠(nà) 12镁(měi) 13铝(lǚ)14 硅(guī)15 磷(lín) 16硫(liú) 17氯(lǜ) 18氩(yà)19钾(jiǎ) 20钙(gài) 21钪(kàng) 22钛(tài)23 钒(fán) 24铬(gè) 25锰(měng) 26铁(tiě) 27钴(g ǔ)28 镍(niè)29 铜(tóng)30 锌(xīn) 31镓(jiā) 32锗(zhě) 33砷(shēn) 34硒(xī) 35溴(xiù)36 氪(kè)37铷(rú) 38锶(sī) 39钇(yǐ) 40锆(gào) 41铌(ní)42 钼(mù) 43锝(dé) 44钌(liǎo) 45铑(lǎo) 46钯(bǎ) 47银(yín) 48镉(gé)49铟(yīn) 50锡(xī) 51锑(tī) 52碲(dì)53 碘(diǎn) 54氙(xiān)55铯(sè) 56钡(bèi) 57镧(lán) 58铈(shì) 59镨(pǔ)60 钕(nǚ)61 钷(pǒ) 62钐(shān) 63铕(yǒu)64 钆(gá) 65铽(tè) 66镝(dī) 67钬(huǒ)68 铒(ěr) 69铥(diū)70 镱(yì) 71镥(lǔ) 72铪(hā)73 钽(tǎn) 74钨(wū) 75铼(lái) 76锇(é) 77铱(yī) 78铂(bó)79 金(jīn) 80汞(gǒng) 81铊(tā) 82铅(qiān)83 铋(bì) 84钋(pō)85砹(ài)86 氡(dōng)87钫(fāng) 88镭(léi)89 锕(ā) 90钍(tǔ)91 镤(pú) 92铀(yóu) 93镎(ná)94 钚(bù)95 镅(méi) 96锔(jú)97 锫(péi)98 锎(kāi) 99锿(āi) 100镄(fèi) 101钔(mén) 102锘(nuò)103 铹(láo)104 钅卢(lú) 105钅杜(dù)106钅喜(xǐ)107钅波(bō)108 钅黑(hēi)109 钅麦(mài)110 钅达(dá) 111钅仑(lún)五个字五个字背顺序名称字母是必背的初中只需背前20个相对质量不用背考试时卷子上会告诉你的前20号元素1 H 氢1.0079(相对原子质量)化学元素周期表2 He 氦4.00263 Li 锂6.9414 Be 铍9.01225 B 硼10.8116 C 碳12.0117 N 氮14.0078 O 氧15.999 4(3) 9 F 氟18.998 10 Ne 氖20.17 11 Na 钠22.9898 12 Mg 镁24.305 13 Al 铝26.982 14 Si 硅28.085 15 P 磷30.974 16 S 硫32.06 17 Cl 氯35.453 18 Ar 氩39.94 19 K 钾39.098 20 Ca 钙40.08其余需要背的就是金属活动顺序表K -jia Ca -gai Na- na Mg -mei Al -lv Zn - xin Fe- tie Sn -xi Pb- qian H -qing Cu -tong Hg- gong Ag- yin Pt- bo Au -jin价态表一价钾钠氯氢银二价氧钙钡镁锌三铝四硅五价磷二三铁二四碳二四六硫都齐全代数化合价和为零还有就是哪些盐可溶哪些盐不可溶自编的小故事口诀,10分钟全背在背诵之前先用2分钟时间看一个不伦不类的小故事:侵害从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,这家有个很美丽的女儿,叫桂林,不过她有两颗绿色的大门牙(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命。
化学元素周期表 读音及口诀

化学元素周期表读音&口诀读音1氢(qīng) 2氦(hài) 3锂(lǐ) 4铍(pí) 5硼(péng) 6碳(tàn) 7氮(dàn) 8氧(yǎng) 9氟(fú) 10氖(nǎi) 11钠(nà) 12镁(měi) 13铝(lǚ) 14硅(guī) 15磷(lín) 16硫(liú) 17氯(lǜ) 18氩(yà) 19钾(jiǎ) 20钙(gài)21钪(kàng) 22钛(tài) 23钒(fán) 24铬(gè) 25锰(měng) 26铁(tiě) 27钴(gǔ) 28镍(niè) 29铜(tóng) 30锌(xīn) 31镓(jiā) 32锗(zhě) 33砷(shēn) 34硒(xī) 35溴(xiù) 36氪(kè)37铷(rú) 38锶(sī) 39钇(yǐ) 40锆(gào) 41铌(ní) 42钼(mù) 43锝(dé) 44钌(liǎo) 45铑(lǎo) 46钯(bǎ) 47银(yín) 48镉(gé)49铟(yīn) 50锡(xī) 51锑(tī) 52碲(dì) 53碘(diǎn) 54氙(xiān) 55铯(sè) 56钡(bèi) 57镧(lán) 58铈(shì) 59镨(pǔ) 60钕(nǚ)61钷(pǒ) 62钐(shān) 63铕(yǒu) 64钆(gá) 65铽(tè) 66镝(dī) 67钬(huǒ) 68铒(ěr) 69铥(diū) 70镱(yì) 71镥(lǔ) 72铪(hā)73钽(tǎn) 74钨(wū) 75铼(lái) 76锇(é) 77铱(yī) 78铂(bó) 79金(jīn) 80汞(gǒng) 81铊(tā) 82铅(qiān) 83铋(bì) 84钋(pō)85砹(ài) 86氡(dōng) 87钫(fāng) 88镭(léi) 89锕(ā) 90钍(tǔ) 91镤(pú) 92铀(yóu) 93镎(ná) 94钚(bù) 95镅(méi) 96锔(jú)97锫(péi) 98锎(kāi) 99锿(āi) 100镄(fèi) 101钔(mén) 102锘(nuò) 103铹(láo) 104钅卢(lú) 105钅杜(dù) 106钅喜(xǐ)107钅波(bō) 108钅黑(hēi) 109钅麦(mài) 110钅达(dá) 111钅仑(lún)口诀横着按周期背:侵害从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,这家有个很美丽的女儿,叫桂林,不过她有两颗绿色的大门牙(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命。
氧族元素的性质

第四讲氧族元素本章学习要求1.臭氧、过氧化氢的结构性质和用途2.氧化物的分类、离域π键的概念3.SO2、SO3、H2SO3、H2SO4和它们相应的盐、硫代硫酸盐、过二硫酸及其盐的结构、性质、制备和用途以及它们之间的相互转化。
13.1 氧族元素的通性13.1.1氧族元素的通性●氧族元素:VIA族氧、硫、硒、碲、钋非金属准金属放射性●硫族元素:除氧以外其它元素统称:硒有多种同素异形体,其中灰硒为链状晶体,它的导电性在暗处很低,当受到光照时可升高近千倍,可用来做光电池和整流器的结构材料。
红硒是分子晶体,常用于制造红玻璃。
硒还用于生产不锈钢和合金。
硒是人体必需的微量元素之一。
碲是银白色链状晶体,很脆,易成粉末。
碲主要用来制造合金,以增加其硬度和耐磨性。
氧族元素原子最外层电子构型是n s2n p4,的非金属活泼性弱于卤素。
(1) 硫、硒、碲可以同电负性更大的元素化合,表现正氧化态,同时d轨道电子也参加成键,形成+II、+IV、+VI多种氧化态。
(2) 本族元素的原子半径、离子半径、电离能和电负性的变化趋势与卤素相似。
随着电离能的降低,本族元素从非金属过渡到金属:氧和硫是典型的非金属;硒和碲是准金属;钋为金属。
(3) 本族元素的单键键能,随原子半径的增大而依次降低(氧除外)。
氧具有较低的键能的原因是:氧的原子半径很小,孤对电子之间的斥力较大,又没有空的d轨道,无法形成dπ-p键,所以O-O单键较弱。
单质的非金属活泼性:O > S > Se > Te顺序降低。
氧和硫是比较活泼的,尤其氧几乎与所有元素化合生成相应的氧化物。
单质硫与许多金属接触时都能发生反应,如室温时汞可以和单质硫化合,高温下活泼性增强。
硒和碲也能与大多数元素反应而生成相应的硒化物。
氧易溶解在有机溶剂中,因此在有机试剂中测定对空气敏感物质的反应时,要考虑到这一点。
13.2 氧及其化合物13.2.1 氧1.氧的存在和制备2.氧的结构、性质和用途●氧是一种化学性质非常活泼的元素,几乎能和所有其它元素直接化合或间接反应生成不同类型的化合物。
元素周期表拼音记忆口诀(精编)

3化学元素周期表口诀在背诵之前先用2分钟时间看一个不伦不类的小故事:侵害从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,这家有个很美丽的女儿,叫,不过她有两颗绿色的大门牙(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命。
刚嫁入门的那天,就被小姑子号称“铁姑”狠狠地捏了一把,亲娘一生气,当时就休克了。
这下不得了,娘家要上告了。
铁姑的老爸和她的哥哥夜入县太爷府,把大印假偷走一直往西跑,跑到一个仙人住的地方。
这里风景优美:彩色贝壳蓝蓝的河,一只乌鸦用一缕长长的白巾牵来一只鹅,因为它们不喜欢冬天,所以要去南方,一路上还相互提醒:南方多雨,要注意防雷啊。
看完了吗?现在我们把这个故事浓缩一下,再用6分钟时间,把它背下来。
侵害鲤皮捧碳蛋养福奶那美女留绿牙嫁给康太反革命铁姑捏痛新嫁者生气休克如此一告你不得了老爸银哥印西提地点仙(彩)色贝(壳)蓝(色)河但(见)乌(鸦)(引)来鹅一白巾供它牵必不爱冬(天)防雷啊!好了,现在共用去8分钟时间,你已经把元素周期表背下来了,不信?那你再用余下的2分钟,对照一下:第一周期:氢氦---- 侵害第二周期:锂铍硼碳氮氧氟氖---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩---- 那美女留绿牙第四周期:钾钙钪钛钒铬锰---- 嫁给康太反革命铁钴镍铜锌镓锗---- 铁姑捏痛新嫁者砷硒溴氪---- 生气休克第五周期:铷锶钇锆铌---- 如此一告你钼锝钌---- 不得了铑钯银镉铟锡锑---- 老爸银哥印西提碲碘氙---- 地点仙第六周期:铯钡镧铪----(彩)色贝(壳)蓝(色)河钽钨铼锇---- 但(见)乌(鸦)(引)来鹅铱铂金汞砣铅---- 一白巾供它牵铋钋砹氡---- 必不爱冬(天)第七周期:钫镭锕---- 防雷啊!唉,没办法,这么难记的东东,又必须要背,就只能这样了。
以上是横着按周期背。
下面是竖着按族背:氢锂钠钾铷铯钫请娜加入私访(娜什么时候当皇上啦)铍镁钙锶钡镭媲美盖茨被累(呵!想和比尔.盖茨媲美,小心累着)硼铝镓铟铊碰女嫁音他(看来新郎新娘都改名了)碳硅锗锡铅探归者西迁氮磷砷锑铋蛋临身体闭氧硫硒碲钋养牛西蹄扑氟氯溴碘砹父女绣点爱(父女情深啊)氦氖氩氪氙氡害耐亚克先动化合价可以这样记忆:一家请驴脚拿银,(一价氢氯钾钠银)二家羊盖美背心。
12氧族--元素化学-无机化学

12氧族--元素化学-无机化学第十三章氧族元素本章摘要1.氧氧气和氧化物臭氧过氧化氢氧元素的成键特征2.硫和硫化物单质硫硫化氢和氢硫酸硫化物3.硫的含氧化合物S(IV)的含氧化合物S(VI)的含氧化合物硫的其它价态含氧化合物4.硒和碲单质氢化物氧化物与含氧§0.概述氧族元素位于第VIA族,有氧(O)、硫(S)、硒(Se)、碲(Te)、钋(Po)五种元素价电子构型:n2np4,可形成某2-氧O:存在形式O2(大气圈)、H2O(水圈)、SiO2及硅酸盐,其它含氧化合物(岩石圈)。
48.6%,居第1位。
硫S:天然单质硫矿;硫化物矿。
方铅矿PbS,闪锌矿ZnS;硫酸盐矿:石膏CaSO4·2H2O,Na2SO4·10H2O,重晶石BaSO4,天青石SrSO4,占0.048%居第16位硒Se:硒铅矿PbSe,硒铜矿CuSe碲Te:碲铅矿PbTe为10–6~10–7%钋Po:放射性元素,本章不做介绍。
§1.氧一.氧气和氧化物1氧气的制备加热含氧化合物制氧气2BaO2→(加热)2BaO+O22NaNO3→(加热)2NaNO2+O2最常见的是催化分解KClO3,工业上制取O2的方法是分馏液化空气。
b.p.N277K,O290K2氧气的性质O2为非极性分子,常温下,无色无味无臭气体,在H2O中溶解度很小。
mp.为90K,液体淡蓝色,bp.为54K,呈淡蓝色固体。
某和大多数单质直接化合成氧化物2Mg+O2——2MgOS+O2——SO2某和大多数非金属氢化物反应2H2S+O2——2S+2H2O2H2S+3O2——2SO2+2H2O4NH3+3O2——2N2+6H2O4NH3+5O2——4NO+6H2O某和低价氧化物反应生成高价氧化物2CO+O2——2CO2丰度芒硝某和硫化物反应2Sb2S3+9O2——2Sb2O3+6SO23氧化物的酸碱性某酸性氧化物包括绝大多数非金属氧化物,某些高价金属氧化物,如Mn2O7,CrO3等某碱性氧化物多数金属氧化物属于碱性氧化物某两性氧化物少数金属氧化物Al2O3,ZnO,BeO,Ga2O3,CuO,Cr2O3等,个别非金属氧化物A2O3,I2O,TeO2等某不显酸性和碱性的氧化物CO,NO,N2O属于不显酸性和碱性的氧化物4氧化物酸碱性的规律某同周期元素的最高价氧化物从左到右酸性增强Na2OMgOAl2O3SiO2P2O5SO3Cl2O7BBABAAAA某同主族同价态氧化物从上到下碱性增强N2O3P2O3A2O3Sb2O3Bi2O3AAABABB某同一元素多种价态的氧化物氧化数高的酸性强MnOMnO2MnO3Mn2O7BABAA二臭氧1臭氧的分子结构臭氧的分子式为O3,中心O价层电子对数:3对,三角形构型,杂化方式:p2中心O的2Pz轨道和两个配体O的2Pz轨道均垂直于分子平面,互相重叠,形成O3中的化学键介于单双键之间。
化学元素周期表读音66952教学内容

精品文档化学元素周期表读音1氢(qīng)2氦(hài)3锂(lǐ)4铍(pí)5硼(péng)6碳(tàn)7氮(dàn)8氧(yǎng)9氟(fú)10氖(nǎi)11钠(nà)12镁(měi)13铝(lǚ)14硅(guī)15磷(lín)16硫(liú)17氯(lǜ)18氩(yà)19钾(jiǎ)20钙(gài)21钪(kàng)22钛(tài)23钒(fán)24铬(gè)25锰(měng)26铁(tiě)27钴(gǔ)28镍(niè)29铜(tóng)30锌(xīn)31镓(jiā)32锗(zhě)33砷(shēn)34硒(xī)35溴(xiù)36氪(kè)37铷(rú)38锶(sī)39钇(yǐ)40锆(gào)41铌(ní)42钼(mù)43锝(dé)44钌(liǎo)45铑(lǎo)46钯(bǎ)47银(yín)48镉(gé)49铟(yīn)50锡(xī)51锑(tī)52碲(dì)53碘(diǎn)54氙(xiān)55铯(sè)56钡(bèi)57镧(lán)58铈(shì)59镨(pǔ) 60钕(nǚ)61钷(pǒ)62钐(shān)63铕(yǒu)64钆(gá)65铽(tè) 66镝(dī)67钬(huǒ)68铒(ěr)69铥(diū)70镱(yì)71镥(lǔ) 72铪(hā)73钽(tǎn)74钨(wū)75铼(lái)76锇(é)77铱(yī)78铂(bó)79金(jīn)80汞(gǒng)81铊(tā)82铅(qiān)83铋(bì) 84钋(pō)85砹(ài)86氡(dōng)87钫(fāng)88镭(léi)89锕(ā) 90钍(tǔ)91镤(pú)92铀(yóu)93镎(ná)94钚(bù)95镅(méi) 96锔(jú)97锫(péi)98锎(kāi)99锿(āi)100镄(fèi)101钔(mén)102锘(nuò)103铹(láo)104钅卢(lú)105钅杜(dù)106钅喜(xǐ)107钅波(bō)108钅黑(hēi)109钅麦(mài)110钅达(dá)111钅仑(lún)口诀A、按周期分:第一周期:氢氦 ---- 侵害第二周期:锂铍硼碳氮氧氟氖 ---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩 ---- 那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰 ---- 嫁改康太反革命铁钴镍铜锌镓锗 ---- 铁姑捏痛新嫁者砷硒溴氪 ---- 生气休克第五周期:铷锶钇锆铌 ---- 如此一告你钼锝钌 ---- 不得了铑钯银镉铟锡锑 ---- 老把银哥印西堤碲碘氙 ---- 地点仙第六周期:铯钡镧铪 ----(彩)色贝(壳)蓝(色)河钽钨铼锇 ---- 但(见)乌(鸦)(引)来鹅铱铂金汞砣铅 ---- 一白巾供它牵铋钋砹氡 ---- 必不爱冬(天)第七周期:钫镭锕 ---- 很简单了~就是---- 防雷啊!B、按族分:氢锂钠钾铷铯钫——请李娜加入私访铍镁钙锶钡镭——媲美盖茨被雷硼铝镓铟铊——碰女嫁音他碳硅锗锡铅——探归者西迁氮磷砷锑铋——蛋临身体闭氧硫硒碲钋——养牛西蹄扑氟氯溴碘砹——父女绣点爱氦氖氩氪氙氡——害耐亚克先动规律一、元素周期表中元素及其化合物的递变性规律1、原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随电子层数增多,原子半径增大。
元素周期表顺口溜

氢qīng 氦hài锂lǐ 铍pí硼péng 碳tàn 氮dàn 氧yǎng 氟fú氖nǎi钠nà镁měi 铝lǚ 硅guī 磷lín 硫liú氯lǜ 氩yà钾jiǎ 钙gài 钪kàng 钛tài 钒fán 铬gè锰měng 铁tiě 钴gǔ 镍niè铜tóng 锌xīn 镓jiā 锗zhě 砷shēn 硒xī 溴xiù氪kè铷rú锶sī 钇yǐ 锆gào 铌ní钼mù锝dé钌liǎo 铑lǎo 钯pá银yín 镉gé铟yīn 锡xī 锑tī 碲dì碘diǎn 氙xiān铯sè钡bèi 镧lán 铪hā 钽tǎn 钨wū 铼lái 锇é铱yī 铂bó金jīn 汞gǒng 铊tā 铅qiān 铋bì钋pō 砹ài 氡dōng钫fāng 镭léi 锕ā 钅卢lú dù xǐ bō hēi mài 钅达dá钅仑lún镧lán 铈shì镨pǔ 钕nǚ 钷pǒ 钐shān 铕yǒu 钆gá铽tè镝dí钬huǒ 铒ěr 铥diū 镱yì镥lǔ锕ā 钍tǔ 镤pú铀yóu 镎ná钚bù镅méi 锔jū 锫péi 锎kāi 锿āi 镄fèi 钔mén 锘nuò铹láo 附化学元素周期表口诀在背诵之前先用2分钟时间看一个不伦不类的小故事:侵害从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,这家有个很美丽的女儿,叫桂林,不过她有两颗绿色的大门牙哇,太恐怖了吧,后来只能嫁给了一个叫康太的反革命;刚嫁入门的那天,就被小姑子号称“铁姑”狠狠地捏了一把,亲娘一生气,当时就休克了;这下不得了,娘家要上告了;铁姑的老爸和她的哥哥夜入县太爷府,把大印假偷走一直往西跑,跑到一个仙人住的地方;这里风景优美:彩色贝壳蓝蓝的河,一只乌鸦用一缕长长的白巾牵来一只鹅,因为它们不喜欢冬天,所以要去南方,一路上还相互提醒:南方多雨,要注意防雷啊;看完了吗现在我们把这个故事浓缩一下,再用6分钟时间,把它背下来;侵害鲤皮捧碳蛋养福奶那美女桂林留绿牙嫁给康太反革命铁姑捏痛新嫁者生气休克如此一告你不得了老爸银哥印西提地点仙彩色贝壳蓝色河但见乌鸦引来鹅一白巾供它牵必不爱冬天防雷啊好了,现在共用去8分钟时间,你已经把背下来了,不信那你再用余下的2分钟,对照一下:第一周期:氢氦---- 侵害第二周期:锂铍硼碳氮氧氟氖---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩---- 那美女桂林留绿牙第四周期:钾钙钪钛钒铬锰---- 嫁给康太反革命铁钴镍铜锌镓锗---- 铁姑捏痛新嫁者砷硒溴氪---- 生气休克第五周期:铷锶钇锆铌---- 如此一告你钼锝钌---- 不得了铑钯银镉铟锡锑---- 老爸银哥印西提碲碘氙---- 地点仙第六周期:铯钡镧铪----彩色贝壳蓝色河钽钨铼锇---- 但见乌鸦引来鹅铱铂金汞砣铅---- 一白巾供它牵铋钋砹氡---- 必不爱冬天第七周期:钫镭锕---- 防雷啊唉,没办法,这么难记的东东,又必须要背,就只能这样了;以上是横着按周期背;下面是竖着按族背:氢锂钠钾铷铯钫请李娜加入私访李娜什么时候当皇上啦铍镁钙锶钡镭媲美盖茨被累呵想和比尔.盖茨媲美,小心累着硼铝镓铟铊碰女嫁音他看来新郎新娘都改名了碳硅锗锡铅探归者西迁氮磷砷锑铋蛋临身体闭氧硫硒碲钋养牛西蹄扑氟氯溴碘砹父女绣点爱父女情深啊氦氖氩氪氙氡害耐亚克先动。
氧族元素(氧硫硒碲)化学方程式总结

第16章氧族元素(氧硫硒碲)氧 1. 氧化汞受热分解:2HgO△2Hg+O2↑2. 过氧化钡受热分解:2BaO2△2BaO+O2↑3. 硝酸钠受热分解:2NaNO3△2NaNO2+O2↑4. 氯酸钾受热分解:2KClO3MnO2△2KCl+3O2↑5. 氧气与镁:2Mg+O2点燃2MgO6. 氧气与硫:S+O点燃SO27. 氧气与硫化氢:3O2+2H2S点燃2SO2+2H2O8. 氧气与氨气:3O2+4NH点燃2N2+6H2O9. 臭氧分解:2O3=3O210. 臭氧与硫化铅:4O3+PbS=PbSO4+4O211. 臭氧与碘离子:O3+2I-+H2O=I2+O2+2OH-12. 氧气与磷:5O2+4P点燃P4O1013. 氧气与磷:3O2+4P点燃P4O614. 氢氧化铜受热分解:Cu(OH)2△CuO+H2O15. 碳酸钙分解:CaCO高温CaO+CO2↑16. 硝酸铅分解:2Pb(NO3)2△2PbO+4NO2↑+O2↑17. 氧化铜分解:4CuO高温2Cu2O+O2↑18. 五氧化二钒与氢气:V2O5+2H2△V2O3+2H2O19. 过氧化钠与硫酸:Na2O2+H2SO4+10H2O=Na2SO4·10H2O+H2O220. CH3CH(OH)CH3+O2=CH3COCH3+H2O221. 电解硫酸氢根:2HSO-通电H2+S2O82-22. (NH4)2S2O8+2H2SO4=H2S2O8+2NH4HSO423. 过二硫酸与水:H2S2O8+2H2O=H2O2+2H2SO424. 氧气与氢气:H2+O22-乙基蒽醌,钯H2O225. 过氧化氢与碘离子:H2O2+2I-+2H+=I2+2H2O26. HO2-+Mn(OH)2=MnO2+OH-+H2O27. 2[Cr(OH)4]-+3HO2-=2CrO42-+OH-+5H2O28. 过氧化氢与硫化铅:4H2O2+PbS=PbSO4+4H2O29. 过氧化氢与高锰酸根:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O30. 过氧化氢与氧化银:H2O2+Ag2O=2Ag+O2↑+H2O31. 过氧化氢与氯气:H2O2+Cl2=2Cl-+O2+2H+硫 1. 电解硫酸氢铵:2NH4HSO电解(NH4)2S2O8+H2↑2. 三氧化硫与碘化钾:SO3+2KI高温K2SO3+I23. 亚硫酸与硫化氢:H2SO3+2H2S=3S↓+3H2O4. 焦硫酸钾与三氧化二铝:3K2S2O7+Al2O共融Al2(SO4)3+3K2SO45. 2NaHSO3+H2SO3+Zn=Na2S2O4+ZnSO3+2H2O6. 硫化汞与硫化钠:HgS+Na2S=Na2[HgS2]7. 硫酸亚铁受热分解:2FeSO4△Fe2O3+SO3↑+SO2↑8. 焦硫酸钾与三氧化二铁:3K2S2O7+Fe2O共融Fe2(SO4)3+3K2SO49. 硫代硫酸钠与氯化亚铜:2Na2S2O3+CuCl=Na3[Cu(S2O3)2]+NaCl10. 焦硫酸钾分解:2K2S2O8△2K2SO4+2SO3↑+O2↑11. 亚硫酰氯与水:SOCl2+H2O=2HCl+SO2↑12. 三氧化硫与盐酸:SO3+HCl=HSO3Cl13. 硫离子与亚硫酸根离子:2S2-+SO32-+6H+=3S↓+3H2O14. 硫代硫酸钠与碘:2Na2S2O3+I2=Na2S4O6+2NaI15. 硫代硫酸根与氯气:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+16. Na2S2+2HCl=NaCl+S↓+H2S17. H2S+6H++2[Ag(S2O3)2]3-=Ag2S↓+4S↓+4SO2+4H2O18. 硫化亚铁与稀盐酸:FeS+2HCl(稀)=FeCl2+H2S↑19. 硫代硫酸钠与盐酸:Na2SO3+2HCl=2NaCl+SO2↑+H2O20. 硫酸钙分解:CaSO4△CaO+SO3↑21. 浓硫酸与碘化钠:8NaI+9H2SO4(浓)=4I2+8NaHSO4+H2S+4H2O22. 浓硫酸与锌:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O23. 硫与氧气:S+O2=SO224. 4FeS2+11O2=2Fe2O3+8SO225. 二氧化硫与氧气:2SO2+O2V2O3△2SO326. 硫化钠与碳酸钠:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO227. 硫与氢氧化钙:3S+3Ca(OH)2=2CaS+CaSO3+3H2O28. 硫与硫化钙:(x-1)S+CaS=CaSx (橙色)29. 硫与亚硫酸钙:S+CaSO3=CaS2O330. 二硫化碳与氧气:CS2+3O2=CO2+2SO231. 二氧化硫与碳酸氢钠:SO2+2NaHCO3=Na2SO3+2CO2+H2O32. 三氧化硫与氢氧化钾:SO3+2KOH=K2SO4+H2O33. 电解硫酸氢钾:2KHSO电解K2S2O8+H2↑34. 过二硫酸钾与水:K2S2O8+2H2OH2SO42KHSO4+H2O235. 二氧化硫与碳酸钠:2SO2(过量)+Na2CO3+H2O=2NaHSO3+CO2↑36. 亚硫酸钠与氢氧化钠:NaHSO3+2NaOH=Na2SO4+H2O37. 亚硫酸钠与硫:Na2SO3+S=Na2S2O338. 硫代硫酸根与银离子:S2O32-+2Ag+=Ag2S2O3↓39. 硫代硫酸银与硫代硫酸根:Ag2S2O3+3S2O32-=2[Ag(S2O3)2]3-40. 亚硫酸与硫化氢:H2SO3+2H2S=3S↓+3H2O41. 亚硫酸氢钠与亚硫酸氢钠:2NaHSO3=Na2S2O5+H2O42. 3FeS2+12C+8O煅烧Fe3O4+12CO+6S43. 硫与铁:Fe+S△FeS44. 硫与汞:Hg+S△HgS45. 硫与碳:2S+C△CS246. 硫与浓硝酸:S+2HNO3(浓)=H2SO4+2NO↑47. 硫与浓硫酸:S+2H2SO4(浓) △3SO2↑+2H2O48. 硫与氢氧化钠:3S+6NaOH△2Na2S+Na2SO3+3H2O49. 硫化铁与稀硫酸:FeS+H2SO4(稀)=H2S↑+FeSO450. 硫化钠与稀硫酸:Na2S+H2SO4(稀)=H2S↑+Na2SO451. 硫化氢与碘:H2S(aq)+I2=S+2HI52. 硫化氢与铁离子:H2S(aq)+2Fe3+=2Fe2++S↓+2H+53. 硫化氢与二氧化硫:2H2S(aq)+SO2=3S+2H2O54. 硫化氢与碘:H2S(aq)+4I2+4H2O=H2SO4+8HI55. 硫化氢氧气:2H2S+3O点燃2SO2+2H2O56. 硫化氢与氧气:2H2S+O点燃2S+2H2O57. 硫化钠与水:2Na2S+2H2O=NaOH+NaOH+2NaHS58. 硫化钙与水:2CaS+2H2O=Ca(OH)2+Ca(HS)259. 硫氢化钙与水:Ca(HS)2+2H2O△Ca(OH)2+2H2S60. 三硫化二砷与硫化钠:As2S3+3Na2S(aq)=2Na2AsS361. 硫化汞与硫化钠:HgS+Na2S(aq)=Na2[HgS2]62. SnS+Na2S2(aq)=SnS2+Na2S63. SnS2+Na2S(aq)=Na2SnS364. 硫化钠与硫:Na2S(aq)+(x-1)S=Na2Sx65. As2S3+2Na2S2(aq)=As2S5+2Na2S66. M2S x+2H+=2M++(x-1)S↓+H2S67. 二氧化硫与一氧化碳:SO2+2CO铝矾土773K2CO2+S68. 二氧化硫与氯气:SO2+Cl活性炭SO2Cl269. 硫酸钙与碳:2CaSO4+C高温2CaO+2SO2↑+CO2↑70. 浓硫酸与锌:2H2SO4(浓)+Zn=ZnSO4+SO2↑+2H2O71. 三氧化硫与磷:5SO3+2P高温5SO2+P2O572. 硫与铜:S+2Cu△Cu2S73. 亚硫酸碘与水:H2SO3+I2+H2O=H2SO4+2HI74. 亚硫酸与铁离子与水:H2SO3+2Fe3++H2O=H2SO4+2Fe2++2H+75. 硫代硫酸钠与氧气:2Na2SO3+O2=2Na2SO476. 硫代硫酸钠分解:4Na2SO3(S) △3Na2SO4+Na2S77. 亚硫酸分解:3H2SO3△2H2SO4+S+H2O78. 亚硫酸氢钠分解:2NaHSO3△Na2S2O5+H2O79. 硫酸与硝酸钠:H2SO4+NaNO3(s)=NaHSO4+HNO3↑80. 硫酸与氯化钠:H2SO4+NaCl(s) △NaHSO4+HCl↑81. 浓硫酸与铜:2H2SO4(浓)+Cu=CuSO4+SO2↑+2H2O82. 浓硫酸与碘化钠:9H2SO4(浓)+8NaI=4I2+8NaHSO4+H2S↑+4H2O83. 硫酸镁分解:MgSO4△MgO+SO3↑84. 硫酸银分解:4Ag2SO4△8Ag+2SO3↑+2SO2↑+3O2↑85. 硫酸亚铁分解:2FeSO4△Fe2O3+SO3↑+SO2↑86. 过二硫酸与水反应:H2S2O7+H2O=2H2SO487. 2KHSO4△K2S2O7+H2O88. 硫代硫酸钠与盐酸:Na2S2O3+2HCl(aq)=2NaCl+S↓+SO2↑+H2O89. 硫代硫酸钠与碘:2Na2S2O3(aq)+I2(aq)=Na2S4O6+2NaI90. Na2S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl91. 硫代硫酸银与水:Ag2S2O3+H2O=Ag2S+H2SO492. 硫代硫酸钠与溴化银:2Na2S2O3(aq)+AgBr=Na3[Ag(S2O3)2]+NaBr93. 2Na2S2O3(aq)+CuCl=Na3[Cu(S2O3)2]+NaCl94. 2[Ag(S2O3)2]3-+4H+=Ag2S↓+SO42-+3S↓+3SO2↑+2H2O95. 过二硫酸钾与铜:K2S2O8(aq)+Cu=CuSO4+K2SO496. 5S2O82-+2Mn2++8H2OAg+2MnO4-+10SO42-+16H+97. 过二硫酸钾分解:2K2S2O8△2K2SO4+2SO3↑+O2↑98. 2K2S2O8+2H2O△4KHSO4+O2↑99. 过二硫酸铵与水:2(NH4)2S2O8+2H2O△4NH4HSO4+O2↑100. 亚硫酸与二氧化锰:2H2SO3+MnO2=H2S2O6+Mn(OH)2101. 硫代硫酸钠与过氧化氢:2Na2S2O3+4H2O2=Na2S3O6+Na2SO4+4H2O 102. H2S x+2SO乙醚H2S x+2O6 (x=3~8)103. 2NaHSO3+H2SO3+Zn=Na2S2O4+ZnSO3+2H2O104. 连二亚硫酸钠与氧气:2Na2S2O4+O2+2H2O=4NaHSO3105. 连二亚硫酸钠与氧气:Na2S2O4+O2+H2O=NaHSO3+NaHSO4 106. 连二亚硫酸与水:2H2S2O4+H2O=H2S2O3+2H2SO3107. 硫代硫酸分解:H2S2O3=S↓+H2SO3108. 加热连二亚硫酸钠:2Na2S2O4△Na2S2O3+Na2SO3+SO2↑109. 连二亚硫酸钠:2Na2S2O4+H2O△Na2S2O3+2NaHSO3110. 二氧化硫与五氯化磷:SO2+PCl5=SOCl2+POCl3111. S+Fe△FeS112. SO2Cl2+2H2O=H2SO4+2HCl↑113. 三氧化硫与盐酸:SO3+HCl=HSO3Cl114. HSO3Cl+H2O=H2SO4+HCl↑硒 1. 二氧化硒与水:SeO2+H2O=H2SeO3H2SeO3+2SO2+H2O=Se↓+2H2SO42. 硒酸与盐酸:H2SeO4+2HCl=H2SeO3+Cl2↑+H2O3. 二氧化硒与二氧化硫:SeO2+2SO2+2H2O=Se↓+2SO42-+4H+3. 硒与氢气:Se+H2673KH2Se4. 三硒化二铝与水:Al2Se3+6H2O=2Al(OH)3↓+3H2Se↑5. H2SeO3+Cl2+H2O=H2SeO4+2HCl碲 1. 三碲化二铝与氢离子:Al2Te3+6H+=2Al3++3H2Te↑2. 三氧化碲与浓氢氧化钾:TeO3+2KOH(浓)=K2TeO4+H2O3. 碲酸与盐酸:H6TeO6+2HCl(aq)=H2TeO3+Cl2↑+3H2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、单质氧
O2
紫外线
臭氧
浅蓝色气体,有鱼腥臭味, 超量有害,稀少状态不仅不 臭,闻起来还清新爽快;
2O
O + O2 → O3 O3
紫外线
O2 + O
高空约25Km 处有一层由太阳强辐射造成的臭氧层,它的 形成阻止了有害于生命的强辐射照射到地球表面上来,从 而保护了地球上的生命体。 还原性的气体SO2、H2S、CO、CFCl3等对大气的污染会 破坏臭氧层,出现臭氧空洞!
②2-乙基蒽醇被O2氧化生成原来的2-乙基蒽醌和H2O2 ;
③2-乙基蒽醌可循环使用;
4. 过氧化氢的鉴定方法
①在酸性溶液中,H2O2能与重铬酸盐生成过氧基配位化合 物CrO(O2)2,或称过氧化铬CrO5,其中铬的氧化数是+6;
4H2O2 + Cr2O72- +2H+ →2CrO(O2)2 + 5H2O
H2O2 + 2Fe2+ + 2H+ → 2Fe3+ + 2H2O
H2O2 + Mn(OH)2→MnO2 + 2H2O
3H2O2+2NaCrO2+2NaOH→ 2Na2CrO4 + 4H2O
2. 过氧化氢的性质与用途
(3)还原性
O2+ 2H+ + 2e― → H2O2
E Ө =0.695 V
― ― O2 + H2O + 2e → HO2 + OH- E Ө =-0.076 V
性鉴定、定量测定过氧化物的反应;
H2O2 + 2I- + 2H+ →I2 + 2H2O
◇油画翻新;(油画染料含铅,与空气中H2S生成黑色PbS)
PbS + 4H2O2 → PbSO4 + 4H2O
2. 过氧化氢的性质与用途
(2)氧化性 ◇漂白毛丝织物、消毒杀菌、火箭燃料的氧化剂等;
H2O2 + H2SO3 → H2SO4 + H2O
2. 过氧化氢的性质与用途
纯H2O2是淡蓝色粘稠液体,它的极性>H2O,H2O2 分子间有较强的氢键,缔合程度>H2O,沸点也> H2O,熔点与水接近,密度随温度变化正常,与水 可以任意比例互溶,3%的水溶液在医药上称为双 氧水,有消毒杀菌的作用。
H2O2的弱酸性、氧化性和不稳定性是其 特征的化学性质:
Ө EB /V
O2 0.695 H2O2 1.77 H2O
O2 -0.076 HO2 0. 78 OH-
低温和高纯度时H2O2比较稳定,若受热到153℃ 以上时便会猛烈歧化分解:
2H2O2 → 2H2O + O2
ΔH
= 196 kJ· -1 mol
2. 过氧化氢的性质与用途
(4)不稳定性
加速H2O2分解速度的因素:
.....
.....
...
臭氧分子的Π34分子轨道示意图
Φ3反键分子轨道 Φ2非键分子轨道 Φ1成键分子轨道 ψO氧原子轨道 EO轨道能量
O3分子键能<O2,不稳定,常 温下分解,比O2活泼; 由于分子轨道中没有单电子, 故是反磁性的;
O3
一、单质氧
臭氧
O3是极性分子,色散力大于O2 ,因此O3沸点>O2, 在水中的溶解度>O2,比O2易液化; O3特征化学性质:不稳定性和强氧化性 (比氧强) O3+ 2H+ + 2e―→ O2 + H2O EӨ =2.07 V O3+ 2H2O +2e―→ O2+2OH- EӨ =1.24 V ◆ 2O3 → 3O2 ΔHӨ =-285.4 kJ· -1 mol ◆ 2O3 + I- +H2O →I2 + O2 + 2OH- 鉴定和测定O3 ◆ 3O3+
锡酸钠Na2SnO3、8-羟基喹啉、
焦磷酸钠Na4P2O7等来抑制
N OH
杂质的催化分解作用。
3. 过氧化氢的制备方法
实验室方法
(1)稀硫酸与过氧化物反应 Na2O2+H2SO4+10H2O → Na2SO4· 2O +H2O2 10H BaO2 + H2SO4 → BaSO4↓+ H2O2 (2)通CO2气体于BaO2溶液中: BaO2 + CO2 + H2O → BaCO3↓ + H2O2
第13章-5 氧、硫、硒和碲
教学要求:
1. 熟悉氧和硫单质同素异形体的结构和性质;
2. 掌握金属硫化物溶解性的一般规律,多硫化物的 结构和氧化性质; 3. 掌握过氧化氢、硫化氢和过硫化氢的结构和氧化 还原性质;
4. 熟悉SO2、SO32-、SO3、SO42- 的结构和性质;
5. 掌握若干重要的硫的其他含氧酸及其盐的性质;
共价化合物如H2O2、K2S2O8等;
2
.. :O ..
..
O: ..
2. 氧分子的成键特征
(3)氧分子失去1个电子 形成二氧基阳离子O2+,氧的氧化数为+ 1 ,如 2 O2+[AsF5]- ,O2+[PtF6]- 为二氧基阳离子的盐; 2O2 +F2+ 2AsF5→ 2O2+[AsF6]O2 + Pt + 3F2→ O2+[PtF6]深红色
sp2
1
1
2
平面 三角形
: :
H2CO
..
sp 1 2 1 直线形 :C .
O: .
配位键
:C
O:
O上这1对电子是在没参加杂化的 p 轨道上,所以是 配位键。
1. 氧原子的成键特征
(3)配位键
①氧原子价电子重排,提供1个空的2p轨道,接 受外来配位电子对而成键,如在有机胺的氧化物 R3N→O中(或在含有d-p 配键的化合物中);
(1) 在碱性介质中的分解速度比在酸性介质中快; (2) 杂质存在,如重金属离子Fe3+、Cr3+、Mn2+ 等都能大大加速H2O2的分解; (3) 紫外光也能促进H2O2的分解;
2. 过氧化氢的性质与用途
(4)不稳定性
阻止H2O2分解的措施:
(1) 棕色瓶内保存,放置在阴凉处; (2) 加入稳定剂防止水解;如微量的:
一、单质氧
臭氧
克鲁岑(德国)
莫利纳(美国)
罗兰(美国)
20世纪70年代,荷兰克鲁岑(Paul J. Crutzen)﹑美国
莫利纳(Mario J.Molina)和罗兰(F.Sherwood Rowland)阐述 了人造化学物质对臭氧层产生影响的化学机理,证明了人
造化学物质对臭氧层构成破坏作用,因此获得了1995年诺
(1)离子键
(2)共价键
(3)配位键
ห้องสมุดไป่ตู้
1. 氧原子的成键特征
1. 氧原子的成键特征
(2)共价键
杂化态 键 配位键 孤电子对 分子构型 举例
sp3
2
0
2
V形
H2O,OF2,Cl2O
sp3
2
1
O
1
三角锥
..
配位键 H3 O+
1. 氧原子的成键特征
(2)共价键
杂化态 键 π键 孤电子对 分子构型 举例
②CrO(O2)2在乙醚中较稳定,在乙醚层中形成蓝色化合物: [CrO(O2)2(C2H5)2O],可证明H2O2或铬(Ⅵ)的存在;
CrO(O2)2 + (C2H5)2O→[CrO(O2)2(C2H5)2O]
-2
O
-1 O
O -1 Cr O -1
-1 O
[CrO(O2)2(C2H5)2O]
CrO(O2)2
第13章-5 氧、硫、硒和碲
教学内容:
一、单质氧 二、氧的成键特征
三、过氧化氢
四、单质硫 五、硫的成键特征 六、硫化氢、硫化物和多硫化物 七、硫的含氧酸及其盐
八、硒和碲
第13章-5 氧、硫、硒和碲
氧硫硒碲
ns2np4,有2个成单价电子, 可形成2个单键或复键,单 质结构的复杂性自上而下增 强;氧双原子分子;硫和硒 8原子环;碲为螺旋状无限 长链,组成固态金属碲。
(1)H2O2是一种比水稍强的二元弱酸
H2O2 + Ba(OH)2 → BaO2 + 2H2O
2. 过氧化氢的性质与用途
(2)氧化性
H2O2+ 2H+ + 2e― → 2H2O
―
EӨ =1.77 V
― HO2 + H2O + 2e → 3OH- EӨ =0.78 V
◇ H2O2能从碘化物溶液中将单质I2 氧化出来,这是定
2s
2p
2s
2p
.. R3N
1. 氧原子的成键特征
(3)配位键
②氧原子同时提供2对孤电子对反馈给原配位原子的 空轨道而形成反馈键,如在PO43- 、ClO4- 、 SO42- 、 Cr2O72-、S2O82-中的反馈键称为d-p 配键;
配键
HO
P
3s 3p
d-p键
3d
HO P ← O → ← OH
O
2s 2p
→
2s 2p O的电子重排
2. 氧分子的成键特征
(1)氧分子结合1个电子
¯ 氧分子结合1个电子形成超氧离子O2,氧
的氧化数为- 1 ,如KO2。 2
2. 氧分子的成键特征
(2)氧分子结合2个电子 形成过氧离子O22- 或共价的过氧链-O-O-,氧
的氧化数为-1,离子型化合物如Na2O2、BaO2或
③生成的硫酸氢铵可循环使用;
