乳酸菌检测国标方法
乳酸测定的标准

乳酸测定的标准
乳酸测定的标准主要有以下几项:
- GB 5009.157-2016 食品安全国家标准食品中有机酸的测定,规定了食品中酒石酸、乳酸、苹果酸、柠檬酸、丁二酸、富马酸和己二酸的测定方法。
该标准适用于果汁及果汁饮料、碳酸饮料、固体饮料、胶基糖果、饼干、糕点、果冻、水果罐头等各类食品。
- GB 1886.173-2016 食品安全国家标准食品添加剂乳酸,适用于以淀粉或糖质为原料,采用乳酸杆菌或米根霉菌发酵而制得的食品添加剂乳酸。
这项标准于2017年开始实施,代替了之前的GB 2023-2003 食品添加剂乳酸。
乳酸菌的检验(7-8)

边缘整齐,直径为 1 mm+1mm,菌落背
菌落,可有淡淡的晕,直径为 2
面为黄色
mm+1mm,菌落背面为粉红色
萄糖为可发酵糖类;磷酸氢二钾为酸碱缓冲剂;柠檬酸氢三
铵、硫酸镁、硫酸锰、和醋酸钠为培养各种乳酸菌
提供各种无机盐;琼脂是培养基的凝固剂。
2
乳酸菌国家标准的解读
• 改良MRS培养基
将莫匹罗星锂盐(Li-Mupirocin)储备液加入到熔化MRS琼 脂培养基中,使培养基中莫匹罗星锂盐的浓度为50μg/mL。
乳酸菌发酵糖产酸使菌落周围碳酸钙溶解,以辨别乳酸菌; 中性红为pH指示剂。
2
乳酸菌国家标准的解读
菌属 乳杆菌
属
双歧杆 菌属
嗜热链 球菌
乳酸菌在 MRS 和 MC 培养基上的菌落特征
MRS 琼脂
MC 琼脂
菌落呈圆形,中等大小,凸起,微白 菌落较小,白色或淡粉色,边缘不太
色,湿润,边缘整齐,直径为
整齐,可有淡淡的晕,直径
选择性抑制剂-------抗生素
2
乳酸菌国家标准的解读
• MC培养基
大豆蛋白胨 5.0 g,牛肉粉 3.0 g,酵母粉 3.0 g,葡萄糖 20.0 g,乳糖 20.0 g,碳酸钙 10.0 g,琼脂 15.0 g,蒸馏水 1 000 mL,1%中性红溶液5.0 mL,pH6.0,蒸馏水1000mL
3mm+1mm,菌落背面为黄色
2mm+1mm,菌落背面为粉红色
兼性厌氧条件下不生长。在厌氧条件下 兼性厌氧条件下不生长。在厌氧条件
生长,菌落呈圆形,菌落中等大小,瓷 下生长,菌落较小,克有淡淡的晕,
乳酸菌国标的执行标准

乳酸菌是指一类在酸性环境下可以进行乳酸发酵的细菌。
在中国,乳酸菌产品的执行标准是由国家标准制定机构——中国国家标准化管理委员会(SAC)负责制定和管理的。
以下是乳酸菌产品的执行标准:
1.GB 19302-2010《食品安全国家标准乳酸菌饮品》:该标准规定
了乳酸菌饮品的分类、要求、检验方法、标签、包装、运输和
储存等方面的要求。
2.GB 19301-2010《食品安全国家标准乳酸菌发酵乳》:该标准规
定了乳酸菌发酵乳的分类、要求、检验方法、标签、包装、运
输和储存等方面的要求。
这些标准主要涵盖了乳酸菌产品的安全性、质量要求、生产工艺、包装和标签等方面的内容。
它们旨在确保乳酸菌产品的质量和安全性,以保护消费者的健康。
请注意,标准可能会根据时间而有所更新和修改。
因此,在具体操作中,建议参考最新的标准版本以确保遵守最新的要求。
可以咨询相关的标准化机构或访问官方标准化网站以获取最新的标准信息。
乳酸菌检测国标方法

乳酸菌检测国标方法乳酸菌检测方法1 适用范围本方法适用于清谷田园食品有限公司系列产品及原料中的乳酸菌的检测。
2 设备和仪器2.1 恒温培养箱:36±1℃2.2 天平:感量为0.01g2.3 无菌吸管:1 ml、2ml、10ml2.4 无菌锥形瓶:500ml2.5 无菌培养皿:直径为90mm2.6 无菌试管:18×180mm2.9 酒精灯2.10 立式蒸汽压力灭菌器2.11 超净工作台2.12 厌氧缸3试剂3.1 无菌生理盐水:称取8.5g氯化钠溶于1000ml蒸馏水中,121℃高压灭菌15min。
3.2 MRS(Man Rogosa Sharpe)培养基3.2.1 成分蛋白胨 10.0g牛肉粉 5.0g酵母粉 4.0g葡萄糖 20.0g吐温80 1.0mLK2HPO4.7H2O 2.0g醋酸钠.3H2O 5.0g柠檬酸三铵 2.0gMnSO4.7H2O 0.2gMnSO4.4H2O 0.05g琼脂粉 15g3.2.2制法:将上述成分加于1000mL蒸馏水中,调节PH至6.2±0.2,加热煮沸溶解,分装于锥形瓶中,在121℃高压灭菌15-20min。
3.3莫匹罗星锂盐(Li-Mupirocin)和半胱氨酸盐酸盐改良 MRS 培养基:3.3.1 莫匹罗星锂盐储备液制备:称取50mg莫匹罗星锂盐加入到50 mL蒸馏水中,用0.22 mm微孔滤膜过滤除菌。
3.3.2 半胱氨酸盐酸盐储备液制备:称取250mg莫匹罗星锂盐加入到50 mL 蒸馏水中,用0.22 mm微孔滤膜过滤除菌。
3.3.3 制法将A.1.1 成分加入到950 mL蒸馏水中,加热溶解,调节pH,分装后121 ℃高压灭菌15 min~20 min。
临用时加热熔化琼脂,在水浴中冷至48 ℃,用带有0.22 mm微孔滤膜的注射器将莫匹罗星锂盐储备液及半胱氨酸盐酸盐储备液制备加入到熔化琼脂中,使培养基中莫匹罗星锂盐的浓度为50 mg/mL,半胱氨酸盐酸盐的浓度为500 mg/mL。
乳酸菌检测方法

一、乳酸菌检测方法植物乳杆菌的检验1原理植物乳杆菌能在相应的厌氧培养条件下,于MRS培养基表面生长成白色、细密、圆形光滑突起的菌落,根据长出的菌落数和稀释倍数,计算出活菌数。
2仪器与试药2.1 仪器超净工作台、高压蒸汽灭菌器、恒温干燥箱、电冰箱、恒温培养箱(60℃±1℃)、恒温水浴锅、显微镜(10x—100x)、架盘天平(0—500g,精确至0.5g)、250ml锥形瓶、250ml 盐水瓶、灭菌吸管:1ml(具0.01ml刻度)、10ml(具0.1ml刻度)、灭菌平皿(直径90mm)、灭菌试管(15mm×160mm)、灭菌L型玻璃棒等。
2.2 试药酪蛋白胨、牛肉浸膏、酵母提取物、琼脂等均为生化试剂;无水乙酸钠、柠檬酸三胺、硫酸镁、硫酸锰、葡萄糖、磷酸氢二钾、碳酸钙、吐温-80、氯化钠等均为分析纯;水为双蒸馏水,其他化学试剂均为分析纯。
2.3 MRS琼脂培养基的组成与制备2.3.1培养基的组成酪蛋白胨10g、牛肉浸膏10g、酵母提取物5g、葡萄糖20g、无水乙酸钠5g、柠檬酸三胺3g、硫酸镁0.5g、硫酸锰0.2g、磷酸氢二钾2.0g、碳酸钙20g、吐温-801ml、琼脂15g、蒸馏水1000ml。
2.3.2培养基制备将上述的各组分在80~90℃加热使溶解,校正pH6.2,加蒸馏水至1000ml中,摇匀,分装于盐水瓶,每瓶100ml。
在121℃高压灭菌20分钟,冷却后备用。
2.4营养琼脂平板的制备取冷至45℃左右的MCA琼脂培养基,在无菌的条件下倒入无菌的培养皿中,每平皿各约15ml,待冷却凝固后,备用。
2.5无菌生理盐水的制备称取氯化钠9.0g,用蒸馏水溶解并定容于1000ml量瓶中,摇匀,分装于250ml三角瓶中,每瓶装90ml. 在121℃高压灭菌20分钟,冷却后备用。
3供试品溶液的制备以无菌操作法取检品10.0g,加入盛有90ml无菌生理盐的三角瓶中,充分振荡10分钟,制成1﹕10样品悬液。
食品安全国家标准 食品微生物学检验 乳酸菌检验

中华人民共和国国家标准G B4789.35 2016食品安全国家标准食品微生物学检验乳酸菌检验2016-12-23发布2017-06-23实施中华人民共和国国家卫生和计划生育委员会前言本标准代替G B4789.35 2010‘食品安全国家标准食品微生物学检验乳酸菌检验“㊁S N/T1941.1 2007‘进出口食品中乳酸菌检验方法第1部分:分离与计数方法“㊂本标准与G B4789.35 2010相比,主要变化如下:增加了乳酸菌总数计数培养条件的选择及结果说明;修改了改良M R S培养基成分;修改了平板计数的接种方法和接种量㊂食品安全国家标准食品微生物学检验乳酸菌检验1范围本标准规定了含乳酸菌食品中乳酸菌(l a c t i c a c i db a c t e r i a)的检验方法㊂本标准适用于含活性乳酸菌的食品中乳酸菌的检验㊂2术语和定义2.1乳酸菌l a c t i c a c i db a c t e r i a一类可发酵糖主要产生大量乳酸的细菌的通称㊂本标准中乳酸菌主要为乳杆菌属(L a c t o b a c i l l u s)㊁双歧杆菌属(B i f i d o b a c t e r i u m)和嗜热链球菌属(S t r e p t o c o c c u s)㊂3设备和材料除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:3.1恒温培养箱:36ħʃ1ħ㊂3.2冰箱:2ħ~5ħ㊂3.3均质器及无菌均质袋㊁均质杯或灭菌乳钵㊂3.4天平:感量0.01g㊂3.5无菌试管:18mmˑ180mm㊁15mmˑ100mm㊂3.6无菌吸管:1m L(具0.01m L刻度)㊁10m L(具0.1m L刻度)或微量移液器及吸头㊂3.7无菌锥形瓶:500m L㊁250m L㊂4培养基和试剂4.1生理盐水:见A.1㊂4.2 M R S(M a nR o g o s aS h a r p e)培养基及莫匹罗星锂盐(L i-M u p i r o c i n)和半胱氨酸盐酸盐(C y s t e i n eH y d r o c h l o r i d e)改良M R S培养基:见A.2和A.3㊂4.3 M C培养基(M o d i f i e dC h a l m e r s培养基):见A.4㊂4.40.5%蔗糖发酵管:见A.5㊂4.40.5%纤维二糖发酵管:见A.5㊂4.60.5%麦芽糖发酵管:见A.5㊂4.70.5%甘露醇发酵管:见A.5㊂4.80.5%水杨苷发酵管:见A.5㊂4.90.5%山梨醇发酵管:见A.5㊂4.100.5%乳糖发酵管:见A.5㊂4.11七叶苷发酵管:见A.6㊂4.12革兰氏染色液:见A.7㊂4.13莫匹罗星锂盐(L i-M u p i r o c i n):化学纯㊂4.14半胱氨酸盐酸盐(C y s t e i n eH y d r o c h l o r i d e):纯度>99%㊂5检验程序乳酸菌检验程序见图1㊂图1乳酸菌检验程序图6操作步骤6.1样品制备6.1.1样品的全部制备过程均应遵循无菌操作程序㊂6.1.2冷冻样品可先使其在2ħ~5ħ条件下解冻,时间不超过18h,也可在温度不超过45ħ的条件解冻,时间不超过15m i n㊂6.1.3固体和半固体食品:以无菌操作称取25g样品,置于装有225m L生理盐水的无菌均质杯内,于8000r/m i n~10000r/m i n均质1m i n~2m i n,制成1ʒ10样品匀液;或置于225m L生理盐水的无菌均质袋中,用拍击式均质器拍打1m i n~2m i n制成1ʒ10的样品匀液㊂6.1.4液体样品:液体样品应先将其充分摇匀后以无菌吸管吸取样品25m L放入装有225m L生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分振摇,制成1ʒ10的样品匀液㊂6.2 步骤6.2.1 用1m L 无菌吸管或微量移液器吸取1ʒ10样品匀液1m L ,沿管壁缓慢注于装有9m L 生理盐水的无菌试管中(注意吸管尖端不要触及稀释液),振摇试管或换用1支无菌吸管反复吹打使其混合均匀,制成1ʒ100的样品匀液㊂6.2.2 另取1m L 无菌吸管或微量移液器吸头,按上述操作顺序,做10倍递增样品匀液,每递增稀释一次,即换用1次1m L 灭菌吸管或吸头㊂6.2.3 乳酸菌计数6.2.3.1 乳酸菌总数乳酸菌总数计数培养条件的选择及结果说明见表1㊂表1 乳酸菌总数计数培养条件的选择及结果说明样品中所包括乳酸菌菌属培养条件的选择及结果说明仅包括双歧杆菌属按G B4789.34的规定执行仅包括乳杆菌属按照6.2.3.4操作㊂结果即为乳杆菌属总数仅包括嗜热链球菌按照6.2.3.3操作㊂结果即为嗜热链球菌总数同时包括双歧杆菌属和乳杆菌属1) 按照6.2.3.4操作㊂结果即为乳酸菌总数;2) 如需单独计数双歧杆菌属数目,按照6.2.3.2操作同时包括双歧杆菌属和嗜热链球菌1) 按照6.2.3.2和6.2.3.3操作,二者结果之和即为乳酸菌总数;2) 如需单独计数双歧杆菌属数目,按照6.2.3.2操作同时包括乳杆菌属和嗜热链球菌1) 按照6.2.3.3和6.2.3.4操作,二者结果之和即为乳酸菌总数;2) 6.2.3.3结果为嗜热链球菌总数;3) 6.2.3.4结果为乳杆菌属总数同时包括双歧杆菌属,乳杆菌属和嗜热链球菌1) 按照6.2.3.3和6.2.3.4操作,二者结果之和即为乳酸菌总数;2) 如需单独计数双歧杆菌属数目,按照6.2.3.2操作6.2.3.2 双歧杆菌计数根据对待检样品双歧杆菌含量的估计,选择2个~3个连续的适宜稀释度,每个稀释度吸取1m L 样品匀液于灭菌平皿内,每个稀释度做两个平皿㊂稀释液移入平皿后,将冷却至48ħ的莫匹罗星锂盐和半胱氨酸盐酸盐改良的M R S 培养基倾注入平皿约15m L ,转动平皿使混合均匀㊂36ħʃ1ħ厌氧培养72h ʃ2h ,培养后计数平板上的所有菌落数㊂从样品稀释到平板倾注要求在15m i n 内完成㊂6.2.3.3 嗜热链球菌计数根据待检样品嗜热链球菌活菌数的估计,选择2个~3个连续的适宜稀释度,每个稀释度吸取1m L 样品匀液于灭菌平皿内,每个稀释度做两个平皿㊂稀释液移入平皿后,将冷却至48ħ的M C 培养基倾注入平皿约15m L ,转动平皿使混合均匀㊂36ħʃ1ħ需氧培养72h ʃ2h ,培养后计数㊂嗜热链球菌在M C 琼脂平板上的菌落特征为:菌落中等偏小,边缘整齐光滑的红色菌落,直径2m mʃ1m m ,菌落背面为粉红色㊂从样品稀释到平板倾注要求在15m i n 内完成㊂6.2.3.4 乳杆菌计数根据待检样品活菌总数的估计,选择2个~3个连续的适宜稀释度,每个稀释度吸取1m L 样品匀液于灭菌平皿内,每个稀释度做两个平皿㊂稀释液移入平皿后,将冷却至48ħ的M R S 琼脂培养基倾注入平皿约15m L ,转动平皿使混合均匀㊂36ħʃ1ħ厌氧培养72h ʃ2h ㊂从样品稀释到平板倾注要求在15m i n 内完成㊂6.3菌落计数注:可用肉眼观察,必要时用放大镜或菌落计数器,记录稀释倍数和相应的菌落数量㊂菌落计数以菌落形成单位(c o l o n y-f o r m i n g u n i t s,C F U)表示㊂6.3.1选取菌落数在30C F U~300C F U之间㊁无蔓延菌落生长的平板计数菌落总数㊂低于30C F U 的平板记录具体菌落数,大于300C F U的可记录为多不可计㊂每个稀释度的菌落数应采用两个平板的平均数㊂6.3.2其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数;若片状菌落不到平板的一半,而其余一半中菌落分布又很均匀,即可计算半个平板后乘以2,代表一个平板菌落数㊂6.3.3当平板上出现菌落间无明显界线的链状生长时,则将每条单链作为一个菌落计数㊂6.4结果的表述6.4.1若只有一个稀释度平板上的菌落数在适宜计数范围内,计算两个平板菌落数的平均值,再将平均值乘以相应稀释倍数,作为每克或每毫升中菌落总数结果㊂6.4.2若有两个连续稀释度的平板菌落数在适宜计数范围内时,按式(1)计算:N=ðC(n1+0.1n2)d (1)式中:N 样品中菌落数;ðC 平板(含适宜范围菌落数的平板)菌落数之和;n1 第一稀释度(低稀释倍数)平板个数;n2 第二稀释度(高稀释倍数)平板个数;d 稀释因子(第一稀释度)㊂6.4.3若所有稀释度的平板上菌落数均大于300C F U,则对稀释度最高的平板进行计数,其他平板可记录为多不可计,结果按平均菌落数乘以最高稀释倍数计算㊂6.4.4若所有稀释度的平板菌落数均小于30C F U,则应按稀释度最低的平均菌落数乘以稀释倍数计算㊂6.4.5若所有稀释度(包括液体样品原液)平板均无菌落生长,则以小于1乘以最低稀释倍数计算㊂6.4.6若所有稀释度的平板菌落数均不在30C F U~300C F U之间,其中一部分小于30C F U或大于300C F U时,则以最接近30C F U或300C F U的平均菌落数乘以稀释倍数计算㊂6.5菌落数的报告6.5.1菌落数小于100C F U时,按 四舍五入 原则修约,以整数报告㊂6.5.2菌落数大于或等于100C F U时,第3位数字采用 四舍五入 原则修约后,取前2位数字,后面用0代替位数;也可用10的指数形式来表示,按 四舍五入 原则修约后,采用两位有效数字㊂6.5.3称重取样以C F U/g为单位报告,体积取样以C F U/m L为单位报告㊂7结果与报告根据菌落计数结果出具报告,报告单位以C F U/g(m L)表示㊂8乳酸菌的鉴定(可选做)8.1纯培养挑取3个或以上单个菌落,嗜热链球菌接种于M C琼脂平板,乳杆菌属接种于M R S琼脂平板,置36ħʃ1ħ厌氧培养48h㊂8.2鉴定8.2.1双歧杆菌的鉴定按G B4789.34的规定操作㊂8.2.2涂片镜检:乳杆菌属菌体形态多样,呈长杆状㊁弯曲杆状或短杆状㊂无芽胞,革兰氏染色阳性㊂嗜热链球菌菌体呈球形或球杆状,直径为0.5μm~2.0μm,成对或成链排列,无芽胞,革兰氏染色阳性㊂8.2.3乳酸菌菌种主要生化反应见表2和表3㊂表2常见乳杆菌属内种的碳水化合物反应菌种七叶苷纤维二糖麦芽糖甘露醇水杨苷山梨醇蔗糖棉子糖干酪乳杆菌干酪亚种(L.c a s e i s u b s p.c a s e i)+++++++-德氏乳杆菌保加利亚种(L.de l b r u e c k i is u b s p.b u l g a r i c u s)--------嗜酸乳杆菌(L.a c i d o p h i l u s)+++-+-+d 罗伊氏乳杆菌(L.r e u t e r i)N D-+---++鼠李糖乳杆菌(L.r h a m n o s u s)+++++++-植物乳杆菌(L.p l a n t a r u m)++++++++注:+表示90%以上菌株阳性;-表示90%以上菌株阴性;d表示11%~89%菌株阳性;N D表示未测定㊂表3嗜热链球菌的主要生化反应菌种菊糖乳糖甘露醇水杨苷山梨醇马尿酸七叶苷嗜热链球菌(S.t h e r m o p h i l u s)-+-----注:+表示90%以上菌株阳性;-表示90%以上菌株阴性㊂附录A培养基及试剂A.1生理盐水A.1.1成分N a C l8.5gA.1.2制法将上述成分加入到1000m L蒸馏水中,加热溶解,分装后121ħ高压灭菌15m i n~20m i n㊂A.2M R S培养基A.2.1成分蛋白胨10.0g牛肉粉5.0g酵母粉4.0g葡萄糖20.0g吐温801.0m LK2H P O4㊃7H2O2.0g醋酸钠㊃3H2O5.0g柠檬酸三铵2.0gM g S O4㊃7H2O0.2gM n S O4㊃4H2O0.05g琼脂粉15.0gA.2.2制法将上述成分加入到1000m L蒸馏水中,加热溶解,调节p H至6.2ʃ0.2,分装后121ħ高压灭菌15m i n~20m i n㊂A.3莫匹罗星锂盐和半胱氨酸盐酸盐改良M R S培养基A.3.1莫匹罗星锂盐储备液制备:称取50m g莫匹罗星锂盐加入到50m L蒸馏水中,用0.22μm微孔滤膜过滤除菌㊂A.3.2半胱氨酸盐酸盐储备液制备:称取250m g半胱氨酸盐酸盐加入到50m L蒸馏水中,用0.22μm微孔滤膜过滤除菌㊂A.3.3制法将A.2.1成分加入到950m L蒸馏水中,加热溶解,调节p H,分装后121ħ高压灭菌15m i n~20m i n㊂临用时加热熔化琼脂,在水浴中冷至48ħ,用带有0.22μm微孔滤膜的注射器将莫匹罗星锂盐储备液及半胱氨酸盐酸盐储备液制备加入到熔化琼脂中,使培养基中莫匹罗星锂盐的浓度为50μg/m L,半胱氨酸盐酸盐的浓度为500μg/m L㊂A.4M C培养基A.4.1成分大豆蛋白胨5.0g牛肉粉3.0g酵母粉3.0g葡萄糖20.0g乳糖20.0g碳酸钙10.0g琼脂15.0g蒸馏水1000m L1%中性红溶液5.0m LA.4.2制法将前面7种成分加入蒸馏水中,加热溶解,调节p H至6.0ʃ0.2,加入中性红溶液㊂分装后121ħ高压灭菌15m i n~20m i n㊂A.5乳酸杆菌糖发酵管A.5.1基础成分牛肉膏5.0g蛋白胨5.0g酵母浸膏5.0g吐温800.5m L琼脂1.5g1.6%溴甲酚紫酒精溶液1.4m L蒸馏水1000m LA.5.2制法按0.5%加入所需糖类,并分装小试管,121ħ高压灭菌15m i n~20m i n㊂A.6七叶苷培养基A.6.1成分蛋白胨5.0g磷酸氢二钾1.0g七叶苷3.0g枸橼酸铁0.5g1.6%溴甲酚紫酒精溶液1.4m L蒸馏水100m LA.6.2制法将上述成分加入蒸馏水中,加热溶解,121ħ高压灭菌15m i n~20m i n㊂A.7革兰氏染色液A.7.1结晶紫染色液A.7.1.1成分结晶紫1.0g95%乙醇20m L1%草酸铵水溶液80m LA.7.1.2制法将结晶紫完全溶解于乙醇中,然后与草酸铵溶液混合㊂A.7.2革兰氏碘液A.7.2.1成分碘1.0g碘化钾2.0g蒸馏水300m LA.7.2.2制法将碘与碘化钾先进行混合,加入蒸馏水少许充分振摇,待完全溶解后,再加蒸馏水至300m L㊂A.7.3沙黄复染液A.7.3.1成分沙黄0.25g95%乙醇10m L蒸馏水90m LA.7.3.2制法将沙黄溶解于乙醇中,然后用蒸馏水稀释㊂A.7.4染色法A.7.4.1将涂片在酒精灯火焰上固定,滴加结晶紫染色液,染1m i n,水洗㊂A.7.4.2滴加革兰氏碘液,作用1m i n,水洗㊂A.7.4.3滴加95%乙醇脱色,约15s~30s,直至染色液被洗掉,不要过分脱色,水洗㊂A.7.4.4滴加复染液,复染1m i n㊂水洗㊁待干㊁镜检㊂。
GB-T 16347-1996 乳酸菌饮料中乳酸菌的微生物学检验

GB-T 16347-1996 乳酸菌饮料中乳酸菌的微生物学检验GB/T 16347-1996乳酸菌饮料中乳酸菌的微生物学检验Microbiological examination oflactic acid bacteria in yoghurt beverage1 主题内容与适用范畴本标准规定了乳酸菌饮料中乳酸菌检验的技术要求。
本标准适用于以鲜乳、乳粉或辅以大豆等为原料,经乳酸菌发酵加工制成的具有相应风味的活性乳酸菌饮料。
2 引用标准GB 4789.28 食品卫生微生物学检验染色法、培养基和试剂3 术语乳酸菌:一群能分解葡萄糖或乳糖产生乳酸,需氧和兼性厌氧,多数无动力,过氧化氢酶阴性,革兰氏阳性的无芽胞杆菌和球菌。
乳酸菌菌落总数:检样在一定条件下培养后,所得1mL检样中所含乳酸菌菌落的总数。
4 设备和材料4.3 恒温水浴:46±1℃。
4.4 电炉:可调式。
4.5 吸管:容量为1,10和25mL。
4.6 广口瓶或三角瓶:容量为500mL。
4.7 平皿:直径为9cm。
4.8 试管:18 ×180mm。
4.9 显微镜。
5 培养基和试剂5.1 改良TJA培养基(改良番茄汁琼脂培养基)。
5.2 改良MC培养基(Modified Chalmers培养基)5.3 0.1%美兰牛乳培养基。
5.46.5%氯化钠肉汤。
5.5 pH9.6葡萄糖肉汤。
5.6 40%胆汁肉汤。
5.7 淀粉水解培养基。
5.8 精氨酸水解培养基。
5.9 乳酸杆菌糖发酵管。
5.10 七叶苷培养基。
5.11 革兰氏染色液:按GB 4789.28规定执行。
5.12 3%过氧化氢溶液:按GB 4789.28规定执行。
5.13 蛋白胨水、靛基质试剂:按GB 4789.28规定执行。
5.14 明胶培养基:按GB 4789.28规定执行。
5.15 硝酸盐培养基、硝酸盐试剂:按GB 4789.28规定执行。
5.16 生理盐水:定量分装于三角瓶和试剂管内灭菌。
乳酸菌活菌数量检测方法--菌落计数法

乳酸菌活菌数量检测方法--菌落计数法本方法适用于乳酸菌制剂及配合饲料中有效活菌数和杂菌率的测定。
按照国家标准GB/T 14699.1进行抽样,获得样品200g,分装于两个无菌、干燥的玻璃瓶中,贴上标签,注明产品名称、批号、取样日期等信息。
一瓶供检验用,一瓶密封保,以备复查。
一、测定原理:乳酸肠球菌用肠球菌琼脂培养基,杂菌用营养琼脂培养基;培养后利用平板菌落计数法进行计数。
二、培养基与缓冲液配方:(1)营养琼脂培养基,每L蛋白胨 10.0g 牛肉膏 3.0g 氯化钠 5.0g 琼脂 18.0g 水稀释至1000ml PH 7.0~7.4(2)肠球菌琼脂培养基,每L蛋白胨 20.0g蔗糖 5.0g 葡萄糖 5.0g 乳糖 5.0g 酵母膏 5.0g氯化钠 4.0g 乙酸钠 1.5gVc 0.5g 琼脂 17.0g 水稀释至1000mlPH 6.5~7.0(3)PH6.8磷酸缓冲液配制方法取0.2mol/L磷酸二氢钾溶液250ml,加0.2mol/L氢氧化钠溶液118ml,用水稀释至1000ml,摇匀即得。
三、样品处理:(1)乳酸菌纯品制剂样品测定乳酸菌纯品制剂时,取样量为1g,溶解到100ml缓冲液中,缓冲液与样品的比例为100:1。
(2)配合饲料样品测定饲料样品时,取样量为25g,溶解到225ml缓冲液中,缓冲液与样品的比例为10:1。
四、有效活菌数、杂菌数的测定:(1)本方法采用平板菌落计数法(2)操作方法:1.取磁力搅拌棒装入500ml三角瓶中,再量225ml PH6.8的磷酸缓冲液一并装入三角瓶中灭菌备用。
纯品制剂量取缓冲液100ml。
2.取25g饲料样品放入三角瓶中,在磁力搅拌器中震荡混匀5min后,再放到摇床上37℃,150转/分,充分震荡45min,混匀成1:10稀释液。
纯品制剂样品量为1g,混匀成1:100稀释液。
3.在超净工作台内用灭菌的1.5ml离心管,按10倍比稀释法稀释。
用移液器吸取上述混悬液100ul,注入含有900ul缓冲液的离心管内,并在液体中反复吹打5次,在漩涡振荡器上震荡30s混匀(注意每次稀释时更换枪头及充分震荡混匀)。
实验一乳酸菌饮料中乳酸菌的微生物检验

引言概述:乳酸菌饮料是一种富含乳酸菌的食品,乳酸菌在食品工业中广泛应用于酸奶、乳饮料等产品中。
本文将详细介绍乳酸菌饮料中乳酸菌的微生物检验方法。
正文内容:一、样品采集和制备1.确定样品采集时机:乳酸菌饮料中的乳酸菌数量会随着储存时间的增加而增加或减少,因此需要在存储时间稳定的情况下进行采集。
2.采集样品方法:使用无菌技术采集样品,避免外部微生物的污染。
3.样品制备:将采集到的样品进行均匀搅拌,以保证样品的均匀性。
二、总菌数检验方法1.琼脂平板法:将样品制备成一定稀释倍数的悬浮液,在琼脂平板上涂布,经过一定孵育时间后,根据菌落的数量计算总菌数。
2.膜过滤法:将样品通过膜过滤器过滤,将过滤后的膜放置在琼脂平板上孵育,根据菌落的数量计算总菌数。
三、乳酸菌检验方法1.培养基选择:根据乳酸菌的生长特性选择适合的培养基,常见的培养基有MRS培养基、LBS培养基等。
2.乳酸菌的分离:将样品制备成一定稀释倍数的悬浮液,均匀涂布在选定的培养基上。
经过一定孵育时间后,可以观察到乳酸菌形成的菌落。
3.鉴定乳酸菌:使用形态学观察、生理生化试验和分子生物学方法等进行乳酸菌的鉴定。
四、活菌数检验方法1.孵育培养基法:将样品制备成一定稀释倍数的悬浮液,均匀涂布在含有乳酸菌生长所需营养物质的培养基上。
经过一定孵育时间后,观察活菌的生长情况,计算活菌数。
2.阻碍培养基法:将样品制备成一定稀释倍数的悬浮液,与含有抑制剂的培养基混合。
通过观察生长情况,计算活菌数。
五、质量指标评价方法1.pH值测定:使用pH计或试纸对乳酸菌饮料中的pH值进行测定,根据标准范围评价产品的质量。
2.乳酸浓度测定:使用乳酸测定仪器或化学试剂对乳酸菌饮料中的乳酸浓度进行测定,根据标准范围评价产品的质量。
3.品尝评价:通过专业的品尝人员进行品尝评价,评估乳酸菌饮料的口感和风味。
总结:乳酸菌饮料中乳酸菌的微生物检验方法包括样品采集和制备、总菌数检验、乳酸菌检验、活菌数检验和质量指标评价方法。
乳酸菌检验方法

河北世翔生物有限公司乳酸菌检验方法前言1.本检验方法针对公司各种形式(固态、液态)的乳酸菌菌微生物添加剂;2.本标准的制定依据GBT 23181-2008 、SNT 1941.1-2007、GB 478935-2010等国家标准制定;3.本标准由研发部起草,经公司总经理批准,公布之日起实施。
一、检验前的准备1.培养基及其试剂1.1盛有若干玻璃珠的无菌水225ml,1.2MRS琼脂培养基:牛肉膏10g蛋白胨10g酵母膏5g121℃,灭菌15-20min1.3培养皿12个,试管12个,涂布棒1个,用报纸包扎后灭菌1.4打开超净工作台,用消毒水或者酒精喷洒,工作台台面,打开紫外灯杀菌30分钟,打开风机,5分钟后,打开照明二、取样按照GB/T14699.1进行取样:用灭菌的铲子,选取有代表性的样品适量放入取样袋中,标注好取样日期,批次备用;液体取样使用灭菌的试管,在火焰保护下进行,完成后放入低温冰箱储藏。
三、检测步骤1. 以无菌操作称取试样25g(ml),加入225ml有玻璃珠的无菌水中,放在摇床上,200r/min,摇动30min,制成1:10的初始菌悬浮液。
取1:10的初始菌悬浮液0.5ml,加入4.5ml无菌水,经充分混匀后,制成1:100的稀释液。
依次方法依次稀释到1:1082.选择107 、108 二个稀释度,用移液枪分别吸取0.1ml,接种到3个营养琼脂平板上,使用涂布棒尽可能小心快速地涂布接种液于琼脂表面,涂布棒不得接触平皿边缘,涂布好的平皿改好,置室温中放置15min使接种物完全被琼脂吸收。
翻转上述平皿置于36±1℃培养箱中培养48±2h。
从样品稀释到涂布完成要求在15分钟内完成。
3.培养后,选取菌落数在30到300个之间的平板计数,低于30 CFU 平板记录具体菌落数,大于300 CFU 的可记录为多不可计。
每个稀释度的菌落数应采用两个平板的平均数。
若平板中有较大片状菌落生长时,则不宜计数;若片状菌落步不到平板的一半,而其余一半分布又很均匀,即可计算半个平板后乘以2以代表全皿菌落数。
乳酸菌的培养检测方案

品质管理检测项目细菌形态学分类一乳酸杆菌乳酸杆菌的基本属性:乳酸菌为一群可发酵碳水化合物以获取能量,并生成大量乳酸的一类细菌的总称。
利用发酵技术保藏食品,最典型的是通过乳酸菌的发酵。
这在发酵乳工业中已经得到广泛的应用。
利用天然的或经筛选的乳酸菌发酵,已经生产出多种不同类型的发酵乳。
因而分离和鉴定乳酸菌对人类的生产和生活都具有非常重要的意义。
无芽孢,革兰氏染色呈阳性。
微好氧,厌氧发酵,最适温度30~40摄氏度,最适PH值为5.5~6.2,在微酸环境下可以生长,中性或者偏碱性环境中则生长速率下降。
在固体培养基上培养时,通常厌氧条件或者减少氧气压力和充有体积分数为5%~10%的CO2可以增加其表面生长物,有些菌株在分离时就是厌氧的。
(一)实验仪器和试剂:实验仪器:现有的仪器:欠缺的仪器:培养基和试剂:①培养基:BCP培养基、MRS培养基和SL培养基BCP培养基:酵母膏2 5g,蛋白胨5g,葡萄糖5g,溴甲酚紫0.04g,琼脂15g,蒸馏水lO00ml,pH7 0;MRS培养基(可以培养包括双岐乳杆菌、嗜酸乳杆菌和干酪乳杆菌):重量(g) 牛肉蛋白粉10 ,鱼肉汁10 ,酵母浸出汁粉5 ,葡萄糖20 ,醋酸钠5 ,柠檬酸二铵 2 ,吐温80 0.1 ,硫酸镁0.58 ,硫酸锰0.28 ,蒸溜水1 000ml ,备注:用高压锅在121℃灭菌15min,调节pH6.2~6.4 。
乳酸杆菌选择性琼脂SL:酪蛋白水解物10g;酵母提取物5g;柠檬酸二铵2g;乙酸钠(CH3COONa?3H2O)25g;MgSO4?7H2O 0.58g;琼脂15g;葡萄糖20g;吐温80 1.0ml;磷酸氢二钾6g;FeSO4?7H2O 0.03g;MnSO4?4H2O 0.15g。
以上用量为1000ml培养基的用量。
溶解琼脂在500ml的沸水中,溶解其他组分在500ml的水中,用冰醋酸调pH=5.4,并混合已融化的琼脂,进一步煮沸5分钟,倾倒平板或此热的培养基适量分装入灭菌的试管,这样无需进一步灭菌,避免重复融化和冷却。
乳酸菌检验的方法要点

乳酸菌检验的方法要点乳酸菌不是分类学上的名称,它是指一群能分解葡萄糖或乳糖产生乳糖产生乳酸、需氧和兼性厌氧、多数无动力、过氧化氢酶阴性、革兰氏阳性的无芽孢杆菌和球菌。
这类细菌在自然界分布广泛,可栖居在人和各种动物的口腔、肠道等器官内,在土壤、食品、饲料、水及一些临床标本中都有乳酸菌的存在。
乳酸菌在工业、农业和医药等与人类生活密切相关的领域应用价值很高,相当多的乳酸菌对人、畜的健康起着有益的作用,但个别菌种能对人畜致病,乳酸菌主要包括23个属的细菌。
乳酸菌的检测流程:1、乳酸菌悬液的制备:将待检测的样品,准确称取0.5克,量取99.5mL无菌生理盐水稀释,(此次稀释了200倍,即0.5克样品,稀释到了100克水溶液),再加入灭菌玻璃珠20~30粒于250mL三角瓶中,置于振荡器或摇床上剧烈摇晃30分钟以上,目的是将粘连在一起的乳酸菌细胞打散从而分散开来。
2、稀释到适当倍数:根据所待检测的样品可能的乳酸菌含量,进行适当的稀释操作,例如如果估计样品的含乳酸菌活菌数为200亿/克左右,则建议稀释2亿倍,这样将来在90mm平板上培养时会长出大约100个乳酸菌落,比较便于计数,总之控制平板培养皿上的乳酸菌落数量在30~300个的范围内,比较便于计数。
3、倒制平板即“接种”:倒制平板在超净工作台上进行,养殖户可使用一盏简单的酒精灯和一个干净的操作台就可操作。
即事先配制好并灭菌处理的检测用琼脂培养基,在水浴锅内保持50℃的温度,使琼脂培养基呈溶解状态,置于操作台旁边备用。
(养殖户可先不从压力锅中取出,在压力锅维持一定的温度,从而也不会凝固。
)取事先干热灭菌处理后的90mm培养皿(也叫平板)若干、1mL移液管若干,置于操作台上备用。
(养殖户的培养皿平板可在压力锅中进行蒸汽灭菌处理。
)在无菌条件下(打开超净工作台无菌风,或养殖户点上酒精灯),将稀释了2亿倍的乳酸菌液,用移液管移取1mL,于培养皿中,再在此培养皿中倒入前述保持溶解状态的检测培养基液15mL左右(倒培养基时,估计能覆盖满平皿的液体量即可),然后,盖好培养皿盖,轻轻转动平皿,原地转几圈,使培养基液与乳酸菌液混合均匀,等数分钟后,待培养基凝固后,可移入培养箱中进行培养;4、在培养箱中进行培养:将前面倒制好的平板倒转(即盖子在下面),放于培养箱中于33℃温度下培养2~3天,待培养皿平板中长出比较明显的带有透明圈的菌落时,即可进行计数得出检测结果。
乳酸菌计算活菌数培养基国标

乳酸菌计算活菌数培养基国标乳酸菌是一类广泛存在于自然界中的细菌,具有很高的益生作用。
在食品工业中,乳酸菌被广泛应用于发酵食品的制作中,如酸奶、乳酸菌饮料等。
为了保证发酵食品的品质和安全性,需要对乳酸菌进行活菌数的检测。
而乳酸菌活菌数的检测方法和标准在我国被统一为《乳酸菌活菌数测定方法》(GB 4789.38-2016)。
乳酸菌活菌数的测定方法主要包括直接计数法和间接计数法两种。
直接计数法是通过显微镜观察乳酸菌在培养基上的菌落数来进行活菌数的估计。
间接计数法则是通过测定乳酸菌产生的酸度或气体量来间接反映活菌数。
在进行乳酸菌活菌数测定之前,首先需要准备好培养基。
培养基的选择对乳酸菌的生长和繁殖起着至关重要的作用。
常用的培养基有MRS培养基、LBS培养基等。
这些培养基能提供乳酸菌所需的营养物质,并且能够抑制其他细菌的生长。
接下来是乳酸菌的接种和培养。
将待测样品接种到培养基上,并且在适宜的温度下进行培养。
乳酸菌的适宜生长温度一般在35℃左右。
在培养的过程中,乳酸菌会利用培养基中的营养物质进行生长和繁殖,最终形成可见的菌落。
乳酸菌活菌数的测定可以通过直接计数法进行。
将培养基上的菌落取出,制备菌悬液后,使用显微镜观察菌落中的乳酸菌数量。
在显微镜下观察时,可以使用乳酸菌特异性染色剂来染色,以便更好地观察和计数。
通过计算所观察到的菌落数和稀释倍数,最终可以得出乳酸菌活菌数的估计值。
除了直接计数法,间接计数法也是一种常用的测定乳酸菌活菌数的方法。
其中,酸度测定法是一种常用的间接计数法。
乳酸菌在发酵过程中会产生乳酸,从而使培养基的酸度增加。
通过测定培养基的酸度变化,可以间接反映出乳酸菌的活菌数。
利用酸度计或pH计进行测定,可以得到乳酸菌活菌数的近似值。
乳酸菌活菌数的测定方法在GB 4789.38-2016中还规定了一些其他的注意事项。
比如,在进行直接计数法时,要求在菌落形成之前进行计数,以避免菌落过大或过小对计数结果的影响。
GB4789. 35乳酸菌检验

食品安全国家标准
食品微生物学检验 食品中乳酸菌检验
GB 4789.35-2010
定义
GB/T 4789.35-2007: 检验方法有三部分: 第1部分:分离与计数方法; 第2部分:PetrifilmTM测试片法; 第3部分:乳杆菌的PCR法
SN标准
GB/T 4789.35-2008 乳酸菌饮料中乳酸菌检验修订
本标准与GB/T 4789.35-2003相比主要修 改如下: ——将选择性分离培养基由改良TJA 培养基 (改良番茄汁琼脂培养基)改为MRS培养基; ——增加API 50CH 诊断试剂条; ——乳酸菌计数由倾注法改为涂布法。
乳酸菌计数
乳杆菌计数 乳酸菌总数结果减去 双歧杆菌与 嗜热链球 菌计数结果之和即得乳杆菌计数。
报告(GB/T4789.35-2008)
根据菌落计数结果出具检测报告。最终确定 的乳酸菌菌落在30~300之间的平板计数, 再乘以相应的稀释倍数,修约保留两位有效 数字,之后的数字,采用10的指数表示。参 照GB/T 4789.2规定。每克(或毫升)食品 中所含有的乳酸菌数以CFU/g(mL)表示。
结果的表述
7.4.1 若只有一个稀释度平板上的菌落数在 适宜计数范围内,计算两个平板菌落数的平 均值,再将平均值乘以相应稀释倍数,作为 每g(mL)中菌落总数结果。 7.4.2 若有两个连续稀释度的平板菌落数在 适宜计数范围内时,按公式(1)计算:
7.4.3 若所有稀释度的平板上菌落数均大于300 CFU,则对稀释度最高的平板进行计数,其他平 板可记录为多不可计,结果按平均菌落数乘以 最高稀释倍数计算。 7.4.4 若所有稀释度的平板菌落数均小于30 CFU,则应按稀释度最低的平均菌落数乘以稀释 倍数计算。 7.4.5 若所有稀释度(包括液体样品原液)平 板均无菌落生长,则以小于1 乘以最低稀释倍 数计算。 7.4.6 若所有稀释度的平板菌落数均不在30 CFU~300 CFU 之间,其中一部分小于30 CFU 或大于300CFU 时,则以最接近30 CFU 或300 CFU 的平均菌落数乘以稀释倍数计算。
乳酸菌的检测

乳酸菌是指一群能分解葡萄糖或乳糖产生乳酸,需氧和兼性厌氧,多数无动力,过氧化氢酶阴性,革兰氏阳性的无芽胞杆菌和球菌。
这类细菌在自然界分布广泛,可栖居在人和各种动物的口腔、肠道等器官内,在土壤、食品、饲料、水及一些临床标本中都有乳酸菌的存在。
乳酸菌在工业、农业和医药等与人类生活密切相关的领域应用价值很高,相当多的乳酸菌对人、畜的健康起着有益的作用,但个别菌种能对人畜致病,乳酸菌主要包括23个属的细菌。
二样本采集检样主要为含乳酸菌活菌的饮料和微生态制剂,样本应放入冰箱保存,心快检验。
三检验方法(中华人民共和国国家标准乳酸菌饮料中乳酸菌的微生物学检验GB/T 16347-1996)乳酸菌菌总数的测定:乳酸菌菌落总数是指标样在一定条件下培养后,所得1ml检样中所含乳酸菌菌落的总数。
(一)检验程序乳酸菌菌落总数检验程序如下:(二)培养基和试剂改良TJA培养基(改良番茄汁琼脂培养基);改良MC培养基(modified Chalmers培养基);0.1%亚甲蓝牛乳培养基;6.5%氯化钠肉汤参照;pH9.6葡萄糖肉汤;40%胆汁肉汤;淀粉水解培养基;精氨酸水解培养基;乳酸杆菌糖发酵管;七叶苷培养基;革兰氏染色液;3%过氧化氢溶液;蛋白胨水、靛基质试剂;明胶培养基;硝酸盐培养基、硝酸盐试剂;生理盐水:定量分装于三角瓶和试管内灭菌。
(三)操作步骤1.以无菌操作将经过充分摇匀的检样25ml(或25g)放入含有225ml灭菌生理盐水的来菌广口瓶内做成1:10的均匀稀释液。
2.用1ml灭菌吸管吸取1:10稀释液1m,沿管壁徐徐注入含有9ml灭菌生理盐水的试管内(注意吸管尖端不要触及管内稀释液)。
3.另取1ml灭菌吸管,按上述操作顺序,作10倍增稀释液,如此每递增一次,即换用1支1ml灭菌吸管。
4.选择2~3个以上适宜稀释度,分别在作10倍递增稀释的同时,即以吸取该稀释度的吸管移1ml稀释液于灭菌平皿内,每个稀释度作两个平皿。
新版乳酸菌的测定2

一、编制目的为规范单位对食品乳酸菌的检验方法,编制本指导书。
二、适用范围本指导书适用于食品乳酸菌的测定三、编制依据GB 4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验》四、设备和材料4.1 冰箱:2℃~5℃;4.2 恒温培养箱:36℃±1℃;4.3均质器及无菌均质袋、均质杯或灭菌乳钵;4.4天平:感量0.1g;4.5无菌试管:18mm×180mm、15mm×100mm;4.6无菌吸管:1ml(具0.01ml刻度)、10ml(具0.1ml刻度)或微量移液器及吸头;4.7无菌锥形瓶:500mL、250mL。
五、培养基和试剂5.1 MRS培养基及莫匹罗星锂盐改良MRS培养基;5.2 MC培养基;5.3 0.5%蔗糖发酵管;5.4 0.5%纤维二糖发酵管;5.5 0.5%麦芽糖发酵管;5.6 0.5%甘露醇发酵管;5.7 0.5%水杨苷发酵管;5.8 0.5%山梨醇发酵管;5.9 0.5%乳糖发酵管;5.10七叶苷发酵管;5.11革兰氏染色液;5.12莫匹罗星锂盐。
六、检验程序七、操作步骤7.1样品制备7.1.1样品的全部制备过程均应遵循无菌操作程序。
7.1.2 冷冻样品可先使其在 2℃~5℃条件下解冻,时间不超过18h,也可在温度不超过45℃的条件解冻,时间不超过 15 min。
7.1.3 固体和半固体食品:以无菌操作称取25 g 样品,置于装有 225 mL 生理盐水的无菌均质杯内,以8000r/min~10000r/min 均质1min~2 min ,制成 1:10 样品匀液;或置225mL生理盐水的无菌均质袋中,用拍击式均质器拍打1min~2min制成1:10的样品匀液。
7.1.4 液体样品:液体样品应先将其充分摇匀后以无菌吸管吸取样品25 mL放入装有225 mL生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分振摇,制成 1:10 的样品匀液。
食品微生物检验技术W5202乳酸菌检验—国标解读与检验准备-4-微教材
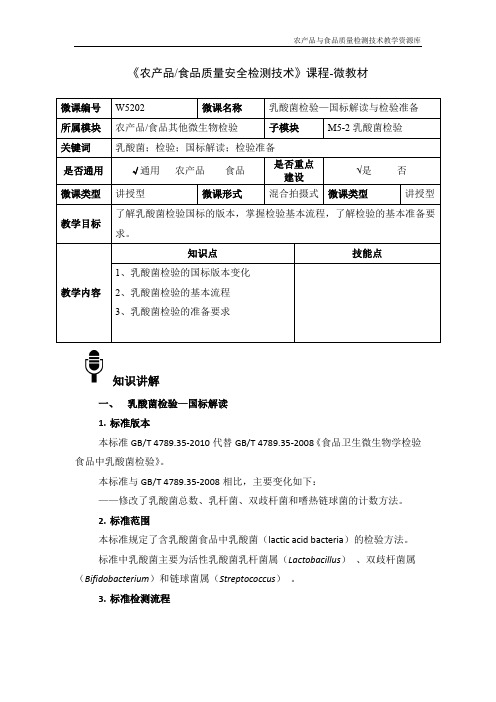
《农产品/食品质量安全检测技术》课程-微教材知识讲解一、乳酸菌检验—国标解读1.标准版本本标准GB/T 4789.35-2010代替GB/T 4789.35-2008《食品卫生微生物学检验食品中乳酸菌检验》。
本标准与GB/T 4789.35-2008相比,主要变化如下:——修改了乳酸菌总数、乳杆菌、双歧杆菌和嗜热链球菌的计数方法。
2.标准范围本标准规定了含乳酸菌食品中乳酸菌(lactic acid bacteria)的检验方法。
标准中乳酸菌主要为活性乳酸菌乳杆菌属(Lactobacillus)、双歧杆菌属(Bifidobacterium)和链球菌属(Streptococcus)。
3.标准检测流程二、乳酸菌检验—检验准备1.实验设备乳酸菌检验用到的实验设备主要有:电子天平、涡旋振荡器、超净工作台、恒温培养箱。
2.实验用具乳酸菌检验用到的实验用具有:样品罐(含225ml生理盐水)、无菌试管(含9ml生理盐水)、微量移液枪及吸头、涂布棒、厌氧培养罐(含厌氧培养产气剂)。
本实验采用日本三菱MGC公司的AnaeroPack系列产品厌氧罐,其配套的氧气指示剂可重复使用4-5次,在O2<0.1%的无氧状态下,呈浅紫色到粉红色;在O2>0.5%有氧状态下,呈浅蓝色到深蓝色。
3.培养基及试剂乳酸菌检验用到的培养基及试剂有:(1)MRS培养基,一种适合各种乳酸菌生长的通用培养基,用于乳酸菌的分离及计数。
(2)莫匹罗星锂盐改良MRS(简称改良MRS)培养基,一种用于食品中双歧杆菌的分离培养或计数的培养基。
莫匹罗星锂盐是一种用于筛选双歧杆菌的用剂,需在临用时用0.22 μm微孔滤膜过滤除菌后加入熔化的琼脂培养基中。
(3)MC 培养基,一种用于乳酸球菌的分离培养或计数的培养基。
乳酸菌发酵糖产酸使菌落周围碳酸钙溶解,以辨别乳酸菌;中性红为pH 指示剂。
乳酸球菌在本培养基上典型特征为红色,有明显溶钙环。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乳酸菌检测方法
1 适用范围
本方法适用于清谷田园食品有限公司系列产品及原料中的乳酸菌的检测。
2 设备和仪器
2.1 恒温培养箱:36±1℃
2.2 天平:感量为0.01g
2.3 无菌吸管:1 ml、2ml、10ml
2.4 无菌锥形瓶:500ml
2.5 无菌培养皿:直径为90mm
2.6 无菌试管:18×180mm
2.9 酒精灯
2.10 立式蒸汽压力灭菌器
2.11 超净工作台
2.12 厌氧缸
3试剂
3.1 无菌生理盐水:称取8.5g氯化钠溶于1000ml蒸馏水中,121℃高压灭菌15min。
3.2 MRS(Man Rogosa Sharpe)培养基
3.2.1 成分蛋白胨 10.0g
牛肉粉 5.0g
酵母粉 4.0g
葡萄糖 20.0g
吐温80 1.0mL
K2HPO4.7H2O 2.0g
醋酸钠.3H2O 5.0g
柠檬酸三铵 2.0g
MnSO4.7H2O 0.2g
MnSO4.4H2O 0.05g
琼脂粉 15g
3.2.2制法:将上述成分加于1000mL蒸馏水中,调节PH至6.2±0.2,加热煮沸溶解,分装于锥形瓶中,在121℃高压灭菌15-20min。
3.3莫匹罗星锂盐(Li-Mupirocin)和半胱氨酸盐酸盐改良 MRS 培养基:
3.3.1 莫匹罗星锂盐储备液制备:称取50mg莫匹罗星锂盐加入到50 mL蒸馏水中,用0.22 mm微孔滤膜过滤除菌。
3.3.2 半胱氨酸盐酸盐储备液制备:称取250mg莫匹罗星锂盐加入到50 mL 蒸馏水中,用0.22 mm微孔滤膜过滤除菌。
3.3.3 制法
将A.1.1 成分加入到950 mL蒸馏水中,加热溶解,调节pH,分装后121 ℃高压灭菌15 min~20 min。
临用时加热熔化琼脂,在水浴中冷至48 ℃,用带有0.22 mm微孔滤膜的注射器将莫匹罗星锂盐储备液及半胱氨酸盐酸盐储备液制备加入到熔化琼脂中,使培养基中莫匹罗星锂盐的浓度为50 mg/mL,半胱氨酸盐酸盐的浓度为500 mg/mL。
3.4 MC培养基
3.4.1 成分
蒸馏水 1 000 mL
1%中性红溶液 5.0 mL
3.4.2 制法
将前面7种成分加入蒸馏水中,加热溶解,调节pH至6.0±0.2,加入中性红溶液。
分装后121 ℃高压灭菌15 min~20 min。
4 检验程序
乳酸菌检验程序见图1。
5操作步骤
5.1样品制备
5.1.1 样品的全部制备过程均应遵循无菌操作程序。
5.1.2 冷冻样品可先使其在2 ℃~5 ℃条件下解冻,时间不超过18 h,也可在温度不超过45 ℃的条件解冻,时间不超过15 min。
5.1.3 固体和半固体食品:以无菌操作称取25 g样品,置于装有225 mL生理盐水的无菌均质杯内,于8000 r/min~10000 r/min均质1 min~2 min,制成1:10样品匀液;或置于225 mL生理盐水的无菌均质袋中,用拍击式均质器拍打1 min~2 min制成1:10的样品匀液。
5.1.4 液体样品:液体样品应先将其充分摇匀后以无菌吸管吸取样品25 mL 放入装有225 mL生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分振摇,制成1:10的样品匀液。
5.2 步骤
5.2.1 用1 mL无菌吸管或微量移液器吸取1:10样品匀液1 mL,沿管壁缓慢注于装有9 mL生理盐水的无菌试管中(注意吸管尖端不要触及稀释液),振摇试管或换用1支无菌吸管反复吹打使其混合均匀,制成1:100的样品匀液。
5.2.2 另取1 mL无菌吸管或微量移液器吸头,按上述操作顺序,做10倍递增样品匀液,每递增稀释一次,即换用1次1 mL灭菌吸管或吸头。
5.2.3 乳酸菌计数
5.2.3.1 乳酸菌总数
乳酸菌总数计数的培养条件的选择和结果说明如表1所示
表1乳酸菌总数计数的培养条件的选择和结果说明
根据待检样品活菌总数的估计,选择2个~3个连续的适宜稀释度,每个稀释度吸取1 mL样品匀液于灭菌平皿内,每个稀释度做两个平皿。
稀释液移入平皿后,将冷却至50℃的MRS琼脂培养基倾注入平皿约15mL,转动平皿使混合均匀。
36℃±1℃厌氧培养48 h±2 h,培养后计数。
从样品稀释到平板倾注要求在15min 内完成。
5.2.3.2 双歧杆菌计数
根据对待检样品双歧杆菌含量的估计,选择2个~3个连续的适宜稀释度,每个稀释度吸取1 mL样品匀液于灭菌平皿内,每个稀释度做两个平皿。
稀释液移入平皿后,将冷却至50℃的莫匹罗星锂盐和半胱氨酸盐酸盐的MRS培养基倾注入平皿约15mL,转动平皿使混合均。
36℃±1℃厌氧培养48 h±2 h,培养后计数平板上的所有菌落数。
从样品稀释到平板倾注要求在15 min内完成。
5.2.3.3 嗜热链球菌计数
根据待检样品嗜热链球菌活菌数的估计,选择2个~3个连续的适宜稀释度,每个稀释度吸取1 mL样品匀液于灭菌平皿内,每个稀释度做两个平皿。
稀释液移入平皿后,将冷却至50℃的MC培养基倾注入平皿约15mL,转动平皿使混合均匀。
36℃±1℃需氧培养48 h±2 h,培养后计数。
嗜热链球菌在MC琼脂平板上的菌落特征为:菌落中等偏小,边缘整齐光滑的红色菌落,直径2 mm±1 mm,菌落背面为粉红色。
从样品稀释到平板倾注要求在15 min内完成。
5.2.3.4 乳杆菌计数
5.2.3.1 项乳酸菌总数结果减去 5.2.3.2 项双歧杆菌与 5.2.3.3 项嗜热链球菌计数结果之和即得乳杆菌计数。
5.3 菌落计数
可用肉眼观察,必要时用放大镜或菌落计数器,记录稀释倍数和相应的菌落数量。
菌落计数以菌落形成单位(colony-forming units,CFU)表示。
5.3.1 选取菌落数在30 CFU~300 CFU之间、无蔓延菌落生长的平板计数菌落总数。
低于30 CFU的平板记录具体菌落数,大于300 CFU的可记录为多不可计。
每个稀释度的菌落数应采用两个平板的平均数。
5.3.2 其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数;若片状菌落不到平板的一半,而其余一半中菌落分布又很均匀,即可计算半个平板后乘以2,代表一个平板菌落数。
5.3.3 当平板上出现菌落间无明显界线的链状生长时,则将每条单链作为一个菌落计数。
5.4 结果的表述
5.4.1 若只有一个稀释度平板上的菌落数在适宜计数范围内,计算两个平板菌落数的平均值,再将平均值乘以相应稀释倍数,作为每g(mL)中菌落总数结果。
5.4.2 若有两个连续稀释度的平板菌落数在适宜计数范围内时,按公式(1)计算:
式中:
N——样品中菌落数;
∑C——平板(含适宜范围菌落数的平板)菌落数之和;
n1——第一稀释度(低稀释倍数)平板个数;
n2——第二稀释度(高稀释倍数)平板个数;
d——稀释因子(第一稀释度)。
5.4.3 若所有稀释度的平板上菌落数均大于300 CFU,则对稀释度最高的平板进行计数,其他平板可记录为多不可计,结果按平均菌落数乘以最高稀释倍数计算。
5.4.4 若所有稀释度的平板菌落数均小于30 CFU,则应按稀释度最低的平均菌落数乘以稀释倍数计算。
5.4.5 若所有稀释度(包括液体样品原液)平板均无菌落生长,则以小于1乘以最低稀释倍数计算。
5.4.6 若所有稀释度的平板菌落数均不在30 CFU~300 CFU之间,其中一部分小于30 CFU或大于300 CFU时,则以最接近30 CFU或300 CFU的平均菌落数乘以稀释倍数计算。
5.5 菌落数的报告
5.5.1 菌落数小于100 CFU时,按“四舍五入”原则修约,以整数报告。
5.5.2 菌落数大于或等于100 CFU时,第3位数字采用“四舍五入”原则修约后,取前2位数字,后面用0代替位数;也可用10的指数形式来表示,按“四舍五入”原则修约后,采用两位有效数字。
5.5.3 称重取样以CFU/g为单位报告,体积取样以CFU/mL为单位报告。
6 结果与报告
根据菌落计数结果出具报告,报告单位以CFU/g(mL)表示。
