重组人源抗狂犬病病毒单克隆抗体的质控方法及质量标准的建立
抗狂犬病毒单克隆抗体的研制及应用

i m nf oeen asy IA 结 果 表 明 : 4株 单 抗 对 R 有 良好 的 特 异 性 , 正 常 V r 胞 及 人 白蛋 白 和 其 m u o urset s ,F ) l a 该 V 对 eo细 他 细胞 培 养物 无 非特 异性 反 应 。将 这 些 单抗 腹 水 进 行 Poe 亲 和层 析 纯 化 后 获 得 的 纯 化 抗 体 用 于制 备 反 rt nG i
相 亲和层析 柱, 并以反 相亲和层析法纯化 R V以获得 高纯度 R V抗原 。应用纯化的 R V建立胶体金免疫层析法
(odi m ncrm t rpyasy GC 检 测 R gl— u oho a gah sa , I A) m o V抗 体 血 清 , 果 显 示 , IA 与 标 准 E IA 法检 测 比较 的 总 符 结 GC LS
I FA e t ,alo o Ab p cfc lyr a td wih rbisv r u i o e c t r el t ss l ffurMc ss e i al e ce t a e iusb tdd n tr a twih Veo c ls.h m a ab i u n l umi n t e e l n a d o h rc l
QI Ho g g n N n —a g,QIS ih a h —u ,WEN n s e g We —h n
人源抗狂犬病毒单克隆抗体载体的构建及烟草转基因研究

48
生物学通报
2011 年 第 46 卷 第 2 期
1.4 转 基 因 烟 草 的 鉴 定 利 用 上 表 中 的 引 物 , PCR 检 测 烟 草 转 基 因 植 株 。 以 未 转 染 农 杆 菌 的 烟 草 作 为 PCR 检 测 的 阴 性 对 照 。 1.5 人源抗狂犬病毒抗体在烟草中的表达检测
摘要 为了构建高效表达人源抗狂犬病毒单克隆抗体载体, 首先对人源抗狂犬病毒抗体 (SO57)重 链 和 轻 链 编 码 基 因 的 密 码 子 进 行 偏 好 性 改 造 ,添 加 增 强 外 源 基 因 表 达 的 控 制 元 件 , 然 后 分 别 与 花 椰 菜 花 叶 病 毒 35s 启 动 子 和 木 薯 叶 脉 花 叶 病 毒 启 动 子 融 合 , 连 接 至 植 物 表 达 载 体 pBI121 上 ,然 后 将 构 建 好 的 载 体 转 入 农 杆 菌 LB4404,采 用 叶 盘 法 转 化 烟 草 叶 片 。 用 分 子 生 物学技术,对 6 株转基因烟草进行检测,电泳检测结果均为阳性。 用酶联接免疫吸附剂法,检 测 6 株烟草叶片中人源抗狂犬病毒单克隆抗体的表达。 结果表明,6 株烟草均成功表达人源抗 狂犬病毒抗体。
规模化生产人源抗狂犬病毒单克隆抗体的报道。
编码基因的密码子具有烟草蛋白表达的偏好性。
本 项 研 究 拟 通 过 对 人 源 抗 狂 犬 病 毒 抗 体 同时,在 5′端添加可增强外源基因表达的 Ω 增强
(SO57)重 链 和 轻 链 编 码 基 因 改 造 , 实 现 抗 体 编 码 子 序 列 。 在 上 海 生 工 生 物 工 程 有 限 公 司 合 成 改 造
pcsvmv++Ω-low 5-GTTGGTAATTGTTGTAAAAATAtacaaacttacaaatttctctg-3 pΩ+csvmv-up 5-cagagaaatttgtaagtttgtaTATTTTTACAACAATTACCAAC-3
重组抗体药物的质量控制_高凯

期[基金项目]国家“重大新药创制”科技重大专项(2009ZX09307-001);国家高技术研究发展计划(863计划)(2007AA021601,2007AA021204)[作者简介]高凯,男,博士,副研究员,主要从事生物技术药物质量控制研究。
联系电话:(010)67095684,E-mail :gaokai@nicpbp.org.cn 。
[通讯作者]王军志,男,研究员,博士生导师,主要从事生物技术药物的质量控制和质量标准研究。
联系电话:(010)67095380,E-mail :wangjz@nicpbp.org.cn 。
·重大新药创制专项巡礼·重组抗体药物的质量控制高凯,陶磊,王军志(中国食品药品检定研究院重组技术产品室,北京100050)[摘要]重组抗体药物是生物工程关键技术的前沿成果,在肿瘤、自身免疫、器官移植和感染性疾病的治疗中均取得了显著疗效,在生物技术药物市场中的比重也在迅速攀升。
作为生物技术产业化领域最成功的产品之一,如何通过质量控制确保抗体药物的安全有效一直是本领域的关注热点。
文中就重组抗体药物质量控制的关键环节、进展及未来需要进一步开展的工作作一简要综述。
[关键词]生物技术药物;重组抗体;质量控制[中图分类号]R917[文献标志码]A [文章编号]1003-3734(2011)19-1848-08Quality control for recombinant therapeutic antibodiesGAO Kai ,TAO Lei ,WANG Jun-zhi(Division of Biopharmaceuticals ,National Institutes for Food and Drug Control ,Beijing 100050,China )[Abstract ]Recombinant therapeutic antibodies are one of the great achievements of modern biotechnology.There is no doubt that the uses of recombinant therapeutic antibodies were successful in treating various life-threat-ening and chronic diseases ,including cancer ,autoimmunity ,transplantation and infectious diseases.Its share in the global biopharmaceutical market also increased rapidly in recent years.Meanwhile ,as one of the most success-ful outcome biotherapeutics ,how to ensure the safety and efficacy of recombinant antibody products through well es-tablished quality control system is always the focus of attention from both the views of regulatory authorities and in-dustries.This article briefly reviewed the key points ,research progress for the control of recombinant antibodies ,as well as raised further work on quality control issues.[Key words ]biopharmaceutics ;recombinant therapeutic antibodies ;quality control 药品的质量源于设计,而非依赖终产品的检测[1],重组抗体药物也不例外。
《中国药典》2020版—人用重组单克隆抗体制品总论修订

纯化的单克隆抗体经除菌过滤分装于中间贮存容器中,即成为原液。
2.6 半成品
制备成品前,如需对原液进行稀释或加入其他辅料制成半成品,应确定半成品的质量控制要求,包括检定项目和可接受的标准。
可由一批或多批原液合并生产半成品。拟混合的每批原液应在有效期内且应符合拟制备制剂的有效期要求,每批原液应按规定的工艺生产、单独检验、并符合相应质量标准;不得将不合格批次与其它合格批次原液进行混合制备半成品;混合的各批原液应可有效追溯;应对混合工艺进行验证。
除另有规定外,制备成品前,如需对原液进行稀释或加入其他辅料制成半成品,应确定半成品的质量控制要求,包括检定项目和可接受的标准。
3.制品检定
应根据制品关键质量属性、对制品和工艺理解认识的积累和风险评估的原则,制定相应质量控制策略。制品检定采用的检测方法应经验证并符合要求。纳入质量标准的检定项目、可接受标准限度,应结合来自于临床前和(或)临床研究时多批样品的数据、用于证明生产一致性批次的数据、稳定性等研究数据来综合确定。重组单克隆抗体制品的质量检定应至少包括以下项目。
应根据重组单克隆抗体制品内在固有质量属性的差异与不同确定制品的关键质量属性cqa选择相应适宜的分析方法开展质量检3511异常毒性检查除另有规定外应进行异常毒性检查附录1141并符合规定
抗狂犬病单克隆抗体调研报告1
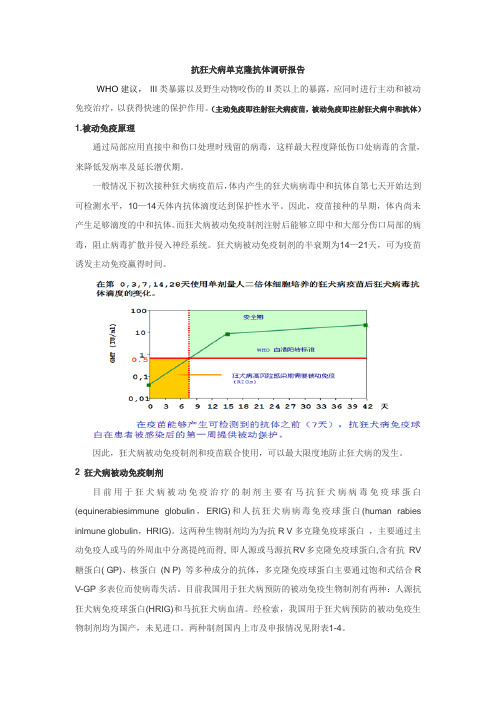
抗狂犬病单克隆抗体调研报告WHO建议,III类暴露以及野生动物咬伤的II类以上的暴露,应同时进行主动和被动免疫治疗,以获得快速的保护作用。
(主动免疫即注射狂犬病疫苗,被动免疫即注射狂犬病中和抗体)1.被动免疫原理通过局部应用直接中和伤口处理时残留的病毒,这样最大程度降低伤口处病毒的含量,来降低发病率及延长潜伏期。
一般情况下初次接种狂犬病疫苗后,体内产生的狂犬病病毒中和抗体自第七天开始达到可检测水平,10—14天体内抗体滴度达到保护性水平。
因此,疫苗接种的早期,体内尚未产生足够滴度的中和抗体。
而狂犬病被动免疫制剂注射后能够立即中和大部分伤口局部的病毒,阻止病毒扩散并侵入神经系统。
狂犬病被动免疫制剂的半衰期为14—21天,可为疫苗诱发主动免疫赢得时间。
因此,狂犬病被动免疫制剂和疫苗联合使用,可以最大限度地防止狂犬病的发生。
2 狂犬病被动免疫制剂目前用于狂犬病被动免疫治疗的制剂主要有马抗狂犬病病毒免疫球蛋白(equinerabiesimmune globulin,ERIG)和人抗狂犬病病毒免疫球蛋白(human rabies inlmune globulin,HRIG)。
这两种生物制剂均为为抗R V多克隆免疫球蛋白,主要通过主动免疫人或马的外周血中分离提纯而得, 即人源或马源抗RV多克隆免疫球蛋白,含有抗RV 糖蛋白( GP)、核蛋白(N P) 等多种成分的抗体,多克隆免疫球蛋白主要通过饱和式结合R V-GP多表位而使病毒失活。
目前我国用于狂犬病预防的被动免疫生物制剂有两种:人源抗狂犬病免疫球蛋白(HRIG)和马抗狂犬病血清。
经检索,我国用于狂犬病预防的被动免疫生物制剂均为国产,未见进口。
两种制剂国内上市及申报情况见附表1-4。
两种狂犬病被动免疫制剂的优缺点狂犬病人免疫球蛋白(HRIG)马抗狂犬病血清(ERIG)理论上存在感染HIV/HCV的危险不存在感染HIV/HCV的危险免疫用制备疫苗要求高,价格高制备抗原容易且价格较低来源受限供应量保证存在伦理道德问题不存在伦理道德问题异源性小有异源性几乎无不良反应接种不良反应发生率高较为安全部需做皮试有过敏风险,必须做皮试半衰期为21天左右半衰期为14天左右由于ERIG 副反应比较严重,而且对某些疫苗的抗体反应有抑制,而HRIG价格昂贵,供应量有限并且有潜在的病原威胁。
重组人源抗狂犬病病毒单克隆抗体的质控方法及质量标准的建立

mbinant human anti-rabies virus monoclonal anti- body,rhRMcAb)为 CHO 细胞表达的全人源抗体,属 于 IgG1 亚型,可代替抗狂犬病血清用于狂犬病病毒 暴露后预防。本文对本公司研制的 rhRMcAb 的质控 方法和质量标准进行了研究,现报道如下。
1. 材料与方法 1. 1 毒株及细胞
狂犬病病毒固定毒株(CVS-11)由武汉生物制品
·862·
中国生物制品学杂志 2010 年 8 月第 23 卷第 8 期 Chin J Biologicals August 2010,Vol. 23 No. 8
研究所提供;鼠成神经细胞瘤细胞(NA 细胞)来自 TJU USA。 1. 2 样品
狂犬病疫苗,并使用抗狂犬病血清。临床上用单克隆
抗体取代血源抗体用于狂犬病病毒暴露后预防已成
为共识[1]。重组人源抗狂犬病病毒单克隆抗体(Reco-
基金项目:“十一五”863 计划生物和医药技术领域重大项目 (2006AA02A247).
作者单位:华北制药集团新药研究开发有限责任公司生物技术 研究室(石家庄 050015).
【Abstract】 Objective To establish the method and standard for quality control of recombinant human monoclonal antibody against rabies (rhRMcAb). Methods The rhRMcAb was analyzed for neutralizing activity by mouse neutralization test(MNT)and rapid fluorescent focus inhibition test(RFFIT), for purity by reduced and non-reduced SDS-PAGE and for peptide map by reduction alkylation and trypsin digestion followed by reverse phase HPLC. The amino acids at N-terminus was sequenced by amino acid sequencer after the pyroglutamate blockage at N-terminus was removed by pyroglutamate aminopeptidase. The affinity constant of rhRMcAb with rabies virus glycoprotein was determined by surface plasmon resonance(SPR)method. Other quality indexes of rhRMcAb were determined according to the requirements in Chinese Pharmacopeia (2005 edition), based on which a standard for quality control was established. Results The activities of six batches of rhRMcAb determined by MNT and RFFIT were basically in agreement. The reduced SDS-PAGE purities of three batches of rhRMcAb bulks were more than 99. 0% . Except major antibody bands, some minor bands with both high and low relative molecular masses were also observed on the non-reduced SDS-PAGE profile of rhRMcAb. The peptide maps of three batches of bulks were consistent with that of in-house reference. The amino acid sequence at N-terminus was identical to the theoretical value. The affinity constant of rhRMcAb with rabies virus glycoprotein was 1. 86 × 108 / M. All the other quality indexes of rhRMcAb met the requirements in Chinese Pharmacopeia (2005 edition). In the established standard for quality control, the neutralizing activity of rhRMcAb was not less than 500 IU / ml, while both SDS-PAGE and HPLC purities were not less than 98. 0%. Conclusion The method and standard for quality control of rhRMcAb were established.
人用单克隆抗体质量控制技术指导原则(2003)

人用单克隆抗体质量控制技术指导原则2003年03月20日发布本要点适用于供治疗的体内诊断用的利用杂交瘤技术制备的单克隆抗体,适用于在人体内应用的利用重复DNA技术制备的基因工程抗体。
一、杂交瘤技术制备的单克隆抗体(一)杂交瘤细胞1.亲本细胞(1)骨髓瘤细胞SP2/0或其他适宜的骨髓瘤细胞系。
应为不合成或不分泌免疫球蛋白链型,具有符合骨髓瘤细胞的染色体特征,并有明确的来源历史及符合要求的保存条件。
(2)免疫亲代细胞经抗原免疫的鼠脾B淋巴细胞或外周血B淋巴细胞。
应有明确的免疫原来源、性质及动物种系,免疫原详细的制备过程。
适宜的免疫方案及免疫淋巴细胞制备的方法。
2.细胞融合与克隆化采用适宜的方法进行融合、筛选及克隆化。
3.杂交瘤细胞检定(1)抗体分泌稳定性连续克隆化后抗体阳性率达100%,经体外连续传代3个月以上和反复冻存、复苏,细胞系能保持稳定分泌特异性抗体。
(2)细胞核学特征检查细胞分裂中期染色体,应符合杂交瘤细胞特征。
4.鼠源病毒检查按附录要求检测鼠源病毒。
5.支原体检查按现行《中国药典》生物制品无菌试验规程进行。
6.无菌试验按现行《中国药典》生物制品无菌试验规程进行。
(二)单克隆抗体的检定1.免疫球蛋白类及亚类用免疫双扩散法或其他适宜的方法测定。
2.亲和力用可靠、准确的方法测定单克隆抗体(以下简称为单抗)的亲和常数或相对亲和力。
一般情况下,对于免疫原为可溶性的单抗,测其亲和常数,对于免疫原为颗粒性抗原的单抗,测其相对亲和力。
3.特异性测定单抗对靶抗原的特异性;对多株单抗识别的抗原决定簇进行相关性分析。
4.交叉反应按附录要求。
免疫组织化学法测定单抗与人体组织交叉反应,用冰冻及石蜡包埋的各种正常脏器组织测定。
来源于肿瘤相关抗原的单抗应进行与各种肿瘤组织的交叉反应试验。
5.效价测定用适宜方法测定。
(三)其他原材料1.细胞培养用小牛血清支原体检测应为阴性。
经小量试验适于杂交瘤细胞生长。
2.培养液应有培养液来源,质量指标。
人用狂犬病疫苗的免疫机制、毒株及质量标准:重庆狂犬抗体检测指南

人用狂犬病疫苗的免疫机制、毒株及质量标准一、人用狂犬病疫苗的免疫机制、毒株及质量标准狂犬病病毒RNA编码核蛋白(N)、M1、M2、病毒包膜糖蛋白(G)和L五种蛋白,其中G蛋白是狂犬病病毒最主要的抗原,可有效刺激特异性辅助性T细胞和细胞毒性T细胞(CTL)增生,并诱导机体产生特异性抗体。
G蛋白特异性抗体是狂犬病疫苗最重要的保护性抗体,免疫效果主要依赖其抗原表位、结构、蛋白折叠及糖基化等。
N蛋白也是一种有效的保护性抗原,能够刺激B细胞和Th细胞诱导产生细胞和体液免疫。
磷蛋白(P)可诱导CTL,但保护作用较弱。
机体在接种狂犬病疫苗约7天左右产生IgM抗体,在约14天后产生IgG抗体并迅速升高。
IgM和IgG抗体均具有中和病毒的能力,有些中和抗体能进入感染狂犬病病毒的神经细胞内抑制病毒复制。
CTL的高峰出现在免疫后12天,可清除中枢神经系统内的狂犬病病毒,Th细胞可增强抗核蛋白和糖蛋白抗体,也能增加保护效果。
但Suss的研究认为细胞免疫在狂犬病中的作用不明。
由于狂犬病病毒核蛋白序列高度保守,氨基酸同源性达78%至93%,故病毒之间在核壳体水平上存在着广泛的抗原交叉反应。
狂犬病病毒的主要抗原部位为G蛋白外功能区,当其氨基酸同源性>74%时,病毒之间能够交叉中和,为同一遗传谱系内的病毒;膜外区的氨基酸同源性<62%时,则无交叉中和反应。
目前疫苗株均属于遗传谱系I,对遗传谱系II中的病毒感染不具保护作用。
现已经有十余个种类或基因型的狂犬病病毒属病毒被描述为狂犬病的病原体。
目前为止,遗传谱系I的狂犬病病毒是引起人狂犬病的最常见的病毒型别,也是至今应用于狂犬病疫苗生产的唯一病毒种类。
故现有疫苗可能无法为遗传谱系I外的其他血清型病毒感染提供保护。
因此,用于疫苗的病毒种类必须慎重选择。
生产用毒种应是在实验室细胞培养适应和减毒,并具有稳定生物学特性的固定毒株,其历史和来源应确证清楚,并经过全面的特征性检定,符合国家相关文件的要求。
抗狂犬病单克隆抗体调研报告1

抗狂犬病单克隆抗体调研报告WHO建议,III类暴露以及野生动物咬伤的II类以上的暴露,应同时进行主动和被动免疫治疗,以获得快速的保护作用。
(主动免疫即注射狂犬病疫苗,被动免疫即注射狂犬病中和抗体)1.被动免疫原理通过局部应用直接中和伤口处理时残留的病毒,这样最大程度降低伤口处病毒的含量,来降低发病率及延长潜伏期。
一般情况下初次接种狂犬病疫苗后,体内产生的狂犬病病毒中和抗体自第七天开始达到可检测水平,10—14天体内抗体滴度达到保护性水平。
因此,疫苗接种的早期,体内尚未产生足够滴度的中和抗体。
而狂犬病被动免疫制剂注射后能够立即中和大部分伤口局部的病毒,阻止病毒扩散并侵入神经系统。
狂犬病被动免疫制剂的半衰期为14—21天,可为疫苗诱发主动免疫赢得时间。
因此,狂犬病被动免疫制剂和疫苗联合使用,可以最大限度地防止狂犬病的发生。
2 狂犬病被动免疫制剂目前用于狂犬病被动免疫治疗的制剂主要有马抗狂犬病病毒免疫球蛋白(equinerabiesimmune globulin,ERIG)和人抗狂犬病病毒免疫球蛋白(human rabies inlmune globulin,HRIG)。
这两种生物制剂均为为抗R V多克隆免疫球蛋白,主要通过主动免疫人或马的外周血中分离提纯而得, 即人源或马源抗RV多克隆免疫球蛋白,含有抗RV 糖蛋白( GP)、核蛋白(N P) 等多种成分的抗体,多克隆免疫球蛋白主要通过饱和式结合R V-GP多表位而使病毒失活。
目前我国用于狂犬病预防的被动免疫生物制剂有两种:人源抗狂犬病免疫球蛋白(HRIG)和马抗狂犬病血清。
经检索,我国用于狂犬病预防的被动免疫生物制剂均为国产,未见进口。
两种制剂国内上市及申报情况见附表1-4。
两种狂犬病被动免疫制剂的优缺点狂犬病人免疫球蛋白(HRIG)马抗狂犬病血清(ERIG)理论上存在感染HIV/HCV的危险不存在感染HIV/HCV的危险免疫用制备疫苗要求高,价格高制备抗原容易且价格较低来源受限供应量保证存在伦理道德问题不存在伦理道德问题异源性小有异源性几乎无不良反应接种不良反应发生率高较为安全部需做皮试有过敏风险,必须做皮试半衰期为21天左右半衰期为14天左右由于ERIG 副反应比较严重,而且对某些疫苗的抗体反应有抑制,而HRIG价格昂贵,供应量有限并且有潜在的病原威胁。
抗狂犬病疫苗单克隆抗体的制备和初步鉴定

抗狂犬病疫苗单克隆抗体的制备和初步鉴定
赵蓉;游云
【期刊名称】《福建医学院学报》
【年(卷),期】1989(023)003
【摘要】用狂犬病疫苗为抗原,免疫BALB/c小鼠,取免疫小鼠脾细胞与小鼠骨髓瘤细胞株SP2/O融合,经过培养、克隆、ELISA鉴定,筛出3株分泌抗狂犬病疫苗单克隆抗体细胞株。
双扩散结果证明:3株细胞均分泌IgG1。
【总页数】2页(P210-211)
【作者】赵蓉;游云
【作者单位】不详;不详
【正文语种】中文
【中图分类】R392-33
【相关文献】
1.抗人绒毛膜促性腺激素β亚单位羧基末端肽(hCGβ-CTP)单克隆抗体制备及初步鉴定 [J], 王锐;安晓丽;梁秋波;张道旭;李郑武;
2.抗人EGFRvⅢ ex单克隆抗体的制备及初步鉴定 [J], 江秀玲;胡有根;石必枝
3.抗人OX40单克隆抗体的制备和初步鉴定 [J], 侯小娟;陈鸿斌;袁旭东;王双;仇玮祎;孙志伟
4.抗鸡β干扰素单克隆抗体的制备及初步鉴定 [J], 张向乐;孟春春;仇旭升;谭磊;宋翠萍;丁铲
5.抗血管紧张素Ⅱ单克隆抗体制备及初步鉴定 [J], 徐彬瑗;白云鹏;曾玲
因版权原因,仅展示原文概要,查看原文内容请购买。
重组人抗狂犬病毒单克隆抗体的制备方法[发明专利]
![重组人抗狂犬病毒单克隆抗体的制备方法[发明专利]](https://img.taocdn.com/s3/m/c3e30b63ac02de80d4d8d15abe23482fb4da028c.png)
[19]中华人民共和国国家知识产权局[12]发明专利申请公布说明书[11]公开号CN 101100663A[43]公开日2008年1月9日[21]申请号200610012910.7[22]申请日2006.07.05[21]申请号200610012910.7[71]申请人华北制药集团新药研究开发有限责任公司地址050015河北省石家庄市和平东路388号[72]发明人贾茜 高健 惠觅宙 魏敬双 赵伟 陶冉程立均 贺建功 白冠仁 [51]Int.CI.C12N 15/09 (2006.01)C12N 15/85 (2006.01)C07K 16/18 (2006.01)C12P 21/08 (2006.01)权利要求书 1 页 说明书 6 页[54]发明名称重组人抗狂犬病毒单克隆抗体的制备方法[57]摘要本发明提供了重组人抗狂犬病毒单克隆抗体的生产方法,利用基因重组哺乳动物细胞成功生产出高纯度的人抗狂犬病毒单克隆抗体NM57,该株抗体稳定性好、特异性强,能够中和目前中国境内的代表性狂犬病毒街毒株,特别适用于狂犬病暴露后预防,取代目前所使用的抗狂犬病马血清(ERIG)或人免疫球蛋白(HRIG)。
200610012910.7权 利 要 求 书第1/1页1.一种抗狂犬病毒单克隆抗体的制备方法,其特征在于采用重组哺乳动物细胞表达。
2.如权利要求1所述的制备方法,包括将含有所述抗体基因的重组载体转染哺乳动物细胞,经贴壁培养制得所述抗体。
3.如权利要求1所述的制备方法,包括将含有所述抗体基因的重组载体转染哺乳动物细胞,经悬浮培养制得所述抗体。
4.如权利要求1-3任一所述的制备方法,其特征在于所述抗体为抗狂犬病毒单克隆抗体NM57。
5.如权利要求1-3任一所述的制备方法,其特征在于所述重组哺乳动物细胞为中华仓鼠卵巢细胞(C H O)、鼠骨髓瘤细胞(N S0)、幼鼠肾细胞(B H K)或人胚胎肾细胞(HEK-293)。
具有中和活性的抗狂犬病病毒单克隆抗体的制备及应用[发明专利]
![具有中和活性的抗狂犬病病毒单克隆抗体的制备及应用[发明专利]](https://img.taocdn.com/s3/m/80122c337f1922791688e8f1.png)
专利名称:具有中和活性的抗狂犬病病毒单克隆抗体的制备及应用
专利类型:发明专利
发明人:曹守春,王云鹏,董关木,李玉华,俞永新
申请号:CN201510055035.X
申请日:20150203
公开号:CN104761640A
公开日:
20150708
专利内容由知识产权出版社提供
摘要:本发明公开了一种中和狂犬病病毒活性的单克隆抗体及能够持续、稳定分泌该单克隆抗体的杂交瘤细胞。
本发明以狂犬病病毒CTN-1V株灭活病毒为免疫原,所制备的单克隆抗体具有中和活性,特异性地识别狂犬病病毒糖蛋白,所述的单克隆抗体的重链可变区氨基酸序列如SEQ ID NO:1所示,轻链可变区氨基酸序列如SEQ ID NO:2所示。
利用本发明所述的单克隆抗体制备的检测制品,如ELSIA试剂及胶体金试剂,可用于人用狂犬病疫苗中糖蛋白抗原的检测,可用于疫苗生产过程中的质量控制,具有较强的应用价值。
因该单克隆抗体具有中和活性,亦可用于制备治疗狂犬病的药物用途。
申请人:中国食品药品检定研究院
地址:100050 北京市东城区天坛西里2号
国籍:CN
代理机构:北京中知法苑知识产权代理事务所(普通合伙)
更多信息请下载全文后查看。
狂犬病疫苗质量管理

狂犬病疫苗质量管理狂犬病是由狂犬病病毒引起的一种急性传染病,感染后几乎100%致死。
为了防止狂犬病的传播,狂犬病疫苗的质量管理至关重要。
本文将从疫苗生产、质量控制和监管三个方面探讨狂犬病疫苗质量管理的重要性和措施。
狂犬病疫苗的生产是质量管理的基础。
狂犬病疫苗的生产需要严格遵守相关法律法规和生产标准,确保疫苗的质量和安全性。
生产过程中需要使用高质量的病毒种子株,确保病毒的活力和纯度;同时,疫苗生产厂家应具备良好的生产设施和设备,以确保生产环境的洁净度和稳定性。
此外,严格的生产工艺控制和质量管理体系也是保证疫苗质量的重要手段。
狂犬病疫苗的质量控制是确保疫苗质量的关键。
质量控制包括原材料的选择和检验、生产过程的监控和记录、中间产品和成品的检验等。
对于狂犬病疫苗来说,关键的质量控制点包括病毒种子株的鉴定、病毒复制的监控、疫苗的灭活效果和纯度的检验等。
只有通过严格的质量控制,才能保证疫苗的质量稳定和一致性,确保接种者的安全和免疫效果。
狂犬病疫苗的监管是保证疫苗质量的重要保障。
监管部门应制定相关法律法规和标准,对疫苗生产企业进行许可和监督,确保其遵守生产规范和质量要求。
监管部门还需要定期对疫苗进行抽样检验和评价,以确保疫苗的质量和安全性。
此外,监管部门还应加强对疫苗接种点和兽医单位的监督,确保疫苗的正确使用和接种效果的监测,提高疫苗接种的覆盖率和有效性。
狂犬病疫苗的质量管理是防止狂犬病传播的重要措施。
通过严格的疫苗生产、质量控制和监管,可以确保疫苗的质量和安全性,有效预防狂犬病的发生和传播。
为了提高疫苗接种的覆盖率和免疫效果,同时也要加强对狂犬病的宣传和教育,提高公众的认识和意识,共同参与到狂犬病防控工作中来。
只有全社会的共同努力,才能有效控制狂犬病的传播,保障人民的生命安全和身体健康。
抗狂犬病毒单克隆抗体的纯化及标记

抗狂犬病毒单克隆抗体的纯化及标记刘文涛;于盼盼;李泽鸿【期刊名称】《中国兽药杂志》【年(卷),期】2011(45)4【摘要】对一株稳定、特异、高效的单克隆抗体(mAb)进行了纯化和荧光素(FITC)的标记,利用标记产物与已有的抗狂犬病毒核蛋白单克隆抗体标记物相比较,效果良好,二者可以结合(或单独)使用;应用标记好的荧光抗体与FITC-抗狂犬病毒免疫球蛋白比较进行血清样品效价测定实验,来确定纯化、标记后的单克隆抗体的灵敏度,结果表明本实验制备的单克隆抗体与FITC-抗狂犬病毒免疫球蛋白具有相同的灵敏度,该单克隆抗体测得的血清样品效价结果与FITC-抗狂犬病毒免疫球蛋白测得的结果相同.因此,此荧光抗体可应用于狂犬病病毒检测(FAT)、病毒毒力测定(TCID50)、中和抗体实验(FAVN)等方面的检测实验,此荧光抗体可为狂犬病的相关研究提供有力的保障.【总页数】4页(P5-8)【作者】刘文涛;于盼盼;李泽鸿【作者单位】吉林农业大学生命科学学院,长春,130118;吉林大学,长春,130118;吉林农业大学生命科学学院,长春,130118;吉林大学,长春,130118;吉林农业大学生命科学学院,长春,130118【正文语种】中文【中图分类】S852.655【相关文献】1.抗人活化血小板嵌合单克隆抗体SZ-51/Hu的纯化、鉴定和核素标记 [J], 张玮;阮长耿2.纯化和标记抗人轻链β2m单克隆抗体的方法 [J], 阮光萍;姚翔;庞荣清;汪兴明;戴莹;潘兴华3.铕标记抗人甲胎蛋白单克隆抗体的分离纯化 [J], 贺广彩;陈杞;陈克明;张丽民4.重组人源抗狂犬病毒单克隆抗体SO57、SOJB对狂犬病毒G蛋白亲和力的比较研究 [J], 程立均;贾茜5.猪瘟病毒单克隆抗体的研制和应用——抗猪瘟兔化弱毒单克隆抗体的纯化 [J], 房德兴;王元伦;周宗安;刘劲松;顾志香因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中国生物制品学杂志 2010 年 8 月第 23 卷第 8 期 Chin J Biologicals August 2010,Vol. 23 No. 8 中国图书分类号 Q78 文献标识码 A 文章编号 1004-5503(2010)08-0861-05
·861· 【治疗制品】
重组人源抗狂犬病病毒单克隆抗体的质控方法及质量标准的建立
魏敬双 程立均 赵伟 周兴军 刘进怀 贾茜
【 摘要 】 目的 建立重组人源抗狂犬病病毒单克隆抗体(rhRMcAb)的质控方法和质量标准。方法 采用小鼠中和试验 (MNT)和快速荧光灶抑制试验(RFFIT)分别测定 6 批 rhRMcAb 样品的中和活性;还原、非还原 SDS-PAGE 检测 rhRMcAb 样品的 纯度;还原烷基化胰蛋白酶酶切和反相高效液相色谱法分析 rhRMcAb 的肽图;焦谷氨酸肽酶去除 N-端焦谷氨酸封闭后,氨基酸 序列分析仪测定 rhRMcAb 的 N-端氨基酸序列;表面等离子共振法(Surface plasmon resonance,SPR)测定 rhRMcAb 与狂犬病病 毒糖蛋白的亲和常数;按《中国药典》三部(2005 版)要求检测 rhRMcAb 的各项其他指标,并建立其质量标准。结果 采用 MNT 和 RFFIT 2 种方法检测 6 批 rhRMcAb 的中和活性,批间活性基本一致;3 批 rhRMcAb 原液的还原 SDS-PAGE 纯度大于 99. 0%, 非还原 SDS-PAGE 除抗体主带外,在高、低相对分子质量处分别存在一些次带;3 批原液样品的肽图图谱与理化测定对照品一 致;N-端氨基酸序列与理论序列一致;结合狂犬病病毒糖蛋白抗原的亲和常数为 1. 86 × 108 / M;其他各项指标均符合《中国药 典》三部(2005 版)要求;建立的质量标准中,中和活性应不低于 500 IU / mg,SDS-PAGE 及 HPLC 纯度应不低于 98. 0%。结论 已建立了 rhRMcAb 的质控方法和质量标准,可用于 rhRMcAb 产品的检定。
【关键词】 重组人源单克隆抗体;狂犬病病毒;质量控制
Establishment of Method and Standard for Quality Control of Recombinant Human Monoclonal Antibody against Rabies
WEI Jing-shuang, CHENG Li-jun, ZHAO Wei, ZHOU Xing-jun, LIU Jin-huai, JIA Qian(New Drug R&D Center, North China Pharmaceutical Corporation, Shijiazhuang 050015, China)
狂犬病疫苗,并使用抗狂犬病血清。临床上用单克隆
抗体取代血源抗体用于狂犬病病毒暴露后预防已成
为共识[1]。重组人源抗狂犬病病毒单克隆抗体(Reco-
基金项目:“十一五”863 计划生物和医药技术领域重大项目 (2006AA02A247).
作者单位:华北制药集团新药研究开发有限责任公司生物技术 研究室(石家庄 050015).
1. 材料与方法 1. 1 毒株及细胞
狂犬病病毒固定毒株(CVS-11)由武汉生物制品
·862·
中国生物制品学杂志 2010 年 8 月第 23 卷第 8 期 Chin J Biologicals st 2010,Vol. 23 No. 8
研究所提供;鼠成神经细胞瘤细胞(NA 细胞)来自 TJU USA。 1. 2 样品
【Abstract】 Objective To establish the method and standard for quality control of recombinant human monoclonal antibody against rabies (rhRMcAb). Methods The rhRMcAb was analyzed for neutralizing activity by mouse neutralization test(MNT)and rapid fluorescent focus inhibition test(RFFIT), for purity by reduced and non-reduced SDS-PAGE and for peptide map by reduction alkylation and trypsin digestion followed by reverse phase HPLC. The amino acids at N-terminus was sequenced by amino acid sequencer after the pyroglutamate blockage at N-terminus was removed by pyroglutamate aminopeptidase. The affinity constant of rhRMcAb with rabies virus glycoprotein was determined by surface plasmon resonance(SPR)method. Other quality indexes of rhRMcAb were determined according to the requirements in Chinese Pharmacopeia (2005 edition), based on which a standard for quality control was established. Results The activities of six batches of rhRMcAb determined by MNT and RFFIT were basically in agreement. The reduced SDS-PAGE purities of three batches of rhRMcAb bulks were more than 99. 0% . Except major antibody bands, some minor bands with both high and low relative molecular masses were also observed on the non-reduced SDS-PAGE profile of rhRMcAb. The peptide maps of three batches of bulks were consistent with that of in-house reference. The amino acid sequence at N-terminus was identical to the theoretical value. The affinity constant of rhRMcAb with rabies virus glycoprotein was 1. 86 × 108 / M. All the other quality indexes of rhRMcAb met the requirements in Chinese Pharmacopeia (2005 edition). In the established standard for quality control, the neutralizing activity of rhRMcAb was not less than 500 IU / ml, while both SDS-PAGE and HPLC purities were not less than 98. 0%. Conclusion The method and standard for quality control of rhRMcAb were established.
通讯作者:魏敬双,E-mail:weijsh@hotmail. com
