利用化学式计算量
物质的量应用于化学方程式计算

物质的量应用于化学方程式计算物质的量在化学方程式计算中非常重要。
它是化学反应中物质转化的量度单位,能够帮助我们确定反应物和生成物的化学计量关系,并进行定量计算。
首先,让我们来了解一下物质的量的概念。
物质的量用化学式“n”来表示,单位是摩尔(mol)。
摩尔表示的是一定物质的粒子数,类似于一打鸡蛋包含12个鸡蛋一样。
化学方程式中的系数用来表明反应物和生成物之间的摩尔比例关系。
利用物质的量,我们可以进行各种计算,例如计算反应物和生成物的摩尔比例、计算反应物和生成物的质量、计算反应的理论产率等。
首先,我们可以利用化学方程式中的摩尔比例关系来计算反应物和生成物之间的摩尔比例。
例如,对于反应方程式2H2+O2→2H2O,我们可以看到1摩尔的O2反应会生成2摩尔的H2O。
这意味着反应中O2和H2O之间的摩尔比例是1:2、通过这个比例,我们可以计算出给定反应量的反应物和生成物之间的摩尔比例。
其次,利用物质的量,我们还可以计算反应物和生成物的质量。
我们可以通过摩尔质量(分子量或相对原子质量)将摩尔转化为质量。
例如,化学方程式2H2+O2→2H2O中,我们可以通过查找元素的相对原子质量表得知,1摩尔的O2的质量是32克,2摩尔的H2O的质量是36克。
这意味着32克的O2可以与36克的H2O完全反应。
利用这个关系,我们可以根据给定物质的量计算其质量。
此外,物质的量还可以用于计算反应的理论产率。
理论产率是指在完全反应下,理论上可获得的最大产物量。
我们可以通过化学方程式中的摩尔系数来计算理论产率。
例如,对于反应方程式2H2+O2→2H2O,理论上1摩尔的O2可以生成2摩尔的H2O。
因此,如果我们有10摩尔的O2,理论上可以生成20摩尔的H2O。
通过这个计算,我们可以预测反应的产物量。
总而言之,物质的量在化学方程式计算中发挥着重要作用。
通过物质的量,我们可以计算反应物和生成物之间的摩尔比例、质量和理论产率。
这些计算可以帮助我们预测反应的结果、确定反应条件以及进行化学方程式的平衡和优化计算。
化学计量在方程式中的计算
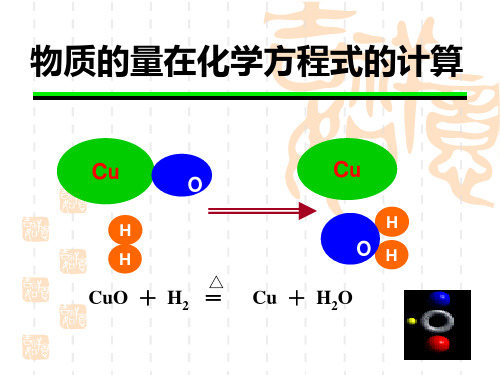
物质的量在化学方程式的计算
Cu
O
H
H △
CuO + H2 =
Cu
H
OH Cu + H2O
回忆以物质的量为核心的计算公式 V(气体)
÷Vm ×Vm
N ÷NA n ×M
×NA
÷M
m
÷V(溶液) ×V(溶液)
C
方程式中化学计量数与物质的量的关系
MnO2+4HCl==MnCl2+ Cl2 化学计量数 1 : 4 : 1 : 1 : 2 +2H2O
一题多变
1、完全中和0.1 mol NaOH,所需H2SO4 的质量是多少?
2、将8.1g铝与足量的氢氧化钠反应, 计算生成氢气 ___ L,需要氢氧化钠 __ mol。
已知:2Al+2NaOH+2H2O=2NaAlO2+ 3H2 ↑
综合计算
某盐酸的 =1.18g/cm3,HCl的质量分
数为36.5%。求①该盐酸物质的量浓度是 多少?②200mL该盐酸与过量铁屑充分反 应,生成 H2的体积(标况状况下)是多少? 若反应后溶液体积变化忽略不计则FeCl2 物质的量浓度是多少?有多少克FeCl2?
能生成氢气___L(标准状况)。盐酸的物 质的量浓度为___。
Zn + 2HCl = ZnCl2 + H2↑
1
2
1
n(Zn)
n(HCl)
n(H2)
化学方程式计算的步骤
设 设所求物质的物质的量n 写 写出相关的化学方程式
在化学式下面标出化学计量数及所 标 求物质的物质的量 列 列出比例式 解 根据比例式求n,再求V、C、m 答 简明地写出答案
粒子数N之比 1 : 4 : 1 : 1 : 2 扩大NA倍 1NA : 4NA : 1NA : 1NA : 2NA
化学式量的计算公式

化学式量的计算公式化学式量,也叫相对分子质量,这可是化学里一个挺重要的概念。
先来说说啥是化学式量。
简单点说,它就是一个化学式中所有原子的相对原子质量的总和。
比如说水(H₂O),氢(H)的相对原子质量约是 1,氧(O)的相对原子质量约是 16,那水的化学式量就是 2×1 + 16 = 18。
计算化学式量的公式其实不难,就是把化学式里每种原子的个数乘以它的相对原子质量,然后再加起来。
这就好比我们去超市买东西算总价,每种商品的价格乘以数量,最后加一块儿就是总花费。
我记得我刚开始教学生这个知识点的时候,有个特别好玩的事儿。
有个小同学,咱们叫他小明吧。
小明特别聪明,但是有点马虎。
我在黑板上写了个二氧化碳(CO₂)的化学式,让大家算算它的化学式量。
小明很快就举手说:“老师,我算出来啦,是28!”我一听,心里就想,这肯定不对呀。
我就问他:“小明,你跟老师说说你是咋算的?”小明特别自信地说:“老师,碳(C)的相对原子质量是12,氧(O)是16,那不就是 12 + 16 = 28 嘛。
”听完他的回答,全班同学都笑了。
我就耐心地跟小明说:“小明呀,你看这二氧化碳里有一个碳原子和两个氧原子,得是 12 + 16×2 才行呀。
”小明这才恍然大悟,红着脸坐下重新算了一遍。
咱们再来说说为啥要学这个化学式量。
它的用处可大啦!通过计算化学式量,我们能知道物质的组成比例,还能在进行化学计算的时候派上大用场。
比如说,在化学反应中,知道了各种物质的化学式量,就能算出反应中各物质的质量关系。
那在实际做题的时候,怎么能保证不出错呢?首先,得把常见元素的相对原子质量记得牢牢的,就像乘法口诀一样熟。
然后,仔细看清化学式里每种原子的个数,千万别数错了。
总之,化学式量的计算公式虽然简单,但是要想熟练掌握,还得多练习。
可别像小明一开始那样马虎哟!希望大家都能轻松搞定这个知识点,在化学的世界里畅游无阻!。
如何使用化学式进行物质的物质量计算

如何使用化学式进行物质的物质量计算使用化学式进行物质的物质量计算化学式作为化学反应和化学物质组成的重要表示形式,可以帮助我们进行物质的物质量计算。
在化学实验、工业生产和日常生活中,对物质的物质量进行准确计算是非常重要的。
本文将介绍如何使用化学式进行物质的物质量计算。
一、化学式的含义和组成化学式是一种用化学元素符号和数字组合表示化学物质组成和化学反应的一种通用符号。
化学式由元素符号、下标和系数组成。
元素符号表示元素的简写形式,用于表示原子的种类;下标表示原子的个数,用于表示单个元素中原子的数量;系数表示化学式中化学物质的数量比例关系。
以水(H2O)为例,其中H表示氢元素,2表示氢元素的原子个数,O表示氧元素,1表示氧元素的原子个数。
化学式H2O表示水分子由2个氢原子和1个氧原子组成。
二、使用化学式计算物质的物质量1. 单质的物质量计算单质是指只由一种元素组成的物质。
计算单质的物质量可以直接根据化学式进行。
例如,计算氧气(O2)的物质量,我们可以根据化学式中O2的系数得知,1mol氧气的物质量为32g。
因此,如果需要计算氧气的物质量,可以根据该系数进行比例换算,如计算2mol氧气的物质量为64g(32g x 2mol)。
2. 化合物的物质量计算化合物是指由两种或两种以上的元素通过化学键连接而成的物质。
计算化合物的物质量需要考虑化学式中各个元素原子的个数和原子量。
以二氧化碳(CO2)为例,需要分别计算出碳和氧的原子量,并根据相应的系数进行计算。
根据化学元素周期表,碳的原子量为12g/mol,氧的原子量为16g/mol。
在CO2的化学式中,C的下标为1,O的下标为2,因此CO2的物质量等于12g/mol + 16g/mol × 2 = 44g/mol。
根据相应的化学式,可以按照上述方法计算出任意化合物的物质量。
三、使用化学式计算化学反应中物质的物质量在化学反应中,通过化学式可以计算反应物和生成物的物质量。
物质的量在化学方程式中的计算

物质的量在化学方程式中的计算物质的量在化学方程式中的计算化学方程式是化学反应的简写形式,它用化学式表示在化学反应中参与的物质种类和数量,以及它们之间的相对比例关系。
在化学方程式中,物质的量是一个重要的概念,它的计算既是化学实验的基础,也是理论研究的基础。
本文将介绍在化学方程式中计算物质的量的相关知识。
1. 物质的量的定义物质的量是一个基本的化学量,它用摩尔(mol)作为单位。
一个摩尔的物质包含6.02×1023个分子、原子或离子,即阿伏伽德罗常数(NA)。
物质的量可以表示任何类型的化学物质,包括元素、化合物、离子等。
在化学反应中,化学式中所示的物质的量就是它们在反应中的摩尔数,它们之间的摩尔比就是它们之间的化学计量比。
2. 化学计量比化学计量比是一组化学物质中各化学成分的摩尔比。
化学计量比与化学式中的系数有密切的关系。
在一个化学方程式中,系数就是化学计量比。
例如,在2H2+O2→2H2O的化学方程式中,系数2就对应着摩尔比H2/O2=2:1的化学计量比。
3. 摩尔质量摩尔质量是一种摩尔单位,它是一种物质的质量与其物质的量之比,通常用克/摩尔表示。
例如,氢气的摩尔质量就是2克/摩尔,即1摩尔的氢气质量是2克。
化学计量比和摩尔质量可以相互转化,由摩尔质量可以计算出相应的质量,而由质量可以计算出各种物质的物质的量。
例如,在2H2+O2→2H2O的化学方程式中,如果我们知道了20克的氢气和10克的氧气,通过摩尔质量可以计算出它们分别的物质的量为10/2=5摩尔和10/32=0.3125摩尔。
4. 限制因素限制因素是指在两种或多种参与化学反应的物质中,摩尔比较小的一方往往会用完,而摩尔比较大的一方则会剩余一些。
例如,在2H2+O2→2H2O的化学方程式中,如果我们将1摩尔的氢气和0.5摩尔的氧气反应,根据化学计量比可以计算出氢气所需的最小氧气量为1摩尔。
因此,如果我们只提供0.5摩尔的氧气,它就成为了反应中的限制因素,氢气中剩余的0.5摩尔就不能反应。
利用化学方程式的简单计算最全

利用化学方程式的简单计算最全化学方程式是用化学符号和化学方程来描述化学反应的方式。
通过化学方程式,我们可以了解反应物与产物之间的物质的数量关系,从而进行计算。
下面将介绍几种常见的利用化学方程式进行简单计算的方法。
1.计算反应物与产物的物质的摩尔数关系:化学方程式中的化学式代表了物质里的原子或分子的数量。
根据方程式,可以计算反应物与产物的物质的摩尔数关系。
例如,对于反应式:2H2+O2->2H2O,可以得知每2摩尔的H2反应生成2摩尔的H2O。
2.计算反应物的摩尔数及质量:根据已知的反应物的摩尔数和化学式里的原子质量,可以计算反应物的质量。
例如,对于反应式:H2 + O2 -> H2O,已知2mol的H2,需要计算H2的质量。
根据氢气的摩尔质量(2g/mol),可以计算出质量为4g。
3.计算反应产物的摩尔数及质量:根据已知的反应物的摩尔数和化学式里的摩尔比,可以计算反应产物的摩尔数及质量。
例如,对于反应式:H2 + O2 -> H2O,已知4g的H2,需要计算产生的H2O的质量。
根据反应式的摩尔比为1:1,可以计算出摩尔数为2mol 的H2O,进而计算出质量为36g的H2O。
4.计算反应后剩余物质的摩尔数及质量:根据已知的反应物的摩尔数和化学式里的摩尔比,可以计算反应后剩余物质的摩尔数及质量。
例如,对于反应式:2H2 + O2 -> 2H2O,已知2mol的H2和2mol的O2,需要计算剩余的H2O的摩尔数和质量。
根据反应式的摩尔比为2:1,可以计算出剩余的摩尔数为1mol的H2O,进而计算出质量为18g的H2O。
5.计算反应过程中的气体的体积:对于气体反应,可以利用化学方程式计算反应过程中的气体的体积。
根据烧瓶法则(Avogadro's law),相同条件下,气体的体积与物质的摩尔数成正比。
例如,对于反应式:2H2 + O2 -> 2H2O,已知2mol的H2和1mol的O2,根据化学反应的摩尔比,可以计算出反应产生2mol的H2O。
物质的量应用于化学方程式的计算

物质的量应用于化学方程式的计算物质的量是描述化学反应和化学方程式中物质数量的重要概念。
在化学方程式中,物质的量由摩尔数来表示,通常以化学式前的系数来表示。
物质的量可以用于计算反应的产物和反应物的摩尔数、质量以及体积等。
在进行这些计算时,需要知道化学方程式中物质的摩尔比。
首先,可以使用化学方程式中物质的系数来计算反应物和产物之间的摩尔比。
例如,对于以下化学反应方程式:2H₂+O₂→2H₂O该方程式表示,2摩尔的氢气和1摩尔的氧气在反应中生成2摩尔的水。
这意味着摩尔比为2:1:2利用这个摩尔比,可以计算反应物或产物的摩尔数、质量或体积。
例如,可以使用已知的摩尔数来计算其他物质的摩尔数。
如果已知有3摩尔的氧气参与反应,根据摩尔比,我们可以计算出需要6摩尔的氢气来完全反应。
同样地,如果已知有5摩尔的水生成,我们可以计算出反应中消耗了10摩尔的氢气和5摩尔的氧气。
除了计算摩尔数外,物质的量还可以用来计算物质的质量或体积。
这可以通过已知物质的摩尔数和摩尔质量来完成。
物质的摩尔质量是指一个摩尔物质的质量,通常以克/摩尔(g/mol)来表示。
摩尔质量可以通过元素的原子质量表来确定。
例如,对于氢气(H₂),其摩尔质量为2.016 g/mol。
因此,我们可以使用摩尔质量来计算物质的质量。
例如,如果已知有5摩尔的水,根据水的摩尔质量(18.015 g/mol),可以计算出水的质量为90.075 g。
类似地,物质的量也可以用于计算物质的体积。
对于气体,可以使用理想气体定律来计算其体积。
理想气体定律表示为PV=nRT,其中P为气体的压力,V为气体的体积,n为气体的摩尔数,R为理想气体常数,T为气体的温度。
通过已知气体的摩尔数,可以使用理想气体定律来计算其体积。
例如,对于2摩尔的氢气,在已知的温度和压力下,可以通过理想气体定律计算出氢气的体积。
总结起来,物质的量在化学方程式中的应用是非常重要的。
它可以用于计算反应物和产物的摩尔数、质量和体积。
化学必修一物质的量计算

化学必修一物质的量计算物质的量(Mole)是化学中一个非常重要的概念,它用来描述物质中粒子的数量。
在化学反应和计量中,常常需要根据反应方程式中的化学式来计算物质的量。
本文将详细介绍物质的量计算的相关知识。
物质的量与粒子数量的关系:在化学中,物质的量用摩尔(mol)来表示。
而1摩尔的定义是,在单位质量为一个摩尔的物质中包含的粒子数目等于阿伏伽德罗常数(约为6.022 x 10^23)。
根据这个定义,我们可以得知不同物质的质量与其包含的粒子数有关。
质量与物质的量之间的关系:物质的质量与其数目相关,可以通过下面的公式计算:质量=物质的量×物质的摩尔质量(M)其中,物质的摩尔质量是指一个摩尔的物质的质量。
摩尔质量可以通过化学式中每个元素的相对原子质量之和来计算。
例如,对于H2O,摩尔质量就等于氢的相对原子质量(1.01 g/mol)与氧的相对原子质量(16.00 g/mol)之和,即18.01 g/mol。
根据这个公式,我们可以通过已知的物质的质量和摩尔质量来计算物质的量。
例如,如果已知一定质量的物质的摩尔质量为M,那么物质的量可以通过下面的公式计算:物质的量=质量/M物质的量与体积的关系:在气体的化学计量中,物质的量与体积有一个关系,即摩尔气体体积。
根据理想气体状态方程(PV=nRT),在一定温度和压力下,气体的物质的量和体积成正比。
这个关系可以用下面的公式表示:V=nRT/P其中,V表示气体的体积,n表示物质的量,R表示理想气体常数(约为0.0821 L·atm/(mol·K)),T表示温度,P表示压力。
在上述的公式中,注意单位的转化。
如果在公式中使用的是SI单位,那么P需要用帕斯卡(Pa)表示,V需要用立方米(m^3)表示,而温度T需要用开尔文(K)表示。
总结:通过上述的介绍,我们可以了解到物质的量在化学中具有重要的意义,可以根据物质的质量和摩尔质量来计算物质的量。
在气体的化学计量中,物质的量与体积有一个关系,可以用摩尔气体体积公式计算。
有关化学式和物质的量的计算

有关化学式和物质的量的计算化学式和物质的量的计算是化学中非常重要的一部分。
它们帮助我们理解化学反应的平衡,推导出化学方程式和进行实验室中的量化分析。
物质的量(也称为摩尔)是描述物质中的基本单位数量的值,以化学计量单位mol表示。
一个摩尔等于一个物质中含有的基本单位的数量。
基本单位可以是原子、分子、离子或其他化学物质的粒子。
通过知道物质的摩尔数,我们可以推导出物质的质量、体积和其他相关信息。
在化学方程式中,化学式表示了化学物质中不同原子的相对数量。
原子通过原子间键连接在一起,形成不同的分子和化合物。
化学式告诉我们每个元素在化合物中的摩尔比例,因此可以用来计算物质的量。
计算物质的量的方法可以通过以下几种方式进行:1.根据化学方程式:化学方程式提供了反应物和生成物的化学式。
通过平衡方程式,我们可以知道化学反应中不同物质的摩尔比例。
例如,对于反应式2H2+O2->2H2O,我们知道2摩尔的氢气与1摩尔的氧气反应生成2摩尔的水。
2. 根据质量:通过知道一个物质的质量,我们可以推导出物质的量。
这需要通过已知物质的摩尔质量来实现,摩尔质量是一个元素、分子或化合物的质量与物质的摩尔数的比值。
例如,如果我们知道一块铁的质量是55.845克(铁的摩尔质量为55.845g/mol),我们可以通过将质量除以摩尔质量来计算物质的量。
3.根据体积:对于气体,我们可以通过测量其体积来计算物质的量。
这基于理想气体定律,理想气体定律指出,在特定条件下,气体的压力、体积和温度成正比。
通过测量压力、体积和温度,我们可以使用理想气体定律来计算气体的物质的量。
物质的量的计算在化学实验室中是非常常见的,尤其是在化学分析和计量实验中。
通过计算物质的量,我们可以确定化学反应的条件和效果,评估反应产率,并理解物质的转化过程。
总之,化学式和物质的量的计算是化学中重要的概念。
它们帮助我们理解物质的组成和变化,并在实验室中提供定量化的结果。
通过掌握这些计算方法,我们可以更好地理解化学反应和化学物质的行为。
【化学知识点】物质的量在化学方程式计算的应用

【化学知识点】物质的量在化学方程式计算的应用物质的量在化学方程式计算的应用:在化学方程式中,各个物质分子式前面的系数之比,等于这些物质之间的物质的量之比。
利用这个原理,可以根据方程式中物质的系数之比,和已知某物质的物质的量,计算其他物质的物质的量。
物质的量之比就等于系数之比。
物质的量是国际单位制中7个基本物理量之一(7个基本的物理量分别为:长度(单位:m)、质量(单位:kg)、时间(单位:s)、电流强度(单位:A)、发光强度(单位:cd)、温度(单位:K)、物质的量(单位:mol),它和“长度”,“质量”,“时间”等概念一样,是一个物理量的整体名词。
其符号为n,单位为摩尔(mol),简称摩。
物质的量是表示物质所含微粒数(N)(如:分子,原子等)与阿伏加德罗常数(NA)之比,即n=N/NA。
阿伏伽德罗常数的数值为0.012kg ¹²C所含碳原子的个数,约为6.02×10²³。
它是把微观粒子与宏观可称量物质联系起来的一种物理量。
其表示物质所含粒子数目的多少。
物质的量是一个物理量,它表示含有一定数目粒子的集合体,符号为n。
物质的量的单位为摩尔,简称摩,符号为mol。
国际上规定,1mol粒子集体所含的粒子数与0.012kg 碳12中含有的碳原子数相同。
(1)设所求物质的物质的量为n(B)[或质量m(B)],或气体标准状况下体积V (B)、或溶液体积V[B(aq)]J。
(2)写出有关反应的化学方程式。
(3)在化学方程式有关物质的化学式下面先写出已知物和所求物的有关量的关系,再代入已知量和所求量。
(4)写出所求物质的数学表达式。
(5)写出解答和答案。
感谢您的阅读,祝您生活愉快。
如何使用化学式进行物质的分子量计算

如何使用化学式进行物质的分子量计算化学式是描述物质组成的化学符号的组合。
通过化学式,我们可以知道一个物质中包含哪些元素以及元素的摩尔比例。
根据化学式,我们可以使用相应的计算公式来确定物质的分子量。
物质的分子量是指一个分子中所包含的所有原子的相对分子质量的总和。
它是计算化学反应中物质的摩尔量的重要指标。
下面以一些具体的案例来介绍如何使用化学式进行物质的分子量计算。
案例一:水(H2O)的分子量计算水是由氢元素和氧元素组成的,化学式为H2O。
氢元素(H)的相对原子质量为1,氧元素(O)的相对原子质量为16。
根据化学式,我们可以知道一个水分子中包含2个氢原子和1个氧原子。
因此,水的分子量计算公式为:分子量(H2O)= 2 * 相对原子质量(H)+ 相对原子质量(O)= 2* 1 + 16 = 18案例二:二氧化碳(CO2)的分子量计算二氧化碳是由碳元素和氧元素组成的,化学式为CO2。
碳元素(C)的相对原子质量为12,氧元素(O)的相对原子质量为16。
根据化学式,我们可以知道一个二氧化碳分子中包含1个碳原子和2个氧原子。
因此,二氧化碳的分子量计算公式为:分子量(CO2)= 相对原子质量(C)+ 2 * 相对原子质量(O)= 12 + 2 * 16 = 44案例三:硫酸(H2SO4)的分子量计算硫酸是由氢元素、硫元素和氧元素组成的,化学式为H2SO4。
氢元素(H)的相对原子质量为1,硫元素(S)的相对原子质量为32,氧元素(O)的相对原子质量为16。
根据化学式,我们可以知道一个硫酸分子中包含2个氢原子、1个硫原子和4个氧原子。
因此,硫酸的分子量计算公式为:分子量(H2SO4)= 2 * 相对原子质量(H)+ 相对原子质量(S)+ 4 * 相对原子质量(O)= 2 * 1 + 32 + 4 * 16 = 98通过上述案例,我们可以看出,使用化学式进行物质的分子量计算可以通过以下步骤进行:1. 根据化学式确定物质中包含的元素以及元素的摩尔比例;2. 查找元素的相对原子质量;3. 根据元素的摩尔比例,计算每个元素的摩尔量;4. 将每个元素的摩尔量相加,得到物质的分子量。
化学解题技巧如何正确使用化学式计算物质的质量和量

化学解题技巧如何正确使用化学式计算物质的质量和量化学是一门基础性和应用性都很强的科学,解题是化学学习中的关键环节之一。
其中,计算物质的质量和量是化学解题中的基础问题之一。
本文将介绍一些化学解题技巧,帮助读者正确使用化学式计算物质的质量和量。
一、摩尔的概念在化学中,摩尔是计算物质的质量和量的基本单位。
摩尔的概念是指在标准条件下,物质的摩尔质量等于该物质的相对分子质量。
相对分子质量是以碳12的原子质量为12作为标准的,表示了化合物相对于碳12的质量。
摩尔质量的计算可以通过化学式和分子量的对应关系得出。
二、化学式计算质量1. 单质的质量计算对于化学式中只包含一个元素的单质物质,可以直接使用该元素在周期表中的相对原子质量来表示其质量。
例如,氧气(O2)的摩尔质量等于32g。
2. 化合物的质量计算化合物的质量计算需要考虑每个元素在化学式中的个数,并且要乘以相应的原子质量。
这可以通过化学式中的下标来确定。
例如,二氧化碳(CO2)的摩尔质量计算为:C的摩尔质量(12g/mol)乘以1,加上O的摩尔质量(16g/mol)乘以2,等于44g/mol。
三、化学式计算物质的量1. 通过质量计算物质的摩尔数通过已知的质量计算物质的摩尔数需要使用以下公式:摩尔数 = 质量 / 摩尔质量。
例如,已知某个物质的质量为32g,其摩尔质量为16g/mol,则该物质的摩尔数计算为:32g / 16g/mol = 2mol。
2. 通过摩尔数计算物质的质量通过已知的摩尔数计算物质的质量需要使用以下公式:质量 = 摩尔数 * 摩尔质量。
例如,已知某个物质的摩尔数为2mol,其摩尔质量为16g/mol,则该物质的质量计算为:2mol * 16g/mol = 32g。
四、应用案例案例一:计算反应物质量已知氢气和氧气按照化学式2H2 + O2 → 2H2O反应生成水,求生成1mol水所需的氢气和氧气的质量。
解答:根据反应的化学式可知,2mol氢气和1mol氧气反应生成2mol水。
化学式量的计算

化学式量的计算化学式量是指化学反应中化学物质的量。
它是化学方程式中各种物质的摩尔系数比,用来描述化学反应中反应物与生成物之间的摩尔关系。
化学式量是化学计量学的基础,可用于计算反应物的摩尔数、质量、体积以及反应的产物量等。
化学式量的计算通常包括以下几个步骤:1.确定化学方程式:在计算化学式量之前,首先需要确定化学反应的化学方程式。
化学方程式中的化学符号表示化学物质,化学方程式中的摩尔系数表示反应物与生成物之间的摩尔比。
在计算化学式量时,需要根据化学方程式中的摩尔系数进行计算。
2.转化物质的质量为摩尔数:在计算化学式量时,通常会给出反应物的质量,需要将其转化为摩尔数。
这可以通过使用物质的摩尔质量来实现。
摩尔质量是指物质的质量与物质的摩尔数之间的关系,通常以g/mol表示。
根据物质的摩尔质量,可以将质量转化为摩尔数,即摩尔质量=质量/摩尔数。
3.使用化学方程式中的摩尔比进行计算:根据化学方程式中的摩尔系数,可以计算出反应物与生成物之间的摩尔比。
摩尔系数表示化学物质在反应中参与的摩尔数,可以理解为反应物与生成物之间的化学比例。
根据摩尔系数,可以计算出反应物与生成物之间的摩尔比。
4.计算产物的质量或体积:根据化学方程式和摩尔比,可以计算出反应的产物的摩尔数。
根据产物的摩尔数和摩尔质量,可以计算出产物的质量或体积。
化学式量的计算可以应用于各种化学反应。
例如,当我们知道反应物的质量时,可以计算出该反应所产生的化学物质的摩尔数。
这对于实验室中的化学制备和工业生产都非常重要。
化学式量的计算也可以帮助我们理解反应的机理和反应物与生成物之间的摩尔关系。
总之,化学式量的计算是化学计量学中的一个重要内容。
它可以帮助我们理解反应物与生成物之间的摩尔关系,并在实验室和工业生产中进行化学物质的计量和控制。
化学式量的计算需要清晰的思维和良好的数学运算能力,但通过学习和实践,我们可以掌握这一重要的化学概念和计算方法。
化学式量的计算

化学式量的计算化学式量的计算是化学中非常重要的一部分,它用来描述化学反应中物质的量的关系。
化学式量可以通过化学方程式中的系数来确定,它代表了反应物和生成物之间的摩尔比例关系。
在化学式量的计算中,我们需要掌握一些基本概念和计算方法。
化学式量的计算需要先确定化学方程式。
化学方程式是描述化学反应的符号表示,它由反应物和生成物的化学式以及反应条件组成。
在化学方程式中,反应物和生成物的化学式前面的系数表示了它们的摩尔比例关系。
我们可以根据化学方程式中的系数来计算化学式量。
例如,对于以下化学方程式:2H2 + O2 → 2H2O其中,2H2表示2个氢气分子,O2表示1个氧气分子,2H2O表示2个水分子。
根据化学方程式,我们可以得知氢气和氧气的摩尔比例为2:1,水的摩尔比例为2:2。
因此,根据摩尔比例关系,我们可以得知氢气和氧气的化学式量分别为2和1,水的化学式量为2。
在化学式量的计算中,我们还需要考虑化学物质的摩尔质量。
摩尔质量是一种物质的质量与其摩尔数的比值,通常以单位摩尔/克表示。
我们可以通过元素的相对原子质量来计算化学物质的摩尔质量。
例如,氧气的摩尔质量为32g/mol,氢气的摩尔质量为2g/mol,水的摩尔质量为18g/mol。
根据摩尔质量的概念,我们可以进一步计算化学式量与质量之间的关系。
化学式量与质量的关系可以通过以下公式来表示:化学式量 = 质量 / 摩尔质量例如,如果我们知道氢气的质量为4g,那么我们可以通过化学式量与质量的关系来计算氢气的化学式量:化学式量 = 4g / 2g/mol = 2mol同样地,如果我们知道水的质量为36g,那么我们可以计算水的化学式量:化学式量 = 36g / 18g/mol = 2mol在化学式量的计算中,我们还需要考虑化学反应的限定性。
限定性是指在化学反应中某些物质的量不足以完全反应,从而限制了反应的进行。
在化学式量的计算中,我们需要根据化学方程式中的系数和反应物的量来确定哪种物质是限定性的。
化学式的实际量计算

思考题:
某校902班小东同学从网上收集的某硝酸铵化 肥外包装袋标签如图所示,请计算该袋化肥的纯 度(即化肥中硝酸铵的质量分数)。
硝酸铵 (NH4NO3) 含氮量: 净重:50kg 34.3% ××化学工业公司 含氮量:34.3% ××化学工业公司
(2)80g氧化铁中铁元素质量是多少克?
二、计算物质质量
例题2:多少克二氧化碳中含有6g碳元素?
Байду номын сангаас
总结:物质质量=元素质量 ÷ 该元素质量分数
练习:
(1)多少克水中含有16g氧元素?
(2)多少克硝酸铵中含有14g氮元素?
三、已知物质质量求物质质量
例题3:多少克SO2和80 gSO3中氧元素质量相 等? 练习: 1、多少克二氧化碳和56g一氧化碳中氧 元素质量相等? 2、245g氯酸钾和多少克高锰酸钾中氧 元素质量相等?
化学式的实际量计算
一、计算物质中元素的质量
例题1:11g二氧化碳中含有多少克碳?
总结:元素质量=物质质量 × 该元素质量分数
解:设11g二氧化碳中含有碳元素的质量为x
CO2 ————— C
44
11g
12
x
44:12=11g:x
x=3g
答:11g二氧化碳中含有3克碳。
练习:
(1)32g二氧化硫中含有多少克氧元素?
如何使用化学式进行物质的化学计量计算

如何使用化学式进行物质的化学计量计算物质的化学计量计算是化学中的重要内容之一,在实验室中,我们常常需要根据给定的化学式计算物质的质量、摩尔数等参数。
本文将介绍如何使用化学式进行物质的化学计量计算。
一、什么是化学计量计算化学计量计算是指根据化学反应的化学式,通过计算得到物质的质量、摩尔数等数值。
化学计量计算基于化学反应的平衡,通过化学式中的系数关系,确定各个物质的摩尔比例和质量比例。
二、化学式表示物质组成与摩尔比例化学式是用化学元素符号和下标表示化合物中的原子数目,它可以准确地表示物质的组成和摩尔比例。
以化学式H2O为例,其中H表示氢原子,O表示氧原子,下标2表示氢原子的个数,无下标的O表示氧原子的个数。
根据这个化学式可以得知,1分子H2O中含有2个氢原子和1个氧原子。
三、如何计算物质的质量对于给定的化学式,我们可以根据元素的相对原子质量计算出该化合物的摩尔质量。
摩尔质量的计算方法是将各个元素的原子质量乘以其在化学式中的个数,然后将这些值相加。
以NaCl为例,Na的原子质量为23,Cl的原子质量为35.5,则NaCl的摩尔质量为23+35.5=58.5 g/mol。
根据摩尔质量,我们可以计算出给定质量的物质含有多少个摩尔。
例如,如果我们有10g的NaCl,根据NaCl的摩尔质量,可以得知10gNaCl含有10/58.5≈0.171mol的NaCl。
四、如何计算物质的摩尔比例在化学反应中,不同物质的摩尔比例对于确定反应的产物量非常重要。
根据化学式中的系数关系,我们可以得到物质的摩尔比例。
以反应2H2+O2→2H2O为例,化学式告诉我们2摩尔H2可以和1摩尔O2反应生成2摩尔H2O。
根据摩尔比例,我们可以计算出给定量的物质所需的其他物质的摩尔数。
例如,如果我们有1mol的H2,根据化学式,可以得知1mol的H2可以和0.5mol的O2反应生成1mol的H2O。
五、如何确定化学式中的系数化学式中的系数表示反应物和产物的摩尔比例关系,它们对于计算物质的质量和摩尔比例非常重要。
有关化学式和物质的量的计算

【有关化学式与物质的量的计算】知识点常用的计算关系式(以化合物A m B n 为例):相对分子质量即式量1、相对分子质量=A 的相对原子质量×m+B 的相对原子质量×n3、A 、B 元素的质量比4、A 元素的质量=化合物质量×A 的质量分数5、两种元素的原子个数比等于它们的质量比除以相对原子质量之比.6、物质的量的概念、单位、意义、微粒个数、摩尔质量A 、物质的量是国际单位制中七个基本物理量之一,符号是n ;B 、用来表示物质所含微粒数目多少;C 、单位是摩尔,单位的符号是mol ;D 、每摩尔物质都含有约6.02×1023个微粒;E 、每摩尔物质的质量是该物质的摩尔质量,单位是g/mol ,数值上等于式量。
7、有关物质的量的基本计算(物质的量、质量、摩尔质量和微粒数目之间的换算) 两个计算公式的熟练运用XmolA m B n ~ XmolA m B n 分子 ~ mXmolA 原子 ~ nXmolB 原子 ~ (m+n )Xmol 原子 其中:N------------微粒数目M------------摩尔质量N A ------------6.02×1023m ------------质量n ------------物质的量8、化学方程式中物质的量的计算:根据化学方程式求反应物、生成物的物质的量之比: 方程式中配平后的物质前面的系数之比就是物质之间的物质的量之比(数量之比) 典型例题基础题1、尿素是一种常用氮肥,其化学式为CO(NH 2)2,该物质由 种元素组成,每个尿素分子是由_________个原子构成的,其中C 、H 、O 、N 原子个数比为_____________________,式量为____________,尿素中碳、氢、氧、氮元素的质量比m C ∶m H ∶m O ∶m N (式量)2、A 的质量分数 n n m N ÷N A N A× M ÷ ×M= ;尿素中氮元素元素的质量分数为。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.利用化学式计算式量化学式是用元素符号来表示物质组成的式子,化学式中各原子的相对原子质量的总和就是式量。
在计算式量时应注意:(1)相对原子质量没有单位,因此式量也没有单位,是相对质量。
(2)同种元素的原子可以合并计算。
(3)当分子中含有多个原子团时,可先将原子团的式量计算出,再乘以原子团的个数。
2.利用化学式计算组成物质的各元素的质量比。
根据化学式先计算出物质中所含元素各自的相对原子质量总和,依据相对原子质量总和列出比例式,再化简成整数比值。
3.利用化学式计算物质中某一元素的质量分数。
先根据化学式算出式量,再算出某一元素的质量分数,其数学表达式为:上式求得的就是分子中某一元素的质量分数。
4.利用化学式计算一定质量的物质中某一元素的质量。
根据物质中某一元素的质量分数可以计算出一定质量的某物质(纯净的或不纯净的)中某元素的质量。
5.有关相对原子质量的计算和化学式的确定。
根据化学式及相关条件可以计算组成该物质的各元素的相对原子质量,也可以根据组成某物质各元素的质量关系确定该物质的化学式。
1.计算CuSO4·5H2O的式量分析:CuSO4·5H2O组成中,是由CuSO4和5个H2O分子组成的,因此是二者相对质量之和。
解答:CuSO4·5H2O的式量=64+32+16×4+(1×2+16)×5=2502.计算NH4NO3中所含各元素的质量比分析:从NH4NO3的化学式知:组成硝酸铵的三种元素是N、H、O,在一个NH4NO3中分别计算各元素的相对质量比即硝酸铵中各元素的质量比。
解答:∵mN:mH:mO=(14×2):(1×4):(16×3)=28 : 4 : 48=7 : 1 : 12∴N、H、O三种元素的质量比为7:1:123.某黄铁矿中含FeS为72%,计算该黄铁矿中硫元素的质量分数是()2A.36%B.38.4%C.42.6%D.48%分析1:黄铁矿中含FeS2为72%,其余为杂质,再根据化学式算出FeS中硫的质量分数。
2设取黄铁矿100克,则其中FeS2的质量为:100×72%=72克,在7 2克FeS2中所含硫的质量为:分析2:也可以根据对应关系计算:设100克黄铁矿中含硫的质量为x。
对应关系:黄铁矿~含FeS2~含2S100克100×72%=72克x克12032×2列出比例式:x=38.4克解:本题的正确答案应选B.4.有气肥(化学式为NH4HCO3)样品50克,其中含NH4HCO3为96%,则该气肥样品中所含氮元素的质量为()A.17克B.8.5克C.6.5克D.4克分析1:样品中含NH4HCO3 96%,说明样品为不纯净的物质。
利用纯度可以计算出50克样品中纯NH4HCO3的质量,再根据气肥的化学式算出所含氮元素的质量分数,利用氮元素质量分数便可计算氮元素的质量。
50克气肥样品中所含纯NH4HCO3的质量:50×96%=48克NH4HCO3中氮元素的质量分数:∴50克样品中所含氮元素的质量:48×17.7%=8.5克分析2:也可以根据对应关系计算,设50克气肥样品中含氮元素的质量为x。
对应关系:气肥样品~含NH4HCO3~含N791450克50×96%=48克x克列出比例式:x=8.5克解答:本题的正确答案应选B。
5.某元素R的单质跟氧气化合生成的氧化物中,R元素跟氧元素的质量比为21: 8,原子个数比为3:4,又知氧元素的相对原子质量为16,则元素R的相对原子质量为()A.24B.27C.56D.65分析:由于已知氧化物中R原子与氧原子的个数比,可以写出氧化物的化学式;又知R元素和氧元素的质量比,根据化学式可以求算出元素R的相对原子质量。
设元素R的相对原子质量为x∵在氧化物中R原子与氧原子的个数比为3:4∴R元素所形成的氧化物的化学式为:R3O4又∵氧元素的相对原子质量为16,且二者之间的质量比为21:8,x=56解答:本题的正确答案应选C。
6.某化合物由Na、S、O三种元素组成的,其钠元素在化合物中的质量分数为32.4%,硫元素在化合物中的质量分数为22.5%,且该化合物的式量为14 2,那么该化合物的化学式为__________。
分析:用计算方法推知化合物的化学式,根据化合物的式量和各元素的质量分数,推算在一个分子里各元素的原子个数,便可知该化合物的化学式。
计算过程如下:∴该化合物的化学式为Na2SO4解答:Na2SO41.某NH4Cl样品中含有92%的NH4Cl,其中所含氮元素的质量分数是()A.46%B.34%C.28%D.24%的两种物质中,相同的是()2A.氧元素的质量分数B.硫元素的质量分数C.元素种类D.原子个数比3.下列物质中,属于纯净物的是()A.含的65%的氧化铁B.含氮32%的硝酸铵C.含钙40%的碳酸钙D.含碳25%的二氧化碳4.A、B两种化合物均由R和氧两种元素组成的,在化合物A和B中,R元素的质量分数分别为50%和40%,若A的化学式为RO2,则B的化学式为()A.R2OB.ROC.R2O3D.RO35.在含四氧化三铁58%的磁铁矿石中,铁元素的质量分数为a%,在含氧化铁60%的赤铁矿石中,铁元素的质量分数为b%(杂质中均不含铁),则a和b 的数值关系正确的是()A.a=bB.a<bC.a>bD.无法确定答案:1.D 2.C 3.C 4.D 5.A2010年中考化学复习之有关化学式的计算复习导引依据化学式计算的主要类型有:计算相对分子质量;计算化合物中各元素的质量比;计算化合物中各元素的质量分数。
复习导引认识化学式的意义是掌握有关化学式计算的基础。
化学式表示的意义:宏观上,表示该物质由哪几种元素组成,如硫酸(H2SO4)由H、S、O三种元素组成;微观上,当物质是由分子构成时,表示该物质的一个分子,以及一个分子中每一种元素原子的个数。
如H2SO4表示每一个H2SO4分子中含有2个H、1个S和4个O。
充分认识和真正理解化学式这两方面的意义后,才能依此进行有关化学式的计算。
1:据Internet(国际互联网)报道:由中国等六国共同破译人类基因图的工作终于在近年完成。
基因图的破译将帮助医生治疗包括癌症在内的很多疾病,C9H13O7N7P是组成基因物质的一部分。
其中含种元素,各元素的原子个数比为:C:H:O:N:P=。
2:下列物质中铁元素的质量分数最高的是()A.FeO B.Fe2O3C.Fe3O4 D.Fe2(SO4)3点拨:以FeO为标准,将Fe的原子个数定为1,把各式变形即可。
3:由Na2SO4、Na2SO3、Na2S三种物质组成的混合物中,测得氧元素的质量分数为22%,则其中钠元素的质量分数为()A.无法确定B.23%C.46% D.32.6%4:(1)在食盐中加入适量的碘酸钾(KIO3),可以有效地预防碘缺乏病。
根据碘酸钾的化学式计算:①KIO3的相对分子质量为;②我国规定,食盐加碘的含量为每千克含碘0.035g,相当于每千克食盐含碘酸钾 g。
(2)根据尿素的[CO(NH2)2]化学式计算:①尿素的相对分子质量为;②有一不纯的尿素样品,测知含氮元素44.8%,若已知杂质不含氮元素,此化肥的有效成分尿素的质量分数为。
5:X、Y元素能形成两种化合物C1、C2,C1中含X元素75%,含Y元素25%,C2中含X元素80%,含Y元素20%,若C1的化学式为XY4,则C2的化学式是()A.X2Y4 B.X2Y6C.X3Y2 D.X2Y36:X、Y两元素的相对原子质量之比为7:2,由它们组成的一种化合物中,X、Y 两元素的质量比为21:8,则这种化合物的化学式为()A.XY2 B.X2Y3C.X3Y4 D.X2Y7:由某氧气和二氧化硫的混合气体,其氧元素的质量分数为60%,则该混合气体中氧气与二氧化硫的质量比为。
8:在高温下用碳充分还原8.0g氧化铁得5.6g铁,氧的相对原子质量为16,则铁的相对原子质量为。
9、某元素的+3价的氧化物中,该元素与氧元素的质量比为13:6,则这种元素相对原子质量为()A.26 B.52 C.78 D.10410、某元素相对原子质量为27,其硫酸盐的相对分子质量为342,则该金属元素硝酸盐(化合价不变)的相对分子质量为()A.89 B.151C.213 D.24011、下列化肥中含氮元素的质量分数最高的是()A.NH4Cl B.NH4NO3C.(NH4)2SO4 D.CO(NH2)212、相同质量的CO和CO2中,碳元素的质量比为()A.1:1 B.7:11C.11:7 D.14:1113、某金属元素,它的氢氧化物的相对分子质量为m,它的氯化物的相对分子质量为n,则该金属元素的化合价为()14、由X、Y两种元素组成的化合物中,X和Y的质量比是3:1,又知X与Y的相对原子质量之比是12:1,则能够表示此化合物化学式的是()A.XY4 B.XY3 C.XY D.X2Y15、化合物X2Y3中含Y为50%,化合物YZ中含Y为25%,则化合物X2Y2Z3中含Y的质量分数为()A.14.29% B.28.57%C.42.86% D.57.14%16、含某种杂质的氧化铁粉末,测知其含氧32.5%,这种杂质可能是()A.CuO B.CuC.Fe D.SiO217、某化合物完全燃烧,需要4.8g氧气,同时只生成4.4g二氧化碳和2.7g水,则该化合物中()A.含有碳、氢、氧三种元素B.只含碳、氧两种元素C.只含碳、氢两种元素D.无法确定18、葡萄中由含量丰富的白藜芦醇(化学式为C14H12O3),它具有抗癌性,能抑制癌细胞的增生。
求:①白藜芦醇的相对分子质量;②白藜芦醇中碳、氢、氧元素的质量比;③含碳元素质量相等的白藜芦醇与二氧化碳的质量比。
19、有一灰锰氧(高锰酸钾的俗名)样品(杂质中不含有氧元素),经分析知,含氧元素的质量分数为34.2%,计算该样品中高锰酸钾的质量分数。
20、金属M的氧化物1.6g充分还原后生成1.12g金属M,若该氧化物的化学式M2O3,求M的相对原子质量。
21. 某含有C、O两种元素的混合气体中,经测定, C元素的质量分数为30%,则该混合物中()A.一定有CO2 B.一定有COC.一定有O2 D.一定有CO2、CO。
