有机金属配合物
有机金属配合物

7-7-1-2 金属羰基化合物成键的表征:
分子振动光谱( 红外, 拉曼)
反馈键强, CO的 轨道的电子云密度增大
则C O间的键级减弱
力常数减小
振动频率减低
结论: 中心M 的电子云密度越大, 或者给电子能力越强, 反馈键越强, CO越小
7-7-1-3 金属羰基化合物中 三种典型的CO配位方式:
:C O: :C N-R :C S: + :N O: :N N:
讨论: 不同膦配体取代CO后, 其他CO的红外振 动频率如何变化?
fac-Mo(CO)3L3,
fac-Mo(CO)3py3
fac-Mo(CO)3(PPh3)3
1888, 1746 cm–1
1934, 1836 cm–1
fac-Mo(CO)3(P(OMe)3)3
7-7-1-4 金属羰基化合物的制备
a. 直接合成法
Ni(s)+4CO(g) Ni(CO)4(l)
Fe(s)+5CO(g) Fe(CO)5(l) (200º C, 200atm) Co(s)+8CO(g) Co2(CO)8(s) (150º C, 35atm)
合成Fe(CO)5的高压反应釜
(AlCl3, 苯)
Re2O7(s) + 17CO(g) Re2(CO)10(s) + 7CO2
(250º C, 350 atm)
Ru(acac)3(soln)+H2+12CO(g) Ru3(CO)12(s) + ….
(150º C, 200 atm, CH3OH)
d. 从具有反应活性的有机羰基化合物制备 例如:
OC CO OC CO M = Mn, Tc, Re CO OC Fe CO CO CO
有机小分子和金属配合物的合成和应用

有机小分子和金属配合物的合成和应用有机小分子和金属配合物,作为一类重要的化学物质,在生活中扮演着重要的角色。
它们的合成和应用十分广泛,涉及到诸多领域,例如生物医药、材料科学、工业制造等。
本文将从这些方面展开探讨。
一、有机小分子的合成和应用有机小分子是由碳、氢、氧、氮等元素组成的分子,具有结构简单、反应灵活等特点。
它们的合成通常通过有机合成化学的方法进行,例如取代反应、加成反应、消除反应等。
有机小分子在生物医药领域中应用广泛,如药物合成、生化分析和生物成像等方面。
例如,阿司匹林以及其它抗炎、抗风湿药物,都是有机小分子药物。
此外,有机小分子也可以用于有机电池、有机发光二极管等有机电子领域。
它们在这些领域中的广泛应用,为我们的生活带来了很多便利。
二、金属配合物的合成和应用金属配合物是由金属离子和配体形成的化合物。
它们的合成可以通过配位化学方法进行。
配体的选择和金属的选用都可以影响金属配合物的性质和应用。
金属配合物在生物医药、材料科学、工业制造等领域中发挥着重要作用。
在生物医药领域,金属配合物可以用作抗癌药物、MRI对比剂和光动力治疗等。
例如,顺铂等铂类抗癌药物是目前治疗癌症的主要药物之一。
此外,金属配合物也可以用于催化反应、催化剂载体、氧化还原反应等工业领域。
金属配合物的广泛应用,为我们的生活带来了很多便利。
三、有机小分子和金属配合物的合成联用有机小分子和金属配合物的联用,是目前化学研究的热点之一。
这种联用可以形成新的混合物质,这些混合物有着更好的性能和应用。
例如,铂配合物和有机小分子相结合,可以制备出性能更优异的电化学传感器和催化剂。
在生物医药领域,有机小分子和金属配合物的联用也有很多应用。
如金属配合物与药物的结合,可以增强药物的稳定性和选择性,从而提高药物的作用效果。
此外,在材料科学领域,有机小分子和金属配合物的联用也有广泛的潜在应用,例如固态发光材料、传感器等。
总之,有机小分子和金属配合物的合成和应用涉及到生活的方方面面,从药物治疗到工业生产,从电子领域到材料科学。
金属有机配合物

7-1 金属茂及其催化不对称合成
环戊二烯的负离子, 即 环戊二烯基叫茂, 记作 Cp-。 20 世纪初 ,Wilkinson 等人发现 Cp- 和 Fe2+ 反应生成 Cp2Fe, 叫铁 茂。
这类金属环戊二烯基化合物, 统称为金属茂。
金属茂化学蓬勃发展起来,开创了近代金属有机 化学的新时代。因此 ,Wilkinson 获得了 1973 年的诺贝尔化学奖。
第七章 金属有机配合物
定义:至少含有一个金属-碳键的化合 物称为金属有机配合物
范畴:无机化学和有机化学的交叉学科
金属有机化学研究的主要内容: 过渡金属和稀土元素配合物
金属有机化合物合成和结构多种多样;促进 了基础化学的发展
在工业、精细有机合成、催化剂、新型功 能材料的开发、生命科学等方面具有重要 意义。
➢ 通过围绕键的旋转而产生的分子中原子或基团在 空间的不同排列方式,称为构象。
➢ 其中较稳定的结构,称为该化合物的构象异构体。 ➢ 上下两个茂旋转,形成一系列构象,相对夹角为构象
角α ➢ α=0°为覆盖型 ➢ α =36°为交错型
绝大多数金属茂是交错型构象。
也发现有覆盖型的 , 如 (Me4Cp)2 Ru。
• Al(Me)3+H2O (MeAlO) n (11)
可作为聚合催化剂的金属茂的类型
(M=Ti,Zr,Hf;X=Cl,Br; R=Me)
大多数是柄型夹心化合物 , 是手性分子。这些分子比较刚 性 ,活性空位 ,手性源位置固定且比较接近。
最大的优点是:
结构一致性 , 从而导致催化活性位置的单一 , 这就保证了 催化聚合物的窄分子量分布,这是金属茂聚合物性能上优 于传统催化剂聚合物的原因。
开环夹心化合物又叫开环金属茂,与金属茂比 较 , 其配位体是戊二烯(7)的负离子-戊二烯
铝常见的配合物

铝常见的配合物铝作为一种重要的过渡金属元素,在化学反应中具有重要的作用。
铝(II)配合物是研究铝化学反应的一个重要方面,它们在金属有机化学、药物化学、催化剂制备等领域具有广泛的应用。
铝的配合物主要包括以下几类:金属铝离子、铝盐、有机铝化合物和无机铝化合物。
1. 金属铝离子配合物金属铝离子配合物是铝最常见的配合物类型。
铝离子(Al3+)可以与多种配体形成配合物,例如水、氨、乙酸等。
这些配合物可以作为催化剂、药物分子、材料等。
例如,AlCl3作为一种重要的氯化铝配合物,广泛应用于水处理、生物医学和催化领域。
2. 铝盐配合物铝盐配合物主要是由铝与其他阳离子形成的盐,如NaAlO2、Al(NO3)3等。
这些铝盐配合物在水处理、燃料电池和光电材料等领域具有重要应用。
例如,NaAlO2作为一种重要的水处理剂,可以去除水中的有机物和重金属离子。
3. 有机铝化合物有机铝化合物是由有机基团与铝离子形成的配合物。
这些化合物在有机合成、药物化学和材料科学等领域具有广泛的应用。
例如,ZIF-8是一种广泛应用的有机金属配合物,可以作为催化剂、吸附剂和材料。
4. 无机铝化合物无机铝化合物是由铝与其他元素形成的化合物,如Al(OH)3、AlF3等。
这些化合物在水处理、催化剂和材料科学等领域具有重要应用。
例如,Al(OH)3作为一种重要的吸附剂,可以去除水中的有机物和重金属离子。
铝的配合物在化学反应中具有重要的作用。
金属铝离子配合物、铝盐配合物、有机铝化合物和无机铝化合物等不同类型的配合物在各个领域具有广泛的应用。
随着对铝化学反应的深入研究,铝配合物的应用范围将不断扩大。
金属-有机配位体配合物的稳定常数
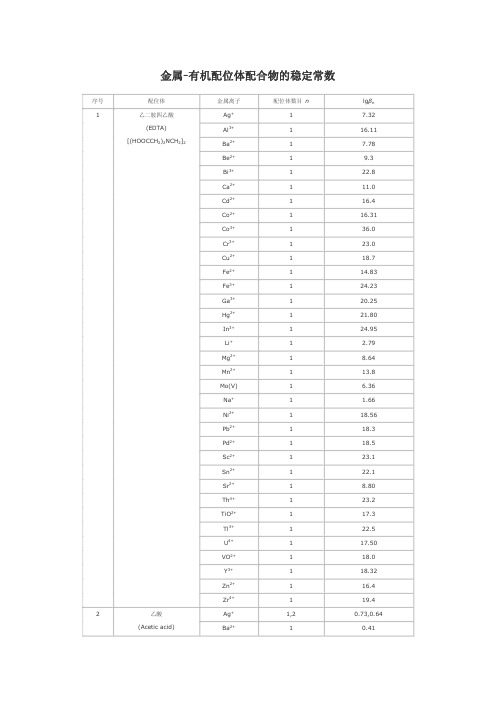
金属有机配位体配合物的稳定常数序号 配位体 金属离子配位体数目 nlg βn Ag + 1 7.32 Al 3+ 1 16.11 Ba 2+ 1 7.78 Be 2+ 1 9.3 Bi 3+ 1 22.8 Ca 2+ 1 11.0 Cd 2+ 1 16.4 Co 2+ 1 16.31 Co 3+ 1 36.0 Cr 3+ 1 23.0 Cu 2+ 1 18.7 Fe 2+ 1 14.83 Fe 3+ 1 24.23 Ga 3+ 1 20.25 Hg 2+ 1 21.80 In 3+ 1 24.95 Li + 1 2.79 Mg 2+ 1 8.64 Mn2+ 1 13.8 Mo(V)1 6.36 Na + 1 1.66 Ni 2+ 1 18.56 Pb 2+ 1 18.3 Pd 2+ 1 18.5 Sc 2+ 1 23.1 Sn 2+ 1 22.1 Sr 2+ 1 8.80 Th 4+ 1 23.2 TiO 2+ 1 17.3 Tl 3+ 1 22.5 U 4+ 1 17.50 VO 2+ 1 18.0 Y 3+ 1 18.32 Zn 2+ 1 16.4 1乙二胺四乙酸 (EDTA)[(HOOCCH 2)2NCH 2]2Zr4+ 1 19.4 Ag + 1,2 0.73,0.64 2 乙酸 (Acetic acid)Ba2+ 10.41Ca 2+ 1 0.6 Cd 2+ 1,2,3 1.5,2.3,2.4 Ce 3+ 1,2,3,4 1.68,2.69,3.13,3.18Co 2+ 1,2 1.5,1.9 Cr 3+ 1,2,3 4.63,7.08,9.60 Cu 2+ (20℃)1,2 2.16,3.20 In 3+1,2,3,4 3.50,5.95,7.90,9.08Mn 2+ 1,2 9.84,2.06 Ni 2+ 1,2 1.12,1.81 Pb 2+ 1,2,3,4 2.52,4.0,6.4,8.5 Sn 2+ 1,2,3 3.3,6.0,7.3 Tl 3+ 1,2,3,46.17,11.28,15.10,18.3Zn2+ 1 1.5 Al 3+ (30℃) 1,2 8.6,15.5 Cd 2+1,2 3.84,6.66 Co 2+ 1,2 5.40,9.54 Cr 2+ 1,2 5.96,11.7 Cu 2+ 1,2 8.27,16.34 Fe 2+ 1,2 5.07,8.67 Fe 3+ 1,2,3 11.4,22.1,26.7Hg 2+ 2 21.5 Mg 2+ 1,2 3.65,6.27 Mn 2+ 1,2 4.24,7.35 Mn 3+ 3 3.86Ni 2+ (20℃) 1,2,3 6.06,10.77,13.09Pb 2+2 6.32 Pd 2+ (30℃)1,2 16.2,27.1 Th 4+1,2,3,4 8.8,16.2,22.5,26.7 Ti 3+ 1,2,3 10.43,18.82,24.90 V 2+ 1,2,3 5.4,10.2,14.7 Zn 2+ (30℃)1,2 4.98,8.81 3 乙酰丙酮 (Acetyl acetone) CH 3COCH 2CH 3Zr4+1,2,3,48.4,16.0,23.2,30.1Ag + 1 2.41 Al 3+ 1,2,3 7.26,13.0,16.3Ba 2+ 1 2.31 Ca 2+ 1 3.0 Cd 2+ 1,2 3.52,5.77 Co 2+ 1,2,3 4.79,6.7,9.7 Cu 2+ 1,2 6.23,10.27 4 草酸 (Oxalic acid) HOOCCOOHFe2+ 1,2,32.9,4.52,5.22Fe 3+ 1,2,3 9.4,16.2,20.2Hg 2+ 1 9.66 Hg 2 2+ 2 6.98 Mg 2+ 1,2 3.43,4.38 Mn 2+ 1,2 3.97,5.80 Mn 3+ 1,2,3 9.98,16.57,19.42 Ni 2+ 1,2,3 5.3,7.64,~8.5 Pb 2+ 1,2 4.91,6.76Sc 3+ 1,2,3,46.86,11.31,14.32,16.70Th 4+ 4 24.48 Zn 2+ 1,2,3 4.89,7.60,8.15 Zr4+ 1,2,3,49.80,17.14,20.86,21.15Ba 2+ 1 0.64 Ca 2+ 1 1.42 Cd 2+ 1 1.70 Co 2+ 1 1.90 Cu 2+ 1,2 3.02,4.85Fe 3+ 1 7.1 Mg 2+ 1 1.37 Mn 2+ 1 1.43 Ni 2+ 1 2.22 Pb 2+ 1,2 2.40,3.80Sc 2+ 1 5.2 Th 4+ 1 5.5 5 乳酸 (Lactic acid) CH 3CHOHCOOHZn2+ 1,2 2.20,3.75 Al 3+ 1 14.11 Cd 2+ 1 5.55 Co 2+ 1,2 6.72,11.42 Cr 2+ 1,2 8.4,15.3 Cu 2+ 1,2 10.60,18.45 Fe 2+ 1,2 6.55,11.25 Mn 2+ 1,2 5.90,9.80 Ni 2+ 1,2 6.95,11.75 Th 4+ 1,2,3,44.25,7.60,10.05,11.60TiO 2+ 1 6.09 V 2+ 1 6.3 6 水杨酸 (Salicylic acid) C 6H 4(OH)COOHZn2+ 1 6.85Al 3+ (0.1mol/L) 1,2,3 13.20,22.83,28.89Be 2+ (0.1mol/L) 1,2 11.71,20.81 7 磺基水杨酸 (5sulfosalicylicacid)Cd 2+ (0.1mol/L)1,216.68,29.08Co 2+ (0.1mol/L) 1,2 6.13,9.82 Cr 3+ (0.1mol/L) 1 9.56 Cu 2+ (0.1mol/L) 1,2 9.52,16.45 Fe 2+ (0.1mol/L) 1,2 5.9,9.9 Fe 3+ (0.1mol/L) 1,2,3 14.64,25.18,32.12Mn 2+ (0.1mol/L) 1,2 5.24,8.24 Ni 2+ (0.1mol/L) 1,2 6.42,10.24 Zn 2+ (0.1mol/L)1,2 6.05,10.65Ba 2+2 1.62 Bi 3+3 8.30 Ca 2+ 1,2 2.98,9.01Cd 2+ 1 2.8 Co 2+ 1 2.1Cu 2+ 1,2,3,43.2,5.11,4.78,6.51Fe 3+ 1 7.49 Hg 2+ 1 7.0 Mg 2+ 2 1.36 Mn 2+ 1 2.49 Ni 2+ 1 2.06 Pb 2+ 1,3 3.78,4.7 Sn 2+ 1 5.2 8 酒石酸 (Tartaric acid) (HOOCCHOH)2Zn2+ 1,2 2.68,8.32 Ba 2+ 1 2.08 Be 2+ 1 3.08 Ca 2+ 1 2.0 Cd 2+ 1 2.2 Co 2+ 1 2.22 Cu 2+ 1 3.33 Fe 3+ 1 7.49 Hg 2+ 2 7.28 Mg 2+ 1 1.20 Mn 2+ 1 2.26 Ni 2+ 1 2.36 Pb 2+ 1 2.8 9 丁二酸(Butanedioic acid) HOOCCH 2CH 2COOHZn2+ 1 1.6 Ag + 1,2 7.4,13.1 Bi 3+ 6 11.9 Cd 2+ 1,2,3,4 0.6,1.6,2.6,4.6 Cu + 3,4 13.0,15.4 10 硫脲 (Thiourea) H 2NC(═S)NH 2Hg2+ 2,3,422.1,24.7,26.8Ag + 1,2 4.70,7.70 Cd 2+ (20℃)1,2,3 5.47,10.09,12.09 Co 2+1,2,3 5.91,10.64,13.94 Co 3+ 1,2,3 18.7,34.9,48.69Cr 2+ 1,2 5.15,9.19 Cu + 2 10.8 Cu 2+ 1,2,3 10.67,20.0,21.0 Fe 2+ 1,2,3 4.34,7.65,9.70 Hg 2+ 1,2 14.3,23.3 Mg 2+ 1 0.37 Mn 2+ 1,2,3 2.73,4.79,5.67 Ni 2+ 1,2,3 7.52,13.84,18.33Pd 2+ 2 26.90 V 2+ 1,2 4.6,7.5 11 乙二胺(Ethyoenediamine) H 2NCH 2CH 2NH 2Zn2+ 1,2,3 5.77,10.83,14.11Ag + 1,2 1.97,4.35 Cd 2+ 1,2,3,4 1.40,1.95,2.27,2.50Co 2+ 1,2 1.14,1.54 Cu 2+ 1,2,3,42.59,4.33,5.93,6.54Fe 2+ 1 0.71 Hg 2+ 1,2,3 5.1,10.0,10.4 Mn 2+ 1,2,3,4 1.92,2.77,3.37,3.50 12 吡啶 (Pyridine) C 5H 5NZn2+ 1,2,3,4 1.41,1.11,1.61,1.93Ag + 1,2 3.41,6.89 Ba 2+ 1 0.77 Ca 2+ 1 1.38 Cd 2+ 1,2 4.74,8.60 Co 2+ 1,2,3 5.23,9.25,10.76 Cu 2+ 1,2,3 8.60,15.54,16.27Fe 2+ (20℃) 1,2 4.3,7.8 Hg 2+1,2 10.3,19.2 Mg 2+ 1,2 3.44,6.46 Mn 2+ 1,2 3.6,6.6 Ni 2+ 1,2,3 6.18,11.14,15.0Pb 2+ 1,2 5.47,8.92 Pd 2+ 1,2 9.12,17.55 13 甘氨酸 (Glycin) H 2NCH 2COOHZn2+ 1,2 5.52,9.96 Cd 2+ 1,2,3 9.00,9.00,16.6014 2甲基8羟基喹啉 (50%二噁烷)Ce3+ 17.71Cu 2+ 1,2 12.48,24.00 Fe 2+ 1,2 8.75,17.10 Mg 2+ 1,2 5.24,9.64 Mn 2+ 1,2 7.44,13.99 Ni 2+ 1,2 9.41,17.76 Pb 2+ 1,2 10.30,18.50 UO2 2+ 1,2 9.4,17.0 Zn 2+ 1,2 9.82,18.72。
有机金属化学在催化领域的应用研究

有机金属化学在催化领域的应用研究在化学领域中,催化反应起到至关重要的作用。
它不仅可以提高反应速率,减少能量消耗,还可以促使某些反应发生,甚至使一些不可逆反应逆转。
有机金属化学作为一门独特的分支学科,具有丰富的化学反应体系和结构特点,近年来在催化领域的应用研究越来越受到重视。
本文将对有机金属化学在催化领域中的应用进行综述,包括有机金属配合物催化剂的设计与合成、催化反应机理研究以及催化剂在有机合成中的应用等内容。
一、有机金属配合物催化剂的设计与合成有机金属配合物催化剂是有机金属化学在催化领域中的核心。
通过设计合成不同的有机金属配合物催化剂,可以调控其电子结构和空间结构,从而提高催化剂的催化活性和选择性。
例如,以过渡金属为中心的催化剂可以通过改变配体的取代基、配位位点和配体结构等方式来调节催化剂的性能。
此外,还可以设计多金属催化剂,通过合理组装不同金属中心以实现协同催化效果。
有机金属化学为催化剂的设计与合成提供了丰富的可能性,为催化领域的研究和应用提供了坚实的基础。
二、催化反应机理研究对催化反应机理的深入研究是催化领域中的重要任务之一。
有机金属化学通过设计和合成不同结构的有机金属配合物催化剂,为揭示催化反应机理提供了研究平台。
通过使用各种实验技术和理论计算方法,可以确定催化反应中的关键步骤和中间体,从而揭示催化剂的作用机理。
例如,有机金属催化剂可以通过配体的交换和配位位点的取代来实现活性中间体的形成和转化,进而促使反应发生。
催化反应机理研究对于优化催化反应的条件和提高反应效率具有重要意义。
三、催化剂在有机合成中的应用有机金属化学在有机合成领域中具有广泛的应用。
通过使用有机金属配合物催化剂,可以实现多种有机合成反应的高效转化。
例如,羰基化反应、烯烃和芳烃的氧化反应、碳氢键功能化反应等。
有机金属催化剂不仅可以提高反应速率和产率,还可以控制反应的立体选择性和化学选择性,实现对多官能团的选择性官能化转化。
此外,有机金属催化剂还可以在不同的反应条件下实现特定键的选择性断裂和形成。
二异丙氧基乙酰乙酸铝螯合物

二异丙氧基乙酰乙酸铝螯合物1.引言1.1 概述二异丙氧基乙酰乙酸铝螯合物作为一种新型有机金属配合物,在化学领域引起了广泛的关注。
它是由乙酸铝与二异丙醇酯化反应得到的一种配合物,具有较强的抗氧化性和稳定性。
随着科学技术的不断发展,对于合成新颖化合物的研究越来越受到关注。
二异丙氧基乙酰乙酸铝螯合物的合成方法及其性质研究对于深入了解这种有机金属配合物的结构和性能具有重要意义。
本文将首先介绍乙酸铝的化学性质,包括其结构、性质和应用领域。
接着,将详细描述二异丙氧基乙酰乙酸的合成方法,探讨各种合成条件下的反应机理和产率。
同时,还将探讨该配合物的结构和性质,包括其晶体结构、热稳定性和溶解性等方面。
在文章的结论部分,将总结出二异丙氧基乙酰乙酸铝螯合物的特性,包括其化学结构、热稳定性和抗氧化性等。
同时,还将探讨该配合物在材料科学、催化剂和生物医药领域等方面的应用前景和展望。
通过对二异丙氧基乙酰乙酸铝螯合物的研究,有助于扩展有机金属配合物的应用范围,并为合成更具特殊性质的配合物提供理论和实验基础。
同时,该研究还对于提高材料的稳定性和性能具有重要意义,有助于推动相关领域的发展和进步。
文章结构部分的内容可以包括以下主要内容:1.2 文章结构本文将按照以下结构逐步展开对二异丙氧基乙酰乙酸铝螯合物的探讨:1.2.1 引言:介绍本文将要讨论的主题,即二异丙氧基乙酰乙酸铝螯合物,并阐述其重要性和研究意义。
1.2.2 正文:2.1 乙酸铝的化学性质:首先介绍乙酸铝的基本性质,包括其化学组成、物理性质以及在化学反应中的应用。
2.2 二异丙氧基乙酰乙酸的合成方法:详细介绍合成二异丙氧基乙酰乙酸的方法及反应机理,包括原料的选择、反应条件的控制以及产物的分离纯化方法。
1.2.3 结论:3.1 二异丙氧基乙酰乙酸铝螯合物的特性:总结二异丙氧基乙酰乙酸铝螯合物的主要特性,包括其物理性质、结构特点以及在不同领域中的应用情况。
3.2 应用前景和展望:探讨二异丙氧基乙酰乙酸铝螯合物在未来的应用前景以及研究方向,包括可能的改进与发展,以及对其进一步研究的必要性和意义。
γ-脲基丙基三乙氧基硅烷 金属

γ-脲基丙基三乙氧基硅烷金属γ-脲基丙基三乙氧基硅烷是一种有机化合物,其化学式为C12H28N2O3Si。
它是一种金属配合物,具有许多重要的应用。
首先,γ-脲基丙基三乙氧基硅烷可以用作有机合成中的试剂。
它的脲基和丙基可以通过一系列的反应与其他化合物发生反应,形成新的化合物。
γ-脲基丙基三乙氧基硅烷作为试剂时,在有机合成中具有很高的选择性和效率。
其次,γ-脲基丙基三乙氧基硅烷的金属配合物广泛用于催化剂领域。
金属配合物由脲基丙基三乙氧基硅烷和金属离子组成,可以催化多种有机合成反应。
例如,铂配合物可以催化烯烃的加成反应,铜配合物可以催化1,3-偶极环加成反应等。
这些配合物对于有机化学合成的加速和控制具有重要意义。
此外,γ-脲基丙基三乙氧基硅烷的金属配合物也在材料科学领域中有着广泛的应用。
金属配合物作为催化剂可以在低温下促进多种材料的合成,如聚合物、陶瓷等。
此外,金属配合物还可以通过控制反应条件和配合物结构获得特定形状和性能的材料,如纳米材料、金属有机骨架材料等。
这些材料具有重要的用途,如储能、传感器、光学器件等。
此外,γ-脲基丙基三乙氧基硅烷的金属配合物还可以应用于医学领域。
金属配合物可以与生物分子相互作用,如DNA、蛋白质等,从而实现药物传递、癌症治疗等。
同时,金属配合物还可以通过控制配位键能力和溶解度来改变药物的活性和生物利用度,从而提高药物的疗效和降低副作用。
综上所述,γ-脲基丙基三乙氧基硅烷的金属配合物在化学合成、催化剂、材料科学和医学领域中有着广泛的应用。
通过进一步的研究和开发,相信这种化合物可以在更多领域发挥其潜力,为人类社会带来更多的益处。
金属有机配合物

金属有机配合物M0Fs一般都是用溶剂热法合成的,有研究表明,合成的方法不同得到的MOFs的性能有可能不一样。
O.M.Yaghi等采用分步合成和一次性合成制备MOF-500([(Fe304)一(SO4)(BPDC)6(BPE)6]8-[NH2(CH3)2+13H2O·8DMF],BP—DC为4,4二苯二甲酸,BPE为顺式一1,2-二一4一乙烷吡啶)时发现合成的最终产物在吸氢性能上有所差异,这是因为分步合成的中间产物IRMOP-51([(Fe3O4)(SO4)(BPDC)6(PY)12] 8-[NH2一(CH3) 13H2O·8DMF),py为嘧啶]不溶,从而阻碍了MOF- 500的合成。
进一步的研究还发现,制备过程中MOFs暴露在空气或水中的程度不同,其储氢性能也不同。
J.Perles等用溶剂热法合成Sc(BDC)3时用有机酸及其钠盐的混合液为有机配体,并加入O-Phen(邻菲罗啉)来调整溶液的pH值,最后得到了单一相的产物,这可以用来指导我们合成高纯度的MOFs。
目前,已有许多研究者在金属离子调节MOFs孔结构方面做了系统的研究,如日本 Myoudaiji大学分子科学学院的Kumagai等人用2一氨基苯甲酸(2一abaH)分别与MCl2·nH2 0(M=Ca、Sr、Ba)桥联生成配位聚合物[Ca(2-aba)2 (H2O)3]、[{Sr(2-aba)2(H 2O)2}·H2O]和[Ba(2-aba)2(H20)]。
Rogan等人以2,2’-联吡啶 (dipya)作为有机配体。
在对苯二甲酸钠(Na2BDC)溶液中分别与Co(II)、Ni(II)、Cu(Ⅱ)络合,生成立方体的红色晶体Co(BDC)(dipya)·5H2 0、棱镜状的浅蓝色晶体Ni(BDC) (dipya)·5H2O和八面体的绿色晶体Cu(BDC)(dipya)·H2 O。
有机金属配合物红色发光材料的研究进展

Eu(I ) BM)3l Sat h
Hua ng等设计了新型的中性配体2一吡啶基苯并咪 唑,两个氮原子可以和Eu3+配位,配位氮原子以可 以自 由旋转 的C—C键连接 ,由于 苯并咪 唑环上 容 易进行烷基以及其它基团的化学修饰,因而利用这 类配体可以较容易地对配合物的各种性能进行有目 的修饰改善[ 9】。分别以DBM和TTA作为第一配体,
利用短寿命三重态发光材料作为能量传递受 体,可以克服在高电流密 度下的主体与客体发光材 料间的能量传递受阻,从 而解决高电流密度下器件 发光饱和度的问题[ 14。。以I r ( PPy) 。 为发光层。高性 能的器件来自于材料较短的磷光寿命( 4弘s) ,显著地 减小了三线态激子之间的湮灭。
热稳定和电化学稳定性以及适宜的激发态性质,因 此已被广泛地应用在染料敏化太阳能电池上。最近 有多个研究组报道了利用联吡啶钌作为红色发光染 料的电致化学发光器件[ 15, 16] 。这类器件具有发光效 率高、启动电压低等优点,而且器件在正向或反向偏 压下均能得到红光发射。目前这类红色发光器件在 响应速度以及寿命上还不是很理想。
以Ru( bpy) 。C12为代表的钌配合物,是发光电 池中 常用的 材料, 但是作 为电致 发光材 料应用 到 OLED的研 究很少 。钌配 合物 的分子 内含有 电荷 相 反的离子对[ Ru( bpy) 。] 2+和Cl - ,这些离子在相应 的电极附近聚集,增强了电子和空穴的注入。以Ru ( bpy) 3C12为发光层的器件效率低于0.1%。Ha ndy 等以Ru( bpy) 。PF。为发光层制备的单层器件,效率 达到1.o%。Rubner 研究小组将可溶性的配合物Ru ( bp y) 。PF。稀释到聚合物中,器件效率达到3 oA。
[cu[nh]3]4so4的配位原子
![[cu[nh]3]4so4的配位原子](https://img.taocdn.com/s3/m/cf05c5ae8662caaedd3383c4bb4cf7ec4afeb6e7.png)
[cu[nh]3]4so4的配位原子
Cu[nh]3]4so4是一种金属配合物,它属于有机配合物中最常见的一种,是一种重要的结构单元,用来影响分子结构、改变生物效应和控制物质性质等方面有广泛的应用。
Cu[nh]3]4so4的配位原子包括铜配位子(Cu₂O)、四个水分子、一个氮原子和一个硫原子。
铜配位子由两个氧原子配位的铜离子组成,氮原子是指有价氮氧化物的氮原子,硫原子或硫醇硫酸根(S⁻²)。
由于Cu[nh]3]4so4的配位原子种类多样,因此它在制备金属有机配合物中有着广泛的应用。
由于铜配位子的存在,具有稳定的金属中心,可以促进金属有机物分子发生变化,调控分子结构,提高其生物活性、分子量、热重分析、吸附比重和亮度等特性,大大促进了金属有机配合物的全面发展。
在生物制药领域,Cu[nh]3]4so4的配位原子用于药物的合成,因其具有橙色光谱活性以及抗氧化性能,可以有效抑制自由基,同时具有抗病毒、抗肿瘤等药理作用,广泛应用于抗肿瘤、抗抑郁、抗病毒等药物的合成。
综上所述,Cu[nh]3]4so4的配位原子在制备金属有机配合物和生物制药领域有着承载着重要功能,能够控制分子结构,调控物质性质,促进金属有机配合物的全面发展,为药物的合成提供了可靠的理论基础,从而拓展了互联网应用的无限可能性。
有机金属配合物共74页

56、极端的法规,就是极端的不公。 ——西 塞罗 57、法律一旦成为人们的需要,人们 就不再 配享受 自由了 。—— 毕达哥 拉斯 58、法律规定的惩罚不是为了私人的 利益, 而是为 了公共 的利益 ;一部 分靠有 害的强 制,一 部分靠 榜样的 效力。 ——格 老秀斯 59、假如没有法律他们会更快乐的话 ,那么 法律作 为一件 无用之 物自己 就会消 灭。— —洛克
39、勿问成功的秘诀为何,且尽全力做你应该做的事吧。——ቤተ መጻሕፍቲ ባይዱ华纳
40、学而不思则罔,思而不学则殆。——孔子
60、人民的幸福是至高无个的法。— —西塞 罗
谢谢!
36、自己的鞋子,自己知道紧在哪里。——西班牙
37、我们唯一不会改正的缺点是软弱。——拉罗什福科
xiexie! 38、我这个人走得很慢,但是我从不后退。——亚伯拉罕·林肯
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
b. 还原羰基化 ( reductive carbonylation)
金属盐 + 还原剂 + CO 18e化合物 典型还原剂: Na, Al, H2, AlR3, CO ... CrCl3 (s)+ Al(s) + 6CO(g) AlCl3(soln) + Cr(CO)6(soln)
7-7 金属羰基和酸配体化合物及 其取代反应
7-7-1 7-7-2 7-7-3
金属羰基化合物 其它-酸配体的化合物 金属羰基化合物的取代反应
CO的HOMO为给体(碱)
CO的LUMO为受体(酸)
金属羰基化合物的反馈键(back bond)生成示意图 Dewas-Chatt-Duncanson(简称为DCD)模型
OC CO OC CO M = Mn, Tc, Re CO OC Fe CO CO CO
OC CO X = H, Cl, Br, I CO CO + I OC Fe OC CO I-
Cl Cl Pt Cl
Pt(IV)
stable
very rare
试用HSAB原则解释下面的现象:
2+ - e(NH3)5OsIII slow (NH3)5Os
III
NH2 (NH3)5OsII
NH2
3+
NH2
3+
18电子规则
一、18电子规
一般说来过渡金属具有 (n-1)d ns np九个价电子轨道。 当其全充满时,金属周围的价电子数等于该金属所处 的那个周期末尾的稀有气体原子的最外层电子数,此 时金属价层电子数为18,所以也称为18电子规则。
7-7-1-2 金属羰基化合物成键的表征:
分子振动光谱( 红外, 拉曼)
反馈键强, CO的 轨道的电子云密度增大
则C O间的键级减弱
力常数减小
振动频率减低
结论: 中心M 的电子云密度越大, 或者给电子能力越强, 反馈键越强, CO越小
7-7-1-3 金属羰基化合物中 三种典型的CO配位方式:
+
LnM
E
oxidation reduction substitution
(1) 取代反应
OC OC CO Cr CO CO CO CH3CN reflux OC OC CO Cr NCMe NCMe NCMe
Cr(CO)3(NCMe)3
Hale Waihona Puke OC OCCO Cr CO CO CO
h CO
OC OC
Cr CO
第七章
有机金属化合物
有机基团的碳原子直接与金属键合的一类化合物(即 含M-C键的化合物)
配体_ 有机配体上的C原子可给与金属 电子的给电子配体 配体_配体的给电子作用与受电子作用都通 过 轨道实现的不饱和有机配体。 -酸 配体___不饱和有机配体既可以给出 电 子,同时又可以空的 轨道接受金属的电子。 由于配体的 轨道有受电性,根据Lewis酸 碱理论的概念,该种配体称为 酸。
(AlCl3, 苯)
Re2O7(s) + 17CO(g) Re2(CO)10(s) + 7CO2
(250º C, 350 atm)
Ru(acac)3(soln)+H2+12CO(g) Ru3(CO)12(s) + ….
(150º C, 200 atm, CH3OH)
d. 从具有反应活性的有机羰基化合物制备 例如:
(a) 端羰基
(b) 双桥羰基 (边桥基) 2 -CO 或 –CO
(c) 三桥羰基 (面桥基) 3-CO
CO提供电子数:2
中性金属羰基化合物中CO伸缩振动频率的大致范围
自由CO: 2143cm–1
端羰基: ~1900~2050cm–1
二桥基( 边桥基): 1800~1900cm–1
三桥基( 面桥基): ~1600~1800cm–1
7-6 金属氢化物,M-H
在不饱和有机化合物的H2加成时,
由H2的裂解形成的氢化物过渡金属
是关键的中间体
下面每一对分子,哪一个酸性更强,哪一 个更具有hydridic性? (a) H-Co(CO)4 vs H-Co(CO)3(PPh3) (b) H-Co(CO)3(PMe3) vs H-Co(CO)3(PPh3) (c) CpRu(CO)2H vs CpOs(CO)2H
7-7-1-4 金属羰基化合物的制备
a. 直接合成法
Ni(s)+4CO(g) Ni(CO)4(l)
Fe(s)+5CO(g) Fe(CO)5(l) (200º C, 200atm) Co(s)+8CO(g) Co2(CO)8(s) (150º C, 35atm)
合成Fe(CO)5的高压反应釜
一些配体可以同时具有几种电子对,其成 键情况取决于金属的性质:
R H C O M O C R H Low oxidation state M M O C H R high oxidation state M
HSAB原则在有机金属化合物中的应用:
软的配体易于和软的金属形成稳定的配合物 通常处于低的 氧化态, 如Mn(I), Co(I), Fe(II), Pt(II), Pt(0)… Pt(II) is soft but Pt(IV) is hard
PPh3 Ph3P Rh PPh3 Cl O + C R Cl CO Ph3P Rh PPh3 Cl + RCl
机理:
O PPh3 C Ph3P Rh PPh3 + R Cl 16e O Cl Cl C R PPh3 PPh3 18e
Ph3P Rh Cl
7-7-1-6 金属羰基化合物的反应
+ C O Nu
CO CO
(2) 在C上发生的亲核进攻
+ C O + Nu LnM O C Nu O LnM C Nu -
LnM
O E LnM C Nu
E
+
CO OC Mo OC CO
CO LiMe CO
CO CO OC Mo OC CO
C Me
O
- Li+
MeI CO CO OC Mo OC CO O
- Li+
C Me
(3) 在O上发生的亲电进攻
(4) 迁移插入反应
PMe3 CO OC Mn OC CO C
CH3 OC Mn OC CO
CO C O + PMe3
CH3
O
(5) 氧化分解反应Oxidative decarbonylation
CO CO OC M CO CO M CO + X2 OC CO CO M X
