鞭毛染色液配制及使用方法
鞭毛的实验报告

1. 学习并掌握鞭毛染色法。
2. 观察鞭毛的形态和分布。
3. 了解鞭毛在细菌运动中的作用。
二、实验原理鞭毛是细菌的一种特殊细胞器,由鞭毛蛋白组成,具有运动功能。
鞭毛染色法是一种常用的微生物学实验技术,通过染色剂将鞭毛染色,使其在显微镜下清晰可见。
本实验采用鞭毛染色法观察细菌鞭毛的形态和分布,并探讨其与细菌运动的关系。
三、实验材料1. 细菌培养物:大肠杆菌、枯草杆菌、葡萄球菌等。
2. 染色剂:鞭毛染色液(如革兰氏染液、卡红染液等)。
3. 实验器材:显微镜、载玻片、盖玻片、镊子、滴管、酒精灯等。
四、实验步骤1. 取适量细菌培养物,用无菌生理盐水制成菌悬液。
2. 将菌悬液滴于载玻片上,用无菌镊子轻轻涂布均匀。
3. 待菌膜干燥后,用酒精灯轻微加热固定。
4. 将载玻片浸入鞭毛染色液中,染色时间为10-15分钟。
5. 用蒸馏水冲洗载玻片,去除多余的染色液。
6. 将载玻片浸入盐酸酒精溶液中,脱色时间为1-2分钟。
7. 用蒸馏水冲洗载玻片,去除多余的脱色液。
8. 将载玻片浸入复染液(如复红染液)中,复染时间为1-2分钟。
9. 用蒸馏水冲洗载玻片,去除多余的复染液。
10. 将载玻片用吸水纸吸干,盖上盖玻片。
11. 在显微镜下观察鞭毛的形态和分布。
1. 大肠杆菌:观察到细菌具有明显的鞭毛,鞭毛呈细长状,着生于菌体一端。
2. 枯草杆菌:观察到细菌具有鞭毛,鞭毛呈细长状,着生于菌体两端。
3. 葡萄球菌:观察到细菌无鞭毛。
六、实验分析1. 通过实验观察,大肠杆菌和枯草杆菌均具有鞭毛,且鞭毛形态和分布不同。
这表明鞭毛在细菌运动中具有重要作用。
2. 葡萄球菌无鞭毛,这可能是其运动能力较弱的原因之一。
3. 鞭毛染色法是一种常用的微生物学实验技术,能够清晰观察到鞭毛的形态和分布,为研究细菌的运动和分类提供重要依据。
七、实验总结本实验通过鞭毛染色法观察了细菌鞭毛的形态和分布,了解了鞭毛在细菌运动中的作用。
实验过程中,我们掌握了鞭毛染色法的操作步骤,提高了实验技能。
鞭毛染色液(石碳酸复红法)
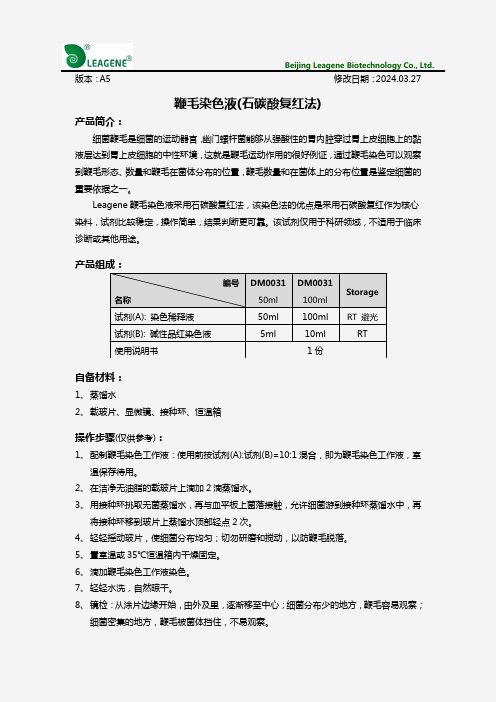
版本:A5 修改日期:2024.03.27 鞭毛染色液(石碳酸复红法)产品简介: 细菌鞭毛是细菌的运动器官,幽门螺杆菌能够从强酸性的胃内腔穿过胃上皮细胞上的黏液层达到胃上皮细胞的中性环境,这就是鞭毛运动作用的很好例证,通过鞭毛染色可以观察到鞭毛形态、数量和鞭毛在菌体分布的位置,鞭毛数量和在菌体上的分布位置是鉴定细菌的重要依据之一。
Leagene 鞭毛染色液采用石碳酸复红法,该染色法的优点是采用石碳酸复红作为核心染料,试剂比较稳定,操作简单,结果判断更可靠。
该试剂仅用于科研领域,不适用于临床诊断或其他用途。
产品组成:自备材料:1、 蒸馏水2、 载玻片、显微镜、接种环、恒温箱操作步骤(仅供参考):1、 配制鞭毛染色工作液:使用前按试剂(A):试剂(B)=10:1混合,即为鞭毛染色工作液,室温保存待用。
2、 在洁净无油脂的载玻片上滴加2滴蒸馏水。
3、 用接种环挑取无菌蒸馏水,再与血平板上菌落接触,允许细菌游到接种环蒸馏水中,再将接种环移到玻片上蒸馏水顶部轻点2次。
4、 轻轻摇动玻片,使细菌分布均匀;切勿研磨和搅动,以防鞭毛脱落。
5、 置室温或35℃恒温箱内干燥固定。
6、 滴加鞭毛染色工作液染色。
7、 轻轻水洗,自然晾干。
8、 镜检:从涂片边缘开始,由外及里,逐渐移至中心;细菌分布少的地方,鞭毛容易观察;细菌密集的地方,鞭毛被菌体挡住,不易观察。
编号 名称 DM0031 50ml DM0031 100ml Storage 试剂(A): 染色稀释液 50ml 100ml RT 避光 试剂(B): 碱性品红染色液 5ml 10ml RT使用说明书 1份染色结果:菌体和鞭毛皆为红色,菌体染色较鞭毛为深。
注意事项:1、固定时不宜用火焰固定。
2、为了您的安全和健康,请穿实验服并戴一次性手套操作。
3、试剂开封后请尽快使用,以防影响后续实验效果。
有效期:12个月有效。
常用染色液的配制

常用染色液的配制1.染料饱和酒精溶液的配制配制染色液常先将染料配成可长期保存的饱和酒精溶液,用时再予以稀释配制。
配制饱和酒精溶液,应先用少量95%酒精先在研钵中徐徐研磨,使染料充分溶解,再按其溶解度加于95%酒精之中,贮存于棕色瓶中即可。
附表1 几种常用染料在95%酒精中的溶解度(26℃)染料名称美蓝结晶紫龙胆紫碱性复红沙黄溶100mL95%酒精中的重量(g) 1.4813.8710.003.203.412.常用染色液的配制(1)碱性美蓝(亦称骆氏美蓝)染色液:取美蓝饱和酒精溶液30ml,加入0.01%氢氧化钾水溶液l00mL,混合即成。
此染色液在密闭条件下可保存多年。
若将其在瓶中贮至半满,松塞棉塞,每日拔塞摇振数分钟,并不时加水补充失去的水分,约1年后可获得多色性,成为多色美蓝染色液。
(2)草酸铵结晶紫(亦称赫克结晶紫)染色液:取结晶紫饱和酒精溶液2mL,加蒸馏水18mL稀释10倍,再加入1%草酸铵水溶液80mL,混合过滤即成。
(3)革兰氏碘溶液:将碘化钾2g置乳钵中,加蒸馏水约5mL。
再加入碘片1g,予以研磨,并徐徐加水,至完全溶解后,注入瓶中,被加蒸馏水至全量为300mL即成。
此液可保存半年以上,当产生沉淀或褪色后即不能再用。
(4)沙黄水溶液:沙黄也称番红花红。
将沙黄饱和酒精溶液以蒸馏水稀释10倍即成。
此液保存期以不超过4个月为宜。
(5)石炭酸复红染色液:取3%复红酒精溶液10mL,加入5%石炭酸水溶液90mL混和过滤即成。
(6)稀释石炭酸复红染色液:将石炭酸复红染色液以蒸馏水稀释10倍即成。
(7)3%盐酸酒精(亦称含酸酒精):加浓盐酸3mL于95%酒精97mL中即成。
(8)瑞士染色色液:取瑞氏染料0.1g置乳钵中,徐徐加入甲醇,研磨以促其溶解。
将溶液倾入有色中性玻瓶中,并数次以甲醇洗涤乳钵,亦倾入瓶内,最后使全量为60mL即可。
将此瓶置暗处过夜,次日滤过即成。
此染色液须置于暗处,其保存期约为数月。
鞭毛染色法——精选推荐

【改良Ryu法】
一、配方:A液:5%石炭酸10ml,鞣酸2g,饱和硫酸铝钾液10ml
B液:饱和结晶紫
应用液:A液10+B液1份混合后室温保存
二、方法:
1.玻片的处理:要求用新的。
用前在95%酒精中浸泡24h以上,用时取出以洁净纱布擦干。
2.在玻片上滴2d蒸馏水
3.取菌环挑取菌落少许,点在蒸馏水顶部;
4.玻片自然干燥
5.加染色液,染15min后自来水轻轻冲洗干净
6.自然干燥,镜检。
【本人经验】
1.蒸馏水不要加太多,否则干燥时间长(尤其是低温环境);
2.一定要自然干燥
3.整个过程动作要温柔,冲洗时切不可直接对准染色部位,要小流水冲玻片一端。
4.取菌量要少,否则细菌重叠在一起,不易观察鞭毛;
5.要从菌落边缘取菌
6.细菌最好用对数生长期的,切不可用选择培养基培养!
7.观察时要从染色斑边缘开始,逐渐向里。
细菌多数集中在边缘。
8.一定用蒸馏水,不要用生理盐水!。
微生物的制片染色技术

微生物的制片染色技术微生物的细胞含水量大(一般可达80~90%或更高),菌体薄而透明,折光性强,因此,除观察活细胞外,绝大多数情况下,都必须经过染色才能在显微镜下观察。
至于细菌的特殊结构——鞭毛、芽孢、荚膜,以及真菌的有性或无性孢子等,均需经特殊方法染色后,才能进行观察。
细菌的制片染色细菌涂片的制作与简单染色涂片制作:在干净载片上加清水1滴,用接种环(或牙签)取纯培养菌种(或牙垢等含菌标本)少许,与水混匀,涂布成薄层,在酒精灯火焰上方微热烘干,杀死菌体并使其固定在载片上。
注意:载片一定要清洁无油,即水滴可均匀散开,不收缩;取样要适当,不可过多;涂片要薄而均匀,干后呈淡乳白色、半透明状;烘干过程载片背面保持温热。
简单染色:在涂片上滴1滴复红或其他染色液,染色1分钟,倾去染料,用水沿玻片一侧轻轻冲去多余染料,擦干载片背面及周围水渍,风干,镜检。
此方法用于观察细菌外形及大小。
革兰氏染色细菌学中广泛使用的一种染色方法。
用于鉴别细菌,可将细菌分为革兰氏染色阳性及革兰氏染色阴性两大类。
染色步骤:用上述方法制备细菌涂片,干燥后,加结晶紫1滴,初染1分钟,用水冲去多余的染料;稍干后,加媒染剂卢戈氏碘液2~3滴,固定1~2分钟,用水冲去碘液;稍干后,加95%酒精1~2滴,脱色20~30秒,迅速用水冲洗(此时革兰氏阳性菌紫色,阴性菌无色);滴加0.5%番红1滴复染1分钟,使被脱色的阴性菌着色。
镜检时,阳性菌紫色,阴性菌红色。
革兰氏染色的关键为酒精脱色,脱色过轻,阴性菌脱不掉紫色;若脱色过重,阳性菌的紫色也会脱掉。
因此,染色时首先应制好薄而均匀的涂片,并掌握好脱色时间。
此外还应注意菌龄,某些革兰氏染色阳性菌,其老龄菌常呈阴性反应,因此,染色用菌种应是24小时内的培养物。
特殊结构染色细菌的鞭毛、芽孢、荚膜等特殊结构,必须用特殊方法才能使其着色。
芽孢染色:芽孢壁较厚,染料不易透过,但着色后亦不易脱色。
芽孢染色一般需用培养24~48小时的菌种,涂片风干后,加5%孔雀绿染液3~5滴,用酒精灯微火加热至出现蒸气(不断补充染液,使其保持不干,也不沸腾),染色5~10分钟,冷却后,用水冲洗,再用0.5%番红液复染1分钟,水洗,风干后镜检。
实验三 鞭毛染色法及活细菌运动性的观察

一、实验目的:
1.学习细菌的鞭毛染色法,观察细菌鞭毛的 形态特征; 2.学习用悬滴法观察细菌的运动性.
二、实验原理:
细菌的鞭毛极细,直径一般为10—20nm,只有用电子 显微镜才能观察到。但是,如采用特殊的染色法,则在 普通光学显微镜下也能看到它。鞭毛染色方法很多,但 其基本原理相同,即在染色前先用媒染剂处理,让它沉 积在鞭毛上,使鞭毛直径加粗,然后再进行染色。常用 的媒染剂由丹宁酸和氯化高铁或钾明矾等配制而成。
三、实验器材
1. 菌种:培养12-16h小时的普通变形杆菌。 2. 标本片:周鞭毛(伤寒杆菌) 3. 试剂:硝酸银鞭毛染色液、生理盐水、蒸馏水、 香柏油、二甲苯。 4. 器材:凹载玻片、盖玻片、镊子、擦镜纸、吸 水纸、接种环,显微镜等。
四、实验方法
(一)鞭毛染色 硝酸银染色法:
1.清洗玻片:选择光滑无裂痕的玻片,最好选用 新的。然后将玻片置洗衣粉过滤液中 (洗衣粉煮沸后用滤纸过滤,以除去粗颗粒), 煮沸20min。取出稍冷后用自来水冲洗、晾 干,再放入浓洗液中浸泡5—6天,使用前取出 玻片,用自来水冲去残酸,再用蒸馏水洗。将 水沥干后,放入95%乙醇中脱水。
下周实验
四大类微生物菌落及个体形态观察
本次实验课结束
请确保油镜头擦拭干净! 请第三组同学留下值日
注意事项
①取菌要取菌落边缘的幼龄菌体。 ②取菌后的接种环在载片上的蒸馏水中轻轻沾几下即可, 不要用力太猛,更不能用接种环大幅度涂开;否则鞭毛 易脱落,造成染色失败。 ③鞭毛染色的玻片只能自然干燥,不能用热风吹干,不 能热固定,这是由于加热后菌体易变形,鞭毛易脱落, 影响观察。 ④A、 B染液染完后用蒸馏水(自来水效果差)冲洗时 一定要充分,背景很脏,鞭毛不易被观察到,影响实验 效果。 ⑤加B染液后,将玻片稍加热(但不能太热,更不能沸 腾或蒸干)使其微冒蒸汽,染色效果较不加热为好。 染色用玻片干净无油污是鞭毛染色成功的先决条件。
鞭毛染色实验报告

1. 掌握鞭毛染色的原理和方法。
2. 观察细菌鞭毛的形态、数量和分布位置。
3. 了解鞭毛在细菌分类和鉴定中的意义。
二、实验原理鞭毛是细菌的运动器官,对细菌的分类和鉴定具有重要意义。
鞭毛染色是一种特殊染色方法,通过媒染剂和染色剂的作用,使鞭毛变粗,便于在显微镜下观察。
常用的媒染剂有单宁酸、明矾钾等,染色剂有碱性复红、硝酸银、结晶紫等。
三、实验材料1. 菌种:金黄色葡萄球菌、普通变形杆菌、大肠杆菌。
2. 培养基:牛肉膏蛋白胨培养基。
3. 试剂:鞭毛染色液(A液)、0.01%美蓝水溶液(B液)、香柏油、二甲苯、无菌水、凡士林。
4. 工具:显微镜、接种环、酒精灯、凹载玻片、盖玻片、镊子、细玻棒、吸水纸。
四、实验步骤1. 活化菌种:将保存的菌种在新制备的牛肉膏蛋白胨斜面培养基上连续移种2-3次,每次于30℃培养10-15h。
活化后菌种备用。
2. 制片:在干净载玻片的一端滴一滴蒸馏水,用无菌操作法,以接种环从活化菌种中取少许菌苔(注意不要带培养基),在载玻片的水滴中轻沾几下。
将载玻片稍倾斜,使菌液随水滴缓缓流到另一端,然后平放,于空气中干燥。
3. 染色:滴加鞭毛染色液A液,染3-5min。
用蒸馏水充分洗净A液,使背景清洁。
将残水沥干或用B液冲去残水。
滴加B液,在微火上加热使微冒蒸汽,并随时补充染料以免干涸,染30~60s。
待冷却后,用蒸馏水轻轻冲洗干净,自然干燥或滤纸吸干。
4. 镜检:先用低倍镜和高倍镜找到典型区域,然后用油镜观察。
菌体为深褐色,鞭毛为褐色。
注意观察鞭毛着生位置(镜检时应多找几个视野,有时只在部分涂片上观察到鞭毛)。
1. 金黄色葡萄球菌:观察到典型的鞭毛,数量较多,主要分布在菌体一端。
2. 普通变形杆菌:观察到鞭毛,数量较少,主要分布在菌体两端。
3. 大肠杆菌:未观察到鞭毛。
六、实验讨论1. 鞭毛染色是细菌鉴定的重要方法之一,通过观察鞭毛的形态、数量和分布位置,可以初步判断细菌的种类。
2. 本实验中,金黄色葡萄球菌和普通变形杆菌均具有鞭毛,而大肠杆菌无鞭毛。
实验三、细菌鞭毛染色及其运动的观察

2016/1/7
12
2细菌运动性的观察201611051压滴法载玻片取菌液加盖玻片观察2悬滴法盖玻片取菌液加凹载玻片并翻转观察1压滴法载玻片取菌液加盖玻片观察2悬滴法盖玻片取菌液加凹载玻片并翻转观察2016110620161107特殊聚光器实现斜射照明给样品照明的光线不直接穿过物镜而经样品反射或折射后进入物镜使样品与背景差别大可以清楚看到透明微小颗粒
实 验
三
细菌鞭毛染色及其运动的观察
生科院微生物教研室
2016/1/7
一、目的
1、学习并初步掌握鞭毛染色法,观察细菌 鞭毛的形态特征; 2、学习用压滴法和悬滴法观察活细菌的运
动性。
2016/1/7
2
二、基本原理
鞭毛具运动功能,细菌是否具有鞭毛,以及鞭毛着生的
位置和数目是细菌的一项重要形态特征。细菌的鞭毛很纤
2016/1/7
5
2016/1/7
6
图 2 运动型细菌
特殊聚光器实现斜射照明,给样品照明的光线不直接穿过物镜, 而经样品反射或折射后进入物镜,使样品与背景差别大,可以清 楚看到透明微小颗粒。 用于:生活细菌运动性观察。 2016/1/7 7
细菌鞭毛的着生位置
2016/1/7
8
2016/1/7
2016/1/7
3
三、实验材料
1、菌种 大肠杆菌、变形杆菌6~8h斜面 培养物;
2、染色剂 鞭毛染色液
3、仪器或其他用具 光学显微镜、酒精 灯 载玻片、盖玻片、凹载玻片、无菌水等。
2016/1/7
4
四、操作步骤
1、鞭毛染色 制片 染色液A 3~5min 充分水洗 染色液B 2min 水洗、自然干燥、镜检。 2、细菌运动性的观察 (1)压滴法 载玻片 取菌液 加盖玻片 观察 (2)悬滴法 盖玻片 取菌液 加凹载玻片并翻转 观察
细菌的革兰氏染色及染色液的配制

革兰氏染色的一般步骤革兰氏染色法是细菌学中广泛使用的一种鉴别染色法,1884 年由丹麦医师Gram 创立。
未经染色之细菌,由于其与周围环境折光率差别甚小,故在显微镜下极难观察。
染色后细菌与环境形成鲜明对比,可以清楚地观察到细菌的形态、排列及某些结构特征,而用以分类鉴定。
革兰氏染色属复染法,即将标本固定后,先用结晶紫染色1 分钟后水洗,然后加革兰碘液媒染一分钟后用酒精脱色,再用稀释石炭酸复红复染。
染色后除可以看到细菌形态外,还可将细菌分为两大类,即不被酒精脱色而保留紫色者为革兰氏阳性菌(G+)。
被酒精脱色复染成红色者为革兰氏阴性菌(Gˉ)。
革兰氏染色原理尚不肯定,可能与细菌所带核糖核酸、细菌壁结构通透性、等电点等因素有关。
致病菌如金黄色葡萄球菌、绿色溶血性链球菌、肺炎球菌、白喉杆菌、炭疽杆菌等属革兰氏染色阳性菌。
百日咳杆菌、大肠杆菌(大肠埃希菌)、铜绿假单胞菌、伤寒杆菌、痢疾杆菌、霍乱弧菌、沙门菌、流行性脑膜炎双球菌、淋病双球菌等均属革兰氏阴性菌。
所以根据细菌的革兰氏染色性质,可以缩小鉴定范围,有利于进一步分离鉴定,以对疾病做出诊断。
又由于各种抗生素的抗菌谱不同,革兰氏染色尚可做为选用抗生素的参考。
革兰氏染色法一般包括初染、媒染、脱色、复染等四个步骤,具体操作方法是:1)涂片固定。
2)草酸铵结晶紫染 1 分钟。
3)纯化水冲洗。
4)加碘液覆盖涂面染 1 分钟。
5)水洗,用吸水纸吸去水分。
6)加 95% 酒精数滴,并轻轻摇动进行脱色,30 秒后水洗,吸去水分。
7)番红染色液(稀)染10 秒钟后,纯化水冲洗。
干燥,镜检。
染色的结果,革兰氏正反应菌体都呈紫色,负反应菌体都呈红色。
实验三细菌的革兰氏染色法一、目的要求了解革兰氏染色的原理,学习并掌握革兰氏染色的方法。
二、基本原理革兰氏染色反应是细菌分类和鉴定的重要性状。
它是 1884 年由丹麦医师Gram 创立的。
革兰氏染色法( Gram stain )不仅能观察到细菌的形态而且还可将所有细菌区分为两大类:染色反应呈蓝紫色的称为革兰氏阳性细菌,用G+ 表示;染色反应呈红色(复染颜色)的称为革兰氏阴性细菌,用G- 表示。
微生物染色液配制及染色法

微生物染色液配制及染色法2.1 美蓝染色法2.1.1 吕氏碱性美蓝染色液美蓝0.3g95%乙醇30mL0.01%氢氧化钾溶液100mL 将美蓝溶解于乙醇中,然后与氢氧化钾溶液混合。
2.1.2 染色法将涂片在火焰上固定,待冷。
滴加染液,染1~3min,水洗,待干,镜检。
2.1.3 结果菌体呈蓝色。
2.2 革兰氏染色法2.2.1 结晶紫染色液结晶紫1g95%乙醇20mL1%草酸铵水溶液80mL将结晶紫溶解于乙醇中,然后与草酸铵溶液混合。
2.2.2 革兰氏碘液碘1g碘化钾2g蒸馏水300mL将碘与碘化钾先进行混合,加入蒸馏水少许,充分振摇,待完全溶解后,再加蒸馏水至300mL。
2.2.3 沙黄复染液沙黄0.25g95%乙醇10mL蒸馏水90mL将沙黄溶解于乙醇中,然后用蒸馏水稀释。
2.2.4 染色法2.2.4.1 将涂片在火焰上固定,滴加结晶紫染色液,染1min,水洗。
2.2.4.2 滴加革兰氏碘液,作用1min,水洗。
2.2.4.3 滴加95%乙醇脱色,约30s;或将乙醇滴满整个涂片,立即倾去,再用乙醇滴满整个涂片,脱色10s。
2.2.4.4 水洗,滴加复染液,复染1min。
水洗,待干,镜检。
2.2.5 结果革兰氏阳性菌呈紫色。
革兰氏阴性菌呈红色。
注:亦可用1:10稀释石炭酸复红染色液作复染液,复染时间仅需10s。
2.3 耐酸性染色法(萎-倪二氏法)2.3.1 石炭酸品红染色液碱性品红0.3g95%乙醇10mL5%酚水溶液90mL将品红溶解于乙醇中,然后与酚溶液混合。
2.3.2 3%盐酸-乙醇浓盐酸3mL95%乙醇97mL2.3.3 复染液吕氏碱性美蓝染色液。
2.3.4 染色法2.3.4.1 将涂片在火焰上加热固定,滴加石炭酸品红染色液,徐徐加热至有蒸气出现,但切不可使沸腾。
染液如因蒸发减少时,应随时添加。
染5min,倾去染液,水洗。
2.3.4.2 滴加盐酸-乙醇脱色,直至无红色脱落为止(所需时间视涂片厚薄而定,一般为1~3min),水洗。
鞭毛

细菌鞭毛染色及活菌运动观察一、目的要求:1、学习并掌握鞭毛染色法并了解鞭毛的形态特征2、巩固显微镜操作技术及无菌操作技术3、学习压滴法观察细菌(活细胞)运动性二、实验器材:1.菌种来源枯草芽孢杆菌1-2d牛肉膏蛋白胨琼脂斜面培养物,铜绿假单胞菌1-2d牛肉膏蛋白胨琼脂斜面培养物2.溶液和试剂稀释美蓝溶液,质量分数为95%的乙醇水溶液,蒸馏水,硝酸银染液A液和B液3.仪器和其它用品酒精灯,载玻片,盖玻片,显微镜,双层瓶(内装香柏油和二甲苯),擦镜纸,接种环,小试管,烧杯,试管架,载玻片夹子,滴管和滤纸三、基本原理:1.压滴法观察活菌运动鞭毛是细菌的运动器官,在水中可以高速旋转推动菌体前行,细菌的游动不是单纯地一直朝前游,而是伴随着不时的随机翻滚转向,但从表观上看仍表现为细菌的前行。
细菌未染色时无色透明,在显微镜下主要靠细菌的折光率与周围环境的不同来进行观察。
若想观察的更加清晰,可以滴加稀释美蓝等染液进行染色,注意不要染色过重,以免影响观察,有鞭毛的细菌运动活泼,且不同时向一个方向运动,而无鞭毛的细菌则呈不规则布朗运动。
这样便可以在光学显微镜下观察到细菌的运动。
2.细菌鞭毛染色法简单染色法适用于一般的微生物菌体的染色,而某些微生物具有一些特殊结构,如鞭毛、芽孢和荚膜,对它们进行观察之前需要进行有针对性的染色。
鞭毛是细菌的纤细丝状的“器官”。
鞭毛的有无、数量及着生方式也是细菌分类的重要指标。
鞭毛直径一般为10-30nm,只有用电镜才可以直接观察到。
若要用普通光学显微镜观察,必须使用鞭毛染色法。
首先用媒染剂(如单宁酸或明矾钾)处理,使媒染剂附着在鞭毛上使其加粗,然后用碱性复红(Gray氏染色法)、碱性复品红(Leifson氏染色法)、硝酸银(West氏染色法)或结晶紫(Difco氏染色法)进行染色。
四、实验步骤:(一)压滴法观察活细菌1.洗片用自来水和去污粉将载玻片清洗干净,然后用蒸馏水冲洗2.涂片在载玻片上滴加少量蒸馏水,采用无菌操作将所要观察的菌种接种到水滴中蒸馏水稍显浑浊即可。
实验室常用染色液

三、常用染料介绍(一)天然染料1、苏木精苏木精是从南美的苏木(热带豆科植物)干枝中用乙醚浸制出来的一种色素,是最常用的染料之一。
苏木精不能直接染色,必须暴露在通气的地方,使他变成氧化苏木精(又叫苏木素)后才能使用,这叫做“成熟”。
苏木精的“成熟”过程需时较长,配置后时间愈久,染色力愈强。
被染材料必须经金属盐作媒剂作用后才有着色力。
所以在配制苏木精染剂时都要用媒染剂。
常用的媒染剂有硫酸铝按、钾明矾和铁明矾等。
苏木精是淡黄色到锈紫色的结晶体,易溶于酒精,微溶于水和甘油,是染细胞核的优良材料,他能把细胞中不同的结构分化出各种不同的颜色。
分化时组织所染的颜色因处理的情况而异,用酸性溶液(如盐酸—酒精)分化后呈红色,水洗后仍恢复青蓝色,用碱性溶液(如氨水)分化后呈蓝色,水洗后呈蓝黑色。
2、洋红洋红又叫胭脂红或卡红。
一种热带产的雌性胭脂虫干燥后,磨成粉末,提取出虫红,再用明矾处理,除去其中杂质,就制成洋红。
单纯的洋红不能染色,要经酸性或碱性溶液溶解后才能染色。
常用的酸性溶液有冰醋酸或苦味酸,碱性溶液有氨水、硼砂等。
洋红使细胞核的优良染料,染色的标本不易褪色。
用作切片或组织块染都适宜,尤其适宜于小型材料的整体染色。
用洋红配成的溶液染色后能保持几年。
洋红溶液出现浑浊时要过滤后再用。
(二)人工染料人工染料,即苯胺染料或煤焦油染料,种类很多,应用极广。
它们的缺点是经日光照射容易褪色,苯胺蓝、亮绿、甲基绿等更易褪色。
在制片中注意掌握酸碱度,并避免日光直射,也能经几年不褪色。
1、酸性品红酸性品红是酸性染料,呈红色粉末状,能容于水,略溶于酒精(0.3%)。
他是良好的细胞制染色剂,在动物制片上应用很广,在植物制片上用来染皮层、髓部等薄壁细胞和纤维素壁。
他跟甲基绿同染,能显示线粒体。
组织切片在染色前先浸在带酸性的水中,可增强它的染色力。
酸性品红容易跟碱起作用,所以染色过度,易在自来水中褪色。
2、刚果红刚果红是酸性染料,呈枣红色粉末状,能溶于水喝酒精,遇酸呈蓝色。
实验用染色液的配制

实验用染色液的配制1.黑色素液水溶性黑素10g,蒸馏水100mL, 甲醛(福尔马林)0.5mL。
可用作荚膜的背景染色。
2.墨汁染色液国产绘图墨汁40mL,甘油2mL,液体石炭酸2mL。
先将墨汁用多层纱布过滤,加甘油混匀后,水浴加热,再加石炭酸搅匀,冷却后备用。
用作荚膜的背景染色。
3.吕氏(Loeffier)美蓝染色液A液:美蓝(methylene blue, 又名甲烯蓝)0.3g, 95%乙醇30mL;B液:0.0l% KOH l00mL。
混合A液和B液即成,用于细菌单染色,可长期保存。
根据需要可配制成稀释美蓝液,按1:10或1:100稀释均可。
4.革兰氏染色液(1)结晶紫(crystal violet)液:结晶紫乙醇饱和液(结晶紫2g溶于20mL95%乙醇中)20mL,1%草酸铵水溶液80mL 将两液混匀置24h后过滤即成。
此液不易保存,如有沉淀出现,需重新配制。
(2)卢戈(Lugol)氏碘液:碘1g,碘化钾2g,蒸馏水300mL。
先将碘化钾溶于少量蒸馏水中,然后加入碘使之完全溶解,再加蒸馏水至300mL即成。
配成后贮于棕色瓶内备用,如变为浅黄色即不能使用。
(3)95%乙醇:用于脱色,脱色后可选用以下(4)或(5)的其中一项复染即可。
(4)稀释石炭酸复红溶液:碱性复红乙醇饱和液(碱性复红1g, 95%乙醇l0mL, 5%石炭酸90mL混合溶解即成碱性复红乙醇饱和液),取石炭酸复红饱和液l0mL加蒸馏水90mL即成。
(5)番红溶液:番红O(safranine,又称沙黄O)2.5g, 95%乙醇100mL,溶解后可贮存于密闭的棕色瓶中,用时取20mL与80mL蒸馏水混匀即可。
以上染液配合使用,可区分出革兰氏染色阳性(G+)或阴性(G-)细菌,G-被染成蓝紫色,G+被染成淡红色5. 鞭毛染色液A液:丹宁酸5.0g, FeCl3 1.5g,15%甲醛(福尔马林)2.0mL,l%NaOH 1.0mL,蒸馏水l00mL;B液:AgNO3 2.0g, 蒸馏水100mL。
细菌鞭毛染色的方法

细菌鞭毛染色的方法细菌鞭毛染色是一种常用的细菌形态鉴定方法,可以帮助微生物学家观察和描述细菌鞭毛结构,从而推测其遗传特性和功能。
下面将详细介绍三种常用的细菌鞭毛染色方法:简单抗酸杆菌染色法、尾鞭毛染色法和菲尔维改良法。
一、简单抗酸杆菌染色法简单抗酸杆菌染色法是一种鉴别分枝杆菌(Mycobacterium)属中患者血液、尿液、痰、脓液等标本中的分枝杆菌。
这种染色方法利用酸性染料石蜡红,可以使抗酸杆菌的鞭毛显色,增强观察的准确性。
步骤:1.取血液、尿液、痰等标本制备涂片,将标本涂抹在玻璃片上,晾干。
2.用火焰消毒的钳子将玻璃片的涂片轻轻通火,将染料石蜡红涂滴于涂片上,让其覆盖标本。
3.将玻璃片先静止1-2分钟,然后用水冲洗掉过多的染料。
4.用20%硝酸酒精对涂片进行脱色,可观察到分枝杆菌的鞭毛呈红色。
5.再用水冲洗涂片,使其完全清洁。
6.取一滴一滴草绿染料滴在涂片上,均匀涂抹。
7.用水冲洗后晾干,用油镜覆盖玻璃片,镜检。
二、尾鞭毛染色法尾鞭毛染色法用于显示一些有机质,如细菌鞭毛、纤毛,尤其是真细菌和螺旋菌的表面鞭毛。
这种染色方法使用了特定的染料,其中一种叫做尾鞭毛染料,可以与细菌鞭毛发生特异性的染色反应。
步骤:1.取细菌液滴制备涂片,晾干。
2.用尾鞭毛染料滴于涂片表面,使其充分渗透,静置几分钟。
3.用水冲洗涂片,除去未与鞭毛结合的染料。
4.用光学显微镜观察涂片,即可看到染色的细菌鞭毛。
三、菲尔维改良法菲尔维改良法是细菌鞭毛染色中的一种较新的方法,其主要优点是能够清晰地显示出细菌鞭毛的细节结构,对细菌鞭毛的分类和鉴定非常有帮助。
步骤:1.取细菌液滴制备涂片,晾干。
2.用菲尔维液滴于涂片表面,使其充分渗透,静置5-10分钟。
3.用水冲洗涂片,除去未结合的染料。
4.将菲尔维溶液滴于涂片上,再用菲尔维JL染色液(主要成分是菲尔维色素)滴于涂片上,使其充分渗透,静置15-20分钟。
5.用70%酒精脱色1-2秒钟,去除多余的染料。
常用染色液的配制

常用染色液的配制1.吕氏(Loefflev)美蓝染色液A液:2%美蓝(Methylene blue)95%酒精溶液B液:10%KOH溶液取A液30ml、B液0.1ml与100ml蒸馏水混合。
2.石炭酸复红染色液A液:4%碱性复红(basic fuchsin)95%酒精溶液将碱性复红在研钵中研磨后,逐渐加入95%酒精,继续研磨使其溶解、配成A液。
B液:5%石炭酸溶液取A液10ml、B液90ml混合即可。
一般可将此溶液稀释5-10倍使用。
但稀释液易变质失效,一次不宜多配。
3.革兰氏(gram)染色液(1)草酸铵结晶紫染液:A液:1%结晶紫(Crystal violet)95%酒精溶液B液:1%草酸铵(Ammonium oxalate)溶液取A液20mlB液80ml,静置48/小时后使用。
(2)路哥氏(Lugol)碘液:碘片1.0g、碘化钾2.0g、蒸馏水300ml先将碘化钾溶解在少量水中,再将碘片溶解在碘化钾溶液另,待碘全部溶解后,加够水即成。
(3)95%酒精溶液(4)蕃红(沙黄)复染液:2.5%蕃红(Safranlne O)95%酒精溶液。
取此液10ml与90ml蒸馏水混匀即成。
4.芽孢染色液(1)5%孔雀绿(Malachite green)溶液。
(2)0.5%蕃红溶液。
(3)苯酚品红溶液称取11g碱性品红溶于100ml无水酒精中。
再取上述溶液10ml与100ml 5%的苯酚溶液混合,过滤备用。
(4)黑色素(nigrosin)溶液10%黑色素溶液,置沸水浴中30min后,滤纸过滤二次,补加水到100ml, 然后加入40%甲醛0.5%(v/v)作防腐剂。
5.荚膜染色液(1)黑色素水溶液将黑色素在蒸馏水中煮沸5min,配成5%溶液,然后加入40%甲醛0.5%(v/v)作防腐剂。
(2)蕃红染色液与革兰氏染色液中的蕃红复染液相同。
6.鞭毛染色液A液:单宁酸5.0g、FeC131.5g、蒸馏水100ml,福尔马林(15%)2.0ml、NaOH(1%)1.0ml。
鞭毛染色实验报告

篇一:鞭毛染色实验报告年月日山东大学实验报告2011 年10月26 日姓名:年级同组科目微生物题目观察鞭毛染色和运动201001140018一.实验目的学习并掌握鞭毛染色法并了解鞭毛的形态特征巩固显微镜操作技术及无菌操作技术学习压滴法观察细菌运动性(活细胞)二.实验原理细菌鞭毛染色法的基本原理简单染色法适用于一般的微生物菌体的染色,而某些微生物具有一些特殊结构,如鞭毛,对它们进行观察之前需要进行有针对性的染色。
鞭毛是细菌的纤细丝状的运动器。
鞭毛的有无、数量及着生方式也是细菌分类的重要指标。
鞭毛直径一般为10~30nm,只有用电镜才可以直接观察到。
若要用普通光学显微镜观察,必须使用鞭毛染色法。
首先用媒染剂处理,使媒染剂附着在鞭毛上使其加粗,然后用碱性复红(gray氏染色法)、碱性复品红(leifson氏染色法)、硝酸银(west氏染色法)或结晶紫(difco 氏染色法)进行染色。
压滴法观察活菌运动的基本原理鞭毛的功能相当于船的螺浆,在水中可以高速旋转从而推动菌体前行,因此水体环境才是鞭毛细菌自由驰骋的天地。
鞭毛的旋转速度是非常快的,每秒钟旋转两百到一千多转,比一般的电动机要快得多。
鞭毛的高速旋转是由其附着于菌体上的基体旋转带动的,基体实际上就是鞭毛的基部,它由一个中轴套上两个或四个环构成,镶嵌固定在细菌的体表(细胞膜和细胞壁)中,在科学家的眼中,基体简直就是一台精巧的纳米机械—分子马达,但这个马达并不是靠电流驱动,而是用伴随着细胞膜两侧质子梯度的消失产生的生物能量atp来驱动,鞭毛马达还可以转向(从反时针旋转变为顺时针旋转)从而使菌体发生翻滚进而改变细菌的运动方向,事实上细菌在游动时也并不是单纯地一直朝前游,而是伴随着不时的随机翻滚转向,但从表观上看仍表现为细菌的前行。
细菌未染色时无色透明,在显微镜下主要靠细菌的折光率与周围环境的不同来进行观察。
若想观察的更加清晰,可以滴加稀释美兰等染液进行染色,注意不要染色过重,以免影响观察,有鞭毛的细菌运动活泼,且不同时向一个方向运动,而无鞭毛的细菌则呈不规则布朗运动。
杜氏利什曼原虫前鞭毛体三种不同染色方法的比较

课程 中必须观察的重点内容。杜 氏利什曼原 虫前鞭毛体标本
通常用姬 氏染色 , 鞭毛着色需要较长时间 , 课上操作费时。本 文 比较 了 3 种不同的染色方法 , 其介绍如下。
1 材 料 与方 法
蓝紫色( 如图 1 c ) 。
3 讨 论
人体寄生虫学实验教学 中杜 氏利什曼原虫前鞭 毛体染色
0一 , 一 ●
图 I 3组 动物主动 脉 大体观 察
H E x 4 0 0 ( a : 健康 对照组 ; b : 动脉 粥样硬 化模型组 ; : 培哚 普 利组 ) 图2 3组动 物主动 脉
! I E染色观 察 H E x 4 0 0 ( a : 健康 对照组 : 动脉 粥样硬 化模型组 ; c : 培哚普利组 )
作, 而且结果不稳定 , 同一培养基 涂片染色相 同时间 , 有 的鞭 毛着色 , 有的鞭毛不着色 , 不易控制。 瑞 氏染色与瑞姬氏染 色相 同时间的情况下 ,背景培养基
1 . 2 标本 的制备与染色 1 . 2 . 1 姬氏( G i e ms a ) 染色 : ①姬姆萨染液配制 : 姬 氏染液原液
mL , 混合后滤去沉淀。 ②同上甲醇晾干固定 。 ③将 配制混合染 液滴加覆盖薄膜区域 , 染色 5 ~ 1 0 ai r n 。④缓冲液冲洗后晾干。
( 收稿 日期 : 2 0 1 6 — 0 7 . 0 1 )
兔 动脉 粥样硬 化对 心脏胶原 的影响及培 哚普利 的干预
( 文 第 1 1 6 4贞 )
洗后晾干 。
短, 宜实验教学 中采用 , 但这 3种染 色方法标 本 的长 期保存
效果 哪一种更佳还需 日后进一步证实 。
( 本文图 1 见封三 ) 参 考 文 献
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
北京华越洋生物提供QQ1733351176
鞭毛染色液(试剂盒)
试剂盒成分:
产品说明:
细菌鞭毛为细菌的运动器官,主要成分是蛋白质。
其形态细长,直径约10-20nm,需用电子显微镜才能观察到。
所以鞭毛染色时先经媒染剂处理,使鞭毛增粗,然后再进行染色,则可在普通光学显微镜下观察。
操作步骤:
取鞭毛染色液 A 液9 份和 B 液 1 份混合配成工作液,现用现配,建议过滤后使用。
(1) 细菌标本制备:变形杆菌接种于琼脂平板,37℃培养18-24h,仔细从菌膜迁徙生长的边缘处挑取菌体少许,轻轻放入无菌蒸馏水试管中,经数分钟使其自行分散,再37℃放置约10min。
(2) 涂片:取上述菌液一接种环,轻轻滴于载玻片上,使成薄膜。
涂抹时接种环随水滴移动,切勿与玻片相磨,以免鞭毛脱落。
(3) 染色:涂片自然干燥(勿用火焰固定)后,滴加鞭毛染色液数滴覆盖菌膜,染色5-10min ,水洗、吸干、镜检。
预期结果:
鞭毛呈淡红色,菌体呈红色。
注意事项:
1. 避免菌液浓度过高,否则鞭毛交叉粘连,菌体量过多,不能充分着色,不利
于观察。
北京华越洋生物提供QQ1733351176
2. 菌悬液37℃处理时间过长会导致菌体鞭毛膨胀过大与脱落,处理时间过短,
鞭毛纤细不易着色。
3. 若染色过浅可适当延长染色时间。
产地:国产
提示:本品仅用于科研实验,不能用作医疗及临床诊断。
储存条件:室温避光保存,有效期至少 1 年。
关键词:鞭毛染色液
鞭毛染色液相关染色产品:。
