结构化学第6章
合集下载
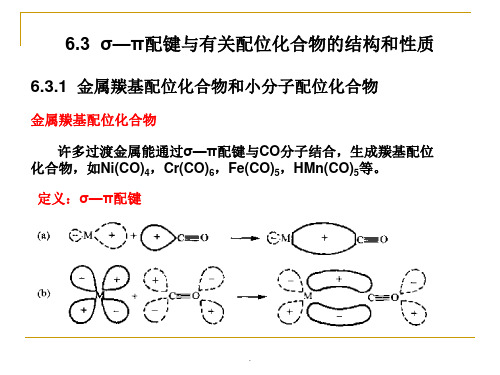
结构化学_第6章_3

[Ti(H2O)6]3+ 颜色?
[Ti(H2O)6]3+在490.2nm处有一最大吸收峰,
即吸收了蓝绿色成分, 其互补色是紫红色,
34 8 6 . 626 10 3 10 hc 3+ 7 4.90210(米) 2O)6] 呈紫红色。 故 [Ti(H 244000 490 .2(纳米) 6.02 1023
14.0
1.70
p197, 表6.2.2 八面体场的f 和g 值
练习
计算FeF63-、Fe(H2O)63+、Fe(CN)63-的分裂能 Pt
151 kJ/mol 168 kJ/mol 286 kJ/mol
Pt
151 kJ/mol
168 kJ/mol
286 kJ/mol
p197, 表6.2.2 八面体场的f 和g 值
Violet
490nm Violet-red
Pt
Pt
6.2.2.2 经验规则:
(1) △o可表示为配体贡献与中心离子贡献的 积
f
g (1000cm-1)
Δo = f × g
练习
计算FeF63-、Fe(H2O)63+、Fe(CN)63-的分裂能 Pt
151 kJ/mol 168 kJ/mol 286 kJ/mol
p227 6-17
无机p184, 光谱化学序列:CO > CN- > NO2- > bipy > en > NH3 > NCS- > H2O > C2O42- > OH- > F- > NO3- > Cl- > SCN- > S2- > Br- > I-
结构化学课件第六章

显然,同前述结果一致
6.2 配体的群轨道
利用Oh群特征标表可知,
6L 6,0,0,2,2
A1g Eg T1u
令 x,y,z 正向的L是σ 1、σ 2、σ 3 ,负向为σ 4、σ 5、σ 6
A1g
1 6
1
2
3
4
5
6
Eg
1 2
1
4F 4Cl 4Br 4NH3 4F
为193,2F 227pm 为230,2Cl 295pm 为240,2Br 318pm 为207, 2NH3 262pm 为208, 2F 195pm
L'
L
L
Cu
L
L
L'
各种对称性场中 d 能级分裂
配
d d 位 场对称性
x2-y2
z2 dxy
dyz
dxz
注
数
2 直 线 形 - 0.628 3 正 三 角 形 0.545 4 正四面体形 - 0.267 4 平面正方形 1.228 6 正八面体形 0.600 5 三角双锥形 - 0.082 5 四 方 锥 形 0.914 7 五角双锥形 0.282
1.028 - 0.628 0.114 - 0.321 0.546 - 0.386 - 0.267 0.178 0.178 - 0.428 0.228 - 0.514 0.600 - 0.400 - 0.400 0.707 - 0.082 - 0.272 0.086 - 0.086 - 0.457 0.493 0.282 - 0.528
1
3
结构化学第6章

八面体场
分裂能(△o):1个电子从较低能量d轨道跃迁到较高 能量d轨道所需的能量。
量子力学原理指出:
不论晶体场的对称性如何,受到相互作用的d轨道的 平均能量是不变的,为球形场作用产生的Es能级,习 惯将Es取作0点;
则有
解之,有
E(eg)-E(t2g)=10Dq 2E(eg)+3E(t2g)=0 E(eg) =6Dq, E(t2g)=-4Dq
常见的杂化形式
d2sp3正八面体
dsp2正方形
d4sp3 正十二面体
sp3正四面体
sp2正三角形
sp直线
2. 电价配键
电价配合物: 中心离子与配体(配位原子电负性较大, 如氮、氧、卤素等)以静电作用结合在一起,中心离 子的电子层结构保持其自由离子状态,采用spd外轨 杂化,是高自旋配合物。
例如
[FeF6]3-, [Ni(NH3)6]2+
二、d轨道的能级分裂
d轨道角度分布图: y
- + + - -
z
+ - -
z
+ -
x
+
y
+
x
dxy
z
+
- + -
dyz
y - + - +
dxz
x
x
d z2
d
x2 y2
(1)d轨道能级的分裂
配体所形成的负电场对中心d电子起作用,消除d 轨道的简并。这种现象叫d轨道的能级在配位场中 发生了分裂。 分裂的根源:(1)d轨道具有明显的角度分布。(2)d轨 道所在的配位场不是球形对称的。
3d
4s
4p
重排
3d
分裂能(△o):1个电子从较低能量d轨道跃迁到较高 能量d轨道所需的能量。
量子力学原理指出:
不论晶体场的对称性如何,受到相互作用的d轨道的 平均能量是不变的,为球形场作用产生的Es能级,习 惯将Es取作0点;
则有
解之,有
E(eg)-E(t2g)=10Dq 2E(eg)+3E(t2g)=0 E(eg) =6Dq, E(t2g)=-4Dq
常见的杂化形式
d2sp3正八面体
dsp2正方形
d4sp3 正十二面体
sp3正四面体
sp2正三角形
sp直线
2. 电价配键
电价配合物: 中心离子与配体(配位原子电负性较大, 如氮、氧、卤素等)以静电作用结合在一起,中心离 子的电子层结构保持其自由离子状态,采用spd外轨 杂化,是高自旋配合物。
例如
[FeF6]3-, [Ni(NH3)6]2+
二、d轨道的能级分裂
d轨道角度分布图: y
- + + - -
z
+ - -
z
+ -
x
+
y
+
x
dxy
z
+
- + -
dyz
y - + - +
dxz
x
x
d z2
d
x2 y2
(1)d轨道能级的分裂
配体所形成的负电场对中心d电子起作用,消除d 轨道的简并。这种现象叫d轨道的能级在配位场中 发生了分裂。 分裂的根源:(1)d轨道具有明显的角度分布。(2)d轨 道所在的配位场不是球形对称的。
3d
4s
4p
重排
3d
结构化学第六章..

二、d轨道的能级分裂
配体所形成的负电场对中心d电子起作用,消除d轨道的简并。
分裂的根源:(1)d轨道具有明显的角度分布。
(2)d轨道所在的配位场不是球形对称的。
1、正八面体配位场(Oh):
在正八面体配合物中,金属离子位于八面体中心,六 个配位体分别沿着三个坐标轴正负方向接近中央离子。
z y 3 2 4 5 6 1 x
四碘合汞(ll)酸 六氟合硅(IV)酸钾 二硫酸根合钴(II)酸钾 氯化二氨合银(I) 二水合一氯化二氯四氨合铬 (III) 三氯一氨合铂(II)酸钾 三氯五氨一水合钴(III) 四硫氰根· 二氨合铬(Ⅲ)酸铵
五、配合物和配体的分类
MLn 称单核配合物
中心原子(离子)M: MmLn 称多核配合物
M—M 称原子簇合物
配位数 5--三角双锥或四方锥形
配位数 6--八面体或三棱柱
表6.1
配位化合物 配位数 [Hg(NH3)2]2+ [Au(CN)2] [CuCN3]2Ni(CO)4 [Zn(NH3)4]2 [Ni(CN)4]2[PtCl4]2Os(CO)5
-
若干配位化合物所采取的几何构型
几何构型 直线型 直线型 平面三角形 四面体 四面体 平面正方形 平面正方形 三角双锥 对称性 配位化合物 配位数 几何构型 对称性 Dh Dh D3h Td Td D4h D4h D3h [Ni(CN)5]3[SbF5]2[CoF6]3- [Fe(CN)6]3Cr(CO)6 [ZrF7]3Re(S2C2Ph2)3 [Mo(CN)8]45 5 6 6 6 7 6 8 三角双锥 四方锥 八面体 八面体 八面体 五角双锥 三棱柱 十二面体 D3h C4v Oh Oh Oh D5h D3h D2d
结构化学_第6章_4

0.0
d2
△o
- 0.4
稳定化能(LFSE)= 0.8 △o
Pt
Pt
0.6
E (△o)
0.0
d3
△o
- 0.4
稳定化能(LFSE)= 1.2 △o
Pt
Pt
0.6
E (△o)
0.0
d4
△o
- 0.4
Pt
Pt
p198 line 3
自旋平行分占两个轨道的电子被挤到同一轨道上自旋相反, 这两种状态间的能量差,称为成对能。
Pt
Pt
配合物中金属原子d电子填入分裂后的d轨道后,若不考 虑成对能,只考虑分裂能,则能量降低的总值称为配合 物稳定化能(LFSE)
Pt
Pt
弱场
0.6
E (△o)
d z2
d x2 y 2
高自旋配合物 [Fe(H2O)6]3+ [FeF6]3-
0.0
△0 < P
d xy
d xz
d yz
-0.4
八面体场中 d 电子排布 未成对电子数 实测磁矩/B.M 自旋状态
例2 例3
Pt
Pt
Cu2+水溶液呈浅蓝色,当加入NH3后呈深蓝色
[Cu(H2O)4]2++4 NH3→[Cu(NH3)4]2++4 H2O
Cu2+水溶液吸收红光呈浅蓝色,加入 NH3后配体由H2O变为NH3,△增大,使 吸收峰波长变短,吸收橙色,变为深蓝色。
10 ↑↓ ↑↓ ↑↓
↑↓ ↑↓
-5P
↑↓ ↑↓ ↑↓
↑↓ ↑↓
-3P
表6.2.3 不同d电子组态的LFSE数值(Δo )
结构化学第六章

第六章配位化合物的结构和性质
一.基本概念:
1.配合物、中心原子、配体、单核配合物、多核配合物
2.电价配合物、共价配合物、高自旋配合物和低自旋配合物
3.分子磁矩与未成对电子数的关系
4.晶体场、分裂能、成对能、光谱化学序、强场、弱场、晶体场稳定化能5.姜太勒效应和络合物畸变
6. M中σ型轨道和π型轨道
7. M-L之间的σ键及能级次序
8.羰基配合物中的σ-π键
9.π络合物中的σ-π键
10.电子规则和9n-l规则
二.基本计算和应用:
1.VBT与CFT理论对配合物的结构与性质的解释
2.d电子的排布、影响分裂能的因素
3.稳定化能的计算及应用
4.姜太勒效应
5.过渡金属络合物的颜色
6.络合物的几何构型
7.用分子轨道理论说明配合物的成键情况
8.σ-π型配键
三.重点内容
1.晶体场理论,d电子的排布、影响分裂能的因素,稳定化能的计算及应用2.配位场理论,八面体场的分裂,配位场稳定化能及对化合物性质的影响3.姜太勒效应
4.σ-π型配键及配位化合物的结构
四.自学引导
1.由静电作用模型引出晶体场理论,通过d电子轨道分裂引出分裂能、稳定化能及对配合物的结构与性质的解释
2.由分子轨道理论引出配位场理论,通过八面体场的分裂引出配位场稳定化能、姜太勒效应及对化合物性质的解释
3.通过σ-π型配键引出对过渡金属的配位化合物的结构、性质的解释。
五.作业
6.3,6.4,6.5,6.7,6.12,6.14,6.15,6.20, 6.23。
结构化学第6章

T2g T2 3 0 T1u
(Rx,Ry,Rz) (xy,yz,xz) (x,y,z)
3 0
-1 0
1 2
-1 (2)
6
6 0
8
① 中心原子AO对称性分类,九个AO分属
d: xy, yz, xz —— T2 g d: x2-y2, Z2—— Eg P: x, y, z—— T1u S: —— Ag
2
大多数 6 配位的化合物为八面体结构,Oh 对称性
正八面体 Fe(CN)64 Co(NH3)63+
V(H2O)62+
Oh 对称
性
3
中心离子:价电子层为9个AO,离子在座标轴原点,
则: 4S
4Px, 4Py, 4 Pz
3dx2-y2, 3dz2
在坐标轴 x, y, z方向——σ对称性
在非座标轴方向,夹在两轴间,
-0.8 -1.2
-0.6 0
-0.4
-0.8 -1.2
d1
d2
d3
d8
d9
d10
38
△ P,弱场, HS
>P,强场, LS △ P,弱场, HS 1. 强场轨道能比弱场降低,d4=d7= Δ,d5= d6= 2Δ 2. d6构型最倾向于低自旋 d5半充满。
3. 强, 弱场 d1-d3, d8-d10 构型相同 d4-d7 构型不同
6-2 配位场理论
1
6-2 配位场理论
6-2-1 八面体络合物的MO轨道
杂化轨道理论能说明络合物分子立体构型,
晶体场理论能说明络合物的颜色,磁性;
但不能解释光谱化学序列,羰基络合物,有机烯络合物等;
而且中心离子与配位体间有电子云的重迭,能组成 MO ,
(Rx,Ry,Rz) (xy,yz,xz) (x,y,z)
3 0
-1 0
1 2
-1 (2)
6
6 0
8
① 中心原子AO对称性分类,九个AO分属
d: xy, yz, xz —— T2 g d: x2-y2, Z2—— Eg P: x, y, z—— T1u S: —— Ag
2
大多数 6 配位的化合物为八面体结构,Oh 对称性
正八面体 Fe(CN)64 Co(NH3)63+
V(H2O)62+
Oh 对称
性
3
中心离子:价电子层为9个AO,离子在座标轴原点,
则: 4S
4Px, 4Py, 4 Pz
3dx2-y2, 3dz2
在坐标轴 x, y, z方向——σ对称性
在非座标轴方向,夹在两轴间,
-0.8 -1.2
-0.6 0
-0.4
-0.8 -1.2
d1
d2
d3
d8
d9
d10
38
△ P,弱场, HS
>P,强场, LS △ P,弱场, HS 1. 强场轨道能比弱场降低,d4=d7= Δ,d5= d6= 2Δ 2. d6构型最倾向于低自旋 d5半充满。
3. 强, 弱场 d1-d3, d8-d10 构型相同 d4-d7 构型不同
6-2 配位场理论
1
6-2 配位场理论
6-2-1 八面体络合物的MO轨道
杂化轨道理论能说明络合物分子立体构型,
晶体场理论能说明络合物的颜色,磁性;
但不能解释光谱化学序列,羰基络合物,有机烯络合物等;
而且中心离子与配位体间有电子云的重迭,能组成 MO ,
《结构化学第六章》
.
产生磁性的原因: 物质具有不同的磁性,首先是源于物质内部的电子组
态,即电子在原子轨道和分子轨道上的排布情况;其次是 源于化学成分、晶体结构、晶粒组织和内应力等因素,这 些因素引起磁矩排列的情况不同。
.
物质的磁结构分类:
.
6.6.2 顺磁共振
顺磁共振是研究具有未成对电子的物质,如配合物、 自由基和含有奇数电子的分子等顺次性物质结构的一种重 要方法,它又称为电子顺磁共振(EPR)或电子自旋共振 (ESR)。 原理:
.
三种成键方式(自由基反应):
6.5.3 簇合物的催化性能(自学)
.
6.6 物质的磁性和磁共振
磁性是普遍存在的一种物质属性,任何一种物质材料 都有磁性,只不过表现形式和程度有所不同。物质的磁性 常用磁化率х或磁矩μ表示。磁化率是在外磁场H中物质 磁化强度M和磁场强度H的比值:
M/H
Χ是一个无量纲的量。
因子是为了使δ得到一个便于表达的数值。
对于扫频仪器,δ可以如下表达成
Δ是i 无量v纲 v参的,1由0于6 乘10v6因i v子参v,参所以1单0位6为ppm。
.
影响化学位移的因素: (1)核外电子分布 (2)抗磁各向异性效应 (3)溶剂效应和氢键的影响
.
3.磷、砷、锑、铋的三价化合物,如PF3、PCl3、AsCl3、 SbCl3、PR3等也可作为配位体形成σ—π配键。P、As等原子除 有一孤对电子可以作为电子对的供给者,与M形成σ键外,它还 有空的d轨道可和M形成反馈π键,使配位化合物稳定存在,例如 Pd(PF3)4、HCo(PF3)4、Ni(PF3)4、(R3P)4Mo(CO)2等。
.
6.3.2 不饱和烃配位化合物
以不饱和烃为配位体,通过σ—π配键与过渡金属形成的 配位化合物,在石油化工中占有重要地位。
产生磁性的原因: 物质具有不同的磁性,首先是源于物质内部的电子组
态,即电子在原子轨道和分子轨道上的排布情况;其次是 源于化学成分、晶体结构、晶粒组织和内应力等因素,这 些因素引起磁矩排列的情况不同。
.
物质的磁结构分类:
.
6.6.2 顺磁共振
顺磁共振是研究具有未成对电子的物质,如配合物、 自由基和含有奇数电子的分子等顺次性物质结构的一种重 要方法,它又称为电子顺磁共振(EPR)或电子自旋共振 (ESR)。 原理:
.
三种成键方式(自由基反应):
6.5.3 簇合物的催化性能(自学)
.
6.6 物质的磁性和磁共振
磁性是普遍存在的一种物质属性,任何一种物质材料 都有磁性,只不过表现形式和程度有所不同。物质的磁性 常用磁化率х或磁矩μ表示。磁化率是在外磁场H中物质 磁化强度M和磁场强度H的比值:
M/H
Χ是一个无量纲的量。
因子是为了使δ得到一个便于表达的数值。
对于扫频仪器,δ可以如下表达成
Δ是i 无量v纲 v参的,1由0于6 乘10v6因i v子参v,参所以1单0位6为ppm。
.
影响化学位移的因素: (1)核外电子分布 (2)抗磁各向异性效应 (3)溶剂效应和氢键的影响
.
3.磷、砷、锑、铋的三价化合物,如PF3、PCl3、AsCl3、 SbCl3、PR3等也可作为配位体形成σ—π配键。P、As等原子除 有一孤对电子可以作为电子对的供给者,与M形成σ键外,它还 有空的d轨道可和M形成反馈π键,使配位化合物稳定存在,例如 Pd(PF3)4、HCo(PF3)4、Ni(PF3)4、(R3P)4Mo(CO)2等。
.
6.3.2 不饱和烃配位化合物
以不饱和烃为配位体,通过σ—π配键与过渡金属形成的 配位化合物,在石油化工中占有重要地位。
结构化学_第6章_5

↑↓ ↑
10 ↑↓ ↑↓ ↑↓
↑↓ ↑↓
-5P
↑↓ ↑↓ ↑↓
↑↓ ↑↓
LFSE
0 0.4Δo 0.8Δo 1.2Δo 1.6Δo-P 2.0Δo-2P 2.4Δo-3P 1.8Δo-3P 1.2Δo-3P 0.6Δo-3P -3P
表6.2.3 不同d电子组态的LFSE数值(Δo )
若不考虑成对能 ,即可定性解释有关规律(198)
主讲:
配合物中金属原子d电子填入分裂后的d轨道后,若不考 虑成对能,只考虑分裂能,则能量降低的总值称为配合 物稳定化能(LFSE)
主讲:
E (△o) 0.6 0.0 -0.4
弱场
d z2
dx2y2
高自旋配合物 [Fe(H2O)6]3+
[FeF6]3-
△0 < P
dxy
dxz
d yz
主讲:
E (△o) 0.6 0.0 -0.4
向于尽可能多地占据轨道,
形成HS型配位化合物
强配体场下,P < o,电子倾向
于尽可能少地占据轨道,形成
LS型配位化合物
主讲:
表6.2.3 不同d电子组态的能变 (p198)
dn
(HS)弱场
LS(强场)
t2g
e*g
LFSE
t2g
e*g
0
0
1↑
0.4Δo
↑
2 ↑↑
0.8Δo
↑↑
3 ↑↑↑
1.2Δo
↑↑↑
主讲:
6.2 配位场理论
6
主讲:
p197
6.2.3 配位场稳定化能与配合物性质
主讲:
0.6 E (△o)
0.0
结构化学_第6章_5-6

Pt
Pt
解:水是弱场配体,故 Mn(H2O)63+ 为高自旋配位离子 , Mn3+:3d4,电子排布为t2g3eg1, LFSE=0.6∆o 因此处于 eg 轨道上的电子易失去,失去电子后 LFSE 增大为12 ∆o ,这就是Mn(H2O)63+不稳定的原因。另外 ,它还容易发生Jahn-teller畸变。 Cr(H2O)63+ 中的 d 电子排布为 t2g3 , LFSE 为 12∆o 。反键 轨道上无电子是Cr(H2O)63+较稳定的原因。该配合物离 子不发生Jahn-teller畸变。
Pt
Pt
Jahn-Teller效应
d z2
E (Dq) 6.0
d x2 y 2
eg*
0.0
d1
d xy
d xz
d yz
-4.0
t2g
低自旋态,小畸变
Pt
Pt
Jahn-Teller效应
E (Dq)
6.0
d z2
d x2 y 2
eg*
d2
0.0
d xy
d xz
d yz
-4.0
t2g 高自旋态,小畸变
Pt
Pt
Jahn-Teller效应
d z2
E (Dq) 6.0
d x2 y 2
eg*
d6
0.0
d xy
d xz
d yz
-4.0
t2g
高自旋态,小畸变
Pt
Pt
Jahn-Teller效应
d z2
E (Dq)
d x2 y 2
6.0
eg*
0.0
d7
d xy
d xz
Pt
解:水是弱场配体,故 Mn(H2O)63+ 为高自旋配位离子 , Mn3+:3d4,电子排布为t2g3eg1, LFSE=0.6∆o 因此处于 eg 轨道上的电子易失去,失去电子后 LFSE 增大为12 ∆o ,这就是Mn(H2O)63+不稳定的原因。另外 ,它还容易发生Jahn-teller畸变。 Cr(H2O)63+ 中的 d 电子排布为 t2g3 , LFSE 为 12∆o 。反键 轨道上无电子是Cr(H2O)63+较稳定的原因。该配合物离 子不发生Jahn-teller畸变。
Pt
Pt
Jahn-Teller效应
d z2
E (Dq) 6.0
d x2 y 2
eg*
0.0
d1
d xy
d xz
d yz
-4.0
t2g
低自旋态,小畸变
Pt
Pt
Jahn-Teller效应
E (Dq)
6.0
d z2
d x2 y 2
eg*
d2
0.0
d xy
d xz
d yz
-4.0
t2g 高自旋态,小畸变
Pt
Pt
Jahn-Teller效应
d z2
E (Dq) 6.0
d x2 y 2
eg*
d6
0.0
d xy
d xz
d yz
-4.0
t2g
高自旋态,小畸变
Pt
Pt
Jahn-Teller效应
d z2
E (Dq)
d x2 y 2
6.0
eg*
0.0
d7
d xy
d xz
结构化学 第六章..

把中心离子与配位体的相互作用,看作类似于晶体中正负 离子间的相互作用。着眼点是中心离子 d 轨道在周围配位
体影响下的能级发生分裂。
电子在分裂了的轨道上的排布状态,决定了配位场的光谱、 磁性、稳定性、几何构型等性质。CFT 可比较满意地解释
上述性质。但这个理论没有考虑中心离子与配体间的共价
作用成份,不能解释羰基、不饱和烯等配合物的成键本质。
Ea=E0+(E0+o)=2E0+
(b) 强场低自旋 O > P
(III) d 电子的排布
—高、低自旋态
例1:[CoF6]3-, Co3+: d 6, O=13000 cm-1, P=21000 cm-1 P > O 弱场高自旋
eg* t2g
t2g4 eg*2
LFSE = - [ 4×( - 4 Dq) + 2×6 Dq] = 4 Dq
设M位于直角坐标系原点, 6个 L 位于坐标轴上。M共有9个价轨道 可参与分别形成或型分子轨道: 型: s px py
pz dx2-y2 dz2
型:dxy dyz dxz
① 中心原子AO对称性分类 型: s ……………..a1g
px py pz ……t1u
dx2-y2 dz2 ………eg
型:dxy dyz dxz ……t2g
Oh群的不可约表示
② 配位体群轨道 6 个 L :每个至少有 1
பைடு நூலகம்
个 型轨道,共有6 个
轨道 ( 一般是配体孤对 电子轨道 ) 。将这 6 个
轨道重新组合成新的
群轨道,使之与M的原 子轨道对称性匹配。
配位体群轨道及其对称性
a1g
1 ( 1 2 3 4 5 6 ) 6
体影响下的能级发生分裂。
电子在分裂了的轨道上的排布状态,决定了配位场的光谱、 磁性、稳定性、几何构型等性质。CFT 可比较满意地解释
上述性质。但这个理论没有考虑中心离子与配体间的共价
作用成份,不能解释羰基、不饱和烯等配合物的成键本质。
Ea=E0+(E0+o)=2E0+
(b) 强场低自旋 O > P
(III) d 电子的排布
—高、低自旋态
例1:[CoF6]3-, Co3+: d 6, O=13000 cm-1, P=21000 cm-1 P > O 弱场高自旋
eg* t2g
t2g4 eg*2
LFSE = - [ 4×( - 4 Dq) + 2×6 Dq] = 4 Dq
设M位于直角坐标系原点, 6个 L 位于坐标轴上。M共有9个价轨道 可参与分别形成或型分子轨道: 型: s px py
pz dx2-y2 dz2
型:dxy dyz dxz
① 中心原子AO对称性分类 型: s ……………..a1g
px py pz ……t1u
dx2-y2 dz2 ………eg
型:dxy dyz dxz ……t2g
Oh群的不可约表示
② 配位体群轨道 6 个 L :每个至少有 1
பைடு நூலகம்
个 型轨道,共有6 个
轨道 ( 一般是配体孤对 电子轨道 ) 。将这 6 个
轨道重新组合成新的
群轨道,使之与M的原 子轨道对称性匹配。
配位体群轨道及其对称性
a1g
1 ( 1 2 3 4 5 6 ) 6
结构化学-第六章

NH2
C
C
O
OO
O
EDTA4-乙二胺四乙酸根
乙二胺en
2020/5/8
5
二. 配位化合物结构理论
价键理论――晶体场理论――分子轨道理论――配位场理论 杂化轨道 静电作用模型 MOT处理配键 配位化合物的
VBT理论T ① 共价配键和d-s-p杂化轨道(低自旋化合物)
A: 当中心离子M固定时, 值随配体而改变
2020/5/8
19
CO≈CN–NO2– 邻蒽菲联吡啶SO32–乙二胺(en)NH3 吡啶 EDTA H2O F–OH– Cl– Br–I–
大者为强场配位体, 小者为弱场配位体。由于通常由光谱 实验确定,故称这个顺序为光谱化学序列(也称配位场强 度序列)。
2020/5/8
12
① 正八面体场
6个配位体,沿x,y,z轴接近金属原子。dz2,dx2- y2与配体的斥 力大,轨道能量上升多;dxy,dxz,dyz与配体的斥力小,轨道 能量上升少 。
接近方式如图:
z
z
z
y
x
y
x
dxz z
dyz
dxy
y
y
x
x
x
dx2-y2
dz2
2020/5/8
13
d轨道分裂为:
❖ 配位体:含有电子的烯、炔、芳香烃,与过渡金属形成配 位化合物
❖ n配位体:一个配体与n个金属原子配位
❖ n配位体:一个配体的 n个配位点与同一个金属原子配位
2020/5/8
4
H
H3C
C
CH3
C
C
O
O
乙酰丙酮
N
N
N
O
结构化学基础-6配位化合物的结构和性质

4 t 0 9 ☻ 立方体场( Oh, 8 配位):
☻ 平面正方形场(D4h):
4 8 = 2 t 2 0 0 9 9
x y2
Ed 2
Ed xy Eb1 g Eb2 g 10 Dq
所以,d 8 结构形成平面正方形结构者甚多。但当 Dq 较小时 (弱场),也可能形成正四面体配位化合物。
• N2的HOMO(3g)能量比CO低,而LUMO轨道又比 CO的高 • 即 N2 较 CO 来说,既不易给出电子,又不易 接受电子。 • 所以 N2 分子配合物不易合成。
磷配体
金属不饱和烃配合物
• 1825年, Zeise(蔡斯)盐:PtCl3(C2H4)]–K+
金属不饱和烃配合物
• 这样既可防止由于形成配键使电荷过分集 中到金属原子上,又促进成键作用。
核磁共振
研究对象:原子核的磁矩在磁场中对电磁波的吸收和发射
• 第1次,美国科学家Rabi发明了研究气态原子核磁性的共振方法,获 l944年诺贝尔物理学奖。 • 第2次,美国科学家Bloch(用感应法)和Purcell(用吸收法)各自独 立地发现宏观核磁共振现象,因此而获1952年诺贝尔物理学奖。 • 第3次,瑞士科学家Ernst因对NMR波谱方法、傅里叶变换、二维谱技 术的杰出贡献,而获1991年诺贝尔化学奖。 • 第4次,瑞士核磁共振波谱学家Kurt Wüthrich,由于用多维NMR技术在 测定溶液中蛋白质结构的三维构象方面的开创性研究,而获2002年诺 贝尔化学奖。同获此奖的还有一名美国科学家和一名日本科学家。 • 第5次,美国科学家Paul Lauterbur于1973年发明在静磁场中使用梯度 场,能够获得磁共振信号的位置,从而可以得到物体的二维图像;英 国科学家Peter Mansfield进一步发展了使用梯度场的方法,指出磁共 振信号可以用数学方法精确描述,从而使磁共振成像技术成为可能, 他发展的快速成像方法为医学磁共振成像临床诊断打下了基础。他俩 因在磁共振成像技术方面的突破性成就,获2003年诺贝尔医学奖。
王顺荣编高教版社结构化学习题答案第6章

12、将 C2H6 和 C2H4 通过 AgNO3 溶液,能否将它们分开?若能,则说明微观作 用机理。 答:烯烃可与 Ag+生成稳定的配位化合物而烷烃却不能。因此,当他们的混合物 通入银盐溶液时,两者即可被分离。乙烯分子中有成键的 π 轨道和反键的 π*轨 道。Ag+的外层电子组态为 4d105s0。当乙烯分子和 Ag+结合时,乙烯分子的 π 轨 道和 Ag+的 5s 空轨道叠加,乙烯的 π 电子进入 Ag+的 5s 轨道而形成 σ 键。与此 同时,乙烯分子的 π*轨道和 Ag+的 d 轨道(如 dxz)叠加,Ag+的 d 电子进入乙 烯分子的 π*轨道,形成 π 键。这样,在乙烯分子和间形成 σ-π 配键。σ-π 配键的 形成使烯烃和 Ag+形成稳定的配合物,从而使烯烃和烷烃分离。
5.配合物[Fe(NH3)4Cl2]只有两种异构体,若此配合物为正六边形构型,应当有几 种异构体?若为三角柱型,又有几种异构体?那么到底应是什么构型?
Cl NH3 Fe NH3 NH3 Cl NH3 NH3 NH3 NH3 Fe Cl Cl NH3
答:正六边形构型 : 三角柱型
Cl NH3 NH3
Cl NH3 NH3 NH3
10. 判断下列配位化合物姜-泰勒效应的大小的次序: [Cu(H2O)6]2+,[Co(H2O)6] [Fe(CN)6]3-, [Ni(CN)6]4答:[Co(H2O)6] 2+ >[Ni(CN)6]4-> [Cu(H2O)6]2+ > [Fe(CN)6]3-
2+
,
11.硅胶干燥剂中常加入 CoCl2(蓝色) ,吸水后变为粉红色,试用配位场理论解 释其原因。 以蔡斯盐和 Ni(CO)4 分子中金属与不饱和分子配体间的化学键特点讨 论络合催化机理。 答:Co2+为 d7 组态。在无水 CoCl2 中,Co2+受配体 Cl-的作用,d 轨道能级发生分 裂,7 个 d 电子按电子排布三原则填充在分裂后的轨道上。当电子发生 d-d 跃迁 时,吸收波长为 650~750nm 的红光,因而显示蓝色。但 CoCl2 吸水后,变为 [Co(H2O)6]Cl2,即由相对较强懂得 H2O 取代了相对较弱的配体 Cl-,引起 d 轨道 分裂能变大,使电子发生 d-d 跃迁时吸收的能量增大,即吸收光的波长缩短(蓝 移) 。[Co(H2O)6]Cl2 吸收波长为 490~500nm 的蓝光,因而呈粉红色。
结构化学课件6第六章 配位化合物的结构和性质

八面体场,d轨道分裂成 eg 轨道(dz2 ,dx2-y2), t2g 轨道(dxy ,dxz ,dyz)。 将eg和t2g这两组轨道间的能量差用△o或10Dq来表 示, △o或10 Dq称为分裂能, 根据重心守恒原理, 则
2E(eg)+3E(t2g)=0 E(eg)-E(t2g)=△o 由此解得 E(eg)=0.6△o = 6Dq E(t2g)=-0.4△o =-4Dq
H2[HgI4]
K2[SiF6] K2[Co(SO4)2] [Ag(NH3)2]Cl [CrCl2(NH3)4]· 2H2O Cl· K[PtCl3NH3] [Co(NH3)5H20]Cl3
[Pt(NO2)(NH3)(NH2OH)(Py)]Cl
四碘合汞(ll)酸
六氟合硅(IV)酸钾 二硫酸根合钴(II)酸钾 氯化二氨合银(I) 二水合一氯化二氯四氨合铬(III) 三氯一氨合铂(II)酸钾 三氯五氨一水合钴(III)
K3[Fe(CN)6]
Fe3+:
3d5
µ =2.40
n=1
配合物的空间构型
配合物分子或离子的空间构型与配位数的 多少密切相关。 配位数
4 2 6 4 4 6 2
空间构型 直线形
四面体 平面正方形 八面体
NiCl 2 4
Ni(CN ) 2 4
例
Ag(NH3 ) 2
Fe(CN) 3 6
空间构型 例
[BeX4]2-四面体
Ni2+形成配位数为4的配合物时,既有四面体构型,也有平面正 方形构型的,前者,Ni2+采用的是dsp2杂化,后者,Ni2+采用的 是sp3 杂化。
四 配 位 的 配 平面正方形,μ=0 合 物
四面体,μ=2.83B.M.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1)为什么六方格子选左图而不选右图?
31
(2)为什么NaCl型晶胞要抽象成立方面心格子(左)而不抽 象成三方R格子(右图红线所示)?尽管后者是一个素格子.
32
6.2.3 晶体结构的代数表示——平移群
33
6.2.4 晶胞
设想把点阵放回晶体中去, 将把晶体切分成并置的平行六面 体小晶块,每个空间格子对应一 个小晶块. 这种小晶块就是晶胞, 是代表晶体结构的最小单元.
42
滑移面有几种类 型. 其中, a滑移面的 基本操作是对于该 面(假象镜面)反映后, 再沿平行于此面的x 轴方向平移ta/2. ta是 x轴方向的平移周期 a. 有时将平移直接 写成a/2.
注意:反映滑移操作中的“反映”是虚操作.
43
44
6.3.4 七大晶系
45
6.3.5 空间点阵型式——14种布拉维格子
17
按连接其中任意两点的向量将所有
点
的点平移而能复原的一组无限多个点.
阵
的
数
学
定
义
18
结构基元与点阵点
19
一维周期性结构与直线点阵
20
Cu (111面)密置层(每个原子就是一个结构基元,对应一个点阵点):
二 维 周 期 性 结 构 Cu (111面)的点阵. 红线画出的是一个平面正当格子: 与 平 面 点 阵
异
片
向
性
产地:甘肃省肃北县
玻 蜡滴 璃
片
云母薄片上的热导率有异向性
6
蓝晶石两个方向上的硬度差异显著,有“二硬石”之称; 古代的宝石工匠早就知道钻石的八面体面(111)特别难以 抛光……
1669年巴尔托林发现了光束通过冰洲石的双折射现象:
7
石墨在平行于层的方向上电导率高且为半金属性导电; 垂直于层的方向上电导率低且为半导体性导电.
阵
与
正
当
平
面
净含一个点阵点的平面格子是素格子,多于一个
格
子
点阵点者是复格子;平面素格子、复格子的取法都有
无限多种. 所以需要规定一种 “正当平面格子”标准.
28
正当平面格子的标准
1. 平行四边形 2. 对称性尽可能高 3. 含点阵点尽可能少 平面格子净含点阵点数:顶点为1/4;棱心为1/2;格内 为1. 正当平面格子有4种形状,5种型式(其中矩形有带心 与不带心两种型式):
尽管三方晶系的两种格子------六方简单(hP)和六方R 心(hR)------形状都与六方
晶系的六方简单 (hP)格子相同(即hR是两个晶系共用的), 但真实的三方晶体中只
有三次对称轴而没有六次对称轴, 六方晶体才有六次对称轴.
54
14种布拉维格子之八:正交简单(oP)
55
14种布拉维格子之九:正交体心(oI)
石墨晶体
红绿点都是C. 点阵 点放在绿点处是一 种方便的作法.
一个素晶胞
25
石墨的素晶胞与素格子
右:素格子
26
6.2.2 点阵单位(格子)
晶体可以抽象成点阵,点阵是无限的. 只要从点阵中取 一个点阵单位即格子,就能认识这种点阵.
如何从点阵中取出一个点阵单位呢?
直线点阵与素向量、复向量
27
平
面
点
40
6.3.2 晶体的宏观对称元素
晶体的理想外形及其在宏观观察中表现出来的对称性称 为晶体的宏观对称性.
41
6.3.3 晶体的微观对称元素
微观对称元素: (1)平移操作对应的点阵. (2)螺旋旋转操作对应的螺旋轴. (3)反映滑移操作对应的滑移面. 旋转2π/n再沿轴向平移m(t/n),
叫作螺旋旋转操作, 相应的微观对称 元素是螺旋轴nm . 其中, t是平移周期, n=2、3、4、6, m是小于n的(正)整 数.
39
6.3 晶体结构的对称性
6.3.1 晶体对称性的两个定理
1. 晶体中的对称轴(旋转轴、反轴、螺旋轴)必与一组 直线点阵平行, 除一重轴外, 对称轴必与一组平面点阵垂直; 晶体中的对称面(镜面、滑移面)必与一组平面点阵平行, 而 与一组直线点阵垂直.
2. 轴次定理: 晶体中的对称轴(旋转轴、反轴、螺旋轴) 的轴次只有1、2、3、4、6.
34
晶
(1)晶胞的大小、形式
胞 两
晶胞的大小和形式可由晶胞参数确定.
要
(2)晶胞的内容
素
晶胞中原子的种类和位置. 表示原子位置要用
分数坐标.
晶胞参数: a、b、c α、β、γ
35
分数坐标
晶胞中原子P 的位置用向量OP=xa+yb+zc代表. x、y、z
就是分数坐标,它们永远不会大于1.
36
立方面心晶胞净含4个原子,所以写出4组坐标即可:
第六章 晶体结构
Chapter 6. Crystal Stucture
1
6.1 晶体的性质与结构特征
人类对晶体的最初认识也许是从采集石器时发现外形 规则或光彩夺目的天然矿物开始的. 世界各地的考古发掘 表明,人类使用玉类宝石至少已有七千年的历史.我国西 汉时期刘胜夫妇墓葬中的两套金缕玉衣就用了4600多玉片. 唐宋诗词中更是屡屡出现“云母屏风烛影深”之类的佳句.
垂直于石墨层观察(蓝、黄球均为C). 注意第1、3
石 层(蓝)对正而与第2层(黄)错开. 沿紫色菱形框, 墨 垂直于石墨层,从第1层切到第3层,就得到一个晶胞:
24
石墨的结构基元与点阵点
晶胞净含4个C原子(8×1/8+4 × 1/4+2 × 1/2+1=4), 每4个C组成1 个结构基元,每个晶胞含一个结构基元. 抽象成点阵后,一个格子净含 1个点阵点, 为六方简单格子:
所有顶点原子: 0,0,0 (前)后面心原子: 0,1/2,1/2 左(右)面心原子: 1/2,0,1/2 (上)下面心原子: 1/2,1/2,0
37
下面一些晶胞作为观察和练习晶胞两要素的材料(以下各图 中A与B代表两种异号离子,而不必特指具体的元素) :
NaCl型晶体
原子的分数坐标: A: 0 0 0
49
14种布拉维格子之四: 四方简单(tP)
50
14种布拉维格子之五: 四方体心(tI)
51
14种布拉维格子之六:六方简单(hP)
黑色与灰白色点 都是点阵点.黑点 与蓝线表示一个
正当格子
52
14种布拉维格子之七:三方晶系的六方R 心(hR)
53
三方晶系的六方简单 (hP)
六方简单 (hP)格子已用于六方晶系, 现在又可用于三方晶系, 所以只算一种格子.
12
晶 体 有 确 定 的 熔 点
13
晶体的周期性结构使它成为天然的三维光栅,
晶
周期与X光波长相当, 能够对X光产生衍射:
体
的
X
射
线
衍
射
效
应
14
晶态结构示意图
按周期性规律重复排列
15
非 晶 态 结 构 示 意 图
16
6.2 晶体的周期性结构与点阵
6.2.1 结构基元与点阵
晶体的周期性结构使得人们可以把 它抽象成“点阵”来研究.将晶体中重 复出现的最小单元作为结构基元(各个 结构基元相互之间必须是化学组成相 同、空间结构相同、排列取向相同、 周围环境相同),用一个数学上的点来 代表,称为点阵点.整个晶体就被抽象 成一组点,称为点阵.
从晶体的数量来看, 大约80%的无机结构和60%的有机 结构具有对称中心.
从晶体学点群来看,32种点群中, 含对称中心的点群有 11种, 而非中心对称点群有21种. 非中心对称点群与对映体 、旋光性、热电效应、铁电效应、压电效应、倍频效应等物 理性质的联系可用下图表示(圈内表示该点群晶体中可能观 察到的某种性质, 圈外表示该点群晶体中不可能观察到的某 种性质).
0 1/2 1/2 1/2 0 1/2 1/2 1/2 0 B: 1/2 0 0 0 1/2 0 0 0 1/2 1/2 1/2 1/2 结构基元: A-B (每个晶胞中有4个结构基元)
38
CsCl型晶体
原子的分数坐标: A: 0 0 0 B: 1/2 1/2 1/2
结构基元: A-B
(每个晶胞中有1个结构基元)
这一貌似简单的问题过了200年才由法国结晶
学家布拉维解决.
天 上 飘 落 的 晶 体
3
晶体的特征
晶体内部各部分的宏观性质相同,称为 晶体性质的均匀性. 非晶体也有均匀性, 尽管起因与晶体不同.
晶体特有的性质是异向性、自范性、对 称性、确定的熔点、X光衍射效应:
4
晶体的均匀性
晶
体
的
云 母
图 中 红 、 蓝 球 均 为 C 原 子
8
9
晶体在理想生长环境中能自发地形成规则的
晶
凸多面体外形,满足欧拉定理:
体
的
F(晶面数)+V(顶点数)=E(晶棱数)+ 2
自
范
性
10
晶
晶体的理想外形具有特定的对称性,这是内部
体
结构对称性的反映.
的
对
称
性
黄铁矿(Pyrite)
11
石英(Quartz) 金刚石(Diamond)
21
三维周期性结构与空间点阵
下列晶体结构如何抽象成点阵?
Mn
(立方简单)
Li Na K Cr Mo W…...
(立方体心)
以上每一个原子都是一个结构基元,都可以抽象成一个点阵点.
22
NaCl型晶体中,按统一的方式将每一对离子A-B抽象 为一个点阵点. 于是,点阵成为立方面心.
NaCl型晶体结构
NaCl型晶体的点阵—立方面心 23
31
(2)为什么NaCl型晶胞要抽象成立方面心格子(左)而不抽 象成三方R格子(右图红线所示)?尽管后者是一个素格子.
32
6.2.3 晶体结构的代数表示——平移群
33
6.2.4 晶胞
设想把点阵放回晶体中去, 将把晶体切分成并置的平行六面 体小晶块,每个空间格子对应一 个小晶块. 这种小晶块就是晶胞, 是代表晶体结构的最小单元.
42
滑移面有几种类 型. 其中, a滑移面的 基本操作是对于该 面(假象镜面)反映后, 再沿平行于此面的x 轴方向平移ta/2. ta是 x轴方向的平移周期 a. 有时将平移直接 写成a/2.
注意:反映滑移操作中的“反映”是虚操作.
43
44
6.3.4 七大晶系
45
6.3.5 空间点阵型式——14种布拉维格子
17
按连接其中任意两点的向量将所有
点
的点平移而能复原的一组无限多个点.
阵
的
数
学
定
义
18
结构基元与点阵点
19
一维周期性结构与直线点阵
20
Cu (111面)密置层(每个原子就是一个结构基元,对应一个点阵点):
二 维 周 期 性 结 构 Cu (111面)的点阵. 红线画出的是一个平面正当格子: 与 平 面 点 阵
异
片
向
性
产地:甘肃省肃北县
玻 蜡滴 璃
片
云母薄片上的热导率有异向性
6
蓝晶石两个方向上的硬度差异显著,有“二硬石”之称; 古代的宝石工匠早就知道钻石的八面体面(111)特别难以 抛光……
1669年巴尔托林发现了光束通过冰洲石的双折射现象:
7
石墨在平行于层的方向上电导率高且为半金属性导电; 垂直于层的方向上电导率低且为半导体性导电.
阵
与
正
当
平
面
净含一个点阵点的平面格子是素格子,多于一个
格
子
点阵点者是复格子;平面素格子、复格子的取法都有
无限多种. 所以需要规定一种 “正当平面格子”标准.
28
正当平面格子的标准
1. 平行四边形 2. 对称性尽可能高 3. 含点阵点尽可能少 平面格子净含点阵点数:顶点为1/4;棱心为1/2;格内 为1. 正当平面格子有4种形状,5种型式(其中矩形有带心 与不带心两种型式):
尽管三方晶系的两种格子------六方简单(hP)和六方R 心(hR)------形状都与六方
晶系的六方简单 (hP)格子相同(即hR是两个晶系共用的), 但真实的三方晶体中只
有三次对称轴而没有六次对称轴, 六方晶体才有六次对称轴.
54
14种布拉维格子之八:正交简单(oP)
55
14种布拉维格子之九:正交体心(oI)
石墨晶体
红绿点都是C. 点阵 点放在绿点处是一 种方便的作法.
一个素晶胞
25
石墨的素晶胞与素格子
右:素格子
26
6.2.2 点阵单位(格子)
晶体可以抽象成点阵,点阵是无限的. 只要从点阵中取 一个点阵单位即格子,就能认识这种点阵.
如何从点阵中取出一个点阵单位呢?
直线点阵与素向量、复向量
27
平
面
点
40
6.3.2 晶体的宏观对称元素
晶体的理想外形及其在宏观观察中表现出来的对称性称 为晶体的宏观对称性.
41
6.3.3 晶体的微观对称元素
微观对称元素: (1)平移操作对应的点阵. (2)螺旋旋转操作对应的螺旋轴. (3)反映滑移操作对应的滑移面. 旋转2π/n再沿轴向平移m(t/n),
叫作螺旋旋转操作, 相应的微观对称 元素是螺旋轴nm . 其中, t是平移周期, n=2、3、4、6, m是小于n的(正)整 数.
39
6.3 晶体结构的对称性
6.3.1 晶体对称性的两个定理
1. 晶体中的对称轴(旋转轴、反轴、螺旋轴)必与一组 直线点阵平行, 除一重轴外, 对称轴必与一组平面点阵垂直; 晶体中的对称面(镜面、滑移面)必与一组平面点阵平行, 而 与一组直线点阵垂直.
2. 轴次定理: 晶体中的对称轴(旋转轴、反轴、螺旋轴) 的轴次只有1、2、3、4、6.
34
晶
(1)晶胞的大小、形式
胞 两
晶胞的大小和形式可由晶胞参数确定.
要
(2)晶胞的内容
素
晶胞中原子的种类和位置. 表示原子位置要用
分数坐标.
晶胞参数: a、b、c α、β、γ
35
分数坐标
晶胞中原子P 的位置用向量OP=xa+yb+zc代表. x、y、z
就是分数坐标,它们永远不会大于1.
36
立方面心晶胞净含4个原子,所以写出4组坐标即可:
第六章 晶体结构
Chapter 6. Crystal Stucture
1
6.1 晶体的性质与结构特征
人类对晶体的最初认识也许是从采集石器时发现外形 规则或光彩夺目的天然矿物开始的. 世界各地的考古发掘 表明,人类使用玉类宝石至少已有七千年的历史.我国西 汉时期刘胜夫妇墓葬中的两套金缕玉衣就用了4600多玉片. 唐宋诗词中更是屡屡出现“云母屏风烛影深”之类的佳句.
垂直于石墨层观察(蓝、黄球均为C). 注意第1、3
石 层(蓝)对正而与第2层(黄)错开. 沿紫色菱形框, 墨 垂直于石墨层,从第1层切到第3层,就得到一个晶胞:
24
石墨的结构基元与点阵点
晶胞净含4个C原子(8×1/8+4 × 1/4+2 × 1/2+1=4), 每4个C组成1 个结构基元,每个晶胞含一个结构基元. 抽象成点阵后,一个格子净含 1个点阵点, 为六方简单格子:
所有顶点原子: 0,0,0 (前)后面心原子: 0,1/2,1/2 左(右)面心原子: 1/2,0,1/2 (上)下面心原子: 1/2,1/2,0
37
下面一些晶胞作为观察和练习晶胞两要素的材料(以下各图 中A与B代表两种异号离子,而不必特指具体的元素) :
NaCl型晶体
原子的分数坐标: A: 0 0 0
49
14种布拉维格子之四: 四方简单(tP)
50
14种布拉维格子之五: 四方体心(tI)
51
14种布拉维格子之六:六方简单(hP)
黑色与灰白色点 都是点阵点.黑点 与蓝线表示一个
正当格子
52
14种布拉维格子之七:三方晶系的六方R 心(hR)
53
三方晶系的六方简单 (hP)
六方简单 (hP)格子已用于六方晶系, 现在又可用于三方晶系, 所以只算一种格子.
12
晶 体 有 确 定 的 熔 点
13
晶体的周期性结构使它成为天然的三维光栅,
晶
周期与X光波长相当, 能够对X光产生衍射:
体
的
X
射
线
衍
射
效
应
14
晶态结构示意图
按周期性规律重复排列
15
非 晶 态 结 构 示 意 图
16
6.2 晶体的周期性结构与点阵
6.2.1 结构基元与点阵
晶体的周期性结构使得人们可以把 它抽象成“点阵”来研究.将晶体中重 复出现的最小单元作为结构基元(各个 结构基元相互之间必须是化学组成相 同、空间结构相同、排列取向相同、 周围环境相同),用一个数学上的点来 代表,称为点阵点.整个晶体就被抽象 成一组点,称为点阵.
从晶体的数量来看, 大约80%的无机结构和60%的有机 结构具有对称中心.
从晶体学点群来看,32种点群中, 含对称中心的点群有 11种, 而非中心对称点群有21种. 非中心对称点群与对映体 、旋光性、热电效应、铁电效应、压电效应、倍频效应等物 理性质的联系可用下图表示(圈内表示该点群晶体中可能观 察到的某种性质, 圈外表示该点群晶体中不可能观察到的某 种性质).
0 1/2 1/2 1/2 0 1/2 1/2 1/2 0 B: 1/2 0 0 0 1/2 0 0 0 1/2 1/2 1/2 1/2 结构基元: A-B (每个晶胞中有4个结构基元)
38
CsCl型晶体
原子的分数坐标: A: 0 0 0 B: 1/2 1/2 1/2
结构基元: A-B
(每个晶胞中有1个结构基元)
这一貌似简单的问题过了200年才由法国结晶
学家布拉维解决.
天 上 飘 落 的 晶 体
3
晶体的特征
晶体内部各部分的宏观性质相同,称为 晶体性质的均匀性. 非晶体也有均匀性, 尽管起因与晶体不同.
晶体特有的性质是异向性、自范性、对 称性、确定的熔点、X光衍射效应:
4
晶体的均匀性
晶
体
的
云 母
图 中 红 、 蓝 球 均 为 C 原 子
8
9
晶体在理想生长环境中能自发地形成规则的
晶
凸多面体外形,满足欧拉定理:
体
的
F(晶面数)+V(顶点数)=E(晶棱数)+ 2
自
范
性
10
晶
晶体的理想外形具有特定的对称性,这是内部
体
结构对称性的反映.
的
对
称
性
黄铁矿(Pyrite)
11
石英(Quartz) 金刚石(Diamond)
21
三维周期性结构与空间点阵
下列晶体结构如何抽象成点阵?
Mn
(立方简单)
Li Na K Cr Mo W…...
(立方体心)
以上每一个原子都是一个结构基元,都可以抽象成一个点阵点.
22
NaCl型晶体中,按统一的方式将每一对离子A-B抽象 为一个点阵点. 于是,点阵成为立方面心.
NaCl型晶体结构
NaCl型晶体的点阵—立方面心 23
