GAMP5及计算机化系统验证相关知识
基于GAMP5的我国制药企业计算机化系统验证的应用研究

基于GAMP5的我国制药企业计算机化系统验证的应用研究我国2010版GMP第十四章附则第19条对计算机化系统的定义:用于报告或自动控制的集成系统,包括数据输入、电子处理和信息输出。
国际上对计算机化系统的定义绝大多数是引用了PIC/S检察指南PI011-3中的定义:计算机化系统是由计算机系统和被其控制的功能或流程组成。
从以上定义中可以看出,计算机化系统不仅仅包括计算机系统本身,还包括受控的功能和过程,甚至包括系统的运行环境。
图1为计算机化系统关系图。
计算机系统是一个媒介,连接着人员与设备,有资质的且经过培训的人员可以根据计算机系统得到相关设备或工艺的实时监控信息,从而根据操作规程对计算机系统进行操作,控制具体的工艺或设备,实现最终管理。
一、计算机化系统概述计算机化系统的组成在计算机化系统的所有组成部分中,计算机系统的硬件和软件是最重要的组成部分。
其中,把计算机系统软硬件分为标准化软硬件和定制类软硬件两类。
GAMP5中又将硬件分成两类,将软件分成四类,如图2所示。
硬件分为标准硬件与定制硬件。
目前,大部分公司所使用的硬件都属于标准硬件。
硬件具体说明如表1所示。
软件分为四种类别,这四种类别的分类是指导性的,其间并没有严格的分界线。
软件具体分类说明如表2所示。
制药企业计算机化系统的类型狭义的计算机化系统指的是自动化控制系统,但是除了自动化控制系统之外,广义的计算机化系统包括了整个自动化和信息化的系统,它涵盖了一切计算机设施,从简单的I/O设施、PLC可编程逻辑控制器到综合的计算机管理信息系统等,都属于计算机化系统。
据此,制药企业常用的计算机化系统的主要类型如图3所示。
制药企业计算机化系统验证制药企业计算机化系统验证是GMP管理的一个重要组成部分,根据GMP 的要求,制药企业计算机化系统验证是通过建立文件来证明计算机化系统能够提供满足用户需求的功能,并且能够稳定工作,包括应用程序的验证(软件方面的验证)和基础架构的确认(硬件方面的确认)。
个人整理-GAMP5-在仪器上的分类

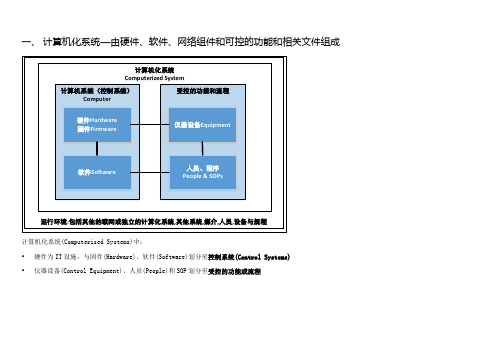
一、计算机化系统—由硬件、软件、网络组件和可控的功能和相关文件组成计算机化系统Computerized System计算机系统(控制系统)Computer受控的功能和流程硬件Hardware 固件Firmware软件Software 仪器设备Equipment人员、程序People & SOPs运行环境:包括其他的联网或独立的计算化系统,其他系统,媒介,人员,设备与规程计算机化系统(Computerised Systems)中:•硬件为IT设施,与固件(Hardware)、软件(Software)划分至控制系统(Control Systems)•仪器设备(Control Equipment)、人员(People)和SOP划分至受控的功能或流程二、GAMP5计算机系统硬件分类三、GAMP5计算机系统软件分类四、使用系统在整个生命周期实现合规与符合预定用途的通用方法1、计算机化系统生命周期●概念提出●项目实施●系统运行●系统退役2、规范和验证规范活动有对应的验证步骤以确认是否满足了所有的规范要求。
对于大型的系统可能需要多层级的规范文件,而小型的、简单的或低风险的系统则只需把几个规范结合起来限可。
应该通过合适的验证步骤对规范进行确认。
使用系统在整个生命周期实现合规与符合预定用途的通用方法五、USP 1058对实验仪器的分类六、GAMP5 在实验仪器里的应用及验证要求1软件不能进行配置:是指软件模块可根据需求进行配置,并不是指对仪器进行配置。
注意:有关计算机化系统确认术语的使用,特别是运行和性能确认之间的关系,在不同公司之间是不相同。
以上的比较仅仅提供一个一般的解释,而并不是强制性的。
八、 类别3:不可配置软件的方法规范基本职责供应商质量管理体系简称:QMS典型的测试包括: ● 正确的安装● 表明系统符合预定用途并按照规定的要求进行系统验收 ● 根据供应商评估和风险评估结果决定进一步测试通常由被监管公司负责必须的规范和核实活动。
GAMP5:计算机化系统质量风险管理验证计划

质量风险管理是计算机化系统生命周期管理方式的一部分;以下评估流程主要是针对新的计算机化系统,重点是软件产品和定制的应用程序而非系统的基础设施;1、概述质量风险管理是对风险进行评估、控制、沟通与审查的系统化过程。
他是一个重复的流程,贯穿于从概念形成到系统引退的整个计算机化系统的整个生命周期;公司应该制定质量风险管理体系,并作为全面质量管理的有机组成部分,确保风险管理决策得到有效执行;2、基于科学的质量风险管理确定由计算机化系统所带来的风险,应基于一下内容的理解:计算机化系统对患者安全、产品质量与数据完整性的影响所支持的业务流程监控或控制关键工艺参数的系统关键质量属性用户需求法规要求项目方法(合同、方法、时间安排)系统组件与结构系统功能供应商能力其他可能的风险,比如安全、健康与环境2.1降低风险的方法通过设计消除风险(尽可能做到改变流程和设计来消除风险);将风险降低到可以接受的水平(无法通过设计的,才考虑通过控制或人工规程将其减低到可以接受的程度,可以降低风险的方法包括降低风险的严重性、减小风险发生的概率,以及提高对风险的可检测性);验证以证明该风险以被管理到可以接受的水平;制定一整套系统化的验证方案来验证与系统相关的风险被控制在一个可以接受的水平;验证的广度和深度与系统对患者安全、产品质量与数据完整所带来的风险来确定,同时还要考虑系统的复杂性与新颖性。
3、质量风险管理流程3.1质量风险管理的基本原则质量风险评估应基于科学知识进行,最终以患者安全为目标;质量风险管理流程投入的精力、程度、文件化的深度应与风险的级别相一致;3.2项目阶段阶段风险管理的流程步骤1.实施最初的分享评估并确定系统的影响系统是否受GXP监管相关是否需要实施后续的流程;确定后续投入的水平,正式水平及文件化深度;识别电子签名和电子记录步骤2.识别系统对患者安全、产品质量与数据完整性有影响的功能根据收集的信息,相关规范,系统组成,系统组件分类识别系统对患者安全、产品质量与数据完整性有影响的功能。
GAMP5及计算机化系统验证相关知识课件

软件
硬件 固件
操作规程与人 员
设备
控制系统
受控的功能与流程
计算机化系统
Industry Regulators行业监管机构
- Regulate to ensure safety of drugs that any of us might take!
PART 820 QUALITY SYSTEM REGULATION
质量系统规则第820部分
EMEA
• Validation: The extent of validation necessary will depend on a number of factors including the use to which the system is to be put, whether the validation is to be prospective or retrospective and whether or not novel elements are incorporated. Validation should be considered as part of the complete life cycle of a computer system. This cycle includes the stages of planning, specification, programming, testing, commissioning, documentation, operation, monitoring and modifying. 验证:验证的范围基于一组包含应用于系统的因素,无论验证是预见 性的还是回顾性的,无论有无新元素的使用。验证应该被认为是计算 机系统完整生命周期的部分。这个周期包括设计,规范,编程,测 试,调试,文档,运行,监控和修改。
GAMP5的基本概念和内容

●生命周期方法也有利推动质量源于设计(QbD)方法的推广。 (▲从产品原始设计、研发开始)
●生命周期方法是可以分划为不同的阶段和活动的。 (▲不同阶段,内容要求和不同)
(3)可增减的生命周期活动的概念。 生命周期活动内容可以根据以下三个因素增加或减少:
●系统对患者安全、产品质量和数据完整性三大要素影响的风险性。 ●系统和过程的复杂性和新颖性 ●供应商的能力 (▲从 3“性”分析和供应商方面的保障情况,决定灵活性程度)
(8)质量管理系统 QMS 内的持续改进。 (▲持续性)
(9)注重关键质量属性(CQA) (▲质量重点关键因素)
(10)注重提高 GXP 合规性的效率 (▲效率, 避免重复性工作)
(11) 注重现有文件和知识的利用 (效率,避免重复性工作,)
(12)注重可配置系统与开发模式 (▲考虑到目前大多计算机化系统是基于可配置软件包,重点在第 4 类软
●质量风险管理主要针对可能对患者安全、产品质量和数据完整性密切 有影响的关键质量属性、关键过程参数进行识别、监控和追溯,至少确保使这些 风险最终能被降低到可接受的范围。
(▲风险管理主要是根据对与患者安全、产品质量和数据完整性关系密
切的关键质量属性、关键过程参数的影响。最低目标是使风险可降低到可接受的 范围。)
另外,应该注意的是,虽然在 GAMP 中也提供一些通常性方法上的参考, 但是面对各种类型的计算机化系统,实际是上还是需要我们认真研究和了解被 验证对象及其应用过程以后,才有可能形成真正合理的可操作的验证方案。所 以如何真正理解 GAMP 的概念,根据不同的计算机化系统的特点和要求,分门 别类建立真正科学、合理和可操作的验证模式,将是一个意义重大的课题。只 有这个问题解决好了,所谓的计算机化系统验证才有可能在我国制药行业合理 地普遍展开。
个人整理_GAMP5 在仪器上的分类
一、计算机化系统—由硬件、软件、网络组件和可控的功能和相关文件组成计算机化系统Computerized System计算机系统(控制系统)Computer受控的功能和流程硬件Hardware 固件Firmware软件Software 仪器设备Equipment人员、程序People & SOPs运行环境:包括其他的联网或独立的计算化系统,其他系统,媒介,人员,设备与规程计算机化系统(Computerised Systems)中:•硬件为IT设施,与固件(Hardware)、软件(Software)划分至控制系统(Control Systems)•仪器设备(Control Equipment)、人员(People)和SOP划分至受控的功能或流程四、使用系统在整个生命周期实现合规与符合预定用途的通用方法1、计算机化系统生命周期●概念提出●项目实施●系统运行●系统退役2、规范和验证规范活动有对应的验证步骤以确认是否满足了所有的规范要求。
对于大型的系统可能需要多层级的规范文件,而小型的、简单的或低风险的系统则只需把几个规范结合起来限可。
应该通过合适的验证步骤对规范进行确认。
使用系统在整个生命周期实现合规与符合预定用途的通用方法五、USP 1058对实验仪器的分类六、GAMP5 在实验仪器里的应用及验证要求1软件不能进行配置:是指软件模块可根据需求进行配置,并不是指对仪器进行配置。
七、传统的确认语与GAMP5活动之间的关系注意:有关计算机化系统确认术语的使用,特别是运行和性能确认之间的关系,在不同公司之间是不相同。
以上的比较仅仅提供一个一般的解释,而并不是强制性的。
八、类别3:不可配置软件的方法典型的测试包括:●正确的安装●表明系统符合预定用途并按照规定的要求进行系统验收●根据供应商评估和风险评估结果决定进一步测试通常由被监管公司负责必须的规范和核实活动。
尽管对于业务流程而言系统是不可配置的,但系统可能还是有些有限的内容如运行时间参数或打印机设置是可以配置的。
计算机化系统验证-风险评估

计算机化系统验证—风险评估今天我们继续聊聊当下不热门的几个话题之一——计算机化系统验证。
(当下比较热门的几个话题:质量量度、计算机化系统、数据完整性、一致性评价及药包材关联审评制)背景上次我们推送了两个与数据完整性及计算机化系统相关的两个话题:“如何开启Excel审计追功能”与“如何启动Excel安全模式”,想看这两篇文章的朋友请关注我们后转到历史消息中进行阅读。
这两篇文章均提及到了计算机化系统的类别及验证,但没有告我们如何进行管理及验证,那么今天我们就跟大家分享如何进行计算机化系统的验证,下面正式开始我们今天的话题。
CFDA与2015年发布了《国家食品药品监督管理总局关于发布《药品生产质量管理规范(2010年修订)》计算机化系统和确认与验证两个附录的公告(2015年第54号)》((这个目前几年不管是FDA还是欧盟基本上都是先严查实验室,对于生产类的大家好像都共识一样可能有2年的过渡期)并告知于12月1日开始实施,随后大家就开始了关于如何让计算机化系统合规的工作,开始进行差距分析、流程改进、软件升级、验证等一系列的工作。
现在为什么开始重视计算机化系统了呢:首先我们认为主要是因为现在科技手段的不断进步,工厂里的生产自动化程度越来越高(人工成本高及人为差错、污染的风险高),为了让制品在通过自动化生产过程中的可控及可追溯性,要先从法规的角度进行管理,这样就来了这个神奇的东西;其次国家工业4.0的升级,自动化的普及迫使我们要保证在这个智能的生产环境中能够持续稳定的生产出符合要求的产品;最后就是我们要融入国际轨道,像欧美等国家很早以前就已经开始了计算机化系统的管理。
关于这里的差距分析、流程改进软件升级一类的今天这里不涉及,我们会在以后的推送中进行细说,这里只介绍计算机化系统的验证,我们该如何对一个计算机化系统进行验证?在说这个话题之前,我们还是赘述以下什么是计算机化系统,下面我来一个比对:计算机系统计算机化系统自动化系统名词Computer Systems Computerised Systems Automation Systems定义由硬件、系统软件、应用软件指受控系统、计算机控制系统指在没有人直接参与的情况以及相关外围设备组成的,可执行某一功能或一组功能的系统以及人机接口的组合体系下,利用外加的设备或装置,使机器、设备或生产过程的某个工作状态或参数自动地按照预定的规律运行的软件通过以上表格的对比你是不是已经知道这几个系统的区别?千万不要把计算机系统和计算机化系统弄混淆,虽只是一字之差,但完全不一样的东东。
计算机化系统验证 确认步骤

自从计算机系统的附录出来以后,对于如何实施计算机系统验证,现有计算机系统如何管理?如何才能判定现有的计算机系统是否能够满足现行法规的要求,都是大家的困惑,这里就来教教大家评估现有计算机系统的七个步骤,供大家参考。
第一步:判定计算机系统是否和GMP、GLP、GSP相关。
这个大家容易理解,因为附录是针对GMP要求的,只有和GMP相关的系统,我们才考虑计算机系统是否需要符合法规要求,其他的,例如:单纯的办公电脑,是不需要在这个里面考虑的。
第二步:根据GAMP5的分类,判定计算机系统的类别。
在GAMP中,第一类:操作系统或网络软件。
如:UNIX或Windows系统。
此类软件一般不需要进行验证。
第二类:由非用户可编程的固件控制的标准仪器、微控制器或智能仪器。
如:分析天平、条形码扫描器等。
此类软件不需要单独验证,只需要在设备确认中,确认设备的控制系统的硬件配置和软件版本号,并确认设备的运行即可。
第三类:标准软件包,也称COTS包。
如:HPLC的操作控制软件。
此类软件不需要对软件本身进行验证,只需要对软件的硬件配置及运行功能进行验证即可。
第四类:可配置的软件包及订制系统。
如:LIMS或ERP系统。
这类需要进行完全意义上的计算机系统的验证。
所以,分类的不同,决定你的验证策略不同。
第三步:判定你的计算机系统,是属于计算机系统,还是计算机化的系统,也就是是独立的系统,还是属于集成于PLC的系统。
第四步:根据以上的判断,确定是否系统是否需要做计算机系统验证。
如果需要而没有做,你就需要考虑补充了。
第五步:如果需要做计算机系统验证的,就需要按照计算机系统验证的要求,看看以前的验证方案中,是否具备计算机系统验证的内容,如果没有,你可能就需要重新补充了。
那么计算机系统验证需要做哪些内容呢?参考APIC的计算机系统验证要求,计算机系统的IQ应该包括软件的硬件配置、硬件的安装环境、软件的版本号、软件安装路径、软件文书资料等,计算机系统的OQ应该包括软件安全性验证、软件备份和恢复、灾难恢复、功能测试、审计追踪、业务连续性等,如果没有,就需要进行补充验证。
采用GMAP5方法的计算机化系统验证的生命周期文件及活动(课件)

16/80
8
2014/6/24
计算机化系统验证常见术语2
名称 可追溯矩阵 验证总结报告 国际制药工程协会 良好自动化生产实践指南 质量管理系统 可编程逻辑控制器 集散控制系统 数据采集与监视系统 企业资源计划 实验室信息管理系统 生产执行系统 楼宇管理系统 环境监视系统 计算机系统验证 不间断电源
系统是否控制不良事件或投诉的记录或报告?
系统是否支持药物安全监视?
关键系统做验证,非关键系统GEP调试即可
缩写 VMP QPP URS FS HDS SDS SMS DQ SCR SMT FAT SAT IQ OQ PQ
英文 Validation Master Plan Quality and Project Plan User Requirement Specification Function Specification Hardware Design Specification Software Design Specification Software Module Specification Design Qualification Source Code Review Software Module Test Factory Acceptance Test Site Acceptance Test Installation Qualification Operation Qualification Performance Qualification
Critical Process Parameter 关键工艺参数
Critical Quality Attribute 关键质量属性
Electronic Record; Electronic Signature 电子记录与电子签名
GAMP 的基本概念和内容

四.GAMP5的基本概念和内容:国际药物工程协会(ISPE)从确保计算机化系统既能满足预定用途又能符合GxP法规要求出发,组织专家编写一套的简称为GAMP的方法性指南文件, 该指南从1995年第一版开始到2008年,已经更新出版了5版。
由ISPE所制订的GAMP和GMP不一样,它不属于强制性的规范和标准,而是一个理论和实践方法上的指南。
因为它不属于规范,ISPE也不属于认证机构,所以在GAMP中也声明:任何宣称“已通过GAMP认证”或”“已获得GAMP 批准”是不合适的。
但GAMP5所提出许多理论和概念还是非常科学和有道理的,所以虽然它不属于法规,但却是目前国际制药行业进行计算机化系统验证方法的主要参考依据, 同时也是医药自动化最重要的合规性指南。
所以目前大部分从事计算机化系统验证的系统供应商或验证咨询公司,实际上也是根据他们自己对GAMP的理解所建立的所谓验证模板进行的,只不过其中应该讲有的是合理的,而有的则未必合理。
另外,应该注意的是,虽然在GAMP中也提供一些通常性方法上的参考,但是面对各种类型的计算机化系统,实际是上还是需要我们认真研究和了解被验证对象及其应用过程以后,才有可能形成真正合理的可操作的验证方案。
所以如何真正理解GAMP的概念,根据不同的计算机化系统的特点和要求,分门别类建立真正科学、合理和可操作的验证模式,将是一个意义重大的课题。
只有这个问题解决好了,所谓的计算机化系统验证才有可能在我国制药行业合理地普遍展开。
GAMP 是“Good Automation Manufactory Practice”(良好自动化生产实践指南)的英文缩写。
GAMP第四版的副题为“Guide for Validation of Automated System”,所以又称《自动化系统验证指南》或称GAMP4;GAMP的第五版题目则改为“A Risk-Base Approach Compliant GXP Computerized Systems”(遵从GXP计算机化系统监管的风险管理方法);又称GAMP5。
个人整理-GAMP5-在仪器上的分类资料

个人整理-G A M P5-在仪器上的分类一、计算机化系统—由硬件、软件、网络组件和可控的功能和相关文件组成计算机化系统Computerized System计算机系统(控制系统)Computer受控的功能和流程硬件Hardware 固件Firmware软件Software 仪器设备Equipment人员、程序People & SOPs运行环境:包括其他的联网或独立的计算化系统,其他系统,媒介,人员,设备与规程计算机化系统(Computerised Systems)中:•硬件为IT设施,与固件(Hardware)、软件(Software)划分至控制系统(Control Systems)•仪器设备(Control Equipment)、人员(People)和SOP划分至受控的功能或流程四、使用系统在整个生命周期实现合规与符合预定用途的通用方法1、计算机化系统生命周期●概念提出●项目实施●系统运行●系统退役2、规范和验证规范活动有对应的验证步骤以确认是否满足了所有的规范要求。
对于大型的系统可能需要多层级的规范文件,而小型的、简单的或低风险的系统则只需把几个规范结合起来限可。
应该通过合适的验证步骤对规范进行确认。
使用系统在整个生命周期实现合规与符合预定用途的通用方法五、USP 1058对实验仪器的分类六、GAMP5 在实验仪器里的应用及验证要求七、传统的确认语与GAMP5活动之间的关系1软件不能进行配置:是指软件模块可根据需求进行配置,并不是指对仪器进行配置。
注意:有关计算机化系统确认术语的使用,特别是运行和性能确认之间的关系,在不同公司之间是不相同。
以上的比较仅仅提供一个一般的解释,而并不是强制性的。
八、 类别3:不可配置软件的方法规范基本职责供应商质量管理体系简称:QMS典型的测试包括:● 正确的安装● 表明系统符合预定用途并按照规定的要求进行系统验收● 根据供应商评估和风险评估结果决定进一步测试 通常由被监管公司负责必须的规范和核实活动。
GAMP5可缩放验证模型

GAMP5可缩放验证模型前面不止一次提到对计算机化系统进行分类管理,今天具体来说说GAMP5的分类方法。
今天的文章就不打原创标签了,大多数的内容参考的是GMP指南质量管理体系部分的内容,黄色字体是进一步的解读。
GAMP5分类对计算机化系统分类的依据是系统的风险性,复杂性和创新性,GAMP5的分类既包括软件也包括硬件。
特别要强调硬件的分类,因为一般情况下,软件分类平常说得比较多,1、3、4和5四大类,硬件分类平常较少看到,分为1和2两类。
1类软件为基础软件,又可以分为两个子类。
一类为已建立的商业软件,比如操作系统,数据库管理软件,编程语言,电子表格软件包(但不包括基于这些工具开发而成的其他应用程序)等;另一类为基础软件工具,比如网络监测软件,批处理作业计划工具,安全软件,防病毒软件,配置管理工具等。
1类基础软件的一个重要特点就是本身并不能实现业务功能,其类似于计算机系统里的基础架构层,所有的应用是在这些软件基础上运行的或者是通过1类基础软件通过编程实现的。
2类软件目前GAMP5中已经不提了,这是之前GAMP版本中的叫法。
3类软件是不可配置的软件,主要是指业务中使用的非定制的商业产品。
其中既包括不可配置的系统(尽管运行参数可被配置)又包括虽可配置但只使用默认配置的系统。
3类通常可以认为是供应商提供的标准软件或者在标准软件的基础上可以进行有限配置的软件,3类软件通常功能比较单一,常见的例子是实验室的总有机碳分析仪或者原子吸收光谱仪,都是现成的软件,可以实现一定程度的配置(比如配置用户权限等级,配置密码强度和更换周期等)。
4类软件是需配置的软件,可配置的软件产品提供配置用户特定业务流程的标准界面和功能,其中包括配置预先设计的软件,例如企业资源计划系统(ERP)、实验室信息系统(LIMS)。
4类的软件配置灵活度更高一些,适用于更加复杂的业务流程,这类软件类似于搭积木,软件开发时已经将各个功能模板搭建好了,需要后期根据业务流程的需要进行组合,这个配置与组合通常是供应商完成的,不会开放给日常的用户甚至是企业的IT部门。
GAMP5遵从GxP计算机化系统监管的风险管理方法

GAMP5遵从GxP计算机化系统监管的风险管理方法ISPE GAMP5 良好自动化生产实践指南——遵从GxP计算机化系统监管的风险管理方法背景指南文件结构解读?软硬件类别生命周期方法质量风险管理被监管公司的活动?供应商评估GAMP5质量管理体系QMS内的生命周期方法达到与维护GxP合规的有效管理注重患者安全、产品质量与数据完整性基于科学的风险质量管理方法质量源于涉及QbD现有文件与知识的利用可配置系统与开发模式提高GxP的合规效率关键质量数据CQAQMS内的持续改进可增减的GxP合规方法有效的供应商关系GAMP 的推动力新增与修订内容(GAMP5 VS GAMP4)完整的系统的生命周期(从概念阶段开始直到系统退役)方法是QMS的一部分基于系统的新颖性、复杂性以及系统在患者安全、产品质量和数据完整性等方面所面临的风险,采用灵活的方法来实现和维护系统的合规性明确QM的角色,介绍流程所有者,系统所有者以及主题专家(SMEs)的角色在GMP环境中,强调明确需求的重要性,将有助于采用QbD的方法。
需求的明确应基于对药品,及其开发和生产过程的关键质量属性(CQAs)的充分了解充分利用供应商文件与知识,尽可能地避免不必要的重复通过对GAMP指南更加实用和有效地诠释来提高效率最大限度地利用诸如开发和调试等活动所产生的文件,并将其作为验证的证据强调有效管理对实现和保持合规性的重要性通过定期的审查、RCA及CAPA来寻求改进流程和系统的机会宗旨提供一种经济的良好的实践框架,以此确保计算机化系统负荷预期用途并遵从适合的法规要求?目标是保证患者安全、产品质量以及数据完整性保证患者安全、产品质量以及数据完整性关键记录、数据和决策的完整性以及影响产品物理属性的那些方面都会直接影响患者的安全责任方管理质量研究开发制造实验室工程IT支持人员所有的相关供应商覆盖面适用于以下法规所涵盖的计算机化系统:药品生产质量管理规范GMP良好临床试验管理规范(GCP)良好实验室质量管理规范(GLP)良好配送质量管理规范(GDP)医疗器械法规(医疗器械内置的软件除外)……以上诸项统称GxP 法规GAMP文件只是指南而非标准!任何供应商或者产品宣称“已通过GAMP5认证”、“已获得GAMP5批准”之类的说法都是不适当的!被监管公司的职责是制定政策与规程来满足使用的法规要求!文件结构GAMP5 指导原则与框架附录管理开发运行特别关注的附录通用附录良好实践指南实验室全局信息系统过程控制基础设施校准管理测试电子数据存档电子记录与签名其他信息论文与文章模板与示例培训材料正文:关键概念生命周期方法?生命周期各阶段?供应商活动?效率的提高5大关键概念产品和流程的理解基于质量管理系统的生命周期方法?可增减的生命周期活动基于科学的质量风险管理方法充分利用供应商的活动5大关键概念药品开发药品生产药品上市与销售用户产品与流程的理解QMS内的生命周期方法可增减的生命周期活动基于科学的质量风险管理充分利用供应商的活动供应商(CS及服务)产品与服务开发产品与服务交付产品与服务的维护与支持大关键概念5?产品和流程的理解确保系统符合预期用途的努力应集中在那些对患者安全、产品质量和数据完整性至关重要的方法?系统需求应对这些至关重要的方面进行识别、描述和确认?对于制造系统而言,工艺需求取决于对产品特征的全面理解?确定关键质量属性和相关工艺参数才能确定过程控制需求系统需求规范应侧重于关键方面,其范围和细节应该与系统有关的风险、复杂性和新颖性相关联应全面地了解流程以是的系统充分有效地合规并获得商业利益确定系统需求的基础制定基于科学与风险的决策的基础,以保证符合预期用途大关键概念5?基于质量管理体系的生命周期方法对不同的系统采用统一的方式进行管理?从系统概念的提出到系统退役在内的所有活动QMS 应能在定期审查、操作和性能数据以及失败根本原因分析的基础上,对过程和系统进行持续性改进利于推动QbD 的方法确保系统符合预期用途和法规要求GAMP 基础QMS 的内在组成部分5大关键概念可增减的生命周期活动依据以下方面选择合适的生命周期活动:系统对患者安全、产品质量和数据完整性产品的影响(风险评估)?系统的复杂性和新颖性(系统组件的架构和分类)供应商评估结果(供应商能力)5大关键概念基于科学的质量风险管理依据以下方面选择合适的生命周期活动:基于明确的流程理解与系统对系统安全、产品质量和数据完整性的潜在影响来进行质量风险管理系统控制或监测关键生产过程参数应可以追溯至关键质量属性,并最终可追溯到制造系统相关的法规条例定性或定量的来识别和管理风险制定风险控制措施将风险降低到可接受水平在日常运行期间对所实施的风险控制措施进行监控以及确保措施有效性5大关键概念重复利用供应商的活动如对供应商的评估结果令人满意,可寻求供应商在整个系统的生命周期内尽可能多的参与以便充分利用供应商的知识、经验与文件:供应商协助进行需求收集、RA、功能规范文件及其他文件的编写、系统配置/测试/支持和维护基于对供应商的评估结果(如:供应商审计)决定是否采用供应商文件应评估供应商文件的适用性、准确性和完整性63大关键术语大关键人物?计算机化系统(CS)计算机化系统验证GxP合规性被GxP监管的计算机化系统GxP法规质量管理体系QMS流程所有者过程所有者主题专家SME计算机化系统计算机化系统指由硬件、软件、网络等组件和相关联文件组成的系统,其共同实现某些功能。
GAMP5:计算机化系统验证--4Q

GAMP5:计算机化系统验证--OQ、PQ1、系统概览和数据系统完成交付后,需要辨别系统的软硬件组件,并创建系统软硬件列表,列表内的信息应当在IQ阶段进行核实;绘制系统软硬件组件和系统的数据流示意图,以及绘制不同权限集角色的权限清单,方便质量管理人员或监管部门查看,确保不同角色之间没有利益冲突;说明:为了有效完成上述任务,可以对系统进行预安装,预安装帮助我们在正式安装前了解系统;2、设计确认系统交付之后,根据URS、FS、DS的内容对系统进行设计确认或设计审核;设计确认对简单的GAMP5 Ⅲ类或GAMP5 Ⅳ类系统,如果系统是整体交付的,不需要根据设施条件再进行组装的,设计确认或设计审核实际上是没有多大帮助的,因为之前对FS的审核已经涵盖这些内容。
对于复杂的系统,不管是不是属于GAMP5 Ⅴ类系统,最好都要执行设计确认或设计审核,确保系统能够被正确的安装或组装,方便将来的使用和维护。
3、安装或组装在这个阶段执行正式的安装或组装。
为了确保系统能成功的安装或组装,推荐在之前的预安装的过程中起草一份安装和安装验收指南。
安装和安装验收指南用于详细描述系统安装或组装的步骤,如果供应商提供的安装或组装说明足够详细,就不需要再起草这份文件了。
记录安装过程是必要的,可以使用带有说明性文字的截屏、照片或图纸的形式来记录安装过程。
安装记录应当在IQ阶段进行核实。
注:本部分描述的任务也可以在IQ阶段执行,然而在实施安装确认前,推荐在之前的预安装过程中起草一份安装和安装验收指南。
4、配置设置为了确保系统能被正确的配置,推荐在之前的预安装过程中起草一份配置设置指南。
配置设置指南用于详细描述配置系统设置步骤,如果供应商提供的配置设置说明足够详细,就不需要在起草这份文件了。
记录系统的配置过程是良好的管理实践,可以使用带有说明性文字的截屏、照片或图纸的形式来记录配置设置过程。
配置设置记录应该在IQ阶段进行核实。
首次的配置设置记录或报告最迟应当在OQ报告签署前得到批准。
GAMP5遵从GxP计算机化系统监管的风险管理方法

可增减的GxP合规方法 有效的供应商关系
GAMP5
质量源于涉及QbD QMS内的持续改进
现有文件与知识的利用 基于科学的风险质量管理方法
关键质量数据CQA 提高GxP的合规效率
可配置系统与开发模式
背景
新增与修订内容(GAMP5 VS GAMP4)
完整的系统的生命周期(从概念阶段开始直到系统退役)方法是QMS的一部分 基于系统的新颖性、复杂性以及系统在患者安全、产品质量和数据完整性等方面所面临的风险,
指南文件结构解读
5 大关键概念
重复利用供应商的活动
如对供应商的评估结果令人满意,可寻求供应商在整个系统的生命周期内尽可能多的参与以便充 分利用供应商的知识、经验与文件: • 供应商协助进行需求收集、RA、功能规范文件及其他文件的编写、系统配置/测试/支持和维
护 • 基于对供应商的评估结果(如:供应商审计)决定是否采用供应商文件 • 应评估供应商文件的适用性、准确性和完整性
5 大关键概念
基于科学的质量风险管理
依据以下方面选择合适的生命周期活动: • 基于明确的流程理解与系统对系统安全、产品质量和数据完整性的潜在影响来进行质量风险
管理 • 系统控制或监测关键生产过程参数应可以追溯至关键质量属性,并最终可追溯到制造系统相
关的法规条例 • 定性或定量的来识别和管理风险 • 制定风险控制措施将风险降低到可接受水平 • 在日常运行期间对所实施的风险控制措施进行监控以及确保措施有效性
背景
覆盖面
适用于以下法规所涵盖的计算机化系统: 药品生产质量管理规范GMP 良好临床试验管理规范(GCP) 良好实验室质量管理规范(GLP) 良好配送质量管理规范(GDP) 医疗器械法规(医疗器械内置的软件除外)
个人整理_GAMP5 在仪器上的分类
一、计算机化系统—由硬件、软件、网络组件和可控的功能和相关文件组成计算机化系统Computerized System计算机系统(控制系统)Computer受控的功能和流程硬件Hardware 固件Firmware软件Software 仪器设备Equipment人员、程序People & SOPs运行环境:包括其他的联网或独立的计算化系统,其他系统,媒介,人员,设备与规程计算机化系统(Computerised Systems)中:•硬件为IT设施,与固件(Hardware)、软件(Software)划分至控制系统(Control Systems)•仪器设备(Control Equipment)、人员(People)和SOP划分至受控的功能或流程四、使用系统在整个生命周期实现合规与符合预定用途的通用方法1、计算机化系统生命周期●概念提出●项目实施●系统运行●系统退役2、规范和验证规范活动有对应的验证步骤以确认是否满足了所有的规范要求。
对于大型的系统可能需要多层级的规范文件,而小型的、简单的或低风险的系统则只需把几个规范结合起来限可。
应该通过合适的验证步骤对规范进行确认。
使用系统在整个生命周期实现合规与符合预定用途的通用方法五、USP 1058对实验仪器的分类六、GAMP5 在实验仪器里的应用及验证要求七、传统的确认语与GAMP5活动之间的关系1软件不能进行配置:是指软件模块可根据需求进行配置,并不是指对仪器进行配置。
注意:有关计算机化系统确认术语的使用,特别是运行和性能确认之间的关系,在不同公司之间是不相同。
以上的比较仅仅提供一个一般的解释,而并不是强制性的。
八、 类别3:不可配置软件的方法规范基本职责供应商质量管理体系简称:QMS典型的测试包括: ● 正确的安装● 表明系统符合预定用途并按照规定的要求进行系统验收 ● 根据供应商评估和风险评估结果决定进一步测试通常由被监管公司负责必须的规范和核实活动。
计算机化系统验证要点分析
8/89
Anwar 奥星设备与工艺系统事业部 验证总监
第一部分 Part 1
计算机化系统相关法规 Computerized System Related Regulations
3/89
相关法规和指南总览 Relevant Regulations and Guidelines
(US FDA) 21CFR Part11 美国联邦法规21篇第11部分电子记录与电子签名
7/89
US 21 CFR Part211
211∙68自动化设备、机械化设备和电子设备 应对计算机或有关系统采取适当控制,以确保生产及控制主记录或其它记录由授权人 员制定变更内容。配方、其它记录或数据在计算机或有关系统输入和输出时,应核查 其准确性。 211∙68 Automation equipment, mechanical equipment and electronic equipment Appropriate controls shall be used for a computer or the related systems to assure that changes in the master production and control records or other records are instituted only by authorized personnel. Input to and output from the computer or the related system of formulas or other records or data shall be checked for accuracy.
CFDA GMP及附录 CFDA GMP and Annexes
制药企业遵循GAMP5的计算机化系统验证实践探讨

制药企业遵循GAMP5的计算机化系统验证实践探讨随着中国医药行业信息化的发展,计算机化系统在药品生产过程中的应用不断增多,制药企业和相关软件厂商运用信息技术和系统控制技术提升生产效率和改进生产质量管理成为医药行业计算机化系统应用的重要方向之一。
这样,如何对计算机化系统进行有效地验证就成为制药企业质量管理体系中的重要环节,也是质量保证部门和信息技术部门面临的新课题。
若无法对计算机化系统进行有效地验证,必然阻碍信息技术在医药行业中的应用和推广。
虽然国际上存在业界认可的计算机化系统验证指南,如国际制药工程协会(ISPE)的良好自动化生产实践指南(GAMP)以及针对计算机化系统验证的特别法规,如美国FDA的21CRFPartll,但目前国内制药企业在计算机化系统验证方面的实际案例较为缺乏,国内制药企业在执行计算机化系统验证中存在较多的困惑,而且国家食品药品监督管理局已在《药品生产质量管理规范(2010年修订)》(GMP)中第一次将计算机化的仓库管理系统和其他相关计算机软件的变更纳人变更控制范畴要求。
本文通过描述上海信谊药厂有限公司制药二厂(简称信谊二厂)对药品生产全程质量监控在线、实时技术平台进行计算机化系统验证的过程,探讨中国制药企业遵循GAMP5执行计算机化系统验证的可行性和具体实践方法。
<br><br>一、计算机化系统验证项目的背景<br><br> 药品生产全程质量监控在线、实时技术平台是信谊二厂根据本厂药品生产管理流程的业务需求开发实施的计算机应用系统,用于对药品生产全过程进行监控。
系统还采用RFID对物料进行识别和追踪,并利用应用系统的控制功能进行生产过程控制,以电子记录的形式创建和维护生产记录,确保生产记录的真实性、准确性和完整性。
系统成功实施后,信谊二厂管理层决定对该计算机化系统进行验证,证明系统同时满足信谊二厂的生产业务需求和国家新版GMP的法规要求,并且能够长期稳定运行,通过计算机化系统验证,将系统纳人企业的质量管理体系,代替原有的人工控制和原始生产记录,使信息技术应用的价值最大化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
质量系统规则第820部分
EMEA
• Validation: The extent of validation necessary will depend on a number of factors including the use to which the system is to be put, whether the validation is to be prospective or retrospective and whether or not novel elements are incorporated. Validation should be considered as part of the complete life cycle of a computer system. This cycle includes the stages of planning, specification, programming, testing, commissioning, documentation, operation, monitoring and modifying. 验证:验证的范围基于一组包含应用于系统的因素,无论验证是预见 性的还是回顾性的,无论有无新元素的使用。验证应该被认为是计算 机系统完整生命周期的部分。这个周期包括设计,规范,编程,测 试,调试,文档,运行,监控和修改。
Addition补充
第110条(第1次的是115条款):使用计算机化仓储管理的,应有 相应的操作规程防止因系统故障、停机等特殊情况而造成物料和产品 的混淆和差错。
第164条(第1次的是172条款):如使用电子数据处理系统、照相 技术或其它可靠方式记录数据资料,应有所用系统的详细规程;记录 的准确性应经过核对。如果使用电子数据处理系统,只有受权人员方 可通过计算机输入或更改数据,更改和删除情况应有记录;应使用密 码或其它方式来限制数据系统的登录;关键数据输入后,应由他人独 立进行复核。用电子方法保存的批记录,应采用磁带、缩微胶卷、纸 质副本或其它方法进行备份,以确保记录的安全,且数据资料在保存 期内应便于查阅。 来源:sFDA药品生产质量管理规范送审版 第2次 2009.12.10
Good Manufacturing Practice for pharmaceutical products, Part II Annex (Draft for Comment) Chapter 12 Terminal Sterilisation:
药品生产质量管理规范第二部分附录(征求意见稿)第12章最终灭菌
GAMP5及计算机化系统验证相关知识 鲁抗立科公司自控验证探讨
Austar Promotes Industry Advancement
GAMP5 (Good Automated Manufacturing Practice)
良好自动化生产实践指南 A Risk Based Approach to Compliant GxP Computerised
SFDA:药品生产质量管理规范(征求意见稿)
Introduce 简介
GAMP5( Good Automated Manufacturing Practice -Rev5) GAMP是由国际制药工程协会(ISPE)主编的实践指南。自90年代以来,不断 改版的良好自动化生产实践指南被广泛使用并得到国际监管部门的公认。它是 计算机化系统验证的指导方针。GAMP5是GAMP的第5版本。
Critical Quality Attributes for a Tablet?片剂的关键质量属性?
purity, potency, stability…纯度、效价、稳定性…….
b) Classify CQAs in terms of their effect on patient safety.根据其对 患者安全的影响对关键质量属性进行分类
Purpose 目的
• Cost effective framework of good practice to ensure that computerised systems are fit for the intended use and compliant applicable regulations 良好实践的有效架构以保证计算机系统是满足使用要求和 顺从规章要求的
计算机化系统 由硬件、软件、网络组件和可控的功能和相关文件组成
软件
硬件 固件
操作规程与人 员
设备
控制系统
受控的功能与流程
计算机化- Regulate to ensure safety of drugs that any of us might take!
Commission Directive 3003/94/ECAnnex 11 Computerised system
3003/94/EC调试指令附录11计算机系统
SFDA
• Where automated and monitoring systems are used for these applications they should be validated to ensure that critical process requirements are met. 使用自动化和监视系统的地方,应该被验证以确保满足关键过程要求
NIHS (National Institute of Health
FDA (Food and Drug
Science)(国立环境健康科学 研究院)
Administration)
食品与药物监督管理局
MCC (Medicine Control Council) 药品控制委员会
TGA (Therapeutic Goods
Administration) 治疗产品管理局
US FDA
• Automated processes. When computers or automated data processing systems are used as part of production or the quality system, the manufacturer shall validate computer software for its intended use according to an established protocol. All software changes shall be validated before approval and issuance. These validation activities and results shall be documented. 自动化过程。当计算机或自动数据处理系统做为生产或质 量系统的一部分时,制造商需要验证计算机软件系统是按 照预先设计使用的。所有软件变更在准许使用前是可验证 的。这些验证的活动和结果应该被文档记录。
Key Concepts
关键概念
GAMP5 KEY CONCEPTS 1- product/Process Understanding GAMP5 关键概念-对产品/工艺的理解
‐ fundamental to determining system requirements. 对决定系统要 求非常重要
System 遵从GxP计算机化系统监管的风险管理方法
Different Terminology不同的术语
• Computerised Systems计算机系统 • Automation Systems自动化系统 • Control Systems控制系统 • Control Equipment控制设备 • Data Management systems 数据管理系统
‐ basis for making risk‐based decisions.是根据风险作出决定的基础
End user SHOULD do the following:最终用户应
a) Identify Critical Quality Attributes (CQAs) for their product during drug development. 在药开发过程中确定其产品的关键质量属性
Computerised System: A system including the input of data, electronic processing and the output of information to be used either for reporting or automatic control 计算机系统:系统中包括数据输入,电子化处理和用于报告或自控的信息输出 SFDA: Good Manufacturing Practice for pharmaceutical products (Draft for comment)
• Safeguard: Patient safety, products quality, & data integrity 保证条款:患者安全,产品质量和数据完整
• Provide suppliers guidance on the development and maintenance of the systems by following good practice. 通过良好实践,为供应商提供系统开发和维护的指导
-通过管理保证我们任何人都可能用到的药品的安全
- All have the power to refuse imports if their regulations are not met.
-如不符合管理规定,任何人都有权拒绝。 MHRA
SFDA (Chinese
(Medicines and Healthcare Products Regulatory Agency ‐ was previously the MCA) (药品及保健产 品管理局‐前身为药品监督局)
