乙酰化修饰定量蛋白质组学含案例培训课件
乙酰化修饰定量蛋白质组学-含案例资料30页PPT

66、节制使快乐增加并使享天再早也 是耽误 了。——裴斯 泰洛齐 68、决定一个人的一生,以及整个命运 的,只 是一瞬 之间。 ——歌 德 69、懒人无法享受休息之乐。——拉布 克 70、浪费时间是一桩大罪过。——卢梭
乙酰化修饰定量蛋白质组学-含案例资 料
11、用道德的示范来造就一个人,显然比用法律来约束他更有价值。—— 希腊
12、法律是无私的,对谁都一视同仁。在每件事上,她都不徇私情。—— 托马斯
13、公正的法律限制不了好的自由,因为好人不会去做法律不允许的事 情。——弗劳德
14、法律是为了保护无辜而制定的。——爱略特 15、像房子一样,法律和法律都是相互依存的。——伯克
乙酰化蛋白质组学

乙酰化蛋白质组学
《乙酰化蛋白质组学》
乙酰化蛋白质组学是一种新兴的生物学研究领域,它研究乙酰化蛋白质的非编码DNA特征(NCDNAs),阐明细胞中乙酰化蛋白质的组成、组织特性和功能,以及其在病理生理过程中的作用。
乙酰化蛋白质是一种特殊的蛋白质,它比普通蛋白质更具特殊性,可以调节细胞中各种生化反应和稳定生理环境。
研究乙酰化蛋白质组的目的是理解乙酰化蛋白质在细胞水平上的作用。
乙酰化蛋白质组学是基于基因组学和蛋白质组学,依据基因组学和蛋白组学的原理,利用全基因组表达和蛋白质谱分析技术,研究乙酰化蛋白质的表达、结构和功能。
乙酰化蛋白质组学可以更深入地揭示病变机制,研究乙酰化蛋白质如何调控蛋白质组学、细胞生命周期以及参与生理过程的代谢反应。
乙酰化蛋白质组学的研究还可以为治疗和预防疾病提供依据,更好地指导临床实践。
乙酰化蛋白质组学是一个新兴的学科领域,它不仅可以发现新的乙酰化蛋白质,还可以揭示健康和疾病状态下乙酰化蛋白质的表达变化。
乙酰化蛋白质组学可以帮助更好地了解疾病发生和发展的机制,从而帮助研制更有效的治疗方法和有效的预防策略。
- 1 -。
蛋白组学定量蛋白质组学.ppt

2
常用研究方法
以质谱技术为基础的化学标记定量方法 荧 光 差 示 双 向 凝 胶 电 泳 技 术 ( F-2D-
质量变化依赖于氮原子数目,因此对未 知的蛋白质难以进行定量。
10
(二)稳定同位素标记的必需氨基酸体 内标记(SILAC法)
高等动物细胞的生长中需要一些必需氨基酸的摄入,如赖氨酸 (Lys)、亮氨酸(Leu)、苯丙氨酸(Phe)等,这些氨基酸细胞自身 无法合成,需要从外界摄入补充。
在培养细胞时,可以在培养介质中特异的加入用稳定同位素标 记的某一种必需氨基酸,在经过适当的培养时间后,细胞中合 成的含有这类氨基酸的蛋白质几乎都掺入了标记的氨基酸 。
31
MCAT策略流程:定性
Lys只在Trypsin酶切后的末端,所以产生的b离子都没有被修饰;所有的y 离子带Lys,因此被修饰。
在MS/MS图谱上,所有的b离子是单一条带出现,所有的y离子是成对出现, 丰度比例一样,且相差同样的m/z。
容易区分b离子和y离子,容易读出氨基酸序列。
32
MCAT策略流程:定量
36
–COOH羧基标记
通过对羧基酯化进行 标记
用H和D标记的甲醇酯 化标记,来定量研究 蛋白质表达量的差异
37
羧基酯化标记进行蛋白定量研究
比例=2 : 1
38
缺点:
特异性不是很好,在C末端和Asp和 Glu残基上都有标记,且效率不均
采用的标记条件容易引起天冬酰胺 (Asn)和谷氨酰胺(Gln)的去酰胺
组蛋白乙酰化经典例子

组蛋白乙酰化经典例子
组蛋白乙酰化是一种重要的表观遗传学修饰过程,它涉及到组
蛋白蛋白质上的乙酰基团的添加。
乙酰化通常发生在组蛋白N末端
的赖氨酸残基上,通过改变染色质结构和调节基因转录来影响细胞
的生物学功能。
以下是一些组蛋白乙酰化的经典例子:
1. Histone H3和H4乙酰化,在核糖体组装和DNA复制过程中,组蛋白H3和H4的乙酰化是一个经典的例子。
这种乙酰化修饰可以
促进染色质的松弛,使得DNA更容易被转录因子和RNA聚合酶访问,从而促进基因的转录。
2. p53蛋白的乙酰化,p53是一个重要的肿瘤抑制蛋白,它的
乙酰化修饰可以影响其在DNA损伤修复和细胞凋亡中的作用。
乙酰
化可以增强p53与DNA的结合,从而促进其在细胞应激响应中的功能。
3. 组蛋白去乙酰化酶(HDAC)抑制剂的作用,HDAC是负责去
乙酰化的酶类,其抑制剂可以导致组蛋白乙酰化水平的升高,从而
影响细胞周期调控和细胞凋亡等生物学过程。
总的来说,组蛋白乙酰化在细胞的生物学过程中起着重要作用,上述例子只是其中的一部分经典案例。
希望这些例子能够帮助你更
好地理解组蛋白乙酰化在细胞内的重要作用。
蛋白乙酰化修饰

蛋白乙酰化修饰蛋白乙酰化修饰(Protein Acetylation)是一种细胞内多型性可变性修饰,它涉及到对蛋白质与其他分子之间相互作用的监控,并在蛋白质功能和系统稳态中发挥重要作用。
它同时也是调控细胞生物学过程的有效方式。
蛋白质乙酰化(Protein Acetylation)是细胞内主要修饰形式之一,它涉及将乙酰基(Acetyl)作为修饰团附着蛋白质表面的氨基酸残基(例如精氨酸,苏氨酸和缬氨酸)上。
蛋白质乙酰化在多种基因表达模式的调节中发挥重要作用,从而调节细胞生理活动,生长和成熟。
它通常被激活蛋白质和非编码RNA激活来实现。
蛋白质乙酰化的机理表明它是一种有效的控制手段,可以影响蛋白质的活性;可以通过蛋白质乙酰化来调控不同类型细胞功能,这种乙酰化反应得到证实可以调节细胞信号传导,解释DNA损伤修复,细胞粘附和活动等。
它还可以调控细胞周期,凋亡,超氧化物歧化酶活性等。
蛋白质乙酰化也可以调控蛋白质组织结构,活性和功能,影响蛋白质跨膜转运甚至参与蛋白质-核酸相互作用,同时可以影响细胞外通路,调节细胞活性以及调控蛋白质组中蛋白质的水平。
此外,蛋白质乙酰化也可以极大地影响蛋白质稳定性,例如可以阻断半胱天冬酰胺酶(caspase)的活性,进而抑制细胞凋亡;也可以通过调节细胞更新过程中的膜蛋白调节神经元的稳定性。
乙酰化还可以影响蛋白质的磷酸化情况,通过磷酸化去乙酰化结合位点上乙酰化酶在活跃状态,从而影响微管蛋白与凝胶状蛋白间的相互作用,影响细胞内结构稳定性。
蛋白质乙酰化已经成为调控生物活性的重要手段,它可以调节蛋白质的表达水平,促进蛋白质聚集,调控蛋白质活性,从而控制细胞内有效的代谢反应和细胞的生长、分化和老化。
研究表明,蛋白质乙酰化可以在多种疾病中起重要作用,包括癌症、心血管、神经系统和免疫相关疾病。
随着越来越多的研究证实,蛋白质乙酰化调控在癌症研究、药物研发和临床应用中发挥重要作用。
组蛋白的修饰作用ppt课件

1
一、组蛋白的定义:
组蛋白是染色体的结构蛋白,与DNA构成核小体。它分为 H1、H2A、H2B、H3和H4等5种。
2
二、组蛋白的特征:
1、进化上的极端保守性: 其保守程度比较:H1<H2A 、H2B<H3 、H4;
2、无组织特异性: 鸟、鱼、两栖类的红细胞染色体不含H1而含H5,精细胞
DNA复制和重组过程发挥着直接的作用。组蛋白H1被细胞周期 蛋白依赖的激酶磷酸化是其主要的修饰作用。组蛋白H1的磷酸 化能够影响DNA二级结构的改变和染色体凝集状态的改变。另 外,组蛋白H1的磷酸化需要DNA复制,并且激活DNA复制的蛋 白激酶也促进组蛋白H1的磷酸化。因此,组蛋白H1的磷酸化与 DNA复制存在一个协同发生的机制。
12
直到1996年,James Brownell 和David Allis 成功的纯化和鉴定 了一种组蛋白乙酰转移酶(Histone acetyltransferase HAT ),该 酶是从供体乙酰辅酶A上将乙酰基团转移到核心组蛋白上。
进一步研究得出HAT的两种作用机制: 1)使组蛋白H1、H2A、H4的氨基末端乙酰化,形成α-乙酰丝氨 酸;通常组蛋白在细胞质内合成后输入细胞核之前发生这一修 饰作用。 2)在组蛋白H2A、H2B、H3 和 H4 的氨基末端区域的某些专一位 置形成N6-乙酰赖氨酸。通常发生在蛋白质的赖氨酸(K)上。如下 图1所示:
由组蛋白甲基化的特定模式识别及结合核小体的蛋白质共同产 生的,并进一步修饰染色质或直接影响转录。
2、组蛋白的甲基化对促进DNA甲基化具有一定的作用。 DNA甲基化在转录水平可影响基因表达、参与真核生物胚胎发 育调节、参与基因组印记和X染色体失活及影响DNA与蛋白质 的相互作用。
组蛋白乙酰化修饰质谱

组蛋白乙酰化修饰质谱
组蛋白乙酰化修饰质谱分析,是一种揭示蛋白质修饰状态的强大技术。
它通过深入剖析组蛋白的乙酰化修饰,揭示了基因表达调控的奥秘。
在质谱分析过程中,我们能够精确鉴定和定量乙酰化修饰的肽段,为研究生物体内复杂的蛋白质修饰网络提供了有力的工具。
在样品制备阶段,我们运用精细的实验技巧,确保待分析的蛋白质样品纯净无瑕,同时保持其乙酰化修饰的完整性。
通过高效的酶消化过程,我们将蛋白质分解为易于分析的肽段。
为了克服高丰度蛋白对鉴定和定量乙酰化修饰的影响,我们采用了肽段预分离技术。
这种技术能够将不同丰度的肽段进行有效分离,提高分析的灵敏度和准确性。
此外,我们还结合了免疫共沉淀技术。
通过高效的抗体富集乙酰化的肽段,我们能够实现大规模乙酰化的鉴定及定量。
这种技术不仅提高了鉴定的特异性,还降低了背景干扰,使分析结果更加可靠。
为了鉴定和定量更多的乙酰化肽段,我们在酶切过程中采用了多种不同的酶对蛋白样品进行酶切。
这种策略能够增加鉴定的覆盖面,提高鉴定的全面性。
总的来说,组蛋白乙酰化修饰质谱分析是一种强大的技术,它通过深入剖析组蛋白的乙酰化修饰,揭示了基因表达调控的奥秘。
这种技术不仅提高了鉴定的灵敏度和准确性,还降低了背景干扰,使分析结果更加可靠。
它是研究生物体内复杂的蛋白质修饰网络的有力工具,为科学家们揭示生命活动的奥秘提供了重要的线索。
蛋白质分子的化学修饰课件

催化去磷酸化反应的酶,将蛋白 质上的磷酸基团去除。
蛋白质磷酸化修饰 磷酸化修饰的种类
调节蛋白质活性
磷酸化修饰可改变蛋白质 的构象或活性位点,从而 调节其功能。
参与信号转导
磷酸化修饰在细胞信号转 导过程中起着关键作用, 可影响细胞生长、分化、 代谢等过程。
蛋白质稳定性
磷酸化修饰可影响蛋白质 的稳定性,通过调节蛋白 质降解途径来影响细胞内 蛋白质水平。
2023
PART 04
蛋白质甲基化修饰
REPORTING
甲基化修饰的种类
赖氨酸甲基化
赖氨酸残基的ε-氨基上加上甲基 基团,包括单甲基化、二甲基化
和三甲基化。
蛋氨酸甲基化
蛋氨酸残基的α-氨基上加上甲基基 团,通常为N-甲基化。
精氨酸甲基化
精氨酸残基的胍基上加上甲基基团 ,包括N-甲基化和N,N-二甲基化。
2023
PART 03
蛋白质糖基化修饰
REPORTING
糖基化修饰的种类
O-糖基化
糖基磷脂化
发生在蛋白质的丝氨酸或苏氨酸的羟 基上,由糖苷酶催化。
将糖基连接到脂质分子上,形成糖脂 。
N-糖基化
发生在蛋白质的氨基上,由糖苷酶催 化。
糖基化修饰的酶类
糖基转移酶
催化糖基从供体转移到受体上。
糖苷酶
催化糖苷键的断裂,释放出糖基 。
泛素化
泛素化是指将泛素分子加到蛋 白质的特定位点上,可以调节 蛋白质的降解和功能。
甲基化
甲基化是指将甲基基团加到蛋 白质的特定位点上,可以调节 蛋白质的构象和与其他蛋白质
的相互作用。
蛋白质分子化学修饰的功能
调节蛋白质活性
调节蛋白质稳定性
乙酰化修饰组学 蛋白鉴定

乙酰化修饰组学蛋白鉴定英文回答:Acetylation is a post-translational modification that involves the addition of an acetyl group to a protein. This modification plays a crucial role in regulating protein function and cellular processes. Acetylation can occur on various amino acid residues, such as lysine, serine, and threonine, and is catalyzed by enzymes known as acetyltransferases.Proteomic analysis is a powerful tool used to identify and quantify proteins in a given sample. When studying acetylation, proteomic analysis can be used to identify acetylated proteins and determine the specific sites of acetylation. This can provide valuable insights into the functional consequences of acetylation and its role in various biological processes.There are several techniques commonly used inacetylation proteomics. One such technique is mass spectrometry, which can identify and quantify acetylated peptides by measuring their mass-to-charge ratio. Another technique is immunoprecipitation, where specific antibodies are used to selectively isolate acetylated proteins from a complex protein mixture. The isolated proteins can then be analyzed using mass spectrometry or other techniques to determine their identity and acetylation status.In my research, I have used acetylation proteomics to study the effects of acetylation on protein function in cancer cells. By comparing the acetylation profiles of cancer cells with normal cells, I have identified specific proteins that are differentially acetylated in cancer. For example, I found that the tumor suppressor protein p53 is hyperacetylated in cancer cells, leading to itsstabilization and increased activity. This finding has important implications for understanding the molecular mechanisms underlying cancer development and progression.中文回答:乙酰化是一种后转录修饰,涉及将乙酰基添加到蛋白质上。
乙酰化修饰蛋白质组学:乙酰化位点怎么分析?最新方法与实践分享?

乙酰化修饰蛋白质组学:乙酰化位点怎么分析?最新方法与实践分享?蛋白质组学作为生物制品研究领域的重要组成部分,为我们揭示了蛋白质的全貌和功能。
而其中一种重要的后转录修饰,乙酰化修饰,在细胞的信号传导、转录调控等生物过程中发挥着至关重要的作用。
本文将深入探讨乙酰化修饰蛋白质组学的概念和重要性,重点聚焦于乙酰化位点的分析方法,并分享最新的研究技术和实践案例,为读者呈现乙酰化修饰蛋白质组学的前沿进展及其在生物药物领域的应用潜力。
1. 乙酰化修饰蛋白质组学的概念与重要性。
乙酰化修饰是一种通过将乙酰基团与蛋白质中的赖氨酸残基结合而形成的后转录修饰方式。
该修饰可以调控蛋白质的稳定性、功能和相互作用,对细胞的生长、分化和应激响应等生物过程至关重要。
了解乙酰化修饰的位点和变化有助于深入理解细胞内复杂的调控网络,为生物药物研究和治疗提供新的靶点和策略。
2. 乙酰化位点的分析方法。
2.1. 质谱法(Mass Spectrometry)。
质谱法是目前研究乙酰化位点最常用的方法之一。
通过对蛋白质进行酶解,将产生的片段进行质谱分析,可以鉴定乙酰化位点。
质谱法的高灵敏度和高分辨率使其能够发现大量的乙酰化位点,并揭示乙酰化修饰的动态变化。
2.2. 沉淀质谱法(SILAC)。
沉淀质谱法结合了质谱法和代谢标记法的优势。
通过使用标记乙酰化底物,将乙酰化蛋白质富集出来,然后用质谱法鉴定乙酰化位点。
沉淀质谱法在高通量乙酰化位点分析中表现出色,并在乙酰化蛋白组学中得到广泛应用。
3. 最新方法与实践分享。
3.1. 西蒙斯方法(SIMAC)。
西蒙斯方法是一种高效的乙酰化位点富集技术。
通过多轮酶解和亲和层析的组合策略,可以高效地富集乙酰化蛋白质,并准确鉴定乙酰化位点。
该方法在乙酰化位点分析上具有高通量和高灵敏度的优势,广泛应用于乙酰化修饰蛋白质组学的研究。
3.2. 抗体富集法(Antibody Enrichment)。
抗体富集法是一种常用的乙酰化蛋白质富集方法。
乙酰化修饰定量蛋白质组学-含案例

乙酰化修饰非标定量技术优势
乙酰化抗体:特异性识别乙酰化赖氨酸残基;精准锁定目标范围。 灵敏度高:可检测出低丰度蛋白; 分离能力强:可分离出酸/碱性蛋白,小于10KD或大于200KD的蛋白、难溶性蛋白等;
适用范围广:可以对任何类型的蛋白质乙酰化进行鉴定,包括膜蛋白、核蛋白和胞 外蛋白等。
乙酰化修饰实验结果示例
质谱扫描完毕,得到质谱信号总图
小鼠的肌肉样本:乙酰化修饰 实验(4例样本:A、B、C、D) 1: 提取各组蛋白质,定量并 用胰酶酶切; 2. 各组肽段纯化,并用乙酰 化修饰抗体进行富集; 3. RP分离和质谱分析. 4: 不同样本中乙酰化修饰的 差异表达可通过二级质谱中峰 面积确定 5. 根据该肽段的二级质谱峰 图,结合数据库检索,得到蛋 白的定性及定量信息。
35 62 64
(4)根据峰型和时间共收取梯度,根据规则合 并,真空离心浓缩后,待质谱分析。 质谱鉴定:MS扫描范围400-1800 MS/MS扫描范围100-2000
68 72
6:纳升级反相色谱-Q Exactive进行蛋白质分析
(1)仪器及试剂:
乙酰化修饰详细实验步骤
涡旋振荡器(海门市其林贝尔仪器制造有限公司,型号:QL-901) 离心机(Thermo,型号:PICO17) 高效液相色谱仪:(Thermo Scientic EASY-nLC 1000 System(Nano HPLC)) 质谱系统(Thermo,型号:Q-Exactive)
流动相A:100% 超纯水,0.1%甲酸 流动相B:100% 乙腈,0.1%甲酸 甲酸:(Sigma-Aldrich,货号:56302,美国) 甲醇:(Sigma-Aldrich,货号:14262,美国) 预柱(Acclaim PepMap100 column,2cm x 100μ m,C18,5μ m)
乙酰化修饰定量蛋白质组学-含案例资料共30页文档

6
、
露
凝
无
游
氛
,
天
高
风
景
澈
。
7、翩翩新 来燕,双双入我庐 ,先巢故尚在,相 将还旧居。8、 Nhomakorabea吁
嗟
身
后
名
,
于
我
若
浮
烟
。
9、 陶渊 明( 约 365年 —427年 ),字 元亮, (又 一说名 潜,字 渊明 )号五 柳先生 ,私 谥“靖 节”, 东晋 末期南 朝宋初 期诗 人、文 学家、 辞赋 家、散
55、 为 中 华 之 崛起而 读书。 ——周 恩来
1
0
、
倚
南
窗
以
寄
傲
,
审
容
膝
之
易
安
。
谢谢!
51、 天 下 之 事 常成 于困约 ,而败 于奢靡 。——陆 游 52、 生 命 不 等 于是呼 吸,生 命是活 动。——卢 梭
53、 伟 大 的 事 业,需 要决心 ,能力 ,组织 和责任 感。 ——易 卜 生 54、 唯 书 籍 不 朽。——乔 特
文 家 。汉 族 ,东 晋 浔阳 柴桑 人 (今 江西 九江 ) 。曾 做过 几 年小 官, 后辞 官 回家 ,从 此 隐居 ,田 园生 活 是陶 渊明 诗 的主 要题 材, 相 关作 品有 《饮 酒 》 、 《 归 园 田 居 》 、 《 桃花 源 记 》 、 《 五 柳先 生 传 》 、 《 归 去来 兮 辞 》 等 。
组蛋白修饰及其功能(乙酰化,甲基化,磷酸化等)PPT演示幻灯片

9
10
组蛋白修饰的生物学意义
11
尤其是组蛋白乙酰化、甲基化修饰能为相关调控蛋白提供其在组蛋白上的附着位点,改变染色质结 构和活性。一般来说,组蛋白乙酰化能选择性的使某些染色质区域的结构从紧密变得松散,开放某 些基因的转录,增强其表达水平。而组蛋白甲基化既可抑制也可增强基因表达。乙酰化修饰和甲基 化修饰往往是相互排斥的。在细胞有丝分裂和凋亡过程中,磷酸化修饰能调控蛋白质复合体向染色 质集结。
组蛋白修饰及其功能
表观遗传学(epigentics)是研究不改变DNA序列而由于其外 部修饰引起的基因开放与否的学科,涉及的主要机制有DNA甲基 化、组蛋白修饰、基因印记、RNA干扰等。其中研究得最多是 DNA甲基化和组蛋白乙酰化、组蛋白甲基化,这些修饰与活化或 失活染色质的结构形成相关。
染色质是由许多核小体组成的,大部分真核生物中有5种富含 碱性氨基酸的组蛋白,即H1,H2A,H2B,H3和H4。H2A,H2B, H3和H4各2个分子构成的8聚体是核小体的核心部分,H1的作用是 与线形 DNA结合以帮助后者形成高级结构。
研究表明,组蛋白精氨酸甲基化是一种相对动态 的标记,精氨酸甲基化与基因激活相关,而H3和H4精 氨酸的甲基化丢失与基因沉默相关。相反,赖氨酸甲 基化似乎是基因表达调控中一种
1. H3-K9甲基化与异染色质的形成:人们曾针对异染色质的形成提出过一个模型:首先组蛋白 脱乙酰酶使H3中的K9、K14脱乙酰化,然后Suv39h1或Clr4对H32K9进行甲基化,H32K9的甲基 化再影响DNA的甲基化,随后甲基化的H32K9做为一个结合位点招募HP1或Swi6蛋白的定位, 最后HP1/Swi6通过它们的shadow染色质结合区域定位在C末端,进而形成异染色质的多聚体。 2. H32K9甲基化对常染色体中基因表达调控的影响: 3. 组蛋白其他位点上发生甲基化与基因表达的关系:大量实验表明H32K9甲基化的功能与基 因沉默有关,但其它位点甲基化可能存在激活转录作用。 4. 组蛋白甲基化与DNA甲基化:H32K9的甲基化可以直接或间接影响DNA 的甲基化,DNA 甲基化可能是组蛋白甲基化的间接结果
蛋白质组学PPT课件
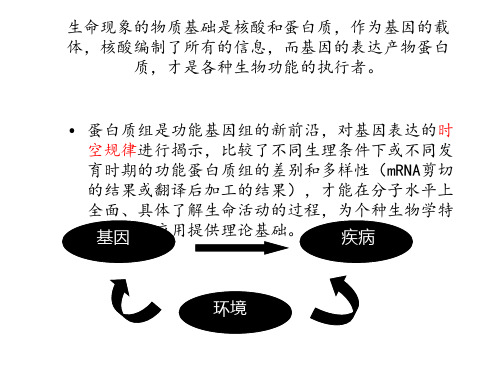
蛋白质组定义
1,基因组表达的全部蛋白质。 2,在一种细胞/组织内存在的全部蛋白 质。
Proteome
• 1994 M.Wilkins and K.W.Williams
•
Macquarie University in Sydney
• Total Proteins Complement of a Genome
环境
ቤተ መጻሕፍቲ ባይዱ
REAL COMPLEXITY…
IS IN CELLULAR ROTEOMES • BEYOND THE GENOME… • Tissue Specific Expression • Alternate Splicing, (1/3 of all genes) • Post-Translational Modifications
Functional
Proteomics
• During human development, cell express different proteins
• Normal and cancer cells express different proteins
• Cell treated with and without drug express different proteins
– Types and Level:
– Signal Sequence cleavage – Glycosylation
– Phosphorylation – Farnylation – Isoprenylation – Acetylation
• All combine > 100-1000 fold increase in complexity
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
样本的差异蛋白分析; ➢ 结果可靠:定性与定量同步进行,同时给出每一个组分的相对表达水平、分子量和
丰富的结构信息; ➢ 自动化程度高:液质联用,自动化操作,分析速度快,分离效果好。
乙酰化修饰定量蛋白质组学含案例
5 乙酰化修饰实验流程
存。 2、原始样本湿重大于1g,根据不同样本得率情况尽量多提供
原始样本。 3、提得的蛋白大于5mg,可完成一次正常富集。若样本珍贵难
获取,最少2mg可完成一次实验。
乙酰化修饰定量蛋白质组学含案例
16 乙酰化非标定量详细实验步骤
2:蛋白质定量 (1) 可以采用Bradford方法及其他方法定量初步 (2) 定量取各组样本的蛋白质进行SDS-PAGE电泳,考染定量,根据每个涌道 染色情况微调蛋白浓度,保证后续实验中每组样本的蛋白量相同。
乙酰化修饰定量蛋白质组学含案例
6 乙酰化修饰实验结果示例
质谱扫描完毕,得到质谱信号总图
小鼠的肌肉样本:乙酰化修饰 实验(4例样本:A、B、C、D)
1: 提取各组蛋白质,定量并 用胰酶酶切;
2. 各组肽段纯化,并用乙酰 化修饰抗体进行富集;
3. RP分离和质谱分析.
4: 不同样本中乙酰化修饰的 差异表达可通过二级质谱中峰 面积确定
横坐标是洗脱时间,纵坐标是信号强度。
5. 根据该肽段的二级质谱峰 图,结合数据库检索,得到蛋 白的定性及定量信息。
乙酰化修饰定量蛋白质组学含案例
7 乙酰化修饰实验结果示例
4例样本共鉴定到1449个蛋白,肽段6879个,乙酰化修饰肽段637个。乙酰 化修饰的差异分析如下:
两两比较 B/A C/B D/C C/A D/A
乙酰化修饰定量蛋白质组 学含案例
乙酰化修饰非标定量技术简介
2
蛋白质的乙酰化修饰是在乙酰基转移酶的作用下,蛋白质的赖氨酸残基 上添加乙酰基的过程,是细胞控制基因表达、蛋白质的活性或生理过程的一 种机制。
最近的调查表明,蛋白质的赖氨酸残基的乙酰化普遍存在于人体的代谢 酶之中,具有调节代谢通路及代谢酶的活性。乙酰化是一个普遍和重要的蛋 白质翻译后修饰,主要集中在对细胞染色体结构的影响以及对核内转录调控 因子的激活方面 ,还影响参与细胞周期和新陈代谢、肌动蛋白聚合控制,蛋 白的乙酰化状态调节受损的癌症和多聚谷氨酰胺疾病。蛋白质的乙酰化具有 很高的功能特异性,与肿瘤等等疾病密切相关,也是目前正在开发的抗癌药 物的靶点。通过高通量的蛋白质组研究和不同物种的代谢通路研究发现,在 生理状况下,存在着大量非细胞核的蛋白质被乙酰化修饰,具有广泛的生物 学意义。 乙酰化修饰定量蛋白质组学含案例
乙酰化修饰定量蛋白质组学含案例
18 乙酰化非标定量详细实验步骤
4: 除盐,此步操作是将实验过程和相关buffer的盐除去,以便于 后续分析。
乙酰化修饰定量蛋白质组学含案例
4乙酰化修饰非标定量技术优势
➢ 乙酰化抗体:特异性识别乙酰化赖氨酸残基;精准锁定目标范围。 ➢ 灵敏度高:可检测出低丰度蛋白; ➢ 分离能力强:可分离出酸/碱性蛋白,小于10KD或大于200KD的蛋白、难溶性蛋白等
; ➢ 适用范围广:可以对任何类型的蛋白质乙酰化进行鉴定,包括膜蛋白、核蛋白和胞
蛋白质样品制备
样品及实验预判
酶解
乙定性定量蛋白质组学结果
统计学、生物信息分析
乙酰化修饰实验流程。
1:收集不同组别的样本并分别提取蛋白质; 2:蛋白质经过还原,封闭后用胰蛋白酶酶切; 3:各组样本肽段进行纯化; 4:各组样本的肽段分别用乙酰化抗体试剂进行富集,并RP分离馏分; 5: Q-Exactive 质谱检测,定性及定量分析; 6:流程化生物信息分析及个性化设计生物信息服务
11
箱线图
乙酰化修饰定量蛋白质组学含案例
12
GO 富集分析
乙酰化修饰定量蛋白质组学含案例
14 高阶(客制化)信息分析
详见信息分析PDF
乙酰化修饰定量蛋白质组学含案例
15 乙酰化非标定量详细实验步骤
1:蛋白质提取 提供专业的样本制备,与后期翻译后修饰富集、液相、质谱完美对接。
注意事项: 1、样本不要反复冻融。收集后立即放于液氮中或-80°冰箱保
乙酰化修饰定量蛋白质组学含案例
17 乙酰化非标定量详细实验步骤
3:酶切,富集
(1) 每组样本(各5mg)分别加入-20℃预冷的丙酮(丙酮:样品体积比=6:1),颠 倒混匀,-20℃沉淀30min~4h
(2) 12000rpm 离心15分钟,弃上清,用lysis buffer充分混悬溶解样品; (3) 加入还原试剂2μL,混匀,60 ℃反应1h; (4) 加入半胱氨酸封闭试剂1μL,室温处理10分钟; (5) 按照酶:蛋白质=1:100的比例加入trypsin酶,37℃酶解过夜(16h); (6) 收集肽段,纯化,真空冷冻干燥。 (7) 乙酰化抗体富集 (8) RP分离 (9) 质谱检测
显著差异 189 202 248 243 273
乙酰化修饰定量蛋白质组学含案例
鉴定到的蛋白列表-结果
8
乙酰化修饰定量蛋白质组学含案例
鉴定9到的肽段列表-结果
乙酰化修饰定量蛋白质组学含案例
10 乙酰化修饰实验结果示例 数据交盖图生物信息
原始数据表达量图
乙酰化修饰定量蛋白质组学含案例
表达量分布图
3 乙酰化修饰非标定量技术原理
技术原理
赖氨酸发生乙酰化的蛋白对各种生物功能进行调控。实验基于特异性识 别乙酰化赖氨酸残基的乙酰化抗体,对含有乙酰化修饰的赖氨酸肽段进行 富集。乙酰化之后的肽段,质量发生42Da 的质量变化,基于非标定量的 质谱方法对乙酰化肽段进行鉴定。
如:组蛋白乙酰化多发生在核心组蛋白N一端碱性氨基酸集中区的特定 赖氨酸残基,将乙酰辅酶A的乙酰基转移到赖氨酸的sNH3+中和掉1个正电荷 。组蛋白乙酰化水平是由组蛋白乙酰基转移酶(histone acetyltmnsferse ,HATs)和组蛋白去乙酰基转移酶(histone deacetylase,HDACs)共同决定 。在细胞核内,组蛋白乙酰化与组蛋白去乙酰化过程处于动态平衡,精确 地调控基因的转录和表达。
