透明质酸 层粘连蛋白 Ⅳ型胶原 Ⅲ型前胶原N端肽质控品产品技术要求kcst
Ⅳ型胶原(Ⅳ-Col)测定试剂盒(化学发光免疫分析法)产品技术要求yuande

Ⅳ型胶原(Ⅳ-Col)测定试剂盒(化学发光免疫分析法)适用范围:用于体外定量测定人血清或血浆中的Ⅳ型胶原含量。
1.1 产品规格试剂盒规格为48人份/盒、96人份/盒。
1.2 主要组成成分表1 Ⅳ型胶原(Ⅳ-Col)测定试剂盒(化学发光免疫分析法)主要组成成分a) 酶结合物以含20%小牛血清的磷酸盐缓冲液(PH7.4)配制的联接HRP的Ⅳ型胶原单克隆抗体,0.5%ProClin300作为防腐剂。
b) 校准品校准品以含20%小牛血清的磷酸盐缓冲液(PH7.4)为稀释液,0.5%ProClin300作为防腐剂,校准品A~G中Ⅳ型胶原的目标浓度分别约为0、15μg/L、40μg/L、80μg/L、160μg/L、400μg/L、800μg/L。
校准品具体浓度详见标签及试剂盒参数IC卡。
c) 发光液发光液A主要成份为鲁米诺,发光液B主要成份为过氧化脲,两者均以pH8.6的Tris-HCl缓冲液配制。
d) 包被微孔板包被有Ⅳ型胶原单克隆抗体白色聚苯乙烯微孔板,用铝箔袋真空包装。
e) 质控品(选配)以100%正常人血清为基质制备的冻干品,其中含0.5%ProClin300作为防腐剂,其靶值浓度范围QCⅠ为50.00 µg/L~80.00 µg/L,QCⅡ为200.00 µg/L~300.0 µg/L。
质控品具体浓度详见质控品参数表。
f) 洗涤剂使用500ml的蒸馏水溶解后为0.02mol/L磷酸盐缓冲液,含0.5‰吐温。
g) 盖板膜h) 试剂盒参数IC卡不同批号试剂盒中的相同组分不能互换。
2.1 外观a)液体组分应澄清,无沉淀或絮状物,实际装量应不小于标示装量;b)冻干组分呈白色或淡黄色疏松体,加水后应在3分钟内完全溶解;c)所有组分均无包装破损,标示清楚。
2.2 准确度将使用纯品配制的1000ng/ml的样品加入基质血清中,回收率应在80%~120%之间。
2.3剂量—反应曲线的线性用双对数或其他数学模型拟合,在[15.0,800] μg/L范围内,剂量-反应曲线相关系数(r)的绝对值应不低于0.9900。
肝病患者血清透明质酸、层粘连蛋白、Ⅳ型胶原、Ⅲ型前胶原肽检测的临床分析

肝病患者血清透明质酸、层粘连蛋白、Ⅳ型胶原、Ⅲ型前胶原
肽检测的临床分析
鲁文清
【期刊名称】《广西医学》
【年(卷),期】1999(21)6
【摘要】@@ 肝纤维化是慢性肝病及肝硬化的病理基础,近年来的研究认为早期肝纤维化经适当治疗可以逆转,所以肝纤维化的早期诊断极为重要.目前国内外对肝纤维化诊断最可靠的方法依然是肝穿刺组织活检(1,2),但肝穿本身也存在局限性,故寻找可靠的血清学检查对肝纤维化诊断是最方便实用的方法.许多报道认为HA(透明质酸)、LN(层粘连蛋白)、Ⅳ-C(Ⅳ型胶原)、PⅢP(Ⅲ型前胶原肽)等指标对肝纤维化有较好的诊断价值(3~7).本文对130例肝病患者血清进行HA、LN、Ⅳ-C、PⅢP 检测,并分析其对肝纤维化的诊断意义.
【总页数】2页(P1213-1214)
【作者】鲁文清
【作者单位】南宁市第四人民医院
【正文语种】中文
【中图分类】R5
【相关文献】
1.肝炎患者血清透明质酸、Ⅲ型前胶原氨基端尾肽、层粘蛋白与Ⅳ型胶原的检测及其临床意义 [J], 朱明风;王路明;陶静芬
2.乙型肝炎患者血清Ⅲ型前胶原、Ⅳ型胶原和透明质酸及层粘连蛋白的检测及其意义 [J], 朱飞燕;钟庆平;吴彩珍
3.肺结核患者血清透明质酸、层粘连蛋白、Ⅲ型前胶原和Ⅳ型胶原检测的临床意义[J], 康卫国;刘久山;蔡绍曦;朱建军;翁介月;佟万成
4.慢性肝病患者血清层粘连蛋白、前Ⅲ型胶原肽及透明质酸检测的临床意义 [J], 申碧荷;刘荣华
5.乙型肝炎患者血清Ⅲ型前胶原、Ⅳ型胶原、透明质酸和层粘连蛋白的检测及其意义 [J], 朱飞燕;钟庆平;吴彩珍;吕永宝;赵治友
因版权原因,仅展示原文概要,查看原文内容请购买。
IV型胶原(IVC)测定试剂盒(化学发光法)产品技术要求科美
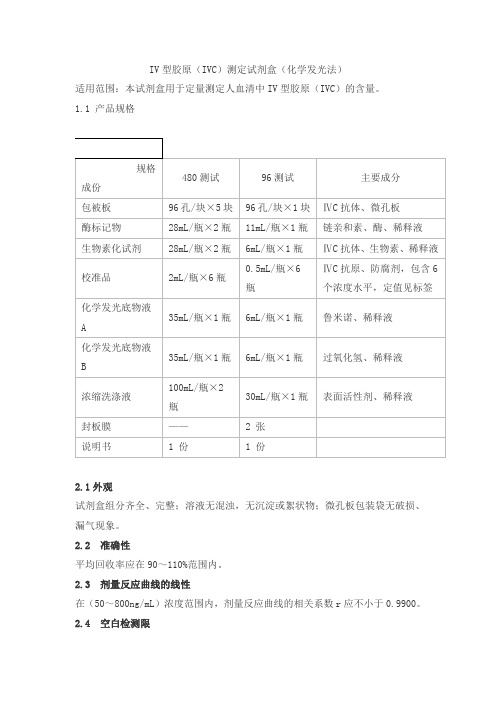
IV型胶原(IVC)测定试剂盒(化学发光法)
适用范围:本试剂盒用于定量测定人血清中IV型胶原(IVC)的含量。
1.1 产品规格
2.1外观
试剂盒组分齐全、完整;溶液无混浊,无沉淀或絮状物;微孔板包装袋无破损、漏气现象。
2.2 准确性
平均回收率应在90~110%范围内。
2.3 剂量反应曲线的线性
在(50~800ng/mL)浓度范围内,剂量反应曲线的相关系数r应不小于0.9900。
2.4 空白检测限
应不大于10.0ng/mL。
2.5精密度
2.5.1分析内精密度
测定QC血清,变异系数(CV)应小于15.0%。
2.5.2分析间精密度
测定QC血清,变异系数(CV)应小于20.0%。
2.6批间差
用三个批号的试剂盒,分别测量同一质控血清,变异系数(CV)应小于20.0%。
2.7 质控血清测定值
应在允许的范围内。
2.8 特异性
2.8.1与人透明质酸(HA)的交叉反应
检测浓度为800 ng/mL的HA,测定值应小于6 ng/mL。
2.8.2与人Ⅲ型前胶原N端肽(PⅢNP)的交叉反应
检测浓度为120 ng/mL的PⅢNP,测定值应小于9 ng/mL。
2.8.3与人层粘连蛋白(LN)的交叉反应
检测浓度为800 ng/mL的LN,测定值应小于6 ng/mL 。
2.9 稳定性
ⅣC试剂盒在2~8℃避光保存,有效期12个月。
在ⅣC试剂盒有效期满后2个月内,分别检测2.1、2.2、2.3、2.4、2.5.1、2.7项,结果应符合各项目的要求。
肝纤维化四项指标有哪些

如对您有帮助,可购买打赏,谢谢肝纤维化四项指标有哪些导语:肝病对于人体来说是致命的,肝脏由于控制着身体的解毒功能,所以,一旦肝脏发生病变就可能造成患者的生命受到严重的威胁,肝病的种类比较多肝病对于人体来说是致命的,肝脏由于控制着身体的解毒功能,所以,一旦肝脏发生病变就可能造成患者的生命受到严重的威胁,肝病的种类比较多,检查起来也比较麻烦,有些人患上了乙肝,但是检查指标非常多,患者很苦恼,而肝纤维化四项指标是指示肝病的重要指标,下面来看看介绍吧。
1、层粘连蛋白,正常值<130ug/ml.它是基底膜中特有的非胶原性结构蛋白,与肝纤维化活动程度及门静脉压力呈正相关。
2、III型前胶原,正常值<120ug/L.用来反映反映肝内III型胶原合成,血清含量与肝纤程度一致,并与血清T-球蛋白水平明显相关。
3、IV型胶原,正常值<75ug/L.它是构成基底膜的主要成份,反映基底膜胶原的更新率,含量增高可较灵敏反映出肝纤过程,是肝纤的早期标志之一。
4、透明质酸酶,正常值<110mg/L.它是为基质成分之一,由间质细胞合成,可较准确灵敏地反映肝内已生成的纤维量及肝功能的受损状况,有认为本指标较之肝活检更能完整反映出病肝全貌。
肝纤四项检查结果[2] 较其他的检查不一样,像肝功能只需检测血液,而肝纤维化主要是为了判断患者肝细胞是否有所损伤,肝脏是否有所变硬,以及是否有肝硬化的现象发生,所以肝纤维化检查较为讲究,其检查结果的时间一般较长,不过一般都在3-5天左右。
从以上的介绍来看,肝纤维化四项指标主要是层粘连蛋白、III型前胶原、IV型胶原、透明质酸酶这四项,因此在进行检查的时候一定要认真的了解这四项指标的数值,看看是否是超过正常值,一旦确诊为预防疾病常识分享,对您有帮助可购买打赏。
Ⅳ型胶原(C-Ⅳ)测定试剂盒(化学发光免疫分析法)产品技术要求huaketai

Ⅳ型胶原(C-Ⅳ)测定试剂盒(化学发光免疫分析法)适用范围:用于体外定量测定人血清中IV型胶原(C-IV)的含量。
1.1 规格
96人份/盒。
1.2主要组成成分
注:校准品靶值批特异,具体浓度详见标签。
质控品质控范围批特异,具体浓度详见标签。
2.1 物理性能
试剂盒的各液体组分应澄明,无沉淀或絮状物;
包被抗体微孔板的铝箔袋,应无破损现象。
2.2 准确度
将已知浓度的Ⅳ型胶原(C-Ⅳ)纯品配制的溶液加入到正常血清中,其回收率应在90%~110%之间。
2.3 线性
在[46,1075]μg/L范围内,用Log(x)-Log(y)模型拟合,剂量-反应曲线相关系数(r)应不低于0.9900。
2.4 批内精密度
用不同浓度的样本各重复检测10次,其变异系数(CV)应不大于15%。
2.5 批间相对极差
用三个批号试剂盒检测同一样本,则三个批号试剂盒之间的批间相对极差(R)应不大于20%。
2.6 空白检测限
空白检测限应不高于23.0μg/L。
2.7 特异性
表2 与LN, HA的交叉反应
2.8校准品溯源性
根据GB/T 21415-2008的有关规定,提供所用校准品的来源、赋值过程及测量不确定度等内容,溯源至企业工作校准品,并与已上市产品比对赋值。
2.9质控品赋值有效性
同一套质控品的测定结果应在本试剂盒规定的范围内。
2.10 稳定性
2℃~8℃保存,有效期12个月,到效期后3个月内进行测定,符合2.2、2.3、2.4、2.6的要求。
III型前胶原N端肽(PIIINP)测定试剂盒(磁微粒化学发光免疫分析法)产品技术要求runnuosi
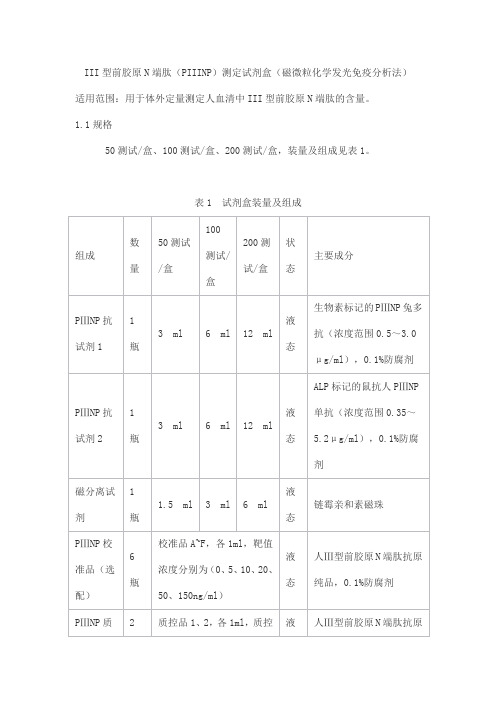
III型前胶原N端肽(PIIINP)测定试剂盒(磁微粒化学发光免疫分析法)适用范围:用于体外定量测定人血清中III型前胶原N端肽的含量。
1.1规格50测试/盒、100测试/盒、200测试/盒,装量及组成见表1。
表1 试剂盒装量及组成2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后为均匀悬浊液,无明显凝集;2.1.3 液体组分应澄清,无沉淀或絮状物;2.1.4 包装标签应清晰,无磨损。
2.2准确度将已知浓度的PⅢNP抗原加入到样本中,其回收率应在(85%~115%)范围内。
2.3空白检测限应不大于0.5 ng/ml。
2.4线性在3~100 ng/ml的测量范围内,试剂盒的相关系数r应≥0.99。
2.5重复性用两个质控品作为样本各重复检测10次,其变异系数(CV)应不大于8%。
2.6质控品测值测值应在质控范围内。
2.7批间差用三个批号试剂盒分别检测质控品1和质控品2,两个质控品测定结果的批间变异系数(CV)应不大于15.0%。
2.8分析特异性2.8.1 与层粘连蛋白(LN)不低于浓度为2000ng/ml的LN,在本试剂盒上测定的结果应不高于本试剂盒的空白检测限。
2.8.2与IV胶原(CIV)不低于浓度为2000ng/ml的CIV,在本试剂盒上测定的结果应不高于本试剂盒的空白检测限。
2.8.3 与透明质酸(HA)不低于浓度为2000ng/ml的HA,在本试剂盒上测定的结果应不高于本试剂盒的空白检测限。
2.9稳定性效期稳定性:试剂盒2℃~8℃环境条件储存,避免阳光直射,有效期为12个月,取失效期两个月内的样品检测2.1~2.6,应符合相应要求。
化学发光免疫类体外诊断试剂(盒)产品技术审评要求规范(2017版)1204

化学发光免疫类体外诊断试剂(盒)产品技术审评规范(2017版)本规范旨在指导注册申请人对化学发光免疫类体外诊断试剂(盒)产品注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本规范是对化学发光免疫类体外诊断试剂(盒)产品的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围本规范适用于利用化学发光免疫分析技术对被测物质进行定量检测的第二类体外诊断试剂(包括以微孔板、管、磁颗粒、微珠和塑料珠等为载体的酶促及非酶促化学发光免疫分析测定试剂)的注册技术审查。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号)化学发光免疫类体外诊断试剂(盒)产品分类代号为6840。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)的相关要求。
(二)主要原材料研究资料(如需提供)主要原材料(例如各种天然抗原、重组抗原、单克隆抗体、多克隆抗体以及多肽类、激素类等生物原科,辣根过氧化物酶、碱性磷酸酶等标记用酶、磁微粒及其他主要原料)的选择、制备、质量标准及实验验证研究资料;校准品、质控品的原料选择、制备、赋值过程及试验资料;校准品的溯源性文件,包括具体溯源链、实验方法、数据及统计分析等详细资料。
III型前胶原N端肽测定试剂盒(化学发光免疫分析法)产品技术要求lianzhongtaike

III型前胶原N端肽测定试剂盒(化学发光免疫分析法)适用范围:用于体外测定人血清中III型前胶原N端肽的含量。
1.1产品型号划分说明
规格:96人份/盒
2.1 外观
2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;
2.1.2 液体组分应澄清,无沉淀或絮状物;
2.1.3 包装标签应清晰,易识别;
2.1.4 各组分装量不得低于标示体积。
2.2 准确度
回收率应在 85%-115%范围内。
2.3 空白限
应不大于 1.0ng/mL。
2.4 线性
在[2.5, 100] ng/mL 的测量范围内,相关系数 r 应≥0.9900。
2.5 重复性
变异系数(CV)应不大于 10%。
2.6 批间差
变异系数(CV)应不大于 15.0%。
2.7试剂盒与表2中有关潜在交叉反应物应无显著的交叉反应
2.8稳定性
该试剂盒在2~8℃贮存,有效期为12个月,取到效期后的试剂盒样品进行检测,检测结果应符合2.2、2.3、2.4、2.5的要求。
2.9溯源性:
依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源到安图的校准品,详见附录A。
IV型胶原(C-IV)测定试剂盒(电化学发光免疫分析法)产品技术要求北京联众泰克

IV型胶原(C-IV)测定试剂盒(电化学发光免疫分析法)产品技术要求北京联众泰克IV型胶原(C-IV)测定试剂盒(电化学发光免疫分析法)适用范围:本试剂盒用于体外定量测定人体血清样本中Ⅳ型胶原(C-IV)的含量。
1.1包装规格:50人份/盒、100人份/盒。
1.2主要组成成分试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(C-IV-Cal)(选配)组成。
组成及含量见下表:注:1、定标品靶值批特异,详见靶值单。
2、试剂盒条码卡内含主校准曲线。
2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;2.1.3 其它液体组分应澄清,无异物,沉淀物和絮状物;2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限应不大于2.0ng/mL。
2.3 准确度将已知浓度的C-IV标准溶液加入到血清中,其回收率应在(85%~115%)范围内。
2.4 线性在[10.0,1000.0]ng/mL范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度2.5.1 批内精密度在试剂盒的线性范围内,测定高、低两个水平的样品,检测结果的变异系数(CV)应不大于8%。
2.5.2 批间精密度在试剂盒的线性范围内,用3个批号试剂盒分别测定高、低两个水平的样品,检测结果的变异系数(CV)应不大于15%。
2.6 效期末稳定性本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.7 特异性2.7.1 与透明质酸(HA)浓度不低于2000.0ng/mL透明质酸(HA),在本试剂盒测定结果应不大于2.0ng/mL;2.7.2 与Ⅲ型前胶原N端肽(PIIINP)浓度不低于2000.0ng/mLⅢ型前胶原N端肽(PIIINP)样本,在本试剂盒测定结果应不大于2.0ng/mL;2.7.3 与层粘蛋白(LN)浓度不低于2000.0ng/mL层粘蛋白(LN)样本,在本试剂盒测定结果应不大于2.0ng/mL。
层粘蛋白检测试剂盒(酶联免疫法)产品技术要求模板

医疗器械产品技术要求编号:层粘蛋白检测试剂盒(酶联免疫法)1.产品型号/规格及划分说明1.1产品型号/规格48人份/盒、96人份/盒。
1.2结构组成试剂盒应包括下列主要部分:包被有LN单抗的微孔板、LN校准品1套A-E(该校准品已标定,浓度为50,100,200,400,600ng/ml)、结合抗体(兔抗人LN多抗)、酶标记物(HRP标记的羊抗兔IgG)、显色剂A(主要成份为过氧化脲)、显色剂B(主要成份为TMB•2HCL)、浓缩洗涤液(25×,主要成份为PBS)、终止液(2MH2SO4)组成。
1.3 适用范围该试剂盒为体外诊断试剂盒,适用于酶标仪,用于临床上定量检测人血清中的层粘蛋白(LN)的含量。
2.性能指标1外观外观应符合如下要求:a) 试剂盒各组份应齐全、完整,液体无渗漏;b) 标签应清晰,易识别。
2液体装量液体试剂最低装量应不小于标示量。
3准确度将已知浓度的层粘蛋白(LN)加入到血清基质中,回收率应在(85%~115%)范围内。
4最低检测限应不大于 50ng/ml。
5线性剂量反应曲线 LN(50~600ng/ml)浓度范围内,试剂盒的相关系数 r 应不低于 0.99。
6重复性用高低 2 个浓度水平的样本各重复检测 10 次,其变异系数(CV)应不大于 15%。
7特异性本试剂盒与透明质酸 HA、Ⅲ型前胶原肽、IV 型胶原无明显交叉反应。
见表 1表 18溯源性校准品应符合 GB/T 21415-2008 要求,层粘蛋白校准品的来源、制备及溯源见附录A。
9批间差用3 个批号试剂盒检测同一份样本,则 3 个批号试剂盒之间的批间变异系数(CV)应不大于 15.0%。
10生物安全性检测LN 校准品应做 HBsAg、抗-HCV、抗-HIV、抗-TP 检测,结果为阴性。
III型前胶原氨基端肽(PIIINP)测定试剂盒 (时间分辨荧光免疫分析法)产品技术要求

III型前胶原氨基端肽(PIIINP)测定试剂盒(时间分辨荧光免疫分析法)适用范围:用于体外定量测定人血清中III型前胶原氨基端肽(PIIINP)的含量。
1.1 规格
本试剂盒包装规格为96人份/盒,具体组成见表1:
表1 试剂盒主要组成成分
2.1物理性能
液体组分应澄清,无沉淀或絮状物。
各组分装量不少于表1中要求。
2.2准确性
回收率应在85%~115%范围内。
2.3线性
用百分结合率对数(Log-Logit)数学模型拟合,在15~800ng/ml范围内,剂量-反应曲线相关系数(r)应不低于0.9900。
2.4精密度
2.4.1批内精密度(CV%)应不高于15%。
2.4.2批间精密度(CV%)应不高于15%。
2.5空白检测限
试剂盒空白检测限应不大于7ng/ml。
2.6 质控品测定值
每次检测结果均应在允许范围之内。
2.7特异性
与层粘连蛋白(LN)、透明质酸(HA)、IV型胶原(CIV)无显著交叉反应。
表1与其它激素的交叉反应数据
2.8稳定性
试剂盒在2~8℃保存12个月,测定结果应符合上述2.1~2.7要求。
Ⅳ型胶原蛋白测定试剂盒(乳胶免疫比浊法)产品技术要求shijiwode
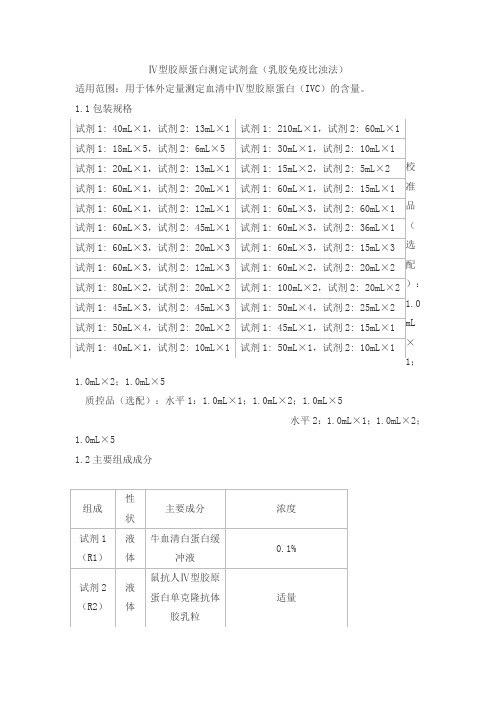
Ⅳ型胶原蛋白测定试剂盒(乳胶免疫比浊法)适用范围:用于体外定量测定血清中Ⅳ型胶原蛋白(IVC)的含量。
1.1包装规格;1.0mL×2;1.0mL×5质控品(选配):水平1:1.0mL×1;1.0mL×2;1.0mL×5水平2:1.0mL×1;1.0mL×2;1.0mL×51.2主要组成成分校准品靶值批特异,详见校准品瓶签。
质控品质控范围批特异,详见质控品瓶签。
2.1 外观试剂1为无色或浅黄色澄清液体,试剂2为乳白色液体。
校准品、质控品为白色冻干粉,复溶后为无色澄清液体。
试剂盒标签标识清晰,外包装完整无损。
2.2 装量试剂液体成分装量不少于瓶签标示量。
2.3 试剂空白在600nm处测定试剂空白吸光度,应≤1.6。
2.4 分析灵敏度测试50ng/mL的被测物时,吸光度变化(ΔA)应≥0.0019。
2.5 空白限试剂盒空白限应≤5ng/mL。
2.6 准确度待检系统与比对系统测值的相关系数(r)不小于0.975;在[5,100] ng/mL区间内绝对偏差不超过±12 ng/mL;在(100,600] ng/mL区间内相对偏差不超过±12%。
2.7 线性2.7.1在[5,600] ng/mL区间内,线性相关系数r≥0.990;2.7.2在[5,100] ng/mL区间内,线性绝对偏差不超过±12 ng/mL;在(100,600] ng/mL区间内,线性相对偏差不超过±12%。
2.8 精密度2.8.1 重复性测试高、低两浓度样本,其结果的变异系数CV≤10%。
2.8.2 批间差随机抽取三批试剂盒,测试同一份样本,批间相对极差(R)应≤15%。
2.8.3 瓶内均匀性校准品、质控品的瓶内变异系数CV应≤10%。
2.8.4 瓶间均匀性校准品、质控品的瓶间变异系数CV应≤10%。
2.9质控品赋值有效性质控品检测结果应在其质控范围内。
Ⅳ型胶原蛋白(ⅣC)测定试剂盒(胶乳免疫比浊法)产品技术要求baiaotaikang
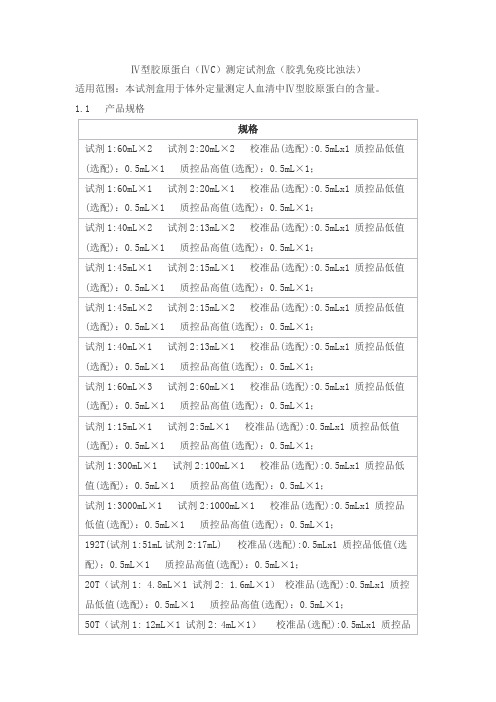
Ⅳ型胶原蛋白(ⅣC)测定试剂盒(胶乳免疫比浊法)适用范围:本试剂盒用于体外定量测定人血清中Ⅳ型胶原蛋白的含量。
1.1 产品规格1.2 组成成分1.2.1 试剂组成试剂1:Tris缓冲液 100 mmol/L试剂2:包被鼠抗人Ⅳ型胶原蛋白单克隆抗体的胶乳悬浊液 0.2%1.2.2校准品的组成校准品为液体,校准品组成是在磷酸盐缓冲液中加入含一定浓度的Ⅳ型胶原蛋白纯品。
1个水平校准品目标浓度为600ng/mL,浓度有批特异性,具体定值详见瓶签。
1.2.3质控品的组成两水平液体质控品,在20g/L牛血清中加入Ⅳ型胶原蛋白纯品。
靶值范围分别为:(10~100) ng/mL、(100~300)ng/mL。
2.1 外观试剂R1为无色至淡黄色澄清液体;试剂R2为乳白色悬浊液;校准品为无色或浅黄色液体;质控品为无色或浅黄色液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 空白吸光度试剂空白吸光度应在0.2~2.0范围内。
2.4 空白限试剂空白限应不大于5ng/mL。
2.5 分析灵敏度测定浓度150 ng/mL的被测物时,吸光度差值(ΔA)应不小于0.004。
2.6 线性测试血清样本,试剂线性在[5,600] ng/mL范围内,ⅣC试剂盒的线性相关系数r应不低于0.9900;在[5,150] ng/mL范围内绝对偏差应不超过±15ng/mL,在(150,600] ng/mL范围内相对偏差应不超过±10%。
2.7 重复性试剂盒测试项目重复性 CV≤10%。
2.8 批间差不同批号之间测定结果的相对极差应≤15%。
2.9 准确度回收实验:回收率在90%~110%。
2.10质控品赋值有效性测定值在质控靶值范围内。
2.11校准品溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至Ⅳ型胶原蛋白纯品(来源:Sigma;纯度≥95%)。
三型前胶原N端肽(PⅢP N—P)测定试剂盒(化学发光法)产品技术要求新产业
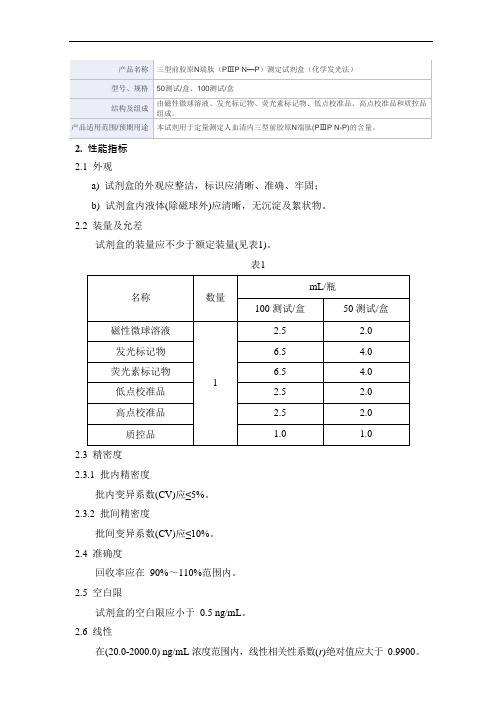
b)试剂盒内液体(除磁球外)应清晰,无沉淀及絮状物。
2.2装量及允差
试剂盒的装量应不少于额定装量(见表1)。
表1
名称
数量
mL/瓶
100测试/盒
50测试/盒
磁性微球溶液
1
2.5
2.0
发光标记物
6.5
4.0
荧光素标记物
6.5
4.0
低点校准品
2.5
2.0
高点校准品
2.5
2.0
质控品
1.0
1.0
2.3精密度
2.3.1批内精密度
批内变异系数(CV)应≤5%。
2.3.2批间精密度
批间变异系数(CV)应≤10%。
2.4准确度
回收率应在90%~110%范围内。
2.5空白限
试剂盒的空白限应小于0.5 ng/mL。
2.6线性
在(20.0-2000.0) ng/mL浓度范围内,线性相关性系数(r)绝对值应大于0.9900。
2.7溯源性
试剂盒的校准品的赋值可溯源到制造商内部校准品。
产品名称
三型前胶原N端肽(PⅢP N—P)测定试剂盒(化学发光法)
型号、规格
50测试/盒、100测试/盒
结构及组成
由磁性微球溶液、发光标记物、荧光素标记物、低点校准品、高点校准品和质控品组成。
产品适用范围/预期用途
本试剂用于定量测定人血清内三型前胶原N端肽(PⅢP N-P)的含量。
2.性能指标
2.1外观
IV型胶原、层粘连蛋白和III型前胶原氨基端肽三联检测定试剂盒的制

专利名称:IV型胶原、层粘连蛋白和III型前胶原氨基端肽三联检测定试剂盒的制备方法
专利类型:发明专利
发明人:袁大丰
申请号:CN202010882813.3
申请日:20200828
公开号:CN111912992A
公开日:
20201110
专利内容由知识产权出版社提供
摘要:本发明公开了IV型胶原、层粘连蛋白和III型前胶原氨基端肽三联检测定试剂盒的制备方法,包括以下步骤:S1:样品垫的制备;S2:结合垫的制备;S3:NC膜的制备;S4:装配。
本发明利用荧光免疫层析技术,采用双抗体夹心法原理进行检测,在层析过程中,样本中的CIV/LN/PIIINP 抗原与结合垫上的荧光微球标记的CIV/LN/PIIINP单克隆抗体反应形成复合物,在层析作用下沿着硝酸纤维素膜向前移行至检测区域,被硝酸纤维素膜上包被的另一株CIV/LN/PIIINP单克隆单克隆抗体捕获并形成复合物沉积在T区,在激发光源的作用下,荧光物质发射特定波长的荧光信号,荧光免疫分析仪俘获荧光信号,通过信号转化及设定的定标曲线自动转化为定量数值。
申请人:河北国高生物科技有限公司
地址:071000 河北省保定市新市区华光路123号1-501
国籍:CN
代理机构:北京中仟知识产权代理事务所(普通合伙)
代理人:田江飞
更多信息请下载全文后查看。
Ⅲ型前胶原、Ⅳ型胶原、透明质酸及层粘连蛋白在诊断肝纤维化中的意义

Ⅲ型前胶原、Ⅳ型胶原、透明质酸及层粘连蛋白在诊断肝纤维化中的意义潘继承;朱建一;吕志刚;孙宏伟【期刊名称】《临床检验杂志》【年(卷),期】2005(23)2【摘要】目的探讨血清Ⅲ型前胶原(PCⅢ)、Ⅳ型胶原(CⅣ)、透明质酸(HA)及层粘连蛋白(LN)的测定在诊断肝纤维化中的意义.方法用放射免疫法检测263例慢性乙型肝炎、67例急性乙型肝炎、27例肝硬化及20例健康人血清PCⅢ、CⅣ、HA 及LN,并进行了统计学分析.结果中度、重度慢性乙型肝炎及肝硬化的4项指标定量结果均高于对照组、急性乙型肝炎及轻度慢性乙型肝炎(P<0.001).4项指标联合检测显示,重度慢性乙型肝炎及肝硬化的阳性率(84.3%与88.9%)显著高于其他组别.结论联合检测血清PCⅢ、CⅣ、HA及LN水平对诊断肝纤维化有较大意义.【总页数】2页(P143-144)【作者】潘继承;朱建一;吕志刚;孙宏伟【作者单位】江苏省省级机关医院,南京,200024;江苏省省级机关医院,南京,200024;江苏省省级机关医院,南京,200024;东南大学附属中大医院,南京,210009【正文语种】中文【中图分类】R575.2【相关文献】1.血清透明质酸、Ⅲ型前胶原、Ⅳ型胶原、层粘连蛋白水平与肝纤维化的关系 [J], 徐隆长;汤雄2.联合检测Ⅲ型前胶原、层粘连蛋白、Ⅳ型胶原及透明质酸在间质性肺疾病诊断中的临床意义 [J], 顾红艳;葛娟;何鲜;印希;卫钰琳;李惠萍3.血清透明质酸、Ⅲ型前胶原、Ⅳ型胶原、层粘连蛋白水平与肝纤维化的关系 [J], 汤雄;石秋生;徐贞秋4.血清透明质酸、Ⅲ型前胶原、Ⅳ型胶原及层粘连蛋白联合检测对肝纤维化程度判断的意义 [J], 陈洪海;沈玉琴5.血清透明质酸、Ⅲ型前胶原、层粘连蛋白、Ⅳ型胶原对肝纤维化的诊断意义 [J], 冯继红;刘文芝;刘玲;綦盛麟;马骏因版权原因,仅展示原文概要,查看原文内容请购买。
磁微粒化学发光法的肝纤四项检测限与功能灵敏度研究

磁微粒化学发光法的肝纤四项检测限与功能灵敏度研究刘玉文;蒋长斌【摘要】目的评价磁微粒化学发光法检测肝纤维化血清学标志物(透明质酸、层粘连蛋白、Ⅲ型前胶原N端肽、Ⅳ型胶原)的空白限、检出限和功能灵敏度.方法参照美国临床和实验室标准化协会(Clinical and Laboratory Standards Institute, CLSI)文件,利用空白样品及系列梯度稀释样品在AutoLumo A2000全自动化学发光测定系统上进行检测,确定该方法配套试剂的空白限、检出限及功能灵敏度.结果透明质酸的空白限为7.59ng/mL、检出限为16.17ng/mL、20%变异系数(coefficient of variation,CV)功能灵敏度为18.72ng/mL;层粘连蛋白的空白限为1.38ng/mL、检出限为3.53ng/mL、20% CV功能灵敏度为4.16ng/mL;Ⅲ型前胶原N端肽的空白限为0.89ng/mL、检出限为2.40ng/mL、20% CV功能灵敏度为2.48ng/mL;Ⅳ型胶原的空白限为2.42ng/mL、检出限为6.49ng/mL、20%CV功能灵敏度为9.21ng/mL.结论全自动化学发光测定肝纤四项的空白限、检出限和功能灵敏度的建立为临床诊断和治疗提供了更有价值的信息.【期刊名称】《标记免疫分析与临床》【年(卷),期】2016(023)002【总页数】3页(P213-215)【关键词】肝纤维化;磁微粒化学发光法;空白限;检出限;功能灵敏度【作者】刘玉文;蒋长斌【作者单位】三峡大学第一临床医学院,湖北省宜昌市中心人民医院检验科,湖北宜昌443003;三峡大学第一临床医学院,湖北省宜昌市中心人民医院核医学科,湖北宜昌443003【正文语种】中文肝纤维化是紧随肝细胞破坏之后的自身修复过程,是慢性肝病发展为肝硬化的必经之路,其实质是细胞外基质(extracellular matrixc,ECM)合成与降解失衡,导致ECM尤其是胶原在肝内的过度增加和沉积[1-2]。
血清转化生长因子-β1、Ⅳ型胶原、透明质酸及Ⅲ型前胶原N端肽对判断肝硬化程度的临床意义

血清转化生长因子-β1、Ⅳ型胶原、透明质酸及Ⅲ型前胶原N 端肽对判断肝硬化程度的临床意义徐银海;陶良萍【期刊名称】《徐州医学院学报》【年(卷),期】2007(027)002【摘要】目的探讨血清转化生长因子-β1(TGFβ1)、Ⅳ型胶原(IVC)、透明质酸(HA)及Ⅲ型前胶原N端肽(PⅢNP)的浓度与肝硬化的关系.方法以ELISA方法检测血清TGFβ1和IVC的浓度,采用放射免疫法检测血清HA和PⅢNP的浓度.结果肝硬化组血清TGFβ1、IVC、HA及PⅢNP的浓度明显高于正常组;在肝硬化组中,血清TGFβ1的浓度与其他分子之间并不存在明确的相关性,而IVC、HA和PⅢNP相互之间却存在着明显的相关性;血清TGFβ1浓度在肝硬化A、B、C级组之间并没有显著性差异;IVC、HA及PⅢNP在C级组肝纤维化患者血清中的浓度明显高于其他组,B级组肝硬化患者血清中的浓度也明显高于A级组.结论TGFβ1、IV型胶原(IVC)、透明质酸(HA)及Ⅲ型前胶原N端肽(PⅢNP)作为非创伤性肝纤维化标志物,对判断肝硬化及其发展程度具有重要意义.【总页数】3页(P96-98)【作者】徐银海;陶良萍【作者单位】徐州医学院附属医院检验科,江苏徐州221002;滁州市第二人民医院检验科,安徽滁州239000【正文语种】中文【中图分类】R446.1【相关文献】1.血清Ⅰ型前胶原氨基端前肽、Ⅰ型前胶原羧基端前肽、Ⅰ型胶原羧基端肽在骨转移性癌诊断中的应用 [J], 王抒;张军宁;乔田奎2.益气温阳活血方对慢性心力衰竭心室重塑大鼠β3-肾上腺素能受体、血清Ⅰ型前胶原羧基端肽和Ⅲ型前胶原氨基端肽的影响 [J], 杨冬花;顾广富;罗建华3.血清Ⅰ型前胶原羧基端肽和Ⅲ型前胶原氨基端肽预测充血性心力衰竭药物疗效的临床价值 [J], 孙亚宁;王爱红;李秀菊;曹春林;朱兴雷4.急性心肌梗死患者血清Ⅰ型前胶原羧基端肽及Ⅲ型前胶原氨基端肽的变化及意义 [J], 陈玲;揭育丽5.血清透明质酸、Ⅲ型前胶原、Ⅳ型胶原及层粘连蛋白联合检测对肝纤维化程度判断的意义 [J], 陈洪海;沈玉琴因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
透明质酸/层粘连蛋白/Ⅳ型胶原/Ⅲ型前胶原N端肽质控品
组成:
适用范围:本品适用于使用厦门万泰凯瑞生物技术有限公司的透明质酸测定试剂盒(化学发光微粒子免疫检测法)、层粘连蛋白测定试剂盒(化学发光微粒子免疫检测法)、Ⅳ型胶原测定试剂盒(化学发光微粒子免疫检测法)和Ⅲ型前胶原N 端肽测定试剂盒(化学发光微粒子免疫检测法)进行临床检测时的实验室内部质量控制。
2.1 外观
试剂(盒)各组分应齐全、完整;标签应清晰,包装无破损。
质控品冻干品应为粉末,复溶后液体应澄清透明。
2.2 质控品赋值有效性
检测结果应该在质控范围内。
2.3 瓶间差
瓶间变异系数应不高于15%。
2.4 瓶内均匀性
瓶内变异系数应不高于10%。
2.5 稳定性
2.5.1 复溶稳定性
原包装质控品在开瓶完全复溶后,置于2℃~8℃条件下保存。
放置72小时后进行检测,结果应符合2.2项的规定。
2.5.2 效期稳定性
原包装质控品在2℃~8℃的条件下储存,有效期为36个月。
取效期末产品进行检测,结果应符合2.1,2.2,2.4项的规定。
