新第二章 化学热力学初步完
化学热力学初步(无机化学) ppt课件
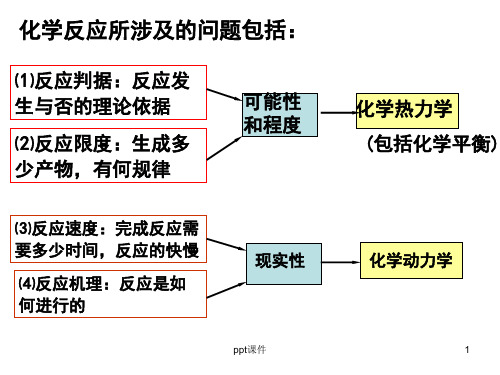
5
2. 局限性:
不知道反应的机理、速率和物质的微观性质,只
讲可能性,不讲现实性。
ppt课件
5
3.2 热力学基本概念
一、体系和环境
体系:被研究的直接对象 环境: 体系外与其密切相关的部分
ppt课件
6
体系类型:根据体系与环境的关系
敞开体系:与环境有物质交换也有能量交换 封闭体系:与环境有能量交换无物质交换
转动能,平动能,电子动能及核能,电子与电子间的势
能,电子与核间的势能等。
特点:“热力学内能”是状态函数。
现还无法求出体系热力学内能的绝对值;但能测定到
ppt课件
20
2. 热力学第一定律内容
一个封闭体系,处于一种特定的内能状态U1。若这 个体系吸收一定的热量Q, 同时环境对体系做功W, 这 个体系则达到一个新的内能状态U2
量传递的方向,是由体系的观点 体
Q﹤
系
出发的;
ppt课件
w﹥
w﹤
功 18
3.3 热力学第一定律及反应热
一、研究基础
1. 热功当量 即: 1 cal = 4.1840 J
为能量守恒原理提供了科学的实验证明。
2. 能量守恒定律
1850年,科学界公认能量守恒定律是自然界的普遍规 律之一。能量守恒与转化定律可表述为:
375 K,506.5 kPa
终态
实际过程与完成过程的不同途径
ppt课件
14
五、热和功: 体系状态变化过程中的能量表现形式
热:体系与环境之间因温度不同而交换或传递的能量 称为热(Q)。
Q>0, 体系吸收热量 , Q<0, 体系释放热量 功: 除热之外,体系与环境之间以其它形式交换或传递 的能量称为功(W)。
第二章 化学热力学初步

热力学规定: 系统从环境吸热,Q为正值,放热Q为负值。 系统对环境作功,W为负值,反之W为正值. 等压过程中,系统膨胀对外作体积功: W = - p外(V2 - V1 ) = - p外△V
2.2 热力学第一定律
热力学第一定律:自然界的一切物质都 具有能量,能量有不同的形式,能量可从 一个物体传递给另一个物体,也可从一种 形式转化为另一种形式,在传递和转化过 程中,能量总值不变。
∵
U2 + P2V2 = H2 U1 + P1V1 = H1
∴
Qp = H终 – H始 = H2 – H1 = △ H Qp =△H △ H = △ U + P △V
(条件:封闭体系,不做其它功,等压过程) 条件:封闭体系,不做其它功,等压过程)
如果有气体参与反应: 如果有气体参与反应: Qp =QV+△ngRT 或 △H=△U + △ngRT △
(3)反应热的数值与反应方程式的写法 ) 有关。 有关。如:
N2(g) + 3H2(g) = 2NH3(g) △rHm = -92.38 kJ.mol-1
1/2N2(g)+3/2H2(g)=NH3(g) △ H = -46.19 kJ.mol-1 r m
2.3.4 热化学定律
1. 可逆反应中正逆反应的反应热的数值相 等而符号相反。 等而符号相反。 Qp正 = -Qp逆 逆 QV正 = -QV逆 正 逆
等压反应热: 等压反应热:
QP = △ H
各物质都处于标准状态下的反应热称 为标准反应热。符号 △rHm ,r表示反应( 表示反应( 标准反应热。 reaction), reaction),m代表反应进度ξ= 1mol, 表示反应是在标准态下进行。 表示反应是在标准态下进行。 的意义:反应进度ξ=1mol时的 时的 △rHm 的意义:反应进度 焓变值。 焓变值。
化学热力学

第 二 章 化 学 热 力 学 初 步
3、掌握化学反应的标准摩尔焓变(standard molar enthalpy change)的各种 计算方法;(标准生成热( standard heat of formation )、燃烧热 (standard heat of combustion)。)
4、掌握化学反应的标准摩尔熵变(standard molar entropy change)和标 准摩尔吉布斯自由能变(standard molar Gibbs free energy change) 的计算方法; 5、会用ΔG来判断化学反应的方向,并了解温度对ΔG的影响。
不 可 逆 途 径 和 可 逆 途 径 的 功 和 热
第 二 章 化 学 热 力 学 初 步
2.1 热力学第一定律
*对于理想气体来说,热力学能U只是温度的函数,
第 二 章 化 学 热 力 学 初 步
根据热力学第一定律,比较不同途径时的功和热, 必然有如下结论: 理想气体恒温膨胀过程中,以可逆途径进行 时,体系对环境做的功最大,吸收的热量最多; 恒温压缩过程中,以可逆途径进行时,环境对体 系做的功最小,体系放出的热量最少。
2.1 热力学第一定律
3. 过程和途径(process and pathway)
方式 途径 过程 状态
第 二 章 化 学 热 力 学 初 步
基 本 概 念
过程 状态1 途径1 状态2
途径2
平衡状态
2.1 热力学第一定律
热力学中常见的过程 等温过程(isothermal process) :T1=T2=T环 等压过程(isobaric process):p1=p2=p环 等容过程(isochoric process):V1=V2 绝热过程(adiabatic process):Q=0 循环过程(cyclic process): 可逆过程*(reversible process):它是一种在无限接近于 平衡,并且没有摩擦力条件下进行的理想过程。 自发过程 (spontaneous process) : 一定条件下,自动进 行的过程。
第二章 化学热力学初步

§2-2 热力学第一定律
一、功与热 是体系与环境之间能量交换的两种方式,是过程 量,没有过程就没有能量的传递。 热Q(heat):热力学中,由于温差而引起传递的能量。 : 功W(work):热力学中,除热以外,各种被传递的能 : 量。如电功、机械功、表面功等. (功=体积功+非体积功) 功 功和热不是状态函数,与过程有关。 功和热不是状态函数
热力学上常见的几种过程: 等压过程(isobaric process): 等压过程 : 体系压力始终恒定不变。 (如敞开容器中进行的反应) 等容过程(isochoric process): 等容过程 : 体系体积始终恒定不变。 (如体积不变的密闭容器进行的反应) 等温过程(isotheemal process):只要求T始 = T终 等温过程 :
3.过程和途径 (process and rood) . 体系的状态发生变化,从始态到终态,我们说体系 经历了一个热力学过程,简称过程 过程;完成这个过程的 过程 具体步骤称途径 途径
298K, H2O(g) 途径1 298K,H 298K, 2O(l) 始态 373K,H 373K, 2O(l) 途径2 途径 373K,H 373K, 2O(g) 终态
已知 (1) C(石墨 + O2(g) → CO2(g) 石墨) 石墨 = △rHm(1) -393.5 kJ.mol-1 (2) CO(g) + 1/2 O2(g) → CO2(g) = △rHm(2) -282.9 kJ.mol-1 C(石墨) + O2(g) (石墨) 石墨 始态) (始态) △rHm =? ? △rHm(1) CO2(g) 终态) (终态) △rHm (2)
第二章 化学热力学初步 (Thermodynamics)

2、功(W):除热以外的其它能量传递形式叫功。 体积功:体系体积变化反抗外力的 功(膨胀功)。 非体积功(电功、表面功) 注意:1、一般,化学反应中体系只作体积功。 2、热和功不是状态函数。因为其大小 与过程进行的途径有关。
注意:焓变是容量性质,与物质的量有关, 计算时应注意化学式前的系数。
例
(1) C(s) O2 (g) CO2 (g)
rH 393.5kJ
m1
1 (2) CO(g) O 2 (g) CO2 (g) rH m2 283.0kJ 2
1 (3) C(s) O 2 (g) CO(g) 求 rH m 3 ? 2 解: 即(1)-(2)=(3)则状态函数ΔrHmθ3
S
r
T
r-reversible,又叫可逆过程热温熵
三、热力学第二定律 1、第二定律的文字与数学表述: 在孤立体系的任何自发过程中,体系的熵 总是增加的。即ΔS(孤立)> 0 真正的孤立体系是不存在的,但若把与体 系有物质和能量交换的那部分环境也包括进去 组成一个新的体系,则这个新体系可算作为孤 立体系。此时,原体系 ΔS(体系)+ ΔS(环境)> 0
第三节 热化学(Thermochemistry)
一、等容反应热、等压反应热和焓的概念(Enthalpy) 在化学反应中,反应物为体系的始态,产物为体系的 终态。反应物和产物内能总和是不同的,反应后,体系总 内能会发生改变。其改变量是以热和功的形式表现出来的。 这就是反应热产生的原因。
1、等容反应热(QV) 等容下反应ΔV=0,则体系不做体积功W=0。
第二章 化学热力学初步
第二章化学热力学初步

分子间的作用力
两个忽略:
分子本身的体积
P不很高(与大气压相比)
两个条件:
T不很低(与273.15K相比)
理想气体状态方程式
pV=nRT
R---- 摩尔气体常量 在STP下,p=101.325kPa, T=273.15K n=1.0mol时, Vm=22.414L=22.414× 10
-3m3
理想气体状态方程式的应用
因而 U = QV + W = QV = U2 U1
即恒容过程中系统的热量变化全部用来
改变系统的热力学内能。
2. 恒压反应热Qp与焓变H
Qp: 在等温条件下,系统在恒压不做非体积功的过 程中的化学反应热效应。
注:由于大多数化学反应在恒压下进行,一般反应热效应不 特别注明均为恒压反应热Qp。 由热力学第一定律得:U = Qp pV Qp = U + pV = (U2 U1) + p (V2 V1) = (U2 + p2V2) (U1 + p1V1) 定义 : 所以 H = U + pV Qp = H2 H1 = H (焓变)
2.2.2 盖斯定律
在不做其它功并处于恒容或恒压的情况下, 任一化学反应,不论是一步完成的,还是分几步 完成的,其化学反应的热效应总是相同的。
即化学反应热效应只与始、终状态有关而与具体 途径无关。 若恒温恒压: Qp = H = H2 H1 若恒温恒容: QV = U = U2 U1 讨论恒压反应: H1 A+B 始态 C+D G
E+F 终态
H5
H+I
根据盖斯定律有: H1 = H2 + H3 = H4 + H5 + H6
大学化学课件-第二章化学热力学初步

系统放热:Q 0
功:系统与环境之间除了热以外其它所有被传递
的能量,称为功,用W表示。 规定:系统对环境做功:W 0
环境对系统做功:W 0
功的分类:体积功和非体积功
体积功:在反抗外力下,因系统体积变化而与环境
交换的功。
非体积功:除了体积功以外其它形式的功,如电功
当系统作体积功时,设系统压力为p,恒定外压下膨
胀做功,体积变化为 V 则 W = - p· V
例 :给一封闭体系加热500 J,体系内理想气 体膨胀做功,外压恒定为101.325 kPa, 气体体 积胀大了1.0升,则体系内能变化多少?
解:已知 Q = 500J P = 101.325kPa V=1.0dm3
目的 1) 研究化学反应的可能性;能量变 化;最大限度。
科学工作者常提出以下问题:
1)正反应能否自发进行。
△rGmø﹤0自发——判断反应进行的方向
2)正反应能否进行到底(K) ——确定反应的 限度;
3)△rHm﹤0, △rHm﹥0 —— 确定反应过
程的能量转换——放热?吸热?
一、系统和环境
系统:被研究对象,由分子、原子和离子等组成。
(3)
始态 (2) 终态
w1= w2 = w3
(1)
2.2.2热力学能(U)
体系内部所有粒子除整体运动的动能和势能外各种能量的 总和,称热力学能或内能。是物质的一种属性,由物质所 处的状态决定。
U = Utr + Urot + Urib + Uel + U分子间 + U静止
平动 转动 振动 电子运动
状态一定,则体系的状态函数一定。体系的一个或几个 状态函数发生了变化,则体系的状态发生变化。
安徽高中化学竞赛无机化学第二章 化学热力学初步

安徽高中化学竞赛无机化学第二章化学热力学初步第二章化学热力学初步2. 1. 01 体系、环境和宇宙:化学热力学中将研究的对象称为体系。
除体系以外的其他部分称为环境。
体系和环境放在一起,在热力学上称为宇宙。
2. 1. 02 三种不同的热力学体系:①封闭体系:和环境之间有能量交换而无物质交换的封闭体系。
②敞开体系:和环境之间既有能量交换,又有物质交换的体系称为敞开体系。
③孤立体系:和环境之间既无物质交换,又无能量交换的体系称为孤立体系。
2. 1. 03 状态函数:描述和确定体系状态的物理量,称为状态函数。
状态一定,则体系的状态函数一定。
体系的状态函数发生了变化,则体系的状态发生变化。
2. 1. 04 量度性质和强度性质:某些状态函数,如V,n等所表示的体系的性质有加和性。
V,n等性质称为体系的量度性质。
某些状态函数,如T,p,以及密度 等性质不具有加和性,称为体系的强度性质。
2. 1. 05 过程和途径:体系的状态发生变化,从始态到终态,则称体系经历了一个热力学过程,简称过程。
若体系的始态、终态的压力和环境的压力等于一个恒值,则称体系的变化为“恒压过程”。
同样可以理解“恒温过程”和“恒容过程”。
若体系变化时和环境之间无热量交换,则称之为“绝热过程”。
完成一个热力学过程,可以采取多种不同的方式。
每一种具体方式,称为一种途径。
过程注重于体系的始态和终态,而途径注重于具体方式。
状态函数的改变量,取决于始态和终态。
在同一过程中,不管途径如何不同,状态函数的改变量均一致。
2. 1. 06 热力学能:2. 2. 02 热力学第一定律在化学反应中的表达形式:化学反应中,体系的热力学能的改变量写成∆r U(下标r是英语中反应一词reaction的字头),它等于生成物的U生减去反应物的U反由第一定律∆r U= Q+ W故有U生-U反= Q+ W2. 2. 03 恒容反应的热效应:恒容反应的热效应全部用来改变体系的热力学能。
《化学热力学初步》课件

现代化学热力学与计算机模拟技术相 结合,为复杂化学反应和过程的研究 提供了强大的工具。
随着实验手段的进步,多组分系统、 溶液、非理想气体以及高分子系统的 热力学研究逐渐发展起来。
目前,化学热力学正朝着跨学科方向 发展,与生物学、材料科学等领域相 互渗透,为解决实际问题提供更多可 能性。
自主学习建议
提供进一步学习热力学的资源 和方法,鼓励学生自主学习, 深入探究热力学原理。
实践环节建议
针对课程内容,提出相应的实 验和实践环节建议,促进学生 理论与实践相结合,提高实践
能力。
THANKS
感谢观看
焓变的计算可以通过已知 的焓值和反应系数进行计 算,也可以通过实验测定 。
影响因素
焓变的大小受反应温度、 压力、物质性质等多种因 素影响。
化学反应的熵变
熵变
熵变是化学反应过程中体系混乱 度的变化,用于衡量反应自发性
的方向。
计算方法
熵变可以通过已知的熵值和反应系 数进行计算,也可以通过实验测定 。
影响因素
《化学热力学初步》ppt课件
目 录
• 化学热力学简介 • 热力学基本概念 • 化学反应的热力学分析 • 热力学在化学中的应用 • 热力学与环境科学 • 总结与展望
01
化学热力学简介
化学热力学的定义
化学热力学是研究化 学反应和物理变化过 程中能量的转化和平 衡的学科。
化学热力学为化学反 应和过程的设计、优 化和控制提供了理论 依据。
热力学过程
01
02
03
等温过程
系统温度保持不变的过程 。等容过程Βιβλιοθήκη 系统体积保持不变的过程 。
新第二章化学热力学初步完PPT[优选版]
![新第二章化学热力学初步完PPT[优选版]](https://img.taocdn.com/s3/m/5dfab7c62af90242a995e5e5.png)
解:(1)式×4-(2)式得(3)式: rHm3= 4×rHm1- rHm2= 676kJ·mol-1
2.3.4 生成焓(生成热)
摩尔生成焓:由指定的稳定的元素单质生成1mol某物质 时的热效应(焓变)叫做该物质的生成焓。
盖斯定律
描述反应体系“热值”(性质)大小的物理量
“焓”,随反应状态而定,其变量H(反应焓变)
取决始末态,变量与途径无关。热焓值属性对应的 物理量焓为状态函数。(U,H,S,G是状态函数;Q,W 不是状态函数,其变量与反应途径有关)
总反应热等于各分步反应热之和。
H 只与始态(反应物)及终态(生成物)
温度任意,不指明即为常温298K
设置化学标准态目的在于反映出仅由物 质本性决定的物质属性或反应性的差别
Na(s) + 1/2Cl2(g) NaCl(s) r Hm = - 411.2 kJ·mol-1
C(石墨,s) + 2 H2(g) +1/2 O2(g) CH3OH(l) r Hm = -239.1kJ·mol-1
热力学能U (内能 )——在确定状态下系统内部一切能 量的总和(分子平动能、转动能、振动能、 位能、 核能、键能等)。物质状态确定其内能值一定,化学 反应内能值变化等于生成物与反应物内能的差值。 U = U2- U1 化学反应内能值变量U只取决于反应 始末态与反应的具体途径无关。(如葡萄糖生化氧化 与直接燃烧;锌直接还原铜离子的反应与电池反应)
此时,T转≈ H 298/ S 298
T转≥ H 298/ S 298
无机及分析化学 第二章 化学热力学初步

4、可逆过程和最大功 U是状态函数,Q和W不是状态函数。
2.3热化学
一、焓的概念 1、反应热:当系统发生化学变化后,并使生成物的 温度回到反应前反应物的温度(即等温过程),系 统放出或吸收的热量叫做这个反应的反应热。等温 过程系统的热变化叫做反应热。 2、等容反应热 △V=0。 系统不做体积功,即W=0。 由热力学第一定律,则,QV =△U–W =△U。 这说明,系统吸收或放出的热量QV(右下标表示等容 过程)全部用来增加或减少系统的热力学能。
2、热化学方程式 (1)热化学方程式:表示化学反应与其热效 应关系的化学反应方程式。
(2)说明:
三、盖斯定律 1、盖斯定律:不管化学反应是一步完成还是 分步完成,其热效应总是相同的。
2、应用:
四、生成焓
1、生成焓:由元素的指定单质生成1mol某
物质时的热效应叫做该物质的生成焓。 2、标准生成焓:如果生成反应在标准态和指 定温度(通常为298K)下进行,这时的生成 焓称为该温度下的标准生成焓。用 表 示。
2.5 吉布斯自由能及其应用
1、吉布斯自由能(自由焓) 1878年美国物理学家吉布斯根据 及T对反 应自发方向的影响,提出了一个新的热力学函数— —自由焓G。 定义为:G=H-TS ,是状态函数。 过程的自由能变ΔG=ΔH-TΔS (KJ/mol) 推导过程: 1)传入环境的热量等于传入系统热量的负值, 即Q环= - ΔH系 又由于ΔS=Qr/T(等温过程熵变的公式) 所以ΔS环=Q环/T= - ΔH系/T
3、物质标准熵的大小有如下的规律: (1)同一物质熵值大小次序是:气态>>液态> 固态; (2)聚集态相同,复杂分子比简单分子有较 大的熵值; (3)结构相似的物质,相对分子质量大的熵 值大; (4)相对分子质量相同,分子构型复杂,熵 值大; (5)物质的熵值随温度升高而增大,气态物 质的熵值随压力增高而减小。
第2章 化学热力学初步(习题解)

第二章化学热力学初步1. 热力学第一定律WU-=Q∆,由于U为状态函数,所以Q和W也是状态函数,对吗?为什么?答:不对。
Q和W只有在能量交换的时候才会有具体的数值,并且随途径不同,共和热的数值都会有变化,所以不是状态函数。
2. 解释下列名词(1) 体系与环境(2) 热(Q)(3) 功(W)(4) 焓(H)和焓变(H∆)(5) 热力学能U(6) 恒容反应热(Q V)和恒压反应热(Q p)答:(1) 热力学中称研究的对象为体系,称体系以外的部分为环境。
(2) 体系在变化过程中吸收的热量为Q。
(3) 体系对环境所做的功。
(4) H=U+PV当泛指一个过程的时候,其热力学函数的改变量为焓变。
(5) 体系内一切能量的总和叫热力学能。
(6) 在恒容过程中完成的化学反应,其热效应称为恒容反应热。
在恒压过程中完成的化学反应,其热效应称为恒压反应热。
3. 什么叫状态函数?它具有何特性?答:藉以确定体系状态的物理量称为体系的状态函数。
它具有加和性。
4. 何谓热效应?测量方法有哪两种?答:化学反应的热效应为当生成物和反应物的温度相同时,化学反应过程中的吸收或放出的热量。
可以选择恒压和恒容两种条件下测量。
5. 什么叫热化学方程式?书写热化学方程式要注意哪几点?答:表示出反应热效应的化学方程式叫做热化学方程式。
书写化学方程式时要注意一下几点:(1)写热化学方式式,要注意反应的温度和压强条件,如果反应是在298K和1.013×105Pa下进行时,习惯上不予注明。
(2)要注明物质的聚集状态和晶形。
(3)方程式中的配平系数只是表示计量数,不表示分子数。
但计量数不同时,同一反应的反应热数值也不同。
6. ①无机化学中常用的反应热有哪几种?反应热的实质是什么?什么类型的化学反应Q V=Q p?等摩尔的NaOH和NH3·H2O溶液分别与过量的HCl溶液中和所放热量是否相等?为什么?②反应2N2(g)+O2(g)=2N2O(g)在298K时,ΔrH mø=164K J·mol-1, 求反应的ΔU?答:①无机化学中常用的反应热有恒压反应热和恒容反应热。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
rHm,298= -241.8 kJ·mol-1
H2(g) + 1/2O2(g) → H2O(l)
rHm,298= -286 kJ·mol-1
2 H2(g) + O2(g) → 2 H2O(g)
rHm,298= -483.6 kJ·mol-1
说明:rHm,298为反应的标准摩尔焓变,下标m表
时的吉布斯自由能变,叫做该物质的标准生成吉布斯 自由能。 说明: 1)温度若不特别指明即为298 K; 2)稳定单质的标准生成吉布斯自由能为零。 3)fGm可查书后附录二。
用fGm计算反应的rGm
rGm=ΣνBfGm(B)= 生成物-反应物
例2-6 (p.36):计算下列反应在298 K时的rGm
3
-
常温时 - 常温下自发
-
高温时 + 高温时不自发
4
+
常温时 + 常温下不自发
+
高温时- 高温时自发
H - TS = H2-H1-(T2S2-T1S1) = ( H2-T2S2 ) - ( H1-T1S1) =G2-G1=G
2.5.1 吉布斯(Gibbs)自由能
G = H - TS 吉布斯-赫姆霍兹方程,
ST 称为该物质在T K时熵的绝对值 1mol某纯物质在标准状态下的熵值称为该物质的标
准摩尔熵,并以符号Sm表示,单位:J·mol-1·K-1
注意:水合离子的标准熵的确定是令H+(aq)的标准 熵为零,导致有的水合离子的标准熵为负。
标准熵的数值见书后附录二。 比较物质标准熵的数值可知有如下规律: (1)同一物质所处的聚集状态不同,熵值大小顺序
功:反应体系与环境之间除了热以外其它所有传递的能量 称为功,用W表示。 化学反应常见压缩膨胀体积功和电功
规定:反应体系对环境做功:W 0 (膨胀;电池) 环境对反应体系做功:W 0 (压缩;电解)
反应体系获得能量为“正”;失去能量为“负”。
2.3 热 化 学 2.3.1 等容反应热、等压反应热和焓的概念 反应热(等温反应过程热效应):化学反应变化后,使
等温过程的熵变计算式:S = Qr / T, Qr为可逆过程的热效应
2.4.3 热力学第二定律
2.4.4 标准摩尔熵
热力学第三定律:在0K时,任何纯物质的完美晶体 的熵值为零,记为S0 = 0
此时分子任何无热运动无热混乱度,系统完全有序无 位置混乱度。
如果将某纯物质的温度从0 K升高到T K,该过程中 熵的变化为:S = ST - S0= ST
为: 气态 >> 液态>固态
H2O(g)[188.7] H2O(l)[69.91] H2O(s)[39.93] (2)聚集状态相同,复杂分子比简单分子有较大的
熵值
O(g)[160.95] O2(g)[205.0] O3(g)[238.8]
(3)结构相似的物质,相对分子量大的熵值大
F2(g)[202.7] Cl2(g)[223] Br2(g) [245.3] I2(g)[260.58] (4)相对分子量相同,分子构型复杂,熵值大。
C6H12O6(s) + 6O2(g) = 6CO2(g) + 6H2O(l)
解:查附录二得各化合物的fGm如下:
-ΣνBfGm(反) C6H12O6(s) O2(g) CO2(g) H2O(l)
fGm/(kJ·mol-1) -910.5 0 -394.4 -237.2
rGm = [6×(-394.4)+6×(-237.2)] -[(-910.5)+0]
取决始末态,变量与途径无关。热焓值属性对应的 物理量焓为状态函数。(U,H,S,G是状态函数;Q,W 不是状态函数,其变量与反应途径有关)
总反应热等于各分步反应热之和。
H 只与始态(反应物)及终态(生成物)
有关,与反应变化的途径无关。 Qp = H
H总= H1 + H2 + H3 反应物 H总 生成物
S 0 反应熵值降低,熵驱动逆向自发 HCl(g) + NH3 (g) = NH4Cl(s)
S 影响自发性,单独不是反应方向的判据
kJ/mol K*J/(mol*K)
H - TS = G (反应方向判据)
编号 H的正负 S的正负 G的正负
1
-
+
-
任何温度都自发
2
+
-
+
任何温度都非自发
解:(1)式×4-(2)式得(3)式: rHm3= 4×rHm1- rHm2= 676kJ·mol-1
2.3.4 生成焓(生成热)
摩尔生成焓:由指定的稳定的元素单质生成1mol某物质 时的热效应(焓变)叫做该物质的生成焓。
标准摩尔生成焓:生成反应在标准态和指定温度(通常为 298K)下进行,这时的生成焓称为该温度下的标准摩
(mol物质/mol反应)
解:查附录二得各化合物的fHm如下:
Na2O2(s) H2O(l) NaOH(s) O2(g)
fHm/(kJ·mol-1) -510.9 -285.8 -425.6 0
rHm = [4×(-425.6 )+0] -[2×(-510.9 )+2×(-285.8 )]
Qp总 = Q1 + Q2 + Q3
H1 中1
H2
H3 中2
已知25℃时, (1)C(石墨)+1/2O2(g) = CO (g)
rHm1= – 110.5kJ·mol-1 (2)3Fe (s)+ 2O2(g) = Fe3O反应(3)Fe3O4 (s)+4C(石墨) = 3Fe (s)+4CO (g)在 25℃时的反应热:
Na(s) + 1/2Cl2(g) NaCl(s) r Hm = - 411.2 kJ·mol-1
C(石墨,s) + 2 H2(g) +1/2 O2(g) CH3OH(l) r Hm = -239.1kJ·mol-1
2.3.3 盖斯定律
描述反应体系“热值”(性质)大小的物理量
“焓”,随反应状态而定,其变量H(反应焓变)
C2H5OH(g)[282] CH3-O-CH3[266.3] 化学反应的熵变等于生成物标准熵的总和减去反应
物标准熵的总和。
即:rSm=ΣνBSm(B)
由标准熵的定义可知,随着温度的升高,标准熵增 大。但是反应的熵变S及焓变H受温度的影响较小。
化学反应自发性的熵效应
S 0 反应熵值升高,熵驱动正向自发 (碳酸钙吸热分解)
令:H=U+pV 该热力学函数称为“焓”
Qp= H2 - H1 = H H 热焓值(状态函数)
生成物 反应物
H 0 反应焓值降低,放热; H 0 反应焓值升高,吸热。
2. 热化学方程式
1mol 反应
表示化学反应与热效应关系的方程式。如:
[ H2(g) + 1/2O2(g) →H2O(g) ]
示反应进度的变化为1 mol反应, 指标准态。
化学标准态 “” 的规定: 气体:气体的分压为标准压力p (100 kPa) ; 固体、液体:纯净物质; 溶液:浓度为1 mol·L-1的稀溶液
温度任意,不指明即为常温298K
设置化学标准态目的在于反映出仅由物 质本性决定的物质属性或反应性的差别
尔生成焓,用f H m表示。
例如,NaCl(s)、CH3OH(l)标准生成焓所对应的热化学反 应方程式为:
Na(s) + 1/2Cl2(g) NaCl(s) f Hm = - 411.2 kJ·mol-1
C(石墨,s) + 2 H2(g) +1/2 O2(g) CH3OH(l)
葡萄糖
f Hm = -239.1kJ·mol-1
2. 等压反应热Qp
W =Fh=PSh=P V
(等温、等压、不做电功即不电解不电池) S
对恒压反应,只做体积功的情况:
V h
U = Qp + W = Qp - pV
P
Qp = U +pV = (U2 – U1)+ p(V2-V1)
Qp = (U2+p2V2)-(U1+p1V1)
标准生成焓的数据见书后附录二。
由定义,指定的稳定的单质标准摩尔生成焓为零。
指定单质一般是指元素的最稳定单质。碳的单质指 定石墨;磷的单质指定白磷。
Cl2、Br2、I2的指定单质是Cl2(g)、Br2(l)、I2(s)。
用物质的标准生成焓,计算各种反应的标准摩尔焓变。 由分析知:反应的标准摩尔焓变等于生成物标准生成焓
H 影响自发性,单独不是反应方向的判据
理想气体等温混合扩散,无热效应,正向自发,逆向非自 发。正向自发性源于体系混乱度(S)的增大。
2.4.2 熵
熵:表示系统内微观粒子运动混乱度大小的 热力学函数(物理量),以S表示。
熵是状态函数。所以过程的熵变S,只取 决于始态和终态,而与途径无关。
G具有能量单位,kJ·mol-1 等温等压过程中,用G判断反应的自发性
G 0 正向自发 G 0 正向非自发 G = 0 平衡状态(反应极限,终点) 热力学第二定律(反应方向判据)
2.5.2 标准生成吉布斯自由能
为了求得反应的G,引入标准生成吉布斯自由能的 定义。
fGm:在标准状态下,由稳定单质生成1mol某物质
第二章 化学热力学初步
能量(热与功)
反应驱动力
因温差而引 起的能量传 递形式
除热外其 它的能量 形式
解决的问题:
