【环境化学】第2.3章 大气环境化学——3.6 光化学烟雾污染
环境化学名词解释

名词解释1、环境污染——由于人为因素使环境的构成或状态发生变化,环境素质下降,从而扰乱和破坏了生态系统和人们的正常生活和生产条件,就叫环境污染。
2、环境化学——是在化学科学的传统理论和方法基础上发展起来的,以化学物质在环境中出现而引起的环境问题为研究对象,以解决环境问题为目标的一门新兴学科。
3、污染物的迁移——指污染物在环境中所发生的空间位移及其所有引起的富集、分散和消失的过程。
4、化学污染物——是指由人类活动产生的天然环境化学组分共存和相互作用又可能产生不良生态效应或健康效应的化学物质。
5、环境污染化学——主要研究化学污染物在生态环境体系中的来源、转化、归宿及生态效应的学科。
又分为大气、水体和土壤三个部分。
6、光化学烟雾——碳氢化合物和氮氧化物等一次污染物在强烈太阳光作用下发生化学反应而生成一些氧化性很强的二次污染物(如臭氧、PAN,硝酸等),这些反应物和产物的混合物所形成的烟雾,称光化学烟雾。
7、温室效应——大气具有易使太阳短波辐射到达地面而拦截地表向外放出长波辐射的作用,而使地球表面温度升高的现象。
8、积聚膜——DP在 0.05~2 um范围内,主要来源于爱根核膜的凝聚,燃烧过程所产生蒸汽冷凝、凝聚,以及由大气化学反应所产生的各种气体分子转化成的二次气溶胶等。
积聚膜的粒子不易被干、湿沉降去除,主要的去除途径是扩散,这两种膜合称为细粒子。
9、爱根核膜——粒径小于0 .05um,主要来源于燃烧过程所产生的一次气溶胶粒子和气体分子通过化学反应均相成核转换的二次气溶胶粒子,所以又称成核型。
10、酸雨——由于酸性物质的湿沉降而形成的。
11、粗粒子膜——DP大于2um,主要来源于机械过程所造成的扬尘,海盐溅沫、火山灰和风砂等一次气溶胶粒子,主要靠干沉降和雨水冲刷去除。
12、敏化光解——水体中存在的天然物质被阳光激发,又将其激发态的能量转移给化合物而导致的分解反应。
13、生物富集——是指生物通过非吞食方式,从周围环境蓄积某种元素或难降解物质,使其在机体内浓度超过周围环境中浓度的现象。
大气环境化学思考题与习题参考答案

大气环境化学思考题与习题参考答案一、思考题1、大气环境化学主要研究什么?其研究意义是什么?答:大气环境化学主要研究大气环境中化学污染物的分布、转化、迁移和归宿的规律。
其研究意义在于揭示大气环境污染物变化的原因和过程,为预防和治理大气环境污染提供科学依据。
2、什么是光化学烟雾?其形成机制是什么?答:光化学烟雾是指汽车尾气中的氮氧化物和挥发性有机物在紫外线照射下,经过一系列光化学反应生成的蓝色烟雾。
其形成机制是氮氧化物和挥发性有机物在紫外线照射下,经过一系列光化学反应生成了二次污染物,如臭氧、过氧乙酰硝酸酯、酮类等。
3、大气中的哪些化学物质会对人体健康产生负面影响?其作用机制是什么?答:大气中的许多化学物质会对人体健康产生负面影响,如二氧化硫、氮氧化物、一氧化碳、臭氧、挥发性有机物等。
它们的作用机制主要包括刺激呼吸道、引起呼吸道炎症、损伤神经系统、致癌等。
4、什么是大气颗粒物?它对人体健康有哪些影响?答:大气颗粒物是指大气中的固体或液体颗粒状物质,按其粒径大小可分为可吸入颗粒物和总悬浮颗粒物。
可吸入颗粒物可深入人体呼吸道,对人体健康产生严重影响,如引起呼吸系统疾病、心血管疾病等。
总悬浮颗粒物则主要影响人体皮肤和眼睛。
5、大气中的哪些化学物质会对环境产生负面影响?其作用机制是什么?答:大气中的许多化学物质会对环境产生负面影响,如二氧化硫、氮氧化物、挥发性有机物等。
它们的作用机制主要包括酸雨、臭氧层破坏、温室效应等。
二、习题参考答案1、下列哪个选项不属于大气环境化学的研究范围?A.大气污染物的排放与分布B.大气污染物的转化与迁移C.大气污染物的生理效应D.大气污染物的治理技术答案:D.大气污染物的治理技术。
大气环境化学主要研究大气环境中化学污染物的分布、转化、迁移和归宿的规律,以及它们对环境和人类健康的影响。
治理技术属于环境保护工程领域的研究范畴,不属于大气环境化学的研究范围。
2、光化学烟雾的主要成分不包括以下哪个?A.氮氧化物B.挥发性有机物C.二氧化硫D.臭氧答案:C.二氧化硫。
环境化学:第二章大气环境化学 3
-4
λ < 120 nm
N2 + hν
N+N
120 160 200 240
λ (nm)
图2-29 O2吸收光谱(R. A. Bailey, 1978)
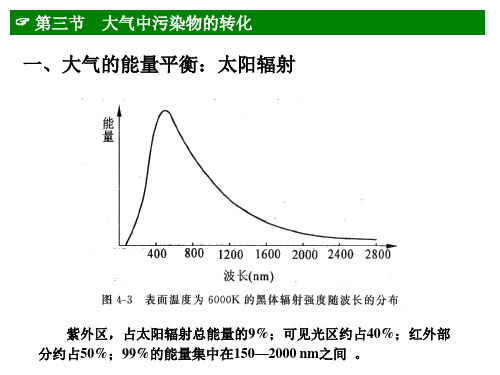
第三节 大气中污染物的转化
(2)臭氧的光离解
O + O2 + M 低碰于撞1反00应0 km的大气中,O3 + M
臭氧吸收1180 nm以下的光就可以离解,但主要 吸收290 nm以下的光,较长波长的光可以进入对流 层和地面。
A :B 能量 A+ + BA :B 能量 A·+B·
不对称裂解 对称裂解
自由基——由对称裂解生成的带单电子的原子或原子 团称为自由基。
第三节 大气中污染物的转化
2、自由基反应(free radical reaction)
凡是有自由基生成或由自由基诱发的反应都 叫做自由基反应。
CCl3F + hγ(175~220nm)
c. H2O2 + hν 2·OH
第三节 大气中污染物的转化
1、 HO 自由基的来源
HO最高含量出现在热带,因为那里温度高,太阳辐射强。
第三节 大气中污染物的转化
2、 HO2自由基的来源
a. 甲醛光解(主要来源):
HCHO + hν
H + HCO
H+O2 + M HCO+O2
HO2 + M HO2+CO
第三节 大气中污染物的转化
3、大气中重要吸光物质的光离解 4
(1) O2和N2的光离解
3
2
O2键能493.8KJ/mol。相
1
应波长为243nm。在紫外区 lgε
大气环境化学

O3 的控制
在反应初始,[O3]与 NOx 初始量及 NO2 和 NO 的比例有
关;NOx 总起始浓度增加,[O3]逐渐增加;随着反应的逐步进
行,NO2 转移自由基的浓度与链分支增加自由基浓度一样快 时,[NOx]总起始浓度的增加会导致[R· ]的减少,最终导致O3 的减少。
二、二氧化硫的气相氧化
2、S02被自由基氧化
在污染大气中,由于各类有机污染物的光解 及化学反应可生成各种自由基,如HO、H02、 RO、R02和RC(O)02等。 自由基主要来源于大气中一次污染物NOx的 光解,以及光解产物与活性碳氢化物相互作 用的过程。
2016/3/21
玉溪师范学院 化学与环境科学系 杨艳
2016/3/21 玉溪师范学院 化学与环境科学系 杨艳
2.光化学烟雾的形成机制
(1)光化学烟雾的日变化曲线
光化学烟雾在白天生成,傍晚消失。污染高峰出现在中午或稍后。
2016/3/21
玉溪师范学院 化学与环境科学系 杨艳
2.光化学烟雾的形成机制
(2) 烟雾箱模拟曲线
在一个大的封闭容器中,通入非烷烃气体,NOx,在模 拟太阳光的人工光源照射下进行反应。 •随着实验时间的增 长: ①NO向NO2转化; ②由于氧化过程而 使丙烯消耗; ③臭氧及其他二次 污染物,如PAN、 H2CHO等生成
2016/3/21 玉溪师范学院 化学与环境科学系 杨艳
4) 我国光化学烟雾发生情况
表 兰州西固地区夏季大气臭氧浓度水平及超标情况
2016/3/21
环境化学

学反应而产生二次污染物,这种由一次污染物和二次污染物的混合物所形成的烟雾污染现象,称为光化学烟雾特征:是烟雾呈蓝色,具有强氧化性,能使橡胶开裂,刺激人的眼睛,伤害植物的叶子,并使大气能见度降低。
2.光化学烟雾的控制对策:1.控制反应活性高的有机物的排放 2.控制臭氧的浓度3.专属吸附:吸附过程中,除了化学键的作用外,尚有加强的憎水键和范德华力或氢键在起作用。
4.硫酸烟雾型污染:形成原因:主要是由于燃煤而排放出来的SO2,颗粒物以及由SO2氧化所形成的硫酸盐颗粒物所造成的大气污染现象。
形成条件:多发生在冬季、气温较低、湿度较高和阳光较弱的气象条件下5.酸性降水:指通过降水如雨,雾,冰雹等将大气中的酸性物质迁移到地面的过程6.降水的化学组成:1.大气中固定气体成分O2,N2,CO2,H2,以及稀有气体。
2.无机物,3.有机物 4.光化学反应物 5.不容物7.降水中的离子成分:SO42-,NO3-,Cl-,铵根离子,钙离子,氢离子。
8.影响酸雨形成的因素:1.酸性污染物的排放及其转化条件 2.大气中的氨气 3.颗粒物酸度及其缓冲能力9.诱发沉积物中重金属释放的因素:1.盐浓度升高 2.氧化还原条件的变化 3.降低pH 4.增加水中配合剂的含量10.吸附等温线:在固定的温度条件下,当吸附达到平衡时,颗粒物表面上的吸附量与溶液中溶质平衡浓度之间的关系11.决定电位:若某个体系的含量比其他体系高得多,则此时该体系电位几乎等于混合复杂体系的pE12.电子活度:电极上电子有效浓度为电子活度, 记作E , 其负对数记作pE13.凝聚---- 由电解质促成的聚集絮凝---- 由聚合物促成的聚集14.清洁区:表明未被污染,氧及时得到补充。
分解区:细菌对排入的有机物进行分解,其消耗的溶解氧量超过通过大气补充的氧量,因此,水体溶解氧下降,此时细菌个数增加。
腐败区:溶解氧消耗殆尽,水体尽心缺氧分解,当有机物被分解完后,腐败去即告结束,溶解氧又恢复上升恢复区:有机物降解接近完成,溶解氧上升并接近饱和清洁区:水体环境改善,又恢复至原始状态15.分配作用:即在水溶液中,土壤有机质对有机物的溶解作用,而且在溶质的整个溶解范围内,吸附等温线都是线性的,与表面吸附位无关,只与有机物的溶解度有关,因而放出的吸附热量小16.吸附作用:即在非极性有机溶剂中,土壤矿物质对有机物的表面吸附作用或干土壤矿物质对有机物的表面吸附作用。
环境化学第2章大气环境化学-5-转化..

大气中SO2的转化首先是SO2氧化成SO3,随后被水
吸收生成硫酸,从而形成酸雨或硫酸烟雾。硫酸与大
气中的NH4+等阳离子结合生成硫酸盐气溶胶。
1)SO2的直接光氧化
SO2 + hv(290~340nm)→1SO2(单重态) SO2 + hv(340~400nm)→3SO2(三重态) 能量较高的单重态分子可按以下过程跃迁到三重态或基态 :
第三节 大气中污染物的转化
3.5 光化学烟雾
3.6 硫氧化物的转化及硫酸烟雾型污染 3.7 大气颗粒物
思考题:
1. 说明光化学烟雾现象,解释污染物与产物的日变 化曲线,并说明光化学烟雾产物的性质与特征。 2. 说明烃类在光化学烟雾形成过程中的重要作用和
有机物在光化学反应中活性顺序。
3. 简述SO2氧化的几种途径。
修正的亨利系数 : K S1 K S1 K S 2 K K H [1 ] 2 [H ] [H ]
* H
* [S(Ⅳ) ]= K H pSO2
三种形态S(Ⅳ)的摩尔分数与pH之间的关系为: 低pH
α0 K K s1 K s2 -1 SO2 H 2O [1 s1 ] C总 [H ] [H ]2
措施: ①在洛杉矶市出售的汽车必须是“清洁的”,要求94年后
出售的汽车全部安装“行驶诊断系统”,即时监测机动车
的工作状态,让超标车辆即时脱离排污状态和接受维修。 ② 鼓励人们乘公共汽车上班,以减少汽车尾气。 ③是世界上利用风能和太阳能发电最多的地方,在替代清 洁燃料的研究方面也处于领先地位。政府通过低息贷款和 补贴的方式鼓励人们尝试使用清洁燃料汽车。
HO·+ SO2→ HOSO2 · (控速)
02-4环境化学第二章__大气环境化学-wps

1)观察结果:
随时间增加,NO向NO2转化。(NO消耗)
由于氧化而大量消耗丙烯(碳氢化合物消耗)。
臭氧、PAN、HCHO、NO2等二次污染物生成。
2)关键反应(3个)
NO2光解导致O3的生成(光化学反应_诱因)
+ 改良燃料(使用天燃气燃料、二甲醚燃料)等
2)改善能源结构:使用替代能源,尽量减少使用化石燃料 3)加强监督管理:控制氧化剂浓度(0.5ppm-警戒水平,
1.0ppm-危害健康水平,1.5ppm-严重危害健康水平)
洛杉矶的治理措施:
设立空气质量管理区,加大区域环境管理部门的自主权,以期
环境政策能够以最有效的方式落实;
3、日变化曲线
1)白天生成,夜晚 消失,污染物浓度峰
值出现在中午和午后。
2)烃类和NO最大值发 生在早上交通高峰时节,
此时NO2浓度很低。
3)随太阳辐射增强,
O3 和 NO2 浓度逐渐增加, O3 和 NO2 浓度峰值比 NO 浓度峰值 晚出现4-5个小时
推断:O3和NO2、醛是二次污染物。
4、烟雾箱模拟揭示的机理
强烈的太阳光+碳氢化合物+氮氧化合物
2、特征与危害
巴黎的光化学烟雾
1)烟雾蓝色 2)具有强氧化性 3)对眼睛、呼吸道等有强烈刺激,并引起头痛、
呼吸道疾病恶化,严重造成死亡
4)对植物叶子有害,能使大气能见度降低
光
化
学
烟
雾
光
化
学 烟 雾
洛 杉 矶 的 光 化 学 烟 雾
从1943年开始,经过近40年的治理,尽管洛杉矶的人口 增长了3倍、机动车增长了4倍多,但该地区发布健康警告的 天数却从1977年的184天下降到了2004年的4天。每年从夏季 至早秋,只要是晴朗的日子,城市上空就会出现一种弥漫天 空的浅蓝色烟雾,使整座城市上空变得浑浊不清。 1943 年以后,烟雾更加肆虐,以致远离城市 100 千米以 外的海拔2000米高山上的大片松林也因此枯死,柑橘减产。 仅1950-1951年,美国因大气污染造成的损失就达15亿美元。 1955年,因呼吸系统衰竭死亡的 65岁以上的老人达400多人; 1970年,约有75%以上的市民患上了红眼病。
第二章大气环境化学(3)

第⼆章⼤⽓环境化学(3)第⼆章⼤⽓环境化学(3)第三节⼤⽓中污染物的转化⼆、光化学反应基础1、光化学反应⼀个原⼦、分⼦、⾃由基或离⼦吸收⼀个光⼦所引发的反应,称为光化学反应。
光化学反应的起始反应(初级过程)是:A + hν→A* (2-1)式中A*为A的激发态,激发态物种A*进⼀步发⽣下列各种过程。
光解(离)过程:A* → B1 + B2+…(2-2)直接反应:A* + B → C1+C2+… (2-3)辐射跃迁:A* → A + hν(荧光、磷光) (2-4)⽆辐射跃迁(碰撞失活):A* + M → A+M (2-5)其中(2-2)、(2-3)为光化学过程,(2-4)、(2-5)为光物理过程。
对于⼤⽓环境化学来说,光化学过程最重要的是受激分⼦会在激发态通过反应⽽产⽣新的物种。
初级光化学过程包括光解离过程、分⼦内重排等。
分⼦吸收光后可解离产⽣原⼦、⾃由基等,它们可通过次级过程进⾏热反应;光解产⽣的⾃由基及原⼦往往是⼤⽓中·OH、HO2·和RO·等的重要来源;对流层和平流层⼤⽓中的主要化学反应都与这些⾃由基或原⼦的反应有关。
次级过程是指初级过程中反应物、⽣成物之间进⼀步发⽣的反应。
例如,H2和Cl2混合物光解,发⽣链式反应:Cl2 + hν→2Cl·Cl· + H2→HCl + H·H· + Cl2→HCl + Cl·2Cl·→Cl22、光化学定律1)格鲁塞斯(Grotthus)与德雷伯(Drapper)提出了光化学第⼀定律:只有被分⼦吸收的光,才能有效地引起分⼦的化学变化。
2)爱因斯坦(Einstein)光化学第⼆定律:在光化学反应的初级过程中,被活化的分⼦数(或原⼦数)等于吸收光的量⼦数,或者说分⼦对光的吸收是单光⼦过程,即光化学反应的初级过程是由分⼦吸收光⼦开始的。
E=hν=hC/λE = hνN0 = N0hC/λ式中:λ为光量⼦的波长;h为普朗克常数,6.626×10-34J·s/光量⼦;C为光速,2.9979×1010 cm/s;N0为阿伏加德罗常数,6.022×1023/mol;代⼊上式得:E= 119.62 ×106/λ若λ=300 nm, E=398.7 kJ/mol ;λ=700 nm, E=170.9 kJ/mol 。
【环境化学】第2.3章 大气环境化学——3.6 光化学烟雾污染

第三节 大气中污染物的转化
3.6 光化学烟雾污染
3.6.1 光化学烟雾定义及实例 3.6.2 特征及形成条件 3.6.3 危害 3.6.4 形成的化学机制★★ 3.6.5 控制对策
1
3.6.1 光化学烟雾定义及实例
➢ 光化学烟雾(Photochemical smog)
含有氮氧化合物和碳氢化合物等一次污染物的 大气,在阳光照射下发生光化学反应而产生二次污染 物,这种由一次污染物和二次污染物的混合所形成的 烟雾污染现象(P92)。
31
3.6.4 光化学烟雾形成的化学机制
➢ 链终止反应
1. HO +NO2 → HNO3 2. RC(O)O2 +NO2 → RC(O)O2NO2 3. RC(O)O2NO2 → RC(O)O2 + NO2
32
3
PAN-过氧乙酰硝酸酯
PBN-过氧苯酰硝酸酯
PAN没有天然源,全部由一次污染物通过反应生成,因此测 得大气中有PAN,可作为发生光化学烟雾的依据
时间段
北京市昌平区府学路亢山广场附近NO2浓度和交通流量日变化关系
2006年6月8日
37
3.6.5 光化学烟雾控制对策
(1)控制污染源-如何控制NOx和HC化合物的浓度
控制工业污染源 改善汽车发动机结构 安装汽车尾气催化反应器
日本、美国和欧洲汽车尾气催化转化器
NO(g)+CO(g) →1/2N2(g)+CO2(g) 催化剂-耐高温多孔陶瓷为载体,铂和钯 无铅汽油,铅很容易使铂系催化剂中毒而失效
日本东京光化学烟雾
1970年,日本东京光化学烟雾,2万人患红眼病。
4
第二章 大气环境化学
第三节 大气中污染物的转化
3.6 光化学烟雾污染
2-3 大气环境化学3

大气中污染物的迁移2大气的组成及其主要污染物1大气中污染物的转化3几种代表性的大气污染环境问题4第二章大气环境化学大气污染物按化学组成分类:•含氮化合物(NOx)•含碳化合物(CO, CO, 碳氢化合物HC)2•含硫化合物(SO, H2S, SO3, CS2等)2•含卤素化合物(卤代烃,氯化物,氟化物等)•颗粒物•放射性物质等大气中硫氧化物(SO X )包括SO 2、SO 3、H 2SO 4、SO 42-,其中SO 2为一次污染物,其余均是由SO 2氧化转化形成二次污染物。
SO 2是最早为人类注意的大气污染物之一,世界历史上发生的八大公害事件中,有一半与之有关:1930年12月比利时马斯河谷烟雾事件,一周内造成60多人死亡(逆温);1948年10月美国多诺拉烟雾事件,40%的人患病,20人丧生;1952年12月伦敦烟雾事件,5天逆温,约4000人死亡;1961年日本四日市哮喘事件,患者达817人,死亡数十人。
七、硫氧化物的转化及硫酸烟雾型污染七、硫氧化物的转化及硫酸烟雾型污染对人类健康(主要是刺激呼吸道)、生态环境等均有直接危害SO2在大气中的氧化问题受到人们的作用,而其氧化产物则危害更大,SO2重视。
500ppm 的SO会导致人死亡;损伤叶片,作物减产;腐蚀建筑材料21、SO2的来源和消除•来源:天然源(火山喷发)人为源(矿物燃料燃烧、含硫矿石的冶炼、硫酸生产过程等)人为排放的SO2中有60%来自煤的燃烧,30%来自油的燃烧和炼制。
•消除:形成硫酸或硫酸根,其中SO2→ SO3转化是关键一步;通过干沉降、湿沉降去除。
2、SO2的浓度特征•本底值存在明显的地区变化和高度变化;•其浓度变化与污染源和当地的气象条件(风向、风速、大气稳定度、低层逆温等)有关;3、SO2的转化氧化途径的多样性以及氧化途径受反应条件(如反应由于大气中SO2的化学反应变得物组成、光照、温度和催化剂等)影响较大,使大气SO2十分复杂,其反应途径一般有四种:(1)光化学氧化;(2)被自由基氧化;(3)液相氧化(4)颗粒物表面上的反应。
第二章大气环境化学PPT课件

(Atmosphere Environmental Chemistry)
.
1
本章重点
(1)污染物在大气中迁移过程;
(2)光化学烟雾和硫酸型烟雾的形成 过程和机理。
.
2
大气环境化学
• 1. 研究对象:天然和人为活动产生的大气中重要的活性物质,包 括大气、降水中的。
– 活性是指:①有反应性;②无反应性,但对生物有害,如SOx、NOx、 O3、PAN等。
.
3
• 大气是指包围在地球表面并随着地球旋转的空气层。大气也称为 大气圈或大气层。大气是地球上一切生命赖以生存的气体环境。
• 大气层的重要性还在于:(1)它吸收了来自太阳和宇宙空间的大 部分高能宇宙射线和紫外辐射,是地球生命的保护伞;(2)大气 也是地球维持热量平衡的基础,为生物生存创造了一个适宜的温 度环境。
.
15
• 例 1 CH4 在 对 流 层 平 均 浓 度 c=1.55ppm , 不 随 时 间 变 化 , 则 FCH4=RCH4=1.5×1014 mol/y,求得停留时间为
ti 5 .1 1 41 1 .0 5 83 4 1 1 10 3 4 1 0 1 .5 6 1 5 6 0 2 .4 y (3/4指对流层占总大气圈质量的比例,16为分子量)
• 地表大气平均压力1个大气压,相当于1cm2地表上承受的空气柱 的质量为1034g。地球总表面积为5.1108km2。大气质量随高度 的分布极不均匀,主要集中在下部。大气层没有明确的边界,但 从北极光的最高发光点推算,离地面800km的高空还有少量空气 存在。所以,一般称大气层的厚度为1000km,但其75%的质量只 在10km以下的范围内,99%在30km以下,高度100km以上,空 气质量仅是整个大气圈质量的百万分之一。
《环境化学》课件第二章-3

NO → NO2 不 需要 O3 参与也 能发生,导致 O3 积累
O3 积累过程导致 许多羟基自由基 的产生
NO和烃类化合物 耗尽
2-7
《环境化学》 第二章 大气环境化学
hν
[O]
[O]
[O] [O]
Generalized scheme for the formation of photochemical smog
图 EKMA方法中的O3等体积分数曲线 (唐孝炎,1990) 0 RH
K
0 NO x
2-10
《环境化学》 第二章 大气环境化学
B.O3 的控制
当[RH]0/[NOx]0 高时,[NOx]0少, O3的生成受[NOx]0的影响明显; [RH]0/[NOx]0 低时,[NOx]0高, O3的生成受[NOx]0的影响不明显;
Oxysulfides and Sulfuric Acid Smog)
八、酸性降水 (Acid Precipitation) 九、温室效应 (Greenhouse Effect) 十、臭氧层的形成与耗损(Formation and Depletion of Ozone Layer)
2-13
《环境化学》 第二章 大气环境化学
Oxysulfides and Sulfuric Acid Smog)
八、酸性降水 (Acid Precipitation) 九、温室效应 (Greenhouse Effect) 十、臭氧层的形成与耗损(Formation and Depletion of Ozone Layer)
2-1
《环境化学》 第二章 大气环境化学
2-4
《环境化学》 第二章 大气环境化学
B. 日变化曲线
环境化学第二章 大气环境化学

影响因素包括:高度、污染源位置与风向、风速、大气稳定度、低层 逆温、湍流
(2)硫化氢 (H2S)
许多天然源都可以向环境中排放含硫化合物,如火山 爆发、海水浪花和生物活动等。 H2S主要来自动植物机体的腐烂,即主要由植物机体 中的硫酸盐经微生物的厌氧活动还原产生。 而大气中H2S主要的去除反应为: HO+ H2S→H2O+SH
平流层顶
40
平流层
吸收紫外线,放出热量,臭氧吸收热量
20
对流层顶
对流层
4. 热层(电离层):80~500 km
吸收紫外线造成温度上升,空气高度电离, 因此也称为电离层,占大气质量的0.5% 5. 逃逸层,外大气层
0
160
200
T/K
240
280
图 大气温度的垂直分布
大气的压力总是随着海拔高度的增加而减小:
b. ④ ⑤
与HO· 的反应,该途径可去除大气中约50%的CO CO的停留时间:约0.4年 CO的危害:使人体缺氧窒息;参与光化学反应,适量CO的
CO HO CO2 H H O2 M HO 2 M CO HO 2 CO2 HO
含碳化合物
含卤素化合物
1. 含硫化合物 大气中的含硫化合物主要包括:氧硫化碳
(COS)、二硫化碳(CS2)、二甲基硫[(CH3)2S]、硫化氢(H2S)、 二氧化硫(SO2)、三氧化硫(SO3)、硫酸(H2SO4)、亚硫酸盐 (MSO3)和硫酸盐(MSO4)等。
(1)二氧化硫 (SO2) 酸雨; ① SO2的危害:刺激性气体,呼吸道危害;植物危害; ② SO2的来源与消除:人为来源中,有60%来自煤的燃烧, 30%左右来自石油燃烧和炼制过程;有50%会转化形成 硫酸或硫酸根,另外50%可以通过干湿沉降从大气中被 消除; ③ SO2的浓度特征:本底浓度一般在0.2~10 μL ·m-3之间, 随不同地区发生变化。
环境化学名词解释

环境化学名词解释光化学烟雾:空气中氮氧化物和碳氢化合物等一次污染物在阳光照射下发生光化学反应产生二次污染物,这两类污染物的混合物形成的烟雾污染现象称之为光化学烟雾二次颗粒物:大气中某些污染组分之间或这些组分与大气成分之间发生反应而产生的颗粒物称为二次污染物温室效应:大气中CO2吸收了地面辐射出来的红外光,把能量截留于大气之中,从而使大气温度升高,这种现象称作温室效应酸雨:酸雨是指由于空气中的SO2和氮氧化物等酸性污染物通过各类途径引起的PH<5.6的酸性降水。
盐基饱和度:在土壤交换性阳离子中盐基离子所占的百分数阳离子交换量:每千克干土中所含全部阳离子总量。
活性酸度:土壤的活性酸度是土壤中氢离子浓度的直接反应质体流动:由水或是土壤两者共同作用所致的质体的转移土壤的缓冲性能:土壤的缓冲性能是指土壤具有缓和其酸碱度发生激烈变化的能力,它可以保持土壤反应的相对稳定,为植物生长和土壤生物活性创造比较稳定的生活环境总碱度:一个强酸标准溶液滴定,用甲基橙为指示剂,当溶液由黄色变为橙红色停止滴定,此时所得结果称为总碱度,也称为甲基橙碱度。
生物放大:指某些在自然界不能降解或者难降解的的化学物质,在环境中通过食物链和营养剂的叠加在生物体内逐渐富集,浓度越来越大的现象生物富集:处于同一营养剂的生物种群或生物体,从环境中吸收某些元素或难分解的化合物,使其在生物体内的浓度超过环境中的浓度的现象富营养化:生物所需的氮磷等营养物质大量的进入缓流水体,引起藻类及其他浮游生物迅速繁殖,水体溶解氧量下降,鱼类及其他生物大量死亡的现象称为富营养化原生矿物:各种岩石受到程度不同的物理风化而未经化学风化的碎屑物次生矿物:由原生矿物经过化学风化后形成的新矿物生长代谢:某些有机污染物在微生物代谢时作为食物源提供能量和提供细胞所需的碳并被降解。
生物修复:通过具有降解功能的细菌和真菌等微生物的作用,去除环境中污染物。
被动扩散:脂溶性物质从高浓度侧向低浓度侧转移的过程。
环境化学-光化学烟雾

• (该Ⅱ自),由基与O2结合生成相应的过氧烃基自由基
该的过带氧羟自基由的基烃也氧可自将由NO基氧与化O2成发N生O而2(开Ⅲ环),。新生成
2
( )
(I
烃基自由基
)
• (3)O3的生成是由什么物质光解而导致 的?
氢
(II 过氧烃基自由基 )
写出乙醛形成过氧乙酰基硝酸酯(PAN) 的反应式。
CH3CHO + HO → CH3CO + H2O
氢摘除 反应
过氧乙酰基
• (2)丙烯氧化的产物促进了NO、NO2、O3之 间的哪个反应? CH3CH=CH2
CH3CH=CH2 + HO → CH3CHCH2OH (或 CH3CH(OH)CH2) CH3CHCH2OH + O2 → CH3CH(O2)CH2OH CH3CH(O2)CH2OH + NO→ CH3CH(O)CH2OH + NO2 CH3CH(O)CH2OH + O2 → CH3C(O)CH2OH + HO2 或CH3CH(O)CH2OH → CH3CHO (乙醛) + CH2OH CH2OH + O2 → H2CO(甲醛) + HO2
链终止
NO2既起链引 发作用,又起
链终止作用
• 在污染大气中还发现了PAN的同系物,它们 是PAN中的乙基由其他烷基替代形成的。如 过氧丙酰基硝酸酯 (PPN)、过氧苯酰基硝酸 酯(PBZN)。
光化学烟雾日变化曲线 NO ⇛ NO2 ⇛ RC(O)O2NO2
PAN 继增z由。反于同应反时产应生R使O过2N·氧(O如乙快丙酰速烯硝氧与酸化O酯成3反(NP应OA生2N,)成类从的物而双质加自。速由N基O2C光H解3C,·H使O二O·次)与产O物2和ON3净O2相
《环境化学(第二版)》戴树桂主编-复习要点

《环境化学(第二版)》戴树桂主编-复习要点大气环境化学:一、大气中污染物的迁移:大气温(密)度层结:静大气的温度和密度在垂直方向上的分布。
大气划分为:对流层,平流层,中间层,热层,逸散层。
对流层:平均厚度12千米;气温随高度的增加而降低,热源来自地面的长波辐射;对流运动显著;每升高100米,气温降低0.6℃;含有全部大气质量3/4的大气和几乎所有的水汽;多种天气现象;污染物的迁移转化;平流层:高度在17-55千米之间;气温随高度的增加而增加,热源来自太阳的紫外辐射;气体状态非常稳定;无天气现象;大气透明度高,适合飞行;中间层:从平流层顶到85千米的高度;气温随高度的增加而降低;热源来自平流层;垂直运动相当剧烈;热层:从平流层顶到800千米之间;温度随高度的增加而迅速上升;空气极稀薄,在太阳紫外线和宇宙射线的辐射下,空气处于高度电离状态,有称电离层;逸散层:超过800千米以上的高空;气体分子受地球引力极小,因而大气质点会不断向星际空间逃逸;大气垂直递减率:随高度的增加气温的降低率,Γ=-dT/dz 。
干绝热垂直递减率:干空气块或未饱和的湿空气块在上升时温度降低值与上升高度的比,用Γd表示。
大气稳定度:气层的稳定程度,即某一高度上的气块在垂直方向上相对稳定的程度;若Γ<Γd ,表明大气是稳定的,Γ>Γd,大气是不稳定的;Γ=Γd,大气处于平衡状态。
影响大气污染物迁移的因素:5风和大气湍流的影响:大气的水平运动成为风,风可使污染物向下风向扩散,从而得到稀释;大气的无规则运动称为大气湍流,湍流可使污染物向各个方向扩散,其中空气的铅直对流运动使得污染物升到高空而扩散。
二、大气中污染物的转化:光化学反应:分子、原子、自由基或离子吸收光子而发生的化学反应,分为初级过程和次级过程。
初级过程:化学物种吸收光量子hv形成激发态物种,基本步骤为:A+h v →A*,随后,激发态A*可能发生如下反应(①、②为光物理过程,③、④为光化学过程):①辐射跃迁:A*→A+h v,②碰撞失活过程:A*+M →A+M,③光离解:A*→B1+B2+……④与其他成分反应:A*+C →D1+D2+……次级过程:在初级过程中反应物、生成物之间进一步发生的反应;大都是热反应。
环境化学.doc

一、名词解释1、光化学烟雾:2、温室效应:3、水体富营养化:4、敏华光解:5、共代谢:6、土壤污染:7、生物降解:8、优先污染物:答案:1.光化学烟雾:由一次污染物和二次污染物的混合物所形成的烟雾污染现象,称为光化学烟雾。
{含有氮氧化物和碳氢化合物等一次污染物的大气,在阳光照射下发生光化学反应而产生二次污染物(O3、醛类、PAN、HNO3等)} 来自第二章2.温室效应:大气中的CO2等温室气体允许太阳光短波辐射到达地面,但同时吸收了地面辐射出来的红外光,把能量截留在大气之中,从而使大气温度升高的现象。
来自第二章3.水体富营养化:是指氮、磷等营养物质大量进入湖泊、河口、海湾等缓流水体,引起藻类及其他浮游生物迅速繁殖,水体溶解氧量下降,鱼类及其他生物大量死亡的现象。
来自第三章4.敏华光解:敏化光解是指一种光吸收分子可能将它的过剩能量转移到另一种分子(有机污染物),从而导致该分子(有机污染物)发生分解。
来自第三章5.共代谢:某些有机污染物不能作为微生物的唯一碳源与能源,必须有另外的化合物存在提供微生物碳源或能源时,该有机物才能被降解,这种现象称为共代谢。
来自第四章6.土壤污染:当污染物通过各种途径进入土壤的数量超过了土壤的自净能力,并破坏了土壤的功能,引起土壤质量恶化的现象,称为土壤污染。
来自第四章7.生物降解:是指有机物质在生物作用下,主要通过生物氧化以及其他生物转化,变成更小更简单的分子的过程。
来自第五章8.优先污染物:由于化学污染物种类繁多,世界各国都筛选一些毒性强、难降解、残留时间长、在环境中分布广的污染物优先进行控制,称为优先污染物。
来自第一章二、选择题1、在水体中颗粒物对重金属的吸附量随PH升高而()A.增大 B.减少 C.不变 D.无法判断解析:当pH升高向碱性条件变化时,水体中的碳酸根离子会大量增加,水体中的碳酸根会络合颗粒物表面的重金属,水体中溶解态重金属含量将会升高。
故选择A2、土壤有机质来源不包括()A树脂B腐殖酸C腐黑物D矿物质解析:D 矿物质属于无机物3、大气颗粒物的粒度有艾根核模、积聚模和粗粒子模。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4
8
12
16
20
24
Time of day 19
光化学烟雾日的变化特征
20
光化学烟雾的日变化特征-总结
特征:
第二章 大气环境化学
第三节 大气中污染物的转化
3.6 光化学烟雾污染
3.6.1 光化学烟雾定义及实例 3.6.2 特征及形成条件 3.6.3 危害 3.6.4 形成的化学机制★★ 3.6.5 控制对策
1
3.6.1 光化学烟雾定义及实例
➢ 光化学烟雾(Photochemical smog)
含有氮氧化合物和碳氢化合物等一次污染物的 大气,在阳光照射下发生光化学反应而产生二次污染 物,这种由一次污染物和二次污染物的混合所形成的 烟雾污染现象(P92)。
7
洛杉矶发生光ห้องสมุดไป่ตู้学烟雾的原因
洛杉矶机动车拥有量大(>800万辆),每天消耗2万吨以上 的汽油,排出污染物占90%-充足的一次污染物生成光化学 烟雾;
洛杉矶盆地,容易形成上热下冷的逆温现象。一年有300天 以上处于逆温,污染物不易扩散;
夏季阳光非常强烈; 具备与洛杉矶类似条件的地方易发生光化学烟雾
例如:墨西哥城、雅典(希腊)、圣保罗(巴西)
8
我国兰州西固地区发生光化学烟雾的原因
1972年,王勋陵和陈庆诚教授在兰州西固地区发现光化学 烟雾,是首次在中国发现光化学烟雾
西固地区建有石油化工、冶炼、发电、制药、纺织等大中 型企业140多个,空气中碳氢化合物、氮氧化物浓度高。
西固地区地处黄河河谷、三面环山,大气对流弱,污染物 不易扩散;
3.6.3 光化学烟雾的危害 -(2) 对植物影响
植物叶片变黄以致枯死; 对光化学烟雾敏感的植物
农作物-棉花、烟草、甜菜、莴苣、番茄和菠菜 观赏植物-菊花、蔷薇、兰花和牵牛花 多种树木 加利福尼亚州,1959,$800万,葡萄减产60%; 美国国家作物损失评价观测网资料:估计臭氧影响谷物、小麦、 大豆和花生产量,带来$20亿~40亿损失。
➢ 烟雾弥漫; ➢ 烟雾呈蓝色; ➢ 空气能见度低; ➢ 具强氧化性; ➢ 污染高峰出现在中午或稍后; ➢ 循环过程:白天生成,晚上消失。
6
光化学烟雾形成的物理化学条件
➢ 氮氧化物存在 ➢ 碳氢化合物存在 ➢ 引起光化学反应的紫外线
光化学烟雾发生的自然条件
➢ 大气相对湿度较低 ➢ 夏、秋季(气温24~32℃) ➢ 晴朗天气
16
第三节 大气中污染物的转化
3.6 光化学烟雾污染
3.6.1 光化学烟雾定义及实例 3.6.2 光化学烟雾特征及形成条件 3.6.3 光化学烟雾的危害 3.6.4 光化学烟雾形成的化学机制★★ 3.6.5 控制对策
17
3.6.4 光化学烟雾形成的化学机制
光化学烟雾的日变化特征 烟雾箱模拟实验 光化学烟雾形成的简化机制-12个反应方程式★
14
3.6.3 光化学烟雾的危害 -(3) 对材料的影响
使橡胶老化和破裂
H CH3 CH2 -C = C-CH2
+O3
n
O R-C
O C-R
H
O CH3
=
=
O RC-C-OH
O RC-C-CH3
15
3.6.3 光化学烟雾的危害 -(4) 其它危害
降低能见度
气溶胶颗粒:0.3~1.0微米, 不易重力沉降,长时间悬浮在空中, 对光散射影响大。
健康效应
5分钟内人能感觉,1小时内胶片脆化 人肺机能减弱 3~6小时内人视力减弱 1小时内呼吸紧张,气喘 2小时内头痛,胸痛,人慢性中毒 全身疼痛,麻痹,肺气肿 小动物2小时内死亡 人在1小时内死亡
注:GB3095-2012中O3二级1小时均值浓度限值为200g/m3,在1atm 0℃下相当于0.0931130-6
西北高原,阳光辐射强;
9
北京大学环境科学与工程学院-唐孝炎教授
研究领域:
环境化学;大气环境化学;臭氧化学及
光化学烟雾;酸沉降化学;大气颗粒物
成果:
“兰州西固地区大气光化学污染规律
和防治对策的研究”获国家科技进步二
等奖 1985
“我国酸沉降及其环境影响” 获国家
科技进步一等奖 1998
中国工程院院士
对人眼睛的刺激 过氧乙酰硝酸酯(PAN) 催泪剂,甲醛的200倍 过氧苯酰硝酸酯(PBN) 催泪剂,比PAN强100倍
对鼻子、咽喉、气管和肺有明显的刺激作用 致癌风险:PAN、PBN
12
光化学烟雾的健康效应(续)
烟雾中O3浓度 / 10-6 (体积分数) 0.02
0.2
0.2~0.5 0.1~1.0 1~2 5~10 15~20 >50
18
concentration 光化学烟雾的日变化特征
HC NO&NO2 O3
ppm
ppb
Toronto,Canada,1992/05/26
5 0.25 50 50
O3 4 0.20 40 40
3 0.15 30 30 2 0.10 20 20 1 0.05 10 10 0 0.00 0 0
HC
NO NO2
中国环境学会副理事长
联合国环境署(UNEP)
臭氧层损耗环境影响评估组共同主席
10
第二章 大气环境化学
第三节 大气中污染物的转化
3.6 光化学烟雾污染
3.6.1 光化学烟雾定义及实例 3.6.2 特征及形成条件 3.6.3 光化学烟雾的危害 3.6.4 形成的化学机制★★ 3.6.5 控制对策
11
3.6.3 光化学烟雾的危害 -(1) 对人体健康的影响
日本东京光化学烟雾
1970年,日本东京光化学烟雾,2万人患红眼病。
4
第二章 大气环境化学
第三节 大气中污染物的转化
3.6 光化学烟雾污染
3.6.1 光化学烟雾定义及实例 3.6.2 光化学烟雾特征及形成条件 3.6.3 危害 3.6.4 形成的化学机制★★ 3.6.5 控制对策
5
3.6.2 光化学烟雾特征及形成条件
➢ 其它名称:洛杉矶烟雾、氧化型烟雾
2
➢ 一次污染物和二次污染物
一次污染物
✓ 氮氧化物 ✓ 碳氢化合物
二次污染物
✓ O3(85%以上) ✓ PAN(10%) ✓ 高活性自由基(RO2、HO2、RCO) ✓ 醛类、酮类和有机酸
3
光化学烟雾实例
美国洛杉矶光化学烟雾
✓ 1943年,首次出现在美国洛杉矶-又称洛杉矶型烟雾; ✓ 美国加利福尼亚州,3/4人口得红眼病; ✓ 1952年,洛杉矶光化学烟雾事件,2天内使65岁以上老人死亡400余人;
