第三章 溶液中配合物的稳定性
环境化学-第三章-水环境化学-第二节-水中无机污染物的迁移转化知识交流

之,pE越大,电子浓度越低,体系接受电子的倾向就越强。
(2)氧化还原电位E和pE的关系
Ox +ne→Red
(1)
根据Nernst方程
E=E0-(2.303RT/nF)lg[Red]/[Ox] (2) 当反应达平衡时,定义
E0=(2.303RT/nF) lgK
(3)
从上述化学方程式(1),可写出
K= [Red]/{[Ox][e]n }
如果考虑到羟基配合作用,那么金属氧化物或氢氧化物的 溶解度(MeT)表征为:
MeT = [ Mez+ ] +∑[ Me(OH)nz-n ]
固体的氧化物和氢氧化物具有两性的特征,它们和质子或 羟基离子都发生反应,存在一个pH值,在该值下溶解度为最 小值。在碱性或酸性更强的pH值区域内,溶解度都会变得更 大。
因此,在 H2S 和硫化物均达到饱和的溶液中,溶液重金属离子 的饱和浓度为: [Me2+]=Ksp/[S2-]=Ksp [H+]2/Ksp´ =Ksp [H+]2/(0.1K1K2)
3、碳酸盐
——多相平衡,pH通过控制碳酸根浓度影响沉淀平衡
封闭体系: 只考虑固相和液相,把 H2CO3* 当作不挥发酸类处理。
吸附量随粒度增大而减少,并且当溶质浓度范围固定 时,吸附量随颗粒物浓度增大而减少。
温度变化、几种离子共存(竞争作用)等。
3、沉积物中重金属的释放——属于二次污染问题
诱发释放的主要因素有: (1)盐浓度升高:碱金属和碱土金属阳离子可将被吸附在固体颗
粒上的金属离子交换出来。
(2)氧化还原条件的变化:有机物增多,产生厌氧环境、铁锰氧 化物还原溶解,使结合在其中的金属释放出来。
2、它在中性表面甚至在与吸附离子带相同电荷符号的表面 也能进行吸附作用。
配合物在溶液中的稳定性

(二)压力对配合物稳定性的影响
TI(Ⅰ)< TI(Ⅲ) 酒石酸根离子(L2-)配合物的lgK1值 强制构型:螯合剂的空间结构和金属离子的配位要求不相适应而产生较大的空间张力而降低络合物稳定性。
一般来说,中心离子半径小,空间位阻效应大。
Ca2+ <Sc2+ <Ti2+ <V2+ >Cr2+ >Mn2+ <Fe2+ <Co2+ <Ni2+ >Cu2+ >Zn2+
S结C构N相- 似 • 的N多配M齿位g配2+体在>空间C结a构2+允许>的S情r况2+下…, ….
一、中心离子对配合物稳定性的影响。
Li+ > Na+ > K+……. 配体的碱性大小可用加质子常数KH衡量碱性大小。 [Cd(en)2]2+ K稳=1. 1.螯合效应:在配位原子、配位数也一样的情况下,螯合物的结构比非螯合物稳定,也就是说螯环的形成使螯合物具有特殊的稳定性 。
。 Ca2+
<•Sc2+水<T和i2+ 金<V2属+ >C金r2+属>M离n2+子<F的e2+半<C径o2+大<N小i2+ 如>Cu下2+ >:Zn2+
• Li > Na > K ……. 强一制般构 5、型6:环螯稳合定+剂,的饱空和间5圆结环构+ 和饱金和属6+离圆子环的配位要求不相适应而产生较大的空间张力而降低络合物稳定性。
配合物稳定性3

两个配合物之间的氧化还原反应
• 两种机理 • 外层机理和内层机理
外界反应机理
[IrCl6]2- + [Fe(CN)6]4+ = [IrCl6]3- + [Fe(CN)6]3+
K = 4.1*105 L/mol˙s 属快速反应
Fe2+ ,Ir3+ d6组态,Fe3+ ,Ir4+ d5组态, 强场情况,取代反应惰性。 反应过程不可能有取代反应
内界反应机理
1)内界反应机理必备条件:
• A、两种反应物之一(通常是氧化剂)必须 带有桥连配体(具有两对以上孤对电子); • B、反应物之一(通常是还原剂)是取代反 应活性的。
2)基元步骤 (1)前身配合物的形成: Ox -X + Red –Y = Ox-X---Red + Y
(2)前身配合物的活化及电子转移: Ox-X---Red = -Ox---X-Red+ 电子转移机理: A、化学机理:桥基配体得到电子成为自由基 阴离子,随后电子再进入氧化剂的金属离子。 B、隧道机理:量子力学隧道效应。
外界反应机理
1)生成前驱配合物。
Ox + Red = Ox || Red (前驱配合物) 快反应 两种反应物相互接近达到一定平衡距离。 2) 前驱配合物的化学活化、电子转移及后继配合物的 形成。 Ox || Red = -Ox || Red+ 慢反应 化学活化:使两种反应物的内部结构(如M-L键 长)及中心原子的电子自旋状态相似,以便发生电子 转移,生成后继配合物。
** 判据:如果两个取代反应惰性的配合物, 它们之间电子转移速率较快,一般属外界机 理。
实验
• [Co(NH3)6]3+ + [Cr(H2O)6]2+
配合物在溶液中的稳定性

第一节 稳定常数的表示方法
一、总稳定常数
M + nL = MLn
a[ML ] K n= a[M ] a [L] n [MLn] . f[ML ] K n= [Mn+][L]n f[M ] f [L] n
n n+ n n+
[MLn] K n= [Mn+][L]n
lgfi = 0.509Zi2√I
一、中心离子性质对配合物稳定性的影响
(一) 中心离子的电子结构 1、惰气型金属离子 碱金属: Li+、Na+、K+、Rb+、Cs+ 碱土金属:Be2+、Mg2+、Ca2+、Sr2+、Ba2+ 及:Al3+、Sc3+、Y3+、La3+(镧系、锕系)
例 1 :对同一种配体(如二苯酰甲烷)形 成的配合物 稳定性:Li > Na > K > Rb > Cs Be > Mg > Ca > Sr > Ba 电荷相同的情况下,随半径增大,稳 定性变小 。
……………… …………
β= K1K2K3….Kn
大多数配合物形成体系的逐级稳定 常数是随配位数增加逐渐下降的。
原因: 1、统计效应; 2、立体障碍(只要配位水比水分子体积大, 这就是不可避免的); 3、静电效应(指配位体间的相互排斥)。
ML`N-nLn + L = ML`N-n-1Ln+1 + L`
正反应的速率(基元反应)为:kf[ML`N-n-Ln][L] kf∝(N-n) 正反应速率应为:k`f(N-n)[ML`N-n-Ln][L] 逆反应速率为:kb[ML`N-nkb∝(n+1) 1Ln+1][L`] k`b(n+1) [ML`N-n-1Ln+1][L`]
第三章水环境化学水中无机污染物的迁移转化

胶体微粒的吸附和聚沉对污染物的影响
④吸附和聚沉对污染物的影响
有人研究某入海河口铬、铜、汞的迁 移机制,测定了该河口底层水和表层底 泥中铬、铜、汞的含量及它们在底泥中 的富集系数(相对底层水),发现多年来 该河口水中铬、铜、汞含量,基本稳定 在标准以下,而部分站位表层底泥中有 时出现超标的情况;而且在表层底泥中 铬、铜、汞的平均富集系数很大,分别 为980~1100、164~500、18~45,呈 现明显的富集能力,其中对铬尤为显著。
第二节 水中无机污染物的迁移转化
无机污染物主要通过沉淀-溶解、氧化-还原、配合作 用、胶体形成、吸附-解吸等一系列物理化学作用进行 迁移转化,参与和干扰各种环境化学过程和物质循环 过程,最终以一种或多种形态长期存留在环境中,造 成永久性的潜在危害。
实际上微量污染物在水体中的浓度和形态分布,在 很大程度上取决于水体中各类胶体的行为。胶体微粒 作为微量污染物的载体,它们的絮凝沉降、扩散迁移 等过程决定着污染物的去向和归宿。在天然水体中, 重金属在水相中含量极微,而主要富集于固相中,在 很大程度上与胶体的吸附作用有关。因此,胶体的吸 附作用对水环境中重金属的过程转化及生物生态效应 有重要影响。
27
胶体微粒的吸附和聚沉对污染物的影响
②不同吸附剂对金属离子的吸附有较大
的差别
P.A.Krenkel和E.B.Shin等研究了各种天然 和人工合成的吸附剂对HgCl2的吸附作用, 其吸附能力大致顺序是:含硫的沉积物(还 原态的)>商业去污剂(硅的混合物、活性 碳)>三维黏土矿物(伊利石、蒙脱石)>含 蛋白去污剂>铁、锰氧化物及不含硫的天 然有机物>不含硫但含胺的合成有机去污 剂、二维黏土矿物和细砂。
26
补充:胶体微粒的吸附和聚沉对污染物的 影响
环境化学 2008_第三章 化学污染物的转化行为
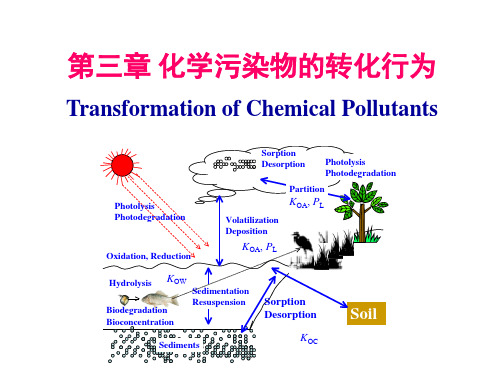
二、空气中硫氧化物的转化和硫酸烟雾型污染
Transformation of Sulfur Oxides in Air and Pollution of Sulfuric Acid Aerosol 1. 硫的来源 人为来源: 含硫矿物燃料燃烧 煤 (0.5-6%)占60%
n MeT [Me ] [Me(OH)z n ] z 1 n
PbO (s) + 2H PbO (s) + H
+
+
Pb2++H2O Pb(OH)+ Pb(OH)2 Pb(OH)3- +H+
lgKs0=12.7 lgKs1=5.0 lgKs2=-4.4 lgKs3=-15.4
PbO (s) + H2O PbO (s) + 2H2O
四、配合平衡
重要的无机配位体有:OH-、Cl-、CO32-、HCO3-、F-、S2-等。 有机配位体:天然水体中有动植物组织的天然降解产物,如氨 基酸、糖、腐殖酸;生活废水中有洗涤剂、清洁剂、EDTA、 农药和大分子环状化合物等。这些有机物相当一部分具有配合 能力。 (1) 配合物在溶液中的稳定性
对眼睛和呼吸道有强刺激作用。 O3等氧化剂
臭氧浓度 出现时间 毒 性
严重时可导致死亡。
注:本表摘自王晓蓉,1993。
有强氧化破坏作用,严重时可导致死亡。
三、溶解-沉淀
1. 金属类污染物可能发生的迁移和转化过程
高等有机化学第三章配合物在溶液中的稳定性

累稳定常数。
积累稳定常数的表示
M + L ML
M + 2L ML2
………..
M + nL MLn
ß 1=
[ML] [M][L]
ß 2=
[ML2] [M][L]2
ß n=
[MLn] [ML][L]n
我们可以得出第i级积累稳定常数ß i与逐级稳 定常数之间的关系: ß i=K1K2……Ki
S~C>I>Br>Cl>N>O>F
配离子的中心离子的性质、配体的性质以 Lewis酸碱分成硬的、交界的和软的酸碱。
硬碱中的价电子结合紧密(半径小),软碱中的价电子容易被极化(半径大)。
(4)(9-17)e-构型的金属 离子(d1-9)
(3)(18+2)e-构型的金属离子(d10s2)
及中心离子与配体之间的相互作用有关。 根据这种反应的实质,可以把路易斯酸称作电子接受体或亲电试剂,而把路易斯碱叫作电子给予体或亲核试剂。
上式中的K 、K ….K 称为配离子的逐级稳定 或者说,软酸、软碱之所以称为软,是形象地表明他们较易变形,硬酸、硬碱之所以称为硬,是形象地表明他们不易变形。
1 2 Lewis酸碱分成硬的、交界的和软的酸碱。
如,卤素离子(碱)对Al3+离子给电子能力为:
n
除去金属离子的性质外,配体的性质也直接影响配合物的稳定性。
n-1 n n 决定中心原子作为配合物形成体的能力的因素的主要有金属离子的电荷、半径及电子构型。
[ML ][L] ②含有价层未充满的原子的化合物,如BX3,AlX3;
n-1
显然,路易斯酸应该有空的价轨道,这种轨道可以是 轨道,也可以是 轨道。
(3)(18+2)e-构型的金属离子(d10s2)
配合物在水溶液中的稳定性

[Ag(CN)2]- +
判断[Ag(NH3)2]+是否可能转化为[Ag(CN)2]-。
上页
下页
返回
帮助
§7–2 配合物在水溶液中的稳定性
第七章 配位平衡与配位滴定
上页
下页
返回
帮助
§7–2 配合物在水溶液中的稳定性
第七章 配位平衡与配位滴定
上页
下页
返回
帮助
§7–2 配合物在水溶液中的稳定性
第七章 配位平衡与配位滴定
Cu2+ + 4NH3
[Cu(NH3)4]2+
平衡浓度/( mol/L) 1.0×10-3
x
1.0
已知[Cu(NH3)4]2+ 的= 2.09×1013
上页 下页 返回 帮助
§7–2 配合物在水溶液中的稳定性
第七章 配位平衡与配位滴定
将上述各项代入累积稳定常数表示式:
K稳
[Cu(NH 3 ) 4 ] 2 [Cu 2 ][NH 3 ] 4
1.比较同类型配合物的稳定性 较高。但不同类型配合物的稳定性则不能仅用 K 比较。 稳
K 对于同类型配合物,稳定常数 稳 较大,其配合物稳定性
例1:比较下列两配合物的稳定性: [Ag(NH3)2]+ [Ag(CN)2]= 107.23 = 1018.74
由稳定常数可知[Ag(CN)2]-比[Ag(NH3)2]+稳定得多。
3.判断配离子与沉淀之间转化的可能性
配离子与沉淀之间的转化,主要取决与配离子的稳定性和 沉淀的溶解度。配离子和沉淀都是向着更稳定的方向转化。
【例3】
在1L[Cu(NH3)4]2+溶液中(c(Cu2+)为4.8×10-17mol/L), 加入0.001molNaOH,问有无Cu(OH)2沉淀生成? 若加入 0.001molNa2S,有无CuS沉淀生成? (设溶液体积基本不变)。
2013-第五章--配合物的稳定性

解:[NH3] = [Ag(NH3)2+] = 1 mol·L-1时
Ag+ + 2NH3
Ag(NH3)2+
Kf = —[AA—gg+—(]N[N—HH3—)32]+—2 = —[A1—g+]= 1.7×107 [Ag+]= 5.9×10-8 mol·L-1
所以 [Ag(NH3)2+] + e
Ag + 2NH3
冠醚
穴醚
大环效应导致的高稳定性极大地扩展了碱金属配 位化学和配位化合物的研究范围。
§5-3 中心与配体的关系(软硬酸碱原理 )
(Hard and Soft Acids and Bases,HSAB)
1. 酸碱的软硬分类 在路易斯酸碱的基础上,进行酸碱的软硬分类 。
软(酸或碱): 指离子半径大、电荷低、易变形、容易被极化的物种。 硬(酸或碱): 指离子半径小、电荷高、不易变形、不易被极化的物种
第一章 配位化学基础知识 第二章 配合物的结构及异构现象 第三章 配合物的化学键理论 第四章 配合物的电子光谱 第五章 配合物在溶液中的稳定性 第六章 配合物反应动力学 第七章 新型配合物
第五章 配合物在溶液中的稳定性
§5-1 配合物的稳定常数 §5-2 影响配合物稳定性的因素 §5-3 中心与配体的关系 §5-4 配合物的应用
[Zn(NH3)4]2+ [Cu(NH3)4]2+ [HgCl4]2[Zn(CN)4]2[HgI4]2[Hg(CN)4]2[Co(NH3)6]2+ [Cd(NH3)6]2+ [Ni(NH3)6]2+ [AlF6]3[Fe(CN)6]4[Co(NH3)6]3+ [Fe(CN)6]3-
《配合物稳定性》课件

在这个课件中,我们会探讨什么是配合物稳定性,以及稳定性和不同因素之 间的关系。
配位数和稳定性的关系
八面体配位数
具有最高稳定性的八面体配合物通常有六个配位中 心。
四面体配位数
四面体配位数的配合物通常比八面体配位数的配合 物不稳定。
方形平面配位数
较稳定的配合物通常包含四个平的影响
1
低自旋配合物
通常具有较高的稳定性,因为自旋配对缩小了金属中心的电子空间。
2
高自旋配合物
通常较不稳定,因为它们的电子是分散的。
3
极化配合物
一般比其他种类的配合物更稳定,因为它们的配体不能自由旋转,金属配体之间 的相互作用更强烈。
配合物的结构和稳定性的关系
线性配合物
最不稳定的结构类型,因为它们通常有高度偏 离理想形状的键角度。
1
铁系催化剂
通常较稳定,能够革取较好的催化成果。
2
铝系催化剂
具有难以分散和不稳定的特点,但也有着催化活性较好的情况。
3
其他催化剂
根据成分和性质有差异。
配合物的分解动力学和稳定性的关系
反应速率
通常,反应速率越慢,配合物 就越稳定。
反应热度
反应热度越高,配合物就越不 稳定。
过渡状态
较为不稳定的配合物可能会在 反应过程中产生过渡态。
八面体配合物
较稳定的结构类型,因为八面体的理想结构是 非常稳定的。
扭转配合物
不如其他类型的结构稳定,因为它们的键角度 往往是无序的。
四面体配合物
较不稳定的结构类型,因为四面体配位中心的 最小能量对比八面体配位中心要高。
配合物中金属离子的电荷密度的影响
高电荷密度
配合物化学-2-稳定性规律

(三)配体本性的影响
例如: 稳定常数
lgKCuL = 1.5851
加质子常数
lgKH1 — 2.544
lgKCuL2 = 1.6751
lgβCuL2= 3.0311 lgKNiL = 0.8001 lgKZnL= 0.8111
lgKH1 — 3.855
lgKH1 — 5.278 lgKH1 — 0.543 lgKH1 — 0.673
(三)配体本性的影响
如果有对此反常的现象,则往往是由于形成的 螯环中张力太大,即螯环处于严重的扭曲状态而勉 强形成螯环或者事实上根本没有形成螯环。
表6-5 Mn (II) –-OOC(CH3)nCOO-体系的稳定常数(25℃)
n 0 1 2 3 5 7 螯环大小 5原子 6原子 7原子 8原子 10原子 12原子 lgK1 3.2 2.30 1.26 1.13 1.08 1.03 I 0.1 0.16 0.16 0.16 0.16 0.16
Na+
K+ Cs+
-0.6(18℃)
-0.15 0.01(18 ℃ )
0.70
0.85 ——
0.53
0.96 ——
-0.48
-0.26 ——
Be2+
Mg2+ Ca2+ Sr2+ Ba2+
-0.6(I=4.0)
—— 0.7 0.8 0.9
1.95
2.23 2.31 2.55 2.7
——
1.82 1.98 2.04 2.27
配体与金属离子结合而形成配位个体,在形式上同该 配体与氨离子结合而形成的共轭酸有类似之处。
(三)配体本性的影响
2、光谱化学序列
第三章配合物的稳定性

该规则初步解释如下: 一般来说,属于硬酸的金属离子倾向于与其他原子以 静电引力结合,因而作为配合物的中心离子的硬酸与 配位原子电负性较大的硬碱较易结合。如(1)(2) (3)。 而软酸金属离子与配位原子间主要以共价键结合,倾 向于和配位原子电负性较小的软碱结合。如(4)。 对(6)的解释: N < < P>As> Sb σ键→增强
3. 软硬酸碱规则应用实例
硬酸金属离子易与配位原子为O,F的硬碱结合,NH3 的硬度不如OH-,因此在这些金属离子水溶液中,不能 形成氨的配合物,如Mg2+,La3+,Al3+,Fe3+,只能得到氢氧 化物沉淀. 而软酸金属离子则可以在水溶液中形成NH3的配合 物,如Ag+,Cd2+等,[Ag(NH3)2]+.
碱
硬碱: OH-, F-, NH3,H2O,PO43-,SO42-,CO32,ClO4-,NO3-,ROH等(N,F,O)
交界碱: Br2+-, py,NO2-, Cl-,SO32- ,N2等 I-, CN-, S2-,CO,C2H4,R3P,R3As等 软碱: (S,P,As)
硬碱:体积小,变形性小,电负性大,难被氧化
例如:配位化学中,作为中心离子的硬酸与配位原子 各不相同的配体形成配合物倾向为: F>Cl>Br>I (1) O>>S>Se>Te (2) N>>P>As>Sb (3) 而与软酸中心离子形成配合物倾向为: F< Cl <Br< I (4) O < < S ~ Se ~ Te (5) N < < P>As> Sb (6)
分步稳定常数:
ML + L ML2
[ MLn ] 累积稳定常数: n K1 K 2 K n n [ M ][ L]
配合物在溶液中的稳定性

[ML 2 ] β 2 = K 1K 2 = [M][L]2
β 3 = K 1K 2 K 3 =
[ML 3 ] [M][L]3
逐级稳定常数
积累稳定常数
最高配位数的积累稳定常数= 最高配位数的积累稳定常数=总稳定常数
第三章 配合物在溶液中的稳定性
化学与化工学院
3.2 中心离子性质对配合物稳定性的影响
第三章 配合物在溶液中的稳定性
稳定常数的表示方法
中心原子性质对配合物稳定性的影响 4
配体性质对配合物稳定性的影响 配位原子性质和中心原子的关系
第三章 配合物在溶液中的稳定性
化学与化工学院
第三章 配合物在溶液中的稳定性
• 稳定性是配合物在溶液中的一个重要性质,在化 稳定性是配合物在溶液中的一个重要性质, 学上有其重要的意义,研究某种配合物时, 学上有其重要的意义,研究某种配合物时,首先 要考虑它在给定条件下是否稳定。 要考虑它在给定条件下是否稳定。 • 稳定性大小常用稳定性常数描述的,稳定常数越 稳定性大小常用稳定性常数描述的, 配合物越稳定。 大,配合物越稳定。 • 稳定常数 K 稳定常数—K 逐级稳定常数—Kn 逐级稳定常数 Kn 积累稳定常数—β 积累稳定常数 β
作用力: (1) 作用力: 中心离子与配体间的作用主要是静电作用结合 成配离子。 成配离子。 影响配合物稳定性的因素: (2) 影响配合物稳定性的因素: 取决于中心离子的电荷和半径。 取决于中心离子的电荷和半径 。 中心离子的电 荷越大,半径越小形成的配离子越稳定。 荷越大,半径越小形成的配离子越稳定。
第三章 配合物在溶液中的稳定性
化学与化工学院
二、 d10型金属离子 Cu( Ag( Au( Cu(Ⅰ)、Ag(Ⅰ)、Au(Ⅰ) Zn( Cd( Hg( Zn(Ⅱ)、Cd(Ⅱ)、Hg(Ⅱ) Ga(Ⅲ)、In(Ⅲ)、Tl(Ⅲ) Ga( In( Tl( Ge( Sn( Pb( Ge(Ⅳ)、Sn(Ⅳ)、Pb(Ⅳ) 作用力: (1)作用力: 这些离子与配体间结合时, 这些离子与配体间结合时 , 在不同的程度上有明显的 共价性。 共价性。 稳定性的规律: (2)稳定性的规律: 这种金属离子的配合物一般比电荷相同、 ① 这种金属离子的配合物一般比电荷相同、体积相近 的惰气型金属离子的配合物要稳定。 的惰气型金属离子的配合物要稳定。 Zn( Cd( Hg( ② Zn(Ⅱ)、Cd(Ⅱ)、Hg(Ⅱ)这三种金属离子配 合物的稳定性是Hg Hg( 的最高。 合物的稳定性是Hg(Ⅱ)的最高。
配合物在溶液中的稳定性

m
m H
mL
( 4)
标准自由能与热力学平衡常数之间的关系:
RT ln K G ML m H M HmL
(5)
将(4)代入(5)得:
ln ML ln H m L (M ML H m ) / RT L H m
对称性和轨道的简并度, 使体系的能量进一步下降, 这种效应称为姜-泰勒效应。 例如:Cu2+(3d9) 离子形成正八面体构型的配合物 时, d轨道分裂成t2g和eg二组轨道, 其中基态的电子 构型为t2g6e2g3, 那么eg轨道上的3个电子就有两种排
列方式:
(1)t 2g eg t 2g [(d z 2 ) 2 (d x 2 y 2 )1 ]
四、空间位阻及配合物的构型
1.空间位阻 在配体中引入适当的基团,一方面可使配合物的 稳定性增加,另一方面也可产生空间位阻,使稳定 性下降。 例如:8-羟基喹林与2-甲基-8-羟基喹啉和某些金属 离子形成配合物。
8-羟基喹林
2-甲基-8-羟基喹啉
配体
Co2+
Mn2+
Pb2+
Cu2+
Ni2+
8-羟基喹林 9.83 2-甲基-8-羟 10.10 基喹啉
对于Zn(Ⅱ)、Cd(Ⅱ)或Hg(Ⅱ)来说,同一金属元素 的各种卤素离子配合物之间的稳定性, Cd(Ⅱ)和 Hg(Ⅱ)的不同卤素离子配合物的稳定性顺序都是F<Cl-<Br-<I例如:[HgF4]2-<[HgCl4]2-<[HgBr4]2<[HgI4]2原因:从离子极化的观点解释,随着卤素离子变 形性的增加,共价性增强,从而配合物的稳定性 增大。 但Zn(Ⅱ)的稳定性却是F->Cl->Br->I-,说明Zn(Ⅱ) 的卤素离子配合物中以静电作用为主。
03-5环境化学第三章__水环境化学

L M
K1
L ML
K2
L ML 2 Kn-1
L
…………….
Kn
MLn
β2
βn
Kn
[MLn ] [MLn1 ][L]
n
[MLn ] [M ][L]n
=K1K2……Kn
➢Kn或βn越大,配合离子愈难离解,配合物也愈 稳定。因此,从稳定常数的值可以算出溶液中各 级配合离子的平衡浓度。
一般而言,配合物的稳定性取决于三个因素: ➢配位体的性质,多齿配位体比单齿配位体稳定 ➢金属离子半径与电荷:
配位体半径越小,越稳定 金属离子的化合价越高,则一般配合物越稳定 ➢金属在元素周期表中的位置:同族元素从上到下 其络合物稳定性增加。
稳定常数是衡量配合物稳定性大小的尺度。 包括:逐级生成常数(K)和累积生成常数(β)
2- 4
K1
[MeOH ] [Me2 ][OH ]
K2
[Me(OH )20 ] [MeOH ][OH ]
K3
[Me(OH )3 ] [Me(OH )20 ][OH
]
K4
[Me(OH)4 2 ] [Me(OH) 3][OH ]
或者也可以写为:Me2++ OH-→Me(OH)+
Me2++
2OH-→Me(OH)
=β1 [Me2+][OH-]/ [Me]T 在一定温=度ψ0下β1,[OβH1、-]β2、…、βn等为定值, ψ仅是pH值的函数。 因此ψ可2 =以[M表e示(OCHd)22+0—] /O[MH-e]配T =合ψ离0子β2在[O不H同-]p2 H值下的分布。
ψ3 =[Me(OH) 3-] / [Me]T = ψ0 β3[OH-]3 ψ4 =[Me(OH) 42-] / [Me]T = ψ0 β4[OH-]4 ψn =[Me(OH) nn-2] / [Me]T = ψ0 βn·[OH-]n
配位化学第一组第三章作业

第三章配合物在溶液中的稳定性作业1.下列各组中,哪种配体与同一种中心离子形成的配合物稳定性较高,为什么?(1)Cl- , F-和Al3+(2)Br-,I-和Hg2+(3)2CH3NH2,en和Cu2+(4)Br-,F- 和Ag+(5)RSH,ROH和Pt2+(6)Cl-,OH-和Si4+(7)RSH,ROH和Mg2+解(1)F-与Al3+形成配合物更稳定,因为F-电负性大,离子半径更小(2)I-与Hg2+更稳定,因为碘离子的电负性较大,离子半径更小(3 )2CH3NH2与Cu2+形成的配合物更稳定,因为它的碱性比en更强与形成的配合物更稳定(4)Br-与Ag+形成的配合物更稳定,因为与Ag+形成配合物Br-变形性比F-强(5)RSH与Pt2+形成配合物更稳定,因为在与Mg2+形成配合物时S 的半径小于O的半径(6)OH-与Si4+形成的配合物更稳定,因为在与Si4+形成配合物时OH-的电荷比更多(7)RSH与Mg2+形成配合物更稳定,因为在与Mg2+形成配合物时S 的半径小于O的半径2.写出下列,配体与中心离子形成的配合物的稳定次序。
解(1)CH3NH2,en,NH2-NH2,NH2-OH和Cu2+en > CH3NH2 > NH2-NH2 > NH2OH(2)R3CCOOH,CH3COOH,Cl3CCOOH,I3CCOOH和Fe3+ R3CCOOH > CH3COOH > I3CCOOH > Cl3CCOOH(3)NH3,NH2-NH2,NH2-OH,R-OH和Ag+NH3 > NH2-NH2 > NH2-OH > R-OH(4)N, NH2与Zn2+N>NH2(5)NH2O2N,NH2CH3,NH2NO2与Cu2+NH2 CH3>NH2NO2>NH2O2N(6)NOH,NOHCH3与Ni2+NOHCH3>NOHCH33.下列二组试剂与同一种金属离子形成螯合物时,估计lg k的大小次序:解:(1)NH 2NO 2NH2CH3NH2NO2 2 > 3 > 1(2)1. 2.3. 4.3 > 2 > 1 > 4(3)M(en)3,M(Pn)3,M(dien)2M(en)3 > M(dien)2 > M(Pn)34.解释下列各胺与Cu(II)形成配离子稳定性的差别:配体lgk1(25oC)乙二胺10.551,2-二氨基丙烷10.651,3-二氨基丙烷9.981,2,3,-三氨基丙烷11.1解:当配位原子相同时,配体碱性越强,越易给出电子,形成的配合物往往越稳定。
配位化学:配合物在溶液中的稳定性

硬酸是指外层电子结合得紧的金属离子或原子。
特征:体积小,电荷高,不易极化。
如: H+ 、Mg2+ 、Al3+
软酸是指外层电子结合得松的金属离子或原子。
特征:体积大,电荷低,易于极化。
如:Cu+ 、 Ag+ 、 Au+
交界酸:介于两者之间的金属离子。
31
32
硬碱是指对外层电子结合得紧的一类路易斯碱。 特征:变形性小,电负性大,不易失去电子。 如: F- 、 OH-
[Cu(NH3)4]2+
反应平衡常数为
Cu2+ + 4NH3
K
[Cu 2 ][NH3 ]4 [Cu(NH 3 )42 ]
K称为[Cu(NH3)4]2+的不稳定常数,用K不稳表示。 K不稳越大, [Cu(NH3)4]2+越容易离解,配离子越不稳定。
1 K稳 K不稳
铜氨配离子的形成过程
10
2. 逐级稳定常数
lgk1 13.62 8.54 7.17 6.40 6.10
稳定性顺序为: Li > Na > K > Rb > Cs
Be > Mg > Ca > Sr > Ba
19
电子构型不同,离子半径相近的中心离子,其配 合物稳定性相差很大;
例:[Mg(EDTA)] [Cu(EDTA)]
lgK稳=8.64 lgK稳=18.70
1
配合物在溶液中的稳定性
一、 稳定常数的表示方法
1.稳定常数K稳
2. 逐级稳定常数 3 .累积稳定常数
二、影响配合物在溶液中稳定性的因素
1.中心离子的性质对配离子稳定性的影响 2. 配体性质对配合物稳定性的影响 3. 软硬酸原则与配合物稳定性的关系
(1)溶液中配合物的稳定性

第六章 配合物在溶液中的稳定性第一节 影响配合物稳定性的因素一、概述逐级稳定常数和积累稳定常数:M + L = ML [M][L][ML]K 1=[M ][L ][M L ]K β11==ML + L = ML 2[M L ][][ML K 22=22212[M ][L ]][M LK K β== …………… ……………… …………二、金属离子对配合物稳定性的影响1、具有惰性气体电子结构的金属离子碱金属:M+碱土金属:M2+及:Al3+、Sc3+、Y3+、La3+金属离子z/r越大,配合物越稳定。
例:二苯甲酰甲烷[phC(O)CH2C(O)ph]配合物的lgK1值(30℃,75%二氧六环)M2+ lgK1Be2+13.62Mg2+8.54Ca2+7.17Sr2+ 6.40Ba2+ 6.102、Irving-Williams顺序研究发现:第四周期过渡金属离子与含O、N配位原子的配体的高自旋八面体配合物,其稳定性顺序如下:Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ > Zn2+CFSE(Dq) 0 -4 -8 -12 -6 0e gt2g这称为Irving-Williams顺序,可用CFSE解释。
Ni2+< Cu2+,可用Jahn-Teller效应解释。
三、配体性质对配合物稳定性的影响1、碱性配位原子相同,结构类似的配体与同种金属离子形成配合物时,配体碱性越强,配合物越稳定。
例:Cu2+的配合物:配体lgK H lgK1BrCH2CO2H 2.86 1.59ICH2CO2H 4.051.912、螯合效应1)螯合效应:螯合环的形成使配合物稳定性与组成和结构相似的非螯合配合物相比大大提高,称为螯合效应。
例:[Ni(NH3)6]2+lgβ6 = 8.61;[Ni(en)3]2+lgβ3 = 18.26稳定常数增加近1010倍。
2)螯合环的大小5员及6员饱和环稳定性较好,且5员饱和环更为稳定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硬酸:其接受电子对的原子(离子)正电荷高,变形性低。
如:Li+、Mg2+、Al3+。
软酸:其接受电子对的原子(离子)正电荷低,变形性高。
如:Cu+、Ag+、Au+。
硬碱:其给出电子对的原子变形性小,电负性大。
如: F-、OH-。
软碱:其给出电子对的原子变形性大,电负性小。
如: I-、S2-。
2、软硬酸碱规则在配合物稳定性中的应用
1)硬酸倾向于与硬碱结合;
2)软酸倾向于与软碱结合;
配位化学中,作为中心离子的硬酸与配位原子各不相同的配体形成配合物倾向为:
F>Cl>Br>I (1)
O>>S>Se>Te (2)
N>>P>As>Sb (3)
而与软酸中心离子形成配合物的倾向的顺序为:
F < Cl < Br < I (4)
O << S ~ Se ~ Te (5)
N << P > As > Sb (6)
对(6)的解释:
σ键增强
N << P > As > Sb
空d轨道:无3d 4d 5d
反馈π键减弱
π键作用大于σ键。
对于O << S ~ Se ~ Te (5),可作类似解释。
3、软硬酸碱规则应用实例
Mg2+ + NH3·H2O Mg(OH)2↓
Ag+ + NH3·H2O [Ag(NH3)2]+
五、其他因素对配合物稳定性的影响
1、温度的影响
对于放热的配位反应,T上升,K减小;
而对于吸热的配位反应,T上升,K增大。
2、压力的影响
压力变化很大时,不可忽略。
如:Fe3+ + Cl- == [FeCl]2+
压力由0.1atm增至2000atm时,K减小约20倍。
*研究海洋中配合物的平衡时要考虑压力的影响。
3、溶剂的影响
1)当溶剂有配位能力时,有如下竞争反应:
ML + S == MS + L
S配位能力越强,ML稳定性越差。
如[CoCl4]2-在下列溶剂中的稳定性顺序:。
