热原和内毒素去除技术的应用探讨-Pall
热源、内毒素相关说明

去除水中的内毒素(热源),可以选用超纯水系统来去除。
特别是在做细胞和组织培养、蛋白质分析和蛋白质纯化等实验时,内毒素(热源)的存在会直接导致培养物的污染而失败,为此,应该用超纯水系统来除实验室用水中的热源。
如果进水为自来水,则一般的顺序是:1、预处理2、RO(反渗透)3、初级纯化(离子交换)4、双波长UV灯消毒5、超滤柱(去内毒素)6、终端过滤器(最后一道过滤)。
这样得出的水就是实验室级超纯水,一定会符合你的需要。
我们昨天药剂课刚学的,水中内毒素的消除方法有:离子交换法、凝胶过滤法、蒸馏法和反渗透法制药用水热源的去除去除热原是制药用水系统设计建造的重要目标之一。
自水的预处理开始,直到注射用水的使用点,水处理的许多工艺环节都考虑了去除热原的要求,如活性炭过滤、有机物去除器、反渗透、超过滤及蒸馏。
中国及美国现行版药典中,对纯化水尚没有控制内素的标准,但在欧洲药典2000增补版中,已作出了“细菌内毒素低于0.25EU/mL”的规定,这意味着对制药用水内毒素的控制将会更加严格。
至于对注射用水,中国药典和欧美药典对细菌内毒素的控制标准已完全一致。
现拟对制药用水系统去除热原常见的方法作一简单介绍。
1、反渗透反渗透膜的孔径最小,按其阻滞污染物(包括热原)的分子量大小计,一般在100~200之间。
由于热原的分子量在5×104以上,其直径大小一般在1~50μm之间,因此能被有效去除。
美国药典将反渗透作为注射用水的生产方法,意味着反渗透技术在去除热原方面的成熟。
2、超过滤微孔滤膜过滤有某种去除热原的功效。
它利用筛分、静电吸附、架桥,利用微孔滤膜拦截直径比较大的那一部分热原物质。
应当指出,这种去除是很不完全的,直径比较小的热原物质会通过0.22μm的微孔滤膜,微小的热原可以透过0.025μm的滤膜,最小的热原体可以穿透所有的微孔滤膜,污染水体。
由于热原分子量越大,致热作用就越强,因此利用微孔滤膜进行除菌过滤时,客观上可能会起到某些截留热原的积极作用,但它不能作为去除热原的可靠方法而单独使用。
细菌内毒素和热原检查法详解演示文稿

第42页,共43页。
加样
编号
A B C D
内毒素浓度/配制内毒素的溶 液
无/供试品溶液
平行管 数
2
2λ/供试品溶液
2
2λ/检查用水
2
无/检查用水
2
注:A为供试品溶液;B为供试品阳性
对照;C为阳性对照;D为阴性对照
凝固酶
凝固蛋白原
凝固蛋白
凝胶
第16页,共43页。
实验试剂:
鲎试剂:是从栖生于海洋的无脊椎动物“鲎”的 蓝色血液中提取的变形细胞溶解物,经低温冷冻 干燥精制而成的生物制剂。鲎试剂的生物活性以 其能检出细菌内毒素的最低有效浓度表示。 鲎试剂的灵敏度是用细菌内毒素来标定的,因此 标定鲎试剂灵敏度所用的细菌内毒素必须是统一 且标准的。
1 科学性:有生物化学的理论基础。
2 准确性:是酶的分子生化反应,专属性高, 重现性强。
3 灵敏性:鲎试剂和细菌内毒素的反应灵敏 度极高,
第12页,共43页。
当内毒素量低到10-10g/ml浓度,它们 都能起凝胶反应,至今未发现一种物质对 鲎试剂的反应比细菌内毒素更灵敏。
4 实用性:方法快速,操作简单,无 需特殊仪器设备,经济实用。
若使用的鲎试剂的规格不是0.1ml/支时, 按标示量加入BET水复溶,将溶解后的 鲎试剂液混匀后每0.1ml分配到10×75m m凝集管中,要求至少分配6管备用。
第40页,共43页。
供试液的稀释
使用鲎试剂的灵敏度标示值小于供试品 的细菌内毒素限量时,用检查用水将供 试液稀释后进行试验,公式如下:
细菌内毒素和热原检查法详解 演示文稿
第1页,共43页。
(优选)细菌内毒素和热原检 查法
第2页,共43页。
热原检查法与细菌内毒素检查法联合应用进行大输液热原检查

( 稿 日期 收
2 0 -5 1 ) 0 80 —5
t na dlbr J . el lil19 19 -6 i n ao『 C lMoBo,9 0, :39 . o I
热原检查法与细菌 内毒素检查法 联 合 应 用 进 行 大 输 液 热 原 检 查
卢 贞
( 泰安荣军医院 , 山东 泰安 2 10 ) 70 0
泰山医学 Nhomakorabea院
学
报
791
J OURNALOFTAI HAN ME CAL COL GE Vo. 9 No 0 2 8 S DI LE 12 .1 00
参 考 文献 :
[ ] 呼格 吉乐图, 1 苏布达 , 王志.肥 大细胞 的组织化 学与超微 结构 异质性 [] J .细胞 生物 学杂志 , 0 7 2 8084 20 ,9:4 - . 4 [ 1 刘爱 军, 2 罗善云 , 孟运莲 , 等.动情 周期 中大鼠子 宫和输 卵管壁 肥大细胞数量 变化 的研 究[ ] 中 国组织化 学 与细胞 化 学杂 J.
f 1 成令 忠, 5 钟翠平 , 文琴. 蔡 现代 组织 学[ . 海, M] 上 上海科 学技
术 出版 社 .0 3:9 .9 . 2 0 l 11 7
『 ] S h a T o a isH. e t p i rec i n l l el e 6 c rmm R。 h r cu N ur hl e rut t nna " ld — l o me i sc —
5 071 6A 、 0 0A 、091 5 91 5 0C、 0 A 、 l 6A 、 1 8C 、 21 51 08 5I 1 51 2 51 5C。
查热原可靠性 强 , 且操 作简便 , 成本低 , 省时 , 省力 , 是热 原检 查 的发展方 向。相 比之下 相对古 老的热原 检查 法 ( 家兔法 )
生物制剂中内毒素去除方法概述

(6)其他亲和吸附配基。 除以上所述配基之外还有很多 种配基如壳聚糖、季铵盐、胺类、多肽类等对 LPS 的去除也有 较好的效果。
三 展望 近年来,LPS 的去除研究已经取得了很大进展,生物技术 产品在制药工业中的比重越来越大,其 LPS 去除工艺的研发
以及工业化规模扩大仍是今后研究的热点。 参考文献: [1]焦炳华.分子内毒 素 学[M].上 海:上 海 科 学 技 术 文 献 出
(5)氨基酸。 自 20 世纪 80 年代起组胺(Him)、组氨酸(His) 就开始作为配基去除 LPS。由于 His 生物活性较高、价格和毒 副作用都较小而更受欢迎,其作用主要来自于连接载体与配 体 的 间 隔 臂(如 己 二 胺)和 组 氨 酸 上 的 咪 唑 环 ,但 受 pH 的 影 响较大。 除组氨酸外,赖氨酸、精氨酸等氨基酸也被认为能与 LPS 发生作用。
98
2015 年第 4 期
LPS 血症中的 LPS。 免疫亲和具有高度特异性,但是这种配基 制备困难,应用范围狭窄,同时还有价格昂贵、洗脱困难的问 题。
(2)多粘菌素 B(PMX-B)。 PMX-B 能 依 靠 其 环 形 肽 结 构 降解革兰氏阴性细菌的细胞壁,其阳离子与类脂 A 的磷酸基 团之间的静电作用力和疏水作用力使其能识别不同来源的 LPS 分子。 采用固定 PMX-B 的纤维素(或琼脂糖)载体 去 除 LPS,有良好的效果和稳定性。但是 PMX-B 的价格昂贵,且有 肾毒性和神经毒性,应谨慎应用。
输液热原反应与细菌内毒素限量的关系

输液热原反应与细菌内毒素限量的关系
张振梅;阴爱清;李海燕;武立霞
【期刊名称】《护士进修杂志》
【年(卷),期】2001(016)003
【摘要】@@ 在医院治疗护理工作中,输液热原反应并不少见.此反应的发生除与不严格执行无菌操作原则有关,还与输入的液体、药物及使用的输液器中的细菌、热源、澄明度三大因素呈正相关.为了降低输液反应发生的机会,医院中心供应室运用细菌内毒素检查法(以下简称BET)对一次性使用输液器的质量进行监控把关,是一种十分有效的方法.本文结合我室运用BET检测一次性使用输液器工作的实践,说明输液热原反应与输液器中内毒素的限量密切相关,提示医院供应室开展BET的必要性.
【总页数】1页(P233)
【作者】张振梅;阴爱清;李海燕;武立霞
【作者单位】北京军区总医院消毒供应室;北京军区总医院消毒供应室;北京军区总医院消毒供应室;北京军区总医院消毒供应室
【正文语种】中文
【中图分类】R4
【相关文献】
1.静脉输液致热原反应死亡1例
2.开展药学服务控制输液热原反应
3.100例临床输液热原反应的原因及对策
4.输液热原反应与细菌内毒素的定量研究
5.预防输液热原反应的护理体会
因版权原因,仅展示原文概要,查看原文内容请购买。
去除内毒素的研究及临床应用(一种新型亲和层析膜内毒素清除初步应用)

去除内毒素的研究及临床应用(一种新型亲和层析膜内毒素清除初步应用)周康;刘康达;陈梅芳;谢倩;张尤历;商振华;郭为【期刊名称】《镇江医学院学报》【年(卷),期】1998(8)4【摘要】随着生物工程及生命医学及制药工业迅速发展,尤其许多重要的产品被开发,多种生物原物质可通过生物工程获得,但其表达工程菌往往是大肠杆菌.产品易受内毒素污染,迫切需要一种高效能的用于去除内毒素的色谱柱。
这是目前生物技术产品中有待解决的问题之一。
因此,需要一种能清除内毒素的有效手段,既不破坏原有的有效成份,又能够完全地把内毒素去除。
亲和色谱法是利用物质的生物学特性来表达到物质的分离,是去除内毒素的一种期望中较为理想的方法。
我们以大孔纤维膜(尼龙66)为介质,以已二胺为间隔臂.以组氨酸或多粘菌素B为配基.制备成亲和层析膜.同时以应用较为灵敏的定量内毒素的检测技术(最低检测限达0.03Eu /ml,最高检测限达0.5Eu/ml)对不同产品制剂内含内毒素去除前后进行定量检测分析。
初步进行了自来水含内毒素的清除率,它能达到99.86%,对胸二磷胆碱纳(CytidineDiphosphateCholineCDP-C)内含内毒素的清除率达95.3%,而其药品的有效成分保留车在88%~95.5%。
另外,对此膜的一次再生率也能达到99.8%的内毒素清除率。
初步结果认为它是在目前方法手段中只为理想的一种清除内毒素的方法。
它的最大优点就在于“亲和”对内毒素能较好地予以吸附.对其他有好成份一律不予吸附或吸附量甚微。
同时.保留?【总页数】2页(P465-466)【关键词】内毒素清除;亲和层析膜;生物技术产品【作者】周康;刘康达;陈梅芳;谢倩;张尤历;商振华;郭为【作者单位】上海医科大学附属中山医院实验研究中心;中科院大连化学物理研究所【正文语种】中文【中图分类】TQ464;TQ460.64【相关文献】1.聚酰胺亲和膜色谱用于去除内毒素的研究Ⅱ.去除条件最佳化和应用 [J], 商振华;周冬梅;郭为;于亿年;周良模;潘明臣;周康2.一种新型兔源内毒素结合蛋白的分离纯化及体外生物活性的初步研究 [J], 葛晓冬;刘友生;王晓东;潘峰;周萍3.亲和层析法去除新生小牛血清内毒素的初步研究 [J], 宋崴4.去除内毒素的研究及临床应用(一种新型亲和层析膜内毒素清除初… [J], 周康;商振华5.应用亲和层析法去除内毒素的研究 [J], 赵克胜;孔海燕;张小纯因版权原因,仅展示原文概要,查看原文内容请购买。
去除内毒素的方法总结
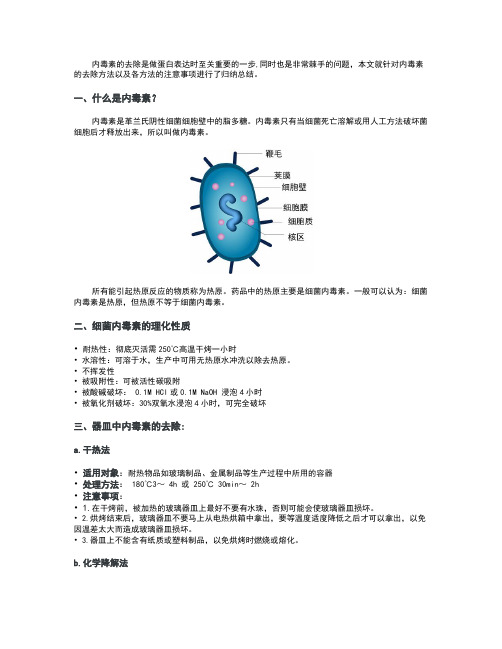
内毒素的去除是做蛋白表达时至关重要的一步,同时也是非常棘手的问题,本文就针对内毒素的去除方法以及各方法的注意事项进行了归纳总结。
一、什么是内毒素?内毒素是革兰氏阴性细菌细胞壁中的脂多糖。
内毒素只有当细菌死亡溶解或用人工方法破坏菌细胞后才释放出来,所以叫做内毒素。
所有能引起热原反应的物质称为热原。
药品中的热原主要是细菌内毒素。
一般可以认为:细菌内毒素是热原,但热原不等于细菌内毒素。
二、细菌内毒素的理化性质•耐热性:彻底灭活需250℃高温干烤一小时•水溶性:可溶于水,生产中可用无热原水冲洗以除去热原。
•不挥发性•被吸附性:可被活性碳吸附•被酸碱破坏: 0.1M HCl或0.1M NaOH 浸泡4小时•被氧化剂破坏:30%双氧水浸泡4小时,可完全破坏三、器皿中内毒素的去除:a.干热法•适用对象:耐热物品如玻璃制品、金属制品等生产过程中所用的容器•处理方法: 180℃3~ 4h 或 250℃ 30min~ 2h•注意事项:• 1.在干烤前,被加热的玻璃器皿上最好不要有水珠,否则可能会使玻璃器皿损坏。
• 2.烘烤结束后,玻璃器皿不要马上从电热烘箱中拿出,要等温度适度降低之后才可以拿出,以免因温差太大而造成玻璃器皿损坏。
• 3.器皿上不能含有纸质或塑料制品,以免烘烤时燃烧或熔化。
b.化学降解法•适用对象:主要用于去除玻璃、塑料和其它高分子材料器皿上的内毒素。
•处理方法:常用3~5%双氧水、重铬酸钾硫酸清洁液(重铬酸钾∶硫酸∶水常用配比1∶1∶10 或1∶2∶8 )、0.1M HCl或0.1 M NaOH浸泡去除。
一般处理4h以上。
•注意事项:佩戴防护用具,防止皮肤直接接触。
四、溶液中内毒素的去除但是,各种去内毒素的方法不是孤立的,可以相互结合使用。
比如,如果液相分离法得到的蛋白内毒素水平未达标,可以接着利用分子筛法进一步去除内毒素。
五、作为目前去内毒素常用的方法,液相分离法的注意事项值得我们重视1.液相分离方法应用于蛋白纯化中内毒素的去除a.目的蛋白上样后,用预冷的基础溶液+1% Triton X-114缓慢淋洗柱子,直至A280数值稳定不变;b.用预冷的去内毒素基础溶液淋洗柱子,直至A280数值达到基线,稳定不变;c.用各梯度去内毒素的洗脱液洗脱,收集各洗脱液于去内毒素的收集管中。
热原检测及其消除方式讨论

热原检测方法及其消除方式目录热原及其本质 (3)定义 (3)本质 (4)二、热原发热的机理 (4)三、热原的检测方法 (5)1.家兔法 (5)2.细菌内毒素检测法 (6)3.单核细胞激活实验法(检测疫苗类生物制品) (7)4.白细胞系法 (7)(1)THP一1细胞法 (7)(2)MonoaM一6细胞法 (7)(3)28SC细胞法 (8)5.体外人全血法 (8)四、热原消除方式 (8)1.蒸馏法去除热原 (8)2.离子交换法除去热原 (9)3. 酸碱处理法除热原 (9)4高温法 (9)5.活性炭吸附法 (9)6.超滤法 (9)五、结论 (10)热原检测方法及其消除方式讨论[摘要] 本文较深入探讨了热原的本质及其作用机理,由此对多种检测方法和消除方式进行分析。
其中,检测方法有家兔法、细菌内毒素检测法、单核细胞激活实验法、白细胞系法和体外人全血法;消除方式包括蒸馏法、高温法、活性炭吸附法和超滤法。
新老方法并存,每一项检测方法和消除方式都有其自身的优势和缺陷。
随着科技的发展,未来热原的种类和作用机理将被研究清楚,而对应的检测方法和消除方式也将得到更新和升级。
[关键词] 热原;检测;消除100多年前,即研发了注射剂之后,非肠道医用制品中的热原对人体的危害即热原反应已经人所共知;临床上主要表现为如下症状有:发热,寒颤,恶心,呕吐,头痛等症状。
并且,热原能够导致机体发热、腰及关节痛、肤色灰白、白细胞下降、血管通透性增强,严重者造成昏迷甚至休克、死亡。
为此,凡非肠道使用制品包括药品、生物制品(包括基因工程产品和基因治疗相关产品)和医疗器械装置(体内使用者)都应进行热原检查。
1总之,为了达到药品的安全效果,对于药品的热原检测和消除是及其重要和必要。
热原及其本质定义热原(pyrogen)系指由微生物产生的能引起恒温动物异常升高的致热性物质。
目前,对于热原国内外仍未有完全统一的认识,但从国内外文献报道中普遍认为:它是指细菌内毒素的脂多糖。
PALL过滤器技术材料

102
技术研究
4
PALL
过滤器的功能
过滤器经常被认为是一种简单的网或筛子, 过滤 / 分离是在一个平面上进行的。
技术研究
5
PALL
过滤器的功能
实际上,颇尔生产的过滤器滤材具有深度。 “弯曲通道”的结果对于污染物的去除起到了
辅助作用
技术研究
6
PALL
深度过滤介质
颗粒可以在表面被捕集, 也可以在介质层内被捕集, 因此,提高了容污能力。
• 基于评价液压过滤器的“多次通过”方 式试验系统
. . . 最初由 Oklahoma 州立大学开发并 称之为“OSU试验”。
F-2 试验现在也称之为“改进 OSU-F-2 试验”
技术研究
41
PALL
F-2 试验装置示意图
Slurry
Reservoir
Clean-up Filter
Test Element p
吸附 / Zeta 电势
大多数需过滤的颗粒都带负电,例如:
细菌 支原体 病毒 酵母
技术研究
硅颗粒 细菌内毒素 (热源) 蛋白分子
29
PALL
小结
过滤介质的过滤 / 分离效率由于
直接拦截 惯性撞击 扩散拦截
的共同作用而增强
技术研究
30
PALL
效率(%)
过滤机理及其效率
直接拦截
100
90 扩散拦截
技术研究
43
PALL
结果表达
由计数器读数计算“过滤比” 或称 “Beta 比”,符号
x =
上游大于直径 x 的微粒数 下游大于直径 x 的微粒数
技术研究
44
输液热原反应与细菌内毒素的定量研究

输液热原反应与细菌内毒素的定量研究作者:李楚云詹云丽来源:《中国实用医药》2010年第10期【摘要】目的介绍细菌内毒素检查法在药品热原方面的研究和应用。
方法查阅相关文献,并进行综合、分析和归纳。
结果细菌内毒素检查法具有快捷、准确、简便、经济等优点,但我国细菌内毒素定量法的应用与国外相比还存在一定的差距。
结论在临床上及早开展细菌内毒素的定量检查是输液治疗安全、有效的有力保证,也将使我国药品质量控制上新台阶。
【关键词】热原反应;细菌内素素;定量静脉输液具有药效快的特点,是临床常用的治疗手段,但在输液过程中时有不良反应发生,其中热原反应最为常见且后果严重。
引起人体致热的物质主要是细菌内毒素,当进入体内的内毒素累积量超过人体的耐受量时,便发生热原反应。
主要的临床表现为体温升高甚至高热,伴以发冷、寒战、出汗、恶心呕吐等,严重者甚至导致休克、死亡。
因此控制进入人体内毒素的限量,是减少上述临床热原反应的必要措施。
近几十年来,内毒素的检测研究已成为医药卫生领域的重要课题之一,本文就细菌内毒素检查法在药品热原方面的研究和应用作一概述。
1 细菌内毒素与热原反应细菌内毒素(bacterial endotoxin)是革兰阴性细菌细胞壁的产物,具有多种生物活性,尤以致热性最为突出,临床上易引起热原反应[1]。
细菌内毒素是一个量的概念,具有累加性。
在医院临床中常遇到这样的情况,输液、配伍药、输液器具各自的细菌内毒素检查均符合规定,但同批号混合用于患者后却发生了热原反应。
据报道某医院对混合残留液进行内毒素限量检查,结果其内毒素检出阳性率高达79.6%[2],这说明细菌内毒素具有累加结果,虽然检测单个药品细菌内毒素含量均在标准要求范围内,即内毒素检查为合格,但联合用药后内毒素量加合后却不一定合格,极可能超过人体承受的限量,因此不可避免地发生热原反应。
2 细菌内毒素检查法概述细菌内毒素检查法又称鲎试验法(bacterial endatoxin text,BET),是利用鲎试剂与细菌内毒素发生凝集反应,来检查药品中内毒素含量是否符合规定的一种方法。
内毒素的检测和去除

内毒素的检测和去除1 内毒素及其来源1.1内毒素内毒素(endotoxin)是存在于革兰氏阴性菌细胞壁外膜表面的一种大分子物质,一般只有在细胞死亡或分解时自行释放到周围介质中,特殊条件下也可以从活细胞中直接泄漏出来。
内毒素又被称为热原,是一种脂多糖物质,具有耐热性,不易被去除。
若疫苗中存在一定浓度的内毒素,接种动物后,可引起动物发热,休克等,严重时甚至造成死亡。
1.2内毒素的来源因为革兰氏阴性菌无处不在,所以内毒素几乎存在于任何地方。
在疫苗生产中一定要重视和尽可能减少内毒素的污染。
生产用水中内毒素的含量是导致疫苗安全性的关键因素之一。
大量研究表明,疫苗生产过程中内毒素主要来源于培养液和配制用水,其在贮存过程中易受到革兰氏阴性菌的污染。
贮水罐,纯水系统的过滤器和连接管道,以及培养液容器等都可能受到革兰氏阴性菌的污染。
工作人员进出车间携带的物品,以及空气净化系统久不维护,都有可能造成生产车间内的空气尘埃浓度升高,导致内毒素污染。
生产用具、管道、泵、阀门、滤器等的清洗消毒不彻底也会造成内毒素污染。
生产原料的污染,如血液制品,细胞培养基。
人为操作不规范也会引起内毒素污染。
2内毒素的检测目前,内毒素的检测方法较多,但是各存在利弊,因此,选取检测方法要根据实际需求,不建议采取单一的检测方法。
2.1鲎试验法鲎试验法是通过酶的级联反应而实现,内毒素在二价阳离子的参与下激活C因子(FC),然后激活其它酶原,产生一系列凝集酶反应。
该方法是目前检测内毒素最特异和最灵敏的方法。
2.2重组C因子法重组C因子法是使用一个单一的蛋白(重组C因子)作为有效活性成分。
反应中内毒素激活重组C因子,活化的重组C因子将荧光底物裂解,产生荧光复合物,定量检测荧光复合物来量化内毒素。
这种方法可有效避免假阳性的产生。
该方法可用于药品生产,环境,器械生产中的内毒素检测。
2.3热原试验法该方法是比较广泛的检测热原的方法,利用微量内毒素可引起动物体温升高的特性来测试其含量。
热原和细菌内毒素资料讲解

热原和细菌内毒素一、热原(progon)医院临床在使用药品注射剂时,常有发生冷感、寒战、发热、头痛、恶心、呕吐、肤色灰白、休克、严重时导致死亡,这种症状称为热原反应。
为提高药品质量和用药安全,人们对热原进行了广泛的研究,直到1923年Seibert提出了用家兔检测热原的方法。
在1942年美国药典首先将家兔热原检查项收入药典成为法定方法,中国药典1953年版开始收载该方法,随后的世界各国药典都以动物热原检查法作为药品质量监测的方法之一。
家兔热原检查法的优点,可在规定时间里观察到家兔的体温变化,相应反应了热原质引起哺乳类动物复杂的体温反应过程。
所以,在半个多世纪以来热原检查法,为保障药品质量和用药安全发挥了重要作用。
但随着制药工业的发展和临床用药的要求,该方法的局限性越来越明显。
这种热原检查法,只局限于某种药物进入体内(血循环)是否能引起体温变化或热原反应作为判断药品是否污染热原的方法,已不能满足医药工业发展的需要。
其缺点:①标准化程度低,无法判断检查样品中存在的热原质到底是什么或是哪一种物质。
②由于试验动物家兔是处在被细菌污染的环境中,通过吸入或皮肤感染细菌内毒素而被免疫,导致动物的个体差异较大。
③试验动物受到药品的药理活性干扰,而影响体温变化(如放射性药品、抗生素、生物制品等),实验结果难以判断。
④设备及实验费用昂贵(如建设动物房、水电、动物饲料等耗费),做一种药品需要280元/次,而鲎试剂仅28元/次。
综上情况分析,鲎试验法可避免以上动物热原检查法的不足,该技术的成功和应用真可谓是药品质量监控一场大革命。
什么是热原?目前国内外仍未有统一的认识,但从国内外文献报道中,一个共同的意见,都普遍认为:它是指细菌内毒素的脂多糖。
欧洲药典委员会副主席J.Van Noordwijk提出:“严格地讲,不是每一种热原都具有脂多糖的结构,但所有已知的细菌内毒素脂多糖都有热原活性”。
在药品生产质量管理规范(GMP)条件下,药品生产的质量控制一般可以接受的观点是:不存在细菌内毒素意味着不存在热原。
生物制药中内毒素的控制及去除

生物制药中内毒素的控制及去除一.热原与内毒素的定义热原系指由微生物产生的能引起恒温动物体温异常升高的致热物质。
它包括细菌性热原、内源性高分子热原、内源性低分子热原及化学热原等。
所以热原有外生致热原和内生致热原之分。
细菌内毒素是革兰氏阴性菌细胞壁上的一种脂多糖和微量蛋白的复合物,它的特殊性不是细菌或细菌的代谢产物,而是细菌死亡或解体后才释放出来的一种具有内毒素生物活性的物质。
一般来说内毒素是热原,但热原不全是内毒素。
欧洲药典委员会副主席J.Van Noordwijk提出:“严格地讲,不是每一种热原都具有脂多糖的结构,但所有已知的细菌内毒素脂多糖都有热原活性”。
在GMP条件下,药品生产的质量控制一般可以接受的观点是:不存在细菌内毒素意味着不存在热原。
二.内毒素控制的重要性生物制药中的每一个环节都有可能污染内毒素使产品不合格,不仅给生产企业造成很大的经济损失,也会直接影响该企业的信誉和形象。
随着国家药监部门对生物制品质量的要求不断提高,对内毒素的要求也越来越高。
因此,从事生物制品生产的人员必须了解国家对各项生物制品的内毒素控制要求,采取有效措施,控制产品内毒素含量,保证患者安全。
三.生产过程中内毒素污染的控制内毒素对热的耐受性非常强。
常用的湿热灭菌法(121 ℃,1 h)不能破坏内毒素。
破坏内毒素生物活性的最有效方法是干热灭菌法。
一般180 ℃ 3~4 h、200 ℃ 60 min或250℃ 30~45min,或用强碱强酸才能彻底破坏它。
生物制品中内毒素的来源主要有:菌毒种、生产环境、不规范操作、设备及器械、原辅材料等。
对于生物制品生产中内毒素污染的控制最主要的措施是生产过程控制,即严格按GMP要求进行生产,严格无菌操作,防止内毒素产生。
生产车间必须是符合GMP要求的洁净厂房,严格按规定进行清洁消毒,并定期对洁净间进行沉降菌和尘埃粒数检测,合格后方可使用。
细菌内毒素很容易吸附在容器上,生产中任何直接接触制品的设备、容器、生产用具、管路、包括检测取样吸管、试管等必须保证无热原。
除热原、内毒素

除热原
1)吸附法常用对热原有较强吸附作用的活性炭作为吸附剂,通常用量为0.1%~0.5%。
经煮沸、搅拌l5分钟后可除去大部分热原。
(2)超滤法在常温条件下,相对分子质量较大的热原能被一定规格的超滤膜截留除去。
(3)离子交换法热原分子上含有带负电荷的磷酸根与羧酸根,强碱性阴离子交换树脂可吸附除去溶剂中的热原,强酸性阳离子交换树脂效果稍差一些。
(4)凝胶滤过法用分子筛阴离子交换剂(二乙氨基乙基葡聚糖凝胶A-25)滤过可除去水中热原。
(5)反渗透法如选用三醋酸纤维膜或聚酰胺膜进行反渗透可除去热原。
(6)高温法和酸碱法常采用180℃/3~4小时、250℃/30~45分钟等条件彻底破坏热原,或采用高锰酸钾硫酸溶液可除去容器用具上的热原。
去内毒素的方法及检查方法

去内毒素的方法及检查方法注:这部分内容为内毒素的检测方法及去除方法。
热原(pyrogen)是微生物产生的内毒素,是由磷脂、脂多糖和蛋白质组成的复合物,微量即可引起恒温动物体温异常升高。
其中脂多糖具有很强的热原活性。
由革兰氏阴性杆菌产生的热原致热能力最强,真菌、病毒也可以产生热原。
【相关链接】热原的危害一、热原的性质及除去热原的方法1.高温法热原的耐热性能良好,60℃加热1h不被分解破坏,100℃不降解,但180℃3~4h、200℃60min或250℃30~45min可使热原彻底破坏。
因此耐热物品如玻璃制品、金属制品、生产过程中所用的容器和其它用具以及注射时使用的注射器等,均可采用此法破坏热原。
但在通常使用的注射剂热压灭菌条件下不足以破坏热原。
2.吸附法热原在水溶液中可被活性炭、石棉、白陶土等吸附而除去。
由于活性炭性质稳定、吸附性强兼具助滤和脱色作用,故广泛用于注射剂生产,但应注意吸附药液所造成的主药的损失。
3.超滤法热原分子量为1×106左右,体积较小,约1~5nm,可以通过一般滤器和微孔滤膜,但采用超滤法如用 3.0~15nm超滤膜可将其除去。
4.蒸馏法热原能溶于水但不挥发,但可随水蒸气的雾滴进入注射用水中,因此制备注射用水时,原水中的热原可经蒸馏除去,但需多次蒸馏,,并加有隔沫装置,单次蒸馏往往效果不理想。
5.酸碱法热原能被强酸、强碱、强氧化剂破坏。
玻璃容器及用具如配液用玻璃器皿、输液瓶等可用重铬酸钾硫酸清洁液或稀氢氧化钠处理,破坏热原。
6.其它包括离子交换法、凝胶滤过法、反渗透法等。
二、热原的检查方法《中国药典》2005年版规定热原检查采用家兔法,细菌内毒素检查采用鲎试剂法。
1.热原检查法由于家兔对热原的反应与人基本相似,目前家兔法仍为各国药典规定的检查热原的法定方法。
《中国药典》2005年版规定的热原检查法系将一定剂量的供试品,静脉注入家兔体内,在规定时间内,观察家兔体温升高的情况,以判定供试品中所含热原的限度是否符合规定。
《基于生物质吸附剂去除明胶中内毒素的应用研究》

《基于生物质吸附剂去除明胶中内毒素的应用研究》一、引言随着科技的发展和人们生活品质的提高,明胶作为生物医用材料,广泛应用于食品、药品和化妆品等众多领域。
然而,明胶生产过程中可能存在的内毒素问题,一直是制约其应用的关键因素。
内毒素的存在不仅影响产品的质量和安全,还可能对人体健康产生潜在的危害。
因此,寻求有效的内毒素去除方法成为了研究热点。
本文基于生物质吸附剂,对明胶中内毒素的去除进行了应用研究,旨在为明胶的纯化和应用提供新的思路和方法。
二、材料与方法2.1 材料明胶、内毒素标准品、生物质吸附剂等。
2.2 方法(1)明胶样品制备:收集不同来源的明胶样品,进行预处理。
(2)内毒素检测:采用鲎试剂法检测明胶中内毒素的含量。
(3)生物质吸附剂制备:采用特定生物质材料制备吸附剂。
(4)吸附实验:将制备好的吸附剂与明胶样品进行吸附实验,观察吸附效果。
(5)效果评价:通过内毒素含量检测,评价吸附剂对明胶中内毒素的去除效果。
三、结果与分析3.1 生物质吸附剂的制备及表征通过特定生物质材料的处理和制备,成功得到了具有良好吸附性能的生物质吸附剂。
该吸附剂具有较高的比表面积和良好的孔隙结构,有利于内毒素的吸附。
3.2 吸附实验结果将制备好的生物质吸附剂与明胶样品进行吸附实验,发现该吸附剂对明胶中的内毒素具有良好的吸附效果。
随着吸附时间的延长,内毒素的去除率逐渐提高。
在一定的时间范围内,生物质吸附剂的吸附量与明胶中内毒素的含量呈正比关系。
3.3 内毒素去除效果评价通过鲎试剂法检测明胶样品中内毒素的含量,发现经过生物质吸附剂处理后,明胶中内毒素的含量明显降低。
与未处理的明胶样品相比,处理后的明胶样品内毒素去除率达到了XX%。
细菌内毒素的耐热性及去除方法

细菌内毒素的耐热性及去除方法
细菌内毒素的耐热性
我们知道细菌内毒素除了具有各种生物活性外,还具很强的耐热性,一般的高压灭菌不能使其灭活,需250℃30分钟以上的干热灭菌才能使其灭活,目前我国药典热原检查法和细菌内毒素检查法中关于玻璃用具的灭菌处理为180℃2小时或250℃30分钟以上,而日本药局方第十三改正为250℃1小时以上。
其它各国药典也大都如此,据国外文献报导,当对细菌内毒素的稀水溶液,在不同温度下保温处理后进行检测,发现其内毒素活性在200℃1小时时还能检测出来。
而只有当加热到250℃1小时才能完全灭活,国内细菌内毒素标准品的耐热情况虽然未能考察,但可以认为对细菌内毒素检查法中玻璃用具等的除菌最好采用250℃1小时以上的干烤处理。
细菌内毒素的除去方法
由于细菌内毒素具有很强的耐热性,因此对于它的去除采用一般的灭菌方法是无法达到的,尤其是制药行业注射剂中内毒素的除去,对于临床用药的安全性意义重大,因此对于药品中内毒素去除可以使用过滤及高压灭菌方法,而对于一般水溶液,则普通采用薄膜过滤后高压法,对于实验中所用器具可使用干热或射线给予灭活,其它也可使用酸、碱破坏的方法。
对于细菌内毒素检查法中所用实验用具的外源性内毒素除去方法,最好采用250℃2hr以上的干热灭菌方法。
三效热原灭活剂对内毒素的清除与净洗用水的选择对效果的影响

三效热原灭活剂对内毒素的清除与净洗用水的选择对效果的影
响
陈靖
【期刊名称】《安徽医学》
【年(卷),期】2001(022)002
【摘要】目的:探讨三效热原灭活剂在清除玻璃注射器内毒素时与净洗用水之间的关系.方法:分别采用常温水(A组)、非新鲜蒸馏水(B组)、新鲜流动蒸馏水(C组)作为净洗用水.结果:灭菌后细菌内毒素检测结果依次为C组优于B组、B组优于A组.结论:新鲜流动蒸馏水组洗涤方法效果最佳.
【总页数】2页(P11-12)
【作者】陈靖
【作者单位】233000,蚌埠医学院附属医院急诊部供应室
【正文语种】中文
【中图分类】R187.5
【相关文献】
1.三效热原灭活剂对注射器去热原的三种方法效果观察 [J], 梁静
2.影响三效热原灭活剂有效浓度的因素分析 [J], 林丽琼;王明英;李丽华
3.三效热原灭活剂对注射用具去热原效果观察 [J], 李才香
4.对“三效热原灭活剂”除热原效果的评价 [J], 王淑梅;马玉梅;赵晓梅;郭丽丽
5.三效热原灭活剂灭活热原效果检测 [J], 赵慧莲;张秀英;黄冬梅;郑晓勤
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
目录 1:背景知识 2:法规 3:我们的技术方案和案例分享
Confidential
GMP要求
2)无菌原料药 3)无菌制剂
API GMP
制剂 GMP
GMP要求逐步提高 第一阶段 无菌 第二阶段 无菌
API 制造 原料 中间产物 药物物质
1)非无菌原料药
药物产品 无菌
Confidential
非无菌原料药 第二章 厂房与设施,第四条 质量标准中有热原或细菌 内毒素等检验项目的,厂房的设计应特别注意防止微生 物污染,根据预定用途、工艺要求采取相应控制措施。 第九章 质量管理,第四十条 按受控的常规生产工艺生 产的每种原料药应当有杂质档案。杂质档案应当描述产 品中存在的已知和未知的杂质情况
热原和内毒素去除技术 的应用探讨
Haojun Chen 2012 Biopharm Marketing
Confidential
目录 1:背景知识 2:法规 3:我们的技术方案和案例分享
Confidential
G-细胞壁结构
Confidential
脂多糖结构
脂多糖的结构复杂,其脂质A是主要的内毒素成分
Confidential
热原控制 vs 除热原补救
水系统
Confidential
目录 1:背景知识 2:法规 3:我们的技术方案和案例分享
Confidential
内毒素去除(控制)方法 酸碱化学处理 氧化 烷化 干热(180℃/4h,250 ℃/45min ) 湿热 (蒸馏) 电离辐射 深层滤板过滤 正电荷过滤器过滤 超滤 层析(离子交换、疏水)
•2010版新药典主推检测细菌内毒素。细菌内毒素检查品种约200品种以上(主要为静脉注射), 约60余品种仍保留家兔法热原检查(不包括局标、标准品种、生物制品) •仍有数百种注射剂无相关检查项,2006年开始对近百个静脉注射用品种进行研究。 •《化学注射液安全性检查指导原则》:“静脉注射用注射剂,应设热原(或细菌内毒素)、异常 毒性、过敏反应物质、降压物质、溶血与凝聚等安全性检查项。”
Confidential
中药
《中药注射剂安全性再评价资料报送要求》
制备工艺:提供本品包括工艺参数在内的详细的现 行生产工艺规程(包括原料的前处理、提取、纯化、浓缩 、干燥、注射剂的处方、配制、灌装、无菌处理、包装等 工艺过程和工艺参数)及近期连续5批产品生产记录。 制备用溶剂、吸附剂、脱色剂、澄清剂等来源和标 准:提供本品生产过程中所用溶剂、吸附剂、脱色剂、澄 清剂等的来源、质控标准,如进行精制需提供精制后的内 控标准。 除热原研究:提供除热原工艺研究及验证资料。 去除高分子物质研究:提供除无效高分子物质研究 验证资料。
Confidential
热原 vs 内毒素 家兔法(药典附录XII D) < 0.6℃/只,3只总和< 1.4℃ : 无热原 > 0.6°C一只,8只总和< =3.5℃ : 无热原 > 0.6°C一只,复检 鲎试剂法(药典附录XII E) 凝胶法 光度测定法
– 浊度法 – 显色基质法
1 Level of 0.125 EU/ml 0.1 0.010.001 Nhomakorabea0
25 50 Temperature (°C)
Confidential
75
SIP和微生物负荷 对NFZ正电荷滤芯的影响 SIP或微生物堵塞情况下,滤出液< 0.125 EU/ml
10 Endotoxin Concentration in Filtrate (EU/ml) 1 Level of 0.125 EU/ml 0.1 SIP,121℃/15 min Brevundimonas diminuta (107/cm2),随后121℃/15 min Control Filter
pH
Confidential
数据分享----生理盐溶液
检测限度: 0.25 EU/ml
8 7 Log Endotoxin 6 Retention 5 Capacity(EU) 4 3 2 1 0
>1x108 >1x107
>1x104
Distilled Water
0.9% NaCl
Ringer’s Solution USP
5 4 3 2 1 0
0.2 micron sterilizing grade N6,6 double layer membrane with positive charge
% Amino Acids
Confidential
0
5
10
15
Detection Limits: At 3.5% Amino Acids Solution, 0.5 EU/ml At 10% Amino Acids Solution, 1.0 EU/ml
0.2 micron sterilizing grade N6,6 double layer membrane with positive charge
60
% Glucose
Confidential
数据分享----酸、碱缓冲溶液
检测限度: 0.25 EU/ml
8 7 6 Log Endotoxin 5 Retention Capacity (EU) 4 3 2 1 0
Confidential
数据分享----葡萄糖溶液
检测限度: 0.25 EU/ml
>1x108
8 7 6
>1x108
>1x108 High Purity Water 20% Glucose 50% Glucose
Log Endotoxin 5 Retention 4 Capacity (EU)
3 2 1 0 0 10 20 30 40 50
0 1 2 3 4 5 6 7 8 Sodium Chloride Concentration (%) 9 10
Endotoxin Retention (EU)
Detection Limits: At 0.9% Sodium Chloride Concentration, 0.1 EU/ml At 2.0% Sodium Chloride Concentration, 0.4 EU/ml At 5.0% Sodium Chloride Concentration, 3.0 EU/ml
0.2 micron sterilizing grade N6,6 double layer membrane with positive charge
>1x108
>1x108
>1x108
High Purity Water pH 6.4
100mm 100mm Sodium Tris-HCI Buffer Acetate-Acetic pH 8.0 Acid Buffer pH 4.6
Confidential
水溶液pH 对NFZ正电荷滤芯的影响
适用范围: pH3~10,滤出液< 0.125 EU/ml
10
Endotoxin Concentration in Filtrate (EU/ml)
1
Level of 0.125 EU/ml
0.1
0.01
0.001 0 2 4 6 8 10 12
过滤前热原水平
10,000 1,000 Endotoxin Concentration (EU/ml) 100 10 1 0,1 0,01
0.2 micron sterilizing grade N6,6 double layer membrane with positive charge
过滤后热原水平 检测限度 0 1 2 3 4 5
>1x108
>1x107
>1x103
0 High Purity Water KCl NaCl CaCl2 Ref: Hunter, Jander & Wickert, Pall SLS
150 mM Concentration
Confidential
数据分享----PBS溶液(100mM)
检测限度: 0.125 EU/ml
适合于产品
Confidential
全流程应用方案
水系统
工艺
1 2 3
Confidential
深层滤板对热原的控制
Confidential
直接过滤除热原----正电荷滤板EK1P
吸附拦截能力> 105EU/cm2
Confidential
深层滤板对热原的控制 EK1P,EKS80P正电荷滤板应用案例 血制品,WFI、产品的过滤(EK1P) 多糖疫苗,粗多糖样品的过滤(EK1P) API,抗生素除活性炭澄清过滤(EKS80P) 中药注射液,QKL、XNJ除活性炭、热原过滤( EKS80P)
Confidential
正电荷滤芯对热原的控制
Confidential
正电位除菌级过滤器级别与内毒素去除效率
Positively Charged ‘N66’ ‘Posidyne’ Filters NTZ NFZ NIZ NAZ
Log 8 10 内毒素截留 (EU) 107 106 105
Sterilising Grades
Confidential
数据分享----氨基酸溶液
检测限度: 0.5~1 EU/ml
>1x108 >1x108 8
Log Endotoxin 7 Retention 6 Capacity (EU)
>1x108 High Purity Water 3.5% Amino Acids 10% Amino Acids
