第二章 红外光谱分析
红外光谱分析法

第一节 基本理论
一、红外吸收光谱的测定与表示法
1. 测定方法 红外光谱测定时所需样品极少,一般为1~5mg。 *固体样品有三种处理方法:
1)配成溶液, 2)与饱和烃如医用石蜡油研成胡状 3)与粉状溴化钾压片,一般用1~2mg样品,与200mg溴化 钾压制成片,可避免溶剂干扰。 *液体样品处理方法: 若不配成溶液,一小滴就够,可直接放在两片吸收池窗板中 间进行测定,叫液膜法。
图2-5正辛烷的红外光谱 (Ⅰ):2960~2850cm-1; (Ⅱ)-CH2-的剪式振动:1465cm-1; (Ⅲ)δ -CH3 (对称):1380cm-1; (Ⅳ)的平面摇摆振动:~725cm-1
43
CH3
(21)375CcHm-1两CH个3:强度当接分近子的中吸出收现带异,丙基时,甲基的1380cm-1带分裂为1385、 (3) -C(CH3)3:叔丁基与异丙基相似,也使1380cm-1带发生分裂,
另一部分光透过,若将其透过的光用单色器进行色散,就可以得到
一带暗条的谱带。若以波长或波数为横坐标,以百分吸收率为纵坐
标,把这谱带记录下来,就得到了该样品的红外吸收光谱图,获得红
外振动信息。
14
红外吸收光谱的图谱多以波长(或波数 )为横坐标,以表示吸收峰的位置;若 用吸收百分率(adsorption%)表示吸收 强度时,吸收峰向上,但是通常以透射 百分率(transmittance%)表示。
振动或称伸张振动),常用符号“S”或
“ν”表示。
H
H
H
H
C
C
对称伸缩振动(νSCH2)
非对称伸缩振动(νasCH2)
2、弯曲振动:
面内弯曲振动 面外弯曲振动 (1)面内弯曲振动:分为剪式和平面摇摆弯曲振动两种。
第二章 红外吸收光谱(讲课)

6. IR光谱在化学领域中的应用
1. 分子结构基础研究 应用IR测定分子的键长、键角,以此推断出分子的立 体构型; 根据所得的力常数可以知道化学键的强弱,由简正频 率来计算热力学函数等。
2. 化学组成分析
根据光谱中吸收峰的位置和形状来推断未知物结构,依 照特征吸收峰的强度来测定混合物中各组分的含量。
第二章 红外吸收光谱
第一节 概述
1、 红外吸收光谱与紫外吸收光谱一样是一种分子吸收光谱。
红外光的能量( E=0.05-1.0ev)较紫外光( E=1-20ev) 低。红外光照射分子时不足以引起分子中价电子能级的跃迁, 而能引起分子振动能级和转动能级的跃迁,故红外吸收光谱 又称为分子振动光谱或振转光谱。
非线型分子振动自由度数目:3N-6个; 线性分子的振动自由度数目: 3N-5个。
理论上每个自由度在IR中可产生1个吸收峰,实际上IR光 谱中的吸收峰数少于基本振动自由度,原因是:
(1)振动过程中,伴随有偶极矩的振动才能产生吸收峰。 (2)频率完全相同的吸收峰,彼此发生简并(峰重叠)。 (3)强、宽峰覆盖相近的弱、窄峰。 (4)有些峰落在中红外区之外。 (5)吸收峰太弱,检测不出来。
表 化学键的力常数
键 H-F 分子 HF k(×105dyn/cm) 9.7 4.8 4.1 键 H-C H-C C-C 分子 CH≡CH k(×105dyn/cm) 5.9 4.5-5.6 CH2=CH2 5.1
H-Cl HCl H-Br HBr
H-I
H-O H-O H-S H-N H-C
HI
H2 O 游离 H2 S NH3
1. 由虎克定律计算化学键振动频率
振
1 2
k
m
1
红外光谱的影响因素和基团分析讲解

叔铵盐:2700~2200cm-1宽谱带
(3). C-H
烃类:3300~2700cm-1范围,3000cm-1是分界线。不饱和碳 (三键、双键及苯环)>3000cm-1, 饱和碳(除三元环)<3000
炔烃:~3300 cm-1,峰很尖锐, 烯烃、芳烃:3100~3000 cm-1
键型 Al-H Si-H P-H S-H Cl-H
频率 1750 2150 2350 2570 2890
化学键的伸缩振动频率范围
键型
波数
键型
C≡N
2260~2220 C-O
C≡C
2220~2060 C-N
C=O
1850~1650 C-F
C=C
1680~1600 C-Cl
C-C
1250-1150 C-Br
2.3. 红外光谱的吸收频率及其影响因素
化学键的振动频率不仅与其性质有关如成键原子的杂 化方式,质量效应等,还受很多外部因素的影响。相同基 团的特征吸收并不总在一个固定频率上。影响因素有关:
1. 质量效应 2.电子效应 内在因素 3.空间效应 4.氢键 5.振动的偶合 外在因素
(1)质量效应
分子中键的振动频率与化学键力常数成正比,与折合 质量成反比。
3). 其它键的振动 C-C:伸缩振动一般很弱,无鉴定价值 C-X:伸缩振动 F:1400~1000 cm-1 (m~s) Cl: 800~600 cm-1 (s) Br: 600~500 cm-1 (s) I: ~500 cm-1 (s) O-H:弯曲振动:面内(1500-1300)面外(650cm-1) B-O:伸缩振动 1500-1300 cm-1 (m~s)B-C:1435 cm-1 Si-O-Si:1100~1000cm-1
第二章 红外光谱

2 . N-H(吸收强度比-OH弱,峰形较尖锐)
胺类: 游离——3500~3300cm-1 缔合——吸收位置降低约100cm-1 伯胺:3500,3400cm-1 仲胺:3400cm-1 叔胺:无吸收 酰胺:伯酰胺:3350,3150cm-1 附近出现双峰 仲酰胺:3200cm-1 附近出现一条谱带 叔酰胺:无吸收
远红外
25 - 1000
400 - 25
红外光谱是用频率4000~400cm-1(2.5~25m)的光波
照射样品,引起分子内振动和转动能级跃迁所产生的
吸收光谱。也称振 - 转光谱。
波长和波数
电磁波的波长( )、频率( v)、能量(E)之间的关系:
二、红外光谱图
I T % 100 % I0
O R C R
O R C H
1715 cm-1
O C
C C
O C R
1665-1685
O
H
(CH3)2N
C
H
1730 CH3C≡N
2255
1690
1663 (CH3)2C=CH-C≡N
2221
同一化合物中,如果同时存在I效应和C效应,则影 响较大的效应决定吸收峰的位移方向
1735 -I>+C
1680
能发生振动能级跃迁,产生吸收光谱。
2. 只有引起分子偶极矩发生变化的振动才能产生
红外吸收光谱。
四、影响特征吸收频率的因素
分为内因(不可变化)和外因(可变)
(一)内部因素 1、电子效应 a. 诱导效应(I 效应)
诱导效应使基团电荷分布发生变化,从而改变了键的力常
数,使振动频率发生变化.
例:
O R C X
υOH ,υNH
波谱解析 第二章 红外光谱习题参考答案

10.
首先计算不饱和度:U=0,结构中含氧,推测可能是饱和醇或者醚。 3366cm-1:-OH 伸缩振动。(中等宽峰,含醇羟基,此化合物为饱和醇) 2974cm-1:-CH3 的 C-H 伸缩振动。 1381,1375cm-1:偕二甲基特征吸收。 1050 cm-1:伯醇 C—O 伸缩振动 综上所述,推测该化合物的结构为:
9. (较难判断)
首先计算不饱和度:U=8,结构中可能含有两个苯环或多个双键。 结合红外谱图分析, 3085,3021cm-1:苯环 C-H 伸缩振动。 2961,2856cm-1:-CH2 的 C-H 伸缩振动。 1601,1500,1452 cm-1:苯环骨架变形振动。 752,703cm-1:单取代苯环 C-H 面外弯曲振动。 谱图中没有明显的烯烃的峰,因此推测结构中应该含有两个苯环,其他的碳 氢均为饱和连接,且没有发现甲基的特征峰。 综上所述,推测该化合物的结构为:
5/6
12.
首先计算不饱和度:U=1,存在一个双键。 结合红外谱图分析, 3294cm-1:N-H 伸缩振动。 2946cm-1:-CH3 的 C-H 伸缩振动。 1655cm-1:羰基伸缩振动(酰胺Ⅰ峰)。 1563cm-1:仲酰胺 C-N-H 弯曲振动(酰胺Ⅱ峰)。 1372 cm-1:甲基对称变角振动。 1299cm-1:仲酰胺的酰胺Ⅲ峰。 721cm-1:仲酰胺 N-H 面外弯曲振动(酰胺Ⅴ峰)。 此外,2820~2720cm-1 无明显吸收峰,结构中不含醛基 综上所述,推测该化合物的结构为:
4.
(1)
O O
A
B
C
B 化合物中含有共轭双键,羰基双键 π 电子发生共轭而离域,降低了双键的
力常数,从而使 C=O 伸缩振动频率相对于 A 降低。C 化合物为烯醇酯,烯氧基
5红外光谱分析

伸缩
3700-3500 3600-3000 1420-1350 1500-1340 1500-1200 1200-1010 1100-800
弯曲
1200-600 1650-1600 900-800 900-700 800-600 680-580 560-420
42
红外-拉曼
5 典型红外图谱(7)
化学键 -CH3 -CH-
16
红外-拉曼
4 红外分析方法(3)
17
4 红外分析方法(5)
红外光谱测定中的样品处理技术 1
液体样品 固体样品 气体样品
液膜法 溶液法 水溶液测定
压片法 调糊法(或重烃油法,Nujol法) 薄膜法 ATR法、显微红外、DR、PAS、RAS 气体池
18
红外光谱测定中的样品处理技术 2
1液膜法
用组合窗板进行测定
(KBr从4000-250cm-1都是透明的,即 不产生红外吸收)
34
红外-拉曼
5 典型红外图谱(1)
3500 cm-1: O-H stretching vibrations. 1600 cm-1 :O-H bending vibration band.
~1100 cm-1:Si-O-Si fundamental vibration.
➢Examination of materials that are not amenable to the film analysis method
➢Analysis of extremely thin films applies on the top surfaces
➢Sample in solution
12
红外-拉曼
3 红外吸收产生的原理(8)
红外光谱解析PPT课件

第二章 红外光谱
有机化合物波谱分析
(8)未知物分子式为C6H8N2,其红外图如下图所 示,试推其结构。
第二章 红外光谱
有机化合物波谱分析
解:(1)不饱和度Ω=1+6+0.5(2-8)=4 3030.70cm-1,1592.66cm-1,1502.26cm-1的峰 表明含有苯环。
(3)3095cm-1,1649cm-1表明含有碳碳双键。
综上,可能为乙酸乙烯酯或丙烯酸甲酯。
第二章 红外光谱
有机化合物波谱分析
(10) 分子式为 C6H14 ,红外光谱如下,试推其结构。
C
第二章 红外光谱
有机化合物波谱分析
(1)不饱和度Ω=1+6+0.5(0-14)=0,所以 C6H14 为饱和烃。
第二章 红外光谱
有机化合物波谱分析
解:(1)不饱和度Ω=1+4+0.5(0-8)=1 1740cm-1表示含有C=O。高频区没有出现宽的强 吸收峰,表明没有-OH,又因为1740cm-1的峰位 于相对高频峰。因此,该化合物为酯类化合物。
(2)3000~2800cm-1的峰为νCH(-CH3,-CH2-), 1380cm-1处孤峰表明有孤立-CH3,1460cm-1说 明含有-CH2-。因此,含有孤立-CH3和
根据(2)得苯环结构和817cm-1强峰,表明该物 质为苯的对二取代物。
(4)1380cm-1的单峰和2920cm-1表明含有CH3,则不含有碳碳三键。
根据(4)和2217cm-1处强峰,显示含有碳氮三 键。
综上,该化合物为对甲基苯甲氰。
第二章 红外光谱
(4)推测C4H8O2的结构
红外光谱的血液光谱分析方法研究

红外光谱的血液光谱分析方法研究第一章:引言人类医学领域一直在探讨新的疾病诊断和治疗方法。
其中,基于光谱技术的诊断方法感受到了越来越多的关注。
光谱技术具有非破坏性和非侵入性等特点,可以为医学研究提供重要信息,如组织结构,生物分子的组成,甚至是生物过程的动态变化。
红外光谱是一种重要的光谱检测技术,已经在分析血液中的生物大分子方面取得了很大的进展。
本文探讨了红外光谱在检测血液生物大分子方面的应用,重点关注了基于红外光谱的血液光谱分析方法。
第二章:血液样本的制备在进行血液样本的红外光谱测试之前,首先需要对血液样本进行处理。
这个过程涉及到血液的样品收集,制备和储存。
2.1 血样的收集为了保证血样的准确性和可靠性,需要优化血样的收集步骤。
在收集血样之前,需要按照规定消毒大腕,穿过手套和血样收集套装。
在收集血样之前,需要首先清洗收集部位,然后固定患者的胳膊。
这个步骤需要保持血样采集部位的清洁和安全。
收集血样时必须想办法防止出现误差,以保证获得最准确的结果2.2 血样的制备在收集血样之后,样品还需要进行处理。
血液样品的制备主要涉及改变它的物理状态,从而为红外光谱测试提供满足要求的样品。
相互干扰的信号的减少和方便的测量使样品制备过程特别重要。
常见的样品处理方法包括气相或溶液处理在红外光谱仪中的悬浮液,挤压法制备的薄膜和压片。
在制备血样时,需要遵守标准操作规程和注意事项。
第三章:红外光谱预测血红蛋白在血浆中的浓度的方法人体血红蛋白可以通过红外光谱测试准确测量。
测量血红蛋白浓度有助于评估体内的血红蛋白含量,与许多疾病如贫血等相关。
红外光谱中的各种生物分子吸收光谱的位置、强度和形状信息可用于定量测量血红蛋白。
这可以通过对血浆样品进行红外光谱扫描实现。
通过化学和计算方法确定红外线的吸收强度和位置。
然后将这些数据与预先确定的标准曲线相结合,便可以准确地计算血红蛋白浓度。
第四章:红外光谱预测白蛋白在血浆中的浓度的方法白蛋白是人体内最常见的血浆蛋白质之一,它在维持人体内的渗透压和稳定性方面起着重要的作用。
红外光谱的影响因素和基团分析

2). C=C伸缩振动 1670~1600 cm-1 ,强度中等或较低。 烯烃: 1680~1600 cm-1
芳环骨架振动:﹝苯环、吡啶环及其它芳环﹞
1650~1450 cm-1 范围 苯: ~1600,1580,1500,1450 cm-1 吡啶:~1600,1570,1500,1435 cm-1 呋喃:~1600,1500,1400 cm-1
酯:脂肪酸酯~1735 cm-1,不饱和酸酯或苯甲酸酯低波
数位移约20 cm-1 羧酸:~1720 cm-1,若在第一区约 3000 cm-1出现强、宽吸收。 醛:在2850~2720 cm-1 范围有 m 或 w 吸收,出现1~2条谱带,结合此峰,
可判断醛基存在。 酮:唯一的特征吸收带
酰胺:1690~1630 cm-1 ,缔合态约 1650 cm-1 伯酰胺:~1690 cm-1(Ⅰ) ,1640 cm-1(Ⅱ) 仲酰胺:~1680 cm-1(Ⅰ),1530 cm-1(Ⅱ), 1260 cm-1 (Ⅲ) 叔酰胺:~1650 cm-1
(5)振动的偶合
分子内两基团位置很近并且振动频率相同或相近时, 它们
之间发生强相互作用, 结果产生两个吸收峰, 一个向高频移 动, 一个向低频移动。
2.4. 红外光谱的分区
常见的有机化合物基团频率出现的范围:4000 1300(官能团 区) 1300~ 650 cm-1(指纹区)依据基团的振动形式,分为四个 区: (1)4000 2500 cm-1 X—H伸缩振动区(X=O,N,C,S) (2)2500 2000 cm-1 三键,累积双键伸缩振动区 (3)2000 1500 cm-1 双键伸缩振动区 (4)1500 600 cm-1 X—Y伸缩, X—H变形振动区
食品安全检测中的红外光谱分析技术

食品安全检测中的红外光谱分析技术第一章介绍食品安全一直是社会关注的焦点,因为食品不安全直接威胁人类健康。
而红外光谱分析技术是目前应用广泛的一种分析检测方法,它在食品安全检测领域也得到了广泛应用。
本文将探讨红外光谱分析技术在食品安全检测中的具体应用。
第二章红外光谱分析技术的基本原理红外光谱分析技术是利用物质特有的红外吸收谱线来进行细微结构分析的一种方法。
当物质受到红外辐射时,各种分子会吸收不同波长的红外辐射波,吸收谱线的位置和形状就是物质特有的“指纹”,根据吸收谱线的特征可以对物质的成分和结构进行分析。
红外光谱分析技术具有快速、灵敏、无损、非破坏等优点,被广泛应用在生化、医药、食品、环保等领域。
第三章红外光谱分析技术在食品安全检测中的应用3.1 膳食纤维检测膳食纤维是指在人体内不被消化和吸收的一类物质,包括不溶性纤维和可溶性纤维。
它们在肠道内起着决定性的生理功能,如帮助防治便秘、调节血糖、保护结肠等。
因此膳食纤维在食品安全检测中的检测非常重要。
利用红外光谱分析技术可以对食品中的膳食纤维进行定性和定量分析,可有效地检测食品中的不溶性纤维和可溶性纤维含量。
3.2 油脂检测油脂是人体所需的重要营养物质,但过度摄入会增加患心血管疾病的风险。
因此对于食品中油脂含量的检测十分重要。
利用红外光谱分析技术可以对食品中的油脂进行快速检测,并精确地测定食品中的脂肪酸的成分和含量,有助于保证人类摄入油脂的安全量。
3.3 糖类检测糖类是人体所需的能量来源,但过多的糖类摄入也会导致肥胖、糖尿病等疾病的发生。
因此对于食品中糖类含量的检测也非常重要。
利用红外光谱分析技术可以对食品中的糖含量进行快速检测,具有快速、高效的特点,有助于精确掌握食品中的糖类含量,保障人类健康。
第四章红外光谱分析技术的局限性虽然红外光谱分析技术在食品安全检测领域具有许多优势,但也存在一些局限性。
例如样品混杂、样品制备和数据处理方面会带来一些误差。
另外,由于红外光谱分析技术无法有效地检测如微量元素等对人体健康产生重要作用的物质,因此在食品安全检测中需要与其他检测技术相结合使用,以获得更为准确的结果。
波谱学课件——红外光谱分析4IR2
例2:未知物分子式为C6H8N2,其红外谱图如下 图所示,试推其结构。
解:不饱和度计算式:US = 1+n4+ 1 (n3-n1)
2
1+6+1/2(2-8)=4
n4-四价原子数目 n3-三价原子数目 n1-一价原子数目
未知物的不饱和度为4,故有可能含苯环,此推 测由3031 cm-1的峰及苯环的骨架振动:在1450~ 1650 cm-1之间有2~4个峰所证实,由750cm-1的吸 收知该化合物含邻位二取代苯环。
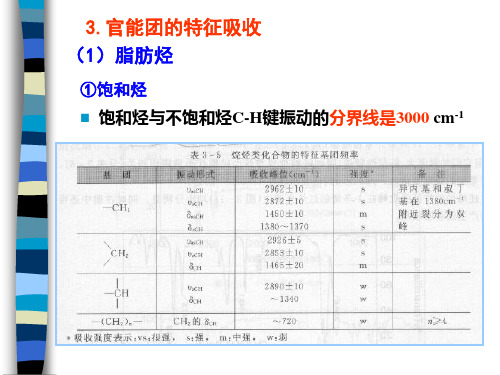
3.官能团的特征吸收 (1)脂肪烃
①饱和烃 饱和烃与不饱和烃C-H键振动的分界线是3000 cm-1
②烯烃
=C-H 3100 ~3000cm-1 C=C在双键区1680~1600 cm-1(w or m) 结构完全对称的双键是红外非活性,在该区无C=C吸
收 面外=C-H位于1000~650 cm-1,强度大,特征性强,
酰胺 酸酐
吸收峰位置(cm-1) 1735-1715 1720-1710 1770-1750 1745-1720
1700-1680(酰胺I带) 1820和1760
(6)胺基
伯胺:在3300-3500cm-1出现双峰(asN-H sN-H),特征性 较强
仲胺:在3500 cm-1有单峰 叔胺:红外光谱没有明显特征 成盐后伯胺、仲胺的N-H均移向低频
如:H2O和CO2及微量杂质
(4)红外谱图解析顺序 先观察官能团区,找出该化合物存在的官能团, 然后查看指纹区;
(5)标准红外谱图的应用 最常见的红外标准谱图为萨特勒(Sadtler) 红外谱图集和DMS(docementation of molecular spectroscopy)卡片
第二章 红外光谱原理

1775 cm-1 1850 cm-1
CH2 CH2
1650 cm-1
1657 cm-1
1678 cm-1
1781 cm-1
1639 cm-1
1623 cm-1
1566 cm-1
1541 cm-1
4.氢键效应
分子内氢键:
分子内氢键使伸缩频率向低波数移动,谱带变宽
注意:分子内氢键,不受浓度影响
峰的吸收强度被强化。这种倍频与基频之间的振动
偶合称为费米共振。 如:苯甲酰氯
羰基:1730cm-1; C-Cl的伸缩振动频率875 cm-1, 其倍频峰与羰基发生费米共振,二者吸收强 度都增强。
8.化学键强度及原子杂化类型
化学键越强,力常数K越大,IR吸收频率越大。
C C
2150cm -1
C=C
1650cm-1
60
2867 3533 1328
40
2957
-CH3 -CH2 –CH –CHO –OCH3 3000-2700
911 948 979
1425
1225 1076 1116
20
3424
1378 1245
第二章
红外光谱(IR)
Chapter 2 Infrared spectra
基础知识介绍 红外光谱的重要区段 红外光谱在结构分析中的应用
第一节
红外光谱基本原理
一、分子的能级和吸收光谱
世界是运动的。世界上任何物质中的分子都 处于不停的运动中,分子运动总能量可表示为:
+
E平
平动能
能量量子化 E=E激发态-E基态
剪式振动δ s:振动中键角的变化类似剪刀的开闭
AX 2型分子
红外光谱习题

第二章红外光谱习题(总3页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--第二章红外光谱一、判断题[1]红外光谱不仅包括振动能级的跃迁,也包括转动能级的跃迁,故又称为振转光谱。
(√)[2]同核双原子分子N≡N、Cl-Cl、H-H等无红外活性。
(√)[3]由于振动能级受分子中其他振动的影响,因此红外光谱中出现振动耦合谱带。
(√)[4]确定某一化合物骨架结构的合理方法是红外光谱分析法。
(×)O分子,没有红外活性,水分子的H-O-H对称伸缩振动[5]对称结构分子,如H2不产生吸收峰。
(×)[6]红外光谱图中,不同化合物中相同基因的特征频率峰总是在特定波长范围内出现,故可以根据红外光谱图中的特征频率峰来确定化合物中该基团的存在。
(√)[7]不考虑其他因素的影响,下列羰基化合物υ伸缩频率的大小顺序为:酰c=0卤>酰胺>酸>醛>酯。
(×)伸缩频率出现在2720cm-1。
(√)[8]醛基中υC=H[9]红外光谱与紫外光谱仪在构造上的差别是检测器不同。
(×)[10]当分子受到红外光激发,其振动能级发生跃迁时,化学键越强吸收的光子数目越多。
(×)频率一般出现在1760cm-1,但形成多聚体[11]游离有机酸C=O伸缩振动υc=0时,吸收频率会向高波数移动。
(×)[12]醛、酮、羧酸等的羰基的伸缩振动在红外光谱中的吸收峰频率相同。
(×)[13]红外吸收峰的数目一般比理论振动数目少,原因之一是有些振动是非红外活性的。
(√)[14]红外光谱的特点是一方面官能团的特征吸收频率的位置基本上是固定的,另一方面它们又不是绝对不变的,其频率位移可以反映分子的结构特点。
(√)[15]Fermi共振是一个基频振动与倍频(泛频)或组频之间产生耦合作用。
(√)二、选择题(单项选择)[1]红外光可引起物质的能级跃迁是( C)。
第二章 红外吸收光谱法

第二章红外吸收光谱法1、在含羰基的分子中,与羰基相连接的原子的极性增加会使分子中该键的红外吸收峰()A、向高波数方向移动B、向低波数方向移动C、不移动D、稍有震动2、红外吸收光谱产生的原因()A、分子外层电子、振动、转动能级的跃迁;B、原子外层电子、振动、转动能级的跃迁;C、分子振动-转动能级的跃迁;D、分子外层电子的能级跃迁。
3、色散型红外分光光度计检测器多用()A、电子倍增器B、光电倍增管C、高真空热电偶D、无线电线圈4、一种能作为色散型红外光谱仪色散元件的材料为()A、玻璃B、石英C、卤化物晶体D、有机玻璃5、一个含氧化合物的红外光谱图在3600~3200cm-1有吸收峰,下列化合物最可能的是()A、CH3-CHOB、CH3-CO-CH3C、CH3-CHOH-CH3D、CH3-O-CH2-CH36、Cl2分子在红外光谱图上基频吸收峰的数目为()A、0B、1C、2D、37、用红外吸收光谱法测定有机物结构时,样品应该是()A、单质B、纯物质C、混合物D、任何物质8、以下四种物质不吸收红外光的是()A、H2OB、CO2C、HClD、O29、红外光谱法,样品状态可以是()A、气体状态B、固体状态C、固体,液体状态D、气体,液体,固体状态都可以10、在红外光谱分析中,固体样品一般采用的制样方法是()A、直接研磨压片测定B、与KBr混合研磨压片测定C、配成有机溶剂测定D、配成水溶液测定11、伸缩振动包括和;变形振动包括和。
12、在苯的红外吸收光谱图中(1)3300~3000cm-1处,由振动引起的吸收峰;(2)1675~1400cm-1处, 由振动引起的吸收峰;(3)1000~650cm-1处,由振动引起的吸收峰;13、红外光谱的三要素是、和。
14、红外吸收光谱的区域可划分为和两个区域。
15、某化合物的分子式为C8H14,其不饱和度为,可能含有个双键或个三键。
16、产生红外吸收的条件是什么?是否所有的分子振动都会产生红外吸收光谱?为什么?17、以亚甲基为例说明分子的基本振动模式。
红外吸收光谱

第二章 红外光谱分析(IR)
§二 原 理
双键区:
表2-2 各类双键的特征吸收
C=O
C=C
苯衍 生 物的 泛 频
强峰。是判断酮、醛、酸、酯及酸酐的 1900-1650 特征吸收峰,其中酸酐因振动偶合而具 有双峰。 1600 和 1500 峰较弱(对称性较高)。在 1680- 1620 附近有 2-4 个峰(苯环骨架振动),用于 识别分子中是否有芳环。 2000- 1650 C-H 面外、C=C 面内变形振动,很弱, 但很特征(可用于取代类型的表征) 。
光可见区内外的温度时,发现红色光以外的黑暗部分
温度比可见光部分高,从而认识到在可见光光波长波 方向末端还有一个红外光区。
红外光发现以后,逐步应用到各个方面,例如红
外检测器、红外瞄准镜、红外理疗仪等。而许多化学 家则致力于研究各种物质对各种不同波长红外光的吸 收程度,用于推断物质分子的组成和结构。
第二章 红外光谱分析(IR)
§二 原 理
3、分子振动: (1)、双原子分子振动 (2)、多原子分子
返回
第二章 红外光谱分析(IR)
§二 原 理
(1)、双原子分子振动:
分子的两个原子以其平衡点为中心,以很小的振幅(与核间距相比)
作周期性“简谐”振动,其振动可用经典刚性振动描述:
1 (频率) 2
1 .......... .......或 (波数) 2c
子的同一种官能团的振动频率变化不大,即具有明显的特征性。 这是因为连接原子的主要为价键力,处于不同分子中的价键
力受外界因素的影响有限!即各基团有其自已特征的吸收谱带。
通常,基团频率位于4000~400cm-1之间。可分为四个区。
第二章 红外光谱分析(IR)
红外光谱分析法在水质监测中的应用研究

红外光谱分析法在水质监测中的应用研究第一章绪论水资源是人类赖以生存的重要资源之一,水质监测是保障水资源安全的重要手段之一。
传统的水质监测方法需要取样分析,费时费力,不利于实时监测。
而红外光谱分析法因其快捷、无需取样、成本低等优点,被广泛应用于水质监测中。
第二章红外光谱基础2.1 红外光谱原理红外光谱是一种分子振动谱,是分子中基团间相互作用引起的振动产生的吸收和发射的谱线。
红外光谱可以提供一些原子团或者分子中特征吸收峰的信息。
2.2 红外光谱仪器红外光谱仪由光源、样品室、光谱分束装置、检测仪器和显示与记录装置等五部分组成。
其中样品室是红外光谱分析的重要组成部分,样品室要求密闭,能够固定样品,并具有薄膜和气氛控制等功能。
2.3 红外光谱数据处理红外光谱数据处理包括预处理和信号处理两个方面。
其中预处理主要是对红外光谱信号进行基线校正、去噪和数据标准化等操作;信号处理主要是对预处理之后得到的谱图进行处理和分析,如质谱指纹图谱的比对等。
第三章红外光谱在水质监测中的应用3.1 红外光谱在水质参数监测中的应用在水质参数监测中,红外光谱可以用于水样中溶解氧、COD、BOD等参数的测定。
例如,一些研究者采用近红外光谱结合PLS 模型对COD进行了测定,取得了较好的成果。
3.2 红外光谱在有机物污染监测中的应用有机物污染是水污染的严重问题之一,而红外光谱可以用于对水中有机物的分析。
研究者通过比对红外光谱图谱,可以判断水中是否存在芳香族有机化合物、多环芳香族烃等污染物,并对其含量进行分析。
3.3 红外光谱在微生物污染监测中的应用水中微生物污染是一种常见的水污染问题,而快速准确地检测水中的微生物是保障水资源安全的重要手段。
红外光谱可以用于检测水中的细菌、藻类等微生物。
第四章红外光谱在水质监测中的优势4.1 无需取样传统的水质监测方法需要取样分析,费时费力,而红外光谱分析法无需取样,非常适合于现场快速检测。
4.2 成本低传统的水质监测方法需要大量仪器和化学试剂,成本高。
(第二章)药物分析-光谱分析法的应用

百分吸收系数:指100 m1溶液中含有1 g溶质,液层厚度1 cm时,
在指定波长和一定条件下所测得的吸收度,用 单位是克-1厘米-1。
或A1% 1c m
表示, E1% 1c m
摩尔吸收系数与百分吸收系数的相互关系为:
E1% 1cm
M
1 10
M:吸光物质的分子量(摩尔质量)。
紫外-可见分光光度法
物质的吸收系数与溶剂的种类、溶液的pH、温度以及波长有关, 测定时必需注意,表示吸收系数时这些条件应注明。 测定吸收系数时,将仪器的波长调至最大吸收波长(λmax)处。
紫外-可见分光光度法
可见分光光度法就是利用有色物质吸收光能的特性来测定物质含量 的方法。 药物内的各种有效成分或主成分,可用此方法进行分析的条件: 1. 成分本身有色; 2. 或与一定显色试剂作用后可形成有色物质; 3. 并且在一定浓度范围内,溶液的吸收度与浓度符合朗伯-比尔定律。
紫外-可见分光光度法
吸收光谱分析发射光谱分析散射光谱分析光谱分析可见分光光度法紫外分光光度法红外分光光度法原子吸收光谱法荧光分析法火焰光度法光是电磁波其能量辐射能可以用波长来表示物质吸收可见光和紫外光则引起价电子跃迁物质吸收红外光则引起分子振动紫外光谱又称为电子光谱红外光谱又称为分子振动光谱分子吸收光谱
第二章 光谱分析法的应用
液4.0ml,30%乙醇定容至刻度,
0.6
吸光度 Absorbance
摇匀,放置15min, 510nm处测定
0.5
吸光度,绘制标准曲线。
0.4
0.3
标准曲线方程为: 0.2
Y=0.0018+1.0926X
0.1
X:所测的吸光度 Y:总黄酮的浓度 R=0.9998
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
红外光谱和分子结构的关系
• 2.2.1分子振动 的形式 • 一、分子的振 动形式 • 伸缩振动 • 亚甲基:
• 变形振动 • 亚甲基
甲基的振动形式
• 伸缩振动 • 甲基:
• • 变形振动 • 甲基
对称δs(CH3)1380㎝-1 不对称δas(CH3)1460㎝-1
对称 υs(CH3) 2870 ㎝-1
• • • • • •
2、饱和碳原子上的—C—H —CH3 2960 cm-1 反对称伸缩振动 2870 cm-1 对称伸缩振动 —CH2—2930 cm-1 反对称伸缩振动 2850 cm-1 对称伸缩振动 —C—H 2890 cm-1 弱吸收
• 3、不饱和碳原子上的=C—H( C—H ) • 苯环上的C—H 3030cm-1 • =C—H 30102260cm-1 • C—H 3300cm-1
• 2)共轭效应
O O H3C C CH3 C CH3 O C CH3 O C
1715
1685
1685
1660
• 3)空间效应 场效应;空间位阻;环张力
1576cm-1 1611cm-1
1644cm-
1
-1 1781cm CH CH 1678cm-1 CH 1657cm-1 CH 1651cm-1
• 1)气体——气体池 • ①液膜法——难挥发液体(BP》80C) • 2)液体
• ②溶液法——液体池
①研糊法(液体石腊法) ②KBR压片法 ③薄膜法
3) 固体
三、联用技术
• • • • GC/FTIR(气相色谱红外光谱联用) LC/FTIR(液相色谱红外光谱联用) PAS/FTIR(光声红外光谱) MIC/FTIR(显微红外光谱)——微量及 微区分析
• • • • • •
例:28003000cm-1 —CH3 特征峰; 16001850cm-1 —C=O 特征峰; 基团所处化学环境不同,特征峰出现位置变化: —CH2—CO—CH2— 1715 cm-1 酮 —CH2—CO—O— 1735 cm-1 酯 —CH2—CO—NH— 1680 cm-1 酰胺
• 二、 叁键(C C)伸缩振动区(25001900 cm-1 ) • 在该区域出现的峰较少; • 1、RC CH 21002140cm-1 • RC CR’21902260cm-1 • R=R’时,无红外活性 • 2、RC N 21002140cm-1 • 非共轭 22402260cm-1 • 共轭 22202230cm-1 • 仅含C、H、N时:峰较强、尖锐; • 有O原子存在时;O越靠近C N,峰越弱;
• 四、 X—Y,X—H 变形振动区 < 1650 cm-1 • 指纹区(1350 650 cm-1 ) ,较复杂。 • C-H,N-H的变形振动; • C-O,C-X的伸缩振动; • C-C骨架振动等。精细结构的区分。 • 顺、反结构区分;
基团吸收带数据
变 形 振 动 伸 缩 振 动 特 征 吸 收 带 ( 伸 缩 振 动 ) 指 纹 吸 收 带 含 氢 化 学 键 伸 缩 振 动 变 三 键 双 键
• 2.氢键效应 • 氢键(分子内氢键;分子间氢键):对峰位,峰强 产生极明显影响,使伸缩振动频率向低波数方向 移动。
O R
H NH R
C=O 伸缩 N-H
游离 氢键 1690 1650 3500 3400
伸缩
N-H 变形
1620-1590
HN H O
H O O C H 3C O-H 伸缩
1650-1620
• 三、双键伸缩振动区( 1900 1200 cm-1 )
• 1、 RC=CR’16201680cm-1 ,强度弱, R=R’(对称) 时,无红外活性。 • 2、单核芳烃的C=C键伸缩振动(16261650 cm-1 )
苯衍生物的C=C
• 苯衍生物在 1650 2000 cm-1 出现 C-H和C=C键 的面内变形振动的泛频吸收(强度弱),可用来 判断取代基位置。 2000 1600
• 光源发出的辐射经干涉仪转变为干涉光,通过 试样后,包含的光信息需要经过数学上的傅立 叶变换解析成普通的谱图。 • 特点: • (1) 扫描速度极快(1s);适合仪器联用; • (2)不需要分光,信号强,灵敏度很高; • (3)仪器小巧。
傅里叶变换红外光谱仪工作原理图
迈克尔干涉仪工作原理图
• 4. 色散型红外光谱仪主要部件 • (1) 光源 • 能斯特灯:氧化锆、氧化钇和氧化钍烧结制成 的中空或实心圆棒,直径1-3 mm,长20-50mm; • 室温下,非导体,使用前预热到800 C; • 特点:发光强度大;寿命0.5-1年; • 硅碳棒:两端粗,中间细;直径5 mm,长2050mm;不需预热;两端需用水冷却; • (2)单色器 • 光栅;傅立叶变换红外光谱仪不需要分光;
• 基团吸
收带数 据
2.4 红外光谱仪
• 2.4.1 仪器类型 与结构
• 两种类型: 色散型 • 干涉型 (傅立叶 变换红外 光谱仪)
• 1. 内部结构
2. 傅里叶变换红外光谱仪结构框图
干涉仪 样品室 检测器 显示器 光源 计算机 绘图仪
干涉图
FTS
光谱图
• 3. 傅立叶变换红外光谱仪的原理与特点
红外光谱信息区
• 常见的有机化合物基团频率出现的范围:4000670cm-1 • 依据基团的振动形式,分为四个区: 1、40002500cm-1X—H伸缩振动区(X=O,N,C,S) 2、25002000cm-1三键,累积双键伸缩振动区
3、20001500cm-1双键伸缩振动区 4、1200400cm-1 • X—Y伸缩, • X—H变形振动区
• 4、基频与倍频 • (1)由基态跃迁到第一激发态,产生一个强 的吸收峰,基频峰; • (2)由基态直接跃迁到第二激发态,产生一 个弱的吸收峰,倍频峰;
C2H4O
O
1730cm-1
1165cm-1
H H H
C
H 2720cm-1
C
• (CH3)1460 cm-1,1375 cm-1。 • (CH3)2930 cm-1,2850cm-1。
不对称 υas(CH3) 2960㎝-1
二、峰位、峰数与峰强
1、峰位 化学键的力常数K越大,原子折合质量越小,键 的振动频率越大,吸收峰将出现在高波数区(短波长 区);反之,出现在低波数区(高波长区)。
• 例1 水分子 • (非对称分子)
2、峰数 峰数与分子自由度有关。无瞬间偶极距变化时, 无红外吸收。 3、瞬间偶极距变化大,吸收峰强;键两端原子电负性相 差越大(极性越大),吸收峰越强; • 例2 CO2分子 • (有一种振动无红外活性)
• (3)检测器 • 真空热电偶;不同导体构成回路时的温差电现 象 • 涂黑金箔接受红外辐射; • 傅立叶变换红外光谱仪采用热释电(TGS)和碲 镉汞(MCT)检测器; • TGS:硫酸三苷肽单晶为热检测元件;极化效 应与温度有关,温度高表面电荷减少(热释电); • 响应速度快;高速扫描;
• 二、制样方法
2.2.3 影响基团频率变化的因素
• 化学键的振动频率不仅与其性质有关,还受分 子的内部结构和外部因素影响。各种化合物中 相同基团的特征吸收并不总在一个固定频率上。 • 一、内部因素 • 1、电子效应 • 1)诱导效应:吸电子基团使吸收峰向高频方 向移动(蓝移)
• R-COR C=0 1715cm-1 ; R-COH C=0 1730cm -1; • R-COCl C=0 1800cm-1 ; R-COF C=0 1920cm-1 ; • F-COF C=0 1920cm-1 ; R-CONH2 C=0 1928cm-1;
红外光谱与有机化合物结构
红外光谱图: • 纵坐标为吸收强度 • 横坐标为波长λ ( m )或波数 1/λ • 可以用峰数,峰位, 峰形,峰强来描述。 • 应用:有机化合物的 结构解析。 • 定性:基团的特征吸 收频率; • 定量:特征峰的强度;
2.1
红外光谱的基本原理
• 红外光谱产生的基本条 件:
• 红外吸收峰强度 问题:C=O 强;C=C 弱;为什么? • 偶极矩变化——结构对称性; • 对称性差偶极矩变化大吸收峰强度大 • 符号:s(强);m(中);w(弱) • 红外吸收峰强度比紫外吸收峰小2~3个数量级;
2.2.2 红外光谱的分区
• 与一定结构单元相联系的、在一定范围内出现的化学 键振动频率——基团特征频率(特征峰);
O-H 3630 N-H 3350 P-H 2400 S-H 2570 C-H 3330 Ar-H 3060 =C-H 3020 -CH3 2960,2870 CH2 2926,2853 -CH 2890 C C 2050 C N 2240 R2C=O 1715 RHC=O 1725 C=C 1650 C-O 1100 C-N 1000 C-C 900 C-C-C <500 C-N-O 500 H-C=C-H 960(反) R-Ar-H 650-900 H-C-H 1450
第二章 红外光谱分析
本章内容
• • • • 红外光谱的基本原理 红外光谱和分子结构的关系 影响基团频率变化的因素 各类化合物的红外光谱特征(重点,难 点) • 红外光谱仪
• 红外光的能量比紫外光的能量低,当红 外光照射分子时不足以引起分子中价电 子能级的跃迁,而能引起分子振动能级 和转动能级的跃迁,所以红外光谱又称 作分子振动光谱或振转光谱。
分子的振动能量比转动能量大,当发生振 动能级跃迁时,不可避免地伴随有转动能级的 跃迁,所以无法测量纯粹的振动光谱,而只能 得到 分子的振动-转动光谱,这种光谱称为红 外吸收光谱。 当样品受到频率连续变化的红外光照射时, 分子吸收了某些频率的辐射,并由其振动或转 动运动引起偶极矩的净变化,产生分子振动和 转动能级从基态到激发态的跃迁,使相应于这 些吸收区域的透射光强度减弱。记录红外光的 百分透射比与波数或波长关系曲线,就得到红 外光谱。
