大肠菌群-菌落总数检验报告原始记录(2)
微生物检测原始记录文本

XXXX检测有限公司
菌落总数与大肠菌群检验原始记录
共页第页主检:
菌落总数和大肠菌群检测原始记录
共页第页
共页第页
主检:年月日校核:年月日
XXXX检测有限公司
水质微生物检验原始记录
共页第页
主检:年月日校核:年月日
XXXX检测有限公司
乳酸菌与大肠菌群检测记录
共页第页主检:
XXXX检测有限公司
致病菌检验原始记录
共页第页
XXXX 检测有限公司 主检:
年 月 日 校核:
主检: 年 月 日 校核: 年 月 日
XXXX 检测有限公司
霉菌和酵母菌检验原始记录
菌落计数:
商业无菌检验原始记录
共页第页
XXXX检测有限公司
主检日期校核日期。
水质细总大肠菌群原始记录

水质细总大肠菌群原始记录1. 目的为确定本公司水质中菌落总数、大肠菌群测定使用方法,明确菌落总数、大肠菌群检测相关细则,指导人员正确作业,确保检测工作正常开展,根据《生活饮用水标准检验方法》GB5750.12-2006制订本方法作业指导书。
2. 适用范围适用于水质中菌落总数、大肠菌群的测定。
3. 职责检测人员严格按照本指导书要求开展检测工作。
4. 检测依据标准及检测方法《生活饮用水卫生标准》GB 5749-2006《生活饮用水标准检验方法》GB5750.12-20065. 标准值表1 二次供水菌落总数、大肠菌群6. 检验仪器及设备高压蒸汽灭菌器、恒温培养箱、冰箱、显微镜、PH试纸。
7. 试剂和材料营养琼脂培养基,三倍浓缩乳糖蛋白胨培养液,伊红美兰琼脂,革兰氏染色液。
8. 检测程序8.1 菌落总数:取采集的样品1mL于灭菌平皿内,倾入已融化冷却至45℃的营养琼脂15mL,同时做一个平行样和一个空白对照平皿,并立即摇匀。
冷却后,翻转平板,置于35℃~37℃恒温箱中,培养48h。
计数每个平板上的菌落数。
8.2 大肠菌群:在5支装有10mL双料乳糖蛋白胨培养液的试管各加水样10mL;在5支装有10mL单料乳糖蛋白胨的试管各加水样1mL,在5支装有10mL单料乳糖蛋白胨的试管各加稀释后的水样(1:10)1mL。
轻摇试管,是液体充分混匀,置35℃~37℃培养箱中24h。
观察是否产酸产气,若有,需进一步做证实试验。
8.3 取一环阳性管中的溶液接种到伊红美兰琼脂平板上,置35℃~37℃培养箱中18h~24h,观察菌落形态,典型的大肠菌群菌落为黑紫色或红紫色,具有金属光泽。
8.4 挑取可疑大肠菌群菌落1或2个进行革兰氏染色,同时接种乳糖发酵管,于36℃±1℃培养箱中,培养24h。
8.5 凡乳糖发酵管最终产酸、产气,革兰氏染色为阴性的无芽孢杆菌,为大肠菌群阳性。
记下证实试验的阳性管数,查总大肠菌群(MPN)检索表得出100mL水样中总大肠菌群的MPN值。
生产用水水质微生物检验原始记录

菌落总数、大肠菌群检验原始记录编号:002 品名:取样日期:取样量:一、菌落总数(实验仪器:SP-02型生化培养箱,LX-01型立式压力蒸汽灭菌器)1.检测设备:培养箱:℃,高压蒸汽灭菌锅温度:℃,压强:Mpa ,灭菌时间:min2.检测条件:温度:℃,湿度:%检测方法:GB4789.2-2016用刻度吸管吸取样品液1ml注入9ml无菌生理盐水的试管中混匀,制成1:10的样品均液。
按上述操作,制成10倍系列稀释样品均液。
根据对样品污染状况的估计,选择2-3个稀释度,每个稀释度分别吸取1ml样品稀释均液加入2个平皿内,同时分别吸取1ml无菌生理盐水加入2个无菌平皿做空白对照。
倾注15ml-20ml 46 ℃左右的PCA培养基,静置冷却,倒置于36±1℃的恒温培养箱中培养48h±2h。
二、大肠菌群(实验仪器:SP-02型生化培养箱,LX-01型立式压力蒸汽灭菌器)1.检测设备:培养箱:℃,高压蒸汽灭菌锅温度:℃,压强:Mpa ,灭菌时间:min2.检测条件:温度:℃,湿度:%培养开始:年月日时,培养结束:年月日时,培养时间:h检测方法:GB/T 4789.3-2003用刻度吸管吸取样品液1ml注入9ml无菌生理盐水的试管中混匀,制成1:10的样品均液。
按上述操作,制成10倍系列稀释样品均液。
根据对样品污染状况的估计,选择2-3个稀释度,每个稀释度接种三管。
将待检样品接种于乳糖胆盐发酵管中,接种量在1ml以上者,用双料乳糖胆盐发酵管,1ml及1ml以下者,用单料乳糖胆盐发酵管,每个稀释度接种三管,置于36±1℃的恒温培养箱中培养24h±2h ,如果所有乳糖胆盐发酵管都不产气,则可报告为大肠菌群阴性,如有产气者,则将产气的发酵管分别转接种在伊红美蓝琼脂平板上,置于36±1℃的恒温培养箱中培养18h±2h,然后取出观察菌落形态,并做革兰氏染色和证实试验。
大肠菌群检验原始记录(第二法)

原始记录
共页;第页项目名称大肠菌群样品编号
使用设备名称电热恒温培养箱手提式压力蒸汽消毒器
试验方法标准GB 4789.3-2010(第二
法)
环境条件温度℃,相对湿度 %
以无菌操作将检样25g置于225mL灭菌生理盐水中,混匀后,做成检验所用稀释液:分别将待检样品稀释液接种于2个VRBA平板混匀,待琼脂凝固后,再加3mL-4mLVRBA覆盖平板表层。
翻转平板,置于36℃±1℃温箱内,培养18h-24,计数典型和可疑菌落。
选取典型菌落或可疑菌落进行证实试验,观察产气情况。
稀释度
典型菌落总数cfu/ml n 1
n 2
n 3
n 4
n 5
证实试验从VRBA平板上挑取10个典型菌落或可疑菌落,分别移种于BGLB肉汤管,36℃±1℃温箱内,培养24h-48h.凡BGLB肉汤管产气,即可报告为大肠菌群阳性。
检测结果
备注n为同一批次产品应采集的样品件数;c为最大可允许超出m值的样品数;m为致病菌指标可接受水平的限量值;M为致病菌指标的最高安全限量值
检验人员校核人员检验日期校核日期。
大肠菌检验原始记录
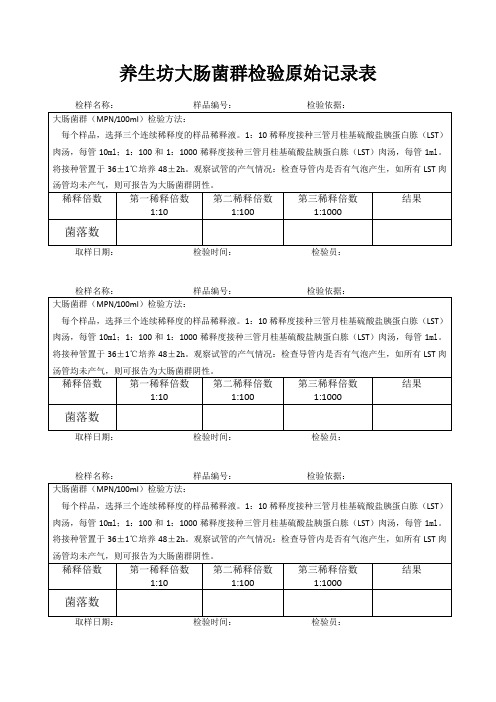
养生坊大肠菌群检验原始记录表检样名称:样品编号:检验依据:大肠菌群(MPN/100ml)检验方法:每个样品,选择三个连续稀释度的样品稀释液。
1:10稀释度接种三管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管10ml;1:100和1:1000稀释度接种三管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管1ml。
将接种管置于36±1℃培养48±2h。
观察试管的产气情况:检查导管内是否有气泡产生,如所有LST肉汤管均未产气,则可报告为大肠菌群阴性。
稀释倍数第一稀释倍数1:10 第二稀释倍数1:100第三稀释倍数1:1000结果菌落数取样日期:检验时间:检验员:检样名称:样品编号:检验依据:大肠菌群(MPN/100ml)检验方法:每个样品,选择三个连续稀释度的样品稀释液。
1:10稀释度接种三管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管10ml;1:100和1:1000稀释度接种三管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管1ml。
将接种管置于36±1℃培养48±2h。
观察试管的产气情况:检查导管内是否有气泡产生,如所有LST肉汤管均未产气,则可报告为大肠菌群阴性。
稀释倍数第一稀释倍数1:10 第二稀释倍数1:100第三稀释倍数1:1000结果菌落数取样日期:检验时间:检验员:检样名称:样品编号:检验依据:大肠菌群(MPN/100ml)检验方法:每个样品,选择三个连续稀释度的样品稀释液。
1:10稀释度接种三管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管10ml;1:100和1:1000稀释度接种三管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管1ml。
将接种管置于36±1℃培养48±2h。
观察试管的产气情况:检查导管内是否有气泡产生,如所有LST肉汤管均未产气,则可报告为大肠菌群阴性。
稀释倍数第一稀释倍数1:10 第二稀释倍数1:100第三稀释倍数1:1000结果菌落数取样日期:检验时间:检验员:。
大肠菌群检验原始记录

初发酵(月桂基硫酸盐胰蛋白胨肉汤,)支)
产气管数(支)
复发酵(煌绿乳糖胆盐
肉汤,
37℃,,48h)
产气管数(支)
10-1
10-2
10-3
检验结果
(MPN/100g)
检验人:复核人:
大肠菌群检验检验原始记录
样品名称
明胶
样品编号
样品状态
生产日期
检验依据
GB4789.3-2010
检验日期
大肠菌群检验过程:
1、称取样品25g样品放入盛有225ml灭菌的生理盐水中,制成1:10的样品匀液,用1ml无菌吸管吸取1:10的样品匀液1ml,沿管壁缓缓注入盛有9ml生理盐水的无菌试管中,制成1:100的样品均液,用1ml无菌吸管吸取1:100的样品匀液1ml,沿管壁缓缓注入盛有9ml生理盐水的无菌试管中,制成1:1000的样品均液。
2、初发酵试验:大肠菌群每个样品,选择3个适宜的连续稀释度的样品匀液,每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤(大肠菌群测定:如果超过1ml,则用双料LST肉汤),36℃±1℃培养24h±2h,观察倒管内产气情况。如未产气,培养至48h±2h,如产气着进行复发酵试验。
三、复发酵试验:(大肠菌群的测定)用接种环从产气的LST肉汤管中分别取培养物1环,移种于煌绿糖胆盐肉汤(BGLB)管中,36℃±1℃培养48h±2h,,观察产气情况。
微生物检测原始记录文本

菌落总数与大肠菌群检验原始记录
共页第页
主检:年月日校核:年月日
菌落总数和大肠菌群检测原始记录
主检:年月日校核:年月日
XXXX检测有限公司
水质微生物检验原始记录
共页第页
主检:年月日校核:年月日
乳酸菌与大肠菌群检测记录
共页第页
主检:年月日校核:年月日
致病菌检验原始记录
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
培养温度:28±1℃培养时间:年月日时 --- 年月日时:
菌落计数:
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:。
菌落总数测定原始记录
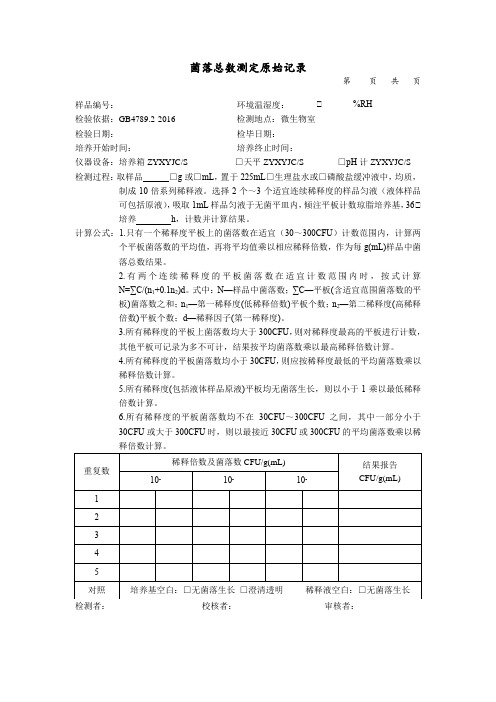
菌落总数测定原始记录第页共页样品编号:环境温湿度:℃ %RH检验依据:GB4789.2-2016 检测地点:微生物室检验日期:检毕日期:培养开始时间:培养终止时间:仪器设备:培养箱ZYXYJC/S- □天平ZYXYJC/S- □pH计ZYXYJC/S- 检测过程:取样品□g或□mL,置于225mL□生理盐水或□磷酸盐缓冲液中,均质,制成10倍系列稀释液。
选择2个~3个适宜连续稀释度的样品匀液(液体样品可包括原液),吸取1mL样品匀液于无菌平皿内,倾注平板计数琼脂培养基,36℃培养h,计数并计算结果。
计算公式:1.只有一个稀释度平板上的菌落数在适宜(30~300CFU)计数范围内,计算两个平板菌落数的平均值,再将平均值乘以相应稀释倍数,作为每g(mL)样品中菌落总数结果。
2.有两个连续稀释度的平板菌落数在适宜计数范围内时,按式计算N=∑C/(n1+0.1n2)d。
式中:N—样品中菌落数;∑C—平板(含适宜范围菌落数的平板)菌落数之和;n1—第一稀释度(低稀释倍数)平板个数;n2—第二稀释度(高稀释倍数)平板个数;d—稀释因子(第一稀释度)。
3.所有稀释度的平板上菌落数均大于300CFU,则对稀释度最高的平板进行计数,其他平板可记录为多不可计,结果按平均菌落数乘以最高稀释倍数计算。
4.所有稀释度的平板菌落数均小于30CFU,则应按稀释度最低的平均菌落数乘以稀释倍数计算。
5.所有稀释度(包括液体样品原液)平板均无菌落生长,则以小于1乘以最低稀释倍数计算。
6.所有稀释度的平板菌落数均不在30CFU~300CFU之间,其中一部分小于30CFU或大于300CFU时,则以最接近30CFU或300CFU的平均菌落数乘以稀释倍数计算。
微生物检验原始记录(大肠菌群)

微生物检验原始记录(大肠菌群)检验原始记录编号:报告类别:微生物共页项目:大肠菌群coliforms 检验地点:样品名称:样品编号:样品状态:符合检验要求;其他境条件:实验依据及步骤GB4789.3-2016样品稀释固体和半固体样品:称取25g样品置盛有225ml生理盐水或磷酸盐缓冲液的无菌均质容器内均质,或放入盛有225ml稀释液的无菌均质袋中拍击式均质器拍打,制成为1:10样品匀液。
依次进行10倍递增稀释。
液体样品:以无菌吸管吸取25ml样品置盛有225ml磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中混匀,为1:10样品匀液。
样品匀液的ph应在6.5-7.5之间,必要时分别用1mol/lNaOH或1mol/lHcL调节。
取1mL1∶10稀释匀液沿管壁缓缓注入9ml磷酸盐缓冲液或生理盐水的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用一支无菌吸管反复吹打,使其混合均匀,制成1:100样品匀液。
按上述操作顺序做10倍递增稀释液,每稀释一次,换用一支1mL灭菌吸量管。
从样品匀液制备到样品接种完毕,全过程不得超过15min。
初发酵试验(9管法)每个样品,选择3个适宜的连续稀释度的样品匀液(液体样品可以选择原液),每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤(大肠菌群测定:如果超过1ml,则用双料LST肉汤)36℃±1℃培养24h±2h,观察倒管内是否有气泡产生。
产气者进行复发酵试验,未产气则继续培养至48±2h,产期进行复发酵试验。
未产气者为大肠菌群阴性。
复发酵试验(证实试验)用接种环从产气的LST肉汤管中分别取培养物1环,移种于煌绿糖胆盐肉汤(BGLB)管中,36℃±1℃培养48h±2h,,观察产气情况。
数据分析与结果一、菌落计数根据证实为大肠菌群的阳性管数,查MPN检索表,报告大肠菌群的最可能数。
大肠菌群检验原始记录(平板计数法)

XX公司
食品微生物检验记录
检品编号:检品名称:
【大肠菌群】按GB 4789.3-2010第二法平板计数法进行检验
环境条件:温度:湿度:
仪器设备:超净工作台编号:;培养箱(36℃±1℃)编号:
电子天平编号:
培养基与试剂:(配制日期:年月日)
①结晶紫中性红胆盐琼脂(VRBA);②无菌生理盐水;③煌绿乳糖胆盐(BGLB)肉汤
样品操作
取 5 份独立包装的样品,分别取()、、、、做为测试样品,按如下述操作,测得结果;
每份测试样品加入225 mL无菌生理盐水,均质,制成1:10样品均液(调节pH值为6.5~7.5),吸取 1 mL(1:10)样品均液至9 mL灭菌生理盐水中做10倍递增稀释。
选、和稀释液检测,培养基为结晶紫中性红胆盐琼脂(VRBA),℃,培养h(从月日: 到月日: ),
挑选10个不同类型典型和可疑菌落,接种煌绿乳糖胆盐(BGLB)肉汤管,℃培养h(从月日: 到月日: )。
标准规定:(标准号:)
n=5 c= m= CFU/g(mL)M= CFU/g(mL)结论:□符合规定□不符合规定
检验者:复核者:检验日期:。
检验原始记录菌落总数及大肠菌群表格

检验原始记录
共页第页
样品名称样品编号
检验环境温度℃相对湿度% 菌落总数的测定(依据GB4789.2-2010检验)
主用仪器:培养箱
检验项目检测结果
样品稀释度10 10 10
菌落数,个
两稀释液之比
空白对照
菌落总数cfu/g
培养温度36℃±1℃培养时间:48 h±2h
主检校核日期
大肠菌群的测定(依据GB4789.3-2010检验)
主用仪器:培养箱
接
种量0.1g×3
初发酵试验LST肉汤管
复发酵试验BGLB肉汤管0.01g×3
初发酵试验LST肉汤管
复发酵试验BGLB肉汤管
0.001g×3
初发酵试验LST肉汤管
复发酵试验BGLB肉汤管
查大肠菌群最可能数(MPN)检索表[MPN/ ]::
培养温度36℃±1℃培养时间:48 h±2h
备注:‘+’表示阳性;‘-’表示阴性。
主检校核日期。
食品中细菌菌落总数及大肠菌群的检测实验报告

实验九食品中细菌菌落总数及大肠菌群的检测[实验目的]1、了解国家规定的食品质量与细菌菌落总数和大肠菌群数量的重要关系。
2、掌握食品细中细菌菌落总数及大肠菌群的检测方法。
[实验原理]菌落总数根据稀释平板技术法检测每mL/g检样在牛肉膏蛋白胨琼脂培养基上,经37℃、24h培养后,所生长的细菌菌落的总数。
它所反映的是检样中的活菌数,细菌数越多,说明污染程度越大,这项指标可作为判定待测样品被污染的程度。
大肠菌群数是在100mL(g)食品中(或1000 mL水中)大肠菌群最近似值。
它是指肠杆菌科中的4个属,即埃希氏菌属、柠檬酸杆菌属、克雷伯氏菌属和肠杆菌属。
这一菌群致病力不强,具有共同特点:好氧和兼性厌氧、革兰氏染色阴性反应、无芽孢杆菌、37℃培养24-48h能发酵乳糖产酸产气。
大肠菌群在人畜肠道内含量最多,可随排泄物进入水源或污染食品。
国际公认以大肠菌群的存在作为粪便污染指标。
这项指标可判定待测样品有无被粪便污染及污染的程度。
[实验材料]1、检样牛乳(饮料、酱油)2、培养基普通营养琼脂平板、单料乳糖胆盐发酵培养基、乳糖发酵培养基、EMB平板3、仪器和其他物品恒温箱、水浴锅、无菌培养皿、无菌吸管、无菌盐水瓶(内装225 mL无菌生理盐水)、无菌试管(内装9 mL无菌生理盐水)、灭菌剪刀、镊子等[实验内容]1、细菌菌落总数的测定(1)制备样品及样品稀释取待测样品(牛乳、酱油)一瓶,用点燃的酒精棉球烧灼瓶口,若是塑料瓶则用75%的酒精棉球擦拭灭菌。
在无菌条件下取样25 mL放入内装225 mL生理盐水的瓶中,充分混匀,制成10-1的稀释液。
用1 mL无菌吸管吸取10-1稀释液1mL,沿管壁徐徐注入装有9mL无菌生理盐水的试管中(注意,吸管尖端不要触及管内稀释液),振荡试管,混合均匀,制成10-2的稀释液。
另取1mL无菌吸管,按上述操作方法做成10-3稀释液。
每次稀释,换用一支无菌吸管,共做10-1、10-2、10-3三个稀释度,分别含样品0.1mL,0.01mL,0.001mL。
微生物检测原始记录
XXXX检测有限公司
菌落总数与大肠菌群检验原始记录共页第页
主检:年月日校核:年月日
XXXX检测有限公司
菌落总数和大肠菌群检测原始记录
共页
第页
主检:年月日校核:年月日
XXXX检测有限公司
水质微生物检验原始记录
共页第页
主检:年月日校核:年月日
XXXX检测有限公司
乳酸菌与大肠菌群检测记录
共页第页
主检:年月日校核:年月日
XXXX检测有限公司
致病菌检验原始记录
共页第页
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
共页第页
培养温度:28±1℃培养时间:年月日时 ---年月日时:
菌落计数:
培养温度:28±1℃培养时间:年月日时 --- 年月日时
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:。
菌落总数测定原始记录(确定版)

菌落总数测定原始记录事业部门:检测人员:样品名称:检验日期:环境温度:℃检验依据:GB 4789.2—20101.主要设备:天平培养箱2.检验过程:取样稀释□饭菜取样:称取25g样品置盛有225ml生理盐水的无菌均质容器内均质,为1:10样品匀液。
□空气样品:室内面积小于30㎡,在对角线里中外三点距墙1米位置取样室内面积大于30㎡,在四角和中间位置取样取样时将计数平板琼脂培养基打开平皿盖放置在工作台上,静置5分钟□手部取样:被检人五指并拢,用浸泡生理盐水的棉签,从指尖到指端涂搽两次,剪去手接触部分棉棒,将棉签放入10ML的生理盐水中□餐具接触面取样:用浸泡生理盐水的棉签,在被检测物体表面取25CM2的面积,涂抹两次使其充分接触,剪去手接触部分棉棒,将棉签放入10ML的生理盐水中倾注平板□空气样品:直接培养箱培养□接触面样品:用1mL无菌吸管吸取该样品匀液1mL,沿管壁缓慢注于盛有9mL生理盐水的无菌试管震荡或者使其混合均匀制成1:100样液;按上面程序更换吸管制作1:1000样液;分别将□1:10、□1:100、□1:1000样液吸取1ML于无菌平皿内,每个稀释度做两个平皿,分别取1ML空白稀释液作空白对比;及时将15-20ML 的46度平板计数培养基倾注平皿,并转动使其混合均匀;培养普通样品36℃±1℃培养48h±2h。
水品30℃±1℃培养72h±3h。
培养起止时间起:止:1:101:1001:1000空白12121212观察结果(个)计算结果报告3.计算方法:1)若只有一个稀释度平板上的菌落总数在适宜计数范围内,计算两个平板菌落总数的平均值,再将平均值乘以相应稀释倍数,作为每克(或毫升)中菌落总数结果。
2)若有两个连续稀释度的平板菌落总数在适宜计数范围内时,按式(Ⅰ)计算:N= ∑C/(n1+0.1n2)d (Ⅰ)式中:N——样品中菌落总数;∑C——平板(含适宜范围菌落总数的平板)菌落数之和;n1——第一个适宜稀释度平板数;n2——第二个适宜稀释度平板数;d——稀释因子(第一稀释度)。
大肠菌落测定原始记录(确定版)
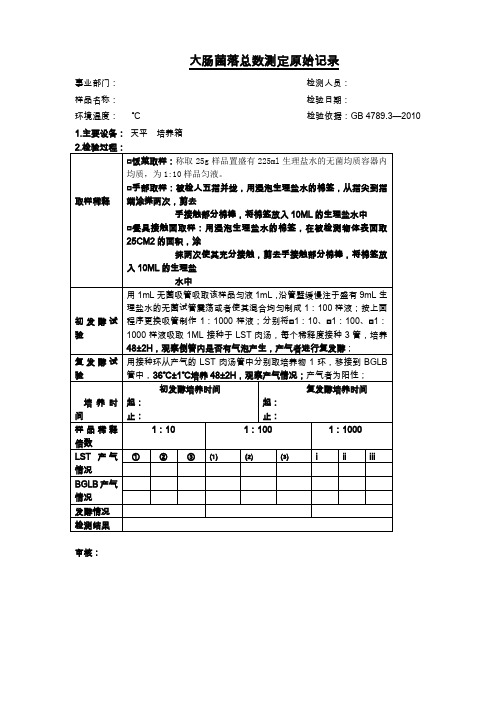
□餐具接触面取样:用浸泡生理盐水的棉签,在被检测物体表面取25CM2的面积,涂
抹两次使其充分接触,剪去手接触部分棉棒,将棉签放入10ML的生理盐
水中
初酵试验
用1mL无菌吸管吸取该样品匀液1mL,沿管壁缓慢注于盛有9mL生理盐水的无菌试管震荡或者使其混合均匀制成1:100样液;按上面程序更换吸管制作1:1000样液;分别将□1:10、□1:100、□1:1000样液吸取1ML接种于LST肉汤,每个稀释度接种3管,培养48±2H,观察倒管内是否有气泡产生,产气者进行复发酵;
大肠菌落总数测定原始记录
事业部门:检测人员:
样品名称:检验日期:
环境温度:℃检验依据:GB 4789.3—2010
1.主要设备:天平培养箱
2.检验过程:
取样稀释
□饭菜取样:称取25g样品置盛有225ml生理盐水的无菌均质容器内均质,为1:10样品匀液。
□手部取样:被检人五指并拢,用浸泡生理盐水的棉签,从指尖到指端涂搽两次,剪去
复发酵试验
用接种环从产气的LST肉汤管中分别取培养物1环,移接到BGLB管中,36℃±1℃培养48±2H,观察产气情况;产气者为阳性;
培养时间
初发酵培养时间
起:
止:
复发酵培养时间
起:
止:
样品稀释倍数
1:10
1:100
1:1000
LST产气情况
①
②
③
⑴
⑵
⑶
ⅰ
ⅱ
ⅲ
BGLB产气情况
发酵情况
检测结果
审核:
大肠菌群_菌落总数检验报告原始记录

微生物实验原始记录
粤珍小厨餐饮管理有限公司
编号:
放入时培养
℃样品名称样品编号
箱温度
取出时培养
设备名称电热恒温培养箱(±1℃)设备编号DHP-9082
℃
箱温度
检验依据GB/T4789.2-2010 GB/T4789.3-2010样品状态
一、菌落总数(cfu/g)
以无菌操作将检样25g于225ml灭菌生理盐水中,均质后充分振摇做成1:10的均匀稀释
液。
取1ml灭菌吸管吸取上述稀释液1ml,加入9ml灭菌生理盐水中,混合均匀,做成1:100
的稀释液,按上述方法操作,做10倍递增稀释。
每个稀释度吸取1ml于灭菌培养皿内,注入凉至46℃的营养琼脂15ml,混匀。
待营养琼
脂凝固后,翻转平板于36℃培养48h。
同时做空白对照。
样品匀液
10-110-210-3(10-i)
观察结果(C)
计算结果N
报告结果
CFU/g
主检:审核:检验日期:年月日
邹平县产品质量监督检验所检验原始记录
共页第页
主检:校核:检验日期:年月日
邹平县产品质量监督检验所检验原始记录
共页第页
主检:校核:检验日期:年月日
如有侵权请联系告知删除,感谢你们的配合!。
微生物检测原始记录模版

菌落总数与大肠菌群检验原始记录
主检:年月日校核:年月日
菌落总数和大肠菌群检测原始记录
主检:年月日校核:年月日
水质微生物检验原始记录
主检:年月日校核:年月日
乳酸菌与大肠菌群检测记录
主检:年月日校核:年月日
致病菌检验原始记录
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
菌落计数:
培养温度:28±1℃培养时间:年月日时--- 年月日时
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:。
大肠菌落原始记录

×××产品质量计量检测所
产品检验原始记录
No
产品名称样品编号技术标准
检测地点温度湿度
大肠菌群的测定
一、设备和材料
培养箱(36℃±1℃);恒温水浴锅(46℃±1℃)
二、操作步骤
1、称取(吸取)25g(ml),放于盛有225ml生理盐水的无菌锥形瓶中,充分混匀,制成1:10的样品匀液。
2、用1ml无菌吸管吸取1:10样品匀液1ml,沿管壁缓慢注于盛有9ml稀释液的无菌试管中,振摇试管使其混合均匀,制成1:10的样品匀液。
3、按上述操作程序,制备10倍系列稀释样品匀液,每递增稀释一次,换用一次1ml无菌吸管。
4、选择稀释度的样品匀液,每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤,分别接种ml;ml;ml,在36℃±1℃培养24±2h,未产气者为大肠菌群阴性。
对产气者按下述进行复发酵实验。
5、用接种环从产气的LST肉汤管中分别取培养物1环,移种于煌绿乳糖胆盐肉汤(BGLB)管中,36℃±1℃培养48±2h,产气者,计为大肠菌群阳性管。
三、大肠菌群最可能数(MPN)的报告见下表
检验:审核:检验日期:。
