无机及分析化学 第7章 配位化合物与配位解离平衡
第7章 配位化合物与配位解离平衡

H3N Cu H3N
NH3 NH3
2+
H2N CH2 CH2
2+
7.1 配位化合物的组成和命名
3 配位化合物的类型
特殊配合物
金属羰基配合物 Fe(CO)5 簇状配合物 金属夹心配合物(二茂铁) 大环配合物(血红素)
CH2 HC H3C N Fe N H3C (H2C)2 CO2H (H2C)2 CO2H N CH3 N CH3 C CH2 H
五氯• 一氨合铂(Ⅳ)酸钾
7.1 配位化合物的组成和命名
3 配位化合物的类型 简单配合物 单齿配体:一个配位原子 (NH3, H2O, CN-) 螯合物 多齿配体:两个(含)以上配 位原子(en,EDTA)
NH2 Cu2+ + 2 CH2NH2 CH2NH2 H2C H2C NH2 H2N Cu
配体(配位原子)
配体:含孤对电子
阴离子:X-, OH-, SCN中性分子:CO, H2O, NH3
配位原子:配体中与中心原子直接相连的原子。 H,C,N,P,As,Sb,O,S,Se,Te,F, Cl,Br,I
7.1 配位化合物的组成和命名
1 配位化合物的组成 单齿配体: 一个配体中只含一个配位原子。
7.2 配离子在溶液中的解离平衡
2 配位解离平衡的移动 加入化学试剂引起组分浓度的变化而导致平衡移动。
配位平衡和酸碱平衡
[Fe(C2O4 )3 ] Fe
3-
3+
+ 3C2O4
+
2-
OH Fe(OH)3
-
+
H+ H2C2O4
平衡
7.2 配离子在溶液中的解离平衡
2 配位解离平衡的移动
无机及分析化学第七章选择题及答案

20. 重量分析中的沉淀形式应当符合(D)A. 溶解度小B. 沉淀纯净含杂质少C. 相对分子量尽量大D. A、B和C17. Ca3(PO4)2的溶解度为a/2 mol·L-1,其Ksp为 ( D)(A). 36a5 (B) 4 a5/ 9 (C) 9a5 /4 (D) 27a5 /87.已知在一定的温度下,CdCO3的Ksp=×10-12,Cd(OH)2的Ksp=×10-14,那么它们在水中的溶解度:( B )>Cd(OH)2 <Cd(OH)2= Cd(OH)2D.不能确定13. AgNO3处理[Fe(H2O)5Cl]Br溶液,产生沉淀主要是 ( A )A. AgBrB. AgClC. AgBr和AgClD. Fe(OH)3存在下,AgCl的溶解度比纯水中大,原因是(C)(A)同离子效应(B)酸效应(C)盐效应(D)配位效应9. 在沉淀反应中,加入易溶电解质会使沉淀的溶解度增加,该现象是( B)A. 同离子效应B. 盐效应C. 酸效应D. 配位效应5. 某物质的化学式是AB3,其溶解度S和容度积常数KspΘ的关系式是(C)A. Ksp Θ=2S2 B. KspΘ=2S3 C. KspΘ=27S4 D. KspΘ=4S29、已知在一定的温度下,CdCO3的Ksp=×10-12,Cd(OH)2的Ksp=×10-14,那么它们在水中的溶解度:B(1)CdCO3>Cd(OH)2(2)CdCO3<Cd(OH)2(3)CdCO3= Cd(OH)2(4)不能确定16、Ag2S的溶度积Ksp的表示式为:D(1)Ksp =c(Ag+)c(s2-) (2)Ksp= c(Ag+)c(s2-) 2(3)Ksp = 2c(Ag+)c(s2-) (4)Ksp= c(Ag+) 2c(s2-)11. 过量AgCl溶解在下列各物质中,问哪种溶液中Ag+浓度最小(D)A. 100 cm3水B. 1000 cm3水C. 1000 cm3 mol·dm-3KNO3溶液 D. 100 cm3 mol·dm-3KCl溶液20.关于晶型沉沉淀的条件,下列说法错误的是: ( D)(A)沉淀反应应当在适当稀的溶液中进行;(B)沉淀作用应当在热溶液中进行;(C)沉淀完毕后进行陈化使沉淀晶体完整、纯净;(D)当沉淀剂是挥发性物质时,沉淀剂用量应为其理论用量的200%为宜。
无机及分析化学第7章 习题解答

第七章 水溶液中的解离平衡 习题解答1.写出下列物质的共轭酸。
S 2-、SO 42-、H 2PO 4-、HSO 4-、NH 3、NH 2OH 、55C H N 。
1.依次为:HS -、HSO 4-、H 3PO 4、H 2SO 4、NH 4+、NH 2OH ⋅H +、55C H N ⋅H +。
2.写出下列物质的共轭碱。
H 2S 、HSO 4-、H 2PO 4-、H 2SO 4、NH 3、NH 2OH 、3+26[Al(H O)]。
2.依次为:HS -、SO 42-、HPO 42-、HSO 4-、NH 2-、NH 2O -、2+25[Al(OH)(H O)]。
3.根据酸碱质子理论,按由强到弱的顺序排列下列各碱。
NO 2-、SO 42-、HCOO -、HSO 4-、Ac -、CO 32-、S 2-、ClO 4-。
3.下列碱由强到弱的顺序:S 2-> CO 32-> Ac-> HCOO-> NO 2-> SO 42-> HSO 4-> ClO 4-1414.151010-- 1410.251010-- 144.741010-- 143.741010-- 143.371010-- 141.991010--4.pH =7.00的水溶液一定是中性水溶液吗?请说明原因。
4.不一定。
K w 随温度的改变而改变,在常温下它的值为10-14,此时的中性溶液pH 为7.005.常温下水的离子积w K θ=1.0×10-14,是否意味着水的解离平衡常数K θ=1.0×10-14?5.不。
w K θ=[H +][OH -],而K θ=[H +][OH -]/c (H 2O);c (H 2O)=11000/18.0255.5mol L 1-=⋅ 6.判断下列过程溶液pH 的变化(假设溶液体积不变),说明原因。
(1)将NaNO 2加入到HNO 2溶液中; (2)将NaNO 3加入到HNO 3溶液中; (3)将NH 4Cl 加入到氨水中; (4)将NaCl 加入到HAc 溶液中;6. (1)pH 变大。
无机及分析化学 第7章 配位化合物与配位解离平衡讲课讲稿

配位数 配位数
7.1 配位化合物的组成和命名
1 配位化合物的组成
配离子电荷 配离子电荷等于中心离子和配体两者电荷的代数和。
(+3)
[Fe(CN)6]3-(赤血盐)
(+2)
[Fe(CN)6]4-(黄血盐) [Fe(CO)5]
?配合物内界是否一定带电
7.1 配位化合物的组成和命名2 配位化合物的命名配体 Nhomakorabea 配位原子
练习:
[Cu(NH3)4]SO4
K3[Fe(NCS)6] [Fe(CO)5]
7.1 配位化合物的组成和命名
1 配位化合物的组成
中心离子(或原子)
➢ 一般为带正电的过渡金属离子 [Co(NH3)6]3+, [Fe(CN)6]4-, [HgI4]2-
➢ 电中性原子:Ni(CO)4 , Fe(CO)5 , Cr(CO)6 ➢ 非金属元素原子:SiF62- , PF6-
◆难点内容:配位化合物的解离平衡常数,配位平衡移 动的计算。
主要章节
79.1.1配核位外化电合子物的的运组动成状和态命名 7.2 配离子在溶液中的解离平衡
7.1 配位化合物的组成和命名
1 配位化合物的组成
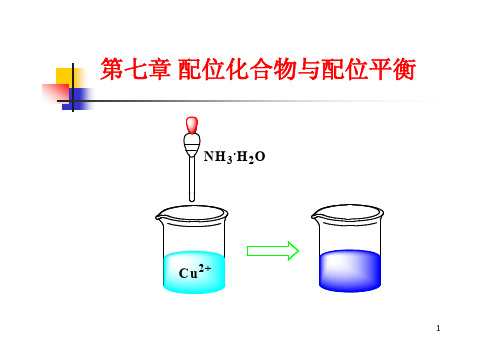
实验例:CuSO4→加NaOH , 浅蓝色沉淀Cu(OH)2 →加氨 水 ,沉淀溶解,生产绛蓝色溶液
习惯名称
K4[Fe(CN)6]:黄血盐 Fe(C5H5)2: 二茂铁 K3[Fe(CN)6]: 红血盐 K[PtCl3(C2H4)]:蔡斯盐
系统名称
[Co(NH3)5H2O]Cl3 三氯化五氨·水合钴(Ⅲ)
Cu2[SiF6]
六氟合硅 (Ⅳ) 酸亚铜
7.1 配位化合物的组成和命名
2 配位化合物的命名
国家开放大学电大《无机及分析化学》学习重点及试题解答

.
应用化工技术专业
无机及分析化学期末复习指导
Word文档资料
《无机及分析化学》考核说明
第一部分课程考核的有关说明
一、考核对象
本课程考核对象为:大学开放教育应用化工技术专业(专科)课程开放试点的学生。
二、考核方式
本课程采用形成性考核和终结性考试相结合的方式。
三、考核依据
《无机及分析化学》。
四、课程总成绩的记分方法
由于无机及分析化学课程包括理论教学和实验教学两部分,所以形成性考核应视平时作业和实验的完成情况及学习情况给分,计占课程总成绩的30%。
1
终结性考试为对学生所学本课程知识的掌握程度而进行的考核,它占总成绩的70%。
课程总成绩按百分制记分,60分为及格。
即以上两个成绩累计60分以上(包括60分)为考核通过。
五、形成性考核要求及形式
形成性考核采取平时作业和实验的完成情况及学习情况给分。
作业由中央电大统一布置、下发专门设计的综合性作业,办学单位教师批改、判分,中央电大抽查、监督。
六、终结性考试要求及形式
1.考试要求本课程的考试重点是无机及分析化学的基础理论、基本知识、重要化合物的性质、化学分析的基本方法。
考试要求分三个层次:掌握、理解(或熟悉)、了解。
2.组卷原则在教学大纲和考核说明所规定的要求和内容范围之内命题,根据本课程的教学要求,在终结性考试中,掌握的内容约占总分的60~70%,理解(或熟悉)的内容约占总分的20~30%,了解的内容约占总分的10%;
2。
无机及分析化学第7章-配位化合物和配位滴定法

HIn2-
In3-
pH=7~11 pH>12
紫红色
蓝色
橙色
第二节 配位滴定法
二、金属指示剂
(2)钙指示剂(又称NN指示剂或称钙红)。
在溶液中钙指示剂有如下平衡:
H2In-
HIn2-
In3-
pH<8.0 酒红色
pH=8~13.0 pH>13.0
蓝色
浅粉红色
第二节 配位滴定法
三、配位滴定法的应用
1.EDTA 标准溶液的配制和标定 常用EDTA二钠盐配制标准溶液,浓度一般为
0.01~0.05 mol/L 。常用的EDTA标准溶液一般用Na2H2Y·2H2O 配制, 其摩尔质量为372.26g/mol。
用于标定EDTA的基准物质很多,实验室中多采用金属 锌 (或氧化锌)为基准物质。
标定可选用铬黑T在pH=10的NH4Cl-NH3•H2O缓冲溶 液中进行,终点由紫红色变为纯蓝色。由于EDTA通常与各 种价态的金属离子以1:1配位,所以,不论是标定还是测定, 结果的计算都比较简单。
一 四羰氯基·合一镍硝基·二草酸根合铁(III)酸钾
三羟基·一水·一乙二胺合铬(III)
第二节 配位滴定法
一、概ห้องสมุดไป่ตู้述
1.配位滴定法及配位滴定对化学反应的要求 配位滴定法是以配位反应为基础的滴定分析方法。
用于
配位滴定的反应除应能满足一般滴定分析对反应的要 求外,还
必须具备以下条件: (1)生成的配位化合物要相当稳定,以保证反应进行
内界中有两种及以上的配体时,不同配体的命名 顺序规则 为: (1)先阴离子后中性分子,先无机物质后有机物质。 (2)同类配体的命名,按配位原子元素符合的英文字 母顺序排列。 (3)同类配体中若配位原子相同,则含原子数少的配 体排在前面。
第七章 配位化合物与配位平衡
12
[Ag(NH3)2]Cl [Co(NH3)5(H2O)]Cl3 K2[HgI4] Na3[Ag(S2O3)2] H2[SiF6] H2[PtCl6] [Fe(CO)5] [Pt(NH3)2Cl2] [Co(NH3)3(NO2)3]
氯化二氨合银(Ⅰ) 三氯化五氨·水合钴(Ⅲ) 四碘合汞(Ⅱ)酸钾 二(硫代硫酸根)合银(Ⅰ) 酸钠
30
解:解题关键求出c(Cu2+)、c(OH-) ①求c(Cu2+): Cu2+ + 4NH3 ⇌ [Cu(NH3)4]2+
c(Cu 2+ ) c 4 (NH3 ) 0.01 12 4.8 10 2 4 c(Cu ) (0.1) K
θ f
c[Cu NH3 4 ]
2+
c(Cu2+)= 2.1×10-11 mol·L-1
36
3) 螯合比
中心离子与螯合剂分子(或离子)数目之比 [Cu(en)2]2+ 1:2 [Co(NH2CH2COO)3] 1:3
37
2. 螯合物的稳定性 1) 螯合效应 由于形成螯环使螯合物具有特殊稳定性的作用. 如:Kfθ[Cu(NH3)4]2+=4.8×1012, Kfθ[Cu(en)2]2+=4.0 ×1019
四元酸
六元酸
EDTA的物理性质
:水中溶解度小,难溶于酸和有机溶剂;易溶于 NaOH或NH3溶液— Na2H2Y·2H2O.
d
2+ 4
M+L⇋ML ML+L⇋ML2 MLn-1+L⇋MLn
c(ML) K c(M)c(L) c(ML 2 ) K2 c(ML)c(L) c(ML n ) Kn c(ML n-1 )c(L)
基础化学:配位平衡及配位滴定

配位效应与配位效应系数M(L)
[ M ] [ M ] [ ML] [ ML2 ] [ MLn ] M ( L) [M ] [M ] 1 K1[ L] K1 K 2 [ L]2 K1K 2 K n [ L]n 1 1 [ L ] 2 [ L ]2 n [ L ] n
AgI(s) + 2CN–
[Ag(CN)2]– + I–
c([Ag(CN) ] ) c(I ) c(Ag ) θ 2 K 2 c(Ag ) [c(CN )]
θ β θ ([Ag(CN) ] ) K 2 2 sp (AgI)
1.3 10 21 1.5 10 16 1.95 10 5
Cu2+ + 2NH3 Cu2+ + 3NH3
β K K
θ θ θ βθ K K K 3 1 2 3
例如: [Ag(NH3)2]+
列出K1 ,K 2 , 1 , 2
2. 配位解离平衡的移动
1.配位解离平衡和酸碱平衡
例: [Fe(C2O4)3]3- 中加入盐酸, 由于生成 弱电解质H2C2O4, 破坏了[Fe(C2O4)3]3-的平 衡.
c([Ag(NH ) ] ) c(Cl ) 0.10 0.10 θ 3 3 2 K 2.53 10 [c(NH 3 )] 2 x2
解得平衡时c(NH3) = x = 1.99 mol· dm-3
故所需氨水的最小浓度应为 1.99 + 0.20 = 2.19 mol· dm-3
pH愈大, aY(H)愈小,故用EDTA测 Ca2+、Mg2+要保持碱性的原因。
第七章 配位化合物与配位平衡

3d
28Ni 2+
4s
4p
NiCl42大连工业大学 基础化学 22/116
[Co(NCS)4]2-、[CoCl4]2-
大连工业大学
基础化学
23/116
dsp2 [Ni(CN)4]2-、[PtCl4]2-,键角90°,平面正方形 测磁矩μ=0 ,无单电子。
3d
28Ni 2+
4s
4p
3d Ni(CN)42大连工业大学 基础化学
HOOCH2C N HOOCH2C
大连工业大学 基础化学
CH2COOH CH2 CH2 N CH2COOH
7/116
表7.1 常见的配体和配位原子
配体种类 含氮配体 单 齿 配 体 含氧配体 含碳配体 含卤素配体 含硫配体
H2N CH2
实 NH3,RNH2
例
配位原子 N O C F,Cl,Br,I S
5.0 n(n 2)
大连工业大学 基础化学
2+ ,外轨型配合物。
[Fe(CN)6]4-,
0 n(n 2)
大连工业大学
n =0
基础化学
34/116
4Fe(CN)6
Fe2+ 稳定性:
d2sp3杂化,内轨型配合物
内轨型
[Fe(CN)6]4- > [Fe(H2O)6]2+ [Co(NH3)6]3+ > [Co(NH3)6]2+ [CoY]- > [CoF6]3[Ni(CN)4]2- > [Ni(NH3)4]2+
大连工业大学 基础化学 18/116
一氯· 二羟基· 三氨合钴(Ⅲ) [CoCl(OH)2(NH3)3] 四氯合铂(Ⅱ)酸四氨合铜( Ⅱ) [Cu(NH3)4][PtCl4] 一氯· 一硝基 · 四氨合铂(Ⅳ)配离子 [PtCl(NO2)(NH3)4]2+ 六氟合硅( Ⅳ)酸铜 Cu[SiF6] [Fe(CO)5] 五羰基合铁 无化合价
配位化合物和配位平衡PPT课件

H3N
Cl
Pt
H3N
Cl
顺式
H3N
Cl
Pt
Cl
NH3
反式
由于空间位 置不同产生的异 构体称为几何异 构体
手性分子也 属于几何异构体
10.2 配合物的化学键理论
研究中心离子与配体键合及键合力的本质
10.2.1 配合物的配位键理论 主要是Pauling的杂化轨道理论——价键理论
配位键理论的要点: 1. 中心离子(原子)Mn+必须具有空轨道,以接受配体
配位体
NH3
配位原子
N
CN–
CO
NH3、Cl–
C
C
N、Cl
配位数
6
6
5
4
10.1.2 配合物的类型 1.简单配合物:单齿配位体
C2H4 Cl
Cl
2.螯合物:多齿配位体
Pd Pd
3.特殊配合物:多核配合物,如:Cl
Cl C2H4
*分子氮配合物,如:[Rn(NH3)5CN)4]4-、Fe(CO)5等
(3)中心离子半径越大,配位数越大:空间允许 如:[AlF6]3-与[BF4]-
但中心离子半径太大时,配位数会降低:与配体结合力小
(4)配体半径太大时,配位数会减小。如: [AlF6]3-与[AlCl4]-
(5)在形成配合物时,增大配体浓度,或降低反应 温度,有利于形成高配位数配合物
配离子的电荷——配离子的电荷是配位体离子与中 心离 子电荷的代数和
π键配位体:没有配位原子,π键电子与中心离子配合 如苯及其衍生物等———不定域电子
配位数——直接与中心原子相连的配位原子个数,不一
定等于配位体的数目
配位数是中心离子的重要特征:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
K3[Fe(CN)6]: 红血盐 K[PtCl3(C2H4)]:蔡斯盐
系统名称
[Co(NH3)5H2O]Cl3
Cu2[SiF6]
三氯化五氨· 水合钴(Ⅲ)
六氟合硅 (Ⅳ) 酸亚铜
7.1 配位化合物的组成和命名
2 配位化合物的命名 在配合物中 先阴离子,后阳离子,阴阳离子之间加‘ 化’ 字或‘ 酸’ 字, 配阴离子看成是酸根。 在配位单元中 1. 先配体后中心,配体与中心之间加‘ 合’ 字 。 2. 配体前面用 二、三、四 … 表示该配体个数 。 3. 几种不同的配体之间加 ‘ · ’ 隔开。 4. 中心后面加( ),内写罗马数字表示中心的价态 。
发生配离子的转化
1 c(Cu ) 1.38 1012
2+
0.0592 1 lg 2 c(Cu 2 )
0.022 V
7.2 配离子在溶液中的解离平衡
3 配位平衡间的转化
例5 在含有NH3和CN-的溶液中加入Ag+,可能会形成[Ag(NH3)2]+和 [Ag(CN)2]-。试问哪种配离子先形成? 若在[Ag(NH3)2]+溶液中加入 KCN,问能否发生配离子的转化?
7.2 配离子在溶液中的解离平衡
1 配位解离平衡常数
Cu2++ 4NH3 [Cu(NH3)4]2+ 稳定常数
Kf
[Cu(NH3)4]2+
Cu2+
+ 4NH3
1 不稳定常数 K d Kf
Kf1
Cu2+ + NH3 = [Cu(NH3)]2+
[Cu(NH3)]2+ + NH3 =[ Cu(NH3)2]2+ [Cu(NH3)2]2+ + NH3 = [Cu(NH3)3]2+ [Cu(NH3)3]2+ + NH3 = [Cu(NH3)4]2+
3. 同类配体中,按配位原子的元素符号在英文字母表中的次序分
[Co (NH3)5 H2O ] Cl3 三氯化五氨 · 水合钴(Ⅲ)
7.1 配位化合物的组成和命名
2 配位化合物的命名 4. 配位原子相同,配体中原子个数少的在前 。
[ Pt(Py)( NH3)(NO2)(NH2OH)] Cl
氯化硝基 · 氨· 羟氨 · 吡啶合钴 (Ⅱ) 5. 配体中原子个数相同,则按和配位原子直接相连的配体中的其它
原子的元素符号的英文字母表次序。
7.1 配位化合物的组成和命名
2 配位化合物的命名
例1
[Cu(NH3)4]SO4 K3[Fe(CNS)6] H2[PtCl6] [Cu(NH3)4](OH)2 K[PtCl5(NH3)] 硫酸四氨合铜(Ⅱ) 六异硫氰根合铁(Ⅲ)酸钾 六氯合铂(Ⅳ)酸 氢氧化四氨合铜(Ⅱ)
Kf2 Kf3 Kf4
逐级稳定常数
K f1 K f2 K f3 K f4 K f 4
2+ [Cu(NH 3 )4 ] [Cu 2+ ][NH 3 ]4
例2 在1.0 mL 0.040 mol· L-1 AgNO3溶液中,加入1.0 mL 2.0 mol· L-1氨水溶液,计算在平衡后溶液中Ag+的浓度。(已知Kf =1.12×107) 解: 溶液体积加倍 初始浓度/mol· L-1 平衡浓度/mol· L-1 Ag+ + 2NH3 = [Ag(NH3)2]+ 0.020 x
7.1 配位化合物的组成和命名
2 配位化合物的命名 配体的先后顺序 下述的每条规定均在其前一条的基础上 1. 先无机配体后有机配体 PtCl2( Ph3P)2 二氯 · 二 (三苯基膦)合铂(Ⅱ) 2. 先阴离子类配体,后阳离子类配体,最后分子类配体 。
K[PtCl3(NH3)]
出先后。
三氯 · 氨合铂(Ⅱ) 酸钾
第七章 配位化合物与配位解离平衡
教学目的和要求 教学重点和难点
第七章 配位化合物与配位解离平衡
● 了解配位化合物的定义、组成、分类,掌握配位化 合物的命名。
●
掌握配位化合物的解离平衡常数,掌握配位平衡的移
动及其应用。
教学重点和难点 教学重点和难点
第七章 配位化合物与配位解离平衡
◆重点内容:配位化合物的组成与命名,配位化合物的 解离平衡常数,配位平衡的移动。
配位平衡和沉淀平衡
Ag +2NH3 [Ag(NH3 )2 ]
+
+
Br - AgBr
例3 向0.10 molL-1 [Ag(CN)2]- 溶液(含有0.10 molL-1的CN-)中加入 KI固体,假设I- 的最初浓度为0.10 molL-1,是否有AgI沉淀生成? (已知 [Ag(CN)2]- 的 K = 1.3×1021,AgI的 K = 8.3×10-17)
sp
sp
,故没有AgI沉淀生成。
7.2 配离子在溶液中的解离平衡
2 配位解离平衡的移动
配位平衡和氧化还原平衡
例4 已知 Cu 2+ + 2e-→Cu, =0.337 V,[Cu(NH3)4]2+
的 K =1.38×1012,求[Cu(NH3)4]2+ /Cu的 。 f
解:
[Cu(NH3 )4 ]2+ +2e- ═Cu+4NH3
◆难点内容:配位化合物的解离平衡常数,配位平衡移
动的计算。
主要章节
7.1 9.1配位化合物的组成和命名 核外电子的运动状态
7.2 配离子在溶液中的解离平衡
7.1 配位化合物的组成和命名
1 配位化合物的组成 实验例:CuSO4→加NaOH , 浅蓝色沉淀Cu(OH)2 →加氨 水 ,沉淀溶解,生产绛蓝色溶液 加BaCl2,白色沉淀
XOHH2O CO
卤素 羟基 水 羰基
NH3 NO2ONO-
氨 硝基
CNSCN-
氰根 硫氰根 异硫氰根
亚硝酸根 NCS-
Py(N) 吡啶
多齿配体: 一个配体中只含两个或两个以上配位原子。 乙二胺四乙酸二钠 (EDTA) 乙二胺(en) 乙二酸(C2O42-)
7.1 配位化合物的组成和命名
1 配位化合物的组成
[Cu(NH3)4]SO4 K3[Fe(NCS)6]
[Fe(CO)5]
7.1 配位化合物的组成和命名
1 配位化合物的组成
中心离子(或原子)
一般为带正电的过渡金属离子
[Co(NH3)6]3+, [Fe(CN)6]4-, [HgI4]2 电中性原子:Ni(CO)4 , Fe(CO)5 , Cr(CO)6 非金属元素原子:SiF62- , PF6-
7.1 配位化合物的组成和命名
1 配位化合物的组成
配离子电荷 配离子电荷等于中心离子和配体两者电荷的代数和。 [Fe(CN)6]3-(赤血盐)
(+3) (+2)
[Fe(CN)6]4-(黄血盐)
[Fe(CO)5]
?配合物内界是否一定带电
7.1 配位化合物的组成和命名
2 配位化合物的命名
习惯名称
将各项平衡浓度代入稳定常数表达式:
Kf c [Ag(CN)2 ]
c AHale Waihona Puke c 2 CN
0.10 21 1.3 10 x 0.102
x = c(Ag+) = 7.7 × 10-21 (molL-1) 加入KI固体后,c (I- ) = 0.10 molL-1 离子积 Q = c(Ag+)c (I- ) = 7.7×10-21 × 0.10 = 7.7×10-22 由于K = 8.3×10-17,Q <K
1.0 mol· L-1 1.0 mol· L-1
Cu 2+ + 2e- = Cu 0.0592 1 lg 2 c (Cu 2+ )
例4:
Cu2+ +4NH3 ═[Cu(NH3 )4 ]2+
c([Cu(NH3 )4 ]2+ ) 12 Kf 1.38 10 c(Cu2+ ) c 4 (NH3 )
五氯• 一氨合铂(Ⅳ)酸钾
7.1 配位化合物的组成和命名
3 配位化合物的类型 简单配合物 单齿配体:一个配位原子 (NH3, H2O, CN-) 螯合物 多齿配体:两个(含)以上配 位原子(en,EDTA)
NH2 Cu2+ + 2 CH2NH2 CH2NH2 H2C H2C NH2 H2N Cu
1.0
1.0-2(0.020-x) 0.020 - x
c([Ag(NH3 )2 ]+ ) 0.020 x 7 Kf 1.12 10 c(Ag + ) c 2 (NH3 ) x [1 2(0.020 x )]2
0.020 x 0.020
x= 1.9×10 -9 molL-1
配体(配位原子)
配体:含孤对电子
阴离子:X-, OH-, SCN中性分子:CO, H2O, NH3
配位原子:配体中与中心原子直接相连的原子。 H,C,N,P,As,Sb,O,S,Se,Te,F, Cl,Br,I
7.1 配位化合物的组成和命名
1 配位化合物的组成 单齿配体: 一个配体中只含一个配位原子。
解:
由附录可查得:
+ = 107.21 [Ag(NH ) ] Kf 3 2 - = 1021.1 [Ag(CN) ] 先形成 Kf 2
[Ag(NH3)2]+ + 2CN- → [Ag(CN)2]- + 2NH3
