HepG2细胞培养方法
高糖高脂诱导胰岛素抵抗HepG2细胞模型的建立及活性成分的功能评价

高糖高脂诱导胰岛素抵抗HepG2细胞模型的建立及活性成分的功能评价一、本文概述随着现代生活节奏的加快和饮食结构的改变,高糖高脂饮食已成为导致胰岛素抵抗(IR)等代谢性疾病的重要因素。
胰岛素抵抗是指胰岛素在靶组织(如肝脏、肌肉和脂肪组织)中的生物学作用受损,导致血糖调节失衡,是2型糖尿病和心血管疾病的主要发病机制之一。
研究高糖高脂诱导的胰岛素抵抗机制及防治策略具有重要意义。
本研究旨在通过建立高糖高脂诱导的HepG2细胞胰岛素抵抗模型,模拟人体内的代谢环境,为深入研究胰岛素抵抗的分子机制提供实验基础。
同时,通过对活性成分的功能评价,筛选出具有改善胰岛素抵抗潜力的天然产物或药物,为开发新型抗糖尿病药物提供候选物质。
本文首先介绍高糖高脂饮食对胰岛素抵抗的影响及其机制,阐述建立胰岛素抵抗细胞模型的重要性和必要性。
接着,详细描述高糖高脂诱导HepG2细胞胰岛素抵抗模型的建立过程,包括细胞培养、高糖高脂处理、胰岛素抵抗指标检测等。
在此基础上,对活性成分进行筛选和功能评价,探讨其作用机制。
总结本文的主要研究内容和成果,展望未来的研究方向和应用前景。
通过本研究,不仅有助于深入了解高糖高脂诱导胰岛素抵抗的分子机制,还可为开发新型抗糖尿病药物提供理论支持和实验依据,对预防和治疗代谢性疾病具有重要意义。
二、材料与方法高糖DMEM培养基、胎牛血清(FBS)、胰蛋白酶、青霉素-链霉素双抗溶液、MTT、DMSO等购自Gibco公司;棕榈酸、油酸购自Sigma 公司;胰岛素、葡萄糖测定试剂盒购自南京建成生物工程研究所;其他常用化学试剂均为国产分析纯。
CO2培养箱(Thermo Fisher Scientific)、倒置显微镜(Olympus)、酶标仪(Bio-Rad)、低速离心机(Eppendorf)、超净工作台(苏州净化设备公司)等。
HepG2细胞用含10% FBS、1%青霉素-链霉素双抗溶液的高糖DMEM 培养基,在37℃、5% CO2的饱和湿度培养箱中培养。
一种hepg2细胞高脂模型的构建方法及应用

一种hepg2细胞高脂模型的构建方法及应用
HepG2细胞是一类在骨髓内表达高脂酸受体(HEPG2)的胚胎干细胞,可以在许多疾病中发挥重要作用。
构建HEPG2细胞高脂模型可以帮助深入研究HEPG2细胞的功能、调节机制以及在疾病中的作用。
一种构建HEPG2细胞高脂模型的方法包括以下几个步骤:
1. 细胞筛选:从HEPG2细胞系中筛选表达HEPG2和高密度脂蛋白(HDL)-C的细胞。
可以采用高通量筛选方法,如电泳和细胞计数法。
2. HEPG2的表达及高密度脂蛋白(HDL)-C的测定:通过PCR和流式细胞术等方法检测HEPG2的表达水平和高密度脂蛋白(HDL)-C的含量。
3. 高脂模型的构建:将HEPG2表达细胞和高密度脂蛋白(HDL)-C 含量较高的细胞系进行混合,通过调质技术制备高脂模型。
4. 高脂模型的培养:将制备好的高脂模型进行培养,可以培养在含有HEPG2受体和高密度脂蛋白(HDL)-C的培养基上进行培养。
5. HEPG2细胞高脂模型的分离:将培养好的高脂模型进行分离,得到HEPG2表达且高密度脂蛋白(HDL)-C含量较高的细胞。
应用:HEPG2细胞高脂模型可以在医学研究、疾病治疗方法等领域发挥重要作用。
例如,它可以作为一种新型的药物载体,通过调节HEPG2细胞的表达水平和高密度脂蛋白(HDL)-C含量,来治疗某些疾病。
还可以用于体内移植和细胞治疗等。
HepG2细胞介绍及生长培养方法

HepG2细胞介绍及生长培养方法简介:HepG2细胞,来源于一个15岁白人的肝癌组织。
该细胞分泌多种血浆蛋白:清蛋白、α2-巨球蛋白、血纤维蛋白溶酶原、铁传递蛋白等。
该细胞能大容量培养,乙肝表面抗原阴性,对G418有抗性,对人生长激素有刺激反应。
来源:人肝癌细胞。
形态:上皮细胞。
生长特性:贴壁。
HepG2细胞特点:1、HepG2细胞分泌多种血浆蛋白:清蛋白、α2-巨球蛋白、血纤维蛋白溶酶原、铁传递蛋白等。
该细胞能大容量培养,乙肝表面抗原阴性,对G418有抗性,对人生长激素有刺激反应。
2、该细胞表达3-羟基-3-甲基戊二酸辅酶A还原酶和肝甘油三酸脂脂肪酶。
该细胞在有百草枯(英文名:gramoxone)的环境下过氧化氢酶mRNA表达增加,ApoA-I mRNA 表达减少。
培养液:MEM(含 2 mM L-谷氨酰胺和Earle's BSS,1.5 g/L NaHCO3, 0.1 mM 非必需氨基酸, 1.0 mM 丙酮酸钠)+ 10%胎牛血清。
传代:吸去培养液。
用0.25% (w/v) Trypsin- 0.53 mM EDTA洗一次,以去除血清(血清会抑制胰酶的活性)。
加2-3毫升Trypsin(胰蛋白酶)-EDTA,放在37℃培养箱内约5分钟,直到细胞全部脱落。
加6-8毫升培养液,用移液器把细胞吹散。
加适量的细胞到新的培养器皿中。
(以1:4至1:6为宜,传代期间培养液每周更换2次)冻存:95%培养液+5%DMSO冻存于液氮。
注释:apoA-I是高密度脂蛋白(HDL)的主要成分,是一种对机体有益的胆固醇,是细胞胆固醇逆向转运的特殊重要因素,可将细胞内的胆固醇和脂质转运到肝脏进行代谢,最终排出体外。
apoA-I还具有抗炎和抗氧化的特性。
因为脂质转运、炎症和氧化应激均与癌症的发生和发展有关。
Farias-Eisner和Reddy猜测卵巢癌患者体内apoA-I水平减少有可能是疾病恶化的主要原因。
进而研究人员证实当被诱导卵巢癌时,表达多拷贝人类apoA-I基因的基因工程小鼠癌症发生的几率非常低,而对照组小鼠则患病比率大大增高。
HepG2培养protocol

HepG2细胞培养培养液配方:DMEM高糖培养基+10%FBS(胎牛血清)+1%双抗(青霉素+链霉素混合)(其中百分比均为某物质在培养液中的终浓度)HepG2细胞传代培养(生物安全柜中操作):1:将长满细胞的培养瓶(皿)中的原培养液吸去2:加入适量生理盐水(工作体积10ml培养瓶加入5ml,工作体积5ml培养瓶加入3ml),轻轻摇匀后吸去3:加入适量胰酶(10ml培养瓶加入3ml,5ml培养瓶加入1ml),轻轻混匀后,计时3分钟后用手用力拍打培养瓶壁(可以看到细胞被消化后拍打后脱落的白色絮状物)4:加入适量新鲜培养基后,吸打混匀(将培养基吸取到移液管中再打到培养瓶壁上,对培养瓶壁上残留的细胞吹下,吸打要反复几次直到混匀)。
将混匀后的的培养液全部吸入到10ml离心管中。
5: 300g离心3分钟后,吸出上清后舍弃6:加入适量生理盐水(10ml培养瓶加入5ml,5ml培养瓶加入3ml),将细胞沉淀反复吹打成细胞悬液。
(吹打时要轻并避免产生气泡,细胞沉淀要完全吹散)。
7: 300g离心3分钟后将上清舍弃8:加入适量新鲜培养基(10ml培养瓶加入6ml,工作体积5ml培养瓶加入3ml),反复吹打将沉淀变为细胞悬液(吹打时要轻并避免产生气泡,细胞沉淀要完全吹散)。
9:取出1/5-1/3体积细胞悬液至新培养瓶中,加入适量新鲜培养基补齐培养瓶工作体积。
吸打混匀。
其余的细胞悬液可以冻存起来,步骤见下方。
10:放入CO2 培养箱中进行培养。
一般3天即可长满培养瓶。
冻存细胞:1:将上述9中的剩余细胞悬液吸入15ml离心管,300g离心3分钟后,将上清去除2:加入适量血清(FBS)将细胞重悬后吸入冻存管中,再加入适量DMSO(使FBS终浓度为90%,DMSO终浓度10%)混匀。
3:慢冻:将冻存管放入4度冰箱1h后-20度冰箱1h,-80度过夜后即可放入液氮罐中长期保存。
注意事项:1:为了保证无污染,所有操作均需在生物安全柜中进行,工作前将安全柜打开紫外照射2:所有东西拿进(包括手)安全柜时都要喷酒精。
RPMI-1640培养基和DMEM培养基中HepG-2细胞生长状况

RPMI-1640培养基和DMEM培养基中HepG-2细胞生长状况作者:张迪等来源:《现代养生·下半月版》 2017年第12期【摘要】目的:比较含12% 新生牛血清的RPMI-1640 培养基与含12% 新生牛血清的DMEM 培养基培养HepG-2 细胞的效果。
方法:采用含12% 新生牛血清的RPMI-1640 培养基与含12% 新生牛血清的DMEM 培养基培养HepG-2 细胞, 观察细胞的生长状态,细胞的贴壁情况,并进行细胞计数。
结果:含12% 新生牛血清的RPMI-1640 培养基中的细胞生长状态更好,细胞的存活率更高。
结论:在对HepG-2 细胞进行细胞培养时建议首选含12% 新生牛血清的RPMI-1640。
【关键词】DMEM;HepG-2;RPMI-1640当前大部分学者在对贴壁细胞进行细胞培养时通常选用PRMI-1640 培养液或DMEM 培养液,故在对HeoG-2 细胞进行细胞培养时也可应用PRMI-1640 培养液或DMEM 培养液。
但已有研究发现[1]:由于PRMI-1640 培养基和DMEM 培养基中各成分不同,尤其是氨基酸,维生素和葡萄糖的含量差别很大,因此对细胞的生长速度和生长状态产生一定影响。
在体外细胞培养的过程中,细胞生长状态的好坏和细胞生长速度的快慢等方面与细胞培养基的选择有着密不可分的联系。
已有研究表明:在细胞培养基的制备过程中,需要在培养基中添加一定含量的生物性液体或组织提取液才能支持细胞的正常生长,由于血清中含有天然促生长因子,可以促进细胞贴壁,因此成为被广泛采用的培养基添加物,最常用的为新生牛血清[2]。
赵翔[3] 等人在研究PRMI-1640 和DMEM 培养基中对Hep G2 的影响时并没有充分考虑到血清浓度对于HepG-2 细胞的影响,选用的为浓度为10% 新生牛血清并且没有加入一定量的双抗。
但已有研究表明由于人肝癌细胞株生长缓慢,恶性程度较高,因此对于血清的要求比较严格,其培养时所需要新生牛血清的浓度要比一般的肿瘤细胞高一些。
《2024年热疗对人肝癌细胞株Hep-G2细胞凋亡的实验研究》范文

《热疗对人肝癌细胞株Hep-G2细胞凋亡的实验研究》篇一一、引言随着现代医学的快速发展,癌症的治疗手段日趋多样化,其中热疗作为一种非侵入性的治疗方法,已经得到了广泛的应用和深入研究。
热疗通过对肿瘤细胞进行选择性热处理,从而引发细胞凋亡或坏死,以达到治疗肿瘤的目的。
本文以人肝癌细胞株Hep-G2为研究对象,通过实验研究热疗对其细胞凋亡的影响,以期为临床治疗提供理论依据。
二、材料与方法1. 材料人肝癌细胞株Hep-G2细胞、热疗设备、细胞培养基、MTT 试剂、流式细胞仪等。
2. 方法(1)细胞培养:将Hep-G2细胞在适宜的培养条件下进行培养,并观察其生长情况。
(2)热疗处理:将Hep-G2细胞分为对照组和实验组,实验组进行不同温度和时间的热疗处理。
(3)细胞凋亡检测:采用MTT法检测细胞活性,流式细胞仪检测细胞凋亡情况。
(4)数据统计与分析:对实验数据进行统计分析,比较各组细胞凋亡率的差异。
三、实验结果1. 细胞活性检测结果通过MTT法检测细胞活性,结果显示,随着热疗温度和时间的增加,Hep-G2细胞的活性逐渐降低。
实验组细胞的活性明显低于对照组,表明热疗对Hep-G2细胞的生长具有抑制作用。
2. 细胞凋亡检测结果流式细胞仪检测结果显示,热疗处理后,Hep-G2细胞的凋亡率明显增加。
随着热疗温度和时间的增加,细胞凋亡率呈上升趋势。
实验组细胞的凋亡率显著高于对照组,表明热疗能够诱导Hep-G2细胞发生凋亡。
四、讨论本实验以人肝癌细胞株Hep-G2为研究对象,通过实验研究热疗对其细胞凋亡的影响。
实验结果显示,热疗能够抑制Hep-G2细胞的生长,并诱导其发生凋亡。
这可能与热疗对细胞内相关基因和蛋白的影响有关,从而引发细胞的凋亡机制。
此外,热疗的温度和时间对细胞凋亡的影响也具有重要作用。
适当的热疗温度和时间能够最大限度地发挥热疗的效果,提高肿瘤治疗的疗效。
然而,本实验仍存在一定局限性。
首先,实验仅在体外环境下进行,未能充分考虑体内环境的复杂性。
Hoechst33258 荧光染色法
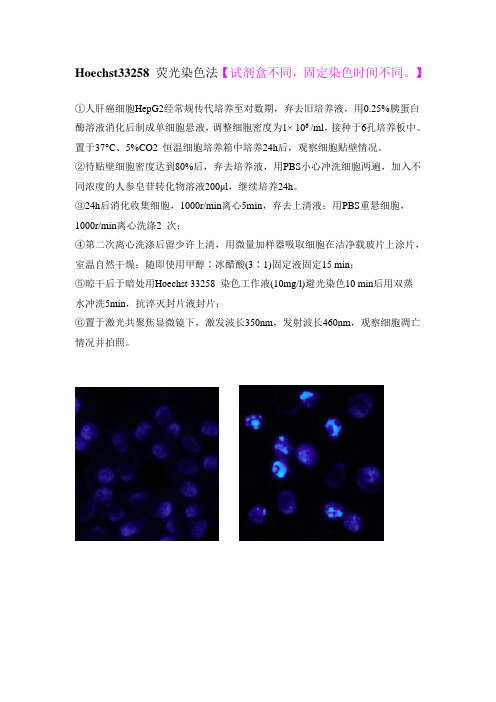
Hoechst33258 荧光染色法【试剂盒不同,固定染色时间不同。
】
①人肝癌细胞HepG2经常规传代培养至对数期,弃去旧培养液,用0.25%胰蛋白酶溶液消化后制成单细胞悬液,调整细胞密度为1× 106 /ml,接种于6孔培养板中。
置于37°C、5%CO2 恒温细胞培养箱中培养24h后,观察细胞贴壁情况。
②待贴壁细胞密度达到80%后,弃去培养液,用PBS小心冲洗细胞两遍,加入不同浓度的人参皂苷转化物溶液200μl,继续培养24h。
③24h后消化收集细胞,1000r/min离心5min,弃去上清液;用PBS重悬细胞,1000r/min离心洗涤2 次;
④第二次离心洗涤后留少许上清,用微量加样器吸取细胞在洁净载玻片上涂片,室温自然干燥;随即使用甲醇∶冰醋酸(3∶1)固定液固定15 min;
⑤晾干后于暗处用Hoechst 33258 染色工作液(10mg/l)避光染色10 min后用双蒸
水冲洗5min,抗淬灭封片液封片;
⑥置于激光共聚焦显微镜下,激发波长350nm,发射波长460nm,观察细胞凋亡情况并拍照。
①人肝癌细胞HepG2经常规传代培养至对数期,弃去旧培养液,用0.25%胰蛋白酶溶液消化后制成单细胞悬液,调整细胞密度为5×105/ml,接种于6孔培养板中。
置于37℃、5%CO2 恒温细胞培养箱中培养24h后,观察细胞贴壁情况。
②待贴壁细胞密度达到80%后,弃去培养液,用PBS小心冲洗细胞两遍,一孔加入含10%胎牛血清的完全培养液,其余各孔分别加入高、中、低3个浓度的人参皂苷转化物溶液与顺铂溶液200μl,继续培养48h。
③倒置显微镜下观察各组细胞生长情况和形态变化。
油酸诱导HepG2细胞脂肪变性模型的建立

Journal of Mathematical Medicine Vol.28No.12015The volume of right hippocampus,parahippocampal gyrus,amygdala,precuneus,inferior frontal gyrus,and bilateralmiddle frontal gyrus,putamen,etc.in the MCI patient group is significantly smaller than that in control group.The volume of right hippocampus ,thalamus,Cuneus,etc.in the AD patient group is significantly smaller than that in MCI patient group.Changes of white matter:The volume of bilateral extra-nuclear,sub-gyral,corpus callosum,ante-rior cingulate cortex,and right parahippocampal gyrus,etc.is smaller in the AD patient group is significantly small-er than that in the control group.The volume of right parahippocampal gyrus,thalamus,Extra -Nuclear,and left fusiform,etc.in the MCI patient group is significantly smaller than that in control group.The volume of bilateral sub-gyral,right anterior cingulated,left postcentral etc.in the AD patient group is significantly smaller than that in MCI patient group.Conclusions:VBM can reveal widespread volumetric reduction of gray matter and white matter in AD and MCI with the advantage of objectivity.It is helpful in the early diagnosis of AD and is helpful to monitor the convertion from MCI to probable AD.Key words DARTEL;alzheimer ’s disease;mild cognitive impairment;magnetic resonance imaging;gray matter;white matter;voxel-based morphometry经国内外学者数十年的努力,使非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD )模型研究有了很大的进展,可分为动物模型和体外细胞模型,动物模型包括影响肝脏能量代谢的基因敲除或突变模型与营养、药物或毒物导致的肝内脂肪酸摄入和输出不平衡诱发的脂肪肝模型[1],体外细胞模型通常是利用肝细胞给予饱和或不饱和脂肪酸刺激,复制脂滴在肝细胞的生成,高度模拟了人NAFLD 的特征性表现。
一种hepg2细胞高脂模型的构建方法及应用

一种hepg2细胞高脂模型的构建方法及应用
HepG2细胞高脂模型是一种用于研究HepG2细胞代谢途径的模型,构建方法包括:
1. 采集HepG2细胞,将细胞置于含有4%脂肪的培养基中,培养24小时。
2. 取出培养基,离心处理细胞,收集细胞悬液。
3. 将细胞悬液加入含有10%葡萄糖的培养基中,培养24小时。
4. 取出培养基,离心处理细胞,收集细胞悬液。
5. 将细胞悬液加入含有100ng/mLα-淀粉酶的培养基中,培养
24小时。
6. 取出培养基,离心处理细胞,收集细胞悬液。
7. 将细胞悬液加入含有20ul乳清提取物的培养基中,培养24小时。
8. 取出培养基,离心处理细胞,收集细胞悬液。
9. 将细胞悬液加入含有10ul/mLDNA片段的培养基中,培养24小时。
10. 取出培养基,离心处理细胞,收集细胞悬液。
11. 将细胞悬液接种到3T3细胞培养平台上,培养24小时。
12. 取出细胞培养板,轻轻摇晃培养板,将细胞分离到培养基中。
13. 将细胞培养箱的温度设定在37°C左右,培养细胞24小时。
14. 收集细胞培养物,进行PCR检测,确定细胞高脂模型的构建
成功。
该高脂模型的构建方法可以用于研究HepG2细胞的脂肪酸代谢途径、脂肪储存和利用等方面的问题,有助于进一步深入了解HepG2细胞的生物学特性。
HepG2细胞培养的条件

1.复苏温度的选择:快速将所冻存细胞40℃水浴摇床60转/ min慢摇至其溶解,溶解后马
上转入37 ℃水浴箱,手工慢摇恒温2~3min复苏,复苏后800 转/ min 离心5min,吸去上清加入10ml 含15%胎牛血清DMEM 培养基,混匀后加入细胞培养板,每孔 1 ml,5%CO2温箱37℃培养.
2.复苏培养基的选择:用DMEM培养基培养的细胞结果在接种密度为1×104/cm2、血清含
量为15%时,经6h培养后细胞开始贴壁,12h后大部分细胞贴壁,且增值速度最快,4d 后可以按1:3的比例传代。
3.复苏的接种密度: 最佳接种密度为1×104/cm2.
4.消化酶以及消化时间的选择:先用pH7.2的PBS洗涤三遍后,再用0.25%的胰蛋白酶溶
液消化0.5分钟效果比较好.
5.培养基中血清浓度的选择:10%--20%.最好.15%就差不多.
6.双抗浓度的选择:双抗浓度为0.5%时传代效果较好,条件易于控制,且细胞能顺利生长.
7.培养基pH条件的选择: pH7.2, 4.5%CO2时传代效果较好,条件易于控制,且细胞能顺利
生长
8.细胞传代条件的选择:推荐在汇合度在95%-100%时进行.
细胞冻存:甘油和DMSO是两种常用的细胞保护剂.他们在细胞保存液中起到防止细胞内冰晶形成的目的.血清浓度经常可以增加到20%.
细胞复苏:冻存细胞应在流水中快速融化并加入生长培养液. 40℃快速融化.
关于冻存记录: 需要建立细胞生长史,名称,传代次数,冻存日期,复苏次数,生长培养液和在冻存器中的位置都是应记录的项目.。
小室培养实验报告

一、实验目的本研究旨在通过Transwell小室共培养技术,观察细胞间的相互作用及其对细胞迁移能力的影响,为进一步研究细胞间的信号传导和肿瘤转移机制提供实验依据。
二、实验材料1. 细胞:人肝癌细胞系HepG2、人正常肝细胞系L022. Transwell小室:Corning公司产品,孔径为8.0 μm3. 培养基:DMEM培养基,含10%胎牛血清,青霉素和链霉素各100 U/mL4. 其他试剂:胰蛋白酶、EDTA、无菌水、细胞计数板、酶标仪等三、实验方法1. 细胞培养:将HepG2和L02细胞分别接种于6孔板,置于37℃、5%CO2培养箱中培养,待细胞贴壁后进行实验。
2. Transwell小室共培养:将Transwell小室置于6孔板中,在上室中加入1 mL 含10%胎牛血清的DMEM培养基,下室中加入2 mL含10%胎牛血清的DMEM培养基。
将HepG2细胞接种于上室,L02细胞接种于下室,共培养24小时。
3. 细胞迁移实验:将Transwell小室取出,用棉签轻轻刮去上室中的细胞,用1 mL PBS洗涤3次,然后用4%多聚甲醛固定30分钟。
将固定后的Transwell小室放入显微镜下观察,计算上室中迁移至下室的细胞数量。
4. 数据分析:采用SPSS 20.0软件进行统计学分析,实验数据以均值±标准差表示,采用t检验进行组间比较。
四、实验结果1. HepG2细胞在Transwell小室共培养条件下,迁移至下室的细胞数量明显多于L02细胞,表明HepG2细胞具有较强的迁移能力。
2. 与单独培养的HepG2细胞相比,共培养后的HepG2细胞迁移至下室的细胞数量显著增加,表明L02细胞对HepG2细胞的迁移具有促进作用。
3. 共培养后的HepG2细胞中,与L02细胞直接接触的细胞数量明显多于未接触的细胞,表明细胞间的直接接触对HepG2细胞的迁移具有促进作用。
五、讨论本研究通过Transwell小室共培养技术,观察了HepG2和L02细胞间的相互作用及其对细胞迁移能力的影响。
人肝癌细胞 hepG2贴壁培养

北京索莱宝科技有限公司
人肝癌细胞hepG2贴壁培养
细胞名称:人肝癌细胞;hepG2
形态特性:上皮样
生长特性:贴壁生长
培养条件:MEM-NEAA,20%FBS
冻存条件:细胞冻存液
特征特性:该细胞系来自15岁男性白人的组织。
形态为上皮形,模式染色体数为55,在免疫抑制小鼠中不致瘤。
细胞处理方法:
1.细胞在培养瓶中培养至状态良好后灌满培养基运输,获得细胞后用酒精棉球擦拭瓶口消毒,然后在超
净台中操作。
2.如细胞生长至70%-80%,将瓶中的培养基移入无菌瓶中留作培养使用,保留5-8mL培养基在37℃、5%
的CO2的温箱中继续培养。
细胞培养至90%-100%后,按要求消化传代。
3.弃去培养基,用无菌PBS或者其他缓冲液清洗细胞2次,加入适量胰蛋白酶消化(EDTA胰酶),待细胞
完全脱壁后加培养基吹打混匀,分瓶培养。
特别注意:(如使用公共实验室或初次接触细胞培养,建议添加双抗培养)
1.我们使用自产培养基及进口血清培养细胞,在您拿回细胞后,如想更换其它品牌培养基,请依照逐次替换的原则,先保留培养瓶中的培养基,多日多次代逐步更换,以减轻对细胞的刺激。
2.如签收时出现培养瓶壁破裂,漏液等情况请及时拍照并联系售后。
3.细胞任何售后问题,均需拍照存档并在2周之内及时联系客服。
第1页共1页。
hepg2细胞培养方法

hepg2细胞培养方法
HepG2细胞是一种具有肝细胞特性的人类肝癌细胞系,在药物筛选、肝癌研究和肝细胞转染方面有着广泛的应用价值。
下面为大家介绍在实验室中HepG2细胞的培养方法。
1. 培养基准备
HepG2细胞的常规培养基为DMEM(Dulbecco's Modified Eagle Medium)和FBS(fetal bovine serum)混合液。
可以根据需要加入相应浓度的药物或指定因子进行特殊处理。
2. 细胞解冻
将冻存的HepG2细胞快速解冻,加入预先准备好的培养基中,并轻轻振荡,使细胞充分均匀地分散于培养基中。
3. 细胞传代与分裂
当细胞密度达到80%时,可进行细胞传代。
将培养瓶中的旧培养液吸取,加入适量的胰酶,并放入孵化箱中进行消化。
待细胞自行分离,可加入适量的新鲜培养基,轻轻振荡后离心收集细胞沉淀。
再将所得细胞沉淀加入新的培养瓶中进行培养。
4. 培养条件
HepG2细胞的最适生长条件为37℃的CO2培养箱中,5%CO2条件下培养。
同时需保持培养基的清洁和稳定,避免交叉污染和不必要的变异。
5. 细胞质量检测
HepG2细胞在培养过程中会出现一些问题,比如细胞污染、死亡和异常增长等。
因此需要在定期监测细胞质量。
通常采用SRB法或MTT 法检测细胞的增殖和生存能力。
总之,对于HepG2细胞的培养,需要严格掌握培养条件和操作方法,以保证细胞的稳定增长和高质量。
同时,也需要注意常见的细胞质量问题,及时进行检测和管理。
人肝癌细胞HepG2培养方法探究与分析

人肝癌细胞HepG2培养方法探究与分析郝广萍【摘要】① 目的探究人肝癌细胞HepG2最合适的培养方法.② 方法对比复苏中先40℃ 水浴溶解后37℃ 温浴与37℃ 水浴溶解细胞的存活率,确定最佳复苏方法;对比采用一步消化法和分步消化法的细胞状态以选择最适传代消化方法;对比手动慢速冻存法、程序降温盒慢速冻存法与玻璃化冻存法冻存效果以选择合适冻存方法;对比刚复苏细胞用10%、12%、15%血清浓度DMEM培养液培养,确定其所需血清最适浓度.③ 结果复苏采用先40℃ 水浴溶解后37℃ 温浴,细胞平均存活率(81.0%)显然比37℃ 水浴溶解(69.3%)高;分步消化法效果比一步消化法效果好;冻存采用程序降温盒效果最佳,玻璃冻存法次之,手动慢速冻存效果最差;采用10%血清浓度的DMEM培养液培养刚复苏细胞增殖慢,死细胞多,12%血清浓度的死细胞少,但是增殖慢,而15%血清浓度的死细胞少且细胞增殖快.④ 结论 HepG2细胞复苏采用先40℃ 水浴溶解后37℃ 温浴,消化传代用分步消化法,冻存用程序降温盒,-80℃冰箱过夜,随后液氮中保存;刚复苏的细胞采用血清含量为15%的DMEM培养液效果好.【期刊名称】《河北联合大学学报(医学版)》【年(卷),期】2018(020)001【总页数】4页(P7-10)【关键词】人肝癌细胞HepG2;复苏;细胞传代;冻存;血清浓度【作者】郝广萍【作者单位】山西医科大学汾阳学院检验系山西汾阳 032200【正文语种】中文【中图分类】R657.3人肝癌细胞系HepG2普遍用于肝癌发病机制、抗肝癌药物的研究[1~3],充分把握该细胞系在体外的生长特性及培养方法,对临床研究应用有重要的意义。
但HepG2细胞较其他癌细胞培养难度大,常会因各种影响因素导致实验失败,因此我们根据本院实验条件,对HepG2细胞复苏方法、传代方法、冻存方法及培养血清浓度选择进行探究优化。
1 材料与方法1.1 一般材料1.1.1 细胞株 HepG2细胞为汾阳学院检验系任来峰老师惠赠1.1.2 试剂、耗材 DMEM高糖基本培养液(Gibco)、无噬菌体低内毒素胎牛血清(杭州四季青公司)、0.25%胰蛋白酶EDTA(hyclone)、青链霉素双抗(hyclone)、PBS粉末(按1:2000比例稀释即可)、DMSO普通级别(索莱宝公司)、25mL细胞培养瓶(康宁)、iCellBox程序降温盒(杭州柏恒科技有限公司)1.2 方法1.2.1 细胞复苏 6管冻存细胞(相同条件、同一时间冻存),分别通过下列两种方法复苏:①3管快速放到40℃的水浴锅中,不断摇荡直到完全溶解,转入37℃水浴锅中,慢慢摇荡2分钟[3,4],移入已加有DMEM完全培养液的3支离心管中,离心,弃上清,磷酸盐缓冲液(PBS)重悬,离心,弃上清,分别加入含15%血清的DMEM培养液混匀后,于5%CO237℃的细胞培养箱里培养,做标记。
人肝癌顺铂耐药细胞株 HepG2的建立

e i s p l a t i n( D D P )w i m e x p o s e d t o i n t e r mi t t e n l t y .D r u g s e n s i t i v i t y o f He p G 2 a n d H e p G 2 / D D P w e r e d e t e c t e d b y
Me d i c a l U n i v e r s i t y.Na n n i n g 5 3 0 O 0 0.C h i n a .
G u a n g x i
【 A b s t r a c t 】 Ob j e c t i v e T o e s t a b l i s h a d r u g — r e s i s t a n t h e p a t o c e l l u l a r c a r c i n o m a c e l l l i n e nd a o b s e r v e i t s
采用药物大剂量冲击和低剂量持续诱导相结合的方法诱导产生耐药细胞先用mtt定ddp对hepg2的半数抑制浓度ic50为135gml然后用含25gmlddp的培养基培养24hpbs遍去除死亡的细胞更换ic50浓度ddp的培养基培养1014d直至细胞稳定生长并连续传代次再次测定ic50然后再用含有25gmlddp的培养基培养24h更换已经提高的ic50ddp的培养基直至细胞在含有25gmlddp的培养基中稳定生长并连续传代7次以上最后测定ddpic50为2335ml命名为hepg2ddp并将其维持培养在含001gmlddp完全培养液中实验前2周更换为不Байду номын сангаасddp的完全培养2mtt法检测细胞对药物的敏感性实验
齐 齐 哈 尔 医学 院学 报 2 0 1 5年 第 3 6卷 第 4期
小柴胡实验报告

一、实验目的本研究旨在探讨小柴胡汤的药效及其作用机制,为临床应用提供理论依据。
小柴胡汤是中医经典方剂,具有和解少阳、疏肝解郁、清热解毒的功效。
本实验通过体外细胞实验和动物实验,验证小柴胡汤的药效。
二、实验仪器与试剂1. 仪器:细胞培养箱、酶标仪、显微镜、离心机、高压蒸汽灭菌器等。
2. 试剂:小柴胡汤提取物、细胞培养液、胎牛血清、四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)、无水乙醇、抗病毒酶联免疫吸附试验(ELISA)试剂盒等。
三、实验方法1. 体外细胞实验(1)细胞培养:采用人肝癌细胞株HepG2和单纯疱疹病毒(HSV)感染的人细胞株HSV-HepG2,分别用含10%胎牛血清的细胞培养液培养。
(2)小柴胡汤提取物制备:将小柴胡汤药材按比例浸泡、煎煮、过滤、浓缩、干燥,得到小柴胡汤提取物。
(3)细胞毒性实验:采用MTT法检测小柴胡汤提取物对HepG2和HSV-HepG2细胞的毒性。
(4)抗病毒实验:采用ELISA法检测小柴胡汤提取物对HSV的抑制作用。
2. 动物实验(1)实验动物:选用健康SD大鼠,随机分为实验组和对照组。
(2)实验方法:实验组给予小柴胡汤提取物,对照组给予等体积的生理盐水。
观察两组动物的生长发育、生理指标、病毒感染情况等。
四、实验结果1. 体外细胞实验(1)细胞毒性实验:小柴胡汤提取物对HepG2和HSV-HepG2细胞具有一定的毒性,随着浓度的增加,细胞毒性逐渐增强。
(2)抗病毒实验:小柴胡汤提取物对HSV具有抑制作用,随着浓度的增加,抑制作用逐渐增强。
2. 动物实验(1)生长发育:实验组大鼠生长发育正常,体重、食欲、活动能力等与对照组无显著差异。
(2)生理指标:实验组大鼠的体温、心率、呼吸频率等生理指标与对照组无显著差异。
(3)病毒感染情况:实验组大鼠的HSV感染率明显低于对照组,说明小柴胡汤提取物具有一定的抗病毒作用。
五、实验结论1. 小柴胡汤提取物对HepG2和HSV-HepG2细胞具有一定的毒性,但其抗病毒作用更为明显。
HepG2细胞培养方法与条件的探讨_唐孟萱

文章编号:1006-3110(2005)01-0071-03【论 著】HepG2细胞培养方法与条件的探讨唐孟萱,周万军,胡元佳,陈卫群,王晓春 摘要: 目的 探讨HepG2细胞最优培养方法与培养条件。
方法 对比40℃先溶解后37℃水浴恒温与传统37℃复苏方法效果以选择最佳的复苏方法;观察不同比例胎牛血清培养基下细胞生长情况以确定最佳的血清含量;观察不同汇合度下细胞生长趋势及死活细胞比例以选择恰当的传代时机;观察不同消化方法的消化效果以选择合适的消化方法。
结果 40℃先溶解后37℃水浴恒温的复苏存活率(85.7%)明显高于传统37℃复苏方法(68.4%);在含12%以上胎牛血清的DM EM中细胞生长良好;汇合度达95%~100%时细胞生长趋势达到平台期,100%以后活细胞逐渐减少而死细胞逐渐增加;应用先PBS洗涤后0.25%胰酶消化的传代方法易于控制,消化效果好。
结论 HepG2细胞采取40℃先溶解后37℃水浴恒温的复苏方法,含12%胎牛血清DM EM培养基培养,采用先PBS洗涤后胰酶消化的方法于汇合度95%~100%时传代的方法进行培养,能获得最佳培养效果。
关键词: HepG2;细胞培养;条件;探讨中图分类号:Q813.1+1 文献标识码:AThe Discussion on HepG2Cell Culture Method and Condition TANG Meng-xuan,ZHOU Wan-jun,HU Yuan-jia,et al.(Department of Medical Laboratory,College of Medical Technology and Inf ormation,Central South U niversity,Changsha 410013,Hunan)Abstract: Objective To probe into the best culture technique and condition of H epG2. Methods Compare the re-suscitation effect of diss olving in40℃advance plus37℃with the tradition37℃resuscitation method.Confirm the best serum content by observing the grow circus of HepG2in different serum content culture m edium.Choose the best s eparate time by observin g the cell grown trend and proportion of life and death cell in different convergence degree.Choose the appro-priate digest method by observing the digest effect of different digest method. Results The res uscitation l ivabil ity of dis-solve in40℃advance plus37℃res uscitation m ethod(85.7%)is evidently higher than the tradition37℃resuscitation m ethod(68.4%).C ells grow well in D MEM that contain10%fetal cattle serum.The trend of growth reach flat when conver-gence degree is95%~100%.Life cel ls drop off and death cel ls gradual ly increas e when convergence degree reached 100%.It is eas y to control and have good diges t effect that use PBS wash the cel ls advance then apply0.25%trypsin to di-gest. Conclusion The culture of HepG2can apply the40℃advance plus37℃res us citation method,growing in DMEM that contain12%fetal cattle serum,and apply PBS wash advance then0.25%trypsin to digest when convergence degree reachs95%~100%.Key words: H epG2;Cell culture;C ondition;Probe 人肝肿瘤细胞株HepG2广泛应用于遗传毒理学试验[1]、外源性生物性异物的细胞毒性[2,3]、乙型肝炎病毒感染机制、病毒培养等方面的研究。
HepG2细胞胰岛素抵抗模型

HepG2细胞胰岛素抵抗模型文献一委陵菜黄酮衍生物抗糖尿病活性及其作用机制研究(博士)参照文献[28,29]方法建立胰岛素抵抗的模型。
以l*106/ml密度接种于96孔板,每孔l00ul,37°C, 5%C02饱和湿度培养箱内孵育过夜,以无血清的RPMI1640培养液同步化24h,模型组加入胰岛素终浓度为5*10-7mol/l的无血清RPMI1640培养液孵育24h,弃去培养液,用预冷的PH=4 RPMI1640培养液洗4次,每次3min,同时设置正常对照组。
以葡萄糖检测试剂盒应用葡萄糖氧化酶一过氧化物酶法(GOD—POD法)检测细胞上清液中葡萄糖含量,计算24h各组细胞的葡萄糖消耗量,确定胰岛素抵抗细胞模型的形成。
将模型细胞和正常细胞于倒置显微镜下观察细胞形态学变化。
将模型细胞置于不含胰岛素的培养基中24h后,用葡萄糖检测试剂盒测定培养基的葡萄糖含量,计算各组细胞的葡萄糖消耗量。
观察HepG2细胞胰岛素抵抗细胞模型的持续时间。
结果处理:以葡萄糖氧化酶法检测96孔板中每孔培养液葡萄糖的含量,与未接种细胞的空白孔糖含量均值相减,计算葡萄糖的消耗量。
于505nni处以酶标仪检测0D值。
待测液葡萄糖浓度(mmol/)=(待测液OD值/标准液0D值)*5.55mmol/l造模前后,形态的改变:倒置显微镜下观察,HepG2细胞为梭形或菱形的贴壁细胞,呈典型的肿瘤细胞形态学特征,HepG2/lR模型细胞与对照细胞相比,形态学特征未见明显改。
文献二参考文献[75-76]的基础上加以改进,将细胞以3000 个/孔接种于96 孔培养板中。
分为空白组和模型组。
待细胞贴壁长至80%后,空白组加入正常培养液(胎牛血清浓度为5%),模型组加入新配置的含有胰岛素浓度分别为20、10、5、2.5、1、0.5μg/mL的培养液(胎牛血清浓度为5%),于37℃,5%CO2 培养箱中孵育36h 后,吸弃培养液,换上无血清无酚红的培养液,孵育12h 后,用葡萄糖测定试剂盒[6]检测培养液上清液中的葡萄糖含量。
RPMI-1640培养基和DMEM培养基中HepG-2细胞生长状况

352017.12基础研究RPMI-1640培养基和DMEM 培养基中HepG-2细胞生长状况张 迪 夏 薇 芦 瑶北华大学医学检验学院 吉林省吉林市 132013【摘 要】目的:比较含12%新生牛血清的RPMI-1640培养基与含12%新生牛血清的DMEM 培养基培养HepG-2细胞的效果。
方法:采用含12%新生牛血清的RPMI-1640培养基与含12%新生牛血清的DMEM 培养基培养HepG-2细胞,观察细胞的生长状态,细胞的贴壁情况,并进行细胞计数。
结果:含12%新生牛血清的RPMI-1640培养基中的细胞生长状态更好,细胞的存活率更高。
结论:在对HepG-2细胞进行细胞培养时建议首选含12%新生牛血清的RPMI-1640。
【关键词】DMEM;HepG-2;RPMI-1640当前大部分学者在对贴壁细胞进行细胞培养时通常选用PRMI-1640培养液或DMEM 培养液,故在对HeoG-2细胞进行细胞培养时也可应用PRMI-1640培养液或DMEM 培养液。
但已有研究发现[1]:由于PRMI-1640培养基和DMEM 培养基中各成分不同,尤其是氨基酸,维生素和葡萄糖的含量差别很大,因此对细胞的生长速度和生长状态产生一定影响。
在体外细胞培养的过程中,细胞生长状态的好坏和细胞生长速度的快慢等方面与细胞培养基的选择有着密不可分的联系。
已有研究表明:在细胞培养基的制备过程中,需要在培养基中添加一定含量的生物性液体或组织提取液才能支持细胞的正常生长,由于血清中含有天然促生长因子,可以促进细胞贴壁,因此成为被广泛采用的培养基添加物,最常用的为新生牛血清[2]。
赵翔[3]等人在研究PRMI-1640和DMEM 培养基中对Hep G2的影响时并没有充分考虑到血清浓度对于HepG-2细胞的影响,选用的为浓度为10% 新生牛血清并且没有加入一定量的双抗。
但已有研究表明由于人肝癌细胞株生长缓慢,恶性程度较高,因此对于血清的要求比较严格,其培养时所需要新生牛血清的浓度要比一般的肿瘤细胞高一些。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
材料:逆转录试剂盒(TAKARA DRR047A)、PCR试剂盒(TAKARA DRR081A)
PCR水(灭菌蒸馏水)、去RNA酶的200ul离心管、PCR 8连管、计时器、水浴箱
逆转录反应体系为20ul
(1)基因组DNA的除去反应。
5*g DNA Eraser Buffer 2ul
g DNA Eraser 1ul
3.不同浓度软脂酸处理细胞24hrs。(每组三个复孔)
(1)对照组:用1mlPBS清洗后,每孔1ml BSA继续培养。
(2)0.02mmol/L palmitate: 1.2ul软脂酸储存液+2998.8ul BSA,每孔1ml。
(3)0.04mmol/L palmitate: 2.4ul软脂酸储存液+2997.6ul BSA,每孔1ml。
3.加入3ml终止液,吹打细胞使其脱落并单个化,再移至罗口离心管。
4.离心5min,800rpm,弃上清。
5.罗口离心管加入完全培养基,混匀后分瓶培养。
6.细胞隔日可以用PBS清洗后更换培养基。
细胞冻存:
材料:RPMI-1640、小牛血清、胎牛血清、0.25%胰蛋白酶、二甲基亚砜(DMSO)、PBS、PS、35cm细胞培养瓶、消毒的罗口离心管、消毒的吸管、消毒的冻存管、水浴箱、计时器、离心机、过滤器、光学显微镜
RNA浓度的标化:
吸取4ul RNA+196ul DEPC水稀释50倍在分光光度计上测算样品的浓度,记好A260、Con(ug/ml)和A260/A280,原始浓度为测量浓度*50(A260和Con换算为Con:A260=40, A260/A280为1.6-2.0,线性范围最好),标化的方法是以最低浓度的一个样品为标准进行标化,标化10ulRNA,计算各个样品加DEPC水量,做RT时RNA加样量为X(0.5ug/原始浓度*1000)ul。
2.从液氮罐中取出细胞冻存管,迅速置37℃水浴1min至融化。
3.打开冻存管,吸取细胞悬液至离心管,轻轻混匀。
4.800rpm离心5min,弃上清。
5.细胞沉淀中加入4ml完全培养基,转入35cm培养瓶37℃常规培养,第二天观察细胞生长情况。
细胞传代与换液:
材料:RPMI-1640、小牛血清、胎牛血清、0.25%胰蛋白酶、PBS、PS、
37℃15min→→85℃5sec(PCR仪反应,约16min,迅速转入-20℃保存)
PCR反应体系为25ul
SYBR Premix EX TaqⅡ12.5ul
上游引物0.25ul
下游引物0.25ul
PCR水10ul
c DNA 2ul
*无论做RT还是PCR应先将按样品数计算每种试剂加入量,配在一管里面混匀后加入每个反应管里面,再加各个管的RNA或c DNA,为了保证每管加量完全,可以多配1-2样品的试剂量,混匀加入每管。
35cm细胞培养瓶、消毒的罗口离心管、消毒的吸管、水浴箱、计时器、离心机、光学显微镜
试剂配制:
100ml终止液:90mlRPMI-1640 + 10ml小牛血清+1支PS,4℃保存
步骤:
1.对数增长期汇合度80%-90%的细胞可以传代,4ml PBS清洗两次。
2.加入0.25%胰酶1ml,37℃孵育5min。
(4)0.08mmol/L palmitate: 4.8ul软脂酸储存液+2995.2ul BSA,每孔1ml。
(5)0.16mmol/L palmitate: 9.6ul软脂酸储存液+2990.4ul BSA,每孔1ml。
(6)0.32mmol/L palmitate: 19.2ul软脂酸储存液+2980.8ul BSA,每孔1ml。
试剂的配制:
10ml冻存液:7ml完全培养基+2ml胎牛血清+1ml DMSO,混匀后过滤,4℃保存
步骤:
1.去除培养瓶中旧的培养基,加入4ml PBS清洗两次。
2.混匀胰酶,每瓶加入1ml,37℃孵育5min。
3.每瓶加入3ml终止液,反复抽打细胞使其脱落并单个化,移至罗口离心管。
4.800rpm离心5min,弃上清。
4.新购买的异丙醇分装于DEPC处理的50ml离心管,4℃保存
步骤:
1.吸出培养基,PBS清洗一次;
2.向100ml培养瓶(6孔板中2孔)加入1ml RNAiso Reagent,水平放置片刻,使裂解液均匀分布于细胞表面并裂解细胞,然后使用移液枪吹打细胞使其脱落(约30次);将裂解液转移至1.5ml EP管,移液器反复吹打(推荐用5ml注射器抽打10次);
3.室温静置5min后加入氯仿200ul(RNAiso Reagent:氯仿=1ml:200ul),用力震荡后,室温静置5min,待分层后离心,12000g,4℃,15min;
4.取80%无色上清液至另一干净1.5ml EP管(切忌吸出白色中间层),加入400ul异丙醇(异丙醇应与上清体积比为1:1),充分混匀后,静置10min;
4.不同浓度TNF-a处理细胞24hrs。(每组三个复孔)
(7)对照组:每孔1ml BSA继续培养。
(8)5ng/ml TNF-a: 1.5ul TNF-a储存液+2998.5ul BSA,每孔1ml。
(9)10ng/ml TNF-a: 3ul TNF-a储存液+2997ul BSA,每孔1ml。
(10)20ng/ml TNF-a: 6ul TNF-a储存液+2994ul BSA,每孔1ml。
试剂配制:
1.BSA培养液:
储存液:称取1g BSA溶于10ml RPMI-1640,混匀后过滤,4℃保存
工作液:一瓶RPMI-1640加入2mlBSA储存液和一支PS,即浓度为0.2%,4℃保存
2.软脂酸储存液:称取13.92mg软脂酸(分子量278.41)溶于1ml甲醇,即浓度为0.05mmol/ml,37℃水浴助溶,分为5份分装于EP管,-20℃保存
HepG2细胞培养方法
细胞复苏:
材料:HepG2细胞、RPMI-1640、胎牛血清、PS(青霉素+链霉素)
35cm细胞培养瓶、消毒的罗口离心管、消毒的吸管、水浴箱、计时器、离心机、光学显微镜
试剂配制:
100ml完全培养基:90mlRPMI-1640 + 10ml胎牛血清+1支PS,4℃保存
步骤:
1.罗口离心管加入含10%胎牛血清的完全培养基3ml.。
3.TNF-a储存液:称取10ngTNF-a溶解于1mlPBS,及浓度为10ng/ml,分为10份分装于EP管,-20℃保存
ห้องสมุดไป่ตู้步骤:
1.低倍显微镜观察六孔板里细胞状态,保证无污染,无杂质,汇合度为70%-80%的细胞才可以进行下一步实验。
2.六孔板里的细胞加入1mlPBS清洗,每孔加入1ml 0.2% BSA的RPMI-1640,继续无血清培养24hrs。
RNase Free dH2O (10-2-1-X)ul
Total RNA Xul
42℃2min水浴,4℃保存
(2)反转录反应。
5*PrimeScript Buffer2 4ul
PrimerScript RT Enzyme MIX 1 1ul
RT Primer MIX 4 1ul
RNase Free d H2O 4ul
(11)40ng/ml TNF-a: 12ul TNF-a储存液+2988ul BSA,每孔1ml。
Trizol法提取细胞总RNA流程
材料:
1. RNAiso Reagent:购于Taraka(货号:D312),100ml
2.氯仿、异丙醇、无水乙醇:国产分析纯
3. 0.1%DEPC-H2O、PBS、75%乙醇
5. 12000g,4℃,离心10min,此时管底可见沉淀;
6.小心弃上清液,缓慢沿管壁加入75%乙醇1ml,轻轻上下颠倒使沉淀飘起,12000g,
4℃,离心5min,小心弃乙醇,可离心数秒后将残液吸走;
7.室温静置2-5min,干燥RNA;
8.加入DEPC-H2O 30或40ul溶解RNA,-80℃保存。
4. DEPC处理的EP管、滴头、50ml离心管,5ml注射器、计算器、低温离心机、冰盒
材料的去RNA酶化:
1.0.1%DEPC水配好的DEPC水过夜灭活,高压蒸汽灭菌,
2.EP管、滴头、离心管用0.1%DEPC水浸泡过夜,高压蒸汽灭菌,
3.75%乙醇:75ml无水乙醇+25ml 0.1%DEPC水。
*考虑到做PCR时检测具体基因数不同,反应体系可以以倍数的改变,如P两个基因,RT时可以做6ul体系,即每个试剂加入量均*0.3,混匀后加入每管。
*加入RT后cDNA2ul,注意加样量一致,改好盖子,在盖子一端的边缘做好标记,弹去反应液里面的空气,离心。
步骤:
1.将汇合度为80%-90%的HepG2细胞加入4ml PBS清洗两次。
2.加入1ml已混匀好的胰酶消化,37℃孵育5min。
3.培养瓶中加入终止液3ml,反复吹打使其脱落并单个化,细胞悬液转移至罗口。
4.800rpm离心5min,弃上清。
5.加入6.5ml完全培养基,充分混匀细胞,取15ul细胞悬液进行细胞计数,要求六孔板约5*106 -1*106 /孔。
6.将6ml细胞悬液转入六孔板,每孔1ml,轻轻摇匀悬液,使其均匀完全覆盖,37℃继续培养。
软脂酸和炎症因子处理HepG2细胞:
材料:RPMI-1640、胎牛血清、0.25%胰蛋白酶、甲醇、PBS、PS、
软脂酸(SIGMA P9767)、TNF-a、BSA
消毒的罗口离心管、消毒的吸管和EP管、过滤器、光学显微镜、测量计、过滤器
5.每管加入1ml冻存液,混匀细胞,移至冻存管中。将细胞冻存管放于-20℃保存2hrs。
