高敏心肌肌钙蛋白I检测试剂盒(荧光免疫层析法)产品技术要求tianbaosongyuan
心肌肌钙蛋白I 肌酸激酶同工酶 肌红蛋白检测试剂盒(胶体金免疫层析法)产品技术要求

心肌肌钙蛋白I/肌酸激酶同工酶/肌红蛋白检测试剂盒(胶体金免疫层析法)适用范围:用于体外定性检测人全血,血清或血浆中的心肌肌钙蛋白I、肌酸激酶同工酶CK-MB、肌红蛋白的1.1 产品包装规格1人份/袋、25人份/盒、50人份/盒。
1.2主要组成成分试剂条内含硝酸纤维素膜(NC膜)的检测区(三条T线)分别固有抗人心肌肌钙蛋白I(cTnI)、肌酸激酶同工酶CK-MB和肌红蛋白MYO的抗体,质控区(C)固有以非标记羊抗鼠IgG。
每人份内含1条试剂条、干燥剂一袋、采样滴管一个、密封袋一袋。
2.1 外观2.1.1 外观:试剂盒表面清洁、密封完整、检测条无破损、无污染。
2.1.2 宽度:膜条宽4.0mm,允差±0.2 mm。
2.1.3 爬速:液体移行速度应不低于8mm/min。
2.2检出限心肌肌钙蛋白I最低检出限1.0 ng /ml,CK-MB最低检出限5ng/ml,肌红蛋白最低检出限70ng/ml。
2.3分析特异性2.3.1阴性特异性:将质控品浓度为50μmol/L胆红素、49g/L白蛋白、5mmol/L胆固醇,分别加入到肌钙蛋白I、肌红蛋白、肌酸激酶同工酶的质控品液中对试剂盒进行检测,其浓度相当于0 ng /ml 肌钙蛋白I、0ng/ml肌酸激酶同工酶和0ng/ml肌红蛋白,测试结果应为阴性。
点样15分钟内仅在观察窗上端出现一条红色C对照线。
阴性特异性肌钙蛋白I为100%、肌红蛋白为100%、肌酸激酶同工酶为100%;2.3.2阳性特异性:将质控品浓度为50μmol/L胆红素,49g/L白蛋白,5mmol/L胆固醇分别加入到质控品肌钙蛋白I、肌酸激酶同工酶和肌红蛋白的质控品液中进行测试,其浓度相当于1.0 ng /ml 肌钙蛋白I、5ng/ml肌酸激酶同工酶和70ng/ml肌红蛋白,测试结果应为阳性。
点样15分钟内在观察窗上出现四条红色对照线(一条红色C对照线、一条红色Myo对照线、一条红色CKMB对照线、一条红色TNI对照线)。
心肌肌钙蛋白I 肌酸激酶同工酶 肌红蛋白检测试剂盒(胶体金免疫层析法)产品技术要求库尔

心肌肌钙蛋白I/肌酸激酶同工酶/肌红蛋白检测试剂盒(胶体金免疫层析法)适用范围:本品用于体外定性检测人全血/血清/血浆中人心肌肌钙蛋白I、肌酸激酶同工酶和肌红蛋白。
1.1规格卡型:1人份/袋、1人份/盒、25人份/盒、50人份/盒。
2.1 物理性状2.1.1外观外观应整洁完整,无毛刺,无破损,无污染。
2.1.2膜条宽度膜条宽度应不小于2.5mm。
2.1.3液体移行速度液体移行速度应不低于10mm/min。
2.2检出限2.2.1心肌肌钙蛋白I用心肌肌钙蛋白I样品检测,检出限应为1ng/mL。
用空白对照检测,结果应均为阴性;用含有0.1ng/mL的心肌肌钙蛋白I样品检测,结果应均为阴性;用含有1ng/mL心肌肌钙蛋白I的样品检测,结果应均为阳性,且显色一致。
2.2.2肌酸激酶同工酶用肌酸激酶同工酶样品检测,检出限应为5ng/mL。
用空白对照检测,结果应均为阴性;用含有2ng/mL的肌酸激酶同工酶样品检测,结果应均为阴性;用含有5ng/mL肌酸激酶同工酶的样品检测,结果应均为阳性,且显色一致。
2.2.3肌红蛋白用肌红蛋白样品检测,检出限应为80ng/mL。
用空白对照检测,结果应均为阴性;用含有20ng/mL的肌红蛋白样品检测,结果应均为阴性;用含有80ng/mL肌红蛋白的样品检测,结果应均为阳性,且显色一致。
2.3分析特异性2.3.1心肌肌钙蛋白I分别检测浓度为1000ng/mL的心肌肌钙蛋白T、心肌肌钙蛋白C样本及正常阴性血清,检测结果应不出现阳性。
2.3.2 肌酸激酶同工酶检测正常阴性血清样本,检测结果应不出现阳性。
2.3.3 肌红蛋白检测浓度为10mg/mL的血红蛋白样本,检测结果应不出现阳性。
2.4重复性2.4.1心肌肌钙蛋白I检测浓度为1ng/mL的心肌肌钙蛋白I样品,其结果应均为阳性,且显色一致。
2.4.2肌酸激酶同工酶检测浓度为5ng/mL的肌酸激酶同工酶样品,其结果应均为阳性,且显色一致。
心肌肌钙蛋白I 肌红蛋白检测试剂盒(胶体金免疫层析法)产品技术要求kangmeitianhong

心肌肌钙蛋白I/肌红蛋白检测试剂盒(胶体金免疫层析法)组成:产品由试剂条、干燥剂和一次性滴管组成,其中试剂条由样品垫、硝酸纤维素膜(TI线包被抗人心肌肌钙蛋白I(cTnI)多克隆抗体;MG线包被肌红蛋白多克隆抗体;QC线包被羊抗鼠多克隆抗体)、玻璃纤维(包被胶体金标记的抗人cTnI 单克隆抗体和胶体金标记的肌红蛋白单克隆抗体)、吸水纸、塑料载板组成。
适用范围:用于体外定性检测人全血、血清、血浆中的心肌肌钙蛋白I和肌红蛋白的水平。
1.1 产品包装规格初始包装:1人份 / 袋1.2 试剂盒组成产品由试剂条、干燥剂和一次性滴管组成,其中试剂条由样品垫、硝酸纤维素膜(TI线包被抗人心肌肌钙蛋白I(cTnI)多克隆抗体;MG线包被肌红蛋白多克隆抗体;QC线包被羊抗鼠多克隆抗体)、玻璃纤维(包被胶体金标记的抗人cTnI 单克隆抗体和胶体金标记的肌红蛋白单克隆抗体)、吸水纸、塑料载板组成。
2.1物理性状2.1.1 外观:试剂盒表面清洁、密封完整,检测条无破损、无污染。
2.1.2宽度:膜条宽3.8 mm。
2.1.3移行速度:液体移行速度应不低于10mm/min。
2.2 临界值及重复性本产品心肌肌钙蛋白I临界值为 0.5ng/mL、肌红蛋白临界值为50.0 ng/mL。
2.2.1 用1.0 ng/mL的心肌肌钙蛋白I和80.0ng/mL的肌红蛋白的样本重复20次,心肌肌钙蛋白I和肌红蛋白阳性率应≥95%。
2.2.2 用0.1ng/mL的心肌肌钙蛋白I和20.0 ng/mL的肌红蛋白的样本重复20次,心肌肌钙蛋白I和肌红蛋白阴性率应≥95%。
2.3分析特异性将1000ng/mL的心肌肌钙蛋白T样本、1000ng/mL的心肌肌钙蛋白C样本、1000ng/mL的骨骼肌型肌钙蛋白I样本,和10mg/mL的血红蛋白样本,分别加入到试剂盒进行检测,结果应为阴性。
点样20分钟内仅在观察窗口上端出现一条红色QC对照线。
阴性特异性100%。
肌钙蛋白I测定试剂盒(化学发光免疫分析法) 产品技术要求新产业生物

医疗器械产品技术要求编号:
肌钙蛋白I测定试剂盒(化学发光免疫分析法)
2.性能指标
2.1外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;试剂盒内组分(磁性微球除外)应为澄清的液体,无沉淀、无悬浮物、无絮状物;磁性微球悬浮溶液应该均匀分布,无肉眼可观察到的团聚颗粒,无异物,无块状沉淀。
2.2重复性
变异系数(CV)应≤5%。
2.3批间差
变异系数(CV)应≤10%。
2.4准确度
相对偏差应在±10%范围内。
2.5空白限
空白限应≤0.006 ng/mL。
2.6线性
在(0.015~50.0)ng/mL浓度范围内,线性相关性系数(r)绝对值应≥0.9900。
2.7分析特异性
测定浓度为1000 ng/mL的心肌肌钙蛋白C(cTnC)、心肌肌钙蛋白T(cTnT)和骨骼肌肌钙蛋白(sTnI),交叉反应率应<0.004%。
2.8校准品均一性
)应≤5%。
校准品均一性(CV
均一性
2.9质控品预期结果
质控品1测定结果应在(0.050~0.150)ng/mL范围内,质控品2测定结果应在(1.40~2.60)ng/mL范围内。
2.10质控品均一性
)应≤5%。
质控品均一性(CV
均一性。
肌钙蛋白I测定试剂盒技术要求

肌钙蛋白I测定试剂盒技术要求肌钙蛋白I(cTnI)是心肌细胞特异性的蛋白质,它的释放与心肌损伤和坏死相关。
因此,cTnI的测定对于心肌梗死、心肌炎等心脏疾病的诊断和监测至关重要。
肌钙蛋白I测定试剂盒是一种用于测量血液中cTnI浓度的试剂盒,其中包含了测量所需的试剂和标准品。
1.灵敏度:试剂盒应具备高灵敏度,能够检测到非常低浓度的cTnI。
因为心肌损伤时cTnI释放的浓度可能很低,所以试剂盒需要具备足够高的灵敏度来确保准确的测量结果。
2.特异性:试剂盒需要具备对cTnI的高特异性,即只能有效地识别和测定cTnI而不受其他物质的干扰。
这是为了避免假阳性和假阴性的发生,保证结果的准确性和可靠性。
3.精确性:试剂盒需要具备高精确度,能够提供稳定且一致的测量结果。
这要求试剂盒的反应性和稳定性非常好,不受其他因素的影响,如温度、储存时间等。
4.操作简便:试剂盒的操作应简单易行,不需要复杂的设备和专业人员。
推荐使用简化的步骤和标准化的操作流程,减少用户误操作的可能性。
5.储存和保质期:试剂盒的储存和保质期要求较长,能够在适应不同环境条件下保持试剂的稳定性和活性。
并且在试剂盒使用前后,可以通过储存和保质期的信息确定试剂盒的有效性。
6.经济实用:试剂盒的价格相对较低,并且具有良好的性价比,使其更易于普及和推广使用。
同时,试剂盒的包装也要方便用户使用,减少浪费和交叉污染。
7.文献支持:试剂盒需要具备一定的文献和临床数据支撑,能够证明其有效性和准确性。
此外,厂家还应提供技术支持和培训,以帮助用户正确操作和使用试剂盒。
总结起来,肌钙蛋白I测定试剂盒需要具备高灵敏度、高特异性、高精确性、操作简便、储存稳定、经济实用等特点,能够提供准确可靠的测量结果,为心脏疾病的诊断和监测提供有效工具。
同时,厂家还需要提供技术支持、培训和文献支持,以保证试剂盒的质量和用户的满意度。
心肌肌钙蛋白I_N末端B型钠尿肽原联检试剂(荧光免疫层析法)产品技术要求万孚

心肌肌钙蛋白I / N末端B型钠尿肽原联检试剂(荧光免疫层析法)1.性能指标1.1 外观检查外观应平整,材料附着应牢固,各组分应齐全,卡固定紧密。
1.2 物理检查膜条宽度应不小于2.0mm;液体移行速度应不低于10mm/min。
1.3 准确度在试剂的线性范围内,分别检测3个不同浓度的参考品,其测量结果的相对偏差(Bias%)不应超过±15%。
1.4 最低检出限1.4.1 cTnI:应不大于0.1ng/mL;1.4.2 NT-proBNP:应不大于18pg/mL。
1. 5 线性1.5.1 cTnI:在(0.1~40)ng/mL的范围内,线性相关系数r≥0.9900。
1.5.2 NT-proBNP:在(18~22000)pg/mL的范围内,线性相关系数r≥0.9900。
1.6 精密度1.6.1 批内精密度在试剂的线性范围内,分别检测2个不同浓度的样本,所得结果的变异系数(CV%)应不大于10%。
1.6.2 批间精密度在试剂的线性范围内,分别检测2个不同浓度的样本,所得结果的变异系数(CV%)应不大于15%。
1.7 分析特异性1.7.1 cTnI:选择同一浓度的心肌肌钙蛋白I样本分别加入胆固醇、甘油三酯、胆红素,使干扰物最终浓度胆固醇60mg/mL、甘油三酯40mg/mL、胆红素2mg/mL,各干扰样本重复检测3次,计算样本检测结果的均值和相对偏差,其中相对偏差(Bias%)在±15%内。
1.7.1 NT-proBNP:选择同一浓度的N末端B型钠尿肽原样本分别加入胆固醇、甘油三酯、胆红素,使干扰物最终浓度胆固醇60mg/mL、甘油三酯40mg/mL、胆红素2mg/mL,各干扰样本重复检测3次,计算样本检测结果的均值和相对偏差,其中相对偏差(Bias%)应在±15%内。
高敏肌钙蛋白I测定试剂盒(化学发光免疫分析法)产品技术要求万孚

2性能指标
2.1外观
外观应符合如下要求:
a)磁珠包被物R1摇匀后应为棕褐色悬浊液;静止久后,棕褐色磁珠沉降于底部,上清液应为无色液体;酶标记物R2应为无色液体,无沉淀或絮状物;样本处理液R3应为无色液体;校准品应为外观均匀,成形完整,呈乳白色的冻干品,复溶后较清亮,无浑浊及沉淀;
b)试剂盒各组分应齐全、完整,液体无渗漏;
c)中文包装标签清晰,无磨损。
2.2准确度
将具有溯源性的两个正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10% 范围内。
2.3空白限
空白限不大于0.006ng/mL;
2.4线性
试剂盒在0.01ng/mL~50 ng/mL 区间内,其相关系数(r)的绝对值不低于0.9900。
2.5重复性
变异系数CV≤8%。
2.6批间差
变异系数CV≤10%.
2.7分析特异性
测定浓度均为1000ng/mL 的心肌肌钙蛋白C、心肌肌钙蛋白T、骨骼肌肌钙蛋白I,交叉反应率应≤0.1%。
2.8校准品
2.8.1校准品准确度
测定校准品,C1,C2 测定结果的相对偏差在±10%范围内,C0 测定结果的绝对偏差的绝对值不高于0.006ng/mL。
2.8.2校准品瓶内均一性
校准品C1,C2 瓶内均一性≤8%,C0 的SD≤0.006ng/mL。
2.8.3校准品瓶间均一性
校准品C1,C2 瓶间均一性≤5%,C0 的SD≤0.006ng/mL。
心肌肌钙蛋白I检测试剂盒(荧光免疫层析法)产品技术要求广州天宝颂原生物

医疗器械产品技术要求编号:
心肌肌钙蛋白I检测试剂盒
(荧光免疫层析法)
1. 性能指标
1.1物理性状
1.1.1 外观
测试卡外壳应整洁完整,印刷内容清晰;测试卡内部试纸条应整洁完整、无毛刺、无破损、无污染;材料附着牢固。
1.1.2 宽度
测试卡内部试纸条宽度应在 4.0mm±0.2mm 范围内。
1.1.3 移行速度
液体移行速度应不低于10mm/min。
1.2精密度
1.2.1批内精密度
用cTnI浓度为0.16ng/mL、5.00ng/mL、20.00ng/mL的企业参考品进行检测,其变异系数CV不大于15%。
1.2.2批间精密度
任取3批测试卡,用cTnI浓度为0.16ng/mL、5.00ng/mL、20.00ng/mL的企业参考品进行检测,其批间变异系数CV不大于20%。
1.3准确度
用cTnI浓度为0.16ng/mL、5.00ng/mL、20.00ng/mL的企业参考品进行检测,其相对偏差(B%)应不超过±15%。
1.4空白限
cTnI空白限应不高于0.05ng/mL。
1.5线性
cTnI线性范围为0.05ng/mL-30.00ng/mL,相关系数r≥0.9900。
1。
心肌肌钙蛋白-I质控品产品技术要求bd

心肌肌钙蛋白-I质控品
适用范围:与本公司生产的心肌肌钙蛋白-I测定试剂盒(免疫比浊法)配套使用,用于心肌肌钙蛋白-I的室内质量控制。
1.1 包装规格:
0.5ml×2(液体,2水平)。
产品组成
磷酸盐缓冲液,浓度:20mmol/L;BSA,浓度:1g/L;
水平1:重组人心肌肌钙蛋白-I,目标浓度范围:1.5mg/L-3mg/L;
水平2:重组人心肌肌钙蛋白-I,目标浓度范围:3mg/L-7mg/L。
2.1 外观
2.1.1 试剂为液体,无色至淡黄色,无可见不溶物。
2.1.2 包装外观应整洁,标签字迹清晰,不易脱落。
2.2 装量
净含量应不少于标示值。
2.3 赋值有效性
测试结果在质控范围内。
2.4 批内重复性
CV≤5%。
2.5 稳定性
2.5.1 开瓶稳定性
产品首次开封后2℃~8℃避光保存可稳定3天,稳定期过后4小时内进行测试,应符合2.3要求。
2.5.2 效期稳定性
原装产品在2℃~8℃避光保存,有效期12个月。
有效期满后1个月内测试结果应符合2.1、2.3和2.4要求。
超敏肌钙蛋白I测定试剂盒产品技术要求新产业

超敏肌钙蛋白I测定试剂盒产品技术要求新产业1.试剂盒成分:试剂盒应包含超敏肌钙蛋白I检测试剂、质控品、稀释缓冲液等试剂。
2.检测原理:该试剂盒基于化学发光免疫分析法,测定血液中的超敏肌钙蛋白I浓度。
该方法利用特异性抗体与超敏肌钙蛋白I结合,产生荧光信号,通过测定荧光信号的强度来确定样品中超敏肌钙蛋白I的浓度。
3. 灵敏度:试剂盒应具有高灵敏度,能够在低浓度范围内准确测定超敏肌钙蛋白I的浓度。
通常,灵敏度应在1 ng/mL以下。
4.精密度:试剂盒应具有良好的精密度,能够在同一实验条件下反复测定,结果应具有较低的变异性。
精密度可通过重复测定一组质控品来评估。
5.线性范围:试剂盒应具有宽线性范围,能够测定不同浓度范围内的超敏肌钙蛋白I。
一般来说,线性范围应当覆盖从低浓度到高浓度的所有可能浓度。
6.特异性:试剂盒应具有良好的特异性,能够与超敏肌钙蛋白I结合,而不与其他相关蛋白结合。
特异性可以通过与其他蛋白进行交叉反应的实验来评估。
7.储存条件:试剂盒的储存条件应符合通常的实验室要求,通常需要在2-8°C下储存,避免冻结。
8.使用方便性:试剂盒应具有使用方便、操作简单的特点,能够被广泛的临床实验室使用。
试剂盒应提供详细的操作指南,并且包含所有必要的试剂和耗材。
9.技术支持:试剂盒的生产商应提供有效的技术支持,包括现场指导、问题解答和技术培训等。
同时,试剂盒应附带一份完整的说明书,包含使用步骤、注意事项和结果解释等内容。
超敏肌钙蛋白I测定试剂盒的技术要求是确保其在临床实验室中准确、可靠地测定血液中超敏肌钙蛋白I浓度的关键。
通过满足这些技术要求,可以提高心肌梗死的早期诊断和预后评估的准确性,为临床医生提供更好的诊断和治疗决策依据。
心肌肌钙蛋白I检测试剂盒(胶体金免疫层析法)产品技术要求注册

医疗器械产品技术要求:心肌肌钙蛋白I检测试剂盒(胶体金免疫层析法)1、产品型号/规格及其划分说明1.1产品规格30人份/盒(卡式)50人份/盒(条式)1.2主要组成成分本试剂盒是由30人份测试卡/50人份测试条及1瓶样本稀释液(5毫升装)、塑料滴管30个(卡式)/50个(条式)组成。
试剂条组成成分为:C线标记鸡IgY多克隆抗体,包被羊抗鸡IgY多克隆抗体,T线标记和包被鼠抗心肌肌钙蛋白I单克隆抗体。
硝酸纤维素膜。
稀释液主要组成成分:酪蛋白(1%)、磷酸氢二钠(0.54%)、磷酸二氢钠(0.08%)、氯化钠(0.9%)、Tween-20(0.4%)。
1.3适用范围本试剂盒用于体外定性检测人体血清、血浆或全血中的心肌肌钙蛋白I(cTnI)。
1.4产品储存条件及有效期(体外诊断试剂适用)2℃~30℃保存,有效期24个月。
2、性能指标2.1物理检查2.1.1外观试剂盒外观整齐,包装完整无破损,标签清晰可辨。
2.1.2膜条宽度膜条宽度应不低于2.5mm。
2.1.3液体移行速度液体在膜上移行速度应不低于10mm/min。
2.1.4液体装量及pH值稀释液装量应不低于其标示值,pH值7.0~7.6。
2.2性能要求2.2.1临界值及重复性本产品临界值为0.3ng/ml。
检测浓度为0.5ng/ml的心肌肌钙蛋白I(cTnI)质控液20次,阳性率不低于95%,且显色一致。
检测浓度为0.1ng/ml(cTnI次,阴性率不低于95%,且显色一致。
2.2.2分析特异性检测如表1浓度的交叉反应物,结果为阴性。
表1交叉反应物名称及浓度检测浓度为100ng/ml的心肌肌钙蛋白I(cTnI)质控液,检测3次,结果均为阳性。
2.2.4批间差按2.2.1要求分别检测三批产品,各批产品之间结果一致且显色度均一。
2.2.5稳定性选择以下之一进行:2.2.5.1加速稳定性,37℃放置20天,应符合2.2.1~2.2.3的要求。
2.2.5.2效期稳定性,2~30℃可放置24个月,过效期一个月内测试,产品性能应符合2.2.1~2.2.3的要求。
心肌肌钙蛋白I测定试剂盒(荧光免疫层析法)产品技术要求zhongjianantai

心肌肌钙蛋白I测定试剂盒(荧光免疫层析法)
适用范围:本试剂盒用于体外定量检测人血清、血浆或全血样本中心肌肌钙蛋白I(cTnI)的含量。
1.1包装规格:20人份/盒,40人份/盒。
1.2主要组成:
表1 试剂盒产品组成表
2.1 物理检查
2.1.1 外观
外观平整,材料附着牢固,内容齐全,试剂无杂质,外包装完整无破损,标签清晰可辨。
2.1.2 膜条宽度
膜条宽度应满足4.0mm±0.2mm。
2.1.3 液体移行速度
液体移行速度应不低于10mm/min。
2.1.4 样本稀释液
样本稀释液的净含量应不少于标示值,且其pH值为7.0±0.2。
2.2准确度
试剂盒的回收率在85%~115%之间。
2.3线性
在[0.2,50]ng/mL范围内,线性相关系数(r)应不低于0.990。
2.4 重复性
分别测定高、低两个浓度的样本,变异系数(CV)应不高于10.0%。
2.5 批间差
用三个不同批号试剂盒分别测定高、低两个浓度的样本,三个批号试剂盒之间的批间变异系数应不高于15.0%。
2.6 空白限
试剂盒空白限应不大于0.1ng/mL。
2.7校准信息溯源性
校准信息所用工作校准品根据GB/T 21415-2008 《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的规定,溯源至工作校准品,工作校准品通过已上市产品进行赋值。
2.8 稳定性
试剂盒在规定的条件下保存至有效期末,取到效期后两个月内的试剂盒,检测2.2、2.3、2.4、2.6项,结果应符合要求。
肌钙蛋白I(cTnI)测定试剂盒(化学发光免疫分析法)产品技术要求taige
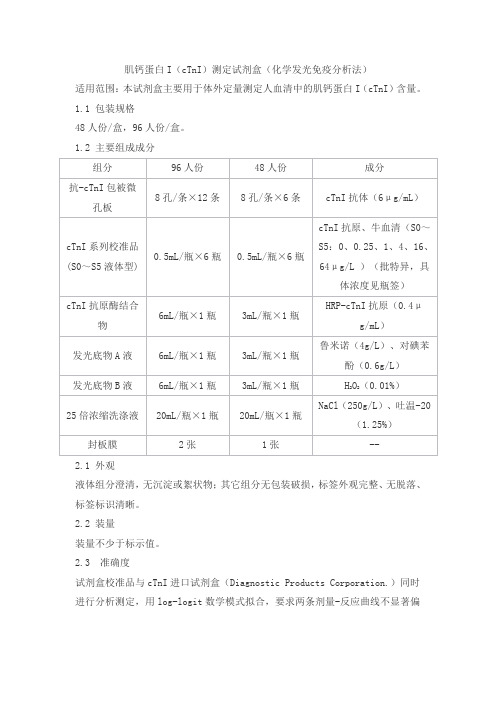
肌钙蛋白I(cTnI)测定试剂盒(化学发光免疫分析法)适用范围:本试剂盒主要用于体外定量测定人血清中的肌钙蛋白I(cTnI)含量。
1.1 包装规格48人份/盒,96人份/盒。
1.2 主要组成成分2.1 外观液体组分澄清,无沉淀或絮状物;其它组分无包装破损,标签外观完整、无脱落、标签标识清晰。
2.2 装量装量不少于标示值。
2.3 准确度试剂盒校准品与cTnI进口试剂盒(Diagnostic Products Corporation.)同时进行分析测定,用log-logit数学模式拟合,要求两条剂量-反应曲线不显著偏离平行(t-检验);以cTnI进口试剂盒(Diagnostic Products Corporation.)为对照品,其回收率应在90.0%~110%范围内。
2.4 剂量-反应曲线线性相关系数在[0.25,64]μg/L范围内,用log-logit数学模式拟合,剂量-反应曲线相关系数(r)的绝对值应不小于0.9900。
2.5 精密度2.5.1 重复性以同批次试剂盒,高低两种浓度的质控血清平行测定10次,求其平均值和标准差(SD),批内精密度(CV%)=SD/平均值×100%,重复性(CV%)应不高于15.0%;2.5.2 批间差三种不同批次试剂盒,对同一样品进行重复测定10次,计算各组测定结果的平均值和标准差(SD),批间精密度(CV%)=SD/平均值×100%,批间差(CV%)应不高于20.0%。
2.6 最低检出量应不高于0.250μg/L。
2.7 质控血清测定值应在允许的范围之内。
2.8 特异性cTnI与肌红蛋白、肌钙蛋白T (cTnT)、肌酸激酶同工酶的交叉反应如下:2.9 稳定性2.9.1 热稳定性37℃放置3天,测定结果应符合上述2.1~2.7项要求。
2.9.2 效期稳定性成品试剂盒2~8℃存放6个月后,测定结果应符合上述2.1~2.7项要求。
2.10 校准品溯源性按照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》要求,该校准品溯源至本公司内部工作校准品,通过与cTnI进口试剂盒(Diagnostic Products Corporation.)比对赋值。
肌钙蛋白 I(cTnI)测定试剂盒(胶乳免疫比浊法)说明书

肌钙蛋白I (cTnI)测定试剂盒(胶乳免疫比浊法)说明书【产品名称】肌钙蛋白I(cTnI)测定试剂盒(胶乳免疫比浊法)【包装规格】a)试剂1:1×15mL 试剂2:1×5mL b)试剂1:2×45mL 试剂2:2×15mL c)试剂1:4×60mL 试剂2:4×20mL d)试剂1:2×60mL 试剂2:2×20mL 【预期用途】用于体外定量测定人血清中肌钙蛋白I 的含量。
肌细胞受损时,肌钙蛋白I (cTnI )立即释放入血,在胸痛发生4-6h 后,血中cTnI 水平超过正常上限,12-24h 达高峰,可持续6~10天之久。
由于cTnI 可检出微小心肌损伤,是公认的快速诊断急性心肌梗死和急性冠脉综合症(ACS )[1]。
测定肌钙蛋白I 常用于心肌细胞受损、急性心肌梗死、急性冠脉综合症的辅助诊断。
【检验原理】样本与胶乳试剂在缓冲液中混合后,其中的肌钙蛋白Ⅰ与胶乳颗粒表面的抗体结合,使相邻的胶乳颗粒彼此交联,发生凝集反应产生浊度变化,该浊度变化与样本中的肌钙蛋白的量成正相关。
【主要组成成分】试剂1主要组分磷酸盐缓冲液30mmol/L聚乙二醇(PEG )0.5%表面活性剂及稳定剂适量试剂2主要组分磷酸盐缓冲液30mmol/L抗人肌钙蛋白(cTnI )抗体乳胶颗粒适量表面活性剂及稳定剂适量注:不同批号试剂盒中各组分未经试验不可互换。
【储存条件及有效期】1.试剂原包装在2~8℃储存,有效期为12个月,生产日期、有效期见标签。
2.开口后的试剂在仪器仓中(2~8℃)可稳定30天。
【适用仪器】艾威德AS-420/AS-660/AS-1200;日立HITACHI 7020型/7060型/7180型/7600型/LABOSPECT 008AS 型;贝克曼AU400/AU480/AU640/AU680/AU2700/AU5400/AU5800/AU5811/AU5821;佳能TBA-FX8/TBA-120FR /TBA-2000FR ;罗氏cobas 8000c 702/cobas 8000c 701/cobas 8000c 502;西门子SIEMENS ADVIA 1800/ADVIA 2400;雅培ABBOTT ARCHITECT c8000/ARCHITECT c16000/ARCHITECT ci8200;西森美康SYSMEX BM6010/C ;科华KHB 卓越310/卓越330/卓越400/卓越450/ZY-1200/ZY-1280;迪瑞CS-240/CS-T300/CS-300B/CS-380/CS-400A/CS-400B/CS-600A/CS-600B/CS-800A/CS-800B/CS-1200/CS-1200ISE/CS-1300B/CS-1400;迈瑞MINDRAY BS-220/BS-330/BS-350E/BS-380/BS-390/BS-400/BS-430/BS-600/BS-800/BS-2000M ;颐兰贝ES-200/ES-380/ES-480;赛诺迈德SUNMATIK-9050型;雷杜Chemray 420;英诺华D280;特康TC6010L ;锦瑞GS400;普康6066。
心肌肌钙蛋白I(cTnI)测定试剂盒(化学发光法)产品技术要求tongxin

心肌肌钙蛋白I(cTnI)测定试剂盒(化学发光法)适用范围:本试剂盒用于体外定量测定人血清或血浆中心肌肌钙蛋白I(cTnI)的含量。
分说明1.1 包装规格96人份/盒1.2 主要组成成分表1 主要组成成分备注:校准品溯源至美国国家标准与技术研究院(National Institute of Standards and Technology,NIST)颁布的有证标准参考物质(SRM 2921),校准品(A~F)目标浓度为0、0.5、1.4、4.0、18.0、45.0ng/ml。
2.1 外观组分齐全、完整,液体无渗漏,微孔板包装袋无破损、漏气现象;包装标签应清晰,易识别。
2.2 装量液体装量应不少于标示值。
2.3 准确度在剂量反应曲线检测范围内,用已知浓度的纯品(源自Hytest公司)做回收试验,其回收率应在85~115%范围内。
2.4 线性在线性范围[0.25,45]ng/ml内,剂量反应曲线相关系数(r)的绝对值应不低于0.9900。
2.5 空白限应不大于0.25ng/ml。
2.6 重复性同一次试验中分别重复检测浓度值为1.35±0.33ng/ml、18.83±3.78ng/ml样本10次,其变异系数(CV)应不大于10.0%。
2.7 批间差用3个批号的试剂盒检测浓度值为1.35±0.33ng/ml、18.83±3.78ng/ml样本,3个批号试剂盒之间的批间变异系数(CV)应不大于15.0%。
2.8 分析特异性测定浓度为1000ng/ml 心肌肌钙蛋白C(Cardiac Troponin C,cTnC),交叉反应率小于0.05%。
测定浓度为1000ng/ml 心肌肌钙蛋白T(Cardiac Troponin T,cTnT),交叉反应率小于0.05%。
测定浓度为1000ng/ml 骨骼肌肌钙蛋白I(Skeletal Troponin I,sTnI),交叉反应率小于0.05%。
心肌肌钙蛋白I(cTnI)检测试剂盒(胶体金法)产品技术要求注册

医疗器械产品技术要求:心肌肌钙蛋白I(cTnI)检测试剂盒(胶体金法)1、产品型号/规格及其划分说明1.1包装规格:检测条1人份/盒、5人份/盒、10人份/盒、20人份/盒、50人份/盒、100人份/盒;检测卡1人份/盒、5人份/盒、10人份/盒、20人份/盒、50人份/盒、100人份/盒。
1.2主要组成成分:每人份含:1.检测试剂:由胶体金垫(胶体金标记羊抗鼠cTnI单克隆抗体)、硝酸纤维素膜(C线包被羊抗鼠多克隆抗体,T线包被羊抗鼠cTnI单克隆抗体)、纤维膜、吸水纸、PVC板;2.干燥剂1个;3.滴管1支。
1.3适用范围/预期用途适用于体外检测人血清或血浆中心肌肌钙蛋白I的含量。
1.4产品储存条件及有效期(体外诊断试剂适用)(10℃~30℃)密封避光保存,有效期24个月。
2、性能指标2.1物理性状2.1.1外观:检测试纸整洁完整、无毛刺、无破损、无污染。
2.1.2宽度:检测试纸宽度≥2.5mm。
2.1物理性状2.1.1外观:检测试纸整洁完整、无毛刺、无破损、无污染。
2.1.2宽度:检测试纸宽度≥2.5mm。
2.1.3移行速度:液体移行速度应不低于10mm/min。
2.2临界值及重复性2.2.1检测浓度为1ng/ml的样本20次,其阳性符合率≥95%,显色均一,反应结果应一致。
2.2.2检测浓度为0.3ng/ml的样本20次,其阴性符合率≥95%,显色均一,反应结果应一致。
2.3特异性检测肌红蛋白250ng/ml、心肌肌钙蛋白C1000ng/ml、心肌肌钙蛋白T1000ng/ml、人骨骼肌肌钙蛋白I为1000ng/ml,检测结果均为阴性。
2.4批间差取连续三批检测试纸各40人份,按照2.2临界值的检验方法,各浓度反应结果应一致。
2.5稳定性常温(10℃~30℃)放置24个月,分别检测2.1-2.3项,结果应符合各项目的要求。
心肌肌钙蛋白I(cTnI)检测试剂(胶体金免疫层析法)产品技术要求普菲特

心肌肌钙蛋白I(cTnI)检测试剂(胶体金免疫层析法)适用范围:用于体外定性检测人血清中心肌肌钙蛋白I (cTnI)。
1.1包装规格25人份/盒1.2主要组成组分心肌肌钙蛋白I(cTnI)检测试剂每人份包含检测试剂一份,干燥剂一份。
心肌肌钙蛋白I(cTnI)检测试剂:玻璃纤维上固定胶体金标记的cTnI单克隆抗体、硝酸纤维素膜上分别在检测线和对照线处包被cTnI单克隆抗体和羊抗鼠IgG。
2.1物理性状2.1.1外观外观应整洁完整、无毛刺、无破损、无污染;材料附着牢固,内容齐全。
2.1.2膜条宽度膜条宽度应不小于2.5mm。
2.1.3液体移行速度液体移行速度应不低于10.0mm/min。
2.2最低检测限2.2.1检测1.0ng/mL的心肌肌钙蛋白I(cTnI)质控品3次,其结果应均为阳性,且显色一致。
2.2.2检测0.1ng/mL的心肌肌钙蛋白I(cTnI)质控品3次,其结果应均为阴性,且显色一致。
2.3分析特异性分别检测含有1000.0ng/mL心肌肌钙蛋白T的阴性质控品,含有1000.0ng/mL心肌肌钙蛋白C的阴性质控品和含有1000.0ng/mL骨骼肌型肌钙蛋白I的阴性质控品各3次,结果应不出现阳性。
2.4 重复性取同一批次的试纸10份,检测1.0ng/mL的心肌肌钙蛋白I(cTnI)质控品,其结果应均为阳性,且显色一致。
2.5 HOOK效应检测100.0 ng/mL的心肌肌钙蛋白I(cTnI)质控品3次,结果应均不出现阴性。
2.6批间差取三个批号的心肌肌钙蛋白I(cTnI)检测试纸,对重复性进行检测,其结果应均为阳性,且显色一致。
2.7稳定性取同批号的试纸在4℃~30℃条件下贮存达到18个月后的试纸进行检测,结果应符合2.2~2.5要求。
肌钙蛋白I(TnI)测定试剂盒(微流控免疫荧光法)产品技术要求深圳微点生物

2.性能指标
2.1外观与结构
试剂盒表面应整洁完整、无毛刺、无破损、无污染,无峰棱,上下盖附着应牢固,拔脱应轻松。
2.2准确度
用校准溶液进行检测,在检测仪上的测试结果的平均值与标示浓度值的偏差应不超过±12%。
2.3线性
2.3.1试剂盒在0.02ng/ml至50ng/ml的线性范围内,试剂盒的线性相关性系数应≥0.9。
2.3.2试剂盒在<0.2ng/ml的范围内线性绝对偏差应不大于±0.05ng/ml,在0.2ng/ml~50ng/ml的范围内线性相对偏差应不大于±10%。
2.4批内精密度
在检测仪上的测试结果的变异系数CV(%)应不超过12%。
2.5批间精密度
用校准溶液对3个批号的试剂盒各5个进行检测,三个批号在检测仪上的测定均值的变异系数CV(%)应不超过15%。
2.6分析灵敏度
应不高于0.02ng/ml。
2.7分析特异性
2.7.1浓度为5mg/ml的血红蛋白,对测定结果的影响应不大于±10%。
2.7.2浓度为0.2mg/ml的胆红素,对测定结果的影响应不大于±10%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
医疗器械产品技术要求编号:
高敏心肌肌钙蛋白I 检测试剂盒
1. 性能指标
1.1物理性状
1.1.1外观
测试卡外壳应整洁完整,印刷内容清晰;测试卡内部试纸条应整洁完整、无毛刺、无破损、无污染;材料附着牢固。
稀释液应澄清无沉淀。
1.1.2宽度
测试卡内部试纸条宽度应在 4.1mm±0.2mm 范围内。
1.1.3移行速度
液体移行速度应不低于10mm/min。
1.2精密度
1.2.1批内精密度
用cTnI 浓度为160.0ng/L、1600.0ng/L、16000.0ng/L 的样本进行检测,其变异系数CV 不大于10%。
1.2.2批间精密度
任取3 批测试卡,用cTnI 浓度为160.0ng/L、1600.0ng/L、16000.0ng/L 的样本进行检测,其批间变异系数CV 不大于15%。
1.3准确度
用cTnI 浓度为160.0ng/L、1600.0ng/L、16000.0ng/L 的样本进行检测,其相对偏差(B%)不大于±10%。
1.4分析灵敏度
cTnI 分析灵敏度应不高于10.0ng/L。
1.5分析测量范围
cTnI 分析测量范围为10.0ng/L-30000.0ng/L,相关系数r2≥0.9900。
1。
