板蓝根颗粒质量标准及检验操作规程
板蓝根质量标准及检验操作规程
XXXXX药业有限公司成品质量标准及检验操作规程1 品名:1.1 中文名:板蓝根1.2 汉语拼音:Banlangen2 代码:3 取样文件编号:4 检验方法文件编号:5 依据:《中国药典》(2015年版一部)。
6 质量标准:7 检验操作规程:7.1 试药与试剂:稀乙醇、板蓝根对照药材、(R-S)-告依春对照品、甲醇、石油醚(60~90℃)、乙酸乙酯、盐酸、精氨酸对照品、羧甲基纤维素钠、正丁醇、冰醋酸、茚三酮试液、水、氢氧化钠滴定液、甲基红乙醇溶液指示剂。
7.2 仪器与用具:显微镜、电子天平、紫外光灯、超声波清洗器、水浴锅、硅胶G薄层板、硅胶GF254薄层板、烘箱、二氧化硫测定仪。
7.3 性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.4 鉴别:7.4.1取本品粉末0.5g,加稀乙醇20ml,超声处理20分钟,滤过,滤液蒸干,残渣加稀乙醇1ml使溶解,作为供试品溶液。
另取板蓝根对照药材0.5g 同法制成对照药材溶液。
再取精氨酸对照品,加稀乙醇制成每1ml含0.5mg 的溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述三种溶液各1~2μl,分别点于同一硅胶G薄层板上,以正丁醇-冰醋酸-水(19:5:5)为展开剂,展开,取出,热风吹干,喷以茚三酮试液,在105℃加热至斑点显色清晰。
供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。
7.4.2取本品粉末1g,加80%甲醇20ml,超声处理30分钟,滤过,滤液蒸干,残渣加甲醇1ml使溶解,作为供试品溶液。
另取板蓝根对照药材1g同法制成对照药材溶液。
再取(R-S)-告依春对照品,加甲醇制成每1ml含0.5mg 的溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述三种溶液各5~10μl,分别点于同一硅胶GF254薄层板上,以石油醚(60~90℃)-乙酸乙酯(1:1)为展开剂,展开,取出,晾干,置紫外光灯(254nm)下检视。
板蓝根颗粒工艺规程

目录1.产品名称及剂型 (3)2.产品概述 (3)3.处方和依据 (3)4.生产工艺流程图 (3)5.生产操作过程及工艺条件 (5)6.工序质量监控 (6)7.原辅料、包装材料、中间体、成品质量标准 (7)8.消耗定额及物料平衡 (7)9.主要设备一览表 (8)10.工艺卫生要求 (9)11.技术安全及劳动保护 (9)12.劳动组织、定岗定员、生产周期 (10)13.环境保护 (11)14.附录 (11)1.产品名称及剂型1.1.产品名称:板蓝根颗粒产品剂型:颗粒剂2.产品概述:2.1.品名:板蓝根颗粒2.2.产品特点:2.2.1.性状:本品为棕色或棕褐色颗粒;味甜、微苦。
2.2.2.功能主治:清热解毒。
用于病毒性感冒,咽喉肿痛。
2.2.3.用法用量:开水冲服,一次5~10g,一日3~4次。
2.2.4.规格:每袋装10克或5克。
2.2.5.包装规格:20袋/包×80包/箱。
贮藏:密封保存。
有效期:2年3.处方和依据.提取处方处方说明:基准处方产量:210-252g左右(为1000g颗粒所用的清膏量)批生产处方产量:136-163kg左右(为650kg颗粒所用的清膏量).制剂处方处方说明:基准处方理论产量:100袋(1000g颗粒)批生产处方理论产量:65000袋(650kg颗粒)处方依据:《中国药典》2010年版一部批准文号:国药准字Z4.生产工艺流程图提取工艺流程图制剂工艺流程图D 级洁净区 外包装区为一般生产区物料工序 检验入库5.生产操作过程及工艺条件药材炮制5.1.1 板蓝根:取原药材,除去杂质,洗净,切断,干燥,筛去碎屑药材炮制收率.提取5.3.1.领料:根据批生产指令领用板蓝根净药材,按《复核管理规程》复核名称、编号、合格证、数量等。
5.3.2.煎煮:按《煎煮、浓缩岗位标准操作规程》进行操作,将复核过的板蓝根净药材按下图表规定加入饮用水,进行煎煮并浓缩至相对密度达(70℃)以上。
板蓝根颗粒质量标准及检验操作规程
XXXXXXXXXXX 有限公司成品质量标准和检验操作规程1品名:1.1中文名:板蓝根颗粒 1.2汉语拼音:BaniangenKeli 2代码:3 取样文件编号:4依据:《中国药典》(2020版一部及四部 5 质量标准:6检验操作规程:6.1试药与试剂:十八烷基硅烷键合硅胶、甲醇、正丁醇、冰醋酸、水、茚三酮试液、板蓝根对照药材、L-脯氨酸对照品、精氨酸对照品、亮氨酸对照品、尿苷对照品、鸟苷对照品及腺苷对照品。
6.2仪器与用具:电子天平、水浴锅、干燥箱、超声波清洗器、硅胶G薄层板。
6.3性状:取本品适量,在自然光下目测形态和色泽,尝味,并记录结果。
6.4鉴别:(1)取本品适量2g(相当于饮片2.8g),研细,加乙醇10ml,超声处理30分钟,滤过,滤液浓缩至2ml,作为供试品溶液。
另取板蓝根对照药材0.5g,加乙醉20ml,同法制成对照药材溶液,再取L-脯氨酸对照品、精氨酸对照品、亮氨酸对照品,分别加乙醇制成每lml各含1mg的溶液,作为对照品溶液。
照薄层色谱法(通则0502)试验,吸取上述五种溶液各2〜5u l,分别点于同一硅胶G薄层板上,以正丁醇一冰醋酸一水(19:5:5)为展开剂,展开,取出,晾干,喷以茚三酮试液,在105r加热至斑点显色清晰,置日光下检视。
供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。
(2)取尿苷对照品、鸟苷对照品、(R,S)-告依春对照品及腺苷对照品,加5%甲醇制成每1ml含尿苷、鸟苷、(R,S)-告依春各20u g及腺苷25u g的混合溶液,作为对照品溶液,照<含量测定>项下的方法试验,吸取上述对照品溶液及<含量测定〉项下的供试品溶液各5-10u l,注入液相色谱仪,记录色谱图。
供试品色谱中,应呈现与对照品色谱峰保留时间相对应的色谱峰。
6.5检查:应符合颗粒剂项下有关的各项规定(附录54)。
6.6含量测定:6.6.1对照品溶液的制备取尿苷对照品、鸟苷对照品及腺苷对照品适量,精密称定,加5%甲醇制成每1ml含尿苷20u g,鸟苷20u g及腺苷25u g的混合溶液,即得。
板蓝根颗粒执行标准

板蓝根颗粒执行标准板蓝根颗粒是一种常见的中药材,具有清热解毒、抗病毒、抗炎等功效,被广泛应用于临床治疗。
为了保证板蓝根颗粒的质量和安全性,制定了相应的执行标准,以规范其生产过程和质量要求。
一、原料要求。
1. 板蓝根颗粒的原料应选用新鲜、无霉变、无虫蛀、无霉斑、无异物的板蓝根为原料。
2. 原料应符合《中华人民共和国药典》规定的品质标准。
二、生产工艺。
1. 原料处理,应将板蓝根进行清洗、除杂、晾干等处理,确保原料的干净和安全。
2. 提取工艺,采用适当的提取剂和工艺条件,进行板蓝根的提取工艺,确保有效成分的提取率和质量。
3. 干燥工艺,采用适当的干燥工艺,确保板蓝根颗粒的水分符合要求,且不影响有效成分的稳定性。
三、质量指标。
1. 外观,板蓝根颗粒应呈现均匀的颗粒状,无结块、异物和霉变现象。
2. 含量测定,板蓝根颗粒中有效成分的含量应符合国家标准规定的范围。
3. 溶出度,板蓝根颗粒在规定条件下的溶出度应符合国家标准规定的范围。
4. 微生物限度,板蓝根颗粒中细菌总数、霉菌和酵母菌数、大肠杆菌和沙门氏菌均应符合国家标准规定的限度要求。
5. 重金属、有害元素限量,板蓝根颗粒中重金属和有害元素的含量应符合国家标准规定的限量要求。
四、包装和储存。
1. 包装,板蓝根颗粒应采用符合食品包装卫生标准的包装材料,包装应牢固、密封良好,防潮、防污染。
2. 标签,包装上应标注产品名称、规格、生产日期、保质期、生产企业名称、生产许可证编号等信息。
3. 储存,板蓝根颗粒应储存在阴凉、干燥、通风、无异味的环境中,远离有害气体和阳光直射。
五、执行标准依据。
1. 《中华人民共和国药典》。
2. 国家药品监督管理局颁布的相关法规和标准。
3. 国家食品药品监督管理局颁布的相关法规和标准。
六、结论。
板蓝根颗粒执行标准的制定,对于保障板蓝根颗粒的质量和安全性具有重要意义。
各生产企业应严格按照执行标准的要求进行生产,确保产品质量稳定、安全可靠,为广大患者提供优质的药品保障。
板蓝根颗粒质量标准

板蓝根颗粒质量标准板蓝根颗粒是一种常见的中药材,具有清热解毒、抗病毒、抗菌等功效,被广泛用于感冒、流感等疾病的预防和治疗。
而对于板蓝根颗粒的质量标准,也是大家非常关注的一个问题。
本文将对板蓝根颗粒的质量标准进行介绍,以便消费者更加了解该产品。
首先,板蓝根颗粒的质量标准应符合国家药典的规定。
国家药典是我国药品质量的权威标准,对于板蓝根颗粒的质量标准有着明确的规定,包括原料的选取、加工工艺、质量控制等方面。
生产厂家在生产过程中应严格按照国家药典的规定进行操作,确保产品的质量符合标准。
其次,板蓝根颗粒的质量标准还应包括对原料的要求。
板蓝根是板蓝根颗粒的主要原料,其质量直接影响着板蓝根颗粒的质量。
优质的板蓝根应该具有外观完整、无虫蛀、无霉变、色泽鲜艳等特点。
生产厂家在选取原料时应严格按照质量标准进行筛选,确保原料的质量符合要求。
另外,板蓝根颗粒的质量标准还应包括对生产工艺的要求。
生产工艺直接关系着产品的质量稳定性和安全性。
生产厂家应建立健全的生产工艺流程,严格控制生产过程中的各个环节,确保产品的质量稳定。
同时,应加强对生产设备的维护和保养,确保生产设备的正常运转,避免因设备原因导致产品质量问题。
最后,板蓝根颗粒的质量标准还应包括对成品的检验要求。
生产厂家应建立健全的质量检验体系,对成品进行全面检验,确保产品的质量符合标准。
对于不合格产品,应及时进行处理,避免流入市场。
综上所述,板蓝根颗粒的质量标准涉及到原料选取、生产工艺、质量控制等多个方面,生产厂家应严格按照国家药典的规定进行生产,确保产品的质量稳定。
消费者在购买板蓝根颗粒时,也应选择正规渠道购买,以确保产品的质量和安全性。
希望本文对大家对板蓝根颗粒的质量标准有所了解,谢谢阅读。
板蓝根颗粒的制备及质量考察

实验一板兰根颗粒的制备及质量考察一、实验目的1.学习中药颗粒剂的制备。
2.掌握颗粒剂的质量要求。
二、实验内容1.稠膏的制备。
2.颗粒剂的制备。
3.质量检查。
三、实验原理中药颗粒剂是将药材加工成片或段,按具体品种规定的方法提取、过滤,滤液浓缩至规定相对密度的浓缩浸膏,加定量药物细粉、辅料或可溶性赋形剂,混匀、制成颗粒,干燥,即得。
颗粒用开水冲服。
加药粉或不溶性赋形剂制备的冲剂,冲化时浑浊;加可溶性赋形剂制备的颗粒剂,冲化时澄清。
工艺流程中药提取浓缩醇沉回收乙醇制粒干燥包装四、实验材料与制备1、实验设备与仪器电炉、浓缩设备、16目金属筛、自封塑料袋等。
2、实验材料与试剂板蓝根、乙醇、白砂糖、糊精、纱布。
3、实验前准备(1)将板蓝根加工成片或段,也可直接采用饮片。
(2)将白砂糖粉碎成细粉。
五、实验步骤1、制法(1)稠膏的制备取粉碎成寸段的板蓝根80g,加水煎煮二次。
第一次加水至400-450mL,煮45-60min,第二次加300-350mL水,煮30-45分钟,合并二次煎液,用双层纱布过滤,将合并的药液进行浓缩。
先直火加热,浓缩到一定稠度时,再改用水浴低温蒸发(或旋转蒸发仪式),收膏的浓度为1:1,即1g清膏相当于中草药1g。
将清膏中加入乙醇,使含醇量达60%,搅匀,静置使沉淀,静置3~4h后,取上清液回收乙醇,浓缩至相对密度为1.30~1.33(80℃)的稠膏。
(2)颗粒剂的制备按稠膏1份,蔗糖1份,糊精1.7-2份混合均匀,制成饮材,过16目尼龙筛制粒,在60~90℃进行干燥,必要时通过16目筛,使颗粒均整一致,把干燥好的颗粒分状于塑料袋中,在阴凉干燥处保存。
2、质量检查依照《中华人民共和国药典2005年版》一部板蓝根颗粒项下的有关规定,检测如下项目。
(1)鉴别紫外灯检:取本品0.5克,加水5毫升使溶解,静置取上清液点于滤纸上,晾干,置紫外灯365nm下观察,斑点显紫色。
茚三酮检:取本品0.5克,加水10毫升使溶解,滤过,取滤液1mL,加茚三酮试液0.5mL到沸水浴中加热数分钟,溶液显蓝紫色。
板蓝根质量标准及检验操作规程

XXXXXXX有限公司原料质量标准及检验操作规程1 品名:1.1 中文名:板蓝根1.2 汉语拼音:Banlangen2 代码:3 取样文件编号:4 检验方法文件编号:5 依据:《中国药典》(2020年版一部)。
6 质量标准:7 检验操作规程:7.1试药与试剂:稀乙醇、板蓝根对照药材、(R-S)-告依春对照品、甲醇、石油醚(60~90℃)、乙酸乙酯、盐酸、精氨酸对照品、羧甲基纤维素钠、正丁醇、冰醋酸、茚三酮试液、水。
7.2仪器与用具:显微镜、电子天平、三用紫外分析仪、恒温鼓风干燥箱、超声波清洗器、水浴锅、硅胶G薄层板、硅胶GF254薄层板。
7.3性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.4鉴别:7.4.1取本品横切面制片显微镜(10×10)观察组织结构特征。
7.4.2取本品粉末0.5g,加稀乙醇20ml,超声处理20分钟,滤过,滤液蒸干,残渣加稀乙醇1ml使溶解,作为供试品溶液。
另取板蓝根对照药材0.5g 同法制成对照药材溶液。
再取精氨酸对照品,加稀乙醇制成每1ml含0.5mg 的溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述三种溶液各1~2μl,分别点于同一硅胶G薄层板上,以正丁醇-冰醋酸-水(19:5:5)为展开剂,展开,取出,热风吹干,喷以茚三酮试液,在105℃加热至斑点显色清晰。
供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。
7.4.3取本品粉末1g,加80%甲醇20ml,超声处理30分钟,滤过,滤液蒸干,残渣加甲醇1ml使溶解,作为供试品溶液。
另取板蓝根对照药材1g同法制成对照药材溶液。
再取(R-S)-告依春对照品,加甲醇制成每1ml含0.5mg的溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述三种溶液各5~10μl,分别点于同一硅胶GF254薄层板上,以石油醚(60~90℃)-乙酸乙酯(1:1)为展开剂,展开,取出,晾干,置紫外光灯(254nm)下检视。
板蓝根质量标准及检验操作规程
板蓝根质量标准及检验操作规程一、建立目的:建立原料检验标准操作规程及质量标准,以保证检验数据的真实性、可靠性。
二、适用范围:适用于原料的检验项目、限度和操作方法。
三、责任者:质量部负责人、检验员。
四、正文内容:板蓝根BanlangenISATIDIS RADIX本品为十字花科植物菘蓝Isatis in,digotica Fort.的干燥根。
秋季采挖,除去泥沙,晒干。
【性状】本品呈圆柱形,稍扭曲,长10~20cm,直径0.5~lcm。
表面淡灰黄色或淡棕黄色,有纵皱纹、横长皮孔样突起及支根痕。
根头略膨大,可见暗绿色或暗棕色轮状排列的叶柄残基和密集的疣状突起。
体实,质略软,断面皮部黄白色,木部黄色。
气微,味微甜后苦涩。
【鉴别】(1)本品横切面:木栓层为数列细胞。
栓内层狭。
韧皮部宽广,射线明显。
形成层成环。
木质部导管黄色,类圆形,直径约至80μm;有木纤维束。
薄壁细胞含淀粉粒。
(2)取本品粉末0.5g,加稀乙醇20ml,超声处理20分钟,滤过,滤液蒸于,残渣加稀乙醇1ml使溶解,作为供试品溶液。
另取板蓝根对照药材0.5g,同法制成对照药材溶液。
再取精氨酸对照品,加稀乙醇制成每1ml含0.5mg的溶液,作为对照品溶液。
照薄层色谱法(附录ⅥB)试验,吸取上述三种溶液各1~2μl,分别点于同一硅胶G薄层板上,以正丁醇-冰醋酸-水(19:5:5)为展开剂,展开,取出,热风吹于,喷以茚三酮试液,在105℃加热至斑点显色清晰。
供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。
(3)取本品粉末lg,加80%甲醇20ml,超声处理30分钟,滤过,滤液蒸干,残渣加甲醇1ml使溶解,作为供试品溶液。
另取板蓝根对照药材lg,同法制成对照药材溶液。
再取(R,S)-告依春对照品,加甲醇制成每1ml含0.5mg的溶液,作为对照品的溶液。
照薄层色谱法(附录ⅥB)试验,吸取上述三种溶液各5~lOμl,分别点于同一硅胶GF254薄层板上,以石油醚(60~90℃)-乙酸乙酯(1:1)为展开剂,展开,取出,晾干,置紫外光灯(254nm)下检视。
板蓝根颗粒中间产品质量标准

依据:《板蓝根颗粒质量标准》,产品质量的稳定性考察。
内容:
1板蓝根颗粒稠膏
1.1性状:本品为棕褐色的稠膏。
1.2检查
1.2.1相对密度:1.25~1.30 (60℃±5℃测定,用比重计)。
1.2.2溶化性:搅拌5分钟,应全部溶化,且不得有焦屑等异物。
2 颗粒
2.1 性状:本品为浅棕黄色至棕褐色的颗粒;味甜、微苦或味微苦(无糖型)。
2.2 检查
2.2.1粒度:不得过7.0%。
2.2.2水分:不得过4.0%(快速水分测定法)。
2.2.3溶化性:搅拌5分钟,应全部溶化,且不得有焦屑等异物。
3 分装
3.1装量差异:(10g)±
4.5%,(5g)±6.5%,(无糖型)(3g)±6.5%。
10袋中,超出
限度的不得多于2袋,并不得有1袋超出限度一倍。
3.2封口质量:平整严密,无漏气,无皱折。
3.3印字质量:产品批号印字清晰无误。
3.4切割质量:准确,文字内容完整无误。
4包装:产品批号、生产日期、有效期印字清晰;装量准确,每件数量应为:10克×20袋×60包、10克×25袋×60包、10克×18袋×60包、5克×20袋×100包
或3克×20袋×100盒;封口严密,打包端正(打包上下偏差应不得过1cm),松
紧适度。
板蓝根颗粒2020版药典标准

板蓝根颗粒2020版药典标准
板蓝根颗粒是一种中药材,其制备和使用需要遵循药典标准。
根据2020年版《中华人民共和国药典》的相关规定,板蓝根颗粒的
药典标准主要包括以下几个方面:
1. 原料药的要求,板蓝根颗粒的原料药应选用优质的板蓝根,
应符合《中华人民共和国药典》中对板蓝根的品质要求,包括外观、理化性质、杂质和微生物等方面的指标。
2. 加工制备的要求,板蓝根颗粒的加工制备应符合药典中对中
药制剂的一般要求,包括制备工艺、质量控制、包装储存等方面的
规定。
3. 质量标准,药典对板蓝根颗粒的质量标准包括外观、理化性质、含量测定、溶出度、微生物限度等指标,确保产品的质量稳定
和安全性。
4. 检验方法,药典中还规定了板蓝根颗粒质量控制的检验方法,包括对原料药和成品的检验方法,确保产品符合标准要求。
总的来说,根据2020年版《中华人民共和国药典》的规定,板蓝根颗粒的药典标准主要涉及原料药的选用、加工制备、质量标准和检验方法等方面,以确保其质量稳定、安全有效。
这些标准的遵循对于保障板蓝根颗粒的药效和安全性具有重要意义。
1.板蓝根颗粒微生物限度检查检验方法验证方案(2015年版)

1.板蓝根颗粒微生物限度检查检验方法验证方案(2015年版)G M P文件湖北****药业有限公司1.概述1.1板蓝根颗粒是《中国药典》2015年版一部品种,批准文号:国药准字Z42020660,其处方由板蓝根组成,具有清热解毒,凉血利咽之功效,用于肺胃热盛所致的咽喉肿痛、口咽干燥、腮部肿胀;急性扁桃体炎、腮腺炎见上述证候者。
有效期:18个月。
1.2根据剂型与产品处方判断,板蓝根颗粒的微生物限度检查内容应包括需氧菌总数计数、霉菌和酵母菌总数计数、大肠埃希菌检查;根据板蓝根颗粒的成分和历史验证数据分析,该产品无明显的抑菌活性,拟采用“平皿法”进行微生物限度检查,采用“常规法”进行控制菌检查。
2.目的确认所采用的方法适用于该产品的微生物计数,以确保测定方法的可靠性,确保检验结果的准确可靠。
若检验程序或产品发生变化可能影响检验结果时,计数方法应重新进行适用性试验。
3.依据《中国药典》2015年版四部“非无菌产品微生物限度检查:微生物计数法”、“非无菌产品微生物限度检查:控制菌检查法”、“非无菌产品微生物限度标准”。
4.范围本验证方案适用于公司板蓝根颗粒微生物限度检查检验方法的适用性试验。
5.职责5.1验证领导小组5.1.1负责验证方案的审批。
5.1.2负责验证的协调工作,以保证本验证方案规定项目的顺利实施。
5.1.3负责验证数据及结果的审核。
5.1.4负责验证报告的审批。
5.1.5负责发放验证证书。
5.2质量部5.2.1负责验证所需的培养基、样品、菌液、缓冲液等的准备。
5.2.2负责取样及对样品的检验。
5.3项目验证小组5.3.1负责拟订验证方案。
5.3.2负责验证方案的实施和收集各项验证试验记录,并对试验结果进行分析后,起草验证报告,报验证领导小组。
6.验证实施条件6.1验证方案培训:在验证实施前,应对参与验证的人员进行验证方案以及与验证相关的文件进行培训,确保相关人员掌握了验证的相关要求与知识。
6.2微生物限度检测室:检验所使用的检测室应经过HVAC系统确认,并符合要求。
板蓝根检测标准

板蓝根检测标准
测定周期:7-15个工作日
测定费用:实验室工程师会根据检测项目及实验复杂程度进行报价。
板蓝根测定范围
板蓝根颗粒,兽用板蓝根,中药饮片板蓝根,板蓝根注射液,板蓝根软胶囊等。
板蓝根测定项目
含量测定,水分测定,多糖测定,粒度测定,药典测定,成分测定,抑菌作用测定,有机酸测定,图谱测定,总糖测定,氨基酸测定,生物碱测定,告依春测定,蔗糖测定,种子发芽率测定,灰分测定,有效成分测定,干燥失重测定,二氧化硫测定等。
百检-板蓝根测定标准
DB62/T 1491-2014陇南市板蓝根生产技术规程
DB62/T 2726-2016花椒与板蓝根间作种植技术规程
检测报告有哪些作用?
1、改善产品质量使用。
(通过检测报告数据,发现自身产品问题所在,提高产品质量,降低生产成本)
2、产品质控使用,为产品性能下降找原因。
3、科研论文数据使用。
4、原因检测及性能检测使用。
5、产品性能改进数据使用。
(板蓝根颗粒)持续性稳定性考察方案
R-QC-018-01 GMP记录
成品稳定性考察方案
品名板蓝根颗粒包装规格20袋/包规格10g/袋
考察目的在成品有效期内监控已上市药品的质量,以确保成品可以在标示的贮存条件下贮存,符合质量标准的各项要求,保证用药人员的安全。
考察批次3批计划取样数量10袋/次;4包/批考察类型□加速试验考察□常规条件下长期稳定性考察
考察项目外观、性状、粒度、水分、微生物限度。
检验方法依据板蓝根颗粒内控质量标准及检验规程
合格标准1、外观:应干燥、颗粒均匀、无吸潮、结块、潮解等现象。
2、性状:本品为浅棕黄色至棕褐色的颗粒;味甜、微苦。
3、粒度:不能通过一号筛与能通过五号筛的总和,不得过13%。
4、水分:应≤5.0%。
5、微生物限度:细菌总数:≤800cfu/g 霉菌、酵母菌总数:≤80cfu/g
大肠埃希菌:不得检出。
活螨:不得检出。
贮存条件常温下贮存(温度:10-30℃湿度:≤75%)样品包装密封
描述
内包装封口严密,无漏气现象。
样品形式市售包装,置于产品稳定性留样柜中。
稳定性考察方法将样品置于温度10~30℃;相对湿度≤75%的条件下放置48个月。
第一年每3个月取样一次,分别于0个月、3个月、6个月、9个月、12个月取样。
12个月以后,分别于18个月、24个月、36个月、48个月取样。
按稳定性重点考察项目进行检测。
起草人日期年月日审核人日期年月日批准人日期年月日。
板蓝根颗粒中间体质量标准及检验操作规程
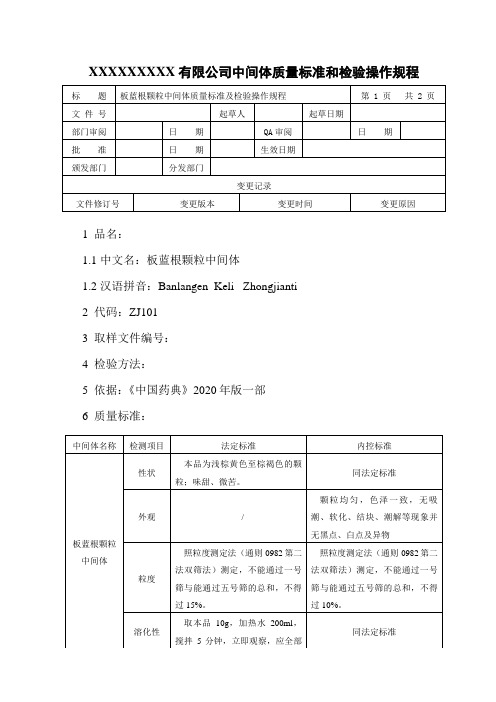
XXXXXXXXX有限公司中间体质量标准和检验操作规程1 品名:1.1 中文名:板蓝根颗粒中间体1.2 汉语拼音:Banlangen Keli Zhongjianti2 代码:ZJ1013 取样文件编号:4 检验方法:5 依据:《中国药典》2020年版一部6 质量标准:7 检验操作规程7.1仪器与用具:一号筛、五号筛、电子天平、烘箱、称量瓶。
7.2检查:7.2.1板蓝根颗粒中间体:7.2.1.1性状:取本品,在自然光下目测颜色及形态、尝味,并记录结果。
7.2.1.2 外观:颗粒均匀,色泽一致,无吸潮、软化、结块、潮解等现象并无黑点、白点及异物。
7.2.1.2粒度:照粒度测定法(附录52)第二法,双筛分法测定,不能通过一号筛与能通过五号筛的总和,不得过10%。
7.2.1.3溶化性:取本品10g,加热水200ml,搅拌5分钟,立即观察,应全部溶化或轻微浑浊。
(附录54)7.2.1.4水分:照水分测定法(附录15)测定,不得过5.0%。
7.3 含量测定:7.3.1 对照品溶液的制备取尿苷对照品、鸟苷对照品及腺苷对照品适量,精密称定,加5%甲醇制成每1ml含尿苷20μg,鸟苷20μg及腺苷25μg的混合溶液,即得。
7.3.2 供试品溶液的制备取装量差异项下的本品,研细,取适量(约相当于饮片1.4g),精密称定,置具塞锥形瓶中,精密加入5%甲醇10ml,密塞,称定重量,超声处理(功率500W,频率40kHz)5分钟,放冷,再称定重量,用5%甲醇溶液补足减失的重量,摇匀,滤过,取续滤液,即得。
7.3.3 测定法分别精密吸取对照品溶液与供试品溶液各5~10μl,注入液相色谱仪,测定,即得。
本品每袋含板蓝根以尿苷(C9H12N2O6)、鸟苷(C10H13N5O5)、腺苷(C10H13N5O4)总量计不得少于0.80mg。
GC-YL-10710板蓝根检验操作规程

f-------------------------稀释体积。
W样
式中:
W0 ----------- 坩埚重量(g)。
W1----------- 坩埚与灰分的重量(g)。
W样----------- 样品的重量(g)。
二氧化硫残留量:照二氧化硫残留量测定法(通则2331)测定,不得过150mg/kg
仪器与试剂:电热套、竖式回流冷凝管、磁力搅拌器、分析天平、甲基红乙醇溶液指示剂、氢氧化钠滴定液滴、盐酸溶液(6mol/L)等
计算公式:
二氧化硫残留量(mg/kg)=(V供-V空)×C×0.032×106
W供
式中V供为供试品溶液消耗氢氧化钠滴定液的体积,ml;
V空为空白消耗氢氧化钠滴定液的体积,ml;
c 为氢氧化钠滴定液摩尔浓度,mol/L;
W供为供试品的重量,g。
0.032为lm l氢氧化钠滴定液(lmol/L)相当的二氧化硫的质量,g;
仪器:粉碎机、药筛、分析天平、坩埚、箱式电阻炉等。
方法:取供试品2~3g,过二号筛混合均匀后,置炽灼至恒重的坩埚中称定重量,缓缓炽热,注意避免燃烧,至完全炭化时,逐渐升高温度至500~600℃,使完全灰化至恒重。根据残渣重量,计算供试品中总灰分的含量(%)。
计算公式:
W1-W0
总灰分% =×100%
计算公式:
酸不溶性灰分% =
W样
式中:
W0----------- 坩埚重量(g)。
W1-----------酸不溶性灰分与坩埚的重量(g)。
W样----------- 样品的重量(g)。
【浸出物】照水溶性浸出物测定法(通则2201)项下的冷浸法测定,不得少于25.0%。
QS-中3052-02板蓝根颗粒_转自DOC

板蓝根颗粒中间产品内控质量标准
【制法】取板蓝根1400g,加水煎煮二次,第一次2 小时,第二次1小时,煎液滤过,滤液合并,浓缩至相对密度为1.20(50℃),加乙醇使含醇量为60%,静置使沉淀,取上清液,回收乙醇并浓缩至适量。
取稠膏,加入适量的蔗糖和糊精,制成颗粒,干燥,制成1000g;或加入适量的糊精或适量的糊精和甜味剂,制成颗粒,干燥,制成600g,即得。
【性状】本品为棕色或棕褐色的颗粒;味甜、微苦(标准规定:为棕色或棕褐色的颗粒;味甜、微苦或味微苦(无蔗糖))。
【取样规定】取样方法、取样量、取样点按取样SOP操作。
颗粒:
【检查】
4.1粒度按粒度测定法(附录XI B第二法,双筛法)测定,不能通过一号筛与能通过五号筛的总和,不得过12%。
4.2水分按“水分测定标准操作程序”测定,不得过4.0%。
4.3溶化性取供试品1袋(多剂量包装取10g),加热水200ml,搅拌5分钟,立即观察,应全部溶化或呈混悬状。
可溶颗粒应全部溶化,允许有轻微浑浊;混悬颗粒应能混悬均匀。
不得有焦屑等。
4.4装量差异按“装量差异检查标准操作程序”检查,限度:±5%以内,超出限度的不得多于2袋,并不得有1袋超出限度1倍。
南板蓝根质量标准及检验操作规程

甘肃亚兰药业有限公司成品质量标准及检验操作规程
1 品名:
1.1 中文名:南板蓝根
1.2 汉语拼音:Nanbanlangen
2 代码:
3 取样文件编号:
4 检验方法文件编号:
5 依据:《中国药典》(2020年版一部)。
6 质量标准:
7 检验操作规程:
7.1 试药与试剂:三氯甲烷、靛蓝对照品、靛玉红对照品、石油醚、乙酸乙酯、乙醇、氢氧化钠滴定液、甲基红乙醇溶液指示剂。
7.2 仪器与用具:显微镜、硅胶G板、烘箱、马弗炉、中药二氧化硫测定仪。
7.3 性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.4 鉴别:
7.4.1取本品制片置10×10显微镜下,做显微观察。
7.4.2取本品粉末2g,加三氯甲烷20ml,加热回流1小时,滤过,滤液浓縮至2ml,作为供试品溶液。
另取靛蓝对照品、靛玉红对照品,加三氯甲烷制成每lml各含0.lmg的混合溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述两种溶液各20µl,分别点于同一硅胶G薄层板上,以石油醚(60~90℃)三氯甲烷-乙酸乙酯(1:8:1)为展开剂,展开,取出,晾干,立即检视。
供试品色谱中,在与对照品色谱相应的位置上,显相同的蓝色和
紫红色斑点。
7.5 检查:
7.5.1水分:不得过12.0%(附录15第二法)。
7.5.2总灰分:不得过10.0%(附录17)。
7.5.3二氧化硫残留量:照二氧化硫残留量测定法(附录58)测定,不得过150mg/kg。
7.6 浸出物:照醇溶性浸出物测定法(附录19)项下的热浸法测定,用稀乙醇作溶剂,不得少于13.0%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
XXXXXXXXXXX有限公司成品质量标准和检验操作规程
1 品名:
1.1 中文名:板蓝根颗粒
1.2 汉语拼音:Banlangen Keli
2 代码:
3 取样文件编号:
4 依据:《中国药典》(2020版一部及四部)
5 质量标准:
6 检验操作规程:
6.1 试药与试剂:十八烷基硅烷键合硅胶、甲醇、正丁醇、冰醋酸、水、茚
三酮试液、板蓝根对照药材、L-脯氨酸对照品、精氨酸对照品、亮氨酸对照品、尿苷对照品、鸟苷对照品及腺苷对照品。
6.2 仪器与用具:电子天平、水浴锅、干燥箱、超声波清洗器、硅胶G薄层板。
6.3 性状:取本品适量,在自然光下目测形态和色泽,尝味,并记录结果。
6.4 鉴别:(1)取本品适量2g(相当于饮片2.8g),研细,加乙醇10ml,超声处理30分钟,滤过,滤液浓缩至2ml,作为供试品溶液。
另取板蓝根对照药材0.5g,加乙醉20ml,同法制成对照药材溶液,再取L-脯氨酸对照品、精氨酸对照品、亮氨酸对照品,分别加乙醇制成每lml各含1mg的溶液,作为对照品溶液。
照薄层色谱法(通则0502)试验,吸取上述五种溶液各2~5μl,分别点于同一硅胶G薄层板上,以正丁醇一冰醋酸—水(19:5:5)为展开剂,展开,取出,晾干,喷以茚三酮试液,在105℃加热至斑点显色清晰,置日光下检视。
供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。
(2)取尿苷对照品、鸟苷对照品、(R,S)-告依春对照品及腺苷对照品,加5%甲醇制成每1ml含尿苷、鸟苷、(R,S)-告依春各20μg及腺苷25μg的混合溶液,作为对照品溶液,照<含量测定>项下的方法试验,吸取上述对照品溶液及<含量测定>项下的供试品溶液各5-10μl,注入液相色谱仪,记录色谱图。
供试品色谱中,应呈现与对照品色谱峰保留时间相对应的色谱峰。
6.5 检查:应符合颗粒剂项下有关的各项规定(附录54)。
6.6 含量测定:
6.6.1 对照品溶液的制备
取尿苷对照品、鸟苷对照品及腺苷对照品适量,精密称定,加5%甲醇制成每1ml含尿苷20μg,鸟苷20μg及腺苷25μg的混合溶液,即得。
6.6.2 供试品溶液的制备
取装量差异项下的本品,研细,取适量(约相当于饮片1.4g),精密称定,
置具塞锥形瓶中,精密加入5%甲醇10ml,密塞,称定重量,超声处理(功率500W,频率40kHz)5分钟,放冷,再称定重量,用5%甲醇溶液补足减失的重量,摇匀,滤过,取续滤液,即得。
6.6.3 测定法
分别精密吸取对照品溶液与供试品溶液各5~10μl,注入液相色谱仪,测定,即得。
本品每袋含板蓝根以尿苷(C9H12N2O6)、鸟苷(C10H13N5O5)、腺苷(C10H13N5O4)总量计不得少于0.80mg。
