复合膜检验操作规程
药用复合膜、袋检验标准操作规程

药用复合膜、袋检验标准操作规程1. 目的规范药用复合膜、袋的检验操作。
2. 范围适用于药用复合膜、袋的检验操作。
3. 术语或定义N/A4. 职责质量控制部对本规程的实施负责。
5. 程序5.1 依据:国家药包材标准YBB00132002-2015。
5.2 外观:取本品适量,在自然光线明亮处,正视目测。
不得有穿孔、异物、异味、粘连、复合层间分离及明显损伤、气泡、皱纹、脏污等缺陷。
复合袋的热封部位应平整、无虚封。
5.2.1印刷:文字、图案清晰、完整,色彩均匀,无明显色差,套印准确。
5.2.3 文字内容:应与样稿一致。
5.2.4 用直尺测量复合膜的宽度,宽度≤200mm±1.5mm、宽度>200mm±2.0mm。
5.3 溶出物试验取本品适量,分别取内表面积为600cm2(分割成长3cm,宽0.3cm的小片)三份置具塞锥形瓶中,加水(70℃±2℃)、65%乙醇(70℃±2℃)、正己烷(58℃±2℃)200ml浸泡2小时后取出,放冷至室温,用同批试验用溶剂补充至原体积作为供试液,以同批水、65%乙醇、正己烷制备空白液,进行下列试验:5.3.1易氧化物精密量取水浸液20ml,精密加入高锰酸钾滴定液(0.002mol/L)20ml与稀硫酸1ml,煮沸3分钟,迅速冷却,加入碘化钾0.1g,在暗处放置5分钟,用硫代硫酸钠滴定液(0.01 mol/L)滴定,滴定至近终点时,加入淀粉指示液5滴,继续滴定至无色,另取水空白液同法操作,二者消耗硫代硫酸钠滴定液(0.01 mol/L)之差不得过1.5ml。
5.3.2重金属精密量取试验液20ml,加醋酸盐缓冲液(pH3.5)2ml,依法检测(中国药典2020年版通则0821第一法),含重金属不得过百万分之一。
5.3.3不挥发物分别精密量取水、65%乙醇、正己烷浸出液与空白各100ml置于已恒重的蒸发皿中,水浴蒸干,105℃干燥2小时,冷却后精密称定,水不挥发物残渣与空白液之差应不得过30.0mg;65%乙醇下挥发物残渣与其空白液残渣之差不得过30.0mg;正己烷不挥发物残渣与其空白液残渣之差不得过30.0mg5.4 微生物限度:取本品用开孔面积为20cm2的消毒过的金属模板压在内层面上,将无菌棉签用氯化钠注射液稍沾湿,在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置用2支棉签共擦抹10次,共擦抹5个位置100cm2。
复合检查项目

CPP膜
〓 生产前必须使用3.8达因的检验笔检测薄膜的电晕处理面是否适合复合。方法同 上。2,厚度用千分尺检查,3,宽度用卷尺测量。
PE光膜
〓 生产前必须使用3.8达因的检验笔检测薄膜的电晕处理面是否适合复合 。方法同上。2,厚度用千分尺检查,3,宽度用卷尺测量。 〓 在地板上摩擦膜面,找出镀铝的一面复在印刷膜上。 〓 用于尼龙膜的复合,袋子成品使用中有高温蒸煮水煮要求。用旧油墨 印刷的薄膜复合时注意反粘,如金色,表印刮刮银,印刷烘箱烘干,印好 后立刻复合。 用于BOPP(消光膜)膜的复合用胶。 〓 复合胶稀释使用,挥发较快,气味刺鼻。复合时不得用错稀料。 〓 胶辊表面光滑,无墨点,无杂物,无凸起和凹痕,长度应略小于印刷 图案版面0.5公分。发现压辊轴承损坏立即停机维修好后使用。 〓 根据需要干燥温度设置在45--70℃之间,注意因季节变化调整设置温 度,排风顺畅。大面积满面油墨一定要烘干,特别是尼龙膜,不干透会造 成很大损失,复合生产时容易产生气泡。 〓 按照标准穿膜路线穿行,不得穿错。复合工序接膜必须用黄胶带粘 贴,接膜时把两段膜割整齐,后膜压在前膜上印刷画面对齐,粘贴牢固。 平时教学员练习穿膜。
5
PET镀铝膜 蒸煮级胶水 普通胶水
6
稀料 复合胶辊
乙酯
7
8
干燥温度
温控器是否有效监测工作温度
9
接膜方法
印膜穿行路线和接膜方法
10
导线辊清洁 保养。
用洁净布蘸稀料清洁
〓 定期清洁导线辊,遇到胶水或油墨污染导线辊及时清洁,避免污染印 膜,底膜。无墨点,无杂物,无凸起和凹痕,滚筒转动灵活。
11
网线辊清洁 防止因网线辊清洁不良造成涂胶量变化 必须使用洗版液和铜丝刷清洁,网线辊磨损必须提前更换和重新处理。 保养
复合膜检验操作规程

1.适用范围本规程适用于进厂药品包装用复合膜的检验。
2.职责检验员:严格按检验操作规程进行检验。
QC主管:监督检查执行情况。
3.材质:由供应商提供材质检验合格报告书。
4.外观质量在自然光线下目视,距离为400mm左右,外观质量应符合下列规定:4.1.穿孔、异物、异味不允许有。
4.2.粘连、复合层间分离不允许有。
4.3.褶皱不允许有。
4.4.划伤、烫伤、气泡不允许有。
4.5.脱层不允许有。
4.6.油污、杂质不允许有。
4.7.卷面应缠紧、缠齐,端面应平整,不允许有塔层、错层,卷芯不得自由脱落或松动,不允许有严重碰伤及压陷。
4.8.每卷接头数应有牢固、明显的标记。
膜长<500m不多于1个,膜长≥500m不多于2个。
5.印刷质量5.1.刀丝、油墨、污染、涂层不均不允许有。
5.2.色泽要均匀,同批及不同批不允许有明显色差。
6.规格尺寸测定方法:将复合膜平铺于水平硬板上,用精度为0.5mm直尺测定,应符合要求。
(单位:mm)氯霉素片:宽度为120mm±1.5mm。
8.微生物限度8.1.供试液的制备用开口面积为20 cm2的消毒过的金属模板压在试样的内层面上,将无菌棉签用无菌生理盐水稍沾湿,在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置用2支棉签共擦抹10次。
共擦抹5个位置100 cm2。
每支棉签擦抹完后立即剪断,投入30ml 无菌生理盐水中。
待全部棉签均投入瓶中后,将瓶迅速摇晃1min,静置10min,即得1:1供试液。
8.2.操作方法:按《微生物限度检查SOP》(1302·005)检查。
8.3.判定8.3.1.若细菌总数≤1000个/100cm2,霉菌总数不超过100个/100cm2,大肠杆菌、活螨未检出,则判符合规定。
8.3.2.若任何一项指标超出规定,则判不符合规定。
9.取样:按《物料取样SOP》(1302·001)、GB2828取样。
(取样量1m)10.注意事项每批产品需与标准样张进行核对,并将随意抽取样品作为样张附于每批检验记录的后面。
药品包装用复合膜标准

药品包装用复合膜标准药品包装用复合膜是一种在医药行业中广泛使用的包装材料,其质量标准对于保障药品的质量和安全具有重要意义。
本标准旨在规定药品包装用复合膜的技术要求、试验方法、检验规则和标志、包装、运输、贮存等要求,以确保药品包装用复合膜的质量和安全性,保障药品的有效性和稳定性。
一、技术要求。
1. 外观质量,药品包装用复合膜应具有良好的透明度和光泽,无色差、气泡、皱纹、污渍等缺陷。
2. 物理性能,药品包装用复合膜应具有一定的拉伸强度、撕裂强度和破裂伸长率,以确保其在包装过程中不易损坏。
3. 化学性能,药品包装用复合膜应符合相关的卫生标准,不得含有对人体有害的物质,如重金属、有机溶剂等。
4. 热封性能,药品包装用复合膜应具有良好的热封性能,确保包装的密封性和防潮性。
5. 印刷性能,药品包装用复合膜应能够满足药品包装的印刷要求,印刷图案清晰、色彩饱满、不易脱落。
二、试验方法。
1. 外观检验,采用目测和光源透视等方法进行外观检验,确保药品包装用复合膜的外观质量符合要求。
2. 物理性能测试,采用拉伸试验机进行拉伸强度、撕裂强度和破裂伸长率的测试,确保其符合相关标准。
3. 化学性能测试,采用化学分析方法对复合膜中的有害物质进行检测,确保其不含有对人体有害的物质。
4. 热封性能测试,采用热封试验机对复合膜的热封性能进行测试,确保其能够满足包装的密封要求。
5. 印刷性能测试,采用印刷设备对复合膜进行印刷,检验其印刷效果是否符合要求。
三、检验规则和标志。
1. 对于合格的药品包装用复合膜,应在其包装上标注相关的质量标志,以示其合格性。
2. 对于不合格的药品包装用复合膜,应及时予以淘汰,并进行相应的处理,以免影响药品的质量和安全。
四、包装、运输、贮存。
1. 药品包装用复合膜应在包装过程中注意防潮、防晒、防污染,确保其质量不受影响。
2. 在运输和贮存过程中,应避免受潮、受热、受压,以免影响其使用性能和质量。
综上所述,药品包装用复合膜标准对于保障药品的质量和安全具有重要意义,各相关企业应严格按照标准要求进行生产和使用,以确保药品的有效性和稳定性,保障人民群众的用药安全。
(2021年整理)药品内包装用聚乙烯复合膜、袋检验标准操作规程

(完整版)药品内包装用聚乙烯复合膜、袋检验标准操作规程编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整版)药品内包装用聚乙烯复合膜、袋检验标准操作规程)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整版)药品内包装用聚乙烯复合膜、袋检验标准操作规程的全部内容。
(完整版)药品内包装用聚乙烯复合膜、袋检验标准操作规程编辑整理:张嬗雒老师尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布到文库,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是我们任然希望 (完整版)药品内包装用聚乙烯复合膜、袋检验标准操作规程这篇文档能够给您的工作和学习带来便利.同时我们也真诚的希望收到您的建议和反馈到下面的留言区,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请下载收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为 <(完整版)药品内包装用聚乙烯复合膜、袋检验标准操作规程> 这篇文档的全部内容。
标准操作规程目的:建立药品内包装用聚乙烯复合膜、袋的验收标准。
范围:用于中间体或原料包装用聚乙烯复合膜、袋。
责任者:采供部、仓管员、 QA、QC。
规程:1.分类和规格本标准使用于中间体、或原料药包装用聚乙烯复合膜、袋。
2.进厂聚乙烯复合膜必须核对厂家、批号,只能重经过供应商审计确认的生产厂家购入。
3。
重金属精密量取水浸液20ml,加醋酸盐缓冲液(pH3。
5)2ml,依法检查(中国药典2000年版二部附录VIII H 第一法),含重金属不得过1ppm.4.易氧化物精密量取水浸液20ml,精密加入高锰酸钾滴定液(0。
2015年版内包装材料检验操作规程
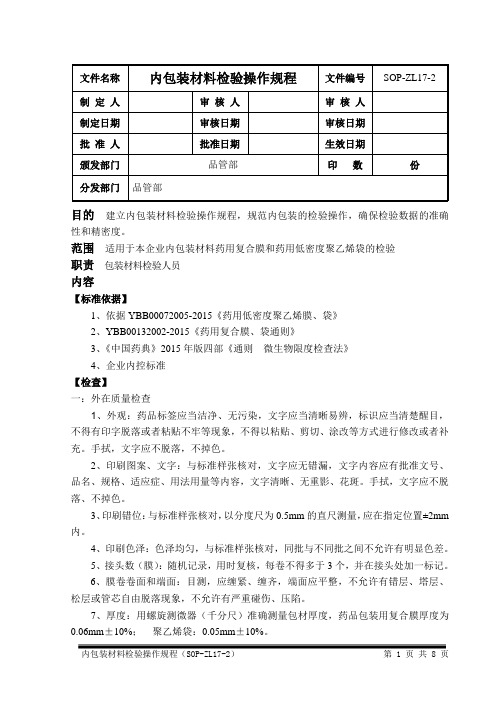
目的建立内包装材料检验操作规程,规范内包装的检验操作,确保检验数据的准确性和精密度。
范围适用于本企业内包装材料药用复合膜和药用低密度聚乙烯袋的检验职责包装材料检验人员内容【标准依据】1、依据YBB00072005-2015《药用低密度聚乙烯膜、袋》2、YBB00132002-2015《药用复合膜、袋通则》3、《中国药典》2015年版四部《通则微生物限度检查法》4、企业内控标准【检查】一:外在质量检查1、外观:药品标签应当洁净、无污染,文字应当清晰易辨,标识应当清楚醒目,不得有印字脱落或者粘贴不牢等现象,不得以粘贴、剪切、涂改等方式进行修改或者补充。
手拭,文字应不脱落,不掉色。
2、印刷图案、文字:与标准样张核对,文字应无错漏,文字内容应有批准文号、品名、规格、适应症、用法用量等内容,文字清晰、无重影、花斑。
手拭,文字应不脱落、不掉色。
3、印刷错位:与标准样张核对,以分度尺为0.5mm的直尺测量,应在指定位置±2mm 内。
4、印刷色泽:色泽均匀,与标准样张核对,同批与不同批之间不允许有明显色差。
5、接头数(膜):随机记录,用时复核,每卷不得多于3个,并在接头处加一标记。
6、膜卷卷面和端面:目测,应缠紧、缠齐,端面应平整,不允许有错层、塔层、松层或管芯自由脱落现象,不允许有严重碰伤、压陷。
7、厚度:用螺旋测微器(千分尺)准确测量包材厚度,药品包装用复合膜厚度为0.06mm±10%;聚乙烯袋:0.05mm±10%。
8、尺寸:用直尺准确测量,应符合企业内控标准。
9、抽样用合格判断方法:根据《辅料、包装材料取样操作规程》(SOP-ZL71-1)取样,按照以下方法判断9.1关键缺陷:●文字错误、有漏字现象、叠印、或印刷不完全、不清晰;●字体图案排版与标准样稿不一致;●材质技术不符合标准规定;9.2主要缺陷:●有污染,折皱;●套印误差≥0.5mm;9.3次要缺陷:●笔划不清晰,粗细不均匀;●印刷深浅不一致;●其他外观不合格;●同批印刷品颜色有明显差异二、外在质量检查1、外观1.1取本品适量,在自然光线明亮处,正视目测。
5004铝塑复合膜检验标准操作规程

陕西德福康制药有限公司1. 目的建立铝塑复合膜检验标准操作规程,规范操作。
2. 范围适用于铝塑复合膜的检验。
3.依据《国家包装容器(材料)标准YBB》4. 职责4.1 起草:QC 审核:QA 批准人:质量负责人4.2 QC 实施本规程。
4.3 QA 监督本规程的实施。
5. 内容产品代码:N0045.1 外观质量5.1.1 色泽均匀。
5.1.2 在自然光线明亮处,正视目测,不得有穿孔、异味、粘连、复合层分离及明显损伤、气泡、皱纹、脏污等缺陷。
复合袋的热封部位应平整、无虚封。
5.1.3 印刷内容与批准的样稿一致。
5.2 检查5.2.1规格尺寸5.2.1.1 试液及仪器一般实验仪器5.2.1.2 分析步骤5.2.2 机械性能(内层与次内层剥离强度)5.2.2.1 试液及仪器拉力测试仪5.2.2.2 分析步骤取膜适量,将样品宽度方向两端除去50mm,沿宽度方向均匀裁取纵、横向15mm宽的试样各5条(复和方向为纵向)。
沿试样长度方向,将复合层与基材预先剥开50mm,被剥开部分不得有明显损伤。
若试样不易剥开,可将试样一端约20mm浸入适当的溶剂(常用醋酸乙酯),待溶剂完全挥发,再进行剥离。
试样应在温度23±2℃,相对湿度50%±5%的环境中放置4小时以上,并在上述条件下进行试验。
将试样剥开部分的两端分别夹在试验机上、下夹具上,使试样剥开部的纵轴与上、下夹具中心连接重合,并松紧适宜,试验机以(300±50)mm/min速度,拉力方向与未剥开部分呈T型,记录各拉力值;取纵、横向平均值应符合下表规定。
5.2.3 热合强度5.2.3.1 试液及仪器一般实验仪器5.2.3.2 分析步骤取复合袋数个,从各个热合部位裁取15mm宽的试样10条。
至少从3个复合袋上裁取。
按塑料薄膜包装袋热合强度试验方法(QB/T2358-1998)的规定进行。
测得的值应符合上表规定。
5.2.4 溶剂残留量5.2.4.1 试液及仪器一般实验仪器5.2.4.2 分析步骤取样品适量,裁取内表面积0.2m2,将其迅速裁成10mm×30mm碎片,放入洁净的已在约80℃条件下预热过的500ml玻璃瓶中,用橡胶塞密封好后,和进样器一起送入(80±2)℃烘箱中,加热30分钟后,迅速地用预热好的进样器取1ml瓶中气体注入色谱仪中,照溶剂残留量法(中国药典2010年版附录Ⅷ P)测定,并计算。
5004铝塑复合膜质量标准

陕西德福康制药有限公司________________
1.目的建立铝塑复合膜质量标准。
2.范围内包材铝塑复合膜。
3.术语或定义 N/A
4.职责质量保证部、质量控制部
5.内容
5.1 产品名称
中文名称:铝塑复合膜
拼音名称:Lv Su Fuhemo
5.2 【标准依据】
《国家包装容器(材料)标准YBB00132002》
5.3定性和定量的限度要求
5.4【批准的供应商】生产商--
5.5 取样、检验方法或相关操作规程编号:检验方法见《铝塑复合膜(药用)标准检验操作规程》(SOP-QC5004-00),取样方法见《取样标准操作规程》(SOP-QA001-00)。
5.6【贮存条件和注意事项】密闭保存。
5.7 【复验期】二年
6.附件
N/A
7.参考或引用文件
7.1 《取样标准操作规程》SOP-QA001-00
7.2 《铝塑复合膜检验操作规程》SOP-QC5004-00
8.文件变更记载。
复合车间过程检验规范

定本规范。
二、适用范围:本规范适用于对复合工序的产品及工作质量进行检验及判定。
三、检验规范
计日而待也。
先帝知臣谨慎,故临崩寄臣以大事也。
受命以来,夙夜忧叹,恐托付不效,以伤先帝之明;故五月渡泸,深入不毛。
今南方已定,兵甲已足,当奖率三军,北定中原,庶竭驽钝,攘除奸凶,兴复汉室,还于旧都。
此臣所以报先帝而忠陛下之职分也。
至于斟酌损益,进尽忠言,则攸之、祎、允之任也。
愿陛下托臣以讨贼兴复之效,不效,则治臣之罪,以告先帝之灵。
若无兴德之言,则责攸之、祎、允等之慢,以彰其咎;陛下亦宜自谋,以咨诹善道,察纳雅言,深追先帝遗诏。
臣不胜受恩感激。
今当远离,临表涕零,不知所言。
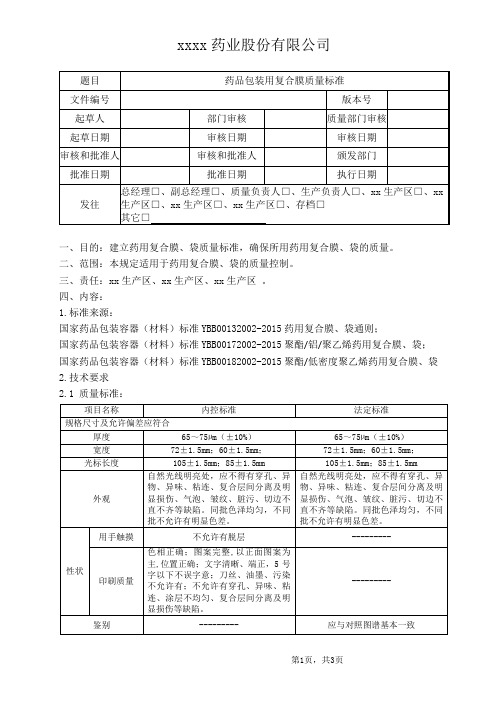
药品包装用复合膜质量标准
xxxx药业股份有限公司
一、目的:建立药用复合膜、袋质量标准,确保所用药用复合膜、袋的质量。
二、范围:本规定适用于药用复合膜、袋的质量控制。
三、责任:xx生产区、xx生产区、xx生产区。
四、内容:
1.标准来源:
国家药品包装容器(材料)标准YBB00132002-2015药用复合膜、袋通则;
国家药品包装容器(材料)标准YBB00172002-2015聚酯/铝/聚乙烯药用复合膜、袋;国家药品包装容器(材料)标准YBB00182002-2015聚酯/低密度聚乙烯药用复合膜、袋2.技术要求
2.1 质量标准:
2.2不同缺陷的允许限度:
3.贮存条件:用药用低密度聚乙烯袋密封,保存于清洁,通风处。
4.相关标准操作规程:药用复合膜、袋检验操作规程(SOP-ZL-JG(BC)-005)、物料取样标准操作规程(SOP-ZL-QA-001)。
5.企业统一指定的物料名称:药用复合膜、袋。
6.内部使用的物料代码:详见产品所对应的药用复合膜、袋物料代码。
7.经批准的供应商:见合格供应商目录。
8.印刷包装材料的实样或样稿:见包装材料样稿。
9.注意事项:标准中未明确的项目,以包材标准样张为准,每批产品需与标准样张进行核对。
10.复验期:执行“物料有效期及复验期管理规程(SMP-WL-008)”相关规定。
11.文件附件:共0份。
12.修订及变更历史:。
2015年版内包装材料检验操作规程

目的建立内包装材料检验操作规程,规范内包装的检验操作,确保检验数据的准确性和精密度。
范围适用于本企业内包装材料药用复合膜和药用低密度聚乙烯袋的检验职责包装材料检验人员内容【标准依据】1、依据YBB00072005-2015《药用低密度聚乙烯膜、袋》2、Y BB00132002-2015《药用复合膜、袋通则》3、《中国药典》2015年版四部《通则微生物限度检查法》4、企业内控标准【检查】一:外在质量检查1、外观:药品标签应当洁净、无污染,文字应当清晰易辨,标识应当清楚醒目,不得有印字脱落或者粘贴不牢等现象,不得以粘贴、剪切、涂改等方式进行修改或者补充。
手拭,文字应不脱落,不掉色。
2、印刷图案、文字:与标准样张核对,文字应无错漏,文字内容应有批准文号、品名、规格、适应症、用法用量等内容,文字清晰、无重影、花斑。
手拭,文字应不脱落、不掉色。
3、印刷错位:与标准样张核对,以分度尺为0.5mm的直尺测量,应在指定位置±2mm 内。
4、印刷色泽:色泽均匀,与标准样张核对,同批与不同批之间不允许有明显色差。
5、接头数(膜):随机记录,用时复核,每卷不得多于3个,并在接头处加一标记。
6、膜卷卷面和端面:目测,应缠紧、缠齐,端面应平整,不允许有错层、塔层、松层或管芯自由脱落现象,不允许有严重碰伤、压陷。
7、厚度:用螺旋测微器(千分尺)准确测量包材厚度,药品包装用复合膜厚度为0.06mm土10%; 聚乙烯袋:0.05mm土10%。
8、尺寸:用直尺准确测量,应符合企业内控标准。
9、抽样用合格判断方法:根据《辅料、包装材料取样操作规程》(S0P-ZL71-1 )取样,按照以下方法判断9.1关键缺陷:•文字错误、有漏字现象、叠印、或印刷不完全、不清晰;•字体图案排版与标准样稿不一致;•材质技术不符合标准规定;9.2主要缺陷:•有污染,折皱;•套印误差》0.5mm9.3次要缺陷:•笔划不清晰,粗细不均匀;•印刷深浅不一致;•其他外观不合格;•同批印刷品颜色有明显差异二、外在质量检查1、外观1.1取本品适量,在自然光线明亮处,正视目测。
复合机操作规程

复合机操作规程一、引言复合机是一种常用的办公设备,用于将纸质文件与电子文件进行复合,提高文件的保存和传输效率。
为了保证复合机的正常运行和操作的安全性,制定本操作规程。
二、操作准备1. 确保复合机所需的耗材充足,如复合膜、纸张等。
2. 检查复合机的电源线是否连接稳定,并确保电源开关处于关闭状态。
3. 清理复合机的工作台面,确保无杂物和灰尘。
三、复合机的开机操作1. 检查复合机的电源线是否连接稳定,并确保电源开关处于关闭状态。
2. 打开电源开关,等待复合机启动。
3. 确认复合机显示屏上的操作界面正常显示。
四、复合机的文件复合操作1. 将要复合的纸质文件放置在复合机的进纸口处,调整文件的位置,确保对齐。
2. 打开复合机的复合膜仓,将复合膜取出并展开。
3. 将复合膜平整地覆盖在纸质文件的上方,确保复合膜与文件的边缘对齐。
4. 关闭复合膜仓,确保复合膜被坚固地固定在纸质文件上。
5. 按下复合机的复合按钮,开始进行文件复合操作。
6. 等待复合机完成复合操作,复合完成后复合机会自动住手。
五、复合机的文件剪切操作1. 将复合完成的文件从复合机的出纸口处取出。
2. 将要剪切的部份放置在复合机的剪切口处,调整文件的位置,确保对齐。
3. 按下复合机的剪切按钮,开始进行文件剪切操作。
4. 等待复合机完成剪切操作,剪切完成后复合机会自动住手。
六、复合机的关机操作1. 确保复合机的复合膜仓已经关闭。
2. 按下复合机的关机按钮,等待复合机彻底关闭。
3. 断开复合机的电源线。
七、操作注意事项1. 在操作复合机时,应注意手部安全,避免手指被夹伤。
2. 在复合机运行过程中,不要将手或者其他物品放入复合机的进纸口或者剪切口。
3. 在复合机操作过程中,不要随意拔插电源线,以免损坏设备或者导致触电事故。
4. 在复合机操作过程中,如遇到异常情况或者故障,请及时住手操作并联系维修人员进行处理。
八、维护保养1. 定期清理复合机的进纸口和剪切口,以保持畅通。
食品包装用复合膜、袋生产工艺操作规程

包装用BOPA/LDPE复合膜、袋生产工艺操作规程一、本操作规程适用于本公司食品包装用BOPA/LDPE复合膜、袋的生产过程,其中印刷、复合、固化、制袋为关键控制点。
二、工艺步骤1.原辅材料验收根据《进货检验规程》对原辅材料等进行检验和验证,合格后方可入库。
2.配料所用PE膜若自吹的情况下,还要根据客户所用塑料薄膜(袋)的用途和要求决定用LDPE、LLDPE还是用LDPE和LLDPE按一定比例的混合料。
将原料确定后倒在料糟内搅拌均匀后再装入原料袋内准备加入料斗。
3.塑料吹膜3.1 吹膜操作人员在开机前首先要检查挤出机的各区加热温度及挤出机的转速,检查热电偶是否正常工作,加热圈是否上牢。
3.2 挤出机的参数调整好后,将树脂颗粒倒入料斗,待挤出机各区温度达到预热温度后,换过滤网,换好后,开始生产。
刚开机时,先把主机速度开慢,薄膜挤出后,操作人员将膜从模头上提起,并同时开动吹气阀,慢慢提升吹气将膜放在第一牵引的两辊之间,夹紧牵引辊。
3.3 根据下达的生产工艺单的要求,调整吹气阀门的大小,控制好薄膜的宽度及厚度,经质检部首检确认后开始正常生产。
详见《吹塑工序操作规程》。
4.电晕处理复合膜在吹塑收卷之前一定要经高压电弧对薄膜进行冲击处理,使其表面具有一定的粗糙度。
刚下机时电晕面要达到40dn/cm以上。
电晕机开启时不要接近高压放电处。
5.收卷薄膜经第一牵引、电晕处理后,经第二牵引按一定的宽度割边后绕在装于充气轴的纸芯上。
6.印刷对有印刷要求的复合薄膜、袋,排版制版后,先检查版面有无磕、碰、撞及掉铬等现象,压印胶辊有无砂眼、坑洞、划伤等,检查机器的用电、用气、电热及运转是否正常,一切正常后,按生产工艺单的要求装胶辊、装版辊、上油墨、装刀、磨刀、上废膜校机打样,等颜色接近样稿及套印正常后接尼龙(PA)光膜,待质检部首件确认后,开始印刷。
详见《印刷工序操作规程》。
7.复合本公司的复合膜采用干式复合法。
按生产工艺单的要求,准备好要用到的网线辊、上胶压辊、胶水、溶剂、刮胶刀、薄膜等,检查复合机的用电、用气、电热、排风等是否正常,调整到适合的烘箱温度、热鼓温度、适当的排风后,用废膜校机,达到一定的初始剥离强度、合适的上胶量并经质检部首件确认后开始生产,生产过程中,注意控制溶剂的残留量、复合强度、产品的卫生等。
复合膜检验操作规程

复合膜检验操作规程1. 目的建立复合膜检验标准操作规程,规范操作。
2. 范围适用于对乙酰氨基酚片、去痛片、复方磺胺甲噁唑片等包装用复合膜的检验。
3. 依据国家药品监督管理局国家药品包装容器(材料)标准YBB001320024. 职责4.1 起草:QC 审核:质量保证部负责人批准人:质量管理负责人。
4.2 QC实施本规程。
4.3 QA监督本规程的实施。
5. 内容5.1 外观:在60cm距离上视观察。
5.1.1 不允许有穿孔、异物、异味、粘连、涂层不均匀、复合层图分离及明显损伤、气泡、皱纹、脏污等缺陷。
5.1.2 印刷的文字、图案清晰、完整,色彩均匀,无明显色差,套印位置偏差≤0.5mm。
5.1.3 卷筒两端面应平整,平面度公差为2mm。
5.1.4 卷筒应紧实,卷芯不得自由脱落或松动。
5.1.5 每卷接头数:膜长<500m不多1个,膜长≥500m不多于2个。
接头处应有牢固、明显的标记。
5.2 尺寸偏差应符合下表的规定:5.3 微生物限度取本品用开孔的消毒过的模板压在内层面上,将无菌棉签用0.9%无菌氯化钠溶液,稍沾湿,在孔板范围内擦抹5次,每个位置用2支棉签共擦抹10次,共擦抹5个位置100cm2。
每支棉签抹完后立即剪断(或烧断),投入盛有30ml 0.9%无菌氯化钠溶液的锥形瓶(或大试管)中。
全部擦抹棉签投入瓶中后,将瓶迅速摇晃1分钟,即得供试液。
取提取液,照微生物限度法(中华人民共和国药典2010版附录XI J)测定。
5.4 包装、运输、贮存5.4.1 产品内包装材料应清洁、无毒、防潮。
内包装应在洁净区内进行,内包装应封扎。
外包装可用瓦楞纸箱。
5.4.2 包装箱上应注明:公司名称、生产地址、产品名称、规格、许可证号、产品批号、数量、净重、生产日期。
5.4.3 每箱产品应附有合格证,其上注明:公司名称、生产地址、产品名称、规格、数量、净重、生产日期及批号、检验员代号。
5.4.4 包装箱上应有“防潮”、“小心轻放”及“向上”标志,其图形应符合GB191-90的规定。
微生物限度检查法操作规程

微生物限度检查法操作规程1.范围本规程适用于微生物限度的检查。
2.设备、仪器及用具、试液、培养基2.1 无菌室:温度18~26℃,相对湿度45~60%,洁净度不应低于10000级。
2.2 其他设备:净化工作台(洁净度为100级)、生化培养箱(23~28℃)、恒温培养箱(30~35℃)、电热恒温水浴锅、高压蒸汽消毒器、电热恒温干燥箱(最高工作温度300℃)、冰箱。
2.3 托盘天平、显微镜。
2.4 玻璃器皿2.4.1 锥形瓶、吸管、试管、培养皿90mm、量筒、烧杯、研钵、载玻片、盖玻片。
2.4.2 洗涤:吸管、锥形瓶、培养皿、烧杯等用清洁液浸泡,用清水冲洗干净再用蒸馏水冲洗2~3遍,晾干。
使用过后如与细菌接触,应121℃湿热灭菌20分钟,倒出内容物,然后清洗、晾干。
2.5 酒精灯、灭菌剪刀、接种环、灭菌镊子、大小橡皮乳头(放于干净带盖的容器中,并定期用70~75%乙醇溶液浸泡)、记号笔。
2.6 无菌衣、帽、口罩(用牛皮纸包严)灭菌,备用。
2.7 试液2.7.1消毒液:0.1%新洁尔灭或络合碘、75%乙醇溶液、5%来苏溶液。
2.7.2 稀释剂: PH7.0氯化钠-蛋白胨缓冲液取磷酸二氢钾3.56g,磷酸氢二钠7.23g、氯化钠4.30g、蛋白胨,加水1000ml,微温溶解,滤清,分装于锥形瓶或试管内,每瓶100ml或每管9ml,加塞,121℃灭菌20分钟备用。
2.7.3 靛基质试液(柯凡克试剂或欧-波氏试剂)、结晶紫染液、碘液、95%乙醇、溴麝香草酚蓝指示剂、酸性品红指示剂、沙黄染液、甲基红指示液、α-萘酚乙醇试液、40%氢氧化钾。
2.8 培养基2.8.1 选择:营养琼脂培养基(细菌计数用);玫瑰红钠琼脂培养基(霉菌及酵母菌计数用);胆盐乳糖培养基;MUG培养基、曙红亚甲蓝琼脂培养基(EMB)、麦康凯琼脂培养基、乳糖培养基、枸橼酸盐培养基、磷酸盐葡萄糖胨水培养基、蛋白胨水培养基、四硫磺酸钠亮绿培养基、胆盐硫乳琼脂(DHL)。
药用复合膜检验规程
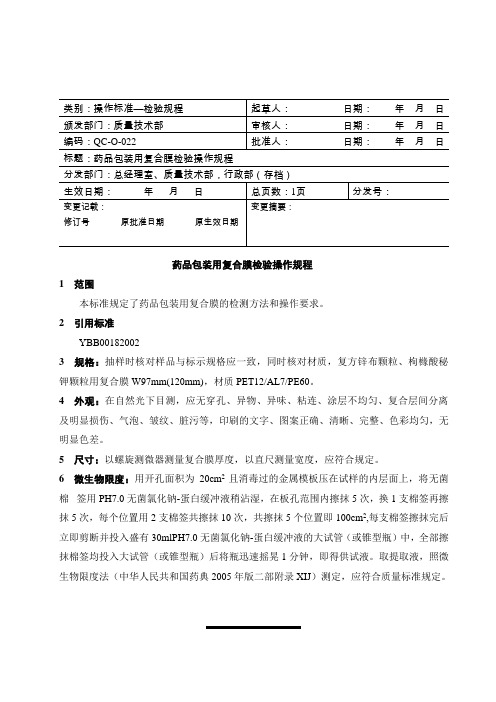
标题:药品包装用复合膜检验操作规程
分发部门:总经理室、质量技术部,行政部(存档)
药品包装用复合膜检验操作规程
1 范围
本标准规定了药品包装用复合膜的检测方法和操作要求。
2 引用标准
YBB00182002
3 规格:抽样时核对样品与标示规格应一致,同时核对材质,复方锌布颗粒、枸橼酸秘钾颗粒用复合膜W97mm(120mm),材质PET12/AL7/PE60。
4 外观:在自然光下目测,应无穿孔、异物、异味、粘连、涂层不均匀、复合层间分离及明显损伤、气泡、皱纹、脏污等,印刷的文字、图案正确、清晰、完整、色彩均匀,无明显色差。
5 尺寸:以螺旋测微器测量复合膜厚度,以直尺测量宽度,应符合规定。
6 微生物限度:用开孔面积为20cm2且消毒过的金属模板压在试样的内层面上,将无菌棉签用PH7.0无菌氯化钠-蛋白缓冲液稍沾湿,在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置用2支棉签共擦抹10次,共擦抹5个位置即100cm2,每支棉签擦抹完后立即剪断并投入盛有30mlPH7.0无菌氯化钠-蛋白缓冲液的大试管(或锥型瓶)中,全部擦抹棉签均投入大试管(或锥型瓶)后将瓶迅速摇晃1分钟,即得供试液。
取提取液,照微生物限度法(中华人民共和国药典2005年版二部附录XIJ)测定,应符合质量标准规定。
5004聚酯、铝、聚乙烯药品包装用复合膜、袋质量标准

5004聚酯、铝、聚乙烯药品包装用复合膜、袋质量标准陕西德福康制药有限公司 ________________文件名称:标准技术程序—内包材质量标准文件编号:STP-QS5004-00 聚酯、铝、聚乙烯药品包装用复合膜、袋质量第 1 页共 3 页标准批准人日期 QA审核日期审核人日期执行日期分发号起草人日期颁发部门质量保证部分发部门质量控制部1. 目的建立聚酯、铝、聚乙烯药品包装用复合膜、袋质量标准。
2. 范围内包材聚酯、铝、聚乙烯药品包装用复合膜、袋。
3. 术语或定义3.1 包装材料:药品包装所用的材料,包括与药品直接接触的包装材料和容器、印刷包装材料,但不包括发运用的外包装材料。
3.2 药品质量标准:是国家对药品质量、规格及检验方法所作的技术规定,是药品生产、供应、使用、检验和药政管理部门共同遵循的法定依据。
4. 职责4.1 质量控制部负责起草审核质量标准。
4.2 质量保证部负责审批质量标准。
5. 内容5.1 产品名称中文名称:聚酯、铝、聚乙烯药品包装用复合膜、袋拼音名称:Juzhi、lv、Julvyixi Yaopin Baozhuangyong Fuhemo、dai 5.2 【标准依据】《国家包装容器(材料)标准YBB00172002》5.3 定性和定量的限度要求序号项目标准1 外观不得有穿孔、异物、异味、粘连、复合层间分离及明显损伤、气reduction in property value. Find warning signals, timely reporting or warning, develop and implement measures against customer transfers and other acts leading to loss or increase the difficulty of clearing. Personal credit business of late, agencies should be timely collection, if necessary, ask the right institutions to bring proceedings. Non-approved by head office, agencies at all levels shall not without the following: give文件名称:文件编号管理规程文件编号:SMP—PMP 001 01 第 2 页共 3 页泡、皱纹、脏污等缺陷。
复合膜易氧化物操作规程

复合膜易氧化物操作规程
复合膜易氧化物是一种常用的包装材料,操作规程如下:
1. 处理环境应保持清洁,干燥,温度控制在21°C左右,湿度控制在50%左右。
2. 操作前应先检查机器是否运转正常,复合膜材料是否符合质量要求。
3. 滚筒表面应平整,无明显凹陷或毛刺,膜材料应平整放置在滚筒上,不得有折叠、起皱和拉伸过度现象。
4. 操作时应保持复合膜的张力均匀,防止张力过大或过小造成复合膜变形。
5. 在复合过程中,严禁用火源接近机器和复合膜,以免引起火灾。
6. 操作后,应对机器进行清洁,并严格按照安全操作规程将废弃材料处理。
7. 操作人员应经过培训,掌握操作规程和安全操作方法,保障安全生产。
以上为复合膜易氧化物的操作规程,操作人员应严格按照规程操作,减少安全事故的发生。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.适用范围
本规程适用于进厂药品包装用复合膜的检验。
2.职责
检验员:严格按检验操作规程进行检验。
QC主管:监督检查执行情况。
3.材质:由供应商提供材质检验合格报告书。
4.外观质量
在自然光线下目视,距离为400mm左右,外观质量应符合下列规定:
4.1.穿孔、异物、异味不允许有。
4.2.粘连、复合层间分离不允许有。
4.3.褶皱不允许有。
4.4.划伤、烫伤、气泡不允许有。
4.5.脱层不允许有。
4.6.油污、杂质不允许有。
4.7.卷面应缠紧、缠齐,端面应平整,不允许有塔层、错层,卷芯不得自由脱落或松
动,不允许有严重碰伤及压陷。
4.8.每卷接头数应有牢固、明显的标记。
膜长<500m不多于1个,膜长≥500m不多
于2个。
5.印刷质量
5.1.刀丝、油墨、污染、涂层不均不允许有。
5.2.色泽要均匀,同批及不同批不允许有明显色差。
6.规格尺寸
测定方法:将复合膜平铺于水平硬板上,用精度为直尺测定,应符合要求。
(单位:mm)
氯霉素片:宽度为120mm±。
8.微生物限度
8.1.供试液的制备
用开口面积为20 cm2的消毒过的金属模板压在试样的内层面上,将无菌棉签用无菌生理
盐水稍沾湿,在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置用2支棉签共擦抹10次。
共擦抹5个位置100 cm2。
每支棉签擦抹完后立即剪断,投入30ml 无菌生理盐水中。
待全部棉签均投入瓶中后,将瓶迅速摇晃1min,静置10min,即得1:1供试液。
8.2.操作方法:按《微生物限度检查SOP》(1302·005)检查。
8.3.判定
8.3.1.若细菌总数≤1000个/100cm2,霉菌总数不超过100个/100cm2,大肠杆菌、活螨
未检出,则判符合规定。
8.3.2.若任何一项指标超出规定,则判不符合规定。
9.取样:按《物料取样SOP》(1302·001)、GB2828取样。
(取样量1m)
10.注意事项
每批产品需与标准样张进行核对,并将随意抽取样品作为样张附于每批检验记录的后面。
11.编号:B-022
12.复检周期:第一次复检周期12个月,第二次复检周期12个月。
13.编制依据
《复合膜质量标准》1103·021
《中国药典》2000年版附录。
