医疗器械标签标记符号 YYT0466.1
医疗器械检测对应的标准

心电监护仪 YY1079-2008 医用电气设备 第2-49 部分:多参数 患者监护设备安全专用要求 YY0668-2008 医用电气设备 第2-27 部分:心电监 护设备安全专用要求
GB9706.25-2005 / IEC 60601-227:2005
眼科用刀通用技术条件 YY 0072-1992 角膜剪 YY/T 0176.10-1997 泪囊牵开器 YY 0073-1992 睑板腺囊肿镊 YY 0074-1992 虹膜剪 YY/T 0176.9-1997 眼睑拉钩 YY/T 0180-1994 睫毛镊 YY/T 0295.10-1997 晶体囊镊 YY/T 0295.11-1997 虹膜镊 YY/T 0295.7-1997 沙眼镊 YY/T 0295.9-1997
体视显微镜
光学系统
激光产品 光动力治疗机 多功能电子视频喉镜 窥喉镜传感视野仪 一次性摄像吸引管 医用冷光源 电子阴道镜 医用皮肤镜 图像分析和捕获系统
体视显微镜 第1部分 普及型体视显
GB/T 19864.1-2005
体视显微镜 第2部分 高性能体视湿
GB/T 19864.2-2005
光学系统 参数的测定
玻璃注射器 第1部分:全玻璃注射
玻璃注射器
YY1001.1-2004
玻璃注射器 第2部分:蓝芯全玻璃 注射器 YY1001.2-2004
腰椎穿刺针
腰椎穿刺针 YY/T 1148-2009
体温计 血压计 血压计
医用电子体温计
GB/T21416-2008 医用红外体温计 第1部分:耳腔式 GB/T21417.1-2008 SJ数字电子体温计 YZB/粤0054-2003 无创血压计规范 第1部分:通用要 EN1060-1:1996 无创血压计规范 第2部分:机械式 血压计的增补要求 EN1060-2:1996 无创血压计规范 第3部分:电子血 压测量系统的增补要求 EN1060-3:1997 手腕式电子血压计 YZB/粤0055-2002
9.符合性声明(第一类医疗器械备案-防护眼罩、医用隔离眼罩)

符合性声明
我公司保证:
1、声明符合国家食品药品监督管理总局第26号《关于第一类医疗器械备案有关
事项的公告》的有关规定和要求;
2、声明本产品符合《第一类医疗器械产品目录》中医用隔离眼罩有关内容要求;
3、声明本产品符合现行国家标准、行业标准并提供符合标准的清单:
GB/T 191-2008 包装储运图示标志
YY/T 0466.1-2009 医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求
国家食品药品监督管理总局令第6号《医疗器械说明书和标签管理规定》ISO13485:2016《医疗器械质量管理体系用于法规的要求》
4、声明所提交的备案资料及内容真实有效,复印材料与原件一致,如有虚假,愿意承担相应的法律责任。
所提供资料清单如下:
1)、第一类医疗器械备案表
2)、产品风险分析报告
3)、产品技术要求
4)、产品检验报告
5)、临床评价资料
6)、产品说明书及最小销售单元标签设计样稿
7)、生产制造信息
8)、证明性文件
9)、符合性声明
厦门*************有限公司
2020年02月17日。
二类体外诊断试剂标准编写要求及常见问题

要求和试验方法
定性产品:外观、宽度、液体移行速度、最低检测限、临界 值、特异性、阴/阳性参考品符合率、重复性、稳定性、批 间差…… (根据产品具体情况确定)
定量产品:外观、净含量、试剂空白吸光度、试剂空白吸光 度变化率、检测限、特异性、分析灵敏度、线性范围、重复 性、批内瓶间差、批间差、准确度、稳定性……(根据产品 具体情况确定)
准没有规定的应增加该要求
线性范围
一般要求
剂量-反应曲线 稀释液浓度为自变量、检测结果均值为因变量,求回归方程 规定线性范围、线性相关系数、线性偏差
常见问题
相关系数不符合国标、行标要求,如GB/T26124-2011中r≥0.990, YY/T1183-2010中r≥0.9900
通用要求规范性引用文件体外诊断试剂标准?定性产品gbt189902008促黄体生成素检测试纸胶体金免疫层析法yyt11642009人绒毛膜促性腺激素hcg检测试纸胶体金免疫层析法yyt11832010酶联免疫吸附法检测试剂盒定量定性yyt11912011抗菌剂药敏纸片2013年6月1日实施yyt12202013肌酸激酶同工酶ckmb诊断试剂盒胶体金法2014年10月1日实施yyt12212013心肌肌钙蛋白1诊断试剂盒胶体金法2014年10月1日实施细菌的分离培养yyt06652008mh琼脂培养基yyt11692009麦康凯琼脂培养基yyt12082013硫代硫酸盐柠檬酸盐胆盐蔗糖tcbs琼脂培养基yyt12092013bcye琼脂培养基yyt12102013麦康凯山梨醇琼脂培养基yyt12112013甘露醇高盐琼脂培养基yyt12122013庆大霉素琼脂基础培养基yyt12192013胰酪胨大豆肉汤培养基?半定量产品yyt04782011尿液分析试纸条2013年6月1日实施规范性引用文件?定量产品gbt261242011临床化学体外诊断试剂盒2011年11月1日实施yyt11832010酶联免疫吸附法检测试剂盒定量定性yyt11942011淀粉酶测定试剂盒连续监测法2013年6月1日实施yyt11922011人绒毛膜促性腺激素hcg定量测定试剂盒化学发光免疫分析法2013年6月1日实施yyt11932011促卵泡生成激素fsh定量测定试剂盒化学发光免疫分析法2013年6月1日实施gbt196342005体外诊断检验系统自测用血糖监测系统通用技术条件yyt11502009血红蛋白干化学检测系统通用技术要求yyt11562009凝血酶时间检测试剂盒yyt11572009活化部分凝血活酶时间检测试剂盒yyt11582009凝血酶原时间检测试剂盒yyt11592009纤维蛋白原检测试剂盒yyt11962013氯测定试剂盒酶法2014年10月1日实施yyt11972013丙氨酸氨基转移酶alt测定试剂盒ifcc法yyt11982013天门冬氨酸氨基转移酶测定试剂盒ifcc法yyt11992013甘油三酯测定试剂盒酶法yyt12002013葡萄糖测定试剂盒酶法yyt12012013尿素测定试剂盒酶偶联监测法yyt12022013钾测定试剂盒酶法yyt12032013钠测定试剂盒酶法yyt12042013总胆汁酸测定试剂盒
一次性使用细胞刷标准

医疗器械注册产品标准YZB/浙 XXXX—2013一次性使用细胞刷诸暨市鹏天医疗器械有限公司发布目录前言......................................Ⅱ1 范围.....................................12 规范性引用文件................................13 分类.....................................14 要求.....................................35 试验方法...................................46 检验规则................................... 67 标志、使用说明书.............................. 78 包装、运输、储存...............................8 《一次性使用细胞刷》企业标准编制说明.. .. . . .. .. . . . .. .. . . . . . .10前言经检索,尚无同类产品现行的国家标准或行业标准,特制定本企业注册产品标准。
本标准编写遵循了GB/T 1.1-2009《标准化工作导则第一部分:标准的结构和编写规则》中有关产品标准编写的基本规定。
本标准自2013年11月1日起实施。
本标准由诸暨市鹏天医疗器械有限公司提出。
本标准起草单位:诸暨市鹏天医疗器械有限公司本标准主要起草人:雷俊王海江赵海龙一次性使用细胞刷1 范围本标准规定了一次性使用细胞刷所用材料的性能及其质量规范、细胞刷的检验规则、试验方法及标志、标签、包装等要求。
本标准适用于一次性使用细胞刷。
一次性使用细胞刷是用于通过内窥镜在人体病灶部位取细胞作病理分析。
(以下简称细胞刷)2 规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。
骨科手术器械二类产品技术审评规范2017版

附件3骨科手术器械〔第二类〕产品注册审评规〔2017版〕本审评规旨在指导和规骨科手术器械〔第二类〕产品的技术审评工作,帮助审评人员理解和掌握该类产品原理/机理、构造、性能、预期用途等容,把握技术审评工作根本要求和尺度,对产品平安性、有效性作出系统评价。
本审评规所确定的核心容是在目前的科技认识水平和现有产品技术根底上形成的。
因此,审评人员应注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。
本审评规不作为法规强制执行,不包括行政审批要求。
但是,审评人员需密切关注相关法规的变化,以确认申报产品是否符合法规要求。
一、适用围本审评规适用于第二类骨科手术器械,一般包括:使用过程中与椎间隙直接接触的骨科手术器械;骨科窥镜用手术器械;以无菌形式提供的骨科手术器械;由网电源、电池或气源提供所需机械动力的骨科手术刀具〔如钻、铣、锯、磨、刨等〕;第二类骨科手术器械包等。
本审评规不适用于骨科外固定器械和一次性使用骨科手术器械,一次性使用骨科手术器械可参考本审评规的相关容。
骨科手术器械产品类代号为6810。
二、技术审查要点〔一〕产品名称的要求骨科手术器械产品名称依据?医疗器械通用名称命名规那么?〔国家食品药品监视管理总局令第19号〕确定。
骨科手术器械的名称可按作用对象和预期用途等方式来命名,如椎管铲刀、颈椎刮匙、椎板咬骨钳、无菌骨牵引针。
由网电源、电池或气源提供所需机械动力的骨科手术器械,可命名构造为:电动/电池式+刀具对象+刀具名称,如电动胸骨锯、电动骨钻。
骨科手术器械包类产品以表达产品组成、功能用途为根本原那么,由多种类别器械组成,一般应以其主要预期用途来命名,如椎间融合手术器械包。
〔二〕产品的构造组成骨科手术器械产品应明确产品构造组成,宜采用图示方式表述产品各组成局部,并明确所用材料。
由网电源、电池或气源提供所需机械动力的骨科手术器械一般由单一或多件与手机配合使用的刀具组成〔如:钻类、铣类、磨类、锉类、锯类、刨类〕。
二类医疗器械产品技术要求

二类医疗器械产品技术要求医疗器械产品技术要求医疗器械产品技术要求编号:通气鼻贴1.0产品型号/规格及其划分说明:1.1产品型号:肤色型、透明型1.2产品规格:产品按人的体型大小分为五个规格:a)XXL:66mm×18mm,适用于大鼻型;b)XL:60mm×17mm,适用于较大鼻型;c)L:56mm×16mm,适用于普通男士鼻型;d)M:55mm×16mm,适用于普通女士鼻型;e)S:42mm×13.5mm,适用于儿童。
1.3产品标志:产品标记分别由品牌代号(YC)、产品名称代号(BT)、结构代号(F或M)和规格(XXL、XL、L、M、S)四部分组成。
如下所示:YC—BT—□—□规格:按3.2中字母XXL、XL……或参数66mm×18mm、42mm×13.5mm……标记;结构代号:肤色型结构用“F”标记,透明型结构用“M”标记;产品名称代号:用“BT”表示,是通气鼻贴简称“鼻通”的汉语拼音首写字母;品牌代号:用“YC”表示,是“XX”汉语拼音首写字母。
示例:XXXX有限公司生产的肤色型普通男士用通气鼻贴标记为:通气鼻贴 YZB/赣×××—2014 YC-BT-F-L(56mm×16mm)1.4产品材料:通气鼻贴所选用的原材料应符合相应的产品质量标准。
2.0性能指标:GB/T191-2008包装储运图示标志;GB/T2828.1-2012计数抽样检验程序第1部分:按接收质量限(AQL)检查的逐批检查及抽样计划;GB/T2829-2002周期检验计数抽样程序及表(适用于对过程稳定性的检验);GB/T 9969-2008工业产品使用说明书总则;YYT 0148-2006医用胶带通用要求;GB/T 16886.10-2005医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验;YY0466-2009医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求。
表B.5医疗器械检验检测机构检验能力建设标准【模板】

2
全部参数
测量、控制和实验室用电气设备的安全要求第6部分:实验室用材料加热设备的特殊要求
GB 4793.6-2008
√
9
医用输液、输血、注射器具
1
全部参数
医用输液、输血、注射器具检验方法第1部分:化学分析方法
GB/T14233.1-2008
√
2
细菌内毒素试验
医用输液、输血、注射器具检验方法第2部分:生物学试验方法
表B.5 医疗器械检验检测机构检验能力建设标准
对象序号
检测对象
参数序号
参数名称
依据的标准(方法)名称及编号(含年号)
省级
1
医用电气设备
1
部分参数
医用电气设备第1部分:安全通用要求GB 9706.1-2007/ IEC 60601-1:1988+A1:1991+A2:1995
√
2
全部参数
医用电气设备第1-1部分:安全通用要求并列标准:医用电气系统安全要求GB9706.15-2008 IEC 60601-1-1:2000
YY/T 0698.6-2009
√
6
部分参数
最终灭菌医疗器械包装材料第7部分:环氧乙烷或辐射灭菌无菌屏障系统生产用可密封涂胶纸要求和试验方法
YY/T 0698.7-2009
√
26
灭菌注射用水
1
灭菌注射用水
《中国药典》2015年版第二部第702页
√
27
制药用水电导率测定法
1
电导率
《中国药典》2015年版
GB/T 14233.2-2005
√
11
金属
1
全部参数
金属维氏硬度试验第1部分试验方法
2020年最新版本的医用一次性防护服企业标准

2020年最新版本的医用一次性防护服企业标准标准号:JHQB025-2020 备案号:JZJQ02028-2020JH/QB 新会嘉珩日用品有限公司企业标准医用一次性防护服2020年4月16日发布 2020年4月17日实施新会嘉珩日用品有限公司发布前言本标准依据GB/T 1.1-2020《标准化工作导则第1部分:标准的结构和编写规则》起草。
本标准由新会嘉珩日用品有限公司提出并起草。
本标准主要起草人:李嘉珩。
本标准于2020年4月16日首次发布。
医用一次性防护服1.目的为了保障本公司生产的医用一次性防护服符合其安全指标及其要求,满足客户的需求,特制定本标准规范医用一次性防护服的检验技术和方法。
2.范围本标准规定了医用一次性防护服的术语和定义、原料、场地条件、工艺流程、产品分级、技术要求、试验方法、检验规则、包装、标志、贮存和运输等内容。
3 范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅所注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 2828.1-2012 计数抽样检验程序第1部分:按接收量限(AQL)检索的逐批检验抽样计划GB/T 2829-2002 周期检验计数抽样程序及表(适用于对过程稳定性的检验)YY/T 0466.1-2016 医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求GB 15979-2002 一次性使用卫生用品卫生标准GB/T 14233.1-2008 医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T 14233.2-2005 医用输血、输液、注射器具检测方法第2部分:生物学试验方法GB 19082-2009 医用一次性防护服技术要求GB/T3923.1-2013 纺织品织物拉伸性能第1部分:断裂强力和断裂伸长率的测定条样法GB/T4744-2013 纺织品防水性能的检测和评价静水压法GB/T4745-2012 纺织品防水性能的检测和评价沾水法GB/T5455-2014 纺织品燃烧性能垂直方向损毁长度阴燃和续燃时间的测定GB/T12703.1-2008 纺织品静电性能的评定第1部分:静电压半衰期GB/T12704.1-2009 纺织品织物透湿性试验方法第1部分:吸湿法YY∕T 1498-2016 医用防护服的选用评估指南YY∕T 1499-2016 医用防护服的液体阻隔性能和分级《中华人民共和国药典》(2015年版四部)IST 40.2(01) 无纺布静电衰减标准测试方法4.口罩用熔喷布技术要求1. 产品型号/规格及其划分说明1.1 材料与组成医用一次性防护服(以下简称医用防护服) 由连帽上衣、裤子组成,袖口、脚踝口为弹性收口,帽子面部收口及腰部收口采用拉绳收口。
输液贴、创口贴产品技术审评规范2014版

输液贴、创口贴产品技术审评规范(2014版)根据《医疗器械注册管理办法》(国家食品药品监督管理局令第16号)的要求并结合输液贴、创口贴产品的特点,为规范输液贴、创口贴产品的技术审评工作,特制定本规范。
一、适用范围本规范适用于管理类别为I类的输液贴和创口贴产品,为接触创面的敷料类产品,该类产品作为创面的机械屏障,用于分泌物的吸收或引流,以控制创面的微生物环境,可直接或间接使创面愈合。
其在《医疗器械分类目录》中类代号为6864-2敷料、护创材料。
以代谢、药理或免疫作用为主的输液贴和创口贴产品、液体创口贴、用于手术切口及留置动/静脉导管时贴敷皮肤用、婴儿肚脐口创口保护等作为∏类医疗器械管理的输液贴、创口贴产品不适用本技术审评规范。
二、技术审评要点(一)产品管理类别的确定根据《医疗器械分类目录》,本规范适用于管理类别为I类的输液贴、创口贴产品。
(-)产品名称的要求产品名称应以预期用途为依据命名。
如:创口贴(创可贴)、输液贴。
(三)产品的结构组成及型式L产品结构组成输液贴、创口贴产品通常由基底材料、胶粘剂层、吸水层、隔离纸或膜、染料(基底材料如有)组成。
目前生产企业通常选用已成型的医用胶带作为原材料,即输液贴可由医用胶带、吸水层(至少在与输液针口接触的部分上具有)、隔离纸或膜组成;创口贴可由医用胶带、吸水层、隔离纸或膜组成。
基底材料一般有无纺布、纸基、PE薄膜、PVC薄膜、PU薄膜、EVA泡棉、海绵、PET薄膜等。
吸水层材质有无纺布、棉垫、PE垫层等。
胶粘剂应为医用胶粘剂,如丙烯酸酯共聚物、氟基丙烯酸酯、有机硅共聚物、聚乙烯基酸、聚异丁烯、聚氨酯等。
2.产品型式输液贴、创口贴产品的型式可根据企业生产情况自行设定,一般分规则型(长方形、圆形、椭圆形等)及不规则型(如根据使用部位,为方便使用设计的异形产品)。
产品图示举例:输液贴创口贴(四)产品适用的相关标准GB15979-2002一次性使用卫生用品卫生标准GB15980-1995一次性使用医疗用品卫生标准GB/T16886.1-2011医疗器械生物学评价第1部分风险管理过程中的评价与试验GB/T16886.5-2003医疗器械生物学评价第5部分:体外细胞毒性试验 GB/T16886.7-2001医疗器械生物学评价第7部分:环氧乙烷灭菌残留量 GB/T16886.10-2005医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验GB18278-2000医疗保健产品灭菌确认和常规控制要求工业湿热灭菌 GB18279-2000医疗器械环氧乙烷灭菌确认和常规控制GB18280-2000医疗保健产品灭菌确认和常规控制要求辐射灭菌GB/T19633-2005最终灭菌医疗器械的包装YY/T0148-2006医用胶带通用要求YY/T0287-2003医疗器械质量管理体系用于法规的要求YY/T0313-1998医用高分子制品包装、标志、运输和贮存YY/T0316-2008医疗器械风险管理对医疗器械的应用YY/T0466.1-2009医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求YY/T0471.1-2004接触性创面敷料试验方法第1部分液体吸收性 YY/T0471.2-2004接触性创面敷料试验方法第2部分透气膜敷料水蒸汽透过率YY/T0471.3-2004接触性创面敷料试验方法第3部分阻水性YY/T0471.4-2004接触性创面敷料试验方法第4部分舒适性YY/T0471.5-2004接触性创面敷料试验方法 YY/T0471.6-2004接触性创面敷料试验方法第6部分第5部分阻菌性气味控YY/T0615.1-2007标示“无菌”医疗器械的要求第1部分:最终灭菌医疗器械的要求FZ/T64005-2011卫生用薄型非织造布(五)产品的预期用途1.创口贴:该产品主要应用于割伤、碰伤、擦伤等创面的止血和保护创面用,不能用于手术创口。
无源医疗器械通用标准(国内)清单
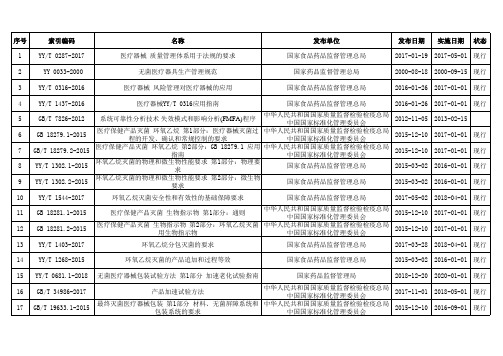
44
GB/T 4857.1-2019
包装 运输包装件基本试验 第1部分:试验时各部位的标 示方法
国家市场监督管理总局 中国国家标准化管理委员会
2019-05-10 2019-12-01 现行
45 GB/T 4857.2-2005
包装
运输包装件基本试验
第2部分:
温湿度调节处理
中华人民共和国国家质量监督检验检疫总局 中国国家标准化管理委员会
39 YY/T 1630-2018
医疗器械唯一标识基本要求
40 YY/T 1681-2019
医疗器械唯一标识系统基础术语
41 YY/T 0468-2015
医疗器械 质量管理 医疗器械术语系统数据结构
国家食品药品监督管理总局
国家食品药品监督管理局 国家市场监督管理总局 中国国家标准化管理委员会
国家药品监督管理局
中华人民共和国国家质量监督检验检疫总局 中国国家标准化管理委员会
2015-12-10
2017-01-01
现行
13 YY/T 1403-2017
环氧乙烷分包灭菌的要求
国家食品药品监督管理总局
2017-03-28 2018-04-01 现行
14 YY/T 1268-2015
环氧乙烷灭菌的产品追加和过程等效
中华人民共和国国家质量监督检验检疫总局 中国国家标准化管理委员会
2011-01-14
2011-05-01
现行
57
GB/T 25915.4-2010
洁净室及相关受控环境 第4部分:设计、建造、启动
中华人民共和国国家质量监督检验检疫总局 中国国家标准化管理委员会
2015-12-10
2017-01-01
医疗器械标志、标签要求

医疗器械标志、标签要求医疗器械处黄荣建二〇〇六年三月一、范围为医疗器械的安全和有效使用,给使用者和其他人员规定了用于提供医疗器械重要信息的标志、标识,主要由下列人员使用。
❑∙∙∙ 医疗器械制造商❑∙∙∙ 医疗器械使用者❑∙∙∙ 负责医疗器械产品上市后监督的人员❑∙∙∙ 主管部门、检测机构、认证机构等二、依据❑∙∙∙ 法律、法规《医疗器械监督管理条例》《医疗器械说明书、标签、包装标识》❑∙∙∙ 国家标准、行业标准通用标准专用标准产品标准❑∙∙∙ 企业标准(注册产品标准)标识、标签和使用说明书。
附录A安全要求中“外部标记”。
(医用电气产品)通用标准•GB/T191-2000《包装储运图示标志》•YY0466-2003《医疗器械用于医疗器械标签、标记和提供信息的符号》•YY/T0313-1998《医用高分子制品包装、标志、运输和贮存》•GB9706.1-1995《医用电气设备第一部分:安全通用要求》•YY91099-1999《医用X线设备标志、包装、运输和贮存》专用标准•YY0089-1992《病人监护系统专用安全要求》•YY0319-2000《医用电气设备第二部分:医疗诊断用磁共振设备安全专用要求》•GB9706.X-XXXX《医用电气设备第X部分:XX设备安全专用要求》•YY0290.4-1997《人工晶体第4部分:标签和资料》•YY/T0486-2004《激光手术专用气管插管标志和提供信息的要求》产品标准•GB8369-2005《一次性使用输血器》•GB10152《B型超声诊断设备》•YY0460-2003《超声洁牙设备》医用高分子制品标志•单包装或初包装宜有下列标志:—产品名称、型号或规格;—制造厂名称、地址和商标;—生产批号或日期。
•无菌产品的单包装或初包装还宜有下列标志:—“无菌”字样和/或无菌图形符号(YY/T0313)、“用后销毁”等字样。
医用高分子制品标志—初包装有小的破损,制品不能安全使用时,应有“包装破损禁止使用”字样。
医用输液瓶口贴产品技术要求标准2023年

医用输液瓶口贴1范围本标准规定了医用输液瓶口贴(简称瓶口贴)的产品组成、规格、要求、试验方法、检验规则、标志、包装、说明书、运输及贮存。
本标准适用于本公司生产的医用输液瓶口贴。
2规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅所注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T191-2008包装储运图示标志GB/T9969-2008工业产品使用说明书总则GB/T2828.1-2012计数抽样检验程序第1部分:按接收质量限(AQL)检索的逐批检验抽样计划GB/T2829-2002周期检验计数抽样程序及表(适用于对过程稳定性的检验)GB/T14233.1-2008医用输液、输血、注射器具检验方法第一部分:化学分析方法YY0148-2006医用胶带通用要求YY/T0466.1-2016医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求《中华人民共和国药典》(2015版)3产品组成与规格3.1医用输液瓶口贴由胶带、吸水垫、离型纸组合而制成。
3.2产品规格应符合表1规定,特殊规格按订货合同执行。
表1产品规格表单位为毫米产品规格胶带直径吸水垫直径基本尺寸允差基本尺寸允差2.8cm×1.6cm28±216±2 4要求4.1外观产品应平整、边缘整齐、不应有破洞、脱胶及污渍。
4.2规格尺寸产品规格尺寸应符合3.2的要求。
4.3剥离强度应不低于1.0N/cm。
4.4持粘性应不大于2.5mm。
4.5残留物按5.5进行试验时,不锈钢板上应无残留粘性物质。
4.6无菌产品应无菌。
4.7环氧乙烷残留量应≤10ug/g。
5试验方法5.1外观目视检查。
5.2规格尺寸用通用量具测量。
5.3剥离强度按YY/T0148-2006中5.2.2规定的方法进行。
5.4持粘性按YY/T0148-2006中5.2.1规定的方法进行。
医疗器械说明书标签和包装标识的检查标准

附件2医疗器械说明书、标签和包装标识检查标准(专业部分)产品:天然胶乳橡胶避孕套注:1、天然胶乳橡胶避孕套执行标准为GB7544-2002《天然胶乳橡胶避孕套技术要求和试验方法》。
2、根据GB7544《天然胶乳橡胶避孕套》标准11.1条规定,避孕套的包装由单个包装和消费包装组成,每个避孕套应单个包装。
一个或多个单个包装在另一包装中提供给消费者,即作为消费包装。
所以避孕套的包装标志包括单个包装标志和消费包装标志。
3、如果避孕套是在直接以单个包装提供给消费者,则单个包装应认为是消费包装,且应满足所有的标志要求。
4、如果在包装、资料和销售的材料上使用了符号,符号应符合YY0466《医疗器械用于医疗器械标签、标记和提供信息的符号》的要求。
2医疗器械说明书、标签和包装标识检查标准(专业部分)产品:血糖仪、血糖试纸,图例:XXX”血糖仪。
,图例:,说明产品使用需参考使用说明书。
注:血糖仪及血糖试纸现目前尚无国家标准及行业标准,可按生产企业的注册产品标准检查。
3医疗器械说明书、标签和包装标识检查标准(专业部分)产品:软性角膜接触镜(隐形眼镜)注:1、接触镜的说明书非每个镜片都配给,一般在外包装箱提供说明书(配戴手册),患者可以索取生产企业的说明书。
2、接触镜的标签是指小包装的标志,接触镜的小包装一般是由西林瓶或铝箔吸塑包装。
4医疗器械说明书、标签和包装标识检查标准(专业部分)产品:助听器5医疗器械说明书、标签和包装标识检查标准(专业部分)产品:医用脱脂棉、医用脱脂纱布(块)6医疗器械说明书、标签和包装标识检查标准(专业部分)产品:一次性使用无菌导尿管2、YY/T0313-1998《医用高分子制品包装、标志、运输和贮存》中规定:初包装是指与制品直接接触的包装;单包装是指单件制品、一套操作过程相关的组件或成套供应的系列制品的包装,是制品销售、使用的基本单元。
7医疗器械说明书、标签和包装标识检查标准(专业部分)产品:中频电疗仪、低频电子脉冲治疗低仪8注:1、中频电疗仪:产生频率为1000~100000Hz的交流电(包括正弦波、脉冲波和调制波)的物理治疗、康复仪器,现行行业标准YY91093-1999《中频电疗仪》。
