第四章第四节 氨硫酸硝酸
第四节 氨 硫酸 硝酸

△
与非金属反应
C+ 2H2SO4(浓) === CO2↑+ 2SO2↑+ 2H2O
△
在加热条件下,浓硫酸能与大多数金属或 非金属起氧化还原反应生成二氧化硫。
思考与交流
设计一个实验检验碳与浓硫酸反应的生 成物。
有人认为,“比较浓硝酸和稀硝酸的还原产物 的化合价,浓HNO3中的氮从+5降为+4,而稀 HNO3中的氮从+5价降为+2,从化合价变化可 以判断稀硝酸的氧化性比浓硝酸强。”这种看 法是否正确?为什么?
2、强氧化性
与金属反应:
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO ↑ +4H2O
[4Zn + 10HNO3(稀) = 4Zn(NO3)2 + N2O + 5H2O]
④非金属单质可被HNO3氧化为最高价氧化物或其
含氧酸。
应用:
1、实验室可利用这个性质来检验NH4+的 存在。 2、实验室制取氨气。
原理:
氨气的实验室制法
△ 2NH4Cl + Ca(OH) 2 === CaCl2 + 2NH3↑+ 2H2O 装置:固体 + 固体加热
收集方法:
向下排空气法检验Biblioteka 法:使湿润的红色 石蕊试纸变蓝
环保措施:
在试管口塞一团用稀硫酸浸湿的棉花。
玻尔巧藏诺贝尔金奖章
丹麦有位叫玻尔的科学家,37岁时他获得了 1922年的诺贝尔奖。第二次世界大战期间,玻尔被 迫离开即将被德军占领的祖国,为了表示他一定要 返回祖国的决心,他决定将诺贝尔奖章留在实验室。 玻尔把金奖章溶解在盛有王水试剂瓶里。后来,纳 粹分子窜入玻尔实验室,那个试剂瓶就在他们的眼 皮底下,他们却一无所知。战争结束后,玻尔 从王 水中把金还原出来,并重 新铸成奖章。而玻尔配制
人教版高中化学必修1第四章_第四节氨 硝酸 硫酸 --氨

NH3 ·H2O == NH3↑ + H2O ②浓氨水加固体CaO
NH3 ·H2O + CaO = NH3↑ +Ca(OH)2
16
5.尾气处理 多余的氨要吸收掉,以避免污染空气, 但多余气体在尾气吸 收时要防止倒吸。常采用的装置有:
17
四、氨气的用途
实验成败的关键是什么? a.烧瓶要干燥;b.装置不漏气;c.气体应收满。 (2)喷泉停止后,为什么烧瓶不能被水完全充满?
由于氨气是用向下排空气法收集的,一定含有少 量空气。
除去氨气外你学过的什么气体也能作喷泉实验?
气体
HCl
水、 吸收剂
NaOH 溶液
NH3
CO2、Cl2、 NO2 和 H2S、SO2 O2
实验4-8
喷泉实验
实验装置
操作及现象
(1)打开_止__水__夹___, 并挤压滴管的胶头 (2)烧杯中的溶液由 玻璃管进入烧瓶, 形成_喷__泉__,瓶内滴 有酚酞溶液呈红___色
结论
氨_极__易__ 溶于水, 水溶液 呈_碱__性
请分析产生此现象的原因?
烧瓶内气体溶于水,压强减小,在外界 大气压作用下溶液进入喷泉。
2NH3+H2SO4==(NH4)2SO4 NH3+HNO3==NH4NO3
⑶浓氨水遇浓硫酸、浓硝酸也都会产生白烟吗?
思考与交流 从氧化还原角度来研究氨气
1、氨气中氮元素的化合价是什么? N H 3 N 2 N O 2 3
2、氨气具有什么性质?
(3)氨气的还原性(氨的催化氧化) ——与氧气的反应
C、a为Cl2气体,b为饱和NaCl溶液
b
人教版高中化学必修一第四章第四节氨硝酸硫酸

(3)若V L烧瓶充满标况下的氨气,喷泉实验后溶液充满
整个烧瓶,所得溶液的物质的量浓度是
1 22.4
。mol/L
2、氨气的化学性质 (1)氨与水反应
NH3+H2O
NH3 H2O
NH4++OH-
关于氨水——氨的水溶液
① 氨水中含有的主要微粒有:
分子:H2O、NH3、NH3•H2O 离子:NH4+、OH注意:计算氨水的质量分数时,以NH3为溶质。 ② 氨水密度小于水(氨水浓度越大,密度越小)
③ NH3•H2O不稳定
△
NH3•H2O == NH3+ H2O
氨水是一种不稳定、易挥发的一元弱碱
讨论1:在1L 1mol/L的氨水中( D ) A、含有1mol NH3 B、含NH3和NH4+的物质的量之和为1mol C、含1mol NH3• H2O D、含NH3、 NH3• H2O和NH4+的物质的量之和为1mol
注意:NH4Cl受热分解,产生的气体冷却又生成NH4Cl,
NH4HCO3 NH3↑+H2O+CO2↑
都产生NH3,
△
非氧化还原反应
(NH4)2CO3 = 2NH3 ↑ + H2O + CO2 ↑
2NH4NO3△= 4H2O + 2N2 ↑ +O2 ↑ 无NH3产生,是氧化还原反应 注意:不是所有的铵盐受热分解都生成氨气。
保存:硝酸盛放于棕色瓶中,置于冷暗处
2、强氧化性
浓氨水 CaO
讨论2:通常情况下能大量共存,并且都能用浓硫酸和碱石灰
干燥的是( B )
A、NH3、NO、HCl C、H2S、SO2、O2
B、N2、H2、O2 D、NO、NO2、O2
高一化学第四节氨、硝酸、硫酸
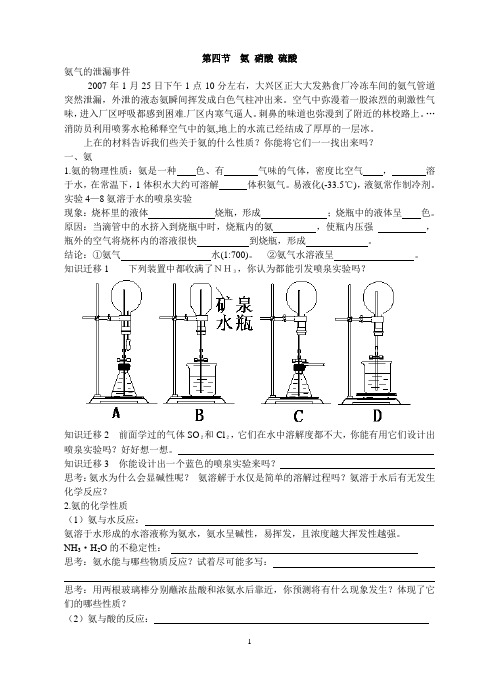
第四节氨硝酸硫酸氨气的泄漏事件2007年1月25日下午1点10分左右,大兴区正大大发熟食厂冷冻车间的氨气管道突然泄漏,外泄的液态氨瞬间挥发成白色气柱冲出来。
空气中弥漫着一股浓烈的刺激性气味,进入厂区呼吸都感到困难.厂区内寒气逼人。
刺鼻的味道也弥漫到了附近的林校路上。
…消防员利用喷雾水枪稀释空气中的氨,地上的水流已经结成了厚厚的一层冰。
上在的材料告诉我们些关于氨的什么性质?你能将它们一一找出来吗?一、氨1.氨的物理性质:氨是一种色、有气味的气体,密度比空气,溶于水,在常温下,1体积水大约可溶解体积氨气。
易液化(-33.5℃),液氨常作制冷剂。
实验4—8氨溶于水的喷泉实验现象:烧杯里的液体烧瓶,形成;烧瓶中的液体呈色。
原因:当滴管中的水挤入到烧瓶中时,烧瓶内的氨,使瓶内压强,瓶外的空气将烧杯内的溶液很快到烧瓶,形成。
结论:①氨气水(1:700)。
②氨气水溶液呈。
知识迁移1 下列装置中都收满了NH3,你认为都能引发喷泉实验吗?知识迁移2 前面学过的气体SO2和Cl2,它们在水中溶解度都不大,你能有用它们设计出喷泉实验吗?好好想一想。
知识迁移3 你能设计出一个蓝色的喷泉实验来吗?思考:氨水为什么会显碱性呢?氨溶解于水仅是简单的溶解过程吗?氨溶于水后有无发生化学反应?2.氨的化学性质(1)氨与水反应:氨溶于水形成的水溶液称为氨水,氨水呈碱性,易挥发,且浓度越大挥发性越强。
NH3·H2O的不稳定性:思考:氨水能与哪些物质反应?试着尽可能多写:思考:用两根玻璃棒分别蘸浓盐酸和浓氨水后靠近,你预测将有什么现象发生?体现了它们的哪些性质?(2)氨与酸的反应:氨与酸反应生成铵盐。
铵盐又叫铵态氮肥。
思考:有一位农民看到自己买的一袋碳酸氢铵化肥受了潮,就在太阳底下晒,等他下午去取时,发现少了许多,是谁偷了他的氮肥?铵盐可以做氮肥体现了铵盐的什么物理性质?铵盐的性质①铵盐都易溶于水②铵盐受热易分解NH4HCO3受热:NH4Cl受热:③铵盐与碱反应(NH4)2SO4 + NaOH:实质:(离子方程式)NH4HCO3 + NaOH:实质:(离子方程式)一切铵盐的共同性质,实验室可利用这个性质来检验NH4+的存在。
氨、硝酸、硫酸 人教课标版精选教学PPT课件

放热
NH3(g) 吸热 NH3(l) 制冷剂
2)氨气的实验室制法:
(1)原料:用NH4Cl与Ca(OH)2混 和 加热制得
(2)原理:
2NH4Cl+Ca(OH)2 == CaCl2+2NH3↑+2H2O
(3)制取装置: 固固加热装置
(4)收集装置:
(5)验满: ⑹环保措施:
棉花的作用: 防止空气对流
NH3 +HNO3 == NH4NO3
制铵盐
NH3 +CO2+ H2O === NH4 HCO3
催化剂
4NH3+5O2
==== △
4NO+6H2O
2 NO + O2 === 2NO2
制硝酸
3NO2 + H2O === 2HNO3 + NO
催化剂
2NH3+CO2
==== △
CO(NH2)2+
H2O
制尿素
V cn22.4 1 mo/lL
V V 22.4
6. 下图装置难以形成喷泉,试分析其原因。如 果要使该装置也能形成喷泉(在不改变气体成 分的前提下),你认为要采取什么措施?
The End
,又何必对未知的前方魂牵梦萦?生活中,其实我们每个人都有目标,并且我们的奋斗,都是为了能离它更近。奋斗努力,快步走行,无可厚非,但是我想,人生在路上行走,本应该走走停停,该歇的则 放慢脚步,看看你的身边,看看你的周围,欣赏一下沿途的美丽风景,也许里面就有会你想要的东西。不要为了追求物质财富,不要忙于到达目的地,只顾疲于奔跑,而错过了身边美丽的风景,不要让你
NH4++OH-
【小结】:氨水的成分
高中化学必修1 第四章 第四节 氨 硝酸 硫酸

(2)强氧化性: 浓硝酸和稀硝酸都能与铜发生反应: • 4HNO3(浓)+ Cu ═ Cu(NO3)2 + 2NO2 ↑ + 2H2O
H2SO4 ═
Zn H2SO4 +
Cu(OH)2 CuO BaCl2
2H+ + SO42变红
ZnSO4 + H2↑
CuSO4 + 2H2O CuSO4 + H2O BaSO4 +
@皮皮课件
紫色石蕊试液
2HCl
17
第二章 硫酸和硝酸的氧化性
2.2 硫酸 A.浓硫酸的特性:
① 吸水性:
向蔗糖中加入浓硫酸时,蔗糖变黑,体积 膨胀,变成疏松多孔的海绵状炭,并放出 刺激性气味。
@皮皮课件
20
第二章 硫酸和硝酸的氧化性
2.2 硫酸
小贴士
有些气体可以用浓硫酸干燥,有些气体却不能用浓硫酸干燥:
能用浓硫酸干燥的气体: H2、O2、N2、CO、CO2、CH4、SO2、HCl、Cl2
不能用浓硫酸干燥的气体:
① 碱性气体(NH3) ② 还原性气体(H2S、HI、HBr)
@皮皮课件 21
• 氧化非金属单质:
加热盛有浓硫酸和木炭的试管,碳就被氧化成二 氧化碳,而硫酸被还原为二氧化硫。
C + 2H2SO4(浓)
==
CO2↑ +
2SO2↑ + 2H2O
@皮皮课件
24
第二章 硫酸和硝酸的氧化性
2.4 硫酸的用途
@皮皮课件
25
第二章 硫酸和硝酸的氧化性
2.5 硝酸
(1)不稳定性(易分解): 4HNO3 ═ 4NO2 + 2H2O + O2↑
【最新】人教版高一化学必修1:第四章第四节氨 硝酸 硫酸——《氨》课件(共24张PPT).ppt

NH3 + HCl == NH4Cl
氨与氯化氢的反应
NH3 + HCl == NH4Cl
思考:如何检验某气体是氨气?
方法1:用湿润的红色石蕊试纸靠近管 口,试纸变蓝,说明气体为氨气。
方法2:用玻璃棒蘸取浓盐酸靠近管口, 产生白烟,说明气体为氨气。
(2)氨与酸反应 NH3 + HNO3 = NH4NO3 2NH3 + H2SO4 = (NH4)2SO4 NH3 + H2O + CO2 = NH4HCO3
【思考与交流】提示:氮是蛋白质的基本组成元素之一。所有 生物体内均含有蛋白质,所以氮的循环涉及到生物圈的全部领 域。氮是地球上极为丰富的一种元素,在大气中约占79%。氮 在空气中含量虽高,却不能为多数生物体所直接利用,必须通 过固氮作用。固氮作用的两条主要途径,一是通过闪电等高能 固氮,形成的氨和硝酸盐,随降水落到地面;二是生物固氮, 如豆科植物根部的根瘤菌可使氮气转变为硝酸盐等。植物从土 壤中吸收铵离子(铵肥)和硝酸盐,并经复杂的生物转化形成各 种氨基酸,然后由氨基酸合成蛋白质。动物以植物为食而获得 氮并转化为动物蛋白质。动植物死亡后遗骸中的蛋白质被微生 物分解成铵离子(NH4+)、硝酸根离子(NO3-)和氨(NH3)又回到 土壤和水体中,被植物再次吸收利用。
(2)氨的实验室制法
△
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
检验:①用湿润的红色石蕊试纸检验 试纸变蓝
②用蘸有浓盐酸的玻璃棒检验 产生白烟
思考:用氢氧化钠代替氢氧化钙好吗? 氢氧化钠易吸水,易结块,不易产生NH3; 热的氢氧化钠对玻璃有腐蚀作用。
【人教版】氨硫酸硝酸

第四章非金属及其化合物第4节氨硝酸硫酸课程标准:了解NH3与水、酸的反应,了解氨水的成份及氨水的不稳定性,了解铵盐的通性省教学要求:了解NH3的性质和用途掌握NH3的实验室制法了解铵盐的性质,掌握NH4+的检验教学目标:知识与技能:了解氨的物理性质,掌握氨的化学性质;了解铵盐的性质。
过程与方法:通过学生分组讨论、实验探究,培养学生分析问题、解决问题的能力、实验操作的能力。
情感态度与价值观:使学生体会化学对环保的重要意义,培养学生关注社会的意识和责任感;通过对问题的讨论、实验的探究,培养学生积极思考、勇于探究的精神。
教学重点:NH3的化学性质、实验室制法、NH4+的检验教学难点:喷泉实验的原理及相关类似的实验的设计教学流程:Ⅰ、课前检测:一、复习检测:1、把SO2气体通入品红溶液中,现象为,加热溶液煮沸后,现象为2、将Cl2通入紫色石蕊试液中,现象为将SO2通入紫色石蕊试液中,现象为二、预习检测:关于氨的下列叙述中,错误的是()A.氨易液化,因此可用来作制冷剂B.氨易溶解于水,因此可用来作喷泉实验C.氨极易溶解于水,因此氨水比较稳定(不容易分解)D.氨溶解于水显弱碱性,因此可使酚酞试剂变为红色Ⅱ、课堂新授:【展示】一瓶氨气,引导学生观察氨气的色、味、态、密度(与空气比较)。
阅读教材P.97-98。
小结氨的物理性质【演示实验】实验4-8,观察实验现象,思考下列问题并小组交流实验装置分析:1、为什么烧瓶内会产生喷泉?2、为什么要用干燥的烧瓶?3、胶头滴管的作用是什么?实验现象分析:1、实验体现氨气的什么性质?2、烧瓶中的溶液为什么会变红?3、如果变红的原因是生成OH -,那么OH -来源于什么物质?【归纳】1、氨的物理性质:无色、刺激性气味的气体,易溶于水(1︰700)。
2、化学性质:(1)与水的反应:NH 3+H 2O NH 3.H 2O NH 4++OH -【思考】1、水中的粒子有哪些?液氨与氨水是否是一种物质?2、如何检验氨气?3、把一瓶浓氨水露置在空气中,有何现象?【过渡】氨气溶与水所得溶液显碱性,氨气是一种碱性气体,那么它遇到酸会不会反应呢?【演示实验】氨气与氯化氢的反应观察现象写出化学反应方程式:NH 3+HCl =NH 4Cl (白烟)【拓展】1、写出氨气与硫酸、硝酸反应的化学方程式:2、下列不可用浓硫酸干燥的气体有( )A 、氨气B 、氯气C 、氧气D 、一氧化氮3、试分析如何检验氨气?【过渡】氨气与酸反应生成的盐叫铵盐。
氨

(3)氨气与某些盐溶液的反应
2NH3+2H2O + Mg2+ = Mg(OH)2↓ + 2NH4+
(4)氨的催化氧化(还原性 ) 催化剂 4NH3 + 5O2=======4NO + 6H2O △ 氨催化氧化(接触氧化)是工业制硝酸的基础, 请写出用氨制取硝酸的化学方程式。 催化剂 4NH3 + 5O2=======4NO + 6H2O △ 2NO + O2 = 2NO2
(装置与实验室制氯气的发生装置相同)
浓氨水
②浓氨水加碱石灰或 NaOH固体法
(碱石灰吸水、溶解时放热) CaO
思考:
能将NH4Cl 、(NH4)2SO4、NaCl、 Na2SO4 四种溶液一一区别开来的试剂是( D )
A NaOH C BaCl2 B AgNO3 D Ba(OH)2
思考:
用氢氧化钠代替氢氧化钙好吗?
氢氧化钠易吸水,易结块,不易产生NH3;热的氢氧 化钠对玻璃有腐蚀作用。
棉花的作用: 防止对流,提高集气速度和纯度。 干燥氨气的常用试剂:
①CaO、碱石灰等碱性干燥剂 ②无水CaCl2不能用来干燥NH3(形成CaCl2·8NH3) 实验室中还可用哪些方法快速制氨气: ①加热浓氨水法
∆ (NH4)2CO3 == 2NH3↑+ H2O↑+ CO2↑
由上面的反应可以看出, NH4Cl 、 NH4HCO3、 (NH4)2CO3 受热都能分解,都有NH3产生,但不是所有的铵 盐受热分解都能产生NH3的,例如NH4NO3的分解:
2NH4NO3 == 2 N2↑ + O2↑ + 4H2O
∆
溶解性: 极易溶于水(体积比1 : 700)
高中化学《第四章第四节 氨 硝酸 硫酸 第一课时 氨》课件ppt

思考与交流
• 1、硫酸、硝酸、盐酸都是酸,它们在 组成上用什么特点?
它们都是酸,在水溶液中电离出H+,硫酸、 硝酸是含氧酸,盐酸是无氧酸;硫酸是二元 酸,硝酸和盐酸是一元酸
2、这些特点与酸的通性有什么关系? 用电离方程式表示。
在水溶液中都电离出氢离子 HA=H++A—
3、实验室制氢气时,常用稀硫酸或盐酸,而 不用浓硫酸或硝酸,为什么?
浓硫酸的特性: 1) 吸水性:能吸收水份——干燥气体
O2、H2、N2、 Cl2、 CO2、SO2、HCl
思考:1.能用浓硫酸干燥H2S、NH3气体吗? 浓硫酸不可干燥碱性气体和还原性气体 2.将硫酸铜晶体投入浓硫酸中,有何现象? 蓝色晶体变为白色固体
2)、脱水性
浓硫酸与木屑、棉花、纸屑反应 浓硫酸与蔗糖反应
离子: NH4+、 OH- 和 H+(少量) 氨水是混合物, 不是电解质
一水合氨是电解质
氨水显弱碱性的主要原因是( B )
A、通常状况下,氨的溶解度不大 B、氨水中的NH3 ·H2O电离出少量OH- C、溶于水的氨分子只有少量电离 D、氨本身的碱性弱
用两根玻璃棒分别在浓 氨水和浓盐酸里蘸一下, 然后将这两根玻璃棒接 近(不要接触),观察 发生的现象
2、氨与酸的反应
NH3+HCl = NH4C(l 产生白烟)
(1)若换成蘸有硝酸的玻璃棒不接触能否反应? 若换成蘸有硫酸的玻璃棒不接触能否反应?
(2)将氨气通入硫酸溶液中能发生反应吗?
2、氨与酸的反应
反应方程式
与盐酸反应 与硝酸反应
NH3 + HCl = NH4Cl(白烟)
可用于检验NH3
NH3+HNO3=NH4NO3 (白烟)
人教版化学必修一第四节氨硝酸硫酸教学课件

人教版化学必修一第四节氨硝酸硫酸( 1)
人教版化学必修一第四节氨硝酸硫酸( 1)
③加热分解 写出NH4Cl、NH4HCO3受热分解的化学方程
式:
人教版化学必修一第四节氨硝酸硫酸( 1)
一般被还原为NO,极稀的硝酸可被还原成NH3,生成NH4NO3。 (2)足量金属与一定量浓硝酸反应时,随着硝酸浓度的降低,产物也发
生改变NO2 —NO—NH4NO3。 (3)金属与硝酸反应的一般通式为: ①金属+浓硝酸―→金属硝酸盐+NO2↑+H2O
反应中,表现氧化性(被还原)的 HNO3 占12;表现酸性的 HNO3 占12。
②金属+稀硝酸―→金属硝酸盐+NO↑+H2O 反应中,表现氧化性(被还原)的 HNO3 占14;表现酸性的 HNO3 占34,生成硝酸盐。
人教版化学必修一第四节氨硝酸硫酸( 1)
人教版化学必修一第四节氨硝酸硫酸( 1)
2.硝酸与非金属反应的规律 (1)浓硝酸能与碳、硫、磷等非金属单质反应,一
般生成最高价含氧酸或最高价氧化物、二氧化氮 和水。 (2)与非金属反应:HNO3表现强氧化性,不表现酸 性。 3.硝酸与化合物的反应 硝酸遇还原性物质时显氧化性,遇非还原性物质时 可显酸性,如HNO3遇FeO先发生复分解反应 (HNO3显酸性)生成Fe(NO3)2,Fe2+再被HNO3氧 化为Fe3+(HNO3显氧化性)。
[解析]Cu、Ag合金与HNO3反应过程如下:
人教版化学必修一第四节氨硝酸硫酸( 1)
• 14 gCu、Ag合金与HNO3反应,若是浓硝 酸,还原产物是NO2或NO2与NO的混合物 ;若是稀硝酸,还原产物是NO。Cu、Ag 失去电子,HNO3得到电子,生成NO2或 NO,由于生成的气体和O2都被H2O吸收生 成HNO3,即生成的气体又将电子转移给 O2,所以在整个反应过程中,相当于Cu、 Ag失去的电子转移给0.05 mol O2;0.05 mol O2得到电子的物质的量为0.05 mol×4 =0.2 mol,即Cu、Ag共失去0.2mol电子, 设Cu、Ag物质的量分别为x、y,则
人教版高中化学必修一4.4《氨 硝酸 硫酸》实用课件

探究
(2)含水的胶头滴管在实验 中作用?
引发水上喷
试一试
若实验室只有单孔塞,能否用上述装置 进行喷泉实验?如能,应如何引发喷泉?
探究
(3)若 VL烧瓶充满标况下的氨气,喷泉 实验后溶液充满整个烧瓶,所得溶液物质 的量浓度 __2_21._4__m_ol/L
吸收硫酸 生产中的 二氧化硫
致冷剂
动动脑?
通过今天的学习,若当你遇到氨气泄漏事 故,你将如何应对? 在遇到氨气泄漏时,应该马上疏散到室外,最 好到开阔地带,并站在上风头。
在撤离时,最好准备一块湿毛巾捂住嘴巴。
如果是在距离水面比较近的地方,就尽量跑到 水边,因为氨气溶于水。
四、铵盐及其性质
思考 加热试管中的氯化铵晶体,
使指示剂变色: 稀硫酸与硝酸使紫色石蕊试液变红
与碱发生中和反应: H+ + OH - = H2O 与碱性氧化物反应:2 H+ + CuO = Cu2+ + H2O
与盐反应:
2 H+ + CO3 2- = H2O + CO2
一、硫酸和硝酸的氧化性
1、硫酸的氧化性
(1)脱水性
浓硫酸与木屑、棉花、纸屑反应 浓硫酸与蔗糖反应
没有熔化就直接变成气体,气体在试 管上方又变成氯化铵晶体,这个变化 是升华过程吗?
(1)铵根离子(NH4+)和酸根离 子组成的化合物,易溶于水。
(2)化学性质:
(A) 受热Leabharlann 分解① 稳定、挥发性酸的铵盐
NH4Cl加热
NH4Cl ——△—— HCl ↑ +NH3↑
(HCl +NH3 ———— NH4Cl)
化学必修一第四章第四节氨硫酸硝酸.doc

第四章第四节氨硝酸硫酸一、氨1、氮的固定:概念:的方法叫氮的固定。
2、氛的物理性质:色气味气体,密度空气,溶于水,常温下,1体积水大约可溶解体积氨气。
氨的水溶液叫做。
氨液化(液态的氨称为)液化时热。
3、氛的化学性质(1)与水反应:氨溶于水后大部分与水反应,化学方程式为:氛水不稳定性:O 氨水有性,故氨气可以使酚猷溶液变色或使湿润的红色石蕊试纸变色。
(可用于氨气的检验。
)(2)与酸反应生成铉盐,请完成下列方程式:NH3+1IC1=(课本P98 “图4-28〃操作可用于氛气的检验)NH3+H2S0J=(可用于吸收氨气)NH3+C02÷H20=(生成破铉)(3)NH3的还原性。
NFh中N是一3价,处于最低价态,具有还原性,可被氧化剂(如0/氧化,写出氨被。
2氧化的化学方程式:C4、铉盐的性质:(1)农业上常见的化肥,如、、等都是铉盐。
铉盐都溶于水。
(2)铉盐的不稳定性:铉盐受热易分解例如:NH出CO : , 4 _________________________________________________________NHiC 1 些二_______________________________________(3)铉盐与碱的反应:铉盐与碱的反应放出氨气NH. lN03+Na0H= _________________________________(NH., ) 2S0, i + NaoH二____________________二、氨的实验室制法1、__________________________________________ 反应原理2、装置:〃+”加热装置;发生装置与制相似。
3、收集法;收集的试管口塞上棉团,作用是4、干燥:O不可以用、做干燥剂。
5、检验:(1)用湿润的试纸放在试管口可以看到试纸变;(2) ____________________________________________________6、尾气吸收:导管口放一团用一或浸湿的棉花球),棉花作用:温馨提示:在实验室有时也用①加热浓氨水的方法得到氨气:②把浓氨水滴入固体氢氧化钠中制得氨气:7、实验室能不能用加热氯化铉反应制备氨气?为什么?(3) NHU的检验:如何证明某物质中含有NH「(铉盐)?%1.浓硫酸(一)物理性质:色状液体,挥发,密度比水O(二)浓硫酸的特性1.脱水性:用玻璃棒蘸取浓硫酸滴到滤纸上,现象,体现浓硫酸的性。
化学必修1第四章第四节氨硫酸硝酸2资料

比较学习
O2 H2 N2 Cl2 CO2 SO2 HCl
思考:能用浓硫酸干燥H2S、NH3气体吗?
2) 脱水性 浓硫酸能按水的组成比脱去有机物中的氢和氧元素。
图 4-31 向蔗糖中加入浓硫酸
思考: 浓硫酸的吸水性与脱水性有何区别?
实验1 在点滴板中放入 少量胆矾,再加
入少量浓硫酸
现象:
固体由蓝色变为灰白色,
(碱石灰吸水、溶解时放热)
CaO
④氨的用途 ——重要的化工原料
制纤维、塑料、染料等(有 机合成工业)
制铵盐、 制纯碱
氨
制尿素
制硝酸
制医用稀氨水、 用做制冷剂
自然界氮的循环
1、氮的固定:
生物固氮 途径: 自然固氮
人工固氮
2、氮在自然界中的循环:
【思考与交流2】 氮在空气中含量虽高,却不能为多
数生物体所直接利用,必须通过固氮作 用。固氮作用的两条主要途径,一是通 过闪电等高能固氮,形成的氨和硝酸盐, 随降水落到地面;二是生物固氮,如豆 科植物根部的根瘤菌可使氮气转变为硝 酸盐等。
他因为攻克氨的合
成这一世界难题, 将无数人从饥饿的 死亡线上拯救出来; 他也因发明大量化 学武器并用于战争, 使无数人伤残致死; 他是诺贝尔化学奖 得主受人尊敬,他也 是战争魔鬼遭人唾骂。
一、氨
氮是动植物生长不可缺少的元素,是蛋 白质的重要成分。
氮的固定:将游离态的氮转变为氮的化合物 叫做氮的固定。如工业合成氨 ,
3、氨与氧气的反应——还原性
氨的催化氧化——工业制硝酸的基本反应
-3
0 催化剂
+2 2-
2-
4 NH3 + 5 O2 △ 4 NO + 6 H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2)硝酸的不稳定性 △ 4HNO3 O2↑ +2H2O + 4NO2↑
或光照 浓硝酸发黄的原因: 硝酸分解释放出的二氧化氮溶于硝酸的原故, 硝酸越浓越易分解。
贮存方法:用棕色试剂瓶避光、低温贮存
3)硝酸的强氧化性 硝酸与金属反应(除Au、Pt外)
Cu+4HNO3(浓)=Cu(NO3)2 +2NO2 ↑+2H2O 3Cu+8HNO3(稀)=3Cu(NO3)2 +2NO↑+4H2O
NH4Cl==NH3↑+HCl↑ △ 铵盐的性质 2、受热易分解 NH HCO ==NH 4 3 3↑+H2O↑+CO2↑ 3、与碱反应生成氨 △ NH4Cl +NaOH==NaCl+NH3↑+H2O
1、易溶于水
△
1、NH3的实验室制法
铵盐与碱反应的应用
2、铵离子的检验
2NH4Cl+Ca(OH)2 ==CaCl2+2NH3↑+H2O
安全尾气 吸收法
实验室中还可以用 哪些方法快速制氨气: ①加热浓氨水法 NH3·H2O NH3 ↑+ H2O ②浓氨水加生石灰法
(生石灰吸水、溶解时放热)
浓氨水
浓氨水
CaO
4.氨的用途:
(1)氮肥 (2)制冷剂 (3)化工原料
无机:生产硝酸、铵盐和纯碱等 有机:合成纤维、塑料、染料和尿素等 生产硝酸原理: NH3 NO NO2 HNO3+NO 侯德榜制碱法:
N2+3H2
高温高压 催化剂
2NH3
氮的固定:将游离态的氮转变为氮的化合物
自然固氮 (75%) 氮的固定 高能固氮 (10%)
N2+O2 == 2NO 放电
高温
生物固氮(65%) 人工固氮(25%)
3、氨气的实验室制法:
1)用加热铵盐和碱的混合物的方法来制取氨气。
△ 原理:2NH4Cl+Ca(OH)2 == CaCl2 + 2NH3↑ +2H2O
一、氨
1、物理性质 (1) 无 色,有 刺激性 气味的气体。
(2)密度比空气
小
。
(3)易液化, 液氨可用作
制冷 剂。
(4)极易溶于水。常温下,1体积水约能溶 解 700 体积的氨。氨水的密度比水 , 且氨水浓度越大,其密度越 。
小
小
观察与思考 ----氨气的喷泉实验
实验1 在干燥的烧瓶内充满氨气, 塞上带有玻璃管和胶头滴管 (预先吸入少量水)的胶塞。 组装实验装置。打开橡皮管 上的止水夹,挤压胶头滴管, 观察现象。
2、反应停止后,如果在溶液中再加入足量盐酸,会出 现什么情况?
溶液中存在NO3-,它遇到H+后,会继续氧化铜, 当然此时NO3-、H+的溶度较稀.
练习2
3、工业上拟用Cu与适量的硝酸来制备Cu(NO3)2 ,下 面是三ቤተ መጻሕፍቲ ባይዱ同学提出的 三个方案: 甲 :铜 乙 :铜 浓硝酸 稀硝酸
Cu(NO3)2
Cu(NO3)2 Cu(NO3)2
2)装置: 固+固 加热 气体,同实验室用 KClO3 和 MnO2 固 体 混 合 加 热 制O2装置
3) 干燥:
常用碱石灰(NaOH和CaO固体混合物) 作干燥剂,不能用酸性干燥剂如浓H2SO4、 P2O5等。
4) 收集: 只能用向下排空气法 5) 验满:
用湿润的红色石蕊试纸放在试管口,也 可用玻璃棒蘸有浓盐酸,靠近试管口。
一切铵盐的共同性质,实验室可利用这个性质
来检验NH4+的存在。
(3)氨气跟氧气的反应 ①在催化剂存在的条件下, 催化剂 4NH3+5O2 △ 4NO+6H2O 这个反应叫做氨的催化氧化,它是 工业上制硝酸的基础。
②氨在纯氧中燃烧: 点燃 4NH3+3O2(纯氧)== 2N2+6H2O
氨的工业制法
反应生成水
思考:
通过以上实验体现了浓 硫酸的什么性质?
(3) 强氧化性: 1)与非金属单质的反应
2H2SO4(浓)+C = 2H2O+2SO2↑+CO2↑ 如何检验浓硫酸与碳反应生成的各种产物? ⑴用何试剂检验H2O、SO2、CO2? ⑵三种产物检验有先后吗?
△
2)与金属反应
根据铜与浓硫酸反应的实验现 象讨论并写出化学方程式,标 出电子转移的方向和数目?
三、 硫酸
1、纯硫酸
(1)无色、透明、粘稠、油状液体
(2)难挥发性 (3)易溶于水,能以任意比与水混溶 (用水稀释放出大量的热)
将浓硫酸慢慢注入水中并不断搅拌
2、硫酸溶液 稀硫酸
完 全 电 离
浓硫酸
以 分 子 态 存 在 为 主
H2SO4=
2+ 2H +SO4
H2SO4
酸的通性 自身特性 (常用浓硫酸为98%,密度为1.84 g/cm3,沸点338º C)
2NO + O2 = 2NO2 3NO2 + H2O = 2HNO3 + NO
练习1
1、足量的Cu中加入少量的浓硝酸,可能会发生什么反 应? 一开始是铜与浓硝酸反应: Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O 随着反应进行, 硝酸由浓变稀,则发生: 3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O
知识 迁移3
可以选用NaOH 溶液
你能设计出一个蓝色的喷泉实验 来吗?
氨与水的反应 NH3 + H2O
(大部分)
NH3· H2O
(弱碱)
(小部分)
NH4 + OH
+
–
氨水能与哪些物质反应?
NH3· H2O的不稳定性: NH3 · H2O NH3↑+ H2O
氨与酸的反应 实验:魔棒生烟
NH3 + HCl
4.浓硫酸的特性
(1) 吸水性
1)能吸收一般的游离水
可用作干燥剂,但是不能干燥碱 性气体(如NH3)和还原性气体(如 H2S,HI,HBr)
2)还能夺取结晶水合物中的结晶水
CuSO4· 5H2O粉末中加浓硫酸 现象:蓝色粉末变白色 浓 H SO 2 4 CuSO CuSO4· 5H2O 4 蓝色 白色
实验现象 形成喷泉,溶液充满烧瓶
结论:氨气的溶解性极大
观察与思考 ----氨气的喷泉实验
(1)氨为什么会形成喷泉?
氨极易溶于水,使烧瓶内外形 成较大的压差;
(2)溶液为什么变为红色?
氨气溶于水溶液显碱性。
知识 迁移1
下列装置中都收满了NH3, 你认为都能引发喷泉实验吗?
知识 迁移2
前面学过的气体SO2和Cl2, 在水中溶解度不大,那么它们能 不能也设计出喷泉实验呀?如能, 需要什么样的试剂?
②与非金属反应
C+4HNO3 (浓)= 2H2O+4NO2↑+CO2↑
注意:加热条件下,浓硝酸能将非金属单质氧
△
化到最高价对应的氧化物或酸
③硝酸还能氧化FeO、 Fe(NO3)2(Fe2+)、HBr (Br-)、 HI(I-) 、H2S (S2-)、 SO2等具有还原性的 化合物发生氧化还原反应,因此,不能用硝酸 与有关的盐反应制取HI、 SO2、 H2S、 HBr等 气体。
缺氮的玉米植株
铵盐的性质 铵盐的性质 ⑴铵盐都易溶于水 ⑵铵盐受热易分解 NH4HCO3 = NH3↑ + CO2↑+ H2O
△
NH4Cl = NH3 ↑ + HCl ↑
⑶铵盐与碱反应 实质: NH4+ + OH- = NH3 ·H2O
△
(NH4)2SO4 + 2NaOH = 2NH3 · H2O + Na2SO4
上述两个反应正确吗?
资料卡片
1体积浓硝酸与3体积浓盐酸的混合物叫 做王水,它的氧化能力更强,金(Au ) 和 铂(Pt )不溶于硝酸,但溶于王水。
帮 你 记 忆
(1:3)
浓HNO3氧化性很强,能与 除金和铂外的金属发生氧化还 原反应。但是Fe 、Al活泼金 属和稀HNO3能反应,但在冷 的 浓HNO3中钝化。
NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3↓ 2NaHCO3==Na2CO3+H2O+CO2↑
归纳总结
氨 物理性质:无色,有刺激性气味,极易溶于水…… 的 + – NH +H O NH · H O NH + OH 1、与水反应 3 2 3 2 4 性 质 化学性质 2、与酸反应生成铵盐 NH3 +HCl =NH4Cl 催化剂 3、与氧气反应 4 NH3+5 O2 △ 4NO+6H2O
图 4-31向蔗糖中加入浓硫酸
C12H22O11浓硫酸 12C + 11H2O (蔗糖) 现象:
颜色 白-棕-黑 蔗糖炭化 试管壁热 浓硫酸吸水放热 体积膨胀,呈疏松海绵状 有气体生成 如果将生成的气体通入品红 有SO 生成 2 溶液褪色
比较学习
浓硫酸的吸水性和脱水性有什么区别?
吸水性是指浓硫酸直接与水分子结合。 吸收现成的水 脱水性是指浓硫酸将许多有机物中 的氢、氧元素按水的比例脱去。
NH4Cl
(氨气与HCl在空气中相遇时产生白烟)
(检验氨气的方法之一)
(2)氨气跟酸的反应 ——生成铵盐
氨气与硝酸反应: NH3+HNO3==NH4NO3 氨气与硫酸反应: 2NH3+H2SO4==(NH4)2SO4
氨与酸反应生成铵盐。铵盐又叫铵态氮肥。
有一位农民看到 自己买的一袋碳 酸氢铵化肥受了 潮,就在太阳底 下晒,等他下午 去取时,发现少 了许多,是谁偷 了他的氮肥?
