第一节 离子键和离子晶体gai
离子键、离子晶体(课件PPT)
高二化学精品课件 离子键和离子晶体

教科书 P35
1. 如果把阴、阳离子看成是球形对称的,阴阳离子的电荷 分布是均匀的,则它们在空间的各个方向上的静电作用是 否相同? 2. 如果是相同的,在静电作用能达到的范围内,只要空间 范围许可,一个离子是否应当同时尽可能多得吸引带相 反电荷的离子呢?
结论: 4. 离子键的特征
通常情况下,阴、阳离子可以看成是球形对称
23
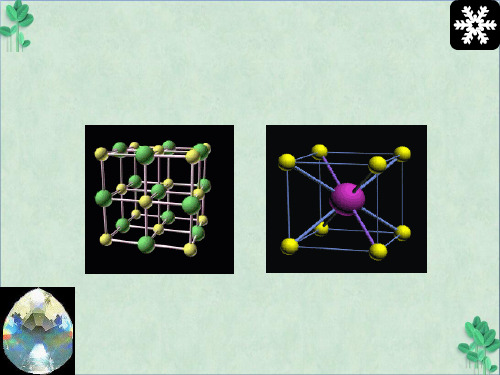
氯化铯的晶体
24
氯化铯的晶胞 教科书 P 36
25
• 找出CsCl、NaCl两种离子晶体中阳离子和 阴离子的配位数,它们是否相等?
离子晶体 阴离子的配位数 阳离子的配位数
NaCl
6
6
CsCl
8
8
26
• 氯化钠与氯化铯均为 AB 型离子 晶体,但两者的阴、阳离子周围 带相反电荷离子的数目却不同, 你认为造成这一差异的可能原因 是什么?
① MgO
④ AlCl3 ⑦ KOH
② Al2O3 ⑤ NaCl
⑧ BaSO4
③ MgCl2 ⑥ NaOH
离子键和离子化合物是什么关系?
6
3、离子键与离子化合物
(1)定义:
含有离子键的化合物
离子化合物包括:
(1)活泼的金属元素如(IA、IIA)和活泼的非
金属元素如(VIA、VIIA)形成的化合物。
的,其电荷分布也是球形对称的,只要空间条件允
许,则一个离子可以同时吸引多个带相反电荷的离
子。因此离子键没有方向性和饱和性。
9
重晶石 BaSO4
10
莹石 CaF2
11
胆矾 CuSO4·5H2O
12
食盐 NaCl
13
• 常温常压下,离子化合物大多数以晶体 的形式存在。通过学习有关离子键和离 子晶体的知识,你知道构成离子晶体的 微粒是什么吗?离子晶体中微粒间的作 用是什么?
高中化学专题3.2离子键离子晶体素材

3.2 离子键 离子晶体一、离子键1.离子键的形成前面我们已经学过,金属元素的电负性小,其原子易失去价电子形成阳离子;非金属元素的电负性较大,其原子易得到电子形成阴离子,当这两种原子相互接近到一定程度时,容易发生电子得失而形成阴、阳离子,阴、阳离子通过静电作用形成稳定化合物。
这种阴、阳离子通过静电作用形成的化学键叫离子键。
阴、阳离子是形成离子键必不可少的粒子,缺一不可。
如MgCl 2中含有Mg 2+、Cl -,KAl(SO 4)2·12H 2O 中含有K +、Al 3+、SO 2-4及H 2O 分子。
可见,离子化合物中含阴、阳离子至少各1种,且不一定不含分子。
2.离子键的实质离子键的实质是静电作用,它包括阴、阳离子之间的引力和它们的核与核、电子与电子之间的斥力两个方面,当引力和斥力之间达到平衡时,就形成了稳定的离子化合物,它就不再显电性,即显电中性。
离子键的强弱与阴、阳离子所带电荷及核间距有关。
据库仑定律可知2r q q k F -+⋅⋅=(k 为系数)。
3.离子键的特征没有方向性和饱和性。
为什么这样说呢?那是因为在通常情况下,阴、阳离子可看成球形对称,它们的电荷分布也是球形对称的,它们在空间的各个方向上的静电作用相同,所以在各个方向上都可以与带相反电荷的离子发生静电作用,且在静电作用能达到的范围内,只要空间条件允许、一个离子可以同时吸引多个带相反电荷的离子。
因此,离子键没有方向性和饱和性。
二、离子晶体1.离子键:(1)定义:阴、阳离子之间强烈的电性作用。
(2)特征:无饱和性和方向性。
(3)本质:电性作用。
(4)存在:离子晶体中。
2.离子晶体:(1)定义:阴、阳离子通过离子键结合,在空间呈现有规律的排列所形成的晶体。
注意:离子晶体的构成粒子是阴、阳离子,所以在离子晶体中,无分子存在,也无原子存在。
如NaCl 、CsCl 只表示晶体中阴阳离子个数比,不表示分子式。
(2)常见的AB 型离子晶体有NaCl 型、CsCl 型、ZnS 型等。
无机化学第九章 离子键和离子晶体

(二) 离子的电子组态
(1) 2 电子组态:离子只有 2 个电子,外层电子组态为 1s2。 (2) 8 电子组态:离子的最外电子层有 8 个电子,外层电子组 态为 ns2np6。 (3) 18 电子组态:离子的最外电子层有 18 个电子,外层电子 组态为 ns2np6nd10 。 (4) 18+2 电子组态:离子的次外电子层有 18 个电子,最外 电子层有 2 个电子,外层电子组态为(n-1)s2(n-1)p6(n-1)d10ns2。 (5) 9~17 电子组态:离子的最外电子层有 9~17 个电子,外层 电子组态为 ns2np6nd1~9。
(二) 离子的电子组态 (electronic configuration)
◆ 稀有气体组态(8 电子和 2 电子组态) ◆ 拟稀有气体组态(18 电子组态) ◆ 含惰性电子对的组态(18+2电子组态) ◆ 不规则组态(9~17电子组态)
不同类型的正离子对同种负离子的结合力大小:
< < 8 电子构型的离子
(2) 对同一元素的正离子而言, 半径随离子电荷升高而减 小。例如: Fe3+<Fe2+
(3) 对等电子离子而言,半径随负电荷的降低和正电荷的 升高而减小。例如: O2->F->Na+>Mg2+>Al3+
9~17电子层 构型的离子
18或18+2电子层构型 的离子
练习
9-1 给出下列或离子的价电子层电子组态:
(1) Cl-
(2) Fe3+
(3) As3+
答:(1) 17Cl:[Ne]3s23p5 (2) 26Fe:[Ar]3d64s2 (3) 33As:[Ar]4s24p3
Cl-: [Ne]3s23p6 属 8 电子组态
3.3.2离子晶体课件人教版选择性必修2

离子键成分的百分数更小,
是分子晶体
离子键的百分数大于50% , 离子键的百分数小于50%,偏向
当作离子晶体处理
共价晶体,当作共价晶体处理
Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
离子晶体
共价晶体
分子晶体
偏向某种晶体类型的过渡晶体,就当作该类型的晶体处理。
四类晶体都有过渡型
近代实验表明,纯洁的离子键是不存在的,绝大多数离子键都不是典型的, 只是离子性占优势而已。
上下、左右、前后
①每个晶胞中实际拥有的Cs+有1个,Cl-有1个。
②每个Cs+(Cl-)周围距离最近的Cs+(Cl-)有 6 个,构成 正八面体 。
③若晶胞参数为a pm,阿伏加德罗常数的值为NA,
168.5
则氯化铯晶体的密度为 _N_A_·_a_3×__10_-_3_0 _g·cm-3。
整理归纳
NaCl
276
1
801
NaBr
290
1
750
MgO
205
CaO
239
2
2800
耐火
2
2576
材料
离子半径、 影响 所带电荷
离子键强弱 影响
熔点
离子半径越小,所带电荷越多,离子键越强,熔点就越高,硬度也越大。
离子晶体的熔点都很高吗?
P88
二、离子晶体 熔沸点高低取决于离子键的强弱,一般来说,离子晶体中阴阳
(5)Al2O3晶体中存在离子键,属于离子晶体( × )
2.下列说法不正确的是
A.离子键和共价键没有明显界限
B.离子晶体和共价晶体没有明显界限
√C.离子晶体中含有离子键,不含共价键
3.2 离子键 离子晶体(教师版) (苏教2019选择性必修2)

第二单元离子键离子晶体第1课时离子键离子晶体目标导航1.能结合实例描述离子键的成键特征及其本质。
2.能解释和预测同类型离子化合物的某些性质。
3.会描述常见类型的离子化合物的晶体结构。
4.能运用模型和有关理论解释不同类型离子化合物的晶胞构成。
知识精讲知识点01 离子键1.离子键和离子化合物(1)概念:阴、阳离子之间通过静电作用形成的化学键叫离子键,由离子键形成的化合物叫离子化合物。
(2)离子键的成键微粒是阳离子和阴离子。
阴离子可以是单核离子或多核离子,如Cl-、O2-、H-、O22-、OH-、SO42-等。
阳离子可以是金属离子(如K+、Ag+、Fe3+)或铵根离子(NH4+)。
有的离子化合物只含有离子键,有的离子化合物中既含有离子键又含有共价键。
2.离子键的形成及特征(1)离子键的形成:①阴、阳离子之间的静电引力使阴、阳离子相互吸引,阴、阳离子的核外电子之间、原子核之间的静电斥力使阴、阳离子相互排斥。
②当阴、阳离子之间的静电引力和静电斥力达到平衡时,阴、阳离子保持一定的平衡间距,形成稳定的离子键,整个体系达到能量最低状态。
(2)离子键的特征:离子键没有方向性和饱和性。
阴、阳离子在各个方向上都可以与相反电荷的离子发生静电作用,即没有方向性;在静电作用能够达到的范围内,只要空间允许,一个离子可以同时吸引多个带相反电荷的离子,即没有饱和性。
【即学即练1】(1)下列化合物中,属于离子化合物的有_______,其中,既含有离子键又含有共价键的有_______。
①HCl ②NaCl ③Na2O ④NaOH(2)写出下列离子化合物的电子式:NaOH_____________ K2O_____________ NH4Cl____________答案:(1)②③④④(2)知识点02 离子晶体1.概念及结构特点(1)概念:由阴、阳离子按一定方式有规则地排列形成的晶体。
(2)结构特点①构成微粒:阴离子和阳离子,离子晶体中不存在单个分子,其化学式表示的是离子的个数比。
离子键和离子晶体

(3)1 族、2 族、13~17 族的同族电荷数相同 的离子的半径,随离子的电子层数增加而增大。
8
第二节 离子晶体
一、晶格和晶胞 二、离子晶体的特征 三、离子晶体的类型 四、离子晶体的半径比规则
9
固体可分为晶体和非晶体两大类。 晶体与非晶体的主要区别是: (1)晶体一般具有整齐规则的几何外形,而非晶 体(如玻璃、沥青、石蜡等)没有固定的几何外形。 (2)晶体具有固定的熔点,而非晶体没有固定的 熔点。 (3)晶体具有各向异性,其某些物理性质在不同 方向上是不同的(如石墨在与层垂直方向上的电导率 为与层平行方向上的 1/104 ),而非晶体的物理性质在 不同方向上都相同。
2
第一节 离 子 键
一、离子键的形成
二、离子键的特征 三、离子的特征
3
一、离子键的形成
当电负性较小的活泼金属元素的原子与电负性 较大的活泼非金属元素的原子相互接近时,金属原 子失去最外层电子形成带正电荷的阳离子;而非金 属原子得到电子形成带负电荷的阴离子。阳、阴离 子之间除了静电相互吸引外,还存在电子与电子、 原子核与原子核之间的相互排斥作用。当阳、阴离 子接近到一定距离时,吸引作用和排斥作用达到了 平衡,系统的能量降到最低,阳、阴离子之间就形 成了稳定的化学键。这种阳、阴离子间通过静电作 用所形成的化学键称为离子键。
在离子晶体中,阳、阴离子被限制在晶格格 点上振动,不能移动,因此离子晶体不导电。但 是当离子晶体熔融或溶于水时,产生自由移动的 阳、阴离子,从而可以导电。
14
三、离子晶体的类型
在离子晶体中,由于阳、阴离子在空间的排列方 式不同,因此离子晶体的空间结构也就不相同。对于 AB 型离子晶体,常见的有 CsCl 型、NaCl 型和 ZnS 型三种典型晶体结构类型。
离子键、离子晶体ppt1 苏教版
离子晶体种类繁多,结构多样 一.离子晶体的空间结构 :
(1)氯化钠型晶胞
Na+ Cl-
钠离子和氯离子在晶胞中的位置: 钠离子:体心和棱中点; 或者反之;交错排列 氯离子:面心和顶点.
复习:晶胞中金属原子数目的计算(平均值)
1/4 1/8
1/2
1
每个NaCl晶胞含Na+、Cl-的个数?
Na+ Cl-
计算方法:均摊法 顶点占1/8;棱占1/4;面心占1/2;体心占1 1 1 1 + Cl : 8 6 4 Na : 12 1 4 8 2 4
(2)CsCl晶胞
ClCs+
铯离子和氯离子的位置? 体心 铯离子: 或者反之 氯离子: 顶点 P36问题解决1:每个晶胞含 铯离子、氯离子的个数? 铯离子:1个; 氯离子:1个。
5. 如图所示,在氯化钠晶体中,与 每个Na+等距离且最近的几个Cl所围 成的空间几何构型( B ) A. 十二面体 B. 正八面体 C. 正六面体 D. 正四面体
谢谢!再见!
• • • • • • • • • • • • • • • • • • • • • • • • • • • • • • •
科学探究1
NaCl和CsCl的晶胞
阴阳离子 离子 阴离子的 阳离子的 的配位数 晶体 配位数 配位数 比
NaCl CsCl
NaCl的晶体结构模型
---Cl-
--- Na+
Na6 Cl-的配位数为: 6
CsCl的晶体结构及晶胞构示 意图
---Cs+
(1) 离子晶体稳定存在的条件
离子形成晶体时,阴、阳离子总是尽可能紧密地排列,且一种离子 周围所环绕的带相反电荷的离子越多,体系能量越低,所构成的离 子晶体就越稳定。
高二化学苏教版课件:离子键_ 离子晶体

离子化合物中的化学键 表示方法:电子式 有的离子化合物中只含有离子键,如MgO、NaF、MgCl2等;
有的离子化合物中既含有离子键又含有共价键,如NaOH等。
相紧邻的A有 6
个,与一个A相紧邻的B有 2 个。
Cl−
Cl−
8×
1 8
=1
Cs+
Cs+ 1
每个CsCl晶胞中含有1个Cs+和1个Cl-, 个数比1:1。
Cs+和Cl配位数均为8
思考 NaCl、CsCl都是AB型离子化合物,其中一种离子周围紧邻的带相
反电荷的离子数目却不同。原因是什么?
在NaCl晶体中,每个Na+的周围有6个Cl-, 而在CsCl晶体中,每个Cs+的周围有8个Cl-。 两者的数目之所以不同,主要在于离子半径的差异。Cs+的半径要大 于Na+,因而可以吸引更多的Cl-。
Cl−
1 8
1 2
Na+
1 4
= 4N×A×5a83.×5 10-30= NA×2a334×10-30g·cm-3
若氯化铯晶胞参数(晶胞正方形的边长)为a pm,请计算其密度。
a
pm
=
168.5 NA×a3×10-30
g·cm-3
课堂总结
阳离子 阴离子
离子键
离子晶体 晶格能
性质差异较大
结构
计算氯化钠型 氯化铯型源自3.2离子键 离子晶体一、离子键的形成 思考 钠原子与氯原子是如何结合形成氯化钠的?
静电作用
离子键离子晶体 完整版课件

即时应用 1. 下列叙述正确的是( ) A.离子键有饱和性和方向性 B.离子化合物只含有离子键 C.有些离子化合物既含有离子键又含有共 价键 D.离子化合物中一定含有金属元素
解析:选C。一种离子对带异种电荷离子的 吸引作用与其所处的方向无关,所以离子键 无方向性,一种离子可以尽可能多地吸引带 异种电荷的离子,所以离子键无饱和性;离 子化合物中一定含有离子键,可能含有共价 键,如NaOH;离子化合物中不一定含有金 属元素,如NH4Cl。
形成稳定的钠离子(Na+:1s22s22p6);氯原子 的电子排布式为:1s22s22p63s23p5,易得到一 个电子,达到氩原子的电子排布,形成稳定 的氯离子(Cl-:1s22s22p63s23p6);然后钠离子 (阳离子)和氯离子(阴离子)间以离子键相结合 形成氯化钠晶体。
探究导引2 离子键的形成过程中,只表现为 阴、阳离子间的静电吸引作用吗? 提示: 不是。离子键的实质是静电作用, 阴、阳离子之间的静电引力使阴、阳离子相 互吸引,阴离子的核外电子与阳离子的核外 电子之间、
新知初探自学导引
自主学习
一、离子键的形成 1. 概念:___阴__、__阳__离__子____间通过 __静__电__作__用____形成的化学键叫做离子键。 2. 形成:在离子化合物中,阴、阳离子之间 的___静__电__引__力____使阴、阳离子相互吸引,
阴离子的核外电子与阳离子的核外电子之
共价化合物HCl溶于水形成能导电的溶液,所 以C项错误;共价化合物不含离子,以分子形 式存在,在熔融状态下也不会电离出离子, 所以不能导电,而离子化合物可以电离出离 子,所以D项正确。
要点突破讲练互动
要点一 离子Leabharlann 的形成探究导引1 从原子结构的角度说明氯化钠 中离子键的形成过程。 提示:钠原子的电子排布式为: 1s22s22p63s1,易失去最外层的一个电子,达 到氖原子的电子排布,
离子键和离子晶体

立方ZnS型离子晶体:
所属晶系: 立方; 点阵: 立方F; 结构基元及每个晶胞中结构基元的数目: ZnS, 4个; Zn和S离子的配位数都是4;
离子的分数坐标:
1 1 1 1 1 1 A为(0,0,0),( , ,0), ( ,0, ), (0, , ) 2 2 2 2 2 2 3 3 3 3 1 1 1 3 1 1 1 3 B为( , , ), ( , , ), ( , , ),( , , ) 4 4 4 4 4 4 4 4 4 4 4 4
③晶体化学定律
哥希密特对影响离子晶体结构型式的因素作 了简明扼要的总结。他指出:“离子晶体的结构型 式,取决于其结构基元(原子、离子或原子团)的数 量关系、离子半径的大小及极化作用的性质”。这 一概括被称为哥希密特晶体化学定律。此定律不 仅适用于离子晶体,也同样适用于其他晶体。可 见影响晶体结构型式的主要因素有三个: (1)晶体的 组成及数量关系; (2)组成晶体微粒的大小关系; (3) 微粒之间的极化作用。 由于上述因素影响晶体结构型式,这就出现了 类质同晶现象及同质多晶现象。
E(r)
核 间距
第一项是库仑作用 ,另一项是排斥作用 dE( r ) 通过 0, 可求出两个离子间的平 衡核间距 dr
在晶体中, 例如NaCl型晶体, 当正离子与负离 子之间的距离为r (r= r++ r-)时, 每个Na+离子周围 有: 6个距离为1 8个距离为 3 6个距离为 4 …… r的Cl- r的Cl-
对一个Cl-离子, 其库仑作用能ECl-为:
ECl Z Ze 2 A 4 0 r
1mol.的Na+和1mol.的Cl-组成的晶体中, 库仑能为:
N Z Ze 2 EC ( E Na ECl ) AN 2 4 0 r
第九章离子键和离子晶体-推荐下载

2
NaCl(s)
△ H4
△H2=I+E=495.8-348.8=147kJ/mol I 是电离能,E 是电子亲合势 ∵∣I∣>∣E∣,∴需供给能量。 (3)气态离子结合成气态离子型化合物, 即是气态 Na+与 Cl-结合成气态 NaCl, 这是由于正负离子间强烈的相互吸引 而成,是高度的放热过程。
第九章 离子键和离子晶体 教学重点: 1.了解离子晶体的结构特征与某些物
理性质的关系; 2.离子晶体的晶格能。 3.了解离子极化的概念及其应用;
第一节 离子键 一、离子键的形成 (一)氯化钠离子键形成过程的玻恩-哈 伯循环 1.形成条件:电负性相差较大(>1.7) 的金属和非金属元素,可通过电子得失, 形成正、负离子。正、负离子间由于静 电引力相互靠近,达到一定距离后体系 出现能量最低点,形成离子键。 2.形成过程:
1
对全部高中资料试卷电气设备,在安装过程中以及安装结束后进行高中资料试卷调整试验;通电检查所有设备高中资料电试力卷保相护互装作置用调与试相技互术关,系电通,力1根保过据护管生高线产中0不工资仅艺料可高试以中卷解资配决料置吊试技顶卷术层要是配求指置,机不对组规电在范气进高设行中备继资进电料行保试空护卷载高问与中题带资2负料2,荷试而下卷且高总可中体保资配障料置2试时32卷,3各调需类控要管试在路验最习;大题对限到设度位备内。进来在行确管调保路整机敷使组设其高过在中程正资1常料中工试,况卷要下安加与全强过,看度并25工且52作尽22下可护都能1关可地于以缩管正小路常故高工障中作高资;中料对资试于料卷继试连电卷接保破管护坏口进范处行围理整,高核或中对者资定对料值某试,些卷审异弯核常扁与高度校中固对资定图料盒纸试位,卷置编工.写况保复进护杂行层设自防备动腐与处跨装理接置,地高尤线中其弯资要曲料避半试免径卷错标调误高试高等方中,案资要,料求编试技5写、卷术重电保交要气护底设设装。备备置管4高调、动线中试电作敷资高气,设料中课并技3试资件且、术卷料中拒管试试调绝路包验卷试动敷含方技作设线案术,技槽以来术、及避管系免架统不等启必多动要项方高方案中式;资,对料为整试解套卷决启突高动然中过停语程机文中。电高因气中此课资,件料电中试力管卷高壁电中薄气资、设料接备试口进卷不行保严调护等试装问工置题作调,并试合且技理进术利行,用过要管关求线运电敷行力设高保技中护术资装。料置线试做缆卷到敷技准设术确原指灵则导活:。。在对对分于于线调差盒试动处过保,程护当中装不高置同中高电资中压料资回试料路卷试交技卷叉术调时问试,题技应,术采作是用为指金调发属试电隔人机板员一进,变行需压隔要器开在组处事在理前发;掌生同握内一图部线纸故槽资障内料时,、,强设需电备要回制进路造行须厂外同家部时出电切具源断高高习中中题资资电料料源试试,卷卷线试切缆验除敷报从设告而完与采毕相用,关高要技中进术资行资料检料试查,卷和并主检且要测了保处解护理现装。场置设。备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程规定,制定设备调试高中资料试卷方案。
化学课件《离子键、离子晶体》优秀ppt1 苏教版
ZnS的晶体结构示意图
根据硫化锌的结构模型确定晶胞,并分
4 析其构成。每个晶胞中有
个Zn2+,
4 有
个S2-
氯化钠与氯化铯均为AB型离子晶体,但两者 的阴、阳离子周围带相反电荷离子的数目却 不同,你认为造成这一差异的可能原因是什 么?
二.离子晶体的配位数以及与 r+/r- 的关系
97.有三个人是我的朋友爱我的人.恨我的人.以及对我冷漠的人。 爱我的人教我温柔;恨我的人教我谨慎;对我冷漠的人教我自立。――[J·E·丁格] 98.过去的事已经一去不复返。聪明的人是考虑现在和未来,根本无暇去想过去的事。――[英国哲学家培根] 99.真正的发现之旅不只是为了寻找全新的景色,也为了拥有全新的眼光。――[马塞尔·普劳斯特] 100.这个世界总是充满美好的事物,然而能看到这些美好事物的人,事实上是少之又少。――[罗丹] 101.称赞不但对人的感情,而且对人的理智也发生巨大的作用,在这种令人愉快的影响之下,我觉得更加聪明了,各种想法,以异常的速度接连涌入我的脑际。――[托尔斯泰] 102.人生过程的景观一直在变化,向前跨进,就看到与初始不同的景观,再上前去,又是另一番新的气候――。[叔本华] 103.为何我们如此汲汲于名利,如果一个人和他的同伴保持不一样的速度,或许他耳中听到的是不同的旋律,让他随他所听到的旋律走,无论快慢或远近。――[梭罗] 104.我们最容易不吝惜的是时间,而我们应该最担心的也是时间;因为没有时间的话,我们在世界上什么也不能做。――[威廉·彭] 105.人类的悲剧,就是想延长自己的寿命。我们往往只憧憬地平线那端的神奇【违禁词,被屏蔽】,而忘了去欣赏今天窗外正在盛开的玫瑰花。――[戴尔·卡内基] 106.休息并非无所事事,夏日炎炎时躺在树底下的草地,听着潺潺的水声,看着飘过的白云,亦非浪费时间。――[约翰·罗伯克] 107.没有人会只因年龄而衰老,我们是因放弃我们的理想而衰老。年龄会使皮肤老化,而放弃热情却会使灵魂老化。――[撒母耳·厄尔曼] 108.快乐和智能的区别在于:自认最快乐的人实际上就是最快乐的,但自认为最明智的人一般而言却是最愚蠢的。――[卡雷贝·C·科尔顿] 109.每个人皆有连自己都不清楚的潜在能力。无论是谁,在千钧一发之际,往往能轻易解决从前认为极不可能解决的事。――[戴尔·卡内基] 110.每天安静地坐十五分钟·倾听你的气息,感觉它,感觉你自己,并且试着什么都不想。――[艾瑞克·佛洛姆] 111.你知道何谓沮丧---就是你用一辈子工夫,在公司或任何领域里往上攀爬,却在抵达最高处的同时,发现自己爬错了墙头。--[坎伯] 112.「伟大」这个名词未必非出现在规模很大的事情不可;生活中微小之处,照样可以伟大。――[布鲁克斯] 113.人生的目的有二:先是获得你想要的;然后是享受你所获得的。只有最明智的人类做到第二点。――[罗根·皮沙尔·史密斯] 114.要经常听.时常想.时时学习,才是真正的生活方式。对任何事既不抱希望,也不肯学习的人,没有生存的资格。
离子键离子晶体ppt课件.ppt

比较下列离子键强度:MgCl2__>__CaCl2__>__SrCl2__>__BaCl2 NaCl > CsCl
2013浙江卷自选模块
NaF的熔点 >
H+
N N BF4-的熔点(填>,=,
<),其原因是
。
两者均为离子化合物,且阴阳离子电荷数均为1, 但后者的离子半径较大,离子键作用较弱,因 此其熔点较低。
1) 离子电荷数的影响 2) 离子半径的影响 离子所带电荷越多、离子半径越小,晶格能越大,离子键 就越强
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
例1.下列关于晶格能的说法中正确的是( C )
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
1. 下列用电子式表示化合物的形成过程正确的是:AB
A. K O
K
K [ O ]2 K
B. Cl
Ba
Cl
[ Cl ] [ Ba ]2 [ Cl ]
b.“绿色”溶剂
c.复合材料 d.绝热材料
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
写出下列离子晶体的化学式
Y
X
该晶体的化学式为
XY2(或Y2X)
Ca O Ti
该晶体的化学式为 CaTiO3
A.晶格能指形成1 mol离子键所放出的能量 B.晶格能指破坏1 mol离子键所吸收的能量 C.晶格能指1 mol离子化合物中的阴、阳离子由相互远离的气 态离子结合成离子晶体时所放出的能量 D.晶格能的大小与晶体的熔点、硬度都无关
第九章离子键和离子晶体

第九章离子键和离子晶体教学重点:1.了解离子晶体的结构特征与某些物理性质的关系;2.离子晶体的晶格能。
3.了解离子极化的概念及其应用;第一节离子键一、离子键的形成(一)氯化钠离子键形成过程的玻恩-哈伯循环1.形成条件:电负性相差较大(>1.7)的金属和非金属元素,可通过电子得失,形成正、负离子。
正、负离子间由于静电引力相互靠近,达到一定距离后体系出现能量最低点,形成离子键。
2.形成过程:Na(s)+1/2Cl2(g)→NaCl(s)△f H NaCl =-392kJ/mol上述过程实际上是多个过程的总结果,从而过程的能量变化是多个过程的能量变化的累加。
这个循环包括下列步骤:(1)固态金属钠变成气态的钠原子,需要供给升华热S ;氯分子变成气态氯原子需要供给解离能D ,对一个Cl 原子只需1/2D ,这一步变化是吸热的。
△H 1=S+1/2D=230kJ/mol(2)气态原子间发生电子转移形成离子。
△H 2=I+E=495.8-348.8=147kJ/molNa(s) +12Cl 2NaCl(s)Na(g)+(g)Cl(g)Na (g)+Cl (g)-+NaCl(g)△H 12△ H 3△ H 4I是电离能,E是电子亲合势∵∣I∣>∣E∣,∴需供给能量。
(3)气态离子结合成气态离子型化合物,即是气态Na+与Cl-结合成气态NaCl,这是由于正负离子间强烈的相互吸引而成,是高度的放热过程。
△H3=-526kJ/mol(4)气态的离子化合物转变为固态的离子晶体,这也是放热过程。
△H4=-243kJ/mol∴△f H NaCl=△H1+△H2+△H3+△H4=230+147-526-243=-392kJ/mol第一、二步是吸热的,第三、四步是放热的,整个过程能量是降低的。
这就从能量变化的角度说明了离子化合物能稳定形成。
(二)氯化钠离子键的键能NaCl离子键的键能是指1mol气态NaCl分子离解为气态中性原子Na(g)和Cl(g)时所需要吸收的能量,它等于上述循环中第二、三步能量变化之和的负值(因为反应方向相反)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A=1.638
(Cu )
9
+
(Ag )
10
+
(Au )
12
+
3.卡普斯钦斯基公式
Z1Z 2 34.5 1 U 1.20210 {r r } {r r }
5
n n
n :晶体分子式中正离子的个数 n :晶体分子式中负离子的个数
例如:CaCl2 1 2 3 2 1 34.5 5 U ( NaCl ) 1.202 10 (1 ) 95 181 95 181
点阵能
定义:由1mol气态的Mz+和Xz-离子生成
1molMX晶体时,释放出的总能量,它是离
子键强弱的重要标志,用符号U 表示。
晶格能的测定----Born-Haber循环
一、离子键理论
1、离子键的形成和特征 成键两步骤:
(1)电子转移形成离子,分别达到Ne和Ar的稀有气体原子的结构, 形成稳定离子。 (2)靠静电吸引,形成化学键。
ne nNa(3s1 ) nNa (2s 2 2 p 6 ) nNaCl
ne nCl (3s 2 3 p5 ) nCl (3s 2 3 p 6 )
非晶体又称无定形体,其内部质点排列不规则,没有一定的结晶
外形。
2、离子晶体ห้องสมุดไป่ตู้其特征结构
离子晶体:由离子键化合物形成的晶体(ion crystals) 。
特点:
(1)晶格结点上交替排列着正、负离子,依离子键结合。
(2)离子晶体中的正负离子按一定配位数在空间排列,因此晶体 中不存在单个分子,而是一个巨大的分子
Z Z e 2 r0n 1 B n
Z Z e2 1 E (1 ) r0 n
即表示一对正、负离子处于平衡位臵时相互作用的势能
许多对Na+和Cl-离子互相结合成NaCl晶体点阵时的情况:
1 6 12 8 6 24 U NZ Z e (1 )( ......) n r0 2r0 3r0 4r0 5r0
YAlO3 LaAlO3 LaCrO3 LaMnO3 LaFeO3
KNgF3 KniF3 KZnF3
(8) 尖晶石型结构
尖晶石的通式是AB2O4,其中A代表二价金属离子, B代表三价金属离子,典型晶体是MgAl2O4,其晶体结构 以及结构中多面体的连接方式如下图所示,结构中O2-可 看成是立方紧密堆积,Mg2+充填于1/8的四面体空隙中,Al3+ 充填于1/2的八面体空隙中,八面体之间以共棱方式、八面体与 四面体之间以共顶方式相连。
CuSO4· 2O 5H
三、几种典型的离子晶体结构
1. 氯化钠结构
面心立方晶格 正、负离子配位数为6 正、负离子半径介于0.414 0.732 实例: KI , LiF, NaBr, MgO, CaS 所有碱金属卤化物(除CsCl,CsBr和CsI外),碱土金属氧化物 和硫族化物,卤化物(除AgBr外)均具有氯化钠型的结构
Z Z e2 E吸引= r
排斥能为:
B E排斥= n r
式中B是比例常数,n是玻尔推斥常数,其值与离子的构型有关。
一对正负离子的总势能跟离子间距的关系是:
Z Z e2 B E总=E吸引+E排斥=- + n r r
当两离子处于平衡距离r=r0时,体系的能量最低,即:
dE Z Z e2 nB ( )rr0=0=- n1 2 dr r0 r0
有确定的熔点(如玻璃为非晶体,无确定的熔点);
能自发地形成规则的多面体外形; 各向异性,即在晶体的不同的方向上有不同的物理性质 均匀性,即同一块晶体的各部分的宏观性质相同; 能对x射线产生衍射效应等。
晶体的结构具有周期性。
非晶体不具备晶体的以上特性,主要就是由于晶体结构具有周 期性而非晶态物质不具有周期性所致。
离子键特点:作用力的实质是静电引力;
既无方向性也无饱和性。
2、离子的性质
(1)离子的电荷
对简单正负离子,离子的电荷是指形成离子键时,原子得到 或失去电子后所具有的电荷数。
(2)离子的电子构型
指由原子失去或得到电子所形成的外层电子构型
二、离子晶体
1、晶体(crystal)的基本概念
(1)晶体的共同特性
(5) 莹石结构
钙离子占据面心立方格子各格点的位臵,格子中有8个氟离子, 每个氟离子被最近的四个钙离子以四面体方式配位着。 阴离子的配位数为4,阳离子的配位数为8。 许多金属(如Cd, Hg,Pb,Sr,Ba)的氟化物、镧系和锕系元素的二 氧化物、二氧化锆等具有这种结构。 如果在氟化钙结构中,阳离子和阴离子互易其位, 则形成一种反莹石结构,Li2O、Na2O等具有这种结构。
CrN ZrN
0.4140 0.4610
CaO
SrO
0.4797
0.5150
MnO
FeO
0.4435
0.4332
TiC
ScN
0.4320
0.4440
(2) CsCl 型
体心立方晶格 正、负离子配位数为8 正、负离子半径介于 0.732 1 实例:TiCl, CsBr, CsI 具有氯化铯结构的化合物有:铯的卤化物(除CsF外),TlCl, 一些络合物,如K[SbF6]等
(4) 纤锌矿(ZnS)结构
硫离子按ABAB…….六方密堆积,锌离子占据其中一半的四 面体间隙。 硫离子和锌离子周围的配位数均为4。 它与闪锌矿结构的差别仅在于密堆积的层次。 具有纤锌矿结构的化合物有:BeO, ZnO, MN (其中M=Al, Ga, In), MnS等
纤锌矿(a-ZnS)型结构
第二章 化学键和晶体结构
第一节 离子键和离子晶体
晶体中原子的结合从两个方面来认识:
第一,从原子形成晶体时的能量效应来考虑, 多个原子结合成分子以至形成晶体的根本原因在于, 原子结合起来后体系具有更低的能量,体系趋于稳定;
第二,从晶体中原子的空间配臵即晶体的几何构型来考虑
离子键:由正负离子之间的静电引力而形成的化学结合力。
成键过程中势能变化情况
系统的总能量决定于离子之间的相互距离R。当排斥力与吸引力 达平衡时(R=R0),系统能量达到最低点,正负离子在各自平衡 位臵振动便形成离子键。
图2.1 势能图
形成离子键的条件:成键原子电负性相差较大;易形成稳定
离子;形成离子键,释放能量大。
离子型化合物:由离子键形成的化合物。
n —Born指数,与离子电子层结构类型有关。
当 R0 以pm,U 以 kJ mol 为单位时,
138940 1Z 2 AZ 1 U (1 ) kJ mol1 R0 n
1
A的取值: CsCl型 A=1.763
NaCl型 A=1.748
ZnS型 n的取值:
离子电子 层构型 n值 He 5 Ne 7 Ar Kr Xe
= = =90 = = =90 = = =90 = = 90 ==90, =120 = =90 , 120 90°
晶体实例 Cu,NaCl Sn,SnO2 I2,HgCl2 Bi,Al2O3 Mg,AgI S,KClO3
尖晶石的晶体结构以及结构中多面体的连接方式
具有尖晶石型结构的主要晶体
氟、氰化合 物
BeLi2F4 MoNa2F4 ZnK2(CN)4 CdK2(CN)4 MgK2(CN)4 TiMg2O4 VMg2O4 MgV2O4 ZnV2O4 MgCr2O4 FeCr2O4 NiCr2O4 氧化物 ZnCr2O4 CdCr2O4 ZnMn2O4 MnMn2O4 MgFe2O4 FeFe2O4 CoFe2O4 CoCo2 O4 CuCo2 O4 FeNi2O
2
12 8 6 24 A (6 ......) 2 3 4 5
A叫马德隆常数,它是一个无量纲的结构特性常数,它只决定 于晶体点阵的几何因素,而与离子的半径和电荷无关
2.Born-Lande公式 NAZ1Z 2 1 U (1 ) R0 n
式中:R0—正负离子核间距离, Z1,Z2 —分别为正负离子电荷的绝对值, A —Madelung常数,与晶体类型有关,
(6) 金红石结构
阳离子占据体心立方格子的格点,同时被六个阴离子配位着。 多数过渡元素和重金属的二氧化物,如GeO2、SnO2、MnO2、 RuO2、OsO2、PbO2等,以及镁、镍、钴、铁、锰、锌的二氟化 物都具有金红石的结构。
(7) 钙钛矿型结构
钙钛矿的通式是ABO3,其中A代表一价或二价金属离子, B代表四价或五价金属离子。其典型矿物为CaTiO3。 CaTiO3结构中Ca2+占有立方面心的角顶位臵,O2-处于立方面心的 面心位臵,所以,CaTiO3结构可以看成是由O2-和半径较大的Ca2+ 共同组成立方紧密堆积,Ti4+充填在1/4的八面体空隙中,Ti4+的配 位数是6,Ca2+的配位数是12。
体心立方结构
(3) 闪锌矿(ZnS)结构
锌离子被硫离子以四面体的四个顶角 的方式包围着,硫离子按ABCABC…….. 立方密堆积中,硫离子所构成的四面体 中间的空隙里,有一半充有锌离子 正、负离子配位数为4 正、负离子半径介于0.225 0.414
闪锌矿晶体结构
具有这种结构的物质有CuX,MS和MSe(其中M=Be,Mn,Zn, Cd,Hg),MP,MAs和MSb(M=Al,Ga,In),SiC等。
离子的堆积方式与正负离子的半径之比有一定关系。
粒子的配位数:在晶体内一个粒子与相邻最近的其它粒子的数目。
离子晶体中,正负离子的半径比(r+ / r-)不同,则正离子的配位 数不同。
AB型离子晶体的三种空间构型
AB型离子晶体的三种空间构型的特点
