第五章 (3)表面活性剂
五章表面活性剂与药用高分子材料【共28张PPT】

(五)起泡剂与消泡剂
●泡沫:气体分子分散在液体中的分散系统。 ●起泡剂 :HLB高,应用外用避孕泡腾片 ●消泡剂。 HLB 1~3 如硅酮、辛醇等。
(六)去污剂与洗涤剂:HLB13~16 (七)其他
●透皮促进剂 1~2%
●晶型稳定剂
第二节 药用高分子材料(polymer in pharmaceutics)
离子型表面活性剂缔合数<100,非离子型>100. ●临界胶团浓度(CMC,Critical micelle Concentration)
开始形成胶团时溶液的浓度
○CMC测定;如表面张力变化。
○CMC值主要由表面活性剂性质决定;
○CMC值受温度、pH值及电解质的影响。
Unimers
Surfactant Aggregates
Dimers or trimers
Normal micelles spherical
cylindrical
Inverted hexagonal phase Reverse micelles
vesicle
Bilayer lamella
4 nm
(三)亲水亲油平衡值(Hydrophil-Lipophilalance value,HLB值)
不溶于水,有弱W/O的能力。O/W乳剂的辅助乳化剂
7、蔗糖的脂肪酸酯:
●无毒、无味、无臭,可降解。 ●单酯是亲水性,乳化剂
●双酯是不溶于水,润滑剂。
三、 基本特性:
(一)表面活性:显著降低表面张力的性质。
(二)胶团 ● 低浓度时,溶液表面定向排列降低,
浓度增加(表面饱和)后,胶团或胶束(Micelle)。 -亲油基团向内,亲水基团向外的多分子有序缔合体。
大学表面活性剂复习资料(考试用)

大学表面活性剂复习资料(考试用)表面活性剂化学复习资料名词解释题目第一章表面活性剂的概述1.表面:液体或固体和气体的接触面。
(物质和它产生的蒸汽或者真空接触的面)2. 界面:液体与液体,固体与固体或液体的接触面。
(物质相与相之间的分界面称之为界面)3. 表面张力:指垂直通过液面上任一单位长度、与液面相切的收缩表面的力(N/m)。
4. 表面自由能:指液体增加单位表面上所需做的可逆功,或恒温恒压下增加单位表面积时体系自由能的增值,或单位表面上的分子比体相内部同分子量所具有的自由能过剩值,称为表面自由能(J/m2)。
5. 表面活性:在液体中加入某种物质使液体表面张力降低的性质叫表面活性。
如肥皂中的脂肪酸钠,洗衣粉中的烷基苯磺酸钠等。
6. 表面活性剂:是指在某液体中加入少量某物质时就能使液体表面张力急剧降低,并且产生一系列应用功能,该物质即为表面活性剂。
第二章表面活性剂的作用原理1. 吸附:表面上活性剂这种从水内部迁至表面,在表面富集的过程叫吸附。
2. 低表面能固体:表面活性剂的表面能<100mJ/m2的物质3. 高表面能固体:表面活性剂的表面能>100mJ/m2的物质。
4. 胶束:两亲分子溶解在水中达一定浓度时,其非极性部分会互相吸引,从而使得分子自发形成有序的聚集体,使憎水基向里、亲水基向外,减小了憎水基与水分子的接触,使体系能量下降,这种多分子有序聚集体称为胶束。
(2)反胶束:表面活性剂在有机溶剂中形成极性头向内,非极性头尾朝外的含有水分子内核的聚集体,称为反胶团。
(3)临界胶束浓度:表面活性剂溶液的表面张力随着活性剂浓度的增加而急剧地降低,但是当浓度增加到一定值后,表面张力随溶液浓度的增加而变化不大,此时表面活性剂从分子或离子分散状态缔合成稳定的胶束,从而引起溶液的高频电导、渗透压、电导率等各种性能发生明显的突变,这个开始形成胶束的最低浓度称为临界胶束浓度(CMC)。
(4)亲水-亲油平衡值(HLB):系表面活性剂中亲水和亲油基团对油或水的综合亲合力,是用来表示表面活性剂的亲水亲油性强弱的数值。
表面活性剂应用导论第5章阳离子表面活性剂

5.1 阳离子表面活性剂概述
②锍盐化合物
锍盐化合物可溶于水,具有除草、杀灭软体动物、
杀菌和杀真菌等作用,是有效的杀菌剂,而且对皮肤的
刺激小,因此使用性能优于传统的季铵盐化合物。
氧化锍衍生物是锍盐型阳离子表面活性剂中性能十
分优异的品种,它在阴离子洗涤剂和传统的松香皂配方
中均能保持良好的杀菌性。
R1
+
γ(0.01%溶液) 72.3 72.2 71.9 70.9 68.7 67.1 62.4 53.9 43.7 43.2 43.4 43.6
CH3
+ R N CH2
Cl-
CH3
①随着烷基碳链长度的 增加,表面活性剂的表 面张力逐渐下降。
表中: γ-表面张力,mN/m
5.2 阳离子表面活性剂的性质
(3)表面张力 分子结构相同时,表面张力与溶液的浓度有关:
季铵盐分子中所含的主要是吗啉环、 吡啶环、 咪 唑啉环、 哌嗪环、 喹啉环,等。
主要用作:
湿润剂、洗涤剂、杀菌剂、缓蚀剂、纤维柔软剂、 助染色剂、抗静电剂、分散剂、起泡剂,等。
5.3 几种阳离子表面活性剂
(4)含杂环的季铵盐 ①含有吗啉环的季铵盐
+ C16H33 N
O· HCl ·(SO3OCH3)-
Krafft点可以衡量表面活性剂的溶解性能。
5.2 阳离子表面活性剂的性质
(2)Krafft 温度点 ②Krafft点与成盐的配对阴离子的关系
如,配对阴离子对十六烷基吡啶Krafft点的影响:
+ C16H33 N
X-
配对阴离子X
Cl Br I
Krafft点/℃
17 28 45
按照 Cl、Br、I的次序,表 面活性剂的Krafft点温度升高, 由此可知,其溶解性能将按此 顺序依次降低。
第五章 表面活性物质

5.4 表面活性剂的胶束作用
5.4.4 胶束形成热力学
胶束形成过程是自发过程,胶束体系是热力学稳定性体系。
(1) 相分离模型
胶束的形成 ① 非离子型
新相的形成
动态平衡
aN
am
Kp
=
am aNj
VG0 -RT ln KP
=
-RT
ln
am aNj
17
5.4.4 胶束形成热力学
每摩尔表面活性剂形成胶束时的自由能变化
种类 A B C
HLB a b c
质量 x y z
5.6.3 HLB值的应用
增溶作用 HLB = 15~18 消泡作用 HLB = 1~3 根据HLB值可推测表活剂的可能用途 可根据HLB值选择合适的表面活性剂
27
第五章 表面活性物质
5.7 不溶物的表面膜
- 不溶性物质 (表活剂如R-COOH) 在水表面形成的单分子膜
n = nα+ nβ 但 nα ≠ cα·Vα,浓度不均匀。
7
5.3.1 表面过剩-吸附
α 相溶质的摩尔数 nα β 相溶质的摩尔数 nβ
界面相中溶质过剩量 ns = n-(nα + nβ)
单位面积的表面上过剩 (吸附量):
= ns
A
A -界面相的截面积
一般气相浓度<<液相浓度
nα + nβ ≈ nα
5.3.3 Gibbs吸附公式的应用
考察表面活性剂在界面相中的状态 ♦ 测定表活剂分子在界面上占据的面积
由σ ~ c 曲线 → Г ~ c 曲线
Гm
Гm单分子层饱和吸附量
cc 1
m Km
表面活性剂, Гm 近似看作表面浓度:
第五章涂料中的流变学与表面化学

Wa LG (1 cos ) Wi LG cos S LG (cos 1)
1800,可沾湿; <900,可浸湿; =00,可完全铺展。
表面张力低得液体有向表张力高得固体表面铺展得倾向。
16
5、2用、i表3粗示糙其粗表糙面度得: 润i 湿AALi
Ai为真实得表面积,AL为Ai得投影面积,对于液体i=1,对 于固体,i≥1。
以铺展情况为例:
E1 SGi E2 SLa LG (i a) i LG SG (i a) S E1 E2 (a i)[( SG SL )i LG (a 2i) a]
P85 18
SG SL LG cos
当界面完全接触时,即a=i,再引入本征接触角得概念,可 得
G SL ( SG LG )
粘附功 Wa G 若 Wa 0 此过程可自发进行。 若将上述过程得固体改为液体,则:
G 0 ( LG LG ) 2 LG
内聚功,反映液体自身结合得牢固度,就是液体分子间相互作用力 大小得表征。
13
2、浸湿 指得就是固体浸入液体得过程,如颜料置入漆料过程。
24
5、3流平与流挂
涂料施工后能否达到平整光滑得特性,称为流平性。
当涂料涂布于一个垂直表面时,由于重力,涂料有向下流动得倾 向,可能引起表面不平整得情况,称为流挂。
5、3、1流平性 当涂料涂刷在基材上时,会留下刷痕,刷痕可因涂料干燥前得流 动而减轻。当涂料流平性差时,肉眼可以观测到表面不平得现 象。刷痕有如一个波形。 流平用Orchard公式评价:
4
5、1、3 温度对粘度得影响
按分子热运动得孔穴理论,低分子液体得粘温关系可用 Andrad方程表示:
E
(T ) Ae RT
(E—流动活化能 ) 对某种液体,在适当得温度变化范围内,E近似为定值
表面活性剂
·表面活性剂 ·表面活性剂在界面上的吸附
·胶束理论
·表面活性剂亲水亲油平衡问题
·表面活性剂作用及应用
第一节 表面活性剂概述
一、溶液的表面张力
2 cos h gr
H2O
C2H5OH (aq)
NaCl (aq)
溶液的表面张力不仅与温度、压力有关, 并且还与溶液的种类和浓度有关。
(三)两性表面活性剂
• 两性表面活性剂基本不刺激皮肤和眼睛;在相当宽的pH值 范围内都有良好的表面活性作用;它们与阴离子、阳离子、 非离子型表面活性剂都可以兼容。由于以上特性,可用作 洗涤剂、乳化剂、润湿剂、发泡剂、柔软剂和抗静电剂。
• 主要品种:甜菜碱衍生物、咪唑啉衍生物等。
(四)非离子表面活性剂 • 非离子表面活性剂因在水中不电离以及能够精细地改变分 子结构而具有独特的性质。 • 非离子表面活性剂去除油性污垢的能力很强,而且具有防 止污垢在合成纤维表面再沉积的能力。它们的临界胶束浓 度也比离子型表面活性剂低一到二个数量级。
B、脂肪醇聚氧乙烯醚硫酸盐(AES) • 脂肪醇聚氧乙烯醚硫酸盐又称脂肪醇硫酸盐。由于分 子中加入了乙氧基使其具有很多优点,如抗硬水性强, 泡沫适中而稳定,溶解性好。缺点是在酸性和强碱性 条件下不稳定,易于水解。 • AES采用C12~C14的椰油醇为原料,有时也用C12~C16 醇,与2 ~4分子环氧乙烷缩合。再进一步进行硫酸化, 中和可用氢氧化钠、氨或乙醇胺。
0 与c成对数关系 0
②当浓度小时
cB / c o cB ln(1 ) a a 0 cB =b =kcB 0 a
0 与c成线性关系 0
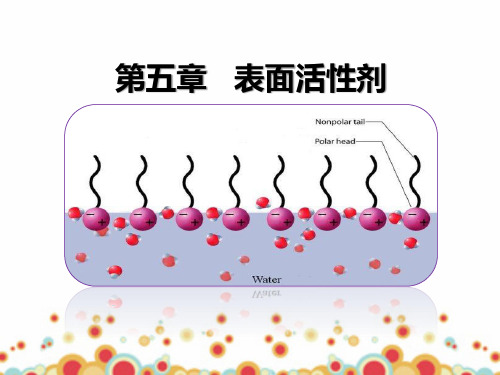
表面活性剂的分子结构: ①具有长碳链(碳原子数大于8)的极性有机化合物。 ②从结构上看,表面活性物质是两亲分子,一端亲水(-OH, -COOH,-SO3Na等),另一端亲油(憎水)(-R等)。 虽然表面活性剂分子是两亲性分子,但并不是所有的两亲 性分子都是表面活性剂,只有亲油部分足够长的两亲性物质 才是表面活性剂。
第五章 表面活性剂
5.1.2 表面活性剂的分子结构特点
分子结构具有不对称性,由非极性的(亲油的 或疏水的)碳氢链和极性的(亲水的或疏油的)基 团两部分组成,而且两部分通常分处分子链的两端。 例如棕榈酸钠(C15H31COONa)
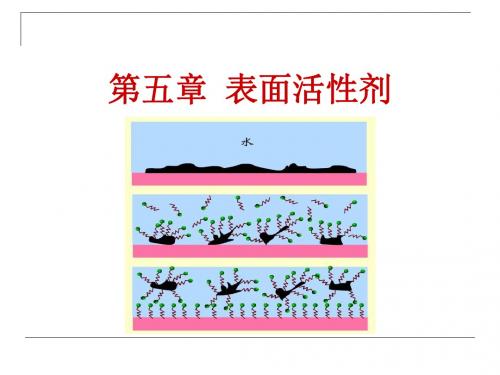
表面活性剂在水中随着浓度增大,表面上聚集 的活性剂分子形成定向排列的紧密单分子层,多余 的分子在体相内部也三三两两的以憎水基互相靠拢, 聚集在一起形成胶束,这开始形成胶束的最低浓度 称为临界胶束浓度。
==CH—
—(C3H6O)— 0.15 氧丙烯基 —CF2— 0.870 CF3—
5.2.2 相转型温度(PIT)
HLB值存在三个缺点:
一是它没有考虑到油相与水相本身的性能;
二是它没有考虑表面活性剂浓度的影响; 三是它没有考虑到温度及各相体积的影响。 针对HLB值的缺点,日本学者筱田耕三提出了相转 型温度PIT(Phase Inversion Temperature)的概念,
1.种类: 胺盐类、季铵盐类
2.结构:含有一个五价氮原子。
3.特点:水溶性大,在酸性和碱性溶液中较稳定具
有良好的表面活性和杀菌作用。 4.应用:杀菌;防腐;皮肤、粘膜手术器械的消毒。 5.常用药物:①苯扎氯铵(洁尔灭);②苯扎溴铵 (新 洁尔灭)
5.1.2.3 两性表面活性剂
分子结构上同时具有正负电荷基团的表面活性 剂,随介质的pH可成阳或阴离子型。 常用品种:卵磷脂、氨基酸型和甜菜碱型两性离子 型表面活性剂。 最大优点:适用于任何PH溶液,在等电点时也无沉 淀。 性质:碱性水溶液中呈阴离子性质,起泡性良好、 去污力亦强; 酸性水溶液中呈阳离子性质,杀菌 力很强,毒性小。
8~10 10~13 >13
在水中分散情况
第五章--表面活性剂

表面活性剂
5.1 概 述
5.1.1什么是表面活性剂
溶质的浓度对溶剂表面张力的影响有三种:
1)物质的加入会使溶剂表面张力略微升高,属于此类物 质的强电解质有无机盐、酸、碱等;
2)物质的加入会使溶剂的表面张力逐渐下降,如低碳醇、 羧酸等有机化合物; 3)物质少量加入就会使溶剂表面张力急剧下降,但降到 一定程度后,就变得很慢或几乎不下降。
1)高级脂肪醇与环氧乙烷加成物
ROH+ nCH2 CH2 O
NaOH Cat.
R O (CH2CH2O)n H
所用脂肪醇有:月桂醇、十六醇、油醇、鲸蜡醇等
2)烷基酚和环氧乙烷的加成物
R OH + nCH2 CH2 O R O (CH2CH2O)n H
所用烷基酚有:壬基酚、辛基酚、辛基甲酚等
3)脂肪酸与环氧乙烷的加成物
单酯盐 O
性质与硫酸酯盐相近,抗电解质、硬化能力较强,洗净能力 好,为低泡性表面活性剂。可作为净洗剂、润湿剂、乳化剂、 抗静电剂和抗蚀剂。缺点:污染环境、影响水质
5.1.3.2 阳离子表面活性剂
这类表面活性剂分为两类: (1)铵盐类表面活性剂,可由高级胺 (C12-18,伯、仲、叔)用盐酸或醋酸处 理而得:
特点:水溶性好,发泡能力强,去污力强;毒性低,对皮肤刺 激性小,有良好的生物降解性和抗微生物能力,优良的抗静电 性和柔软平滑性,与其它表面活性剂相容性好。但是价格较贵。
CH3 R N CH 2 COOCH3
+
5.1.3.4
非离子表面活性剂
亲水基为羟基-OH和醚键-O-
由于亲水性较弱,必须由几个羟基或醚键才能发挥
(1)按工业用途分类:
表面活性剂的润湿作用

Cos = (SG - SL)/ LG
有机固体及高聚物的表面能则与一般液体不相上下,不易
被润湿,被称为低能表面(SV 100mJ/m2 )。
无机固体易被润湿,如常见的金属及其氧化物、硫化物、
无机盐等,其表面被称为高能表面。通常,硬度大、熔点 高的固体表面能也较高(SG = 1(见图6-11),Ø 愈大表面愈粗糙。 **浓度为3mol/L的CaCl2水溶液。
2.影响接触角滞后的因素 (1)表面粗糙度
杨氏方程:SG - SL = LG cos0
粗糙表面的杨氏方程: r(SG - SL) = LG cosW
Wentzel 方程:粗糙度 r = cosW/cos0> 1
有时为不相溶的液相-液相-固相,即在固液界面上一种液
体被另一种液体所取代, 例如:洗涤时,水洗液取代织 物表面的油污。 润湿剂是指能促进水或水溶液将空气从液体或固体表面上 取而之的物质。 润湿过程与相关相的表面和界面性质有密切的关系,故表 面活性剂必然在此过程中显示出它的作用。
第一节 润湿过程
4.粉末测定法 (1)Bartell静态法
H 2 LG cos Rgρ
(2)Washburn动态法 h2 CR LG cos t
式中η为液体的粘度; C为校正因子, R为仪器常数, 对指定系统CR为定值, 可选用一种渗入速率最 快的液体作标准样品来标定。
二.接触角滞后现象
1.角度测量法 直接量角法
斜板法
2.长度测量法-滴高法和最高滴高法 sin = 2HR/(H2+R2) or tg(/2) = H/R 当
R H m
cos 1 gHm2 /2 LG
《药物制剂技术》第5章 液体制剂

NUAA
★脂肪酸山梨坦(Span,司盘)
-种类:司盘-20,司盘-40,司盘-60,司盘-65, 司盘-80,司盘-85
-用途:HLB1.8~3.8,是常用的W/O型乳化剂
O CH2OOCR
脂肪酸(种类决定不同的司盘类产品)
HO
OH
OH
脱水山梨醇
NUAA
★聚山梨酯(Tween,吐温)
NUAA
(2)羟苯酯类(尼泊金类)
❖ 几种合用有协同作用 ❖ 常用浓度0.03-0.16% ❖ 在酸性、中性、碱性溶液均有效
作用强弱顺序: 在酸性溶液中>中性溶液中>碱性溶液中
NUAA
(3)山梨酸及其盐 ❖ 酸性溶液中效果好 ❖ 常用浓度0.2-1.2%。 (4)苯扎溴铵 ❖ 有强烈的杀菌,防腐作用,只作外用。
温度
NUAA
四、表面活性剂的生物学性质 (1)对药物吸收的影响
可增进或降低药物的吸收
★胶束增溶或包裹药物 ★增加生物膜的通透性
NUAA
(2)与蛋白质相互作用
--在不同条件下蛋白质与离子型表面活性剂发生 电性结合。
--破坏蛋白质的螺旋结构
NUAA
(3)表面活性剂的毒性和刺激性
口服毒性
毒 性 阳离子型 大
形成比单一溶剂更易溶解药物的混合溶剂, 称为潜溶剂。 如:苯巴比妥(90%乙醇中溶解度最大)
NUAA
(三)助溶法 即加入第三种物质,使难溶性药物(溶质)在
溶剂中溶解度增大的过程。这第三种物质称为助溶 剂。
(助溶剂是一些低分子化合物,而不是胶体或表面活性剂 )
NUAA
助溶作用的机理: 形成了溶解度更大的络合物、复合物、缔合物。
表面活性剂在溶液中的表面活性

(d)表示浓度已大于临界胶束浓度时的表面活性剂分子状态。 此时再增加表面活性剂,水溶液表面已形成了单分子膜,空气 和水的接触面不会再缩小。因此也就不能再降低表面张 力了。而胶束不断增加,由球状变为棒状,再到层状等。
作
问答题:
业
1、影响表面活性剂在界面吸附的因素有哪些, 如何影响?
2、解释:表面活性剂在溶液中如何维持自身 稳定状态?
度达到一定程度后,吸附量不再增加,而趋于恒
定,此时称饱和吸附,极值称饱和吸附量Γ
∞
。
了解:
对离子型表面活性剂,表面活性离子在表面形成定向排列 的、带电的吸附层后,在其电场作用下,反离子被吸引,一部 分进入吸附层(固定层),另一部分以扩散形式分布,形成双 电层结构。
二、影响吸附的因素
1、亲水基 亲水基小者,分子横截面积小,饱和吸附量大。 非离子型表面活性剂饱和吸附量大于离子型。 2、疏水基 疏水基小者,分子横截面积小,饱和吸附量大。
(b)
溶液
稳定化
稳定化
(a)
(c)
(c)表面活性剂浓度逐渐升高。水溶液表面聚集了足够 量的表面活性剂,并毫无间隙地密布于液面上形成单分 子膜,此时空气与水完全处于隔绝状态。如再提高浓度, 则水溶液中的表面活性剂分子就各自以几十、几百地聚
集在一起,排列成憎水基向里,亲水基向外的球状胶束。
此为正规的胶束。表面活性剂形成胶束的最低浓度叫临 界胶束浓度(cmc)。
4、cmc的物理意义
表面活性剂溶液的浓度只有稍高于它的临界胶 束浓度时,才能充分显示其作用。 润湿、渗透作用,只需界面吸附,浓度稍高于 cmc即可显示效果。 乳化、分散、增溶、净洗,需大量胶束起作用, 浓度需超过cmc较多。
5、临界胶束浓度的测定 表面张力法
第五章 表面活性剂混合体系

三、双水相(Aqueous Surfactant Two Phase, ASTP)
①双水相的形成 正负表面活性剂混合溶液中大聚集体之间相 作用,形成网架结构,和水液一起分离出来, 成为一富集了表面活性剂的流动的“似凝胶” 相,与贫表面活性剂的水相共存的现象。 ② 双水相的特点 ● “贫”、“富”表面活性剂相是相对的;双水相的上相 和下相都是极稀的表面活性剂溶液。(<0.1mol/L) ● “富”表面活性剂相通常粘度大; “贫”表面活性剂相 粘度 小,似水。 ● 两相的位置没有固定规律,密度相差不大(百分位)。 ● “富”表面活性剂相一般为大聚集体的絮凝相,如长棒 状 胶束,多层囊泡、层状相等; “贫”表面活性剂相一般含 有分散的小球形或短棒状胶束,小囊泡等。
⑸ 碳氟/碳氢混合体系显著降低油水界面张力
——而单一碳氟不行,因为碳氢碳氟互疏
5.4.2 正负及离子-非离子混合体系
γ ,CMC均降低 相互作用强烈,不各 自形成胶束,而是形 成混合胶束。 很多非离子表面活性 剂表现出微弱的正电 性,与负离子表面活 性剂混合时类似正负 混合。 碳氢极性添加物降低 碳氟体系表面张力和 CMC的效率低于其在碳 氢混合体系的效率。
重要的表面活性剂混合体系
●同系物混合体系 ●离子/非离子型表面活性剂混合体系 ●表面活性剂与疏水盐混合体系 ●表面活性剂与水溶性大分子混合体系 ●正负离子型表面活性剂混合体系 ● 碳氟、碳氢链表面活性剂混合体系
5.1 表面活性剂同系物混合体系
分子间无相互作用: 1+2=1.2 体相知cmc10,cmc20,x1,x2
在胶束中, 达平衡时, 所以, 而组分单独存在时, 所以, 即:
第五章_反胶团萃取

图是表面活性剂聚集体的可能的微观构造
正胶团: 表面活性剂的极 性头朝外,疏水的 尾部朝内,中间形 成非极性的“核”
水
极性 “头”
非极性的 “核”
非极性 “尾”
有机溶剂 反胶团: 表面活性剂的 极性头朝内,疏 水的尾部向外, 中间形成极性的 “核” 极性的“核”
极性 “头”
非极性 “尾”
在反胶团中有一个极性核心,它包括由表 面活性剂极性端组成的内表面、平衡离子 和水,被称之为“水池”。 因为这个“水池”具有极性,可以溶解具 有极性的分子和亲水性的生物大分子,而 极性分子和/或亲水性的生物大分子也因此 可"溶解"在非极性的有机溶剂中。
3常用表面活性剂表面活性剂的存在是构成反胶团的必要条件有三类表面活性剂都可在非极性溶1阴离子型表面活性剂2阳离子型表面活性剂3非离子型表面活性剂表面活性剂有机溶剂表面活性剂有机溶剂aotn烃类c10异辛烷环己烷四氯化碳苯brij60辛烷ctab己醇异辛烷己醇辛烷tritonx己醇环己烷磷脂酰胆碱苯庚烷tomac环己烷磷脂酰乙醇胺苯庚烷常用的表面活性剂及其相应的有机溶剂在反胶团萃取蛋白质使用最多的是阴离子型表面活性剂aotaot容易获得它具有双链形成反胶团时无需添加辅助表面活性剂且有较好的强度
反胶团:是两性表面活性剂在非极性有机 溶剂中亲水性基团自发地向内聚集而成 的、内含微小水滴的、空间尺度仅为纳 米级的集合型胶体。是一种自我组织和 排列而成的,并具热力学稳定的有序构 造。
反胶团的微小界面和微小水相具有两 个特异性功能: (1)具有分子识别并允许选择性透过的 半透膜的功能; (2)在疏水性环境中具有使亲水性大分 子如蛋白质等保持活性的功能。
2)、混合表面活性剂反胶团体系: 是指两种或两种以上表面活性剂构成 的体系,一般来说,混合表面活性剂反 胶团对蛋白质有更高的分离效率。 3)、亲和反胶团体系: 是指除了有组成反胶团的表面活性剂 以外,还有具有亲和特征的助剂,它的 亲和配基与蛋白质有特异的结合能力, 往往极少量亲和配基的加入就可使萃取 蛋白质的选择性大大提高。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
五、加溶
1、加溶的概念 当表面活性剂溶液的浓度增大时,表面活性剂会缔合 形成聚集体,胶团(或胶束)。 正胶团:在水相中的胶团称为正胶团,通常指的胶团即 为正胶团,能加溶不溶于水或微溶于水的油类; 反胶团:在油相中的胶团称为反胶团或逆胶团。由于油 的种类很多,油相中的胶团又统称为非水胶团,能加溶水或 极性溶剂。
2012-5-9
23
(1)有机高分子絮凝剂的分子结构与电荷密度 有机高分子絮凝剂一般为共聚物,多为无规或嵌段共聚物,有的在 高分子主链上还带有支链或环状结构。有机高分子絮凝剂为线性结构时, 一般絮凝效果较好。 无规共聚物:单体M1,M2在大分子链上无规排列,两单体在主链上 呈随机分布,没有一种单体能在分子链上形成单独的较长链段。 :~~~~~M1 M1M2 M2M2 M1M2 M1M2 M2M1~~~~~ 目前开发出的共聚物中多数是这一类,如丁二烯-苯乙烯无规共聚 物(丁苯橡胶)。 嵌段共聚物:由较长的M1链段和较长的M2链段间隔排列形成的大分 子链,根据链段的多少可以分为:二嵌段,如苯乙烯-丁二烯共聚物; 三嵌段,如苯乙烯-丁二烯-苯乙烯;多嵌段共聚物等。 对由M1,M2两种单体组成的二嵌段共聚物可表示为:~~~~~ M1M1M1M1 M1M1 M2 M2M2 M2M2 M2~~~~~
2012-5-9
6
(4)加溶于胶团的极性基层 对短链芳香烃类的苯、 乙苯等较易极化的碳氢化合物,开始加溶时被吸附于胶团水界面处,加溶量增多后,插入定向排列的表面活性剂极性 基之间,进而更深地进入胶团内核。在聚氧乙烯基为亲水基 的非离子表面活性剂胶团溶液中,苯加溶于胶团的聚氧乙烯 外壳中(下图d)。
2012-5-9 24
有机高分子絮凝剂的电荷密度取决于分子链节中可电离 基团的数量。 阳离子和阴离子型有机高分子絮凝剂溶解在水溶液中, 能离解成多价的高分子离子并带有大量反离子。许多高分子 离子是柔软弯曲的长链,在水溶液中,由于高分子离子的带 电而使柔顺的分子链变得伸展,高分子离子带的电荷越多, 伸展的程度就越大。 絮凝效率高的有机高分子,其电荷密度和分子量都需 要有一适当值。阴离子絮凝剂应具有较高的分子量和较低的 电荷密度,在水溶液中,其分子链应是柔顺并有一定伸展度 的线性结构。
2012-5-9
11
(2)表面活性剂的类型 具有同样疏水基的表面活性剂,其加溶量次序: 非离子型>阳离子型>阴离子型。 原因:非离子型表面活性剂的cmc比离子型的低,而阳 离子型表面活性剂形成的胶团较疏松,使其加溶作用比阴离 子型的强。 非离子型表面活性剂溶液: 对脂肪烃的加溶作用随疏水基链长增加而增加,但随聚 氧乙烯链长增加而减小; 对于极性有机物,加溶作用随聚氧乙烯链长增加而增加。
加溶作用与乳化作用的区别: 加溶后不存在两相,是热力学稳定体系; 乳化作用则是两种不相混溶的液体形成的液-液分散体系, 有巨大的相界面和界面自由能,是热力学不稳定的多分散体系。 2、加溶的方式 被加溶物在胶团中的加溶方式有四种: (1)加溶于胶团内核 饱和脂肪烃、环烷烃及苯等不易极化 的非极性有机化合物,一般被加溶于胶团的内核中,就像溶于非 极性碳氢化合物液体中一样(下图a)。
2012-5-9
5
(2)加溶于表面活性剂分子间的“栅栏”处
长链醇、胺等极性
有机分子,一般以非极性碳氢链插入胶团内部,而极性头处于表面活性 剂极性基之间,并通过氢键或偶极子(相距很近的符号相反的一对电荷, 如由正负电荷组成的电偶极子)相互作用(下图b)。 (3)吸附于胶团表面 一些既不溶于水也不溶于非极性烃的小分子 极性有机化合物,如苯二甲酸二甲酯以及一些染料,吸附于胶团的外壳 或部分进入表面活性剂极性基层而被加溶(下图c)。
2012-5-9
3
右图为25℃时,微溶物 2-硝基二苯胺溶解度与表面活性剂 溶液浓度曲线。 从图中可以看到,在表面活性剂 浓度小于cmc时,2-硝基二苯胺溶解 度很小,而且不随表面活性剂浓度
图1-16 2-硝基二苯胺在月桂酸钾 水溶液中的溶解度
改变。在cmc以上,溶解度随表面活性剂浓度的增加而迅速 上升。表面活性剂溶液浓度超过cmc越多,微溶物就溶解得 越多。 结论:微溶物溶解度的增加与溶液中胶团形成有密切关 2012-5-9 4 系。
2012-5-9
18
分散体系中加入与分散质点所带电荷相同的离子表面 活性剂,分散体系稳定性增加;若加入与分散质点所带 电荷相反的离子表面活性剂,分散体系稳定性下降。
分散体系中分散剂的重要作用就是防止分散质点接近 到范德华力占优势的距离,使分散体系稳定,而不致絮凝、 聚集。分散剂的加入能产生静电斥力,降低范德华力,有利 于溶剂化(水化),并形成围绕质点的保护层。
2012-5-9 16
在实际应用中,有时需要稳定的分散体,例如油漆涂料、印刷油墨 等,有时又需要破坏分散体,使固体微粒尽快地聚集沉降,例如在污水 处理、原水澄清等方面。表面活性剂对分散作用有很大影响。
2012-5-9 17
2、分散体系的稳定性 相互吸引力:小质点分散体系(胶体分散体系)中的质点, 由于质点间存在范德华引力,以及分散的质点具有较高的自由能, 所以有聚集的倾向,与泡沫、乳状液等一样,皆为热力学不稳定 的体系。 静电斥力:由于质点本身的电离或吸附带电粒子等原因,质 点表面都带有电荷,在分散介质中形成扩散双电层,使粒子在靠 近到一定距离时,因双电层的重叠而产生排斥作用,降低了粒子 间的范德华引力。 胶体的稳定性取决于质点间相互吸引力与静电斥力的相对大 小。
2012-5-9 14
(4)温度 温度对加溶作用的影响与表面活性剂的类型和加溶物的性质有关。 对 溶作用的空间变大,使极性和非极性有机物加溶量均增大。 对于聚氧乙烯醚类非离子表面活性剂,温度升高,聚氧乙烯基的水 化作用减弱,cmc降低,胶团更易形成,胶团聚集数增大。特别是温度升 至表面活性剂浊点时,胶团聚集数会剧增,胶团变大,内核也变大,使 非极性碳氢化合物和卤代烷类有机物的加溶量增加。 极性有机物加溶在胶团的表面活性剂分子之间,其加溶量随温度上 升先增加后下降,在达到表面活性剂的浊点之前会出现一个最大值。这 是因为升高温度使表面活性剂热运动加剧并增加了胶团聚集数,使加溶 量增加。继续升高温度,则加剧了聚氧乙烯的脱水作用使其容易卷缩, 导致加溶空间变小,极性有机物的加溶量减少。
2012-5-9
21
(3)防止固体微粒重新聚集 固体微粒在液体中的分散体系为热力学不稳定体系,微 粒聚集变大是自然趋势。固体分散于液体中后,需要采取有 效措施,防止固体微粒再聚集。 ①表面活性剂降低了固-液界面的界面张力,即增加了 分散体系的热稳定性; ②表面活性剂吸附在固体微粒的表面上,从而增加了防 止微粒再聚集的势垒。因此,加入表面活性剂会降低粒子再 聚集的倾向。
图1-17 加溶方式示意图 2012-5-9 7
上述四种加溶方式,其加溶量的规律:d>b>a>c。 虽然加溶方式主要取决于加溶物和加溶剂(表面活性 剂)的化学结构,但胶团溶液处于动态平衡中,加溶物的位 置随时间迅速改变,各种加溶物在胶团中的平均停留时间为 10-6~10-10s。因此,所谓加溶位置只是优选位置,并不能说 加溶物就不会存在于其他位置。 加溶的本质:由于胶团的特殊结构,从它的内核到水相 提供了从非极性到极性环境的全过渡。因此,各类极性或非 极性的难溶有机物都可以找到适合的溶解环境,而存在于胶 团中。由于胶团粒子一般小于0.1μm,加溶后的胶团溶液仍 是透明液体。 2012-5-9
2012-5-9
19
3、表面活性剂的分散作用 (1)固体粒子的润湿 润湿是固体粒子分散的最基本条件,若要把固体粒子均匀地分散在 介质中,首先必须使每个固体微粒或粒子团能被介质充分润湿。这个过 程的推动力用铺展系数表示。
当铺展系数S>0时,固体粒子就会被介质完全润湿,此时接触角为 0°。 液体中加入表面活性剂,会在液-气界面(水为分散介质)形成定 向吸附,使界面张力降低,有利于铺展系数增大,接触角变小,固体粒 子被充分润湿。
第五章 表面活性剂 5.1 概述 5.2 阴离子表面活性剂 5.3 两性表面活性剂 5.4 表面活性剂的应用
2012-5-9 1
5.1 概述 5.1.1 表面活性剂的分类 5.1.2 表面活性剂的功能及其作用
一、表面活性剂在溶液中的状态 二、泡沫 三、乳化 四、润湿 五、加溶 六、分散 七、洗涤
2012-5-9 2
2012-5-9 9
(1)表面活性剂结构 ①疏水基链长的影响:表面活性剂的链长对加溶量有明显的影响。 在同系物中,碳氢链越长,cmc越小,越易形成胶团,且胶团大小随碳 氢链增长而增加(聚集数增加)。 随着表面活性剂碳氢链的增长,非极性的烃类和弱极性的苯、乙苯 在胶团内核的加溶量会增加。下表列出了乙基苯在羧酸钾同系物水溶液 中的加溶量就说明了这一规律。 胶团对极性有机物的加溶也有类似的规律。例如,25℃时,正辛醇 在0.1mol/L油酸钠(9-十八烯酸钠,C18)溶液中的加溶量大于在十二 酸钾溶液中的加溶量,庚醇在烷基磺酸钠中的加溶量随烷基碳原子数增 加而增加。 ②疏水基结构的影响:疏水基有分支的表面活性剂,其加溶能力较 直链者小,带有不饱和结构的,加溶能力较差。这些都与cmc和胶团聚 集数有关。 2012-5-9 10
8
3、影响加溶能力的因素 表面活性剂的加溶能力可以用加溶物溶解度S与表面 活性剂溶液浓度cs 之比来表示。S/cs 越大,表面活性剂的 加溶能力越强。 影响体系加溶能力的因素:空间因素和能量因素。 空间因素:指胶团提供的容纳加溶物的可用空间大小; 能量因素:是加溶物进入胶团引起体系能量变化的影 响。 表面活性剂结构、加溶物结构、有机添加剂、温度等 会对空间和能量产生影响,进而影响加溶能力。
2012-5-9 20
(2)粒子团的分散或碎裂 粒子团的分散或碎裂涉及到粒子团内部的固-固界面分 离。在固体粒子团中常会存在缝隙,另外粒子晶体由于应力 作用也会使晶体造成微缝隙,粒子团的碎裂就发生在这些地 方。 ①表面活性剂吸附在粒子微裂缝中,会加深微裂缝,而 且可以减少固体质点分散所需的机械功; ②离子型表面活性剂吸附于粒子表面时,可使粒子中质 点获得相同电性的电荷,质点就互相排斥而易于分散在液体 中。
