乙醇脱氢酶的分离提纯鉴定与定量
猪肝乙醇脱氢酶的分离纯化及部分性质

关键词 :猪肝 ;乙醇脱氢酶 ;分 离纯化 ;酶学性质
I s o l a t i o n , P u r i i f c a t i o n a n d P a r i t a l Ch a r a c t e r i z a t i o n o f Al c o h o l De h y d r o g e n a s e f r o m P i g L i v e r
※生物工程
良 晶 科 学
2 0 1 5 . V o 1 . 3 6 , N o . 1 7 1 7 9
猪肝 乙醇脱氢酶 的分离纯化及 部分性质
傅 婷 ,王 丹 ,万 骥 ,唐 云 明
4 0 0 7 1 5 ) ( 西南大学生命科学学 院,重庆市甘薯工程研究 中心 ,三峡库 区生态环境教 育部重点实验室 ,重庆
摘
要 :新鲜猪肝经匀浆、缓冲液抽提 、硫酸铵分级沉淀 、DE AE — S e p h a r o s e 离子交换层析及S u p e r d e x . 2 0 0 凝胶 过滤
层析 ,获得 电泳纯的 乙醇脱氢酶 ( a l c o h o l d e h y d r o g e n a s e ,ADH)。纯化结果显示 :该酶 比活力为 1 6 2 2 . 3 3 U / mg , 回收 率为2 9 . 0 5 %,纯化倍数为3 4 . 5 8 ;该酶分子质量 约为1 7 1 . 7 9 k D,亚基 分子质量约为4 3 . 6 8 k D。A DH酶学性质研
生化实验六 酵母醇脱氢酶的提取与纯化

总活力=活力单位数/ml 酶液X总体积(ml) 比活力=活力单位数/mg蛋白=总活力/总蛋白mg
每一步总活力 酶的回收率: 第一步总活力 ×100%
实验材料、试剂和器材
材料:酵母 试剂:3.0 mol/L 乙醇 、
0.06 mol/L焦磷酸钠(pH 8.5)、 0.0015 mol/L NAD+ 、 0.01 mol/L K2HPO4、 丙酮 (预冷)、 0.066 mol/L Na2HPO4 仪器:离心机、可见光分光光度计、紫外光分光光度计、水浴锅
(四) 有机溶剂沉淀酶蛋白
在上清中按100 ml加55 ml丙酮的比例,加入 预冷丙酮,混匀,静置5 min,4℃,5000 rpm离 心5 min。弃上清,沉淀溶于5.0 ml 0.01mol/L K2HPO4中,体积为V4,取2个1 ml分别于1.5 ml 离心管中(一管用于测蛋白浓度,一管用于测酶 活力) 。
(二) 热变性去除杂蛋白
剩余的上清在55℃保温15 min,间歇搅拌,冰 浴冷却,5000 rpm离心5 min,取上清,量体积V2 ,取2个1 ml分别于1.5 ml离心管中(一管用于测蛋 白浓度,一管用于测酶活力) , 4℃保存备用, 剩余上清置冰浴中。
(三) 有机溶剂沉淀杂蛋白
将置于冰浴中上清,加上清体积一半的 预冷丙酮,混匀, 4℃静置5 min ,5000 rpm ,离心5 min,取上清,量体积V3,取2个1 ml分别于1.5 ml离心管中,4℃保存备用(一 管用于测蛋白浓度,一管用于测酶活力) , 剩余上清倒入已置于冰浴中的50 ml离心管。
考马斯亮蓝G-250与蛋白质结合,最大 吸收波长在595nm,在0~100μg/ml,吸光度 与蛋白质含量成正比。
蛋白质与G-250反应在2 min内达到平 衡,且稳定,可检测微克级的蛋白质。
乙醇脱氢酶法测定血浆中乙醇

乙醇脱氢酶法测定血浆中乙醇西北国防医学杂志(MedJNDFNC)2005Oct.;26(5)345乙醇脱氢酶法测定血浆中乙醇伏建峰,史清海,路西春,高华,丁艳萍(兰州军区乌鲁木齐总医院,新疆乌鲁木齐830000)论着?摘要:目的:建立一种快速测定血浆中乙醇浓度的新方法.方法:选用三(羟甲基)氨基甲烷一盐酸(Tris—HCL)作为缓冲体系,在碱性条件下,乙醇脱氢酶(ADH)催化乙醇转化成乙醛,同时生成还原型辅酶I(NADH).在340Bill波长处检测吸光度的变化,对照标准计算乙醇的浓度.结果:ADH最适用量为753KU/L,辅酶I(NAD)最适浓度为60.0mmol/L,检测过程仅需90s,线性范围可达0~68.60mmol/L,变异系数(CV)为2.31%~3.25%,回收率为98.4%~101%,与美国DADE试剂盒比较具有良好的相关,^y:0.985,Y=0.987x+0.024.结论:本法测定血浆中乙醇无需除蛋白,具有快速,简便等优点,可用于自动生化分析仪及手工操作,适于临床常规运用.关键词:实验室诊断;乙醇;乙醇脱氢酶;检测;临床应用中图分类号:R446.1文献标识码:A文章编号:1o07—8622(2005)05—0345—03 Determinationofalcoholinplasmabyalcoholdehydrogenasemethod FUJian—feng,SHIQing—hai,LUXi—chun,eta1.(UrumchiGeneralHospitalofLanzhouCommand,PLA,830000,China)Abstract:0bjective:Toestablishanewmethodforrapidmeasuringalcohol(ALC)inplasma. Methods:(hydroxymethy1)aminomethane—hydrochloride(Tris—HCL)burwasusedinthisstudy.Intheconditionofalkalescence,alcoholdehydrogenase(ADH)catalyzedtheoxidationofALCtoacetaldehyd e,withthesimultaneous productionofdeoxidizednicotinamideadeninedinucleotide(NADH).Thevarianceofabsor bancewasdeterminedbyafilterof340nm.TheconcentrationofALCwascalculatedaccordingtothestandard.Resul ts:ThemostadaptquantityofADHwas753KU/L.andthebestconcentrationoftheNADwas60.0mmoL/L.Itco stonly90Sinthewholereaction.Therangeoflinearitywasfromzeroto68.60mmo1/L.Thecoemcientofva riationfCVindifferentconcentrationswasfrom2.31%to3.25%.Therecoveryraterangedfrom98.4%to10 1%.ComparedwithDADE(America)reagentsmethod,theregressionequationwasobtained.Conclusion: ThisADHmethodfor measuringtheconcentrationofALCinplasmaisrapidandsimplewithoutremovingprotein.I tcouldbeusedboth automaticallyandmanuallyandsuitableforclinicalapplication.Keywords:Laboratorydiagnosis;Alcohol;Alcoholdehydrogenase;Testing;Clinicalappli cation饮酒过量可引起以神经精神症状为主的疾病,称为酒精中毒(alcoholpoisoning)或乙醇中毒(etha.nolpoisoning)….一次饮用大量酒类饮料会对中枢神经系统产生先兴奋后抑制作用,重度中毒可使呼吸,心跳抑制而死亡.鉴于酒精中毒的后果严重,所以迅速测定血浆中乙醇浓度,对早期诊断和处理急性酒精中毒具有非常重要的f临床价值.作者报道一种新的酶终点法测定血浆中乙醇浓度,无需除蛋白,收稿日期:2005—06—23作者简介:伏建峰(1967一),男,副主任技师,Tel:0991—4992736, Email:****************整个检测过程仅需90S,可用于自动生化分析仪及手工操作,适于临床常规运用.1原理选用三(羟甲基)氨基甲烷一盐酸(s—HCL)作为缓冲体系,在碱性条件下,乙醇脱氢酶(ADH)催化乙醇转化成乙醛,同时生成还原型辅酶I(NADH).在340nm波长处检测吸光度的变化,对照标准计算乙醇的浓度.2材料与方法2.1试剂:ADH,辅酶I(NAD)为Sigma产品,三(羟甲基)氨基甲烷(Tris)为国产分析纯.试剂I:346西北国防医学杂志(MedJNDFNC)2005Oct.;26(5)ADH16.8mg溶于10ml重蒸水.试剂II:NAD238.8mg溶于6ml重蒸水.试剂III:Tris10.70g溶于1O0ml重蒸水,检{贝0前与0.1mol/LHCL按5:1(V/V)混合.2.2标准液:分别加入100,200,300和400Ixl无水乙醇到50ml蒸馏水中,制备出的标准液浓度分别为17.15,34.30,51.45和68.60mmol/L,储存于具塞容器中备用.2.3混合血浆制备:采集40位健康体检者肘部静脉血各2ml,NaF抗凝,离心后制备混合血浆.2.4标准血浆:分别加入20,40,60,80l无水乙醇到10ml混合血浆中,混匀.制备出的标准血浆浓度分别为17.15,34.30,51.45和68.60mmol/L,以1m1分装,一20~C储存备用.2.5仪器:XL型生化分析仪(美国杜邦).2.6自动分析参数:反应类型:终点法;反应温度:37~C;波长:340nm(主)/380nm(次);样品3l,试剂I25l,试剂II130Ixl,试剂III340Ixl;反应时间:90s.3实验与结果3.1ADH用量的选择:取ADH(单位:KU/L)活性分别为:27,54,108,215,323,430,538,645,753,860,968的酶工作液分别测定高浓度(51.45retool/ L)的乙醇标准液,图1结果表明,ADH用量在753 KU/L以上最适.3.2NAD浓度选择:在pH10.5,ADH为753KU/L条件下,观察NAD浓度(mmol/L)为10,20,30,40,5O,6O,7O,8O,9O时对反应进程的影响,NAD最适浓度为60.0retool/L.3.3缓冲体系的选择:配制pH9~11的各种缓冲液:甘氨酸一NaOH,KH2PO4一K2HPO4,Na2CO3一NaHCO和Tris—Hcl等,在相同条件下,观察其对反应进程的影响,riffs—Hcl较为适宜.3.4缓冲液浓度及pH的选择:分别配制pH为:8.0,8.5,9.0,9.5,10.0,10.5,11.0的Tris—Hcl溶液,结果显示pHlO.5时较为适宜,同时确定Tris浓度为882.9mmoL/L.3.5反应动力学曲线:选择低,中,高(17.15,34.30,68.6mmol/L)三个不同浓度标准血浆,用本法在XL上观察反应进程,图2结果表明,不同浓度的样品60s内吸光度上升最快,70~80s曲线平缓, 90s后吸光度基本一致,因此选择90s为反应终点时间图2ADH法检测三个不同乙醇浓度标准血浆反应进程曲线3.6线性范围:取浓度为0,17.15,34.30,51.45,68.60mmol/L的标准血浆用本法测定,乙醇在0~68.60rnmol/L范围内线性良好.3.7精密度试验:选择低,中,高(17.15,34.30,51.45mmol/L)三个不同浓度标准血浆,用本法重复测定20次,批内变异系数分别为3.25%,2.31%和2.40%.3.8回收试验::在已知乙醇浓度为20,0rnmol/L的标本内分别加入低,中,高三种浓度(17,15,34.30,51.45rnmol/L)的乙醇标准液,回收率分别为1O0%,101%及98.4%.3.9干扰试验:将同体积蒸馏水和同体积不同浓度的干扰物,分别加入到等体积的混合血浆中,前者为对照样品,其余为含不同浓度干扰物质的检测样品,每个样品重复测定5次,取均值.检测样品与对照样品比较,偏差<±5%,说明该浓度物质对检测无显着干扰.测定结果显示,本法至少能去除30mmol/L的乙醛.此外,胆红素<500ixmol/L,血红蛋白<5g/L,甘油三脂<10.0mmol/L时,测定结果未见明显干扰.3.1O对比试验:选取40份不同乙醇含量的血浆分别用本法与美国DADE试剂盒对比测定,结果经回归分析::0.985,Y:0.987x+0.024.3.1l临床应用:健康体检且无饮酒习惯者40例,清晨空腹采血,用本法测定血浆乙醇含量,结果0西北国防医学杂志(MedJNDFNC)2005Oct.;26(5)347 mmoL/L36例,0.5~1.5mmoL/IA例;交通管理部门送检疑有酒后驾车者27例,血浆乙醇浓度在l0.8—39.0mmol/L,平均为21.4mmol/L,其中24人最终承认饮过酒;酒后反应迟钝并呕吐者8例,血浆乙醇浓度为20.5~39.7mmol/L;酒后昏迷者3例,血浆乙醇浓度分别为55.2,59.1和62.8mmol/L.4讨论ADH法检测乙醇最早由Hadjiioanno提出并沿用至今,传统方法需除蛋白,且反应时间较长(约300s),由于乙醇极易挥发,很难确保其检测的准确性.本法选择Tris—HCL作为缓冲体系,加之选用高活力的ADH,促使样品中有限的乙醇快速转化成乙醛,整个检测过程仅需90s且不用除蛋白,经方法学评价,各项指标均较为满意:线性范围可达0~68.60mmol/L,变异系数(CV)为2.31%~3.25%,回收率为98.4%~101%,与美国DADE试剂盒比较具有良好的相关.ADH工作环境为碱性,甘氨酸一NaOH,KH2PO4一K2HPO4,Na2CO3一NaHCO3和Tris—Hcl 等缓冲体系均可选用.在我们的实验中,甘氨酸一NaOH,KH2PO一K2HPO缓冲体系不甚理想;Na2CO3一NaHCO3和Tris—Hcl缓冲体系较为理想, 由于Na2CO,一NaHCO,缓冲液容易结晶,不利于存储,作者选择Tris—Hcl作为缓冲体系,该缓冲体系含有两性离子,有利于发挥酶的活力.不同文献报道的ADH的最适pH值也有很大差别,范围大致为8.8~10.9L2"J,可能由试验条件及ADH的来源不同所致,作者所选用ADH来自酵母,在本试验条件下,ADH的最适pH值为l0.5.乙醛是乙醇的氧化产物,其产量增多可抑制ADH的活性,试验中当乙醛浓度达30.0mmol/L时,仍未见其对ADH有明显的抑制作用,推测可能是s—Hcl和乙醛结合生成一种复合物,且此反应不可逆,使乙醛迅速被移走,反应得以快速进行.酶法自动分析已经普及,血中乙醇的酶学测定法分为两种:乙醇氧化酶法和ADH法.乙醇氧化酶法的试剂组成简单,缺点是特异性差,甲醇对测定干扰很大,可出现假阳性.ADH法相对特异,受甲醇或异丙醇的干扰极小,此外ADH较乙醇氧化酶更易得到且成本较低,因此ADH法更适宜常规操作,易于推广应用.参考文献:[1]BishopML,Duben—EngelkirkJL,FodyEP.Clinical chemistry[M].FourthEdition,PhiladelphiaUSA:Lippin. cottWilliamsWilkins,2000.508—610.[2]胡建强,刘凤兰.血清乙醇脱氢酶活性测定及其临床应用[J].天津医科大学学报,2001,7(1):110—111.[3]陈金来,刘毅,郭妹,等.酶法血清乙醇测定试剂盒的初步评价及临床意义[J].天津医科大学学报,2002,8 (4):506—508.[4]1wamotoR,KubotaH,HosokiT,eta/.Completeaminoacid sequenceandcharacterizationofthereactionmechanismofa glucosamine—inducednovelalcoholdehydrogenasefrom Agrobacteriumradiobacter(tumefaciens)[J].ArchBio. chemBiophys,2002,398(2):203—212.[5]张红霞,邓振华,谢娜,等.酒后驾车血液呼气中乙醇检测方法评价[J].刑事技术,2003,5:36—39.《西北国防医学杂志》征订启事<西北国防医学杂志=》为兰州军区联勤部卫生部主办的国,内外公开发行的综合性医药卫生学术性期刊,是"中国科技论文统计源"期刊,已被<中国科学引文数据库》等国内重要数据库收录,也被美国化学文摘(CA)和俄罗斯文摘杂志(JA)收录,刊出省部级以上各类基金资助论文及获奖论文占有较高比例,多次在军内外期刊质量评比中获奖.本刊刊登军内外医务工作者有关基础医学,临床医学,军事医学,文献综述,讲座,护理,卫生科技管理等方面的学术文章.主要栏目有:述评,论着,临床研究,高原医学,经验交流,护理,综述,讲座,卫生行政等.我们希望本刊能对广大医务工作者有所裨益,并热切欢迎对我刊给予扶持和指导.<西北国防医学杂志》(前身为<兰后卫生=》),1979年创刊,2002年改为双月刊,大16开本,80页,逢双月末出版,每期定价10.0o元.<西北国防医学杂志>国内邮发代号54—101,欢迎在当地邮局订阅,也可直接向编辑部订阅,全年70.0o元(含邮费).编辑部地址:兰州市小西湖西街98号;邮政编码:730050联系电话:(0931)8975420;E—mail:************。
乙醇脱氢酶的初步分离及其酶学性质的研究

乙醇脱氢酶的初步分离及其酶学性质的研究吴桂英;金放;吴元欣;赵玉凤【摘要】以硫酸铵为沉淀剂,采用盐析法对乙醇脱氢酶(ADH)进行了初步的分离纯化,ADH比活力从粗酶液的0.464 U·mg-1提高到1.198 U·mg-1,纯化倍数为2.582.研究了ADH的基本酶学性质,其最适作用pH值为7.0~10.0,pH值为8.0时酶活力达到最大,pH值为7.0时酶较为稳定;最适作用温度为37℃,温度为30~40℃时酶活力较为稳定,温度超过45℃后酶活力急剧下降.【期刊名称】《化学与生物工程》【年(卷),期】2009(026)006【总页数】3页(P69-71)【关键词】乙醇脱氢酶;分离;酶学性质【作者】吴桂英;金放;吴元欣;赵玉凤【作者单位】黄石理工学院化学与材料工程学院,湖北,黄石,435003;武汉工程大学化工与制药学院,湖北,武汉,430073;武汉工程大学化工与制药学院,湖北,武汉,430073;武汉工程大学化工与制药学院,湖北,武汉,430073【正文语种】中文【中图分类】Q554.9酒精对肝脏、肾脏、胃肠道、神经系统、循环系统都有一定毒性,一些口腔癌、咽癌、喉癌、结肠癌及上呼吸道癌患者与过量饮酒也有密切关系[1],由此可见酗酒对身体有害。
国内外解酒饮品多为单纯兴奋剂,进入机体产生类质激素效应,从而“中和”乙醛对人体中枢神经系统的抑制作用,起到醒酒效应,仅为“治标”,并且其“醒酒”功能成分多为化学合成物质,成本也较高。
乙醇在人体内的代谢主要靠体内的两种酶[1] ,一种是乙醇脱氢酶(Alcohol dehydrogenase,ADH)[2~5],另一种是乙醛脱氢酶(Aldehyde dehydrogenase, ALDH)[4,6]。
前者使乙醇转化为乙醛,后者使乙醛进一步转化为乙酸,最终分解为二氧化碳和水,由此可以看出ADH是乙醇在人体内代谢的必需酶。
由于微生物发酵的生产周期短,培养基价格低廉,酶制剂可以实现大规模、低成本的工业化生产,因此从微生物细胞中提取ADH[7~9]并制成酶制剂具有广阔的市场前景。
乙醇脱氢酶(ADH)检测试剂盒(乙醛比色法)
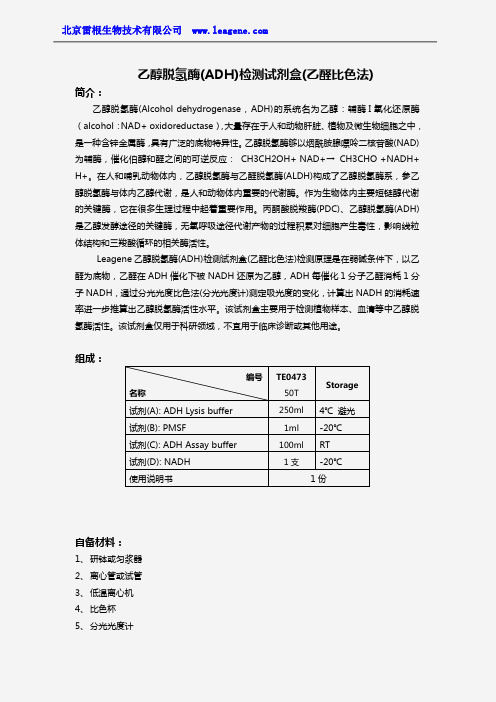
乙醇脱氢酶(ADH)检测试剂盒(乙醛比色法)简介:乙醇脱氢酶(Alcohol dehydrogenase,ADH)的系统名为乙醇:辅酶I氧化还原酶(alcohol:NAD+oxidoreductase),大量存在于人和动物肝脏、植物及微生物细胞之中,是一种含锌金属酶,具有广泛的底物特异性。
乙醇脱氢酶够以烟酰胺腺嘌呤二核苷酸(NAD)为辅酶,催化伯醇和醛之间的可逆反应:CH3CH2OH+NAD+→CH3CHO+NADH+ H+。
在人和哺乳动物体内,乙醇脱氢酶与乙醛脱氢酶(ALDH)构成了乙醇脱氢酶系,参乙醇脱氢酶与体内乙醇代谢,是人和动物体内重要的代谢酶。
作为生物体内主要短链醇代谢的关键酶,它在很多生理过程中起着重要作用。
丙酮酸脱羧酶(PDC)、乙醇脱氢酶(ADH)是乙醇发酵途径的关键酶,无氧呼吸途径代谢产物的过程积累对细胞产生毒性,影响线粒体结构和三羧酸循环的相关酶活性。
Leagene乙醇脱氢酶(ADH)检测试剂盒(乙醛比色法)检测原理是在弱碱条件下,以乙醛为底物,乙醛在ADH催化下被NADH还原为乙醇,ADH每催化1分子乙醛消耗1分子NADH,通过分光光度比色法(分光光度计)测定吸光度的变化,计算出NADH的消耗速率进一步推算出乙醇脱氢酶活性水平。
该试剂盒主要用于检测植物样本、血清等中乙醇脱氢酶活性。
该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。
组成:自备材料:1、研钵或匀浆器2、离心管或试管3、低温离心机4、比色杯5、分光光度计编号名称TE047350TStorage试剂(A):ADH Lysis buffer250ml4℃避光试剂(B):PMSF1ml-20℃试剂(C):ADH Assay buffer100ml RT试剂(D):NADH1支-20℃使用说明书1份操作步骤(仅供参考):1、配制ADH Lysis buffer工作液:取出ADH Lysis buffer和PMSF,恢复至室温,ADHLysis buffer:PMSF按一定的的比例混合,混匀,即配即用,不易久置,否则蛋白酶抑制剂PMSF的效率会有所下降。
从废弃啤酒酵母细胞提取乙醇脱氢酶的新工艺

从废弃啤酒酵母细胞提取乙醇脱氢酶的新工艺
乙醇脱氢酶(ADH)是一种非常重要的酶,可以用于生物燃料。
目前,运用传统方法
制备乙醇脱氢酶,大多数技术门槛较高,收益较低。
本文提出了从废弃啤酒酵母菌细胞(S. cerevisiae)中提取乙醇脱氢酶的新工艺,以提高生物燃料的可持续性。
本研究以啤酒酵母(Saccharomyces cerevisiae)细胞为研究对象,从废弃啤酒酵母
细胞中提取乙醇脱氢酶。
首先,废弃啤酒酵母细胞以4℃的温度被调配到0.01M的;接着,采用激光诱导凝胶电泳的方法对乙醇脱氢酶的分子量和活性进行评估;最后,采用免疫印
迹实验以筛选高活性的乙醇脱氢酶菌株。
结果表明,在测试的乙醇脱氢酶中,S. cerevisiae能够提供高质量的乙醇脱氢酶。
它的活性较高,在体内具有较高的在乙醇水溶液中的酶转化率。
因此,提取乙醇脱氢酶可
能成为一种有效的生物燃料产业发展技术。
在本研究中提出的工艺,为生物燃料的研究和可持续利用开辟了新的前景。
与传统技
术相比,此工艺的成本更低,而且可以有效地利用废弃的细胞,减少废弃物的产生,更符
合环保要求。
总之,通过废弃啤酒酵母菌细胞提取乙醇脱氢酶,有助于提高资源利用效率,减少废
弃物产生,创造可持续的生物燃料。
但是,乙醇脱氢酶产量仍不能完全满足技术应用的需求,因此有必要进一步优化生产工艺,以更好地利用资源。
细菌乙醇脱氢酶总活性光度法定量检测试剂盒产品说明书(中

细菌乙醇脱氢酶总活性光度法定量检测试剂盒产品说明书(中文版)主要用途细菌乙醇脱氢酶总活性光度法定量检测试剂是一种旨在通过检测反应系统中氧化型烟酰胺腺嘌呤二核苷酸(NAD)还原后峰值的增高,即采用光度法来测定细菌裂解样品中酶活性的权威而经典的技术方法。
该技术经过精心研制、成功实验证明的。
其适用于各种细菌菌株裂解悬液样品乙醇脱氢酶的总活性检测。
产品严格无菌,即到即用,操作简捷,性能稳定。
技术背景乙醇脱氢酶(alcohol dehydrogenase;ADH;EC1.1.1.1),又称为乙醇NAD氧化还原酶(alcohol NAD- oxidoreductase),属于氧化还原酶家属成员之一,是一组含有6个亚酶的催化乙醇氧化的锌依赖性金属酶蛋白。
存在于许多生物体中。
通过氧化原发性和继发性醇类分子和半缩醛(hemiacetals),转化产生乙醛或酮。
乙醇脱氢酶分成三类:一类为辅酶烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide;NAD)或辅酶烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate;NADP)依赖型;一类为吡咯喹啉醌-,血红素基团、F420(Pyrroloquinoline quinone,haem group,F420)依赖型;一类为黄素腺嘌呤二核苷酸(Flavin adenine dinucleotide)依赖型。
NAD或NADP依赖型乙醇脱氢酶又可以分成三种:一种为锌依赖性的中长链型(350氨基酸残基);一种为锌非依赖性的短链型(250氨基酸残基);一种为铁激活性(385氨基酸残基)。
在微生物中,乙醇脱氢酶起着发酵功能。
且用于酒精性饮料、工业溶剂、醋的生产,参与外源性芳香族化合物(xenobiotic aromatic compounds )的降解,帮助细菌或酵母在甲醇环境中生长。
基于底物乙醇,在乙醇脱氢酶的作用下,转化为乙醛(aldehyde)产物后,通过测定反应体系中氧化型烟酰胺腺嘌呤二核苷酸(oxidized nicotinamide adenine dinucleotide;NAD)转化为还原型烟酰胺腺嘌呤二核苷酸(reduced nicotinamide adenine dinucleotide;NADH)的变化(340nm 波长),来定量分析乙醇脱氢酶的总活性。
醇醛脱氢酶的分离纯化及其基因文库的构建和筛选

醇醛脱氢酶的分离纯化及其基因文库的构建和筛选谢莉;张铎;窦燕峰;张丽萍;赵宝华【期刊名称】《生物工程学报》【年(卷),期】2007(23)5【摘要】在维生素C的发酵生产过程中,普通生酮基古龙酸菌S2(Ketogulonigenium vulgare)能产生醇醛脱氢酶,将L-山梨糖转化为VC的前体2-酮基-L-古龙酸(2-KLG).通过超声波破碎菌体、硫酸铵分级沉淀、DEAE Sepharose Fast Flow阴离子交换层析,Q Sepharose High Performance柱层析等过程,从普通生酮基古龙酸菌S2发酵液中分离纯化了醇醛脱氢酶,并用该纯化酶免疫新西兰兔制备出了合格抗血清.同时,普通生酮基古龙酸菌S2基因组DNA经Sau3AⅠ部分酶切后,与黏粒载体pKC505连接,用包装蛋白进行包装,转染大肠杆菌DH5α,构建了基因组文库.最后应用免疫酶斑点技术(Dot-ELISA)从12 000个克隆子中筛选得到一个阳性克隆K719#.通过检测该基因工程菌的活性,表明K719#具有使L-山梨糖转化为2-KLG的功能,从而使醇醛脱氢酶在大肠杆菌中获得了高效表达,这为简化VC的生产工艺奠定了基础.【总页数】5页(P891-895)【作者】谢莉;张铎;窦燕峰;张丽萍;赵宝华【作者单位】河北师范大学生命科学院,石家庄,050016;河北师范大学生命科学院,石家庄,050016;石家庄制药集团,石家庄,050051;河北省生物研究所,石家庄,050081;河北师范大学生命科学院,石家庄,050016【正文语种】中文【中图分类】Q939【相关文献】1.重组醇醛脱氢酶的分离纯化及性质研究 [J], 谢莉;张铎;郭会灿;张丽萍;李曼;赵宝华2.不吸水链霉菌基因文库的构建及初步筛选 [J], 桓明辉;陈飞;吴红艳;关艳丽;王志;程永涛3.高盐极端环境土壤基因组DNA的分离纯化方法研究及基因文库的构建 [J], 孙栋;唐莉丽;王倩倩;杨冬梅;蒋承建;武波4.碱性土壤基因组DNA的分离纯化和基因文库的构建 [J], 蒋承建;隆文杰;梁璇;孙栋;武波5.从小菌基因组文库中筛选醇醛脱氢酶阳性克隆 [J], 焦迎晖;张利平;张惟材因版权原因,仅展示原文概要,查看原文内容请购买。
啤酒废酵母中乙醇脱氢酶提取工艺的研究

摘 要 : 以废 弃 的 啤 酒 酵母 为 原料 , 用超 声辅 助 的 方 法对 其 中的 ADH 进 行 了提 取 . 采 实验 考 察 了料 液 比 、 酒酵母 用量 、 H、 声波 功 率 、 声 全 程 时 间 和提 取 液 浓度 对 ADH 提 取 效 果 啤 p 超 超 的影 响 , 进一 步通 过 I 3 ) 交 试 验 对 ADH 的提 取 工 艺进 行 了优 化 , 到 了啤 酒 废 酵母 中 (。 正 得
应 5mi , 即 置于 沸水 中灭活 , 3 0n 波 长处 检测 吸 光 度值 . 白对 照 用 蒸 馏 水代 替 加 NAD 其余 n立 于 4 m 空 ,
均相 同.
ADH 酶 活 力 ( mI) 义 : ADH 在 3 ℃ 每 分 钟 氧 化 乙 醇 脱 氢 生 成 乙 醛 , 还 原 N 为 U/ 定 将 7 即 AD NADH, 3 0n 处测 定 的 吸光 度变 化 0 0 1作 为一 个活 力单 位 ( . 在 4 m .0 U) 1 2 2 ADH 的提 取 方法 . .
* 收 稿 E期 :0 7 9 1 t 2 0 —0 — 7
作 者 简 介 : 跟 年 ( 2 , , 西 省 泾 阳县 人 , 授 , 究 方 向 : 物 制 药 毛 1 6 一) 男 陕 9 教 研 生
维普资讯
・4 ・ 2
陕 西 科 技 大 学 学 报
1 2 3 AD 提取 工艺 的单 因素 实验 . . H
在 ADH 提 取实验 中 , 固定其 他 条件 , 以提 取 液 中 ADH 活 力 为 指标 , 分别 对 料 液 比 、 品处 理 量 、 样 提 取液 p 超 声波 功率 、 H、 超声 全 程时 间和 提取 液浓 度进 行考 察 , 以确定 各影 响 因素 的适 宜水 平.
乙醇脱氢酶(alcohol dehydrogenase,ADH)活性测定试剂盒说明书

货号: QS1007 规格:50管/48样乙醇脱氢酶(alcohol dehydrogenase,ADH)活性测定试剂盒说明书紫外分光光度法注意:正式测定之前选择 2-3 个预期差异大的样本做预测定。
测定意义:ADH是生物体内短链醇代谢的关键酶,催化乙醇与乙醛可逆转换,在很多生理过程中起着重要作用。
哺乳动物ADH主要在肝脏生成,肝脏损伤导致ADH释放到血清中。
血清ADH活性高低反映了肝功能是否异常。
测定原理:ADH催化NADH还原乙醛生成乙醇和NAD+,NADH在340nm处有吸收峰,而NAD+没有;测定340nm 吸光度下降速率,来计算ADH活性。
自备实验用品及仪器:研钵、冰、低温离心机、紫外分光光度计、1mL石英比色皿、可调式移液器和蒸馏水。
试剂组成和配制:试剂一:液体×1瓶,室温保存。
试剂二:液体×1瓶,4℃保存。
临用前把试剂三转移到试剂二中,4℃保存。
试剂三:粉剂×1支,-20℃保存。
试剂四:液体×1瓶,4℃保存。
粗酶液提取:1、组织:按照组织质量(g):试剂一体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL试剂一)进行冰浴匀浆。
16000g,4℃离心20min,取上清置冰上待测。
2、细菌、真菌:按照细胞数量(104个):试剂一体积(mL)为500~1000:1的比例(建议500万细胞加入1mL试剂一),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min);16000g,4℃离心20min,取上清液置冰上待测。
3、血清等液体:直接测定。
ADH测定操作:1. 分光光度计预热30 min,调节波长到340 nm,蒸馏水调零。
2. 试剂二在25℃水浴中保温30 min。
3. 空白管:在1mL石英比色皿中依次加入100μL蒸馏水、800μL试剂二和100μL试剂四,迅速混匀后于340nm测定吸光值变化,分别记录15s和75s时吸光值,分别记为A1和A2。
人类乙醇脱氢酶基因型鉴定实验报告

人类乙醇脱氢酶基因型鉴定实验报告人类乙醇脱氢酶基因型鉴定实验报告酒精是一种常见的神经系统抑制剂,它会让人产生感觉的放松和愉悦,并且也会增加人们对危险和冒险的倾向。
然而,在接触酒精时,每个人的反应可能会存在差异,这是因为乙醇代谢速率的遗传变异可能会影响个体对酒精的敏感性和酒精耐受能力。
因此,研究乙醇代谢的相关基因变异可以为精准的药物治疗和预防酒精滥用提供重要的指导和支持。
本实验旨在通过检测人类乙醇脱氢酶(ADH)的基因型,探索ADH基因多态性对酒精代谢能力的影响,并为相关药物治疗提供参考。
实验方法本实验选取了50名年龄在18-35岁之间的健康成年人作为研究对象,均为中国汉族人。
通过采集被试者的口腔黏膜细胞,提取DNA,然后进行基因型分析。
在此基础上,分析ADH1B*1、ADH1B*2、ADH1B*3、ADH1C*1、ADH1C*2、ADH4*1和ADH4*2这7个ADH基因突变位点的基因型分布情况,并进一步分析这些基因型与乙醇代谢速率的相关性。
结果和分析实验结果表明,ADH基因突变位点的基因型频率在被试者中存在差异。
其中,ADH1B*2位点的基因型频率最高,为36%,其次是ADH1C*1和ADH1C*2位点的基因型频率,分别为26%和22%。
而ADH1B*1、ADH1B*3、ADH4*1和ADH4*2位点的基因型频率较低,分别为6%、6%、2%和2%。
进一步分析发现,ADH1B*2位点的基因型与乙醇代谢速率之间存在很大的关联性。
具体来说,该基因型的个体乙醇代谢速率较快,一般较为耐酒,容易产生饮酒后仍然保持理智和冷静的感觉。
而ADH1C*1和ADH1C*2位点的基因型与乙醇代谢速率关联性较小,可能会导致人体对酒精的摄入量有较大的差异。
结论和建议通过本实验的研究,我们可以初步认识到酒精代谢的遗传变异对人们饮酒行为的影响。
ADH基因突变位点的分布和相应基因型的差异,可能导致不同个体对酒精的代谢能力不同,甚至在同等条件下出现酒精含量差异较大的现象。
酵母菌细胞中分离醇脱氢酶

从土样中分离纯化酵母菌满鹏程,王鹏,杨军刚,郑强一、实验目的1、学习从土壤中分离、纯化微生物的原理玉方法2、学习、掌握微生物的鉴定方法3、对提取的图样进行微生物的分离、纯化培养、并进行简单的形态鉴定4、分离纯化醇脱氢酶二、实验原理1、基本思想:酵母菌常见于含糖份比较高的环境中,如果园土、菜园土及果皮等的表面。
多数酵母菌喜欢偏酸条件,最适pH为4.5-6.0.酵母菌生长迅速,容易分离培养。
在液体培养基中,酵母菌比霉菌生长快,利用酸性条件则可以抑制细菌的生长。
因此常用酸性液体培养基获得酵母菌的加富培养,然后在固体培养基上划线分离纯化。
2、基本路线:采样→稀释→接种→鉴定→纯化→保藏菌种三、器材和用品1、器材:小铁铲和无菌纸或袋、培养皿、载玻片、盖玻片、普通光学显微镜、量筒、滴管、吸水纸、无菌水试管、烧杯、三角瓶、电炉、玻璃棒、接种环、恒温培养箱、高温灭菌锅、移液枪(枪头)、天平、滤纸、pH试纸等。
无菌吸管3支/组、无菌培养皿、100ml无菌水1瓶/组、涂棒、显微镜、接种环,恒温摇床;光照培养箱;离心机;搅拌器等。
2、试剂:a、美兰染液。
b、马铃薯葡萄糖琼脂培养基:马铃薯200g(煮开10min后过滤取汁),葡萄糖20g,琼脂20g,水1000ml,pH自然。
分装三角瓶;试管斜面1支/组。
c、乳酸马铃薯葡萄糖培养液:配方同上,不加琼脂加乳酸,按1000ml 培养基加入5ml乳酸,pH为5.5左右,再分装试管9ml2支/组。
d、3mol/L的乙醇溶液,0.06mol/L的焦磷酸溶液,0.0015mol/L的NAD,0.01mol/L 的磷酸氢二钾溶液,丙酮。
硫酸铵;牛血清白蛋白;三羟甲基氨基甲烷;氧化型烟酰胺腺嘌呤二核苷酸[NAD]酵母菌;牛肉膏蛋白胨液体培养基;琼脂斜面培养基。
四、实验方法1、采集土样带上小铁铲和无菌袋到果园土、菜园土等地采集较细碎土壤。
2、样品稀释在无菌纸上称取样品5g,放入100mL无菌水的三角瓶中,手摇10分钟使土和水充分混合。
AcetobacterZ127乙醇脱氢酶的纯化及酶学性质

重庆大学学报 (自然科学版 ) Journal of Chongqing University (Nɑturɑl Science Edition)
文章编号 : 1000 - 582X (2006) 04 - 0065 - 04
Ap r. 2006 Vol. 29 No. 4
实验 从 自 行 分 离 、鉴 定 的 A cetobacter Z127 中 提 取 、纯化得到大量的高活性 ADH ,并对其生化特性进 行了初步研究. 这就为探讨从微生物中分离纯化 ADH 新工艺和研制 ADH 新产品提供了基础材料和理论
依据.
1 材料与方法
1. 1 材料 菌种 :重庆大学生物工程学院微生物实验室筛选
以上各步 ADH 分离提纯的结果见表 2.
表 2 不同阶段 ADH分离纯化结果
阶段
ADH 粗提液 硫酸铵
盐析 凝胶过 滤层析
蛋白含量 /m g 6. 94
3. 43
0. 83
总活力 /U
2 325
1 891
1 118
比活 纯化 /U ·mg- 1 倍数 收率 / %
335. 01 1
100
551. 31 1. 65 81. 33
将菌种接种于牛肉膏培养基 [ 5 ]. 37 ℃、160 r/m in 振荡培养 12 h,转接至同成分培养基中 ,同条件培养至 对数期 ,取发酵液 4 ℃、5 000 r/m in离心 15 m in,收集 菌体 ,用蒸馏水冲洗 2次 ,按体积比 (细胞 /裂解液 ) 1 ∶3 加入细菌 裂 解 液 , 37 ℃温 育 1 h, 将 样 品 置 于 冰 上 10 m in, 4 ℃下 10 000 r/m in离心 20 m in,收集上清即 ADH 粗提液. 1. 2. 2 硫酸铵分级沉淀
乙醇脱氢酶法测定血浆中乙醇

乙醇脱氢酶法测定血浆中乙醇伏建峰;史清海;路西春;高华;丁艳萍【期刊名称】《西北国防医学杂志》【年(卷),期】2005(26)5【摘要】目的:建立一种快速测定血浆中乙醇浓度的新方法.方法:选用三(羟甲基)氨基甲烷-盐酸(Tris-HCL)作为缓冲体系,在碱性条件下,乙醇脱氢酶(ADH)催化乙醇转化成乙醛,同时生成还原型辅酶I (NADH).在340 nm波长处检测吸光度的变化,对照标准计算乙醇的浓度.结果:ADH最适用量为753 KU/L,辅酶I(NAD+)最适浓度为60.0 mmol/L,检测过程仅需90 s,线性范围可达0~68.60 mmol/L,变异系数(CV)为2.31%~3.25%,回收率为98.4%~101%,与美国DADE试剂盒比较具有良好的相关,γ=0.985,y=0.987x+0.024. 结论:本法测定血浆中乙醇无需除蛋白,具有快速、简便等优点,可用于自动生化分析仪及手工操作,适于临床常规运用.【总页数】3页(P345-347)【作者】伏建峰;史清海;路西春;高华;丁艳萍【作者单位】兰州军区乌鲁木齐总医院,新疆,乌鲁木齐,830000;兰州军区乌鲁木齐总医院,新疆,乌鲁木齐,830000;兰州军区乌鲁木齐总医院,新疆,乌鲁木齐,830000;兰州军区乌鲁木齐总医院,新疆,乌鲁木齐,830000;兰州军区乌鲁木齐总医院,新疆,乌鲁木齐,830000【正文语种】中文【中图分类】R446.1【相关文献】1.高效液相色谱法测定血浆或组织中吡喹酮、氯霉素、喹乙醇及利血平的浓度 [J], 曾振灵;陈仗榴;董漓波2.固相萃取高效液相色谱-质谱法测定血浆中乙醇醛、甘油醛的含量 [J], 董陆陆;李泽文;李宝馨3.稳定同位素稀释法测定人体血浆中羟苯乙醇胺的含量及其... [J], 张建华;沈耕荣4.柱前衍生化高效液相色谱法测定人血浆中花生四烯酸乙醇胺浓度 [J], 李晶;董志;唐柏彬;乐乐乐5.改良乙醇脱氢酶法测定血清中微量乙醇 [J], 胡云良;王慧燕;张立;李艳霞;王友沛;王贤理因版权原因,仅展示原文概要,查看原文内容请购买。
中草药中乙醇脱氢酶抑制剂的靶向筛选与分离的开题报告

中草药中乙醇脱氢酶抑制剂的靶向筛选与分离的开题报告一、研究背景中草药是我国独特的资源,具有广泛的药理活性和丰富的生物活性成分。
其中许多化合物具有很高的医药价值。
但是,传统的中草药提取方法具有提取效率低、提取时间长和提取的成分不纯等缺点。
因此,开发新的高效提取技术来提高提取效率和成分纯度是十分必要的。
一种常用的中草药提取方法是醇提法。
醇提法通常使用乙醇等有机溶剂来提取药材中的活性成分。
但是,近年来的研究显示,在中草药中存在着一些化合物,如黄酮、类黄酮和苯酚等,它们可以通过乙醇脱氢酶催化反应产生苯酚类化合物并降低活性成分的含量。
因此,寻找能够抑制乙醇脱氢酶活性的天然化合物具有重要的意义。
二、研究目的本课题旨在通过对中草药中抑制乙醇脱氢酶活性的天然化合物进行靶向筛选与分离,最终获得用于提高中草药提取效率和成分纯度的化合物,从而提高中草药利用价值。
三、研究方法1. 中草药样品的提取与分离:选取具有抑制乙醇脱氢酶活性的中草药材料(如黄芪、枸杞、当归等),采用醇提法进行提取,然后用TLC、HPLC等方法分离和纯化化合物。
2. 乙醇脱氢酶的活性测定:采用比色法或荧光法等方法检测乙醇脱氢酶的活性,以评估化合物的抑制作用。
3. 抑制剂筛选:通过对中草药提取物中分离得到的化合物在乙醇脱氢酶抑制实验中的作用进行评估,筛选出具有较高抑制效果的化合物。
4. 靶向分离:通过一系列化学技术,如分光镜法、纯化柱法等,以及质谱技术对乙醇脱氢酶抑制剂进行分离、鉴定结构,并揭示它们与乙醇脱氢酶之间的相互作用机制。
四、研究意义本课题研究的抑制乙醇脱氢酶活性的天然化合物,不仅有望提高中草药的提取效率和成分纯度,而且还有可能为寻找抑制其他酶活性的天然化合物提供新的思路和方法。
因此,本研究具有重要的科学意义和应用价值。
酵母醇脱氢酶的提取及专一性测定(精)

- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乙醇脱氢酶的分离提纯鉴定与定量12级临本二班吕梦月许力飞王雅琦王明华马翔张宇王帅实验目的:乙醇脱氢酶的分离提纯鉴定与定量实验原理:分离:加蛋白质抑制剂:竞争性或非竞争性抑制蛋白酶活性;防止蛋白酶分解;除核酸:利用核酸和蛋白质在链霉素磷酸酶中溶解度不同除去核酸;去盐:超滤液筛分过程,以膜两侧的压力差为驱动力,以超滤膜为过度介质,在一定的压力下,当原液流过膜表面时,超滤液膜表面密布的许多细小的微孔只允许水及小分子物质通过而成为透过液,而原液中体积大于膜表面微孔径的物质则被截留在膜的进液侧,成为浓缩液,因而实现对原液的净化、分离和浓缩的目的。
等电点测定法的原理:在等电点时蛋白质分子以两性离子形式存在,其分子静电荷为零,此时蛋白质分子颗粒在溶液中因没有相同电荷的相互排斥,分子相互作用之间的作用减弱,其颗粒极易碰撞、凝聚而产生沉淀,所以蛋白质在等电点时,其溶解度最小,最易形成沉淀物。
提纯:醋酸纤维素薄膜电泳以醋酸纤维薄膜为支持物。
它是纤维素的醋酸酯,由纤维素的羟基经乙酰化而制成。
它溶于丙酮等有机溶液中,即可涂布成均一细密的微孔薄膜,厚度以0.1mm—0.15mm为宜。
太厚吸水性差,分离效果不好;太薄则膜片缺少应有的机械强度则易碎。
鉴定:乙醇脱氢酶可将乙醇分解生成乙醛定量:S D S-P A G E即十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法:1. 在混合样品中各蛋白质组分的迁移率主要取决于分子大小和形状以及所带电荷量。
2. 在聚丙烯酰胺凝胶系统中,加入适量SDS (阴离子表面活性剂),使蛋白质的氢键和疏水键打开,并结合到蛋白质分子上(一定条件下,大多数蛋白质与之结合比为1.4g SDS/1g protein),使各种蛋白质-SDS 复合物都带上相同密度的负电荷,其数量远远超过了蛋白质分子原有的电荷量,从而掩盖了不同种类蛋白质之间原有的电荷差别。
此时特定蛋白质分子的电泳迁移率主要取决于其分子量大小,而其它因素对电泳迁移率的影响几乎可以忽略不计。
3. 蛋白质分子量在15,000~200,000之间时,电泳迁移率与分子量的对数值线性相关:若将已知分子量的标准蛋白质的迁移率对分子量的对数作图,可以获得一条标准曲线,而从未知蛋白质在相同电泳条件下的迁移率即可在标准曲线上求得其分子量。
实验试剂与器材:器材:剪刀、研钵、铁架台、漏斗、烧杯、玻璃棒、滤纸、试管一支、管式的超滤装置、聚酰胺膜、醋酸纤维薄膜(2×8厘米);常压电泳仪;点样器(市售或自制);培养皿(染色及漂洗)(直径9cm—10cm);普通滤纸;玻璃板;钝头镊子;白瓷反应板;试管(15~20ml);水浴;分光光度计;离心机;比色杯(光径1cm)试剂:磷酰胺素、1%~2%的链霉素硫酸盐、硫酸铵、0.02mol/L的盐酸、PH7.4的磷酸盐缓冲液、0.1mol/mL的氢氧化钠、去离子水、巴比妥—巴比妥钠缓冲液(pH8.6,0.07mol/L,离子强度0.06):称取1.66g巴比妥(AR)和12.76g巴比妥钠(AR),置于三角烧瓶中,加蒸馏水约600ml,稍加热溶解,冷却后用蒸馏水定容至1000ml。
置4℃保存,、.交联葡聚糖G-25(细粒)、0.1mol/L磷酸缓冲液(pH7.0)、0.4% K3Fe(CN)6 、乙醇脱氢酶的标准溶液、乙醇、染色液(0.5%氨基黑10B):称取0.5g氨基黑10B,加蒸馏水40ml,甲醇(AR)50ml,冰乙酸(AR)10ml混匀溶解后置具塞试剂瓶中贮存、漂洗液:取95%乙醇(AR)45ml,冰乙酸(AR)5ml和蒸馏水50 ml混匀置具塞试剂瓶贮存、透明液:临用前配制。
甲液:取冰乙酸(AR)15ml,无水乙醇(AR)85ml,混匀置试剂瓶内,塞紧瓶塞,备用。
乙液:取冰乙酸(AR)25ml,无水乙醇(AR)75ml,混匀置试剂瓶内,塞紧瓶塞,备用。
、保存液:液体石蜡、定量洗脱液(0.4mol/L NaOH溶液):称取16g氢氧化钠(AR)用少量蒸馏水溶解后定容至1000ml。
实验步骤:分离:1.细胞破碎:将10g肝组织用剪刀剪碎,放入研钵中,加入0.067mol/LPH7.4的磷酸盐缓冲液4ml研磨成糊状,再加2ml0.067mol/LPH7.4的磷酸盐缓冲液,搅匀,然后将所得的物质过滤,取滤液。
2. 添加蛋白质抑制剂:在盛有研磨液的试管中加入5ml磷酰胺素,震荡40度水浴中保温30min。
3.除核酸:逐滴加入1%~2%的链霉素硫酸盐,直至沉淀不再产生。
进行过滤除去沉淀。
4.盐析:逐滴加入硫酸铵溶液直至蛋白质不再沉淀。
进行过滤取其沉淀部分,并加入适量磷酸盐缓冲液直至蛋白形成6ml糊状物。
5.去盐:将上述溶液放入超滤装置中,使蛋白质和小分子物质分离开,将大分子物质分离开并加入一定量磷酸盐缓冲液直至糊状物形成6ml。
6.等电点沉淀法:在上述溶液中加入一定量0.02mol/L盐酸边加入边搅拌,一边用PH剂测量使其PH值调至5.4,然后倒置离心机中6000r/min离心15分钟,倒掉上清液,再在此溶液中加入6ml去离子水,震荡使下部的沉淀重新溶解,并以0.1mol/mL 的氢氧化钠将其PH值调至8.6.重复进行两次。
提纯:醋酸纤维膜电泳:1电泳槽与薄膜的制备(1)醋酸纤维素薄膜的湿润与选择:用钝头镊子取一片薄膜,在薄膜无光泽面上,距边2cm处用铅笔各划一条直线此线为点样标志区。
小心地平放在盛有缓冲液的平皿中。
若漂浮于液面的薄膜在15s—30s内迅速湿润,整条薄膜色泽深浅一致,则此膜均匀可用于电泳;若薄膜湿润缓慢,色泽深浅不一或有条纹及斑点,则表示薄膜厚薄不均匀应舍去,以免影响电泳结果,将选好的薄膜用竹夹子轻压,使其完全浸泡于缓冲液中约30min后方可用于电泳。
(2)电泳槽的准备:根据电泳槽的宽度,剪裁尺寸合适的滤纸条。
在两个电极槽中,各倒等体积的电极缓冲液,在电泳槽的两个膜支架上,各放两层滤纸条,使滤纸的长边与支架前沿对齐,另一端浸入电极缓冲液内。
当滤纸条全部浸润后,用玻璃棒轻轻挤压在膜支架上的滤纸以驱赶气泡,使滤纸的一端能紧贴在膜支架上。
2、点样用钝头镊子取出浸透的薄膜,夹在两层滤纸间以吸去多余的缓冲液,无光泽面向上平放在点样板上,点样时用点样器沾少许经分离的肝脏研磨液,再将点样器轻轻印在点样区内,样品线长度一般为1.5cm,宽度一般不超过3mm.使经分离的肝脏研磨液完全渗透至薄膜内,形成一定宽度、粗细均匀的直线,用同样的方法对标准乙醇脱氢酶溶液进行点样。
3、电泳用钝头镊子将点样端的薄膜平贴在阴极电泳槽支架的滤纸桥上(点样面朝下),另一端平贴在阳极端支架上。
如图1-2-9所示,要求薄膜紧贴滤纸桥并绷直,中间不能下垂,如一电泳槽同时安放几张薄膜,则薄膜之间应隔几毫米,盖上电泳槽盖使薄膜平衡10min。
用导线将电泳槽的正、负极与电泳仪的正、负极分别连接,注意不要接错。
在室温下电泳,打开电源开关,调旋钮调到每厘米电流强度为0.3mA(8块薄膜则为4.8mA)。
通电10min—15min 后,将电流调节到每厘米膜宽电流强度为0.5mA(8片共8mA),电泳时间约50min—60min。
电泳后调节旋钮使电流为零,关闭电泳仪切断电源或自然风干。
4、染色与漂洗用钝头镊子取出电泳后的薄膜,无光泽面向上,放在含有0.5%氨基黑10B染色液的培养皿中,浸染5min。
取出后用自来水冲去多余染料,然后放到盛有漂洗液的培养皿中,每隔10min换漂洗液一次,连续数次,直至背景蓝色脱尽。
取出后放在滤纸上,用电吹风的冷风将薄膜吹干。
凝胶层析法:1.凝胶准备称取5g交联葡聚糖G-25,倾入锥形瓶中,加蒸馏水约60ml溶胀,搅动后静置.待凝胶沉积后,用倾注法除去浮于表面的细粒,重复3次.将溶胀后的凝胶用10倍体积的磷酸缓冲液浸泡过夜,以达平衡.2.装柱取玻璃层析柱(25cm×1.5cm)一支,垂直装好.加入缓冲液,打开出口,将气泡赶出,关闭出口.然后从管顶向柱内加入缓冲液8cm左右高,将平衡后的交联葡聚糖G-25悬浮液边搅拌边加入柱内,再打开出口,使液体流出,继续不断地加入交联葡聚糖G-25悬浮液,柱内凝胶柱床沉积至高20cm左右时为止.床面上覆盖3ml缓冲液,关闭出口,在凝胶柱面上加盖一层圆形滤纸,使层析柱稳定5~10min后,接储液瓶,打开出口,用2倍于床体积的磷酸缓冲液洗脱平衡,最后关闭出口.3..上样,洗脱打开平衡好的层析柱出口,使柱内溶液流出至刚露出柱床面时即关闭出口.吸混合物样品0.5ml左右,在距离床面1mm处沿管内壁轻轻转动加进样品,切勿搅动床面.然后打开出口,使样品进入床内,直至床面重新露出.同上加入1~2倍样品量体积的洗脱液(这样可以使样品定容至最小,而样品又完全进入床内),当少量洗脱液将流入床面时,加入多量的洗脱液,但注意切勿搅动床面凝胶,连接储液瓶进行洗脱.4.分部收集根据电泳方法进行的结果可得乙醇脱氢酶为第N条带,用自动部分收集器,以5滴/min,5min/管的速度进行收集.并且观察柱上的色带,待第N柱液体流下时,再继续收集两管透明的洗脱液作为空白,关闭出口.即可收集到提纯后的乙醇脱氢酶。
再进行醋酸纤维膜电泳进行一遍看看是否纯净,若不纯净则重复进行凝胶交换柱层析法进行提纯。
鉴定:将提纯后的乙醇脱氢酶中放入一定量酒精,并加入氧化亚铜并加热,观察是否有砖红色沉淀。
定量:1. 安装夹心式垂直板电泳槽:夹心式垂直板电泳槽有很多型号,主要结构相同,且操作简单,不易泄漏。
可根据具体不同型号要求进行操作。
主要注意事项:安装前,胶条、玻板、槽子都要洁净干燥;勿用手接触灌胶面的玻璃。
2. 配胶:根据待测蛋白质分子量范围,选择适宜的分离胶和浓缩胶浓度,按下表配制:3. 制备凝胶板:①分离胶制备:按表配制12%分离胶。
由于AP和TEMED相遇后凝胶即开始聚合,所以应立即混匀混合液。
混匀后用注射器抽取3.2~3.5ml凝胶液,加至长、短玻璃板间的缝隙内(立即清洗注射器及针头)。
再用滴管取少许蒸馏水,沿长玻璃板壁缓慢注入约3~4mm高,以进行水封。
30~60min后,凝胶与水封层间出现折射率不同的界线,则表示凝胶完全聚合。
倾去水封层的蒸馏水,再用滤纸条吸去多余水分。
②浓缩胶的制备:按表配制3%浓缩胶(待分离胶聚合后再加AP/TEMED),混匀后用注射器加到已聚合的分离胶上方,直至距离短玻璃板上缘约0.5cm处(立即清洗注射器及针头)。
轻轻将样品槽模板插入浓缩胶内,避免带入气泡。
约30min后凝胶聚合。
待凝胶凝固后,小心拔去样品槽模板,用窄条滤纸吸去样品凹槽中多余的水分,将Tris-Gly电泳缓冲液倒入上、下贮槽中,应没过短板约0.5cm以上,即可准备加样。
4.样品处理及加样蛋白质标样及待测蛋白都用样品溶解液溶解,使浓度为0.5~1mg/ml,沸水浴加热3分钟,冷却至室温备用(处理好的样品液如经长期存放,使用前应在沸水浴中加热1min,以消除亚稳态聚合)。
