优秀课件高中化学必修一第二章复习 (共24张PPT)
合集下载
化学必修一第二章复习课PPT教学课件

实际参加反应的离子符号来表示反应的式 子叫离子方程式。离子方程式不仅可以表
示
,而且还可以表
示
。
2020/12/10
5
试写出下列离子反应方程式。
①实验室制二氧化碳的反应 ; ;
;
②碳酸氢氨和盐酸的反应 ; ;
;
2020/12/10
6
• 4.复分解反应的实质就是溶液中的离子相互
交换的反应,这类离子反应发生的条件
解质。电解质溶液之所以能够导电,是由
于它们在溶液中发生了 ,产生了可以自
由移动的 。
叫做酸;
叫做碱;
叫做盐。酸碱
中和反应的实质是
。
2020/12/10
4
• 2.电解质的电离可以用电离方程式来表示。 试写出下列物质发生电离的方程式。
⑧Al2 (SO4)3 ⑨KHCO3 ⑩NH4HSO4
; ;
;
3.电解质在溶液中的反应实质上是离子之 间的反应,这样的反应叫做离子反应。用
第二章 化学物质及其变化
2020/12/10
1
第一节 物质的分类
• 1.分散系:把一种(或多种)物质分散在另 一种(或多种)物质中所得到的体系
• 分散质:被分散的物质 • 分散剂:起容纳分散质的作用的物质 • 按分散质和分散剂的状态分析,分散系有9种
组合方式。雾是液-气分散系;烟是是固-气 分散系。分散系按分散质直径大小可分 为: 溶液、胶体、浊液 。胶体区别于溶液和浊 液的本质特征: 胶体粒子的大小在1-100nm之间。
时,放映室射到银幕上的光柱的形成就是
丁达尔现象。当把制得的胶体进行过滤时,
滤纸上没有留下任何物质。这个事实说明,
胶体粒子可以透过滤纸,即胶体粒子的直 径比滤纸的直径小。
第2章 章末复习课-2020-2021学年人教版高中化学必修1课件(共27张PPT)

练
(2)强弱规律
氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
返 首 页
22
(3)价态规律(以硫元素为例)
· ·
知
专
识
题
网
总
络
结
构
(4)先后规律
对
建
练
①一种氧化剂同时遇到多种还原剂时,还原性强的先被氧化。
②一种还原剂同时遇到多种氧化剂时,氧化性强的先被还原。
返 首 页
23
· ·
5.已知常温下在溶液中可发生如下两个离子反应:
CO2===CaCO3↓+H2O
返 首 页
10
· ·
知
A [B 项,Fe 与稀硫酸反应,Fe 被氧化为 Fe2+;C 项,漏掉 专
识
题
网 络
OH-与
H+的反应;D
项,过量
CO2
通入石灰水中, 生成
Ca(HCO3)2,
总 结
构 建
不能生成 CaCO3 沉淀。]
对 练
返 首 页
11
· ·
2.完成下列反应的离子方程式。
知
专
识
C [溶液无色,则不含有色离子 Cu2+,B 错误;溶液呈酸性, 题
网
总
络 构
则 OH-、HCO- 3 不能存在,A、D 错误;C 项都能存在。]
结 对
建
练
返 首 页
18
4.现有失去标签的氯化钙、硝酸银、盐酸、碳酸钠四种无色溶
液,为了确定四种溶液的成分,将它们任意编号为 A、B、C、D 后
· ·
8H+,则 A、B、D 正确;氧化剂与还原剂物质的量之比为 28∶3,
对 练
人教版高中化学必修一课件第二章单元复习.pptx

四、四种基本反应与氧化还原反应的关系化合反应ຫໍສະໝຸດ 分解反应氧化还原反应
置换反应
P31页题12
复分解反应
五、氧化还原反应中得失电子数目和方向: 1、单线桥法2、双线桥法P32页题19
六、氧-还反应中氧化性、还原性、酸性的体现 P32页题18、1736页题21
七、氧化还反应在是常生活中的运用 P32页题15、16
高中化学课件
金戈铁骑整理敬请各位同仁批评指正共同进步
第三节氧化还原反应
知识点: 一、氧化还原反应的特征:P31页题2 二、氧化还原反应的实质:P31页题4 三、一些知识规律: 1、几组概念: (1)氧化剂(2)氧化反应(3)氧化产物 还原剂还原反应还原产物 一个口诀:得、降、氧--氧化剂被还原,发生 还原反应,指出产物为还原产物。P31页题9 2、氧化还原反应的通式:P33页题13 氧化剂+还原剂-----氧化产物+还原产物
第一节物质的分类
知识点:
1、物质的分类方法:P35页题13
2、胶体 (1)定义:P23页题3 (2)是否稳定:P23页题9 (3)能否透过半透膜或滤纸P35页题15 (4)胶体的应用----丁达尔现象P23页题14
第二节离子反应
知识点:
1、电解质与非电解质的区分:P35页题16 2、物质的电离:P36页题18 3、离子反应的实质:P34页题3 4、离子反应的书写:P35页题9 哪些写离子符号,哪些写化学式? 5、离子反应所代表的意义: 6、离子的共存:哪些条件使离子不共存?还 有哪些附加条件?P35页题8
必修一第二章化学物质及其变化复习ppt课件
知识点五:氧化还原反应
3.氧化还原反应与四种基本类型反应关系
氧化还原反应
置换反应 复分解反应
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
知识点五:氧化还原反应
4.基本概念
还原剂 失电子 还原性
价升
被氧化
氧化 产物
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
知识点五:氧化还原反应
5.基本规律
3、电子得失守恒规律: 例.已知M2O7 x-+ 3S 2-+ 14H+ = 2 M3+3S↓+ 7H2O,则M2O7 x-中的M的化合价为 (D)
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
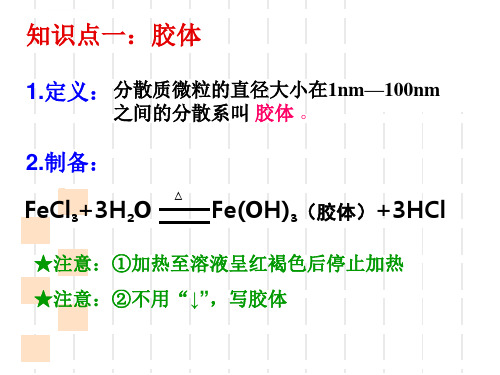
知识点一:胶体
1.定义: 分散质微粒的直径大小在1nm—100nm
之间的分散系叫 胶体 。
2.制备: FeCl3+3H2O △
Fe(OH)3(胶体)+3HCl
★注意:①加热至溶液呈红褐色后停止加热 ★注意:②不用“↓”,写胶体
3.性质:
⑤胶体的凝聚 Ⅰ加电解质溶液 Ⅱ加带相反电荷的胶粒 Ⅲ加热凝聚(加热较长时间)
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
知识点一:胶体
均匀透明 稳定 d<1nm 小分子或离子
氯化钠溶液
均匀透明 介稳定
钾盐、钠盐、铵盐、硝酸盐全溶 SO42-除Ba2+(Ca2+、Ag+ 微溶) Cl-除Ag+ CO32-只溶K+、Na+、NH4+(Mg2+微溶) OH-只溶K+、Na+、Ba2+(Ca2+微溶)
3.氧化还原反应与四种基本类型反应关系
氧化还原反应
置换反应 复分解反应
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
知识点五:氧化还原反应
4.基本概念
还原剂 失电子 还原性
价升
被氧化
氧化 产物
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
知识点五:氧化还原反应
5.基本规律
3、电子得失守恒规律: 例.已知M2O7 x-+ 3S 2-+ 14H+ = 2 M3+3S↓+ 7H2O,则M2O7 x-中的M的化合价为 (D)
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
知识点一:胶体
1.定义: 分散质微粒的直径大小在1nm—100nm
之间的分散系叫 胶体 。
2.制备: FeCl3+3H2O △
Fe(OH)3(胶体)+3HCl
★注意:①加热至溶液呈红褐色后停止加热 ★注意:②不用“↓”,写胶体
3.性质:
⑤胶体的凝聚 Ⅰ加电解质溶液 Ⅱ加带相反电荷的胶粒 Ⅲ加热凝聚(加热较长时间)
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
知识点一:胶体
均匀透明 稳定 d<1nm 小分子或离子
氯化钠溶液
均匀透明 介稳定
钾盐、钠盐、铵盐、硝酸盐全溶 SO42-除Ba2+(Ca2+、Ag+ 微溶) Cl-除Ag+ CO32-只溶K+、Na+、NH4+(Mg2+微溶) OH-只溶K+、Na+、Ba2+(Ca2+微溶)
高中化学必修一《第二章》复习课件

①强酸和弱碱反应。如硫酸和氨水反应,离子方程式为
A H++NHH3·+H+2OOH==-==NHH2+ 4O+表H2示O。的是( )
②A强. 碱KO和H弱+酸K的H反SO应4。=如K烧2S碱O和4+次2H氯2酸O反应,离子方程 式为OBH.-C+uH(OClHO)=2=+=2CHlOC-l+=HC2uOC。l2+2H2O
●例题分析
●例题分析
【例1】 (2013·经典习题选萃【)如例1图】 表(20示13·的经典一习些题选物萃质)如或 图表示的一
概念间的从属关系中不正确的是( )
C 概念间的从属关系中不正确的是( )
X
Y
Z
A
氧化物
化合物 纯净物
B
胶体
分散系 混合物
C 酸性氧化物 碱性氧化物 氧化物
D 离子化合物 电解质 化合物
2.离子共存问题——(1“)因反发应生即复不分共解存反”应不共存。 (1)因发生复分解反应①不有共气存体。产生:气体又有酸性气体和碱性气
练习6①.已有知气体某产溶生液:中体气表存体现又在为有较易酸多挥性的发气弱C体u酸和2的+碱、酸性根S气O与体4H2两-、+不种N能,O大具3-量,共存
体表现为易挥发弱酸不的能酸大根量与共H存+不。能大量共存;铵盐与强碱
第二章 化学物质及其变化
复习 课
知识网络·宏观掌控 化学物质及其变化
知识网络·宏观掌控 化学物质及其变化
专题突破·纵引横连
分类法及其在化学学习中的应用
●专题归纳 运用分类方法不仅能使有关化学物质及其变化的知识系 统化,而且有利于发现物质及其变化的规律,对进一步研究 物质的性质起指导作用。
1.物质的分类 (1)物质的分类依据多种多样,分类依据不同,物质所属 的类别也就不同。 如NaNO3属于纯净物、化合物、电解质,按照金属阳离 子分类属于钠盐,按阴离子分类属于硝酸盐。 (2)交叉分类法和树状分类法。 ①树状分类法中所涉及类别之间既有并列关系,也有从 属(包含)关系。 ②交叉分类法所涉及的不同类别之间是并列与交叉关 系,它们之间不能相互包含。 (3)有关物质分类的试题,可以记忆几个特殊的物质,用
A H++NHH3·+H+2OOH==-==NHH2+ 4O+表H2示O。的是( )
②A强. 碱KO和H弱+酸K的H反SO应4。=如K烧2S碱O和4+次2H氯2酸O反应,离子方程 式为OBH.-C+uH(OClHO)=2=+=2CHlOC-l+=HC2uOC。l2+2H2O
●例题分析
●例题分析
【例1】 (2013·经典习题选萃【)如例1图】 表(20示13·的经典一习些题选物萃质)如或 图表示的一
概念间的从属关系中不正确的是( )
C 概念间的从属关系中不正确的是( )
X
Y
Z
A
氧化物
化合物 纯净物
B
胶体
分散系 混合物
C 酸性氧化物 碱性氧化物 氧化物
D 离子化合物 电解质 化合物
2.离子共存问题——(1“)因反发应生即复不分共解存反”应不共存。 (1)因发生复分解反应①不有共气存体。产生:气体又有酸性气体和碱性气
练习6①.已有知气体某产溶生液:中体气表存体现又在为有较易酸多挥性的发气弱C体u酸和2的+碱、酸性根S气O与体4H2两-、+不种N能,O大具3-量,共存
体表现为易挥发弱酸不的能酸大根量与共H存+不。能大量共存;铵盐与强碱
第二章 化学物质及其变化
复习 课
知识网络·宏观掌控 化学物质及其变化
知识网络·宏观掌控 化学物质及其变化
专题突破·纵引横连
分类法及其在化学学习中的应用
●专题归纳 运用分类方法不仅能使有关化学物质及其变化的知识系 统化,而且有利于发现物质及其变化的规律,对进一步研究 物质的性质起指导作用。
1.物质的分类 (1)物质的分类依据多种多样,分类依据不同,物质所属 的类别也就不同。 如NaNO3属于纯净物、化合物、电解质,按照金属阳离 子分类属于钠盐,按阴离子分类属于硝酸盐。 (2)交叉分类法和树状分类法。 ①树状分类法中所涉及类别之间既有并列关系,也有从 属(包含)关系。 ②交叉分类法所涉及的不同类别之间是并列与交叉关 系,它们之间不能相互包含。 (3)有关物质分类的试题,可以记忆几个特殊的物质,用
高一化学必修1 第二章全章PPT课件

3、交叉分类法
罗
纳
中国运动员
尔
多
刘
外国运动员
翔
姚
球类运动员
明
田
非球类运动员
亮
交叉分类法举例
Na2CO3 Na2SO4 K2SO4 K2CO3
钠盐 钾盐 硫酸盐 碳酸盐
以所含阳 离子不同 进行分类
以所含阴 离子不同 进行分类
分类的标准
氧化物的分类
定义:元素与氧化合生成的化合物。 有且只有两种元素组成, 且含有氧元素。
离子反应
反 参与(从本质上)分为 应
分子反应
按照反应中有无电子转 移(从本质上)分为
氧化还原反应 待学
非氧化还原反应
讨论:初中已学化学反应的分类?
常见的化合反应主要包括:
①金属+氧气→金属氧化物 ②非金属+氧气→非属氧化物 ③酸性氧化物+水→可溶性含氧酸 ④碱性氧化物+水→可溶性碱 ⑤碱性氧化物+酸性氧化物→含氧酸盐
[分类标准3]:是不是氧化还原反应: 化学反应(1)(2)(3)(4)(5)为一类,都是氧化还原反应。
树林中炫丽的光线, 你知道产生的原因吗?
夜晚城市中光怪陆离的霓虹灯, 这又是如何形成的呢?
二、分散系及其分类
1、分散系: 一种物质(或几种物质)分散到另一种(或多种)物质里所形 成的混合体系。
按是否可 可溶性盐: K+、Na+NH4+、NO3-、SO42-、Cl-
盐 溶于水: 难溶性盐: CO32-、PO43-、AgCl、BaSO4
组成中是 否有可电 离的H+、 OH-
正盐: 既不含能电离的氢离子,又不含氢氧 根离子的盐.Na2CO3、KCl、Ba(NO3)2
罗
纳
中国运动员
尔
多
刘
外国运动员
翔
姚
球类运动员
明
田
非球类运动员
亮
交叉分类法举例
Na2CO3 Na2SO4 K2SO4 K2CO3
钠盐 钾盐 硫酸盐 碳酸盐
以所含阳 离子不同 进行分类
以所含阴 离子不同 进行分类
分类的标准
氧化物的分类
定义:元素与氧化合生成的化合物。 有且只有两种元素组成, 且含有氧元素。
离子反应
反 参与(从本质上)分为 应
分子反应
按照反应中有无电子转 移(从本质上)分为
氧化还原反应 待学
非氧化还原反应
讨论:初中已学化学反应的分类?
常见的化合反应主要包括:
①金属+氧气→金属氧化物 ②非金属+氧气→非属氧化物 ③酸性氧化物+水→可溶性含氧酸 ④碱性氧化物+水→可溶性碱 ⑤碱性氧化物+酸性氧化物→含氧酸盐
[分类标准3]:是不是氧化还原反应: 化学反应(1)(2)(3)(4)(5)为一类,都是氧化还原反应。
树林中炫丽的光线, 你知道产生的原因吗?
夜晚城市中光怪陆离的霓虹灯, 这又是如何形成的呢?
二、分散系及其分类
1、分散系: 一种物质(或几种物质)分散到另一种(或多种)物质里所形 成的混合体系。
按是否可 可溶性盐: K+、Na+NH4+、NO3-、SO42-、Cl-
盐 溶于水: 难溶性盐: CO32-、PO43-、AgCl、BaSO4
组成中是 否有可电 离的H+、 OH-
正盐: 既不含能电离的氢离子,又不含氢氧 根离子的盐.Na2CO3、KCl、Ba(NO3)2
第二章 复习课件(2)-人教版高中化学必修第一册 (共36张PPT)

②NaHCO3―→Na2CO3 NaHCO3固体加热分解转化成Na2CO3。
1、下列说法正确的是( )
A.NaHCO3的热稳定性比Na2CO3强 B.等质量的Na2CO3、NaHCO3分别与足量的盐酸反应,前者产 生的CO2多 C.足量的Na2CO3和NaHCO3分别与等物质的量的盐酸反应,两 者产生的CO2一样多 D.等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,前者 消耗的盐酸多
1、取一小块金属钠,放在燃烧匙里加热,下列现象描述正确
的是( )
①金属先熔化
②在空气中燃烧,放出黄色火花
③燃烧后得白色固体
④燃烧时火焰为黄色
⑤燃烧后生成淡黄色固体物质
A.②⑤
B.①②③
C.①④⑤
D.④⑤
答案 C
2、下列关于钠的叙述,正确的是( ) A.钠是银白色金属,硬度很大 B.金属钠的熔点很高 C.钠的金属活泼性大于铜,能从CuSO4溶液置换出Cu D.钠有很强的还原性 答案 D
氧化钠(Na2O) 白色固体 碱性氧化物 -2 常温
过氧化钠(Na2O2) 淡黄色固体
过氧化物(非碱性氧化物) -1
加热或点燃
热稳定性
不稳定(2Na2O+O2 △
=====2Na2O2)
化 学 与水反应 Na2O+H2O===2NaOH
性 质
与CO2 反应
Na2O+CO2===Na2CO3
稳定
2Na2O2+2H2O=== 4NaOH+O2↑ 2Na2O2+2CO2===
C.4.0 mol·L-1 6.4 g 答案 A
D.2.0 mol·L-1 6.4 g
2、将30 mL 0.5 mol·L-1 NaOH溶液加水稀释到500 mL,关于 稀释后的溶液叙述不正确的是( ) A.浓度为0.03 mol·L-1 B.从中取出10 mL溶液,其浓度为0.03 mol·L-1 C.含NaOH 0.6 g D.从中取出10 mL溶液,含NaOH 0.015 mol 答案 D
1、下列说法正确的是( )
A.NaHCO3的热稳定性比Na2CO3强 B.等质量的Na2CO3、NaHCO3分别与足量的盐酸反应,前者产 生的CO2多 C.足量的Na2CO3和NaHCO3分别与等物质的量的盐酸反应,两 者产生的CO2一样多 D.等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,前者 消耗的盐酸多
1、取一小块金属钠,放在燃烧匙里加热,下列现象描述正确
的是( )
①金属先熔化
②在空气中燃烧,放出黄色火花
③燃烧后得白色固体
④燃烧时火焰为黄色
⑤燃烧后生成淡黄色固体物质
A.②⑤
B.①②③
C.①④⑤
D.④⑤
答案 C
2、下列关于钠的叙述,正确的是( ) A.钠是银白色金属,硬度很大 B.金属钠的熔点很高 C.钠的金属活泼性大于铜,能从CuSO4溶液置换出Cu D.钠有很强的还原性 答案 D
氧化钠(Na2O) 白色固体 碱性氧化物 -2 常温
过氧化钠(Na2O2) 淡黄色固体
过氧化物(非碱性氧化物) -1
加热或点燃
热稳定性
不稳定(2Na2O+O2 △
=====2Na2O2)
化 学 与水反应 Na2O+H2O===2NaOH
性 质
与CO2 反应
Na2O+CO2===Na2CO3
稳定
2Na2O2+2H2O=== 4NaOH+O2↑ 2Na2O2+2CO2===
C.4.0 mol·L-1 6.4 g 答案 A
D.2.0 mol·L-1 6.4 g
2、将30 mL 0.5 mol·L-1 NaOH溶液加水稀释到500 mL,关于 稀释后的溶液叙述不正确的是( ) A.浓度为0.03 mol·L-1 B.从中取出10 mL溶液,其浓度为0.03 mol·L-1 C.含NaOH 0.6 g D.从中取出10 mL溶液,含NaOH 0.015 mol 答案 D
高一化学必修一第二章复习课件

3.摩尔质量
定义:单位物质的量(1mol)的物 质所具有的质量
符号:M 单位:g/mol 特点: 在数值上等于该粒子的相对原
子质量或相对分子质量
4.气体摩尔体积
定义:单位物质的量(1mol)的气 体所占的体积
符号:Vm 单位:L/mol或L·mol-1
5.物质的量浓度
v定义:以单位体积溶液里所含溶质B的物 质的量来表示溶液的组成的物理量
超过刻度线,吸出一部分水
摇匀后液面下降,补充水
不变 不变 不变 变大 不变 变大 变大 不变 变大 变小 不变 变小
变小 不变 变小 不变 变大 变小 变小 不变 变小 不变 变大 变小
根据稀释前后溶质的物质的量不变:
C(浓溶液)·V(浓溶液)= C(稀溶液)·V(稀溶液)
物质的量浓度(c)与溶质的质量分数(w) 之间的换。算关系:
一 化学实验安全
1.不慎将酸溅到眼中,应立即用水冲洗, 边洗边眨眼睛;
2.不小心将碱迸溅到眼中,用水洗净后再 用稀硼酸溶液淋洗 ;
3.不慎将浓碱溶液溅到皮肤上,要立即用 大量水冲洗,然后涂上硼酸溶液;
4.不慎将浓硫酸倒在皮肤上,宜用干抹布 拭去,在用大量水冲洗,最后涂上稀的 NaHCO3溶液
二 分离和提纯有哪些方法,
SO42-
①稀HCl ②BaCl2
滴加稀盐酸, 无明显现象, 再滴BaCl2溶液
Na2SO4+BaCl2= BaSO4↓+2NaCl
产生白色沉淀
化学方法分离与提纯:
1.四原则:不增(不引入新的杂质)、不减 (不损耗样品)、易分(容易分离)、易 复原(被提纯物质要分离)。 2.除杂的思路:选择那些易与杂质反应时生 成气体或沉淀的物质为试剂,然后再根据 “不增”的原则确定加入试剂顺序。 3. 三必须:一除杂试剂必须过量;二过量 试剂必须除尽(因为过量试剂带入新的杂 质);三除杂途径选最佳。
化学必修一第二章知识点复习 PPT

重要胶粒带电的一般规律:
注意:氢氧化铁胶粒带电,而氢氧化铁胶体是不带电! 氢氧化铁胶粒带正电,胶粒周围会分布着一些异性 电荷,所以胶体呈中性。
2.Fe(OH)3胶体制备
(1)取一个小烧杯,加入25 mL蒸馏水,将烧杯中的蒸馏水 加热至沸腾。 (2)向沸水中逐滴加入5 ~ 6滴饱和氯化铁溶液。 (3)继续煮沸至溶液呈红褐色,停止加热。
2FeCl3+Cu=2FeCl2+CuCl2
常用于印刷电路板
2、FeSO4与氯水反应,反应后加入KSCN溶液 生成浅黄色溶液,加入KSCN溶液后溶液变为红色
6FeSO4+3Cl2=2FeCl3+2Fe2(SO4)3
转移2e-
0
+2
Zn+CuSO4=Cu+ZnSO4
1
0.3mol
转移2e2 x
x=0.6mol
Fe2+和Fe3+的检验
1、KSCN检验: ①含Fe2+溶液滴加KSCN溶液后无变化。 ②含Fe3+溶液滴加KSCN溶液后变红色.
反应方程式:Fe3++SCN-=[Fe(SCN)]2+
2、碱检验。 ①含Fe2+滴加NaOH溶液后先生成白色沉淀,在空气中变成灰
◆氧化还原反应:在反应过程中有元素化合价变化的 化学反应。 ◆氧化还原反应的实质是:电子的转移。
◆氧化还原反应中,电子转移的总数与化合价升 高或降低的总值相等。
3、氧化还原反应的表示——双线桥
失2×e-
0
0
+1 -1
得2e-
双线桥步骤: 1、写正确化学方程式或离子方程式。 2、标出对应元素的化合价。 3、双线都从反应物指向生成物。 4、在线上分别标出得失的电子数。
人教版高中化学必修一课件:第2章 本章整合(共21张PPT)

(2)所给物质中铬元素化合价降低,H2CrO4 作氧化剂,发生还原
反应,H2CrO4 Cr(OH)3。
(3)根据氧化还原反应前后质量守恒的原则可得如下的化学方
程式:
2Cr(OH)3+3O2↑+2H2O
-1
0
(4)根据 H2O2 O2, 每生成1 mol O2 转移 2 mol e-,故转移 0.3
mol
专题1
专题2
专题3
专题4
4.在氧化还原反应中一定有氧化剂和还原剂,但氧化剂和还原剂
可以是不同物质,也可以是同一种物质,被氧化和被还原的元素也
可能是同一种元素,如在反应2H2O2
2H2O+O2↑中,氧化剂和
还原剂均为H2O2,被氧化和被还原的元素均为氧元素。
5.物质的氧化性或还原性的强弱取决于得到电子或失去电子的
方案Ⅰ:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进
行实验;
方案Ⅱ:将它们按照钠盐和其他化合物分类,然后分别溶于水得到
溶液,进行实验。
(1)根据方案Ⅰ进行分类时,某同学发现Na2CO3溶液也显碱性,于是 将Na2CO3与NaOH都划分为碱类,是否合理? 。
(2)请写出方案Ⅱ两组物质间任一反应的离子方程式: 。
6、“教学的艺术不在于传授本领,而在于激励、唤醒、鼓舞”。2021年11月下午3时28分21.11.915:28November 9, 2021
• 7、“教师必须懂得什么该讲,什么该留着不讲,不该讲的东西就好比是学生思维的器,马上使学生在思维中出现问题。”“观 察是思考和识记之母。”2021年11月9日星期二3时28分45秒15:28:459 November 2021
可加入的试剂是( )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1)氧化还原反应的定义
定义:凡有电子转移(得失或偏移)的化学反应。 实质:电子转移(微观) 特征:化合价升降(宏观)
化合价升高,失去电子,被氧化,发生氧化反应
氧化剂+还原剂==还原产物+氧化产物
化合价降低,得到电子,被还原,发生还原反应
口 诀:
升 失 氧,还原剂,一 还 三 氧; 降 得 还,氧化剂,一 氧 三 还。
七、离子反应方程式书写常见错误 1、该拆的没拆,不该拆的拆了 2、反应原理不对 3、电荷,质量不守恒 4、不注意系数配比 5、过量问题
解题方法:1、看原理是否正确 2、看拆写 3、看守恒
(质量、电荷、得失电子)
4、看系数配比
一、氧化还原反应的概念
1、化合价升降的角度(特征表现): 1)有元素化合价升降的反应为氧化还原反应
(2)氧化还原反应与四种基本类型的关系
分解反应
置换反应
非氧化还原反应
复分解反应 化合反应
氧化还原反应
每个范围各举一例
Fe2O3+3CO====2Fe+3CO2 2O3====3O2
有单质参加或生成的反应,一定是氧化还原反应? × 有单质参加或生成的置换反应,一定是氧化还原反应? √
△
注意:
(1)氧化还原是矛盾共存,有氧化 反应必然就有还原反应。且电子得失 总数守恒,化合价升降总数守恒
离子在一定条件下能否共存,是指所处的条件下 它们能否反应。
离子之间不反应,就可以大量共存。 只要离子间发生反应,就不能大量共存。
离子不能大量共存原因: 1、因生成气体而不能大量共存。
如H+与CO32—、SO32—、S2—、HCO3—、HSO3—、 HS—等不能大量共存。
2.因生成沉淀而不能大量共存
被氧化 化合价升高,
+2 0 高温 0 +4
2CuO+C===2Cu+CO2
化合价降低, 被还原
CuO中所含的Cu元素化合价降低,被还原,发 生了还原反应;CuO作氧化剂, C作还原剂, C的化合价升高, 被氧化,发生了氧化反应。
电子的转移(得失或偏移)
NaCl为离子化合物 HCl为共价化合物
Ⅲ、电子得失的角度(实质): 1)有电子转移(得失或偏移)的反应都是氧化还原反应 反应物
氧化剂
过程
产物
:被还原,发生还原反应,生成还原产物 化合价降低,得到电子,被还原 0 Zn +1 + 2HCl === +2 ZnCl2 0 + H2 ↑
化反应,生成氧化产物
升(化合价升高)失(失电子)氧(被氧化、氧化反应)-还原剂 降(化合价降低)得(得电子)还(被还原、还原反应)-氧化剂
同一反应方程式中,
氧化性
还原性
具有氧化性的物质:氧化剂+氧化产物 具有还原性的物质:还原剂+还原产物 为什么?
还原性
氧化性
(4)氧化性、还原性的强弱比较 区别:
判断氧化(还原)性:只看化合价能否升降; 比较氧化(还原)性强弱:看得失电子难易程度 得电子能力越强反应越活泼氧化性越强 失电子能力越强反应越活泼还原性越强
(关键是熟记酸、碱、盐的溶解性)
如 Ag+与 Cl-、Br-、 I- 、SO42— ; Ba2+与CO32—、SO42—、PO43—; Cu2+与S2—、OH—等。
3.因生成难电离物质(弱酸、弱碱、水等) 而不能大量共存。
如:H+与常见弱酸根离子PO43-、 CH3COO-、CO32、S2-等生成弱酸; OH-与NH4+、Cu2+、Fe3+ 、Ca2+等生成弱碱; H+与OH-生成水。
失12e-(6×2e-)
2KClO3 == 2KCl + 3 O2
得12e-(2×6e-)
+5 -2
△ MnO2
-1
0
再见
4.因发生氧化还原反应而不能大量共存。
如强氧化性离子(Fe3+、MnO4-)与强还原性离子(I、S2-)不能大量共存; Fe3+与S2-、I-,如2Fe3++2I-==2Fe2++I2↓ ; Fe2+与H+、NO3-等。
含氧酸根离子的氧化性,大多在酸性条件下才能体现 ,如硝酸、浓硫酸、次氯酸均具有强氧化性,亚硫酸也具 有一定的氧化性,但它们的酸根离子在中性或碱性条件下 氧化能力却很弱,均不能将S2-、I-氧化。
第二章 化学物质及其变化
复习
溶液 外观
胶体
浊液
澄清、透明 澄清透明
浑浊
>100nm 不能 无 不均一 不稳定
1nm~ 微粒 <1nm 100nm 大小 能否通 能 能 过滤纸 丁达尔 无 有 效应 特征 均一,稳定 均一,介 稳定
三、电离方程式的书写 NaCl == Na + + Cl 小结:1、左写化学式,右写离子符号,原子团不拆; 2、满足质量守恒+电荷守恒; 3、强电解质用“ == ” H2SO4 == 2H + + SO4 2Ba(OH)2 == Ba 2+ + 2OH -
(二)离子反应的类型 1.复分解型(离子之间的交换反应)
如:酸、碱、盐、氧化物之间的交 换反应等。
2.氧化还原型(离子参加的氧化还原
反应) 如:溶液中的置换反应等。
口 诀: 单质氧化物 写成化学式 对于酸式根 强分弱不分 处理微溶物 清拆浊不拆 要拆强酸、强碱、可溶盐 不拆弱酸、弱碱、气体沉
七、离子共存问题:
注意:
如:Na和Mg分别与盐酸反应?
氧化(还原)性强弱, (1)与化合价升降无关, (2)与得失电子多少无关
根据同一反应方程式的方向
氧化剂+还原剂===氧化产物+还原产物
强 强 弱 弱
氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物 口诀:比什么性,找什么剂,产物之性小于剂。
强者制取弱者
氧化(还原)性越是强,反应越容易; 得失电子后,都趋于稳定,氧化(还原)性减弱。
(2)在同一反应中,氧化剂和还原 剂可以是同一种物质 (3)同一物质在不同的反应中,可 作氧化剂,也可以作还原剂。
(3)物质的氧化性、还原性的判断
具有氧化性 具有还原性 还原剂 能失电子
反应物
本质
氧化剂 能得电子 化合价可降低
依据
化合价可升高
同种元素
最高价时——只具氧化性 最低价时——只具还原性 中间价时——兼有氧化性和还原性
