热力学基础习题课
第七章-热力学基础-习题课

3.14103
J
1
c
b
(2) a c等体, Wac 0
0 22.4 44.8 V (l)
Qac
M
5 RT 2
5 2 (PcVc
PaVa ) 5.67 103
J
c b 等压过程 Wcb P(Vb Vc ) 2.27 103 J
Qcb
M
7 RT 2
7 2
P(Vb
Vc ) 7.94103
3. 右图,一定量的理想气体分别由初态a经①过程ab和由初态a
经②过程acb到达相同的终态b,则两个过程中气体从外界吸收
的热量Q1,Q2的关系为: [ B ]
A:Q1<0, Q1>Q2 B:Q1>0, Q1>Q2
p
C:Q1<0, Q1>Q2 D:Q1>0, Q1<Q2
b ①
解: a b 等体降压 Q1 Eab
2.如图示,1mol氧气,由状态a变化到状态b,试求下列三种情 况下,气体内能的改变、所作的功和吸收的热量:
(1)由a等温变化到b;(2)由a等体变化到c,再由c等压变化到b; (3)由a等压变化到d,再由等体变化到b。 p(atm)
解:(1) E 0
2
a
d
Wab
Qab
PV ln Vb Va
700J Q E W
W 200J
E
M
CV T
M
5 RT 2
500J
7.设高温热源的热力学温度是低温热源的热力学温度的n倍,
则理想气体在一次卡诺循环中,传给低温热源的热量是从高
温热源吸取的热量的 [ (A) n倍 (B) n-1倍
]C
(C)
热力学习题课超经典 共24页PPT资料
1、求Ta、Tb、Tc。 2、求气体在ab和bc 过程中吸收的热量, 气体内能的变化各如 何? 3、气体在abc过程中 最高温度如何?
P(105Pa)
1.5 b
1a
0.5
c
0 1 2 3 V(10-3m3)
P(105Pa)
1.5 b
1、由 PV M RT 1 a
Mmol
0.5
求出求Ta、Tb、Tc。 0 1
T
Skn (玻氏熵公式)
热力学第二定律的实质:一切与热现象有 关的实际宏观过程都是不可逆的。
无摩擦的准静态过程才是可逆的
熵增加原理:孤立系统内部所发生的过程 总是向着状态几率增大的方向进行
= 可逆过程
孤立系统 dS0 > 不可逆过程
例:0.1mol的单原子理想气体,经历一准 静态过程abc,ab、bc均为直线。
(A) (1)过程中吸热,(2) 过程中放热.
√(B) (1)过程中放热,(2) 过程p中吸热.
(C) 两种过程中都吸热. (D) 两种过程中都放热.
a
(2)
分析: 作一循环a(1)ba, 这是逆循环.
(1)
b
W<0, △E=0, Q<0,
O
V
(1)过程中放热;
同理可得(2) 过程中吸热。
练习13 第四题 容积为10L的盒子以速度 v=200m/s匀速运动,容器中充有质量为50g 温度为18C的氢气,设盒子突然停止,气体 的全部定向运动动能都变为气体分子热运动 动能,容器与外界没有热交换,则达到热平 衡后,氢气的温度将增加——K;氢气的压强将 增加 —— Pa
c
2 3 V(10-3m3)
2、a
b,
M QabMmoC lV(TbTa) E
热力学基础习题课共35页

66、节制使快乐增加并使享受加强。 ——德 谟克利 特 67、今天应做的事没有做,明天再早也 是耽误 了。——裴斯 泰洛齐 68、决定一个人的一生,以及整个命运 的,只 是一瞬 之间。 ——歌 德 69、懒人无法享受休息之乐。——拉布 克 70、浪费时间是一桩大罪过。——卢梭
热力学基础习题课
16、自己选择的路、跪着也要把它走 完。 17、一般情况下)不想三年以后的事, 只想现 在的事 。现在 有成就 ,以后 才能更 辉煌。
18、敢于向ห้องสมุดไป่ตู้暗宣战的人,心里必须 充满光 明。 19、学习的关键--重复。
20、懦弱的人只会裹足不前,莽撞的 人只能 引为烧 身,只 有真正 勇敢的 人才能 所向披 靡。
第13章 热力学基础习题及答案

第十三章习题热力学第一定律及其应用1、关于可逆过程和不可逆过程的判断:(1) 可逆热力学过程一定是准静态过程.(2) 准静态过程一定是可逆过程.(3) 不可逆过程就是不能向相反方向进行的过程.(4) 凡有摩擦的过程,一定是不可逆过程.以上四种判断,其中正确的是。
2、如图所示,一定量理想气体从体积V1,膨胀到体积V2分别经历的过程是:A→B等压过程,A→C等温过程;A→D绝热过程,其中吸热量最多的过程。
3、一定量的理想气体,分别经历如图(1) 所示的abc过程,(图中虚线ac为等温线),和图(2) 所示的def过程(图中虚线df为绝热线).判断这两种过程是吸热还是放热.abc过程热,def过程热.4、如图所示,一绝热密闭的容器,用隔板分成相等的两部分,左边盛有一定量的理想气体,压强为p0,右边为真空.今将隔板抽去,气体自由膨胀,当气体达到平衡时,气体的压强是。
(=γC p/C V)5、一定量理想气体,从同一状态开始使其体积由V1膨胀到2V1,分别经历以下三种过程:(1) 等压过程;(2) 等温过程;(3)绝热过程.其中:__________过程气体对外作功最多;____________过程气体内能增加最多;__________过程气体吸收的热量最多.VV答案1、(1)(4)是正确的。
2、是A-B 吸热最多。
3、abc 过程吸热,def 过程放热。
4、P 0/2。
5、等压, 等压, 等压理想气体的功、内能、热量1、有两个相同的容器,容积固定不变,一个盛有氦气,另一个盛有氢气(看成刚性分子的理想气体),它们的压强和温度都相等,现将5J 的热量传给氢气,使氢气温度升高,如果使氦气也升高同样的温度,则应向氨气传递热量是 。
2、 一定量的理想气体经历acb 过程时吸热500 J .则经历acbda 过程时,吸热为 。
3、一气缸内贮有10 mol 的单原子分子理想气体,在压缩过程中外界作功209J ,气体升温1 K ,此过程中气体内能增量为 _____ ,外界传给气体的热量为___________________. (普适气体常量 R = 8.31 J/mol· K)4、一定量的某种理想气体在等压过程中对外作功为 200 J .若此种气体为单 原子分子气体,则该过程中需吸热_____________ J ;若为双原子分子气体,则 需吸热______________ J.p (×105 Pa)3 m 3)5、 1 mol 双原子分子理想气体从状态A (p 1,V 1)沿p -V 图所示直线变化到状态B (p 2,V 2),试求:(1) 气体的内能增量. (2) 气体对外界所作的功. (3) 气体吸收的热量. (4) 此过程的摩尔热容.(摩尔热容C =T Q ∆∆/,其中Q ∆表示1 mol 物质在过程中升高温度T ∆时所吸收的热量.)答案1、3J2、-700J3、124.7 J ,-84.3 J4、500J ;700J5、解:)(25)(112212V p V p T T C E V -=-=∆ (2) ))((211221V V p p W -+=, W 为梯形面积,根据相似三角形有p 1V 2= p 2V 1,则)(211122V p V p W -=. (3) Q =ΔE +W =3( p 2V 2-p 1V 1 ).(4) 以上计算对于A →B 过程中任一微小状态变化均成立,故过程中ΔQ =3Δ(pV ). 由状态方程得 Δ(pV ) =R ΔT , 故 ΔQ =3R ΔT ,摩尔热容 C =ΔQ /ΔT =3R .p p p 12循环过程1、 如图表示的两个卡诺循环,第一个沿ABCDA 进行,第二个沿A D C AB ''进行,这两个循环的效率1η和2η的关系及这两个循环所作的净功W 1和W 2的关系是 η1 η2 ,W 1 W 22、 理想气体卡诺循环过程的两条绝热线下的面积大小(图中阴影部分)分别为S 1和S 2,则二者的大小关系是:3、一卡诺热机(可逆的),低温热源的温度为27℃,热机效率为40%,其高温热源温度为_______ K .今欲将该热机效率提高到50%,若低温热源保持不变,则高温热源的温度应增加________ K .4、如图,温度为T 0,2 T 0,3 T 0三条等温线与两条绝热线围成三个卡诺循环:(1) abcda ,(2) dcefd ,(3) abefa ,其效率分别为η1_________,η2__________,η 3 __________.5、一卡诺热机(可逆的),当高温热源的温度为 127℃、低温热源温度为27℃时,其每次循环对外作净功8000 J .今维持低温热源的温度不变,提高高温热源温度,使其每次循环对外作净功 10000 J .若两个卡诺循环都工作在相同的两条绝热线之间,试求: (1) 第二个循环的热机效率; (2) 第二个循环的高温热源的温度.6、 1 mol 单原子分子理想气体的循环过程如T -V 图所示,其中c 点的温度为T c =600 K .试求:(1) ab 、bc 、c a 各个过程系统吸收的热量; (2) 经一循环系统所作的净功; (3) 循环的效率. BAC DC 'D 'p p-3m 3)p O 3T 0 2T 0 T 0fad b c e(注:循环效率η=W /Q 1,W 为循环过程系统对外作的净功,Q 1为循环过程系统从外界吸收的热量ln2=0.693)答案 1、=;<2、S 1 = S 2.3、500 ; 1004、33.3% ; 50%; 66.7%5、解:(1) 1211211T T T Q Q Q Q W -=-==η 2111T T T W Q -= 且 1212T TQ Q =∴ Q 2 = T 2 Q 1 /T 1即 212122112T T T W T T T T T Q -=⋅-==24000 J 由于第二循环吸热 221Q W Q W Q +'='+'=' ( ∵ 22Q Q =') =''='1/Q W η29.4% (2) ='-='η121T T 425 K6、解:单原子分子的自由度i =3.从图可知,ab 是等压过程,V a /T a = V b /T b ,T a =T c =600 KT b = (V b /V a )T a =300 K (1) )()12()(c b c b p ab T T R i T T C Q -+=-= =-6.23×103 J (放热) )(2)(b c b c V bc T T R iT T C Q -=-= =3.74×103 J (吸热) Q ca =RT c ln(V a /V c ) =3.46×103 J (吸热) (2) W =( Q bc +Q ca )-|Q ab |=0.97×103 J (3) Q 1=Q bc +Q ca , η=W / Q 1=13.4%热力学第二定律1、根据热力学第二定律判断下列说法的正误: (A) 功可以全部转换为热,但热不能全部转换为功. ( ) (B) 热可以从高温物体传到低温物体,但不能从低温物体传到高温物体 ( )(C) 不可逆过程就是不能向相反方向进行的过程.()(D) 一切自发过程都是不可逆的.()2、热力学第二定律的开尔文表述和克劳修斯表述是等价的,表明在自然界中与热现象有关的实际宏观过程都是不可逆的,开尔文表述指出了___________________________的过程是不可逆的,而克劳修斯表述指出了________________的过程是不可逆的.3、所谓第二类永动机是指________________________________________,它不可能制成是因为违背了________________________________________.答案1、⨯,⨯,⨯,√2、功变热;热传导3、从单一热源吸热,在循环中不断对外作功的热机;热力学第二定律。
热力学基础习题课-田浩.ppt

V C T
CP dT
பைடு நூலகம்
M
CV dT
PV C1 绝 Q 0 1 P T C2 热 TV 1 C3
0
M
CV dT
CV dT
0
题 型
1、理想气体各种等值、绝热过程的功、热 量和内能变化的计算。(5道) 2、热机效率及制冷机制冷系数的计算。 (3道) 3、热力学第二定律,及熵变的计算。 (2道)
A
B
VB
(2)B气体对外做功为 A U CV ,m (TB T0 ) 0.55T0
所以A气体对外做功0.55RT0.
(3)对A气体应用热力学第一定律,有
Q U A CV ,m (TA T0 ) A 2.5R(2.78T0 T0 ) 0.55RT 5RT0
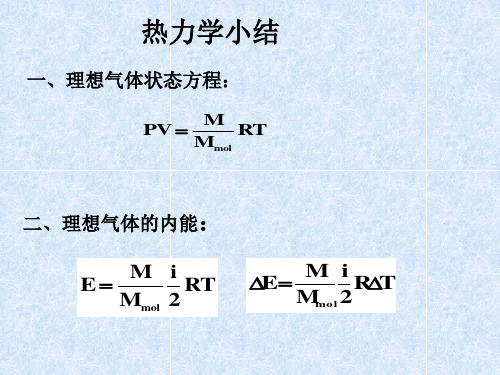
热力学基础
一、热力学基本概念:热力学系统、热力学过程、
内能、功、热量、热容
U M
定压摩尔:C p dT p
i 对于理想气体: CV R 2
Q
CV T
A pdV
V1
V2
Q dU 定容摩尔:CV dT dT V V
Q0 A 解:(2)a到b过程,
B
b到c过程,等容降压,放热 Qbc CV ,m (Tc Tb ), CV ,m 2.5R
1 所以 Tb 2 Ta , Tc Ta 273K
V V 1Ta ( ) 1Tb , 1.4 2
所以 Qbc CV ,m (Ta 2 1Ta )
C A B
D
解:(1)由题意可知,A,B两室中气体的变化过程为准静 态过程。且 vA vB v 对于A室气体,经历等容过程,有 QA vCV ,m (TA T0 ) 对于B室气体,经历等压过程,有 QB vC p,m (TB T0 ) 因为 QA QB Q ,所以 C p,m TB T0 7 CV ,m TA T0 5 根据迈耶公式: Cp,m CV ,m R ,所以 CV ,m 5R / 2, Cp,m 7R / 2 (2)B室中气体的做功为 A pV vR(TB T0 ) 所以
大学物理热学习题课

dN m 32 4 ( ) e Ndv 2kT
v2
对于刚性分子自由度 单原子 双原子 多原子
i tr
(1)最概然速率
2kT 2 RT RT vp 1.41 m
(2)平均速率
i=t=3 i = t+r = 3+2 = 5 i = t+r = 3+3 =6
6、能均分定理
8kT 8 RT RT v 1.60 m
M V RT ln 2 M mol V1
QA
绝热过程
PV 常量
M E CV T M mol
(2)由两条等温线和两条绝热线 组成的循环叫做 卡诺循环。 •卡诺热机的效率
Q0
Q2 T2 卡诺 1 1 Q1 T1
M P1V1 P2V2 A CV T M mol 1
E 0
•热机效率
A Q1 Q2
M E CV T M mol M Q C P T M mol
A Q1 Q2 Q2 1 Q1 Q1 Q1
A=P(V2-V1) 等温过程
A
E 0
Q1 Q2 •致冷系数 e W Q1 Q2
热机效率总是小于1的, 而致冷系数e可以大于1。
定压摩尔热容
比热容比
CP ( dQ )P dT i2 i
8、平均碰撞次数 平均自由程
z
2d v n
2
CV •对于理想气体:
Cp
v z
1.热力学第一定律
1 2 2d n
二、热 力 学 基 础
Q ( E2 E1 ) A dQ dE dA
准静态过程的情况下
4. 摩尔数相同的两种理想气体 一种是氦气,一种是氢气,都从 相同的初态开始经等压膨胀为原 来体积的2倍,则两种气体( A ) (A) 对外做功相同,吸收的热量 不同. (B) 对外做功不同,吸收的热量 相同. (C) 对外做功和吸收的热量都不 同. (D) 对外做功和吸收的热量都相 同. A=P(V2-V1)
热力学第一定律习题课 (1)全

= 1.3%
(5)
P
qm ws
220 t/h103 kg/t 3600 s/h
1.1361 03
kJ/kg
=
6.94 104
kW
讨论
(1)本题的数据有实际意义,从计算中可以看到,忽略进出 口的动、位能差,对输轴功影响很小,均不超过3%,因此在实 际计算中可以忽略。 (2)蒸汽轮机散热损失相对于其他项很小,因此可以认为一 般叶轮机械是绝热系统。
m2u2 m1u1 m2 m1 h 0
u2
m2
m1 h
m2
m1u1
方法三 取充入气罐的m2-m1空气为闭口系
Q U W
Q 0 ? W ? U ?
U m2 m1 u2 u
W W1 W2 m2 m1 pv W2
2
则 Q23 U23 W23 U3 U2 87.5 kJ175 kJ 87.5 kJ
U1 U3 U123 87.5 kJ (77.5 kJ) 165 kJ
讨论
热力学能是状态参数,其变化只决定于初 终状态,于变化所经历的途径无关。
而热与功则不同,它们都是过程量,其变 化不仅与初终态有关,而且还决定于变化所 经历的途径。
1 2
(cf23
c22 )
ws
因为w3 0,所以
燃烧室 压 气 机
cf 3' 2 q (h3' h2 ) cf22
2 670103 J/kg- (800 - 580) 103 J/kg + (20 m/s)2 = 949 m/s
( 4 ) 燃气轮机的效率
取燃气轮机作为热力系,因为燃气在
( 5 ) 燃气轮机装置的总功率 装置的总功率=燃气轮机产生的功率-压气机消耗的功率
物理化学《化学热力学基础》习题及答案

物理化学《化学热力学基础》习题及答案1-2 选择题1、273K ,θp 时,冰融化为水的过程中,下列关系是正确的有(B )A.0<WB.p Q H =∆C.0<∆HD.0<∆U2、体系接受环境做功为160J ,热力学能增加了200J ,则体系(A )A.吸收热量40JB.吸收热量360JC.放出热量40JD.放出热量360J3、在一绝热箱内,一电阻丝浸入水中,通以电流。
若以水和电阻丝为体系,其余为环境,则(C )A.0,0,0>∆=>U W QB.0,0,0>∆==U W QC.0,0,0>∆>=U W QD.0,0,0<∆=<U W Q4、任一体系经一循环过程回到始态,则不一定为零的是(D )A.G ∆B.S ∆C.U ∆D.Q5、对一理想气体,下列关系式不正确的是(A )A.0=⎪⎭⎫ ⎝⎛∂∂p T UB.0=⎪⎭⎫ ⎝⎛∂∂T V H C.0=⎪⎪⎭⎫ ⎝⎛∂∂T p H D.0=⎪⎪⎭⎫ ⎝⎛∂∂T p U 6、当热力学第一定律写成pdV Q dU -=δ时,它适用于(C )A.理想气体的可逆过程B.封闭体系的任一过程C.封闭体系只做体积功过程D.封闭体系的定压过程7、在一绝热刚壁体系内,发生一化学反应,温度从21T T →,压力由21p p →,则(D )A.0,0,0>∆>>U W QB.0,0,0<∆<=U W QC.0,0,0>∆>=U W QD.0,0,0=∆==U W Q 8、理想气体定温定压混合过程中,下列体系的性质不正确的是(C )A.0>∆SB.0=∆HC.0=∆GD.0=∆U9、任意的可逆循环过程,体系的熵变(A )A.一定为零B.一定大于零C.一定为负D.是温度的函数10、一封闭体系从B A →变化时,经历可逆R 和不可逆IR 途径,则(B )A.IR R Q Q =B.T Q dS IRδ> C.IR R W W = D.TQ T Q IR R =11、理想气体自由膨胀过程中(D )A.0,0,0,0=∆>∆>=H U Q WB.0,0,0,0>∆>∆=>H U Q WC.0,0,0,0=∆=∆><H U Q WD.0,0,0,0=∆=∆==H U Q W12、2H 和2O 在绝热定容的体系中生成水,则(D )A.0,0,0=∆>∆=孤S H QB.0,0,0>∆=>U W QC.0,0,0>∆>∆>孤S U QD.0,0,0>∆==孤S W Q13、理想气体可逆定温压缩过程中,错误的有(A )A.0=∆体SB.0=∆UC.0<QD.0=∆H14、当理想气体反抗一定外压做绝热膨胀时,则(D )A.焓总是不变的B.热力学能总是不变的C.焓总是增加的D.热力学能总是减小的15、环境的熵变等于(B 、C ) A.环体T Q δ B.环体T Q δ- C.环环T Q δ D.环环T Q δ-16、在孤立体系中进行的变化,其U ∆和H ∆的值一定是(D )A.0,0<∆>∆H UB.0,0=∆=∆H UC.0,0<∆<∆H UD.不能确定H U ∆=∆,017、某体系经过不可逆循环后,错误的答案是(A )A.0=QB.0=∆SC.0=∆UD.0=∆H18、C 6H 6(l)在刚性绝热容器中燃烧,则(D )A.0,0,0=<∆=∆Q H UB.0,0,0=>∆=∆W H UC.0,0,0==∆≠∆Q H UD.0,0,0=≠∆=∆W H U19 、下列化学势是偏摩尔量的是( B ) A.Zn V T B n F ,,⎪⎭⎫ ⎝⎛∂∂ B.Z n p T B n G ,,⎪⎭⎫ ⎝⎛∂∂ C.Z n V S B n U ,,⎪⎭⎫ ⎝⎛∂∂ D.Z n p S B n H ,,⎪⎭⎫ ⎝⎛∂∂ 20、在℃10-,θp ,1mol 过冷的水结成冰时,下述表示正确的是( C )A.00,0,0>∆>∆>∆<∆孤环体,S S S GB.00,0,0<∆<∆<∆>∆孤环体,S S S GC.00,0,0>∆>∆<∆<∆孤环体,S S S GD.00,0,0<∆<∆>∆>∆孤环体,S S S G21、下述化学势的公式中,不正确的是( D ) A.B B Z n p T n Gμ=⎪⎪⎭⎫ ⎝⎛∂∂,, B.m B pS T ,-=⎪⎭⎫ ⎝⎛∂∂μ C.m B TV p ,=⎪⎪⎭⎫ ⎝⎛∂∂μ D.Z n p T B n U ,,⎪⎪⎭⎫ ⎝⎛∂∂ 22、在373.15K ,101.325Pa ,)(2l O H μ与)(2g O H μ的关系是( B )A.)()(22g O H l O H μμ>B.)()(22g O H l O H μμ=C.)()(22g O H l O H μμ<D.无法确定23、制作膨胀功的封闭体系,pT G ⎪⎭⎫ ⎝⎛∂∂的值( B ) A.大于零 B.小于零 C.等于零 D.无法确定24、某一过程0=∆G ,应满足的条件是( D )A.任意的可逆过程B.定温定压且只做体积中的过程C.定温定容且只做体积功的可逆过程D.定温定压且只做体积功的可逆过程25、1mol 理想气体经一定温可逆膨胀过程,则( A )A.F G ∆=∆B.F G ∆>∆C.F G ∆<∆D.无法确定26、纯液体在正常相变点凝固,则下列量减少的是( A )A.SB.GC.蒸汽压D.凝固热27、右图中哪一点是稀溶液溶质的标准态的点( B )A.a 点B.b 点C.c 点D.d 点28、在θp 下,当过冷水蒸气凝结为同温度的水,在该过程中正、负号无法确定的是( D )A.G ∆B.S ∆C.H ∆D.U ∆29、实际气体的化学势表达式为θθμμp f RT T ln)(+=,其中标准态 化学势为( A )A.逸度θp f =的实际气体的化学势B.压力θp p =的实际气体的化学势C.压力θp p =的理想气体的化学势D.逸度θp f =的理想气体的化学势30、理想气体的不可逆循环,G ∆( B )A.0<B.0=C.0>D.无法确定31、在βα,两相中含A 、B 两种物质,当达平衡时,正确的是( B )A.ααμμB A =B.ααμμA A =C.βαμμB A =D.ββμμB A =32、多组分体系中,物质B 的化学势随压力的变化率,即)(,B Z B Z n T p ≠⎪⎪⎭⎫ ⎝⎛∂∂μ的值( A ) A.0> B.0< C.0= D.无法确定33、℃10-、标准压力下,1mol 过冷水蒸汽凝集成冰,则体系、环境及总的熵变为( B )A.0,0,0<∆<∆<∆univ sur sys S S SB.0,0,0>∆>∆<∆univ sur sys S S SC.0,0,0>∆>∆>∆univ sur sys S S SD.0,0,0<∆>∆<∆univ sur sys S S S34、p-V 图上,1mol 单原子理想气体,由状态A 变到状态B ,错误的是( B )A.Q U =∆B.Q H =∆C.0<∆SD.0<∆U35、体系经不可逆过程,下列物理量一定大于零的是( C )A.U ∆B.H ∆C.总S ∆D.G ∆36、一个很大的恒温箱放着一段电阻丝,短时通电后,电阻丝的熵变( D )A.0>B.0<C.0=D.无法确定37、热力学的基本方程Vdp SdT dG +-=可使用与下列哪一过程( B )A.298K ,标准压力的水蒸发的过程B.理想气体向真空膨胀C.电解水制备氢气D.合成氨反应未达平衡38、温度为T 时,纯液体A 的饱和蒸汽压为*A p ,化学势为*A μ,在1θp 时,凝固点为0f T ,向A 溶液中加入少量溶质形成稀溶液,该溶质是不挥发的,则A p 、A μ、f T 的关系是( D )A.f f A A A A T T p p <<<0,**,μμB.f f A A A A T T p p <<>0,**,μμC.f f A A A A T T p p ><>0,**,μμD.f f A A A A T T p p >>>0,**,μμ39下列性质不符合理想溶液通性的是: ( D )A. ∆mix V =0B. ∆mix S >0C. ∆mix G <0D. ∆mix G >040、从A 态到B 态经不可逆过程ΔS 体是: ( D )A.大于零B.小于零C.等于零D.无法确定41、常压下-10℃过冷水变成-10℃的冰,在此过程中,体系的ΔG 与ΔH 如何变化: ( D )A. ΔG<0,ΔH>0B. ΔG>0,ΔH>0C. ΔG=0,ΔH=0D. ΔG<0,ΔH<042、某绝热封闭体系在接受了环境所做的功之后,其温度:( A )A.一定升高B.一定降低C.一定不变D.不一定改变43、对于纯物质的标准态的规定,下列说法中不正确的是: (C)A. 气体的标准态就是温度为T ,压力为100kPa 下具有理想气体性质的纯气体状态。
热力学基础习题、答案及解法(2011.1.6)

热力学基础习题、答案及解法一、选择题1. 如图一所示,一定量的理想气体,由平衡状态A 变到平衡状态B (b a P P =),则无论经过的是什么过程,系统必然 【B 】(A )对外做正功 (B )内能增加 (C )从外界吸热 (D )向外界吸热2. 对于室温下的单原子分子理想气体,在等压膨胀的情况下,系统对外所做的功与从外界吸收的热量之比Q W 等于 【C 】 (A )32 (B )21 (C )52 (D )72参考答案:T R MW p ∆=μT R i M Q p ∆⎪⎭⎫⎝⎛+=22μ522222=+=∆⎪⎭⎫ ⎝⎛+∆=i T R i M TR MQ W pp μμ3. 压强、体积、温度都相等的常温下的氧气和氦气,分别在等压过程中吸收了相等的热量,它们对外做的功之比为 【C 】 (A )1:1 (B )5:9 (C )5:7 (D )9:5参考答案:T R i M Q p ∆⎪⎭⎫ ⎝⎛+=22μ RT M pV μ=氦氧T T ∆⎪⎭⎫⎝⎛+=∆⎪⎭⎫ ⎝⎛+223225 P VA∙B∙O1图75=∆∆氦氧T T T R M W p ∆=μ 75=∆∆=氦氧氦氧T T W W p p 4. 在下列理想气体过程中,哪些过程可能发生? 【D 】 (A )等体积加热时,内能减少,同时压强升高 (B )等温压缩时,压强升高,同时吸收 (C )等压压缩时,内能增加,同时吸热 (D )绝热压缩时,压强升高,同时内能增加参考答案:0=dV 0=W T R i M E Q ∆⎪⎭⎫⎝⎛=∆=2μ 0=dT 0=∆E !11!2ln lnp p RT M V V RT MW Q μμ=== 0=dp T R i M Q ∆⎪⎭⎫ ⎝⎛+=22μ T R i M E ∆⎪⎭⎫ ⎝⎛=∆2μ T R MV p W ∆=∆=μ 0=dQ 0=Q ⎰⎪⎪⎭⎫⎝⎛--=-=∆⎪⎭⎫⎝⎛=-=∆--1011001112γγγγμV V V p pdV T R i M W E5. 分别在等温、等压、等容情况下,将400J 的热量传给标准状态下的2mol 氢气,关于3个过程热量和内能的变化说法正确的是【D 】 (A )等容过程做功最多,等压过程内能增加最多 (B )等压过程做功最多,等容过程内能增加最多 (C )等温过程做功最多,等压过程内能增加最多 (D )等温过程做功最多,等容过程内能增加最多参考答案:0=dV 0=W T R i M E Q ∆⎪⎭⎫⎝⎛=∆=2μ 0=dT 0=∆E !11!2ln lnp p RT M V V RT MW Q μμ===0=dp T R i M Q ∆⎪⎭⎫ ⎝⎛+=22μ T R i M E ∆⎪⎭⎫ ⎝⎛=∆2μ T R MV p W ∆=∆=μ 6. 如图所示,一定量的理想气体经历c b a →→过程,在此过程中气体从外界吸收热量Q ,系统内能变化ΔE ,则以下哪种说法是正确的? 【A 】 (A )系统从外界吸收热量,内能增大; (B )系统从外界吸收热量,内能减少; (C )系统向外界放出热量,内能增大; (D )系统向外界放出热量,内能减少。
秋热力学第一二定律习题课.pptx

263.15K, 552Pa
第15页/共47页
H2O( l, 1mol) 263.15K, 101.325kPa
H2O( s, 1mol) 263.15K, 101.325kPa
①
凝聚态的等温可逆过程
⑤
H2O( l, 1mol)
H2O( s, 1mol)
263.15K, 611Pa
263.15K, 552Pa
p3 = 101.325kPa V3 = 10.0dm3
U U1 U2 48.96kJ
T3 = 373.15K ng = 0.327mol,
H H1 H2 53.01kJ
nl = 1.306mol
第7页/共47页
求解热力学过程中热力学函数变化值应该注意的地方: 1.不同的热力学过程有不同的公式计算,需要记忆。 以下是一些基本的热力学变化过程: 第一类:简单状态变化: 理想气体的等温、等容、等压、恒外压、绝热、自由膨 胀、多方可逆。 实际气体根据题目提供的气体状态方程计算。 第二类:发生相变或化变: 等温等压可逆相变、等温等压化学反应。
III:H2O( g + l ) p3 = 101.325kPa V3 = 10.0dm3 T3 = ? ng = ?,nl = ?
I:H2O( g ) p1 = 0.5×101.325kPa V1 = 100dm3
T1 = 373.15K
n = 1.633mol
(1) 等温可逆
II:H2O( g ) p2 = 101.325kPa V2 = 50dm3 T2 = 373.15K n = 1.633mol
0.5 ×101.325kPa ×100dm 3 n 8.314J mol -1 K-1 ×373.15K
热力学习题课

p
p
p
[C ]
O 图(a)
V O 图(b)
V O 图1 膨胀到体积 V2 分别 经历的过程是:AB 等压过程; AC 等温过程; AD 绝热过程,其中吸热最多的过程是 (A)A B ; Q E W ( B) A C ; [A] ( C) A D ; (D)既是 A B 也是 A C,两 过程吸热一样多。
p a' b' b d d' O c' c V
[B]
a
W h Q
Tcd h 1 Tab
W h' Q'
Tc 'd ' h' 1 Ta 'b '
11.如图所示,已知图中画不同斜线的两部分的面积分别 为
S1和S 2 ,那么如果气体的膨胀过程为a─1─b,则气
p a 1 2 O S1 b S2 V
p
p2
T
E CV (T2 T1 )
V1 V2 等压: T1 T2
绝热:
1
T2 2T1
常量
V 1T
1
o
V
V1
V1 T1 V2 T2
1 T2 1 T1 2
V2 2V1
Q E W
14.一定量某种理想气体在等压过程中对外作功为 200 J.若 此种气体为单原子分子气体,则该过程中需吸热
S1 S 2 ; 体对外做功W=________
如果气体进行a─2─b─1─a的循环过程,
则它对外做功W=_______________
S1
12.某理想气体等温压缩到给定体积时外界对气体作 功| W1 | ,又经绝热膨胀返回原来体积时气体对外作功 | W2 | 则整个过程中气体 | W1 | (1) 从外界吸收的热量Q = ________________ (2) 内能增加了 E ______________________
热力学基础第5讲——热力学习题课

b
V1 V
1 Q1 CV (T A T 0) ( P A P0)(V A V 0) 0 , 2 1 Q 2 CV (T 1 T A) ( P A P1)(V 1 V A) 0 , 2 Q2 1 52.34 % Q1
作
业
题: 习题9.13 、9.18、9.21
8: 1 mol 单原子理想气体从初态压强 P0 32 Pa ,
P1 V0
b
V1 V
P V , 255 31 3 ( Pa ). ( Pa / m ) , 则: 7 56
在直线上一个微小过程中,
dA PdV , dE CV dT , dP dV , P V PdV VdP RdT PV RT dQ PdV CV dT
p a (2) b V
(1) O
4、下图为一理想气体几种状态变化过程的 P-V图, 其中MT为等温线,MQ为绝热线,在AM、BM、CM三种 准静态过程中: (1) 温度降低的是__________过程; AM (2) 气体放热的是__________过程. AM、BM
p M A T B Q O
C
V
预习内容:
6.1 — 6.3
复习内容:
第 9 章
由于 AB、CA 均为绝热线,系统与外界没有热量 交换, 系统在此循环中只在等温过程 BC 与外界存在热 量交换。 系统是从单一热源吸热。
另一方面,曲线 ABCA 所围 面积不为零,即系统在此循环过 程中对外做正功。 因此,该循环的总效果是: 系统从单一热源吸热,使之完全 变为功而不产生其它影响。
Q Ⅱ
Ⅰ
P P2 P0 (V0 / V1 ) 2.64atm 1 T1 1081K
热力学习题课

4.一定量的理想气体经历acb过程时吸热500 J.则经历 acbda过程时,吸热为(指的是总热量) (A) –1200 J. (B) –700 J. (C) –400 J. (D) 700 J. [B]
解法(一) 整个循环: E 0,
Q W
Wacb ?
Wda ? Wbd ?
C p TAB CV TAB WAB
0 CV TAD WAD
TAB
i3
7/28
| TAD |
W AD 2 R i
3.氦气、氮气、水蒸汽(均视为刚性分子理想气体),它们的摩 尔 数相同,初始状态相同,若使它们在体积不变情况下吸收相等 的热量,则 (A) 它们的温度升高相同,压强增加相同.
热力学基础 小结及习题课
1/28
一、热力学第一定律
系 E 统
W
Q E W
注意正负号的规定
Q吸
2/28
二、热力学第一定律的应用
Q E W
热一律
QV E
过程 过程特点 过程方程
等体
内能增量
dV 0
P C T V C T
PV C
E CV T
等压 dP 0
S1 S 2
p a 1 2 O S1 b S2 V
S1 则它对外做功W=_______________
13/28
10.某理想气体等温压缩到给定体积时外界对气体作 功| W1 | ,又经绝热膨胀返回原来体积时气体对外作功 | W2 | 则整个过程中气体 放热 | W1 | (1) 从外界吸收的热量Q = ________ | W2 | (2) 内能增加了 E _________
p
热力学基础习题课共35页文档

1、合法而稳定的权力在使用得当时很 少遇到 抵抗。 ——塞 ·约翰 逊 2、权力会使人渐渐失去温厚善良的美 德。— —伯克
3、最大限度地行使权力总是令人反感 ;权力 不易确 定之处 始终存 在着危 险。— —塞·约翰逊 4、权力会奴化一切。——塔西佗
5、虽然权力是一头固执的熊,可是金 子可以 拉着它 的鼻子 走。— —莎士 比
31、只有永远躺在泥坑里的人,才不会再掉进坑里。——黑格尔 32、希望的灯一旦熄灭,生活刹那间变成了一片黑暗。——普列姆昌德 33、希望是人生的乳母。——科策布 34、形成天才的决定因素应该是勤奋。——郭沫若 3
热力学基础习题课

解:两种气体经历等容过程,升高相同温度 Q2 CV2 ,m 5 对于氦气 对于氢气 3 Q C 1 V , m 1 Q2 CV2 ,m 2 RT Q1 CV1 ,m 1 RT, 由于两种气体初始状态 pV RT 具有完全相同的p,V,T
1 2
4. 如图,一定质量的理想气体,其状态在p-T图上沿着 一条直线从平衡态a变到平衡态b,下列说法正确的是:
p
b
80 C
20 C
a
V1
c
d
2V1 V
解:初态:1mol氢气, p=1atm,20C
对abc过程:
p
5 E CV ,m T R(80 20) 150R 2 2V W RT1 ln 1 (273 80)R ln 2 353R ln 2 V1
b
80 C
20 C
a
V1
c
d
Q E W 150R 353R ln2
2V1 V
对adc过程:
E CV ,m T 5 R(80 20) 150R 2
2V1 W RT2 ln (273 20)R ln 2 293R ln 2 V1
Q E W 150 R 293R ln 2
(2)等压过程
(4)绝热过程
2
E
解:理想气体的内能 E i RT 理想气体状体方程 pV RT
i E pV 2
O
V
因此,在E~V中p表示直线的 斜率,即在该过程p保持恒量
6. 处于平衡态A的一定量的理想气体,若经准静态等 体过程变到平衡态B,将从外界吸收热量416J,若经 准静态等压过程变到与平衡态B有相同温度的平衡态 C,将从外界吸收热量582J,所以,从平衡态A变到 平衡态C的准静态等压过程中气体对外界所作的功为 166 J 解:题设包括两个的过程T相同E相同 AB,等容过程 AC,等压过程
物理化学《化学热力学基础》习题及答案

物理化学《化学热力学基础》习题及答案 1-2 选择题1、273K ,θp 时,冰融化为水的过程中,下列关系是正确的有(B )A.0<WB.p Q H =∆C.0<∆HD.0<∆U2、体系接受环境做功为160J ,热力学能增加了200J ,则体系(A )A.吸收热量40JB.吸收热量360JC.放出热量40JD.放出热量360J3、在一绝热箱内,一电阻丝浸入水中,通以电流。
若以水和电阻丝为体系,其余为环境,则(C )A.0,0,0>∆=>U W QB.0,0,0>∆==U W QC.0,0,0>∆>=U W QD.0,0,0<∆=<U W Q4、任一体系经一循环过程回到始态,则不一定为零的是(D )A.G ∆B.S ∆C.U ∆D.Q5、对一理想气体,下列关系式不正确的是(A )A.0=⎪⎭⎫ ⎝⎛∂∂p T UB.0=⎪⎭⎫ ⎝⎛∂∂T V H C.0=⎪⎪⎭⎫ ⎝⎛∂∂T p H D.0=⎪⎪⎭⎫ ⎝⎛∂∂T p U 6、当热力学第一定律写成pdV Q dU -=δ时,它适用于(C )A.理想气体的可逆过程B.封闭体系的任一过程C.封闭体系只做体积功过程D.封闭体系的定压过程7、在一绝热刚壁体系内,发生一化学反应,温度从21T T →,压力由21p p →,则(D )A.0,0,0>∆>>U W QB.0,0,0<∆<=U W QC.0,0,0>∆>=U W QD.0,0,0=∆==U W Q 8、理想气体定温定压混合过程中,下列体系的性质不正确的是(C )A.0>∆SB.0=∆HC.0=∆GD.0=∆U9、任意的可逆循环过程,体系的熵变(A )A.一定为零B.一定大于零C.一定为负D.是温度的函数10、一封闭体系从B A →变化时,经历可逆R 和不可逆IR 途径,则(B )A.IR R Q Q =B.T Q dS IRδ> C.IR R W W = D.TQ T Q IR R =11、理想气体自由膨胀过程中(D )A.0,0,0,0=∆>∆>=H U Q WB.0,0,0,0>∆>∆=>H U Q WC.0,0,0,0=∆=∆><H U Q WD.0,0,0,0=∆=∆==H U Q W12、2H 和2O 在绝热定容的体系中生成水,则(D )A.0,0,0=∆>∆=孤S H QB.0,0,0>∆=>U W QC.0,0,0>∆>∆>孤S U QD.0,0,0>∆==孤S W Q13、理想气体可逆定温压缩过程中,错误的有(A )A.0=∆体SB.0=∆UC.0<QD.0=∆H14、当理想气体反抗一定外压做绝热膨胀时,则(D )A.焓总是不变的B.热力学能总是不变的C.焓总是增加的D.热力学能总是减小的15、环境的熵变等于(B 、C ) A.环体T Q δ B.环体T Q δ- C.环环T Q δ D.环环T Q δ-16、在孤立体系中进行的变化,其U ∆和H ∆的值一定是(D )A.0,0<∆>∆H UB.0,0=∆=∆H UC.0,0<∆<∆H UD.不能确定H U ∆=∆,017、某体系经过不可逆循环后,错误的答案是(A )A.0=QB.0=∆SC.0=∆UD.0=∆H18、C 6H 6(l)在刚性绝热容器中燃烧,则(D )A.0,0,0=<∆=∆Q H UB.0,0,0=>∆=∆W H UC.0,0,0==∆≠∆Q H UD.0,0,0=≠∆=∆W H U19 、下列化学势是偏摩尔量的是( B ) A.Zn V T B n F ,,⎪⎭⎫ ⎝⎛∂∂ B.Z n p T B n G ,,⎪⎭⎫ ⎝⎛∂∂ C.Z n V S B n U ,,⎪⎭⎫ ⎝⎛∂∂ D.Z n p S B n H ,,⎪⎭⎫ ⎝⎛∂∂ 20、在℃10-,θp ,1mol 过冷的水结成冰时,下述表示正确的是( C )A.00,0,0>∆>∆>∆<∆孤环体,S S S GB.00,0,0<∆<∆<∆>∆孤环体,S S S GC.00,0,0>∆>∆<∆<∆孤环体,S S S GD.00,0,0<∆<∆>∆>∆孤环体,S S S G21、下述化学势的公式中,不正确的是( D ) A.B B Z n p T n Gμ=⎪⎪⎭⎫ ⎝⎛∂∂,, B.m B pS T ,-=⎪⎭⎫ ⎝⎛∂∂μ C.m B TV p ,=⎪⎪⎭⎫ ⎝⎛∂∂μ D.Z n p T B n U ,,⎪⎪⎭⎫ ⎝⎛∂∂ 22、在373.15K ,101.325Pa ,)(2l O H μ与)(2g O H μ的关系是( B )A.)()(22g O H l O H μμ>B.)()(22g O H l O H μμ=C.)()(22g O H l O H μμ<D.无法确定23、制作膨胀功的封闭体系,pT G ⎪⎭⎫ ⎝⎛∂∂的值( B ) A.大于零 B.小于零 C.等于零 D.无法确定24、某一过程0=∆G ,应满足的条件是( D )A.任意的可逆过程B.定温定压且只做体积中的过程C.定温定容且只做体积功的可逆过程D.定温定压且只做体积功的可逆过程25、1mol 理想气体经一定温可逆膨胀过程,则( A )A.F G ∆=∆B.F G ∆>∆C.F G ∆<∆D.无法确定26、纯液体在正常相变点凝固,则下列量减少的是( A )A.SB.GC.蒸汽压D.凝固热27、右图中哪一点是稀溶液溶质的标准态的点( B )A.a 点B.b 点C.c 点D.d 点28、在θp 下,当过冷水蒸气凝结为同温度的水,在该过程中正、负号无法确定的是( D )A.G ∆B.S ∆C.H ∆D.U ∆29、实际气体的化学势表达式为θθμμp f RT T ln)(+=,其中标准态 化学势为( A )A.逸度θp f =的实际气体的化学势B.压力θp p =的实际气体的化学势C.压力θp p =的理想气体的化学势D.逸度θp f =的理想气体的化学势30、理想气体的不可逆循环,G ∆( B )A.0<B.0=C.0>D.无法确定31、在βα,两相中含A 、B 两种物质,当达平衡时,正确的是( B )A.ααμμB A =B.ααμμA A =C.βαμμB A =D.ββμμB A =32、多组分体系中,物质B 的化学势随压力的变化率,即)(,B Z B Z n T p ≠⎪⎪⎭⎫ ⎝⎛∂∂μ的值( A ) A.0> B.0< C.0= D.无法确定33、℃10-、标准压力下,1mol 过冷水蒸汽凝集成冰,则体系、环境及总的熵变为( B )A.0,0,0<∆<∆<∆univ sur sys S S SB.0,0,0>∆>∆<∆univ sur sys S S SC.0,0,0>∆>∆>∆univ sur sys S S SD.0,0,0<∆>∆<∆univ sur sys S S S34、p-V 图上,1mol 单原子理想气体,由状态A 变到状态B ,。
大学物理热力学基础习题课

答案:B 9、下列说法中,哪些是正确的
1、可逆过程一定是准静态过程;2、准静态过程一定是可逆的 4、不可逆过程一定是非准静态过程;4、非准静态过程一定是 不可逆的。
A、(1,4);B、(2,3);C、(1,3);D、(1,2,3,4)
答案:A
10、根据热力学第二定律,下列那种说法正确
A.功可一全部转换成热,但热不可以全部转换成功 B.热可以从高温物体传递到低温物体,反之则不行
Q QBC QAB 14.9 105 J 由图得, TA TC 全过程:
E 0
W Q E 14.9 105 J
3. 图所示,有一定量的理想气体,从初状态 a (P1,V1)开始,经过一个等容过程达到压强为 P1/4 的 b 态,再经过一个等压过程达到状态 c , 最后经过等温过程而完成一个循环。求该循环 过程中系统对外做的功 A 和吸收的热量 Q .
a
T2 300 1 1 25% T1 400
c
d
300 400
T(K)
8. 一卡诺热机在每次循环中都要从温度为 400 K 的高温热源吸热 418 J ,向低温热源放 热 334.4 J ,低温热源的温度为 320 K 。如 果将上述卡诺热机的每次循环都逆向地进行, 从原则上说,它就成了一部致冷机,则该逆向 4 卡诺循环的致冷系数为 。
解:设状态 c 的体积为V2 , 由于a , c 两状态的温度相同
故
p1 p1V1 V2 4 V2 4V1
循环过程 E 0 , Q W
而在 a b 等容过程中功 W1 0 在 b c 等压过程中功
p1 p1 3 W2 V2 V1 4V1 V1 p1V1 4 4 4
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Cp d T
热源的熵的增量为
4.187 105 S2 1.122 103 J K -1 373.15 373.15 100C p
水和热源的总熵的增加量为
S S1 S2 0.184 10 J K
迈耶公式(推导过程要掌握)
Q E W
过程量 状态量
),
状态量只决定于( 而与( )无关 始末状态,过程
摩尔热容比 C p / CV 温度升高 T 0, E 0 温度降低 T 0, E 0 系统吸热 Q 0 系统放热 Q 0
二、四种过程 过程 W 等体 等压 等温
内的分子数占总分子数
的百分比
v v dv
v
表示速率 v 附近单位 速率区间的分子数占分子 总数的百分比 .
v v dv 区间
f ( v)
Nf v (b )
v 曲线
f v dv N v1 表示速率在 v1 v2 区间的分子数占总分子数的百 分比 . 归一化条件
(4).三种统计速率
2kT 2 RT vp m M
平均速率
v v f v dv
0
分布函数和 温度的关系
8kT 8 RT v m M
分子质量相同, 试比较T1和T2的 大小
平方平均速率
v v2 f v dv
2 0
方均根速率
vrms 3kT 3 RT v m M
关于可逆过程和不可逆过程的判断:
(1) 可逆热力学过程一定是准静态过.
(2) 准静态过程一定是可逆过程. (3) 不可逆过程就是不能向相反方向进行的过程. (4) 凡有摩擦的过程,一定是不可逆过程. 以上四种判断,其中正确的是
6 .熵 玻尔兹曼熵公式 克劳修斯熵公式 熵增加原理 孤立系统 自发过程
分子间及分子和器壁间的碰撞是完全弹性碰撞
分子平均平动动能
1 2 mv 2
理想气体压强公式
2 p n 3
2. 在推导理想气体压 强公式中,体现统计 意义的两条假设是 _____和____ 沿空间各方向运动的 分子数目相等
v x 2 v y 2 v z2
2. 温度的统计解释(推导) 理想气体状态方程
p nkT
宏观量温度与微观量的统计平均值关系
温度的统计意义: 气体温度是分子 平均平动动能的 量度
3 kT 2
气体分子的方均根速率
v2 3kT 3RT m M mol
3. 能量均分定理 理想气体的内能 气体处于平衡态时,分子的任何一个自由度的平均动能都相 等,均为
1 kT,这就是能量按自由度均分定理. 2
热 学
习题课 2014.12.2
第一章 统计物理学
1.理想气体状态方程
M RT RT pV M mol p nkT
要求牢记,明确式中各参数的意义
2. 理想气体的压强公式(推导)
1. 从分子动理论导出的 压强公式来看, 气体作 理想气体的分子模型为: 用在器壁上的压强, 决 定于_____和____. 分子可以看作质点 单位体积内的分子数 n, 除碰撞外,分子力可以略去不计 分子的平均平动动能
分子的平均能量
i k kT 2
M M i E E0 RT M mol M mol 2
M i E RT M mol 2
质量为 M 理想气体的内能
内能随温度的改变
试写出下列各式的物理意义:
1 kT ——分子每一自由度所均分的能量 2 i kT ——自由度为 i 的分子的平均能量 2 5kT / 2 ——双原子气体分子的平均能量 1 RT ——1/3mol单原子理想气体的内能 2 3 RT ——1mol单原子理想气体的内能 2 5iRT ——10 mol自由度为 i 的理想气体的内能
4. 热力学第二定律 开尔文表述:不可能从单一热源吸收热量,使 利用热力学第二定律可证明 : 之完全变为有用的功而不引起 [卡诺定理] 在相同的高温热源( T1 )和低温 其它变化。 ( )过程不可逆 热源( T2 )之间工作的一切热机的效率
T2 1 克劳修斯表述:不可能把热量从低温物体 T1
例 1mol单原子分子的理想气体,经历如图所示的可逆循 2 环,连接ac两点的曲线Ⅲ的方程为 p V / V0 p0 ,a点 的温度为T0 。( 1)试以 T0 、R表示Ⅰ、Ⅱ、Ⅲ过程中气 体吸收的热量。(2)求此循环的效率。 P b Ⅱ c 9 P0 解:(1)过程Ⅰ: 3 Ⅰ QI CV Tb Ta R Tb Ta Ⅲ 2 P 3 0 a Vb pb pa 12 p0V0 12 RT0 2 V0 3V0 V 5 QII C p Tc Tb R Tc Tb 过程Ⅱ :
2
2kT 2 RT vp m M
v p1 v p2 T1 T2
分布函数和分 子质量的关系
温度相同,试比较M1和 M 2的大小
v p1 v p2 M1 M2
证明题
例:说明下列各式的物理意义
f (υ)dυ
nf (υ)dυ
f (υ)dυ
υ2 υ1
υ2 Nυf υ1
f (υ)dυ
υ2 Nυf υ1
υ2 υ1
表示在速率v1~v2速率区间内,分子出现的概率。
(υ)dυ 表示分子速率在v1 ~ v 2间隔内的分子数。
v1 ~ v2速率区间内分子的平均速率
v'
v2
v1
vdN
N
v2
v1
vdN / N
N / N
v2
v1 v2 v1
vf v dv f v dv
分子平动动能的平均值
5.重力场中粒子的分布: 波尔兹曼能量分布
n n0 e
mgh / kT
mgh / kT
p n0 kTe
n0 kTe
gh / RT
p0 RT p0 kT h ln ln mg p g p
忽略 粒子间的相互作 用
6.分子碰撞的统计规律(推导)
分子平均碰撞频率:
(υ)dυ
解: 利用定义分析
表示分子速率在v值附近单位速率区间内的分子数占总分子 数的百分比,也可表示任何一个分子速率在v值附近单位速 率区间内出现的概率。
d N υ f (υ) Ndυ
f (υ)dυ 表示分子速率在 v~v+dv 区间内的分子数占总分子数
的百分比或出现的概率
N dN dN 表示单位体积内,分子速率在 nf (v)d v V N V v~v+dv 区间内的分子数
p a
O Q 1 A Q 2
高温热源 T1 Q1 热机 W Q2
V
W Q1 Q2
热机效率
低温热源 T2 高温热源 T1 致冷机
W 1 Q2 Q1 Q1
W Q1 Q2
致冷机致冷系数
W
2. 制冷循环
p a O Q 1 A Q 2
Q1
Q2
V
低温热源 T2
Q2
W
Q2 Q1 Q2
z 2nd
2
分子平均自由程:
z
1 2 2n d
kT 2 d 2 P
处于重力场中的某种气体,在高度Z 处单位体积内的分 子数即分子数密度为 n 。若f(v)是分子的速率分布函 数,则坐标 x ~x + dx 、y ~ y + dy 、z ~ z + dz 介于区间 内,速率介于v ~v + dv 区间内的分子数 dN = ( )
自动传到高温物体而不引起 其中,取“ =”时,对应可逆热机;取“<” 外界的变化。 ( )过程不可逆 时,对应不可逆热机。
5. 可逆过程与不可逆过程 可逆过程:如果逆过程能重复正过程的每 一个状态,而且不引起其他变 化,则该过程称为可逆过程。 可逆过程发生的条件: 不可逆过程:如果逆过程能重复正过程的 (1) 过程为无限缓变过程; 每一个状态,但会引起其他变 (2) 无耗散力作功。 化,则该过程称为不可逆过程。
nf (v ) d v d x d y d z
第二章 热力学基础
一、热力学第一定律
系统对外做功 V 0,W 0 外界对系统做功 V 0,W 0 内能增量 i E RT CV T 2 i 定体摩尔热容 CV R 2 定压摩尔热容 C p CV R
v1 v2
v
dS
v2
o
0
f v dv 1
内的分子数
dS Nf v dv v v dv 区间
v v dv
v
(3).麦氏分布函数
m f 4 2kT
3/2
e
m 2 2 kT
2
fmax
f ( v)
o
最概然速率
vp
v
p
p1T 恒量
p V
P-V图
V
p V
p V
三、循环过程
p a O Q 1 A Q 2
E 0
p
Q1 A a V O Q2 V
正循环: 顺时针
逆循环: 逆时针
W净 Q1 Q2 0
W净 Q2 Q1 0
W净= 曲线所围的面积 Q1 Q2
Qn
1. 热机循环
绝热自由膨胀
(证明其不可逆)
2 5 Vc V0 pb Vc Vb 45 p0V0 45 RT0 2 3 过程 Ⅲ :EIII CV Ta Tc 2 R Ta Tc 3 paVa pcVc 39 p0V0 39 RT0 2
