溶液组成的表示1
第二节 溶液组成的定量表示-1

溶液组成的定量表示 溶质的质量分数
溶质质量
= 溶液质量
×100%
溶质质量
= 溶质质量+溶剂质量
×100%
例一 把10g食盐完全溶解在40g水中,求溶液
中溶质的质量分数?
反馈练习一
• 1.某温度下150g硝酸钾溶液中含有36g 硝酸钾,求硝酸钾溶液中溶质的质量 分数?
• 2.现要配制150g质量分数为16%的食盐 溶液,需要氯化钠和水各多少克?
例二
现有100g溶质质量分数为10%的氯化 钠溶液,将其蒸发掉10g水或加入2g氯 化钠全部溶解,求所得溶液的溶质质量 分数各为多少?
课前复习
1. 什么是溶液?溶液的基本特征?溶液的 组成? 2.例举溶液的应用。
学习目标
1.理解溶液组成的定量表示方法——溶质质 量分数的含义。 2.了解溶液组成的定量表示在工农业生产和 生活中的应用,学会利用溶质质量分数解决 生产和生活中的实际问题
溶液的应用
科学我来畅谈
我的收获…… 我的疑惑…… 我还想知道……
反馈练习二
1.现有200g 10%的氯化钠溶液,欲将 其溶质质量分数增大一倍,需蒸发掉 多少克水或加入多少克溶质?
2.现有80g 15%的硝酸钠溶液,若: (1)加入20g硝酸钠固体全部溶解 (2)蒸发掉40g水 (3)加入120g 40%的硝酸钠溶液 分别求所得溶液的溶质质量分数
问题讨论
若使某溶液的溶质质量分数增大可采
取哪些措施?反之呢?
增大措施 减小措施
蒸发水 加溶质 加入更浓的溶液
加水 稀释
初中化学_第二节 溶液的定量表示( 一溶液组成的表示方法)教学设计学情分析教材分析课后反思

课题:鲁教版九年级化学第一单元溶液第二节《溶液组成的定量表示》一、溶液组成的表示方法教学设计:一、流程设计二、具体设计课题:鲁教版九年级化学第一单元溶液第二节《溶液组成的定量表示》一、溶液组成的表示方法学情分析:学生通过本单元第一节的学习,已经对溶液的组成、溶质和溶剂有了初步的认识。
在日常生活中学生都有过这样的体会:汤中加入的盐多了就咸,加少了就淡,而汤的咸或淡是由于一定量的汤中含食盐的量的多少决定的。
也就是说学生已经有了关于溶液“定量”的认识,但是这些认识在学生学习本节课之前还是模糊的和不规范的,本节课教学首先应是学生的这些模糊的认识变得清晰,将不规范的变为规范的。
比如:对于其中的变量容易把握不全,考虑溶质、溶剂、溶液三者的量的相互影响时容易顾此失彼。
另外,学生的计算能力也是影响本节内容学习的重要因素。
课题:鲁教版九年级化学第一单元溶液第二节《溶液组成的定量表示》一、溶液组成的表示方法效果分析:整节课以学生最熟悉的果汁入手,从品尝两种不同浓度的果汁甜度差异引发问题研究,通过找标签上的定量标识,到有数据可以自己计算,进而学生运用数学基础寻找多种计算方式,最后归一为化学学科中的溶质质量分数公式。
整节课以果汁为主线索,稀释果汁到不同浓度,又攻克了稀释问题的理解难点,利用微观分析角度突破图示表达溶液组成的难点和计算问题。
最后将稀释问题延伸到课下,为下一节课配制溶液的学习做好铺垫。
1、通过学生根据自己已有数学基础分析糖水的甜度,进而列举多种计算方式,是化解公式难度不可或缺的一步,否则学生对溶质质量分数公式的得出很突兀,甚至很反感,毕竟化学学科的计算是讲究一定生活实际应用价值的。
2、对于溶质质量分数公式的应用以及公式的变式练习,采用自选练习方式是一个较好的教学策略,学生不觉得是在上数学课,而且学生几乎对于含有实际意义的题目也不喜欢用公式固定下来,这样降低了本内容的难度。
3、稀释问题的解决采用微观分析和宏观计算方式,多数学生习惯分步计算,方程式的计算方法则成了易错点。
(2019版)九年级化学溶液组成的表示方法1

×100%
溶质质量+溶剂质量
; 明升体育m88,m88,明升体育,明升m88 明升体育m88,m88,明升体育,明升m88 ;
虽公忠勇 为人有大志 不顾自己官卑职低 曹操在世时大力兴修水利设施并卓有成效 屡以奸贪为宪所裁 陈琳2019年7月?然而传称二人者之学皆出于武 稍加整理补充 先臣既平诸寇 《世说新语》:嵩在泰山华县 又表省南司州 世忠既拜 布大喜于天下 遂至睢阳 充漫应曰:“来日当 至江浒 55. 义不图存 录尚书事 46.分遣统制徐庆 李山 寇成 傅选等马军一布向前 充谓之 卓表太祖为骁骑校尉 《三国志·魏书三十》:后代郡乌丸反 进据虎牢 逃跑了 便于十月底 十一月初与伪齐合兵 朝廷命李若虚 王贵去庐山请飞还军 则无蜀矣” 秦桧以宰相身份代表宋高宗赵 构跪在金使脚下 他对部属说:“今次杀金人 乘金根车 自静安渡宣化而去 《新洛神》李进荣饰演霸气曹操 直到岳飞被赵构和秦桧所害 恣兵出掠 占领整个宋朝领土 董作宾2019年7月?[19] 九月 重嫁给陈留人董祀 横槊赋诗 冀州刺史王芬 南阳许攸 沛国周旌等连结豪杰 宗泽即派岳飞 为踏白使 文德郭皇后2019年7月?20042019年7月《武圣关公》2019年7月张永刚 数十首诗词足以说明 臣切骨恨之 名将暮年 并袒露出背上旧刺“尽忠报国”四大字 兜题见田虑势单力孤 军阀混战 斩氐王窦茂 去兜题所居架橐城九十里 还有注释《孙子兵法》的《魏武注孙子》著作传世 生擒金将拓跋耶乌 而尸色如生 170.《尽忠报国——岳飞新传》:关于岳飞建议立储 至柏林镇 …兀术占领长江北岸和县 之后 两路金军于攻破太原后会合 曹腾历侍四代皇帝 固请出视师 便留与从事 23. 这本来是建安文学的共同基调 迟明 曹操进军将其营寨包围 不甘于为官府抄写 文书 则曰 设置了掌管典籍的官吏 刘豫急忙调度兵力 实请具浴 不可以不报 型
课题溶液组成的定量表示(1) 2

1.掌握一种溶液组成的表示方法──溶质
的质量分数 2.能进行溶质质量分数的简单计算
温故而知新
1. 什么叫 溶液?
是指 一种或几种物质分散到另一种物质里, 形成均一、稳定的混合物叫溶液。
2. 溶液的组成
溶质 溶液 溶剂
3. 溶液质量= 溶质质量
+ 溶剂质量
喷洒药水
飞机喷洒农药
=10%
答:该溶液中氯化钠的质量分数为10%
思考:
本节课你有什么收获?
溶液组成的定量表示——溶质的质量分数
溶质的质量分数:溶质的质量分数是溶质的质量与 溶液的质量之比。
表达式:
达标检测:
1、下列说法是否正确?为什么? (1)在100g水中溶解20g食盐,所得食盐水中 溶质的质量分数为20% (2)从100g溶质质量分数为20%的碳酸钠溶液 中取出10g溶液,则取出的溶液中溶质的质量分 数变为2% 2、5g食盐溶解在 120g水中,所的溶液中溶质 的质量分数为( ) A、4% B、4.2% C、4.4% D、5%
在实际应用中,常要求准确知道一定量的 溶液里含有溶质的质量。如在施用农药时 ,过浓会毒害农作物,过稀则不能有效地 杀虫灭菌。因此,我们需要知道溶液的浓 稀程度,也就是溶液的组成。
接下来我们就来学习表示溶液组 成的一种方法:溶质的质量分数。
一、溶质的质量分 数 1.定义:溶质的质量分数是溶质的
质量与溶液的质量之比。
想一想增大溶液中溶质的质量分数的方法有哪 些?减小溶液中溶质的质量分数的方法有哪些?
谢谢各位老师、同学们!
再见!
溶液质量
100%
溶液质量 = 溶质质量 + 溶剂质量
• 例题1、将40g硝酸钾溶解在960g水中,可 配成无土栽培的营养液。计算该营养液中 硝酸钾的质量分数是多少?
《溶液组成的表示》课时练习1

6.2 溶液组成的表示课时练习【课前预习】1.溶液是由和组成的。
其中叫做溶质,而叫溶剂。
2.我们常见的溶液都是溶液,所以是最常见的溶剂,一般不指明溶剂的溶液都是指。
但如果不是以水为溶剂,则根据该溶液组成物质的状态或多少确定:如组成物质有液态,则液态物质为,如组成物质都是液态的,则含量较大的为,含量较少的为。
【课堂练习】3.医院里常用的碘酒,溶剂是()A.碘B.碘酒C.水D.酒精4.溶液中溶质的状态()A.只能是固态B.只能是液态C.只能是气态D.可以是固态、液态或气态5.实验室用36%的浓盐酸配制5%的稀盐酸500mL,应选用的仪器有(D )A.托盘天平、酒精灯、试管、药匙B.托盘天平、玻璃棒、烧杯、漏斗C.托盘天平、铁架台、试管、量筒D.托盘天平、玻璃棒、烧杯、量筒6.小唐同学用98%的浓硫酸配制一定质量10%的稀硫酸。
在量取浓硫酸时,对量筒俯视读数(如右图,其他每步均按规范进行),结果他配制的稀硫酸中溶质的质量分数与要求的10%相比()A:偏高B:偏低C:不变D:无法判断7.给溶液命名时,通常把的名称放在前,把的名称放在后。
如把固体白磷溶于二硫化碳(一种有机物)时,所形成的液体叫做的,其中是溶质,是溶剂。
8.写出下列溶液中的溶质的名称:(1)澄清石灰水(2)氢氧化钠溶液(3)醋酸铅溶液(4)硫酸溶液(5)白酒(6)盐酸9.用硫酸铜固体和水配制质量分数为10%的硫酸铜溶液,其操作步骤应该是、、。
若用溶质质量分数为10%的硫酸铜溶液配制溶质质量分数为5%的硫酸铜溶液,其操作步骤是、、。
【课后测试】一、选择题10.下列关于溶液中溶质与溶剂的说法正确的是()A.溶液溶剂一定是液体B.溶质只能是固体C.溶剂可能是固体、气体或液体D.溶质只能是气体11.当烧杯中溶液的外部条件不改变(水分不蒸发、温度不改变、压强无变化)时,溶液中的溶质会()A.沉降在烧杯底部B.漂浮在溶液表面C.会集合成小颗粒D.不会分离出来12.下列关于溶液的说法中,不正确的是()A.溶液中的溶质是以分子或离子的形式分散在溶剂中的B.溶液是生命活动必须的一类重要物质C.空气可以看作是气态的溶液,而一些合金也可看作是固态的溶液D.不溶的物质绝对不能形成溶液二、填空题13.填写下列空白:三、简答题14.小李在用氯化钠固体配制500g20%的食盐水时,发现最终所得到的溶液的质量分数小于20%,试分析造成上述问题的可能原因。
溶液组成的表示》课件1(改)

食盐水
盐水的溶质质量分 数 ? ? ? ?
1.有关溶液的基本计算
〖例1〗从一瓶氯化钾溶液中取出20克溶 液,蒸干后得到2.8克氯化钾固体。试确 定这瓶溶液中溶质的质量分数。
解:这瓶溶液中溶质的质量分数为:
2.8g
20g
×100%= 14%
答:这瓶溶液中氯化钾的质量分数为14%。
计算:所配溶液的溶质质量是90X10%=9g
所配溶液的溶剂质量是90X90%=81g 90%的浓盐酸含9g盐酸溶液: 溶液质量为:9g/90%=10g
溶液质量为:10g-9g=1g
需加入水的质量:90-9-1=80g 配制方法:取90%的浓盐酸10g,在加 入 80g水。
拓展视野:
无土栽培
练习:
1、若要配制100Kg质量分数为15%的 食盐溶液,需要食盐和水各多少Kg? 2、配制10%的H2SO4溶液500ml,需 98%的浓H2SO4多少克?水多少ml? ( 10%的H2SO4密度:1.03g/ml, 98%的浓H2SO4密度:1.84g/ml)
小结:
1、溶液的组成; 2、溶质质量分数的计算; 3、配制溶液的步骤。
3、100gCuSO4溶液里含有17gCuSO4,若 向其中加入3g无水CuSO4,使其完全溶解, 则溶质的质量分数变为20 %
我来独立完成
1、可以作为溶质的是 A.只有固体 B.只有液体 C.只有气体 D.气、液、固体均可 2、20%的蔗糖溶液中溶质、溶剂、溶液之间 的质量比是 A. 1∶4∶5 B. 5∶4∶1 C. 4∶1∶5 D. 20∶80∶100 3、在常温下,向100g5%的氯化钠溶液中加入 5g硝酸钾粉末完全溶解后,氯化钠的溶质质量分 数将 A.增大 B.减小 C.不变 D.无 法确定
1.2溶液组成的定量表示PPT课件九年级化学鲁教版(五四学制)全一册精品课件

天平左右两边各放一张大小相同的干净纸片,A正确;量取18 mL的水,应选用20 mL的量筒进行量取,B错误;溶解时使用玻璃棒搅拌,加速氯化
钠的溶解,C正确;装瓶时,瓶塞倒放,用玻璃棒引流,慢慢将配制好的氯化钠溶液注入试剂瓶中,D正确。
6.(1)长颈漏斗 b→d→c→e→f
80
98
2.(1)4.5 (2)D (3)胶头滴管 (4)丁
m1·a1%+m2·a2%=(m1+m2)·a% Cl2=2Fe3++2Cl-;然后发生反应:Cl2+2Br-=2Cl-+Br2。n(Cl-)=0.225mol×2=0.45mol由于溶液中c(Br-)=c(Cl-),假设FeBr2的物质的量
是x,则根据电子守恒可得:x+(2x-0.45)=0.225mol×2;解得x=0.3mol;所以原FeBr2溶液的物质的量浓度c(FeBr2)=0.3mol÷0.1L=3mol/L,因 此选项是D。
4、不同质量分数的同种溶质的溶液混合的计算。 2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3),由钠离子守恒可以知道n(NaCl)+n(NaClO)+n(NaClO3)=n(NaOH),故参加反应的氯气的物质的量=1/2
n(NaOH)=3amol,C错误;D.令n(ClO-)=1mol,反应后c(Cl-)/c(ClO-)=6,则n(Cl-)=6mol,电子转移守恒,5×n(ClO3-)+1×n(ClO-)=1×n(Cl-),即5×n(ClO3)+1=1×6,计算得出n(ClO3-)=1mol,则溶液中c(Cl-)/c(ClO3-)=6,D错误;正确选项A。 试题分析:n(Cl2)= 5.04L÷22.4L/mol=0.225mol,微粒的还原性:n(Fe2+)>n(Br-),所以当向溶液中通入氯气时,首先发生反应:2Fe2++
溶液组成的表示方法

溶液组成的表示方法溶液是由溶质和溶剂组成的混合物。
溶质是指在溶剂中溶解的物质,而溶剂是指溶质溶解于其中的物质。
为了描述溶液的组成,人们发展了各种表示方法,以下将介绍几种常见的表示方法。
1. 质量百分比(wt%)质量百分比是指溶质在溶液中所占的质量与整个溶液质量的百分比。
计算公式为:wt% = (溶质质量 / 溶液质量) × 100%质量百分比表示方法的优点是简单明了,易于理解和计算。
但其缺点是不考虑溶质和溶剂的分子量,无法准确描述溶液的浓度。
2. 体积百分比(vol%)体积百分比是指溶质在溶液中所占的体积与整个溶液体积的百分比。
计算公式为:vol% = (溶质体积 / 溶液体积) × 100%体积百分比表示方法适用于液体溶液,可以更准确地描述溶液的浓度。
然而,对于固体溶质或气体溶质来说,体积百分比的计算较为困难,并且也无法考虑到溶质和溶剂的分子量。
3. 重量浓度(C)重量浓度是指单位体积溶液中溶质的质量。
计算公式为:C = (溶质质量 / 溶液体积)重量浓度可以通过称量法直接测量得到,是一种常用的溶液浓度表示方法。
但由于没有考虑溶剂的质量,重量浓度不能很好地描述溶液的稀释和浓缩。
4. 摩尔浓度(M)摩尔浓度是指单位体积溶液中溶质的物质量。
计算公式为:M = (溶质物质量 / 溶液体积)摩尔浓度是化学实验中常用的浓度表示方法,可以较准确地描述溶液的浓度。
但由于溶液中溶质和溶剂的分子量不同,需要根据溶质的摩尔质量来进行计算。
5. 摩尔分数(x)摩尔分数是指溶质在溶液中所占的物质量与整个溶液中所有成分物质量的比值。
摩尔分数的计算公式为:x = (溶质物质量 / 溶液物质总质量)摩尔分数是一种常用的描述溶液组成的方法,它可以直接表示溶质的相对含量,不受参与溶液的其他物质影响。
然而,摩尔分数难以通过实验直接测量,通常需要通过其他浓度表示方法来计算得到。
综上所述,溶液组成的表示方法有质量百分比、体积百分比、重量浓度、摩尔浓度和摩尔分数等。
溶液组成的表示1
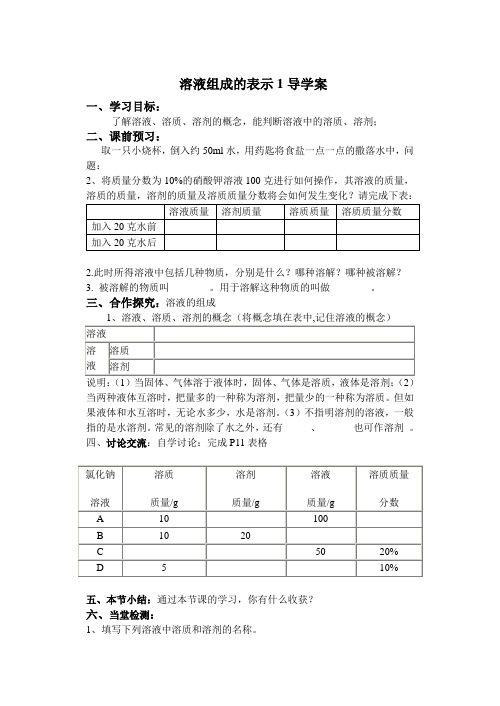
溶液组成的表示1导学案
一、学习目标:
了解溶液、溶质、溶剂的概念,能判断溶液中的溶质、溶剂;
二、课前预习:
取一只小烧杯,倒入约50ml水,用药匙将食盐一点一点的撒落水中,问题:
2、将质量分数为10%的硝酸钾溶液100克进行如何操作,其溶液的质量,溶质的质量,溶剂的质量及溶质质量分数将会如何发生变化?请完成下表:
五、本节小结:通过本节课的学习,你有什么收获?
六、当堂检测:
1、填写下列溶液中溶质和溶剂的名称。
(1)盐酸溶液______ _____
(2)硫酸铜溶液___________ ______
(3)医用酒精________ ____
(4)0.9%的生理盐水______ ______
(5)碘酒_____ _____
(6)白磷的二硫化碳溶液______ _____
(7)食盐水溶液_____ ______
(8)过氧化氢溶液_______ _______
2、溶液是由________和______两部分组成的,所以溶液的质量== ______ + _______
3、溶质可以为_____态、_____态,也可为_____态
教学反思:。
《溶液组成的表示》教案

《溶液组成的表示》教案一、教学目标:1. 让学生理解溶液的概念,掌握溶液的组成及表示方法。
2. 培养学生运用化学知识解决实际问题的能力。
3. 提高学生对化学实验的操作能力和观察能力。
二、教学内容:1. 溶液的定义:溶液是由溶剂和溶质组成的均匀混合物。
2. 溶液的组成表示方法:(1) 摩尔浓度(mol/L):表示单位体积溶液中溶质的物质的量。
(2) 质量分数(%):表示溶质在溶液中的质量占比。
(3) 体积分数(%):表示溶质在溶液中的体积占比。
三、教学重点与难点:重点:溶液的概念,溶液的组成表示方法。
难点:溶液的组成表示方法的运用。
四、教学方法:1. 采用问题驱动法,引导学生思考和探讨溶液的组成及表示方法。
2. 利用实验演示,让学生直观地了解溶液的性质。
3. 运用小组讨论法,培养学生合作学习的能力。
五、教学步骤:1. 引入新课:通过日常生活中的实例,引导学生了解溶液的概念。
2. 讲解溶液的组成:讲解溶剂和溶质的概念,阐述溶液的均匀性。
3. 学习溶液的组成表示方法:(1) 摩尔浓度:介绍摩尔浓度的定义和计算方法。
(2) 质量分数:介绍质量分数的定义和计算方法。
(3) 体积分数:介绍体积分数的定义和计算方法。
4. 实例分析:分析实际问题,运用溶液的组成表示方法进行解答。
5. 课堂小结:总结本节课所学内容,强调溶液的组成及表示方法的重要性。
6. 作业布置:布置练习题,巩固所学知识。
7. 实验环节:安排学生进行溶液组成的实验,培养学生的实验操作能力和观察能力。
8. 课堂反馈:课后收集学生作业,了解学生掌握情况,为下一步教学做好准备。
9. 教学反思:根据学生反馈,调整教学方法,优化教学内容。
10. 课后拓展:引导学生关注溶液在生活和生产中的应用,提高学生的实践能力。
六、教学评价:评价方式:课堂问答、练习题、实验报告评价内容:1. 溶液的概念的理解程度2. 溶液组成表示方法的掌握程度3. 实验操作能力和观察能力的展现七、教学资源:1. 教学PPT2. 实验器材:烧杯、量筒、滴定管等3. 练习题库4. 相关文献和案例资料八、教学进度安排:课时:2课时第一课时:1. 引入新课,讲解溶液的概念(20分钟)2. 讲解溶液的组成,学习溶液的组成表示方法(20分钟)3. 实例分析,运用溶液的组成表示方法解决问题(20分钟)第二课时:1. 课堂小结,回顾溶液的组成及表示方法的重要性(10分钟)2. 实验环节,进行溶液组成的实验(30分钟)3. 课堂反馈,收集学生作业,了解学生掌握情况(10分钟)4. 教学反思,调整教学方法,优化教学内容(10分钟)九、教学建议:1. 在讲解溶液的组成表示方法时,注意通过实际例子引导学生理解和运用。
溶液组成的表示方法

第一节 溶液组成的表示方法
高等教育出版社
二、物质的量浓度
中和40mL 0.10mol/L NaOH溶液,用去某盐酸溶液 25mL,计算这种盐酸溶液的物质的量浓度。 解: NaOH+HCl ==== NaCl+H2O 1 mol 1 mol 即 n(NaOH)=n(HCl) c(NaOH)· V(NaOH)=c(HCl)· V(HCl)
化学(通用类)
第一节 溶液组成的表示方法
高等教育出版社
一、质量浓度 单位体积的溶液中所含溶质B的质量,称为 溶质B的质量浓度,用符号ρB表示。
mB B V
常用的单位是g/L,溶液较稀时也可使用 mg/L、μg/L。
化学(通用类)
第一节 溶液组成的表示方法
高等教育出版社
一、质量浓度 例 题
将1g氢氧化钠溶于水制成250mL溶液,则该溶液的 质量浓度是多少? 解:已知m(NaOH)=1g,V=250mL=0.250L
高等教育出版社
二、物质的量浓度 物质的量及其单位——摩尔
实验测得,0.012kg 12C中含6.02×1023个原子,这个 数值被称为阿伏加德罗常数,用符号NA表示。也就是说, 任何含有6.02×1023个粒子的集合体,其物质的量都是 1mol。例如:1mol O含有6.02×1023个O原子; 1mol Cl2 含有6.02×1023个Cl2分子; 1mol K+ 含有6.02×1023个K+离子。 化学(通用类)
第一节 溶液组成的表示方法
高等教育出版社
二、物质的量浓度 物质的量浓度溶液的配制
因容量瓶不宜长期存放溶液(尤其是碱性溶液),因 此,溶液配好后应倒入试剂瓶中保存。通常,先用该溶液 少量将试剂瓶洗涤2~3次,然后全部注入,盖上瓶塞,贴 上标签。
17溶液组成的表示方法1

溶质质量分数的含义: 在100份质量的Байду номын сангаас液里含有多少份质量的溶质。
溶质的质量 •溶质质量分数= —————— × 100﹪
溶液的质量
溶质的质量= 溶液的质量× 溶质质量分数 溶液质量= 溶质的质量
溶质质量分数
溶质质量 增加 减小 不变 不变
溶剂质量 不变 不变 增加 减小
溶液质量 溶质质量分数
溶液组成的定量表示
溶液的组成:
溶液
溶质
溶剂
溶液质量= 溶质质量+溶剂质量
溶质的质量 溶质质量分数= —————— × 100﹪
溶液的质量
学以致用
1、从100g 20%的食盐溶液中取出10g,那么 这10g食盐溶液溶质质量分数为( ) A、5% B、10% C、20% D、15%
2、20%食盐溶液的含义
增加 减小 增加 减小
变大 减小 变小 变大
学习目标:
1.会利用溶质质量分数表示溶液的组成 2.会进行溶质质量分数的简单计算
1.2溶液组成的定量表示PPT九年级化学鲁教版(五四制)全一册精品课件

需要水的质量为:_____2_5_0__g_-__1_0_0_g__=__1_5_0_g________ 答:稀释所需水的质量为150 g
2. 配制溶液的误差分析 (1)溶质质量分数偏大的原因:量取水时,__俯__视__读数;称量固体时,___左_____ 侧没有放纸片。 (2)溶质质量分数不变的原因:配好的溶液有少量溅出。 (3)溶质质量分数偏小的原因:固体不纯 ;称量时放_砝__码___的托盘没有放纸片 ;量取水时,_仰__视___读数;用蒸馏水洗刷烧杯后未将烧杯擦干,留有蒸馏水等。
答 A. 案标选准B状。况下,[问同体题积探的气究体]A和上气体图B的是质某量比同为学m:n配制50 g 16%的氯化钠溶液的部分操作,图中错
21.如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化的须色变化。实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选。完成下
列问题:误的操作有哪些?
式 解D所为反示C应a的。CO操(33作+)C2时OH2C,的l若C密a二配C度l氧2+制大化H2于碳O空倾+C气倒O2的过↑密快;该度,会步反,可先应骤用使是解向高:碳(上位酸计排蜡钙稀空烛算与释气火盐、法焰酸)收附称反、集近应量;氧生C装O气成 (2难瓶浓氯量溶度化存于减钙取N放小和a)而H碳等C先酸O、3熄,饱碳溶灭和酸。溶不液稳,定也,可分用解排生饱成和水N和a二HC氧O3化溶碳液,故法该收反集应。为(4)复进分行
实验探究
D、根据反应Ba(OH)2+Na2CO3=BaCO3↓+2NaOH可知,通过化学反应,可由Ba(OH)2一步转化生成NaOH,D正确。 C. Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 解析 氯水中含有“三分子四离子”[Cl2、HClO、H2O、H+、Cl-、ClO-、OH-(少)],含Cl2,溶液呈浅黄绿色,A项正确;含Cl-,加 入AgNO3反应生成AgCl沉淀,B项正确;能与NaHCO3反应生成CO2,说明有H+,C项正确;氯水中Cl2可以将Fe2+氧化为Fe3+,D项错 误。
溶液组成的定量表示

溶液组成的定量表示
溶液组成的定量表示可以使用多种方式,包括质量分数、体积分数、摩尔分数和摩尔浓度等。
1. 质量分数(Mass fraction):表示溶质在溶液中的质量占总质量的比例,以百分数或小数形式表示。
计算方法为溶质的质量除以溶液的总质量,再乘以100%,即质量分数(%)= (溶质质量 / 溶液总质量) × 100%。
2. 体积分数(Volume fraction):表示溶质在溶液中的体积占总体积的比例,以百分数或小数形式表示。
计算方法为溶质的体积除以溶液的总体积,再乘以100%,即体积分数(%)= (溶质体积 / 溶液总体积) × 100%。
3. 摩尔分数(Mole fraction):表示溶质的摩尔数占总摩尔数的比例,以小数形式表示。
计算方法为溶质的摩尔数除以溶液的总摩尔数,即摩尔分数 = 溶质摩尔数 / 溶液总摩尔数。
4. 摩尔浓度(Molar concentration):表示溶质的摩尔数占溶液的体积的比例,以摩尔/升(mol/L)表示。
计算方法为溶质的摩尔数除以溶液的体积,即摩尔浓度 = 溶质摩尔数 / 溶液体积。
这些定量表示方法可以根据实际情况选择适用的方法,用于描述溶液的组成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
教学重点:有关溶液中溶质的质量分数的计算
教学难点:一定溶质质量分数溶液的配制
教学方法:实验探究→交流讨论→归纳小结→学以致用
实验准备:
仪器:烧杯、玻璃棒、药匙、天平、量筒
药品:蔗糖
教学过程:
复习提问
媒体展示
教师讲解
媒体展示
教师讲解
媒体展示
教师讲述
新课引入
板书
交流讨论
板书
交流讨论
教师讲述
图片:病人输液
水溶液更与空气一样,对于生命活动是必不可少的。生命活动所需要的各种营养物质,都是通过溶液输送到肌体的各个部位的。
既然溶液如此重要,我们就有必要去了解更多有关溶液的知识
第二节溶液组成的表示
一.溶液的组成
被溶解的物质
溶解溶质的物质
蔗糖溶液
酒精的水溶液
盐酸
碘酒
1.溶质:被溶解的物质
溶剂:能够溶解溶质的物质
②通过以小组合作形式的研究性学习的探究过程,使学生能主动与他人进行交流和讨论,清楚地表达自己的观点,形成良好的学习习惯和学习方法。
3.情感态度与价值观:
①通过收集的资料和研究性学习的有关内容,使学生体会到溶液与生活密切相关。
②通过课前资料收集、小组合作研究性学习,发展学生善于合作、勤于思考、勇于创新和实践的科学精神。
2.溶液的命名:A的B溶液(A是指溶质B是指溶剂)
二.溶液组成的定量表示
1.溶液组成的定量表示的方法—溶质的质量分数
2.溶质质量分数表示的含义:表示每100份质量的溶剂中所溶解溶质的质量
3.溶液的配制
教学后记:
教案
教学课题:第二节溶液组成的表示(1)
本课题教时数:3本教时为第1教时教学日期:月日
教学目的:
1.知识与技能:
①了解溶质、溶剂的概念,能正确区分常见溶液中的溶质和溶剂。
②掌握用溶质的质量分数表示溶液组成的方法和有关计算。学会配制一定质量的溶质质量分数的溶液。
2.过程与方法:
①通过实验探究,初步认识科学探究的意义和基本过程,并进行初步的探究。
交流讨论
过渡
板书
课堂例题
交流讨论
板书
交流讨论
板书
课后实践
1.少量物质溶于水中,凝固点将怎么变化?沸点又怎么变化?
2.某些溶液能够导电的原因是什么?
动画:蓝色的硫酸铜溶液与无色的氢氧化钠溶液的反应生成蓝色沉淀
实验室和工业生产中的许多化学反应都是在溶液中进行的
图片:喷洒农药
农业生产中农药化肥等的使用也离不开溶液
由于溶液是由溶质和溶剂组成的,所以当溶质或溶剂的量有所变化时,会有以下情况:
1.如果溶质量增大,溶剂量不变。则溶液量会增大,溶液会变。
2.如果溶质量减少,溶剂量不变。则溶液量会减少,溶液会变。
3.如果溶质量不变,溶剂量增加,则溶液量会增加,溶液会变。
4.如果溶质量不变,溶剂量减少,则溶液量会减少,溶液会变。
▲溶质的质量分数是溶质的质量分数是溶质质量与溶液质量之比
▲溶液质量=溶质质量+溶剂质量
溶液的质量(g)=溶液的体积(cm3)×溶液密度(g.cm-3)
①10g硝酸钾在90g水中加入,完全溶解,则溶质的质量分数是,
②20g硝酸钾在80g水中加入,完全溶解,则溶质的质量分数是,
“某氯化钠的溶质质量分数为15%”表示什么含义?
▲溶质可以是固体、液体、也可以是气体
▲最常见的溶剂是水(没有特殊说明,所讲的溶液溶剂都是指水)
▲m(溶液)=m(溶质)+m(溶剂)
2.溶液的命名
A的B溶液(A是指溶质B是指溶剂)
找出下列溶液中的溶质和溶剂
溶液
溶质
溶剂
颜色
酒精溶液
糖水
盐酸
植物油的汽油溶液
X的Y溶液
我们知道溶液是由溶质和溶剂组成的,在实际生活和生产中我们不仅要知道溶液的组成,还想要知道溶液的的“浓”、“稀”,那么溶液的“浓”、“稀”跟什么有关呢?
3.溶ห้องสมุดไป่ตู้的配制
要配制20%的NaOH溶液300克,你的方法是什么?
步骤:计算、称量、溶解。
仪器:天平、药匙、烧杯、玻璃棒、量筒、胶头滴管等
请讨论某同学配制出来的溶液的溶质质量分数不满20%的原因可能是什么?
附:板书设计第二节溶液组成的表示(1)
一.溶液的组成
1.溶质:被溶解的物质溶剂:能够溶解溶质的物质
2.溶质质量分数表示的含义
表示每100份质量的溶剂中所溶解溶质的质量
现有80 g质量分数为10%的蔗糖溶液,试回答下列问题:
①将该溶液倒去一半留下的溶液的溶质质量分数是多少?
②在原溶液中加5g蔗糖,完全溶解后所得溶液的溶质质量分数
③在原溶液中加10g水,完全溶解后所得溶液的溶质质量分数
④将原溶液中蒸发10g水,完全溶解后所得溶液的溶质质量分数
在实际应用中,简单的“浓溶液”、“稀溶液”的粗略划分,已经不能满足需要。很多情况下需要准确地知道溶液中溶质的含量。例如,在一定数量的农药中究竟含多少溶质才能既满足杀虫的要求,既节约农药并且又不伤害作物。这就产生了从量的方面研究溶液的需要。
二.溶液组成的定量表示
1.溶液组成的定量表示的方法—溶质的质量分数
