植物化学物综述
翻白草化学成分概述

翻白草化学成分概述作者:孙琛来源:《科技资讯》2015年第10期摘要:翻白草具有比较繁杂的化学成分,其全草都含有鞣质(单宁),黄酮类是它的主要有效成分,此外还含有萜类和甾体类化合物、脂肪酸、酚类化合物和其他化合物,翻白草在全国各地均有分布,有着丰富的药材资源,由于其具有复杂的化学成分,所以它的药理作用和生物活性也很广泛,在未来具有广大的应用前景,本文针对翻白草的化学成分进行了概述。
关键词:翻白草化学成分概述中图分类号:R284 文献标识码:A 文章编号:1672-3791(2015)04(a)-0000-00翻白草(Potentilla discolor Bge.)为蔷薇科(Rosaceae)植物,大多数以全草或根入药,采集于夏季和秋季,生长于北方温带区域[1],存活于坡地、丘陵、荒地、沟边、山野草丛、草地、山谷、草甸及疏林[2],全国各地均有分布,主其具有比较繁杂的化学成分,现将翻白草的化学成分综述如下:1.黄酮类:黄酮类化合物主要存在的两种形式是结合糖苷和游离态,还拥有多种多样的结构类型,具有多种药理及生理活性,比如:以预防和治疗呼吸系统和心血管系统疾病、消炎抗菌、抗氧化、降血糖、抗肿瘤、抗辐射、抗癌、增强免疫力等[3][4]。
黄酮类化合物能够促使胰岛β细胞的恢复,降低血糖和血清胆固醇,改善糖耐量[5],其中含有的主要黄酮类化合物主要有槲皮素(Quercetin)分子式为C15H10O7、槲皮素-3-O-β-D-葡萄糖(quercetin- 3- O-β- D- glucoside)分子式为C21H20O12、槲皮素-7-O-α-L-鼠李糖苷(quercetin-7-O-α-L-rhamnosid)分子式为C21H20O13、槲皮素-3-O-α-D-阿拉伯糖苷(quercetin-3-O-α-D-arabinose)分子式为C20H18O11、槲皮素-3-O-β-D-半乳糖-7-O-β-D-葡萄糖苷(quercetin-3-O-β-Dgalactoside -7-O-β-D-glucoside)分子式为C27H30O17、金丝桃苷(Hyperoside)分子式为C21H20O12、芹菜素(Apigenin)分子式为C15H10O5、木犀草素(luteolin)分子式为C15H10O6、山奈酚(Kaempferol) C15H10O6、山奈酚-3-O-β-D-葡萄糖(kaempferol-3-O-β-D-glucoside)分子式为C21H20O12、山奈酚-7-O-α-L-鼠李糖(kaempferol-7-O-α-L-rhamnoside)分子式为C21H20O12、金合欢素( acacetin)分子式为C17H14O7。
植物化学物的降脂功效

植物化学物的降脂功效代会敏;刘春晓(综述);马洪波(审校)【摘要】目前已有大量文献报道多种植物或其活性成分有降脂作用,但关于它们的概述却鲜有文献报道。
本文综述了具有降脂作用植物化学物,按活性成分分为9类,且简述了每种活性成分的降脂特点,为开发新型降脂药奠定基础。
【期刊名称】《吉林医药学院学报》【年(卷),期】2015(000)005【总页数】5页(P384-388)【关键词】高脂血症;植物;植物化学物;降脂作用【作者】代会敏;刘春晓(综述);马洪波(审校)【作者单位】吉林医药学院公共卫生学院,吉林吉林 132013;吉林医药学院公共卫生学院,吉林吉林 132013;吉林医药学院公共卫生学院,吉林吉林 132013【正文语种】中文【中图分类】R285随着人们生活水平的提高,越来越多的人患有“三高”症状,即高血压、高血脂和高血糖,其中高脂血症容易引发多种疾病,如脂肪肝、肥胖症、高血糖和冠心病等等,严重危害人类身体健康,降低生活质量。
目前临床上用于降脂的多为西药,虽然降脂效果明显,但容易引起不良反应,且复发率较高,只治标不治本。
植物中有些是天然降脂的好材料,效果显著,不良反应较西药显著减少,达到标本兼治的目的。
本文将植物化学物调节高脂血症血脂水平的研究概况综述如下。
1 黄酮类和类黄酮化合物黄酮和类黄酮是自然界植物中广泛存在的化合物,它们的降脂作用主要是通过促进脂质代谢、影响脂质吸收和合成等途径来发挥,这些途径涉及到分子水平的逐级调控机制,包括脂质吸收受体、脂质合成与代谢基因、细胞信号通路和脂质代谢与合成酶等一系列调控机制[1]。
许多研究表明,黄酮类化合物具有抗氧化和降血脂作用。
乌药、潘石榴叶、山楂、荷叶、罗布麻等,都含有黄酮类化合物。
曹宁等提取乌药叶总黄酮,实验发现其能降低模型小鼠血清中的胆固醇(TC)、甘油三酯(TG)和低密度脂蛋白(LDL-C),且有剂量依赖性,即小鼠口服摄入量越多,降脂效果越好,有很好的降脂活性[2]。
紫苜蓿(medicago_sativa)提取物_化学成分

紫苜蓿(medicago sativa)提取物化学成分1. 引言1.1 概述紫苜蓿(Medicago sativa)是一种常见的多年生草本植物,属于豆科植物,被广泛栽培用作饲料和绿肥。
该植物以其高营养价值和多样的药理活性而闻名。
近年来,越来越多的研究关注紫苜蓿提取物的化学成分,并探究其在医药领域中的应用潜力。
1.2 文章结构本文将从引言、紫苜蓿提取物化学成分、紫苜蓿提取物的主要活性成分、紫苜蓿提取物的药理作用研究以及结论和展望等方面对紫苜蓿提取物进行全面阐述。
1.3 目的本文旨在系统地介绍紫苜蓿提取物的化学成分,并总结其主要活性成分及其可能的药理作用研究。
通过对已有文献和研究结果进行综合分析,进一步挖掘紫苜蓿提取物在医药领域中的应用前景,并为相关领域的进一步研究提供理论基础和参考。
以上内容为引言部分的详细清晰撰写。
2. 紫苜蓿提取物化学成分2.1 紫苜蓿概述紫苜蓿(Medicago sativa)是豆科植物的一种,是一种常见的草本植物,广泛分布在全球各地。
紫苜蓿在医药和保健品行业中被广泛应用,并且其提取物已被证明具有多种药理活性。
2.2 提取方法对紫苜蓿进行化学成分分析需要先进行提取。
目前常用的提取方法包括水煎剂法、醇提法或超临界流体萃取等。
其中,水煎剂法在实验室和工业生产中得到广泛应用,因其简单、方便且经济高效。
2.3 化学成分分析通过对紫苜蓿提取物的化学成分进行分析,可以发现其中存在多种活性成分。
已有研究表明,紫苜蓿提取物主要含有多酚类化合物、皂苷类化合物和生物碱类化合物等。
3.1 多酚类化合物多酚类化合物是紫苜蓿提取物中最为丰富的成分之一。
这些化合物常见的包括黄酮类化合物(如大豆苷、根皮素等)、儿茶素和花青素等。
多酚类化合物是具有很强的抗氧化作用的天然物质,可以帮助中和自由基,减少氧化损伤。
3.2 皂苷类化合物紫苜蓿提取物中还含有丰富的皂苷类化合物。
皂苷是一种表面活性剂,在药理学研究中显示出多种生理活性,如抗炎、抗氧化和抗菌作用等。
植物化学物综述

植物化学物综述一、植物化学物概念植物由种类繁多的化学物质组成,根据其代谢产物的产生过程将代谢产物分为初级代谢产物和次级代谢产物。
次级代谢产物是植物的代谢产生的多种低分子量末端产物通过降解或合成长生不再对代谢过程起作用的化合物。
这些产物除个别是维生素的前体物外均为非营养成分,现已将它们统称为植物化学物。
从广义上讲,植物化学物生物进化过程中植物维持其与周围环境互相作用的生物活性分子。
植物次级代谢产物对植物本身而言具有多种功能,如保护其不受杂草、昆虫及微生物侵害,作为植物生长调节剂或形成植物色素,维系植物与其生长环境之间的互相作用等。
从化学结构上讲,这些次级代谢产物种类众多;从数量上讲,与初级代谢产物相比又微乎其微。
然而直到近年来营养科学工作者才开始系统地研究植物中这些生物活性物质对机体健康的促进作用。
植物次级代谢产物对健康具有有益和有害的双重作用。
过去我们认为并一直强调在植物性食品中它们是天然毒物并对人体健康有害,或因限制营养素的利用而被认为是抗营养”物质。
对植物化学物有益作用的认识食欲对农场动物的观察。
大量的流行病学调查结果证明,在蔬菜和水果中含有一些生物活性物质,它们具保护人图和预防诸如心血管疾病和癌症等慢性病的作用,因此又重新引起了营养科学工作者对植物化学物的兴趣。
二、植物化学物的分类和来源植物化学物可按照它们的化学结构或者功能特点进行分类。
(一)类胡萝卜素类胡萝卜素是水果和蔬菜中广泛存在的植物次级代谢产物,它们的主要功能之一是使植物显示出红色或黄色。
通常根据极性基团的存在与否将类胡萝卜素分成无氧和含氧两种类型。
主要有无氧的a-和3■胡萝卜素和番茄红素,有氧的黄体素、玉米黄素和阳-隐黄素。
(二)植物固醇植物固醇主要存在于植物的种子及其油料中,主要有3-谷固醇豆固醇和菜油固醇。
(三)皂甙皂甙是一类具有苦味的化合物,它们可与蛋白质和脂类形成复合物,在豆科植物中皂甙特别丰富。
(四)芥子皂甙戒子皂苷存在于所有十字花科植物中,它们的降解产物具有典型的芥末、辣根和花椰菜的味道。
野生资源植物金荞麦化学成分及活性物质研究综述

野生资源植物金荞麦化学成分及活性物质研究综述
黄仁术;易凡
【期刊名称】《安徽农业科学》
【年(卷),期】2013(41)8
【摘要】野生资源植物金荞麦某些活性物质具有明显的抗菌和抗肿瘤作用.该文对金荞麦的化学成分、抗菌活性物质、抗肿瘤活性物质和活性物质提取分离工艺的研究现状进行了详细综述,并在此基础上对今后的研究方向提出了建议,为金荞麦药效物质的有效开发提供一定思路,也有利于将地方野生资源优势持续、有效地转变为经济优势.
【总页数】3页(P3379-3381)
【作者】黄仁术;易凡
【作者单位】植物细胞工程安徽省工程技术研究中心,安徽六安237012;皖西学院生物与制药工程学院,安徽六安237012;皖西学院生物与制药工程学院,安徽六安237012
【正文语种】中文
【中图分类】S517
【相关文献】
1.金荞麦(-)表儿茶素类活性物质体外抑菌试验
2.秦巴山区资源植物野生金荞麦的引种繁殖和开发前景
3.野生资源植物金荞麦离体快繁技术研究
4.资源植物金荞麦
高类黄酮含量愈伤系的获得及其cDNA文库的构建5.资源植物野生金荞麦的研究进展
因版权原因,仅展示原文概要,查看原文内容请购买。
入侵植物加拿大一枝黄花的化学成分及其生物活性综述

入侵植物加拿大一枝黄花的化学成分及其生物活性综述摘要:加拿大一枝黄花(Solidago canadensis L.)属于菊科外来入侵植物,是一种典型恶性杂草,由于其具有超强的繁殖能力及生存适应能力,对入侵地区生物多样性和生态平衡造成了严重损害。
国内外学者从不同学科角度对加拿大一枝黄花进行了深入研究。
笔者在广泛进行文献检索的基础上,主要对其已报道的化学成分及其生物活性研究概况进行综述,旨在从化学活性物质及其生态功能方面探讨其潜在的化学生态学生物入侵机制,进一步为加拿大一枝黄花的资源开发利用和综合防治提供依据。
关键词:入侵植物;加拿大一枝黄花;化学成分;化感作用;生物活性中图分类号:S184;S451文献标志码:A文章编号:1002-1302(2016)05-0005-05E-mail:michaelsjf@。
加拿大一枝黄花(Solidago canadensis L.)原产于北美地区,是双子叶纲菊目菊科一枝黄花属植物,为多年生草本,以种子和根状茎繁殖。
该物种于1935年作为花卉植物被引入我国,由于其超强的繁殖能力及环境适应性,现已迅速蔓延成恶性杂草,对长三角地区的社会经济、自然生态系统和生物多样性均构成了一定威胁,是一种典型的外来入侵杂草,目前已经被列入中国重要外来有害植物名录[1-2]。
加拿大一枝黄花具有很强的入侵特性,随着其在长江流域的泛滥,有关加拿大一枝黄花的研究增多,但主要集中在危害评估、杂草防治、生物学特性和形态描述、生态学以及综合研究等方面[3-5]。
加拿大一枝黄花在欧洲已有700年的药用历史,用于治疗慢性肾炎、膀胱炎、结石、风湿、糖尿病等疾病,具有抗氧化[6]、抗菌[7-8]等药理作用。
一枝黄花属植物化学成分的系统研究始于20世纪60年代,迄今已发现了多炔、二萜、三萜、三萜皂苷、酚类、植物精油等多种类型的活性成分[9]。
前人对其化学成分的研究主要集中于药理研究,对其在生存环境中的化感活性研究较少,特别是活性成分的生态功能及对其成功入侵的贡献等方面的研究尤为缺乏。
生物碱类植物化学物治疗和预防阿尔茨海默病的研究进展

生物碱类植物化学物治疗和预防阿尔茨海默病的研究进展李宝龙;单毓娟;刘旭;贾博宇;周忠光【摘要】Alzheimer disease (AD) is the most common type of senile dementia, a neurodegenerative disease without effective therapeutic drugs. At present, some phytochemicals with excellent bioactivities in preventing and treating AD have been targeted in the field of new drugs exploitation. This review summarizes the related literatures published recently which mainly show the latest and resegrch progress of a variety of alkaloids such as galanthamine, physostigmine, huperzine, vinca -derived alkaloids, nicotine in the prevention and therapy for AD.%阿尔茨海默病(AD)是最常见的老年痴呆型神经退行性疾病,目前尚无特效药.研究与开发防治阿尔茨海默病的有效植物化学物是当今医药学研究领域的重要课题之一.通过对近年来有代表性的文献进行分析归纳,总结了加兰他敏、毒扁豆碱、石杉碱、长春花属以及烟碱等生物碱类植物化学物治疗和预防阿尔茨海默病的研究进展.【期刊名称】《中医药学报》【年(卷),期】2012(040)003【总页数】3页(P145-147)【关键词】阿尔茨海默病;植物化学物;生物碱【作者】李宝龙;单毓娟;刘旭;贾博宇;周忠光【作者单位】黑龙江中医药大学,黑龙江哈尔滨 150040;哈尔滨工业大学,黑龙江哈尔滨 150090;黑龙江中医药大学,黑龙江哈尔滨 150040;黑龙江中医药大学,黑龙江哈尔滨 150040;黑龙江中医药大学,黑龙江哈尔滨 150040【正文语种】中文【中图分类】R741.05植物化学物(phytochemicals)是植物中存在一类生物活性成分,由种类繁多的化学物质组成。
青蒿素 生物化学-概述说明以及解释

青蒿素生物化学-概述说明以及解释1.引言1.1 概述概述青蒿素是一种来自于青蒿属植物(Artemisia)的天然化合物,被广泛应用于抗疟疾领域。
自从20世纪70年代青蒿素的抗疟活性被发现以来,青蒿素已经成为了目前治疗疟疾的重要药物之一。
青蒿素的独特结构和药理作用使其具有优秀的抗疟效果,特别是对于多药耐药性疟疾的治疗效果显著。
本文将介绍青蒿素的生物化学特性和药理作用,探讨其在抗疟疾领域的重要性,同时对青蒿素近年来的研究进展和未来展望进行分析和归纳。
文章的目的是为读者提供关于青蒿素的全面了解,并展望其在医药领域的应用前景。
在本文的正文部分,我们将先介绍青蒿素的发现与历史背景,包括植物来源的发现和早期研究成果。
然后我们将详细探讨青蒿素的生物化学特性,包括其化学结构和生物合成途径。
接下来,我们将阐述青蒿素的药理作用,包括其抗疟机制和其他可能的药理活性。
通过对这些方面的描述,读者将能够更好地理解青蒿素在抗疟疾领域的重要性。
在结论部分,我们将总结青蒿素在抗疟疾领域的重要性,并展望其未来的研究进展和应用前景。
我们将讨论青蒿素的局限性以及可能的改进途径,以期为疟疾治疗提供更有效的方法。
通过本文的阐述,我们希望能够为读者提供有关青蒿素的全面了解,同时为未来的研究和应用提供指导和启示。
青蒿素作为一种重要的抗疟疾药物,其在临床治疗中的应用前景仍然值得期待。
1.2文章结构文章结构本文主要分为引言、正文和结论三个部分。
引言部分主要对文章进行概述,介绍青蒿素这一主题的背景和意义。
首先,青蒿素作为一种重要的抗疟疾药物,在全球范围内应用广泛,具有极高的疗效和安全性。
其发现和研究不仅对抗击疟疾具有重要意义,也为天然产物药物研究提供了范例。
然后,本文将介绍青蒿素的生物化学特性和药理作用,深入探讨其在抗疟疾领域中的重要性和研究进展。
最后,文章将对青蒿素的未来展望和应用前景进行展望,以期为相关领域的研究和应用提供参考。
正文部分将着重介绍青蒿素的发现与历史背景、生物化学特性和药理作用。
紫苏药理作用及其化学物质基础研究进展

紫苏药理作用及其化学物质基础研究进展一、本文概述紫苏,作为一种传统中药材,自古以来就在我国乃至东亚地区的医药体系中占有重要地位。
近年来,随着现代药理学和化学研究的深入,紫苏的药理作用及其化学物质基础受到了广泛关注。
本文旨在综述紫苏的药理作用研究进展,以及与其药理活性相关的化学物质基础,为紫苏的进一步开发利用提供科学依据。
本文首先对紫苏的化学成分进行了概述,包括挥发油、黄酮类、酚酸类等主要成分,并简要介绍了这些成分的基本性质。
随后,重点综述了紫苏在抗炎、抗氧化、抗肿瘤、心血管保护等方面的药理作用研究进展,以及这些作用与紫苏化学成分之间的关联。
本文还对紫苏的临床应用现状进行了简要概述,以期为未来紫苏的药用价值开发提供参考。
二、紫苏的化学成分紫苏作为一种具有丰富生物活性的药用植物,其化学成分复杂且多样。
近年来,随着现代分析技术的不断发展,人们对紫苏的化学成分有了更深入的了解。
紫苏主要含有挥发油、黄酮类化合物、酚酸类化合物、矿物质及微量元素等多种化学成分。
挥发油:紫苏的挥发油是其最具代表性的化学成分之一,主要包括紫苏醇、紫苏醛、紫苏酮等。
这些化合物赋予了紫苏特有的香气和风味,并在其药理作用中发挥重要作用,如抗炎、抗氧化、抗菌等。
黄酮类化合物:黄酮类化合物是紫苏中一类重要的活性成分,如木犀草素、芹菜素等。
这类化合物具有较强的抗氧化性能,可以清除自由基,保护细胞免受氧化损伤,同时还具有抗炎、抗肿瘤等药理作用。
酚酸类化合物:紫苏中还含有多种酚酸类化合物,如咖啡酸、迷迭香酸等。
这些化合物同样具有抗氧化、抗炎等作用,为紫苏的药理活性提供了物质基础。
矿物质及微量元素:紫苏还含有丰富的矿物质和微量元素,如钙、铁、锌等。
这些成分对维持人体正常生理功能具有重要作用,同时也参与了紫苏药理作用的发挥。
紫苏的化学成分复杂多样,这些成分共同构成了紫苏独特的药理作用基础。
未来随着研究的深入,紫苏的化学成分及其药理作用将得到更全面的揭示,为紫苏的开发利用提供更有力的科学依据。
瑞香属植物化学成分的研究综述(Ⅰ)

瑞香属植物化学成分的研究综述(Ⅰ)朱慧贤*(玉溪师范学院资源环境学院云南玉溪 653100)摘要:本文对瑞香属植物香豆素、木脂素和二萜原酸酯类化学成分及其生物活性进行了研究。
关键词:瑞香属;化学成分;生物活性中图分类号:R284.1 文献标识码:A 文章编号:CHEMICAL STUDY ON DAPHNE (THYMELAEACEAE) (Ⅰ)Zhu Huixian(Department of Chemistry, Yuxi Teacher’s Colle ge, Yuxi 653100) Abstract: Constituents (coumarins, lignans and diterpene orthoesters) from Daphne genus and their bioactivities were reviewed.Key words: Daphne; constituents; bioactivity瑞香属(Daphne)植物约70种,分布于欧洲、北非和亚洲温带和亚热带地区至大洋洲,我国有35种,大部分产于西南部和西北部,他处少见,有些种类的韧皮纤维为制纸原料,有些供观赏[1]。
瑞香属的主要化学成分为香豆素类、木脂素类、萜类、黄酮类化合物,大多具有较显著的生理活性,如抗生育、抗白血病、镇静、镇痛及镇咳祛痰等作用[2],因而对该属植物的化学成分和药理作用方面的研究受到各国学者的瞩目。
本文就该属的香豆素类、木脂素类、二萜原酸酯类化学成分和生物活性进行了综述。
1 香豆素类化学成分及其生物活性香豆素类化合物是瑞香属植物中发现最早且分布最普遍的一类有生物活性的化合物,目前已知的有20多种。
该属中的香豆素按结构可分为以下5类:单香豆素、双香豆素、三香豆素、香豆木脂素和香豆素甙(表1)。
瑞香素(daphnetin)具有镇痛、镇静、抗菌、抗炎、抗缺氧、麻醉、抗血栓等作用[3]。
瑞香素的免疫药理学和组织代谢方面亦有研究。
杜鹃花属植物化学成分及生物活性研究进展

杜鹃花属植物化学成分及生物活性研究进展本文对近20年来国内外杜鹃花属植物化学成分及生物活性研究现状进行综述。
杜鹃花属植物主要含有木藜芦烷类及其相关二萜和黄酮类成分,这些化学成分具有降压、杀虫、镇痛、保护心肌、抗HIV等作用。
标签:杜鹃花属;木藜芦烷型二萜;黄酮;化学成分;生物活性杜鹃花科(Ericaceae)植物在全世界约有70属,分布广泛,主要分布在亚热带地区;我国有20属,约800余种,分布于全国,以西南地区最多。
其中杜鹃花属(Rhododendron)是杜鹃花科中最大的一个属,全世界约960种,我国约542种(不包括种下等级),除新疆、宁夏外,各地均有分布,但80%以上的种类集中分布在西藏东南、云南西北、四川西南,是世界杜鹃花属植物的主要分布中心。
杜鹃花属植物或具有较高的欣赏价值,或有很高的药用价值,具有广阔的开发应用前景,已引起国内外的重视。
杜鹃花属植物主要含有木藜芦型及其相关的二萜,此外还含有黄酮、三萜及其苷、酚类、鞣质、挥发油等多种化学物质,许多成分有药用价值,有止咳、祛痰、平喘、降压、降胆固醇、利尿、抗菌等多方面的用途,还可用于治疗心血管病和风湿等。
杜鹃花科植物的毒性早就引起了人们的注意,明代的《本草纲目》记载了羊踯躅(又名黄杜鹃)(R.moll G.Don)的毒性:“花、根、叶有大毒。
羊食其叶,踯躅而死,曾有人以其根入酒饮,遂至于毙也。
”经国内外学者对杜鹃花科植物的研究,在上世纪80年代就确定了该科植物的有毒成分主要为木藜芦烷类二萜。
国内外学者对杜鹃花属药用植物的化学成分及生物活性进行了一系列的研究,取得了一定的进展,本文拟对此进行综述,为进一步开发利用杜鹃花属植物资源提供一定的依据。
1、化学成分1.1二萜类化合物从杜鹃花属植物中分离得到的二萜化合物根据化学结构的不同可分为4种骨架类型:木藜芦烷型,leueothane,1,5一开环一木藜芦烷型和山月桂烷型。
木藜芦烷型二萜为多羟基四环二萜,拥有较为特异的A环缩环B环扩环的对映贝壳杉烷类骨架,是由C5—C7—C6—C5四环骈合而成,大部分的此类二萜环的连接方式为trans/eis/cis(H-1处于a位,A,B环反式稠合),少量的连接方式为eis/cis/cis(A,B环顺式稠合);由木藜芦烷型二萜为基本骨架变化而来的leucothane为多羟基四环二萜,拥有A环扩环,B环缩环的木藜芦烷型骨架(A-homo-B-nor granyanane skeleton,6/6/6/5ring system);1,5一开环一木藜芦烷型二萜为多羟基三环二萜,拥有1,5开环的十元环的木藜芦烷型骨架(10/6/5 ringsystem);山月桂烷型二萜为多羟基四环二萜,拥有B环扩环,C环缩环的木藜芦烷型骨架(5/8/5/5 ring system)[4]。
百合的化学成分及应用研究进展

百合的化学成分及应用研究进展
张建;黄一承;马艳丽;李晓磊;李丹
【期刊名称】《农业与技术》
【年(卷),期】2022(42)8
【摘要】百合属植物资源丰富,广泛分布于北半球温带区域,因其兼具食用和药用价值,近年来成为研究热点。
目前关于百合属植物的研究主要集中在观赏品种的开发
与化学成分的验证生物活性阶段,对其中功能性成分的分离以及相关产品的研发有
待加强力度深入研发。
本文综述了百合属植物的甾体皂苷、酚类、多糖和生物碱等成分的生物功能,揭示了百合在中医学上的部分医疗作用原理。
对百合在食药等方
面的加工进行了阐述,并展望了未来的研究方向,以期对百合的产业发展有促进作用。
【总页数】4页(P5-8)
【作者】张建;黄一承;马艳丽;李晓磊;李丹
【作者单位】长春大学农产品加工吉林省普通高等学校重点实验室;长春大学园林
学院
【正文语种】中文
【中图分类】S-3
【相关文献】
1.百合属植物化学成分及其生物活性的研究进展
2.百合化学成分及其提取方法研究进展
3.生物炭在缓解兰州百合连作障碍中的应用研究进展
4.卷丹和百合化学成分
与提取方法研究进展
因版权原因,仅展示原文概要,查看原文内容请购买。
党参属植物化学物、生物活性及质量控制综述(2015年英文文献)

REVIEWThe genus Codonopsis (Campanulaceae):a review of phytochemistry,bioactivity and quality controlJing-Yu He •Na Ma •Shu Zhu •Katsuko Komatsu •Zhi-Yuan Li •Wei-Ming FuReceived:7May 2014/Accepted:18July 2014/Published online:7August 2014ÓThe Japanese Society of Pharmacognosy and Springer Japan 2014Abstract Codonopsis ,in the family Campanulaceae,is a genus containing 42species of dicotyledonous herbaceous perennial plants,predominantly found in Central,East and South Asia.Several Codonopsis species are widely used in traditional medicine and are considered to have multiple medicinal properties.Among the Codonopsis species,Codonopsis pilosula (Franch.)Nannf.and nceolata (Sieb.et Zucc.)Benth.&Hook.f.ex Trautv.are more popular than others according to the findings,especially phytochemical and bioactive studies.Phytochemical research shows that Codonopsis species contain mainly polyacetylenes,phenylpropanoids,alkaloids,triterpenoids and polysaccharides,which contribute to multiple bioac-tivities.However,the mechanisms of their bioactivities need to be further elucidated.The less popular Codonopsis species remain to be studied and exploited.In addition,although a series of methods for the quality evaluation of Codonopsis species have been developed,a feasible and reliable approach to the efficacious and safe use of various Codonopsis species is still needed,with considering botanical origin,chemical constituents and bioactive effects.This review aims to provide up-to-date and com-prehensive information on the phytochemistry,bioactivity and quality control of medicinal plants in the genus Codonopsis and to highlight current gaps in knowledge,which is useful for the wider development of the Codon-opsis genus.Keywords Codonopsis ÁPhytochemistry ÁBioactivity ÁQuality controlIntroductionCodonopsis ,which is a dicotyledonous genus of herba-ceous perennial plants in the family Campanulaceae,has 42species predominantly distributed in Central,East and South Asia;40Codonopsis species can be found in China [1].However,Codonopsis pilosula (Franch.)Nannf.,C.pilosula Nannf.var.modesta (Nannf.)L. D.Shen, C.tangshen Oliv.and nceolata (Sieb.et Zucc.)Benth.&Hook.f.ex Trautv.are the only species widely used,of which the fresh or dried roots are collectively regarded as famous herbal medicines and have been used in folk medicine for hundreds of years.Codonopsis Radix is pre-scribed as the dried roots of C.pilosula ,C.pilosula var.modesta and C.tangshen in the Chinese Pharmacopoeia (2010edition)[2].It is called ‘‘Dangshen’’in Chinese and ‘‘Tojin’’in Japanese,and has been used in traditional Chinese medicine for replenishing qi (vital energy)defi-ciency,strengthening the immune system,improving poor gastrointestinal function,gastric ulcer and appetite,decreasing blood pressure,etc.,and is sometimes used as a substitute for Ginseng (Panax ginseng C.A.Mey.)[3,4].The roots of other Codonopsis species,including C.tu-bulosa ,C.subglobosa ,C.clematidea and nceolata ,are reported to be used as substitutes for Codonopsis Radix in some regions [3]. nceolata ,commonly called bonnet bellflower,is a herb with high value in traditional Chinese medicine and its root is also becoming popular as aJ.-Y.He ÁN.Ma ÁZ.-Y.Li ÁW.-M.Fu (&)Guangzhou Institute of Advanced Technology,Chinese Academy of Sciences,1121Haibin Rd.,Nansha Dist.,511-458Guangzhou,People’s Republic of China e-mail:wm.fu@S.Zhu ÁK.KomatsuDivision of Pharmacognosy,Department of MedicinalResources,Institute of Natural Medicine,University of Toyama,2630Sugitani,Toyama 930-0194,JapanJ Nat Med (2015)69:1–21DOI10.1007/s11418-014-0861-9special vegetable in some Asian countries[5]nceo-lata has been used for the treatment of bronchitis,asthma, cough,tuberculosis,dyspepsia and psychoneurosis[6–8]. Phytochemical researches have revealed that the roots of Codonopsis species contained alkaloids,phenylpropanoids, triterpenoids,polyacetylenes,flavones,organic acid,poly-saccharides,etc.[9–54].Among them,polyacetylenes, phenylpropanoids,alkaloids,triterpenoids and polysac-charides are considered to be the major constituents and responsible for most of the activities found in the plants of this genus.The chemical profile varied greatly between species and sample collections may cause these Codon-opsis species to possess diverse bioactivities.Some com-pounds belonging to thesefive chemotypes have been evaluated for potential biological activity and pharmaco-logical mechanisms.However,the pharmacological mechanisms of these Codonopsis species related to bio-logical activity and clinical application remain largely unexplained.Additionally,the toxicity of Codonopsis has not been reported in the scientific literature.As many investigations indicated that a variety of chemical constituents contributed to the effects of Codon-opsis species,the quantitation of bioactive components becomes urgent for ensuring the efficacy of Codonopsis species.In the Chinese Pharmacopoeia(2010edition),only lobetyolin is used as the chemical marker for identification of Codonopsis Radix,which seems useless for many Codonopsis species involved[2].Hence,a number of studies have attempted to develop accurate,sensitive and selective analytical methods for qualitative and quantitative evaluation of Codonopsis materials.To provide information benefiting traditional uses and scientific studies,this review summarizes and evaluates the available phytochemical and bioactive properties of Codonopsis genus reported by the literature.In addition, for the efficacious and safe uses of Codonopsis,the pro-gress of research on quality evaluation of various Codon-opsis species is also presented.Chemical constituents of genus Codonopsis Phytochemical studies have been performed on Codonopsis species plants over the last30years all around the world. Only some of the different Codonopsis species plants have been explored for obtaining information on chemo-taxo-nomical identification,isolation and identification of vari-ous important chemicals from this genus and comparison of the chemicals in different plants or species.C.pilosula,C.tangshen,nceolata and C.clemati-dea have been widely investigated in their phytochemistry; more than100compounds have thereby been isolated and identified.On the other hand,few compounds in C.cordifolioidea,C.nervosa,C.thalictrifolia,C.xundian-ensis and C.tubulosa are reported because they are found only in selected regions.The components in other Codonopsis species have not yet been reported since these Codonopsis species may be difficult to collect and/or be scarce.To date,polyacetylenes,phenylpropanoids,alka-loids,triterpenoids,etc.have been isolated and character-ized from the different parts of these Codonopsis species plants.The names of these constituents,the plant and the parts from which they are derived are summarized in Table1.The structures of the compounds are shown in Figs.1,2,3,4,5,6and7.AlkaloidsThe pyrrolidine alkaloids codonopsine(1),codonopsinine (2),codonopsinol(3)and radicamine A(4)were isolated from the aerial parts of C.clematidea[9,10].Two pyr-rolidine alkaloids,codonopyrrolidiums A(5)and B(6), were isolated from the roots of C.tangshen[13],and were also found in the roots of C.pilosula and C.pilosula var. modesta[12,14].In addition,the pyrrolidine alkaloids codonopsinols A(7),B(8),C(9)and the glycoside,cod-onopiloside A(10)were obtained from the roots of C. pilosula[11].Codotubulosine B(11)was found in the roots of C.tubulosa[15].Other alkaloids,n-9-formyl harman(12),norharman (13),1-carbomethyl carboline(14),1,2,3,4-tetrahydro-b-carboline-3-carboxylic acid(15)and tryptophan(16),were isolated from the roots of nceolata[16,17,19]. Tryptophan(16),perlolyrine(17)and nicotinic acid(18) were obtained from the roots of C.pilosula[18,20,21]. The common compounds uracil(19)and adenosine(20) were found in the roots of C.pilosula and the roots of C. pilosula and C.tangshen,respectively[13,18,22]. PhenylpropanoidsThe phenylpropanoids tangshenosides I(21),II(22),III (23)and IV(24)werefirst isolated from C.tangshen[23, 25].Tangshenoside V(25),tangshenoside VI(26)and codonosides A(27)and B(28),considered to be the characteristic components,were isolated from C.tangshen [13,26].Tangshenoside VI(26)was also isolated from the aerial parts of C.nervosa[27].Recently,tangshenoside VIII(29)has been obtained from the roots of nceolata [24].In addition,12phenylpropanoids,cordifoliketones A (30)and B(31),sinapinaldehyde(32),coniferaldehyde (33),coniferoside(34),isoconiferin(35),nervolans B(36) and C(37),dillapiole(38),1-allyl-2,6-dimethoxy-3,4-methylenedioxybenzene(39),4-allyl-2-(3-methylbut-2-en-1-yl)phenol(40)and sachaliside(41),were isolated from the roots of C.cordifolioidea[28,29].Syringin(42)has been commonly found in5Codonopsis species[21,23,30–32].TriterpenesThree new triterpenyl esters,codonopilates A(43),B(44) and C(45),together with seven known triterpenoids, 24-methylenecycloartanyl linolate(46),24-methylene-cycloartan-3-ol(47),friedelin(48),1-friedelen-3-one(49), stigmast-7-en-3-one(50),taraxerol(51)and stigmast-7-en-3-ol(52),were isolated from the CHCl3-soluble fraction of the methanol extract of C.pilosula[14].Additionally,a-spinasterol(53)was obtained from C.pilosula,C.tang-shen,nceolata and C.thalictrifolia[32–35],and tar-axeryl acetate(54)was obtained from C.pilosula, C. tangshen and C.clematidea[10,34,35].The oleanan-type bisdesmoside with sugars at C-3and C-28,codonolaside (55),codonolasides I(56),II(57)and III(58),and their prosapogenins,eclalbasaponin XIII(59)and echinocystic acid3-O-b-D-glucuronopyranoside(60),were isolated from the roots of nceolata[36].The triterpene saponins, lancemasides A(61),B(62),C(63),D(64),E(65),F(66) and G(67),have also been isolated from the roots of C. lanceolata cultivated in Korea[19].Codonolaside IV(68), codonolaside V(69),foetidissimoside A(70),aster saponin Hb(71),oleanolic acid(72),echinocystic acid(73)and stigmasterol(74)were found in the roots of nceolata [19,30,34,37–39].Foetidissimoside A(70)and rubiprasin B(75)were isolated from the aerial parts of C.clematidea [10].For the aerial parts of C.thalictrifolia,isolation of a-spinasterol(53)and b-amyrin acetate(76)was reported [32].Zeorin(77)and lupeol(78)were isolated from the whole plants of C.nervosa[40].PolyacetylenesIsolation and identification of lobetyolin(79),lobetyolinin (80)and lobetyol(81)from the roots and aerial parts of plants belonging to the genus Codonopsis have also been reported[10,12,18,25,27,29,32,34,41,42].Three new polyacetylene glucosides,cordifolioidynes A(82),B(83) and C(84),were isolated from a95%ethanol extract of the roots of C.cordifolioidea[29].Recently,cordifoli-oidynes B(83)has also been found in C.pilosula,C. pilosula var.modesta and C.tangshen,which are the botanical sources of Codonopsis Radix[12].FlavonesChrysoeriol(85),tricin(86),wogonin(87)and luteolin (88)were isolated from the roots of C.xundianensis Wang ZT and Xu GJ,which grows in Yunnan Province,China [43].Luteolin(88),kaempferol(89),luteolin-5-O-b-D-glucopyranoside(90),luteolin-7-O-b-D-gentiobioside(91), apigenin-7-O-b-D-glucopyranoside(92)and luteolin-7-O-Table1Compounds in Codonopsis speciespound names Species Part of the plant ReferencesAlkaloids1Codonopsine C.clematidea Aerial parts[9]2Codonopsinine C.clematidea Aerial parts[9]3Codonopsinol C.clematidea Aerial parts[10]4Radicamine A C.pilosula Roots[11]C.clematidea Aerial parts[10]5Codonopyrrolidium A C.pilosula Roots[12]C.pilosula var.Roots[12]modestaC.tangshen Roots[13]6Codonopyrrolidium B C.pilosula Roots[14]C.pilosula var.Roots[12]modestaC.tangshen Roots[13]7Codonopsinol A C.pilosula Roots[11]8Codonopsinol B C.pilosula Roots[11]9Codonopsinol C C.pilosula Roots[11]10Codonopiloside A C.pilosula Roots[11]11Codotubulosine B C.tubulosa Roots[15]12n-9-Formyl harman nceolata Roots[16]13Norharman nceolata Roots[16]141-Carbomethyl carboline nceolata Roots[16] 151,2,3,4-Tetrahydro-b-carboline-3-carboxylic acid nceolata Roots[17]16Tryptophan C.pilosula Roots[18]nceolata Roots[19]17Perlolyrine C.pilosula Roots[20]18Nicotinic acid C.pilosula Roots[21]19Uracil C.pilosula Roots[18]20Adenosine C.pilosula Roots[22]C.tangshen Roots[13]Phenylpropanoids21Tangshenoside I C.pilosula Roots[12]Roots[12]C.pilosula var.modestaC.tangshen Roots[23]nceolata Roots[24]22Tangshenoside II C.tangshen Roots[23]nceolata Roots[24]23Tangshenoside III C.tangshen Roots[25]nceolata Roots[24]24Tangshenoside IV C.tangshen Roots[25]nceolata Roots[24]25Tangshenoside V C.tangshen Roots[26]26Tangshenoside VI C.tangshen Roots[26]C.nervosa Aerial parts[27]27Codonoside A C.tangshen Roots[13]28Codonoside B C.tangshen Roots[13]29Tangshenoside VIII nceolata Roots[24]30Cordifoliketone A C.cordifolioidea Roots[28]31Cordifoliketone B C.cordifolioidea Roots[28] 32Coniferaldehyde C.cordifolioidea Roots[29] 33Sinapinaldehyde C.cordifolioidea Roots[29] 34Coniferoside C.cordifolioidea Roots[29] 35Isoconiferin C.cordifolioidea Roots[29] 36Nervolan B C.cordifolioidea Roots[28] 37Nervolan C C.cordifolioidea Roots[28] 38Dillapiole C.cordifolioidea Roots[28] 391-Allyl-2,6-dimethoxy-3,4-methylenedioxybenzene C.cordifolioidea Roots[28] 404-Allyl-2-(3-methylbut-2-en-1-yl)phenol C.cordifolioidea Roots[28] 41Sachaliside C.cordifolioidea Roots[29] 42Syringin C.pilosula Roots[21]C.tangshen Roots[23]nceolata Roots[30]C.nervosa Aerial parts[31]C.thalictrifolia Aerial parts[32]Triterpenes43Codonopilate A C.pilosula Roots[14] 44Codonopilate B C.pilosula Roots[14] 45Codonopilate C C.pilosula Roots[14] 4624-Methylenecycloartanyl linolate C.pilosula Roots[14] 4724-Methylenecycloartan-3-ol C.pilosula Roots[14] 48Friedelin C.pilosula Roots[14]C.tangshen Roots[12]nceolata Roots[33] 491-Friedelen-3-one C.pilosula Roots[14] 50Stigmast-7-en-3-one C.pilosula Roots[14] 51Taraxerol C.pilosula Roots[14]C.tangshen Roots[34] 52Stigmast-7-en-3-ol C.pilosula Roots[14] 53a-Spinasterol C.pilosula Roots[35]C.tangshen Roots[34]nceolata Roots[33]C.thalictrifolia Aerial parts[32] 54Taraxeryl acetate C.pilosula Roots[35]C.tangshen Roots[34]C.clematidea Aerial parts[10] 55Codonolaside nceolata Roots[36] 56Codonolaside I nceolata Roots[36] 57Codonolaside II nceolata Roots[36] 58Codonolaside III nceolata Roots[36] 59Eclalbasaponin XIII nceolata Roots[36] 60Echinocystic acid-3-O-(60-O-methyl)-b-D-glucuronopyranoside nceolata Roots[36] 61Lancemaside A nceolata Roots[19] 62Lancemaside B nceolata Roots[19] 63Lancemaside C nceolata Roots[19] 64Lancemaside D nceolata Roots[19] 65Lancemaside E nceolata Roots[19]66Lancemaside F nceolata Roots[19] 67Lancemaside G nceolata Roots[19] 68Codonolaside IV nceolata Roots[37] 69Codonolaside V nceolata Roots[38] 70Foetidissimoside A nceolata Roots[19]C.clematidea Aerial parts[10] 71Aster saponin Hb nceolata Roots[39] 72Oleanolic acid nceolata Roots[30] 73Echinocystic acid nceolata Roots[30] 74Stigmasterol C.tangshen Roots[34]nceolata Roots[33] 75Rubiprasin B C.clematidea Aerial parts[10] 76b-Amyrin acetate C.thalictrifolia Aerial parts[32] 77Zeorin C.nervosa Whole plants[40] 78Lupeol C.nervosa Whole plants[40] Polyacetylenes79Lobetyolin Codonopsis pilosula Roots[18]Roots[12]C.pilosula var.modestaC.tangshen Roots[25]nceolata Roots[41]C.clematidea Aerial parts[10]C.cordifolioidea Roots[29]C.nervosa Whole plants[27]C.thalictrifolia Aerial parts[32] 80Lobetyolinin C.pilosula Roots[18]Roots[12]C.pilosula var.modestaC.tangshen Roots[12]C.clematidea Aerial parts[10] 81Lobetyol C.pilosula Roots[42]Roots[12]C.pilosula var.modestaC.tangshen Roots[34]C.cordifolioidea Roots[29] 82Cordifolioidyne A C.cordifolioidea Roots[29] 83Cordifolioidyne B C.pilosula Roots[12]Roots[12]C.pilosula var.modestaC.tangshen Roots[12]C.cordifolioidea Roots[29] 84Cordifolioidyne C C.cordifolioidea Roots[29] Flavones85Chrysoeriol C.xundianensis Roots[43] 86Tricin C.xundianensis Roots[43] 87Wogonin C.xundianensis Roots[43]88Luteolin C.nervosa Whole plants[40]C.thalictrifolia Aerial parts[32]C.clematidea Aerial parts[10]C.xundianensis Roots[43] 89Kaempferol C.nervosa Whole plants[40] 90Luteolin-5-O-b-D-glucopyranoside C.nervosa Aerial parts[27]C.thalictrifolia Aerial parts[32] 91Luteolin-7-O-b-D-gentiobioside C.nervosa Aerial parts[27]C.thalictrifolia Aerial parts[32] 92Apigenin-7-O-b-D-glucopyranoside C.nervosa Aerial parts[31]93Luteolin-7-O-b-D-glucopyranosyl(1?6)-[(6000-O-caffeoyl)]-b-D-glucopyranoside C.nervosa Whole plants[40] C.clematidea Aerial parts[10]94Hesperidin C.pilosula Roots[35] Organic acids95Succinic acid C.pilosula Roots[44]C.nervosa Aerial parts[31] 963-O-caffeoylquinic acid C.nervosa Aerial parts[31]C.thalictrifolia Aerial parts[32] 975-O-caffeoylquinic acid C.nervosa Aerial parts[31] 984-(b-D-Glucopyranosyl)-benzoic acid C.nervosa Aerial parts[31] 99Caffeic acid C.thalictrifolia Aerial parts[32] 100Linoleic acid C.thalictrifolia Aerial parts[32] 1019,10,13-Trihydroxy-(E)-octadec-11-enoic acid C.pilosula Roots[35] 102Shikimic acid nceolata Roots[33] 103Vanillic acid C.tangshen Roots[34] Other compounds104Atractylenolide III C.pilosula Roots[21] 1055-Hydroxymethyl-2-furaldehyde C.pilosula Roots[14]C.tangshen Roots[34] 106Angelicin C.pilosula Roots[44] 107Psoralen C.pilosula Roots[44] 108Emodin C.pilosula Roots[18] 109Geniposide C.pilosula Roots[17] 110Hexyl-b-D-glucopyranoside C.pilosula Roots[18] 111Butyl-b-D-fructournanoside C.pilosula Roots[18] 112b-Sitosterol C.pilosula Roots[35]C.nervosa Whole plants[40] 113b-Daucosterol C.pilosula Roots[35] 114Hexyl-b-gentiobioside C.tangshen Roots[25] 115Hexyl-b-sophoroside C.tangshen Roots[25] 116(E)-2-hexenyl-b-sophoroside C.tangshen Roots[25] 117(E)-2-hexenyl-a-L-arabinopyranosyl(1?6)-b-D-glucopyranoside C.tangshen Roots[25]C.clematidea Aerial parts[10] 118Cordifoliflavane A C.cordifolioidea Roots[45] 119Cordifoliflavane B C.cordifolioidea Roots[45] 120Lanceolune A nceolata Roots[46] 121Lanceolune B nceolata Roots[46] 122Lanceolune C nceolata Roots[46]b-D-glucopyranosyl(1?6)-[(6000-O-caffeoyl)]-b-D-gluco-pyranoside(93)were obtained from C.nervosa[27,31,40],and luteolin(88),luteolin-5-O-b-D-glucopyranoside(90)and luteolin-7-O-b-D-gentiobioside(91)were alsofound in the aerial parts of C.thalictrifolia[32].In addi-tion,luteolin(88)and luteolin-7-O-b-D-glucopyrano-syl(1?6)-[(6000-O-caffeoyl)]-b-D-glucopyranoside(93)were isolated from the aerial parts of C.clematidea[10].Hesperidin(94)was only isolated from the roots of C.pilosula[35].Organic acidsTo date,succinic acid(95),3-O-caffeoylquinic acid(96),5-O-caffeoylquinic acid(97)and4-(b-D-glucopyranosyl)-benzoic acid(98)have been found in C.nervosa[31].Caffeic acid(99),linoleic acid(100)and3-O-caffeoyl-quinic acid(96)were isolated from C.thalictrifolia[32].Succinic acid(95)and9,10,13-trihydroxy-(E)-octadec-11-enoic acid(101)were isolated from C.pilosula[35,44].Shikimic acid(102)and vanillic acid(103)were onlyobtained from the roots of nceolata and C.tangshen,respectively[33,34].Other compoundsAtractylenolide III(104),5-hydroxymethyl-2-furaldehyde(105),angelicin(106),psoralen(107),emodin(108),ge-niposide(109),hexyl-b-D-glucopyranoside(110),butyl-b-D-fructournanoside(111),b-sitosterol(112)and b-dau-costerol(113)were isolated from the roots of C.pilosula[14,17,18,21,35,44].Hexyl-b-gentiobioside(114),hexyl-b-sophoroside(115),(E)-2-hexenyl-b-sophoroside(116),(E)-2-hexenyl-a-L-arabinopyranosyl(1?6)-b-D-glucopyranoside(117)and5-hydroxymethyl-2-fur-aldehyde(105)were isolated from the roots of C.tangshen[25,34].Cordifoliflavanes A(118)and B(119)were iso-lated from the roots of C.cordifolioidea[45].Three newbenzofuranylpropanoids,lanceolunes A(120),B(121)andC(122),as well as a new cerebroside,codonocerebrosideA(123),have been isolated from the roots of nceolata[41,46].(E)-2-Hexenyl-a-L-arabinopyranosyl(1?6)-b-D-glucopyranoside(117),3-oxo-a-ionol-b-D-glucopyranoside (124)and1,6-hexanediol,3,4-bis(4-hydroxy-3-methox-yphenyl)(125)were isolated from the aerial parts of C. clematidea[10].In addition,sweroside(126)and b-sitos-terol(112)were obtained from the whole plants of C. nervosa[40].Nutritive constituents including amino acids and trace elements in C.pilosula have been reported[47]. Essential oilsAs one of the important compositions,essential oils of several Codonopsis species have been reported.In the essential components from C.pilosula,50of66separated components were identified by GC–MS,mainly containing 1,2-benzonedicarboxylic acid dibatyl-ester(12.45%), heptedecanoic acid(8.10%)and2,4,5-triisopropyl styrene (7.62%)[48].Using the GC–MS method,54peaks were separated and37of them were identified in the essential components extracted from C.clematidea,in which the most abundant component was methyl hexadecanoate(30.40%)[49].The essential oils from the whole plants ofC.thalictrifolia,as a traditional Tibetan medicine,were analyzed by GC–MS,and45of60separated components were identified by comparing their mass spectra,in which the main principles were palmitic acid(43.5%)and linolic acid(18.3%)[50].In the essential oils extracted from the fresh and dried roots of C.cordifolioidea,63compounds were identified by GC–MS analysis,indicating that linolic acid(21.9%),retene(11.4%),pentadecane(7.4%), methyl9,12,15-octadecatrienoate(6.8%)and heneicosyl-cyclopentane(3.8%)were the main components[51]. PolysaccharidesLarge-molecule components in Codonopsis species were also studied.A water-soluble polysaccharide with a molecular mass of1.19104Da was obtained from the roots of C.pilosula and its structure investigation revealed that this polysaccharide had a backbone consisting of (1?3)-linked-b-D-galactopyranosyl,(1?2,3)-linked-a-D-galactopyranosyl and(1?3)-linked-b-D-rhamnopyr-anosyl residues and were branched with two glycosyl123Codonocerebroside A nceolata Roots[41] 1243-Oxo-a-ionol-b-D-glucopyranoside C.clematidea Aerial parts[10] 1251,6-Hexanediol,3,4-bis(4-hydroxy-3-methoxyphenyl) C.clematidea Aerial parts[10] 126Sweroside C.nervosa Whole plants[40]residues composed of a-L-arabinose-(1?5)-a-L-arabi-nose,whose C-1linked residues at the O-2position of galactosyl along the main chain in the ratio of1:1:2:1:1[52].Another polysaccharide with a molecular mass of 7.49104Da was isolated from C.pilosula and its com-ponents were galactose,arabinose and rhamnose in themolar ratio of1.13:1.12:1.Its main chain was shown to be (1?3)-linked-b-GalpNAc,(1?3)-linked-a-Rhap and (1?2,3)-b-Galp[53].Furthermore,a pectic polysac-charide with a molecular mass of1.459105Da was at first isolated from C.pilosula,and its structural analysis revealed that this polysaccharide is composed of rhamnose, arabinose,galactose and galacturonic acid in the molar ratio of0.25:0.12:0.13:bined with chemical and spectroscopic analyses,its structure was proposed to be 1,4-linked-a-D-GalpA and1,4-linked-a-D-GalpA6Me interspersed with rare1,2-linked-b-L-Rhap,1,2,6-linked-a-D-Galp and terminal a-L-Arap[54].BioactivitiesAlthough there is information on the uses of many Codonopsis species in traditional medicine,only bioactiv-ity studies on C.pilosula and nceolata have been reported frequently,which proved their importance as medicinal plants.Bioactivity studies on other Codonopsis species such as C.clematidea and C.cordifolioidea were scarce.The studies generally referred to the bioactive effects of aqueous,methanol and ethanol extracts,as well as their further purified fractions,flavones,saponins and polysaccharides.Codonopsis pilosulaAnti-tumor activityThe polysaccharide from C.pilosula(10l g/mL)was able to inhibit the activities of human gastric adenocarcinoma cells and hepatoma carcinoma cells[55].A pectic poly-saccharide(50,100,200and400l g/mL)exhibited marked cytotoxicity to human lung adenocarcinoma A549cells,in a dose-dependent manner[54].Anti-diabetic activityAfter mice were orally administered the polysaccharide from C.pilosula for a week,Fu et al.[56]found that three different doses of polysaccharide(100,200and300mg/ kg/day)could effectively decrease fasting blood glucose and insulin in serum,enhance superoxide dismutase(SOD)activity and reduce the content of malondialdehyde(MDA) in serum.It was therefore considered to possess a signifi-cant hypoglycemic effect in diabetic mice by improving insulin resistance.He et al.[57]showed that the aqueous extract of the roots of C.pilosula(equal to4.5g raw material/kg/day)might retard the progression of diabetesby reducing the blood glucose level and preventing the increase of aldose reductase activity in streptozotocin-induced diabetic mice after3days of oral administration.Anti-aging activityXu et al.[58]found that after mice were orally administrated the polysaccharide from C.pilosula for8weeks,the poly-saccharide(50and150mg/kg/day)was able to increase the thymus index and spleen index as well as the activities of SOD in serum and liver,glutathione peroxidase and nitric oxide synthase particularly in kidney,while decreasing MDA in serum and liver and lipofuscin in brain.Its post-ponement of senility might be related to raising immunity, eliminating free radicals and anti-lipoperoxidation. Effects on gastric mucosaLiu et al.[59,60]found that the water-soluble fraction from the roots of C.pilosula(equal to10g raw material/ kg)had a significant protective effect on gastric mucosal damage caused by alcohol,0.6N HCl and0.2N NaOH, and suggested that the pharmacological mechanism was related to the synthesis and/or release of prostaglandins in gastric mucosa.To date,Song et al.[61]found that lob-etyolin at the oral dose of1.5mg/kg had an effect on decreasing the ulcer index and the level of gastrin and increasing the level of6-keto-prostaglandin F1a in rats with gastric ulcer induced by ethanol,and suggested that lobetyolin played a protective role in gastric mucosa injury. Effects on blood systemAqueous extracts of C.pilosula(500l g/mL)potently inhibited erythrocyte hemolysis[62].In addition,after ischemia–reperfusion injury rats received8mg/100g body weight of a solution of saponins via intraperitoneal injec-tion,the results showed that the increase in SOD levels was accompanied by decreases in MDA,serum creatinine and blood urea nitrogen levels;bcl-2mRNA and protein levels were raised in transplanted kidneys from treated animals, while bax mRNA and protein levels were reduced.The apoptosis index was significantly decreased in transplanted kidneys from treated animals relative to untreated controls. These results clearly demonstrated protective effects on ischemia–reperfusion injury after kidney transplantation, which might be explained by decreasing lipid peroxidation and inhibition of apoptosis[63].Effects on immunityZhang and Wang[64,65]found that6days of oral administration of the polysaccharide from C.pilosula (800mg/kg/day)had effects on immunosuppressed mice induced by cyclophosphamide,including increasing the thymus and spleen index and the phagocytic activity of peritoneal macrophages and recovering the activity of a-naphthyl-acetate esterase in peripheral lymphocytes.In an immunological study in vitro,a water-soluble polysaccha-ride(50,100and200l g/mL)could stimulate concanavalin A-or lipopolysaccharide(LPS)-induced lymphocyte pro-liferation in a dose-dependent manner[52].In addition,the methanol extract of C.pilosula(1mg/mL)inhibited inducible nitric oxide synthase and protein oxidation in LPS-stimulated murine RAW264.7macrophage cells[66].Effects on nervous systemTotal alkaloids(30l g/mL)caused a significant enhancement of nerve growth factor-induced neurite outgrowth in PC12 cells as well as an increase in the phosphorylation of mitogen-activated protein kinase[67].Moreover,Pan et al.[68]orally administered alkaloids from C.pilosula(1mg/kg/day)to mice for4days after they suffered from amnesia by scopol-amine,and found that the alkaloids were effective against the decrease in acetylcholine.Other chemicals,saponins from Codonopsis Radix,were reported to have protective effects on the damage to astrocytes induced by hypoxia/hypoglycaemia and reoxygenation,and were able to inhibit the necrosis of astrocytes at three different concentrations(5.2,52and 520l g/mL)[69].Additionally,the polysaccharide from C. pilosula(1.1mmol/mL)also had marked protective effect on neural stem cell injury induced by sodium thiosulphate[70]. Other bioactivitiesThe extract of C.pilosula(20,40and60l g/mL)signifi-cantly attenuated angiotensin II(AngII)-induced insulin-like growth factor II receptor(IGFIIR)promoter activity.C.pilosula also reversed Ca2?influx,mitochondrial outer-membrane permeability and apoptosis increased by AngII plus Leu27-IGFII which was applied to enhance the AngII effect.Molecular markers in the IGFIIR apoptotic pathway and IGFIIR-Gaq association were down-regulated by C. pilosula.However,p-BadSer136and Bcl-2were increased. The results suggested that C.pilosula could suppress the AngII plus Leu27-IGFII-induced IGFII/IGFIIR pathway in myocardial cells[71].Codonopsis lanceolataAntioxidant activityThe water-soluble fraction and the n-butanol-soluble frac-tion of ethanol extract of nceolata showed。
淫羊藿综述
淫羊藿综述一、药源本品为小檗科植物淫羊藿、箭叶淫羊藿、巫山淫羊藿和柔毛淫羊藿等的干燥地上部分。
二、化学成分主要化学成分:淫羊藿的主要有效成分是多糖和黄酮类化合物,其中黄酮类化合物以淫羊藿苷为代表成分。
其他成分:木质素、生物碱、挥发油等。
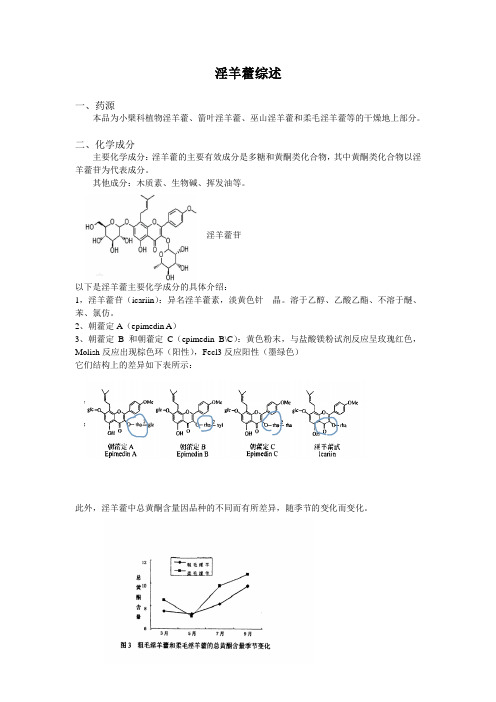
淫羊藿苷以下是淫羊藿主要化学成分的具体介绍:1,淫羊藿苷(icariin):异名淫羊藿素,淡黄色针晶。
溶于乙醇、乙酸乙酯、不溶于醚、苯、氯仿。
2、朝藿定A(epimedin A)3、朝藿定B 和朝藿定C(epimedin B\C):黄色粉末,与盐酸镁粉试剂反应呈玫瑰红色,Molish反应出现棕色环(阳性),Fecl3反应阳性(墨绿色)它们结构上的差异如下表所示:此外,淫羊藿中总黄酮含量因品种的不同而有所差异,随季节的变化而变化。
三、主要化学成分提取分离方法黄酮类化合物常见的提取方法有以下两种:(1)溶剂提取法:常先用乙醇(甲醇)提取。
回收溶剂后以水混悬,石油醚萃取脱脂,水溶液用乙酸乙酯萃取,大部分中等极性黄铜成分会溶解在此部分,少数极性大的黄酮用正丁醇萃取。
然后用硅胶柱(氧化铝柱)分离,Sephadex LH-20纯化。
(2)碱提酸析法:黄酮类物质难溶于水,而大多具有酚羟基,可用碱性水/醇浸出,经酸化后得到黄酮类物质。
三、黄酮类化合物的结构鉴定(1)二氢黄酮类和异黄酮类的比较共同点:均有苯甲酰系统,无桂皮酰系统,带Ⅱ强,带Ⅰ以带Ⅱ的肩峰或低强度峰出现。
不同点:带Ⅱ有明显区别,受A环含氧取代基的影响产生红移。
二氢黄酮(醇):270~295nm 异黄酮:245~270nm(2)总黄酮含量是衡量淫羊藿药材质量的重要指标之一,国家药典规定淫羊藿总黄酮含量不得低于5%,淫羊藿总黄酮的含量绝大多数是用紫外分光光度法测定,对照品几乎都用淫羊藿苷。
(3)黄酮类化合物鉴定的一般方法:1、确定是黄酮类化合物(化学法鉴别)2、判定是否为苷类(化学法,Molish反应)3、如果是苷类,水解,分别进行苷元和糖的鉴定4、对苷元进行鉴定(层析法对照,光谱法鉴定)5、对糖进行鉴定(层析法对照)6、确定糖和糖的连接(依次水解,酶水解,NMR)7、确定苷元和糖的连接(NMR)(4)紫外光谱在黄酮类化合物中的应用黄酮类化合物在甲醇中的紫外吸收光谱主要有2个吸收带组成:带Ⅰ:300~400nm间出现的吸收峰带Ⅱ:220~280nm间出现的吸收峰通常在测定样品在甲醇溶液的UV后测定加入诊断试剂的UV以了解样品的羟基取代情况。
植物生理学与生物化学研究综述

植物生理学与生物化学研究综述植物生理学与生物化学是研究植物内部生物化学代谢和生理过程的学科,广泛应用于农业、园艺、环境科学等领域。
本文将综述植物生理学与生物化学的研究内容、方法和应用。
1. 植物生理学研究内容植物生理学研究植物的生长、发育、代谢和适应环境的机制。
它关注植物内部的生理过程,如光合作用、呼吸作用、激素调节、水分利用等。
同时,植物生理学也研究植物对环境刺激的响应机制,如温度、光照、水分和盐分等因素对植物的影响。
2. 生物化学研究内容生物化学研究植物内部的分子组成、代谢途径和信号传导。
它涉及到植物细胞的生物大分子,如蛋白质、核酸、多糖和脂类等。
通过研究植物的代谢途径,可以了解植物利用光能和无机物合成有机物的过程。
此外,生物化学还研究植物内部的信号传导网络,如激素信号和细胞凋亡等。
3. 植物生理学与生物化学的研究方法植物生理学与生物化学的研究离不开实验方法和技术手段的支持。
常用的方法包括光合作用测定、呼吸作用测定、离体器官培养等。
通过这些实验手段可以研究植物的生理反应和代谢过程。
在生物化学研究中,常用的方法包括蛋白质表达与纯化、核酸提取与测序、质谱分析等。
这些方法可以揭示植物内部分子的组成和功能。
4. 植物生理学与生物化学的应用植物生理学与生物化学的研究为农业生产和环境保护提供了重要的理论依据和技术支持。
在农业生产中,植物生理学和生物化学可以通过调控激素和光信号等途径,提高农作物的产量和品质。
在环境科学中,植物生理学和生物化学可以研究植物的吸附和分解有害物质的能力,用于修复土壤和水体中的污染物。
总结:植物生理学与生物化学是研究植物内部生物化学代谢和生理过程的学科,研究内容包括植物生长发育、代谢和适应环境的机制等。
研究方法主要包括实验方法和技术手段,如光合作用测定、蛋白质表达与纯化等。
在农业和环境科学中,植物生理学与生物化学的研究有着广泛的应用。
当归的化学成分及药理作用研究综述

当归的化学成分及药理作用研究综述摘要在中国,当归是一种传统的中成药,具有很长的使用时间。
近几年,随着中药的发展,医学领域对中药的研究也得到了更大的重视。
近年来,中药的研究表明,当归不但具有调节血运、调节血运的功效,还具有抗菌、调节免疫、抗氧化等功能。
文章对其化学成分及药理学研究进展进行了系统的总结。
关键词:当归;挥发油;多糖引言当归性温、辛、甘,具有润燥滑肠、治疗便秘、经血不通等作用,故被誉为“药王”。
为了进一步推动中药在临床上的应用,确保病人用药的安全和效果,必须弄清中药的组成及作用机制,以便为今后的用药提供科学依据。
随着对中药的开发与健康的重视,当归中药资源紧缺。
如今,在传统饮食、医药、美容等行业中,除药用之外,也是一种主要的原材料。
但由于气候变化、环境污染以及人们对当归的过分开发,使其在我国的药材资源面临巨大的威胁。
尽管在我国的当归种植中占据了相当大的份额,但是随着产量和品质的不断提高,其产量和品质也越来越高。
通过对不同药材进行深层次的分析,我们对不同药材的作用有了新的理解。
本文在对中药成分及药理的分析基础上,指出很多中药的成分与药理成分与成分存在着类似或类似的作用,并加以开发和应用,从而形成了一种新型的药用植物。
该文对其化学成分及药理活性进行了系统的总结,以期对其在中药中的开发与利用具有一定的参考价值。
1 当归中主要化学成分目前,通过对当归化学成分的分析,发现其主要化学成分为挥发油、有机酸、多糖、类黄酮等。
对每种化学成分的研究现状进行了分析如下。
1.1挥发油王华,孙娜等人研究了当归的化学组成和生物活性。
挥发油是当归的主要化学成分之一,约占1%。
当归的挥发油可分为两部分:薬本内酯、丁烯基酞内酯。
最常见的化合物是苯酞类和二聚体的复合物,其次是倍半嶄类化合物、烯基苯酣等[1]。
1.2有机酸曹颜冬分离测定了当归的化学成分,发现主要的有机酸是阿魏酸、丁酸、壬二酸和茴香酸,其中阿魏酸更具代表性[2]。
花青素的研究综述

刘仕旭化学化工学院 20110441062前言花青素(Anthocyanidin),又称花色素,是自然界一类广泛.在自然状态下,花青素在植物体内常与各种单糖结合形成糖苷,称为花色苷(Anthocyanin),由Marguart(1853)命名矢车菊花朵中的蓝色提取物时提出来的,现在作为同类物质的总称[2,3]。花青素广泛存在于开花植物(被子植物)中,据统计,27个科,73个属植物中含花青素。近年来,国内外的学者通过对其研究,其主要用于食品着色方面,也可用于染料、医药、化妆品等方面[10],作为一种天然食用色素,安全、无毒、资源丰富,且具有一定营养和药理作用,特别在食品、化妆、医药等方面有着巨大的应用潜力,因为和其他天然色素一样,其染色力危害人的健康,因此天然色素越来越引起了科研领域及相关学者、工作者的广泛关注。1 花青素的植物来源及应用葡萄皮是花色苷类色素的主要原料,其他属于此类色素并具有开发前景的有胡萝卜素、高粱红色素、山楂红色素、黑米红色素、牵牛红色素、鸡冠花红色素,越橘红色素。已经投入商业生产色素有葡萄皮色素、浆果类(草莓、木莓、杨梅、枸杞)、紫玉米、萝卜红、蓝靛果、越橘红、黑米红等。在配料酒、糖果、糕点、冰棍、雪糕、冰淇淋、果汁(味)饮料、碳酸饮料中加入,用量0.5%~5%。另外也可用于化妆品,如红色花青素做口红。这些商品用色素(除葡萄皮色素外)共同特征是对光、热、氧稳定性好,对微生物稳定,一般溶于水和乙醇,不溶于植物油[4,8]。2 花青素的种类、结构与特性花青素的基本结构单元是2-苯基苯并吡喃型阳离子,即花色基元。现已知的花青素有20多种,主要存在于植物中的有:天竺葵色素(Pelargonidin)、矢本菊色素或芙蓉花色素(Cyanidin)、翠雀素或飞燕草色素(Delphindin)、芍药色素(Pe-onidin)、牵牛花色素(Petunidin)及锦葵色素(Malvidin)。自然条件下游离状态的花青素极少见,主要以糖苷形式存在,花青素常与一个或多个葡萄糖、鼠李糖、半乳糖、阿拉伯糖等通过糖苷键形成花色苷。已知天然存在的花色苷有250多种[2~4,8]。花青素分子中存在高度分子共轭体系,具酸性与碱性基团,易溶于水、甲醇、乙醇、稀碱与稀酸等极性溶剂中。不溶于乙醚、氯仿等有机溶剂,遇醋酸铅试剂会沉淀,并能被活性炭吸附。在紫外与可见光区域均具较强吸收,紫外区最大吸收波长在280nm附近,可见光区域最大吸收波长在500~550nm范围内。花青素类物质的颜色随pH值的变化而变化,pH<7呈红色,pH在7~8时呈紫色,pH>11时呈蓝色[2]。3 花青素的各项研究3.1 花青素的分离与分析植物花青素多采用酸性的甲醇、乙醇、水等极性溶剂提取,但该法同时提取了材料中由原花青素及花白素转化形成的花青素。提取液中用溶剂萃取、纸层析、柱层析方法分离纯化。采用纸层析或柱层析方法分离,得到3种主要的花青素苷元。花青素总量测定多采用分光光度法,样品经沸水提取,加酸性乙醇显色,生成特有的刚果红,于波长535nm处测吸光度,该法不受黄酮苷及儿茶素的干扰,但受原花色素、花白素干扰,分析结果往往偏高,灵敏度不够理想[2]。已有采用高效液体相色谱法(HPLC)测定花青素种类和含量的报道。D.Strack等从欧洲越桔花青素提取物中分离检测到16种花色苷,孙视等从引种越桔中检测到15种花色苷,色谱分析条件为:采用Aquapore RP-300色谱柱,10%甲酸水溶液做A泵流动相,流速1ml、min,柱温28℃,检测波长530nm,经梯度洗脱,在65min内完成检测。采用矢车菊-3-葡萄糖苷作为对照品进行方法考察显示:方法线性关系、重现性良好,准确度较高[2]。3.12花青素的生物合成途径20世纪80年代末90年代初,植物花青素及类黄酮物质代谢途径研究已较为成熟。苯丙氨酸是花青素及其他类黄酮生物合成的直接前体,由苯丙氨酸到花青素经历3个阶段:第1阶段由苯丙氨酸到香豆酰CoA,这是许多次生代谢共有的,该步受苯丙氨酸解氨酶(PAL)基因活性调控。第2阶段由香豆酰CoA到二氢黄酮醇,是类黄酮代谢的关键反应,该阶段产生的黄烷酮和二氢黄酮醇在不同酶作用下,可转化为花青素和其他类黄酮物质。第3阶段是各种花青素的合成[2]。3.3花青素生物合成的基因工程利用蛋白质纯化、转座子标签、PCR及鉴别筛选等手段从玉米、金鱼草、矮牵牛等植物中分离并克隆了部分与花青素生物合成相关的结构基因与调节基因。已分离与克隆的结构基因主要有CHS、CHI、DFR、ANS、3GT、AMT基因。已克隆的调节基因主要有R基因及其同族的C、Sn和Lc基因,另外还有B、Cl、Pl、Vpl、Del、An2、An4基因,并发现这些调节基因具高度相似序列,表明不同物种花青素生物合成由相似因子介导与控制[2,14~16]。通过外源结构基因导入,利用反义基因法与共抑制原理等技术调控花青素等类黄酮物质的合成,从而改变植物花色、果色与叶色已经取得许多成果[2]。人们根据植物花的颜色与类黄酮有关,而苯基乙烯酮合酶CHS是类黄酮生物合成的关键酶,于是从矮牵牛中分离出CHS的cDNA,将cDNA与CaMV的35S启动子反向连接,再把此反义基因系统连到双元载体Bin19上,得到矮牵牛转基因植株,其花色从原来的紫红色变为粉红色,并夹有杂白色或全白色,这种反义RNA技术为园艺学育种提供了一条新途径[7]。由于其易于观察的特性,花青素调控基因可用于研究植物基因表达及相互作用,植物遗传条件的优化上[2]。3.4花青素的生理及保健功能由WHO、FAO组成的食品添加剂联合专家委员会(JEC-FA)考察了花色苷的毒理学资料,结论是“毒性很低”。唯一的负面作用是使一些动物器官(肝、肾上腺、甲状腺)的重和体重下。1982年确定其人体ADI值(每日允许摄入剂量)为0~2.5mg/kg体重[3]。有证据表明,花青素不仅无毒和无诱变作用,而且有治疗特性。花青素在眼科学,治疗各种血液循环失调疾病,发炎性疾病上有疗效。最近关注花青素和相关类黄酮物质的抗氧化特性,导致许多文章报道它们在减少冠心病方面的作用,引发了调查所谓的“法兰西怪事”,即法国人食用高饱和脂肪酸,却很少人患冠心病[4,8]。3.5 花青素的植物组织培养技术用食品生物工程技术可实现花青素工业化生产,作为种蚯蚓体内能分离出至少2种以上具有抗凝活性但是分子量和生化特征不相同的蛋白酶。例如在粉正蚓(程牛亮等,1990)、赤子胜爱蚓(熊焱等,1999)体内均分离出多种纤溶酶组分[17~19]。粉正蚓的纤溶酶中有的可以水解碱性氨基酸,有的可以水解酸性氨基酸;李旭霞等(2003)提出赤子胜爱蚓纯化的组分中有的可以直接水解纤维蛋白,也有的以纤溶酶原作为水解底物[1,5~6,20]。日本宫崎医科大学的美原恒教授,利用蚯蚓提取蛋白酶获得了成功,此药可以代替尿激酶,是治疗心肌梗塞、脑血栓的特效药。郭斗涛等(1998)报道,口服蚯蚓水提物30ml、d,14d(1个疗程)后,脑血栓患者的血液流变学指标明显改善[21]。董德洛等(1993)给脑血栓患者口服蚯蚓水提物实验发现,该提取物可能通过抗凝及促纤溶作用,促进脑血栓患者神经功能缺损的恢复。陈飞等(2003)指出蚯蚓的溶栓作用,侧重于脑血管病的预防和中风后遗症的恢复。蚯蚓CaM是一种分布很广泛,功能重要的钙结合蛋白,作为主要的钙受体蛋白,调节着20多种酶的活性,在第二信使调节系统中处于重要位置[22]。4 结语近几年来,针对花青素的抗氧化、抗突变、预防心脑血管疾病、保护肝脏、抑制肿瘤细胞发生等多种生理功能[2,3的应用已有了突飞猛进的发展,世界上许多国家的学者都大量的研究.总的来说,对花青素的研究开展的比较广泛,不稳定(易受pH、氧化剂、亲核剂、酶、金属离子、温度、光照等影响),使其应用受到一定限制[4,11,12]。但由于至今国内市场上还没有花青素纯品,需要更为深入的研究.对花青素的研究中,我认为花青素今后主要的发展方向为:提取高纯度的花青素及对花色苷类色素的深入研究与开发提供必备的表征条件和理论依据,并且有助于它的工业利用[10]。参考文献[1] 曾小澜,章碧玉,麦羡霞.蚯蚓提取物对多种瘤细胞的作用[J].山西医学院学报,1995,26(2):81-83.[2 ]张绍章,田琼,李予蓉.蚯蚓提取物对小鼠脾脏抗体形成细胞的影响[J].第四军医大学学报,1993,14(5):350-352.[3] 孙淑芬,莫简,郭正仁.蚯蚓提取物对血卟啉激光抗癌的增敏作及其机理[J].第四军医大学学报,1991,12(2):141-144.[4] 邢宝东,殷慎敏,茹炳根.蚯蚓纤溶酶的分离纯化及性质[J].生物化学与生物物理学报,1997,29(6):609-612.[5 ]赵晓瑜,静天玉.蚯蚓纤溶酶的成分分析[J].中国生物化学与分子生物学报,1998,14(4):407-411.[6 ]林少琴,余萍,兰瑞芳.蚯蚓纤溶酶的亲和层析纯化及部分性质[J].药物生物技术,2000,7(4):229-233.[7] 杨嘉树,李令媛,茹炳根.蚯蚓体内一种纤溶酶原激活剂(ePA)的分离纯化[J].中国生物化学与分子生物学报,1998,14(2):156-163.[8] 杨嘉树,李令媛,茹炳根.蚯蚓体内一种纤溶酶原激活剂(ePA)的部分性质研究[J].中国生物化学与分子生物学报,1998,14(2):164-169.[9 ]杨嘉树,郭亚迁,茹炳根.蚯蚓纤溶酶原激活剂(ePA)小亚基活性中心的酶学性质及CD光谱的研究[J].中国生物化学与分子生物学报,1998,14(6):721-725.[10] 刘堰,李清漪.赤子爱胜蚓超氧化物岐化酶的纯化和部分性质研究[J].生物化学杂志,1994,10(5):605-610.[11] 徐炜虹,杨齐衡,路英华,等.蚯蚓过氧化氢酶的纯化及性质[J].华东师范大学学报(自然科学版),1996,4:95-101.12 严民宏,王二力,周元聪,等.赤子爱胜蚓纤维素酶的初步研究[J].华东化工学院学报,1991,17(1):82-86.[13] 钟良玮,张祖,单鸿仁.双胸蚓胶原酶的萃取、纯化、性质及化学组成的研究[J].生物化学杂志,1991,7(3):291-296.[14] 李令媛,马宏宝,吕迎春.镉诱导威廉环毛蚓金属硫蛋白的分离纯化及特性研究[J].生物化学杂志,1994,10(4):444-450.[15]] 王采芹,张庭芳.蚯蚓钙结合蛋白的分离纯化及性质的研究[J].北京大学学报(自然科学版),1996,32(6):741-748.[16 ]陈飞,刘艳玲,吴红玲.蚯蚓有效成分研究进展[J].微生物学杂志,2003,20(1):43-44.[17] 郭斗涛,中西医结合杂志,1988,8:400.[18] 董得洛,黄德铭.上海医科大学学报,1993,20(1):16.[19] 李旭霞,李庆伟,抗凝血蛋白药物的研究进展[J].辽宁师范大学学报(自然科学版),2003,26 (2):187-191.[20] 程牛亮,牛勃,张祖询,等.双胸蚓纤溶酶的纯化及性质[J].生物化学杂志,1990,6(2):186-190.[21] 熊焱,杨四成,刘晓英,等.蚯蚓纤溶酶的纯化及部分序列测定[J].生物化学杂志,1997,13(3):292-295.[22] 李玉珍,杨继虞,陶建宁.赤子爱胜蚓纤溶酶的理化性质研究[J].广东药学,2000,10(2):30-32.[23] Tsunoda S,et al.AnticancerRes,1997,17(5A):3349.。
山茱萸化学成分及药理作用研究新进展

山茱萸化学成分及药理作用研究新进展一、本文概述山茱萸,作为一种传统中药材,自古以来就在中医理论中占据重要地位。
近年来,随着现代科学技术的进步,对山茱萸的研究逐渐深入,其化学成分及药理作用的了解也日益丰富。
本文旨在全面概述山茱萸化学成分的研究现状,深入探讨其药理作用的新进展,以期为山茱萸的进一步开发利用和临床应用提供科学依据。
本文将首先介绍山茱萸的主要化学成分,包括其含有的多种活性成分,如黄酮类、皂苷类、木脂素类等。
随后,将重点综述这些化学成分在近年来的药理作用研究中的新发现,特别是在抗炎、抗氧化、抗肿瘤、心血管保护等方面的作用机制。
本文还将关注山茱萸在临床应用中的潜力和前景,以及当前研究中存在的问题和挑战。
通过对山茱萸化学成分及药理作用研究的综述,本文旨在为中医药学的发展贡献新的力量,同时也为现代医学提供新的药物研发思路和方向。
二、山茱萸的化学成分山茱萸作为一种传统中药材,其化学成分丰富多样,涵盖了多种具有生物活性的化合物。
这些化学成分主要包括皂苷类、黄酮类、环烯醚萜类、木脂素类以及其他一些微量成分。
皂苷类化合物是山茱萸中含量较高的一类成分,具有显著的药理活性。
其中,马钱子苷是山茱萸中的主要皂苷成分,具有抗炎、抗氧化等作用。
还有山茱萸皂苷A、B、C等,这些皂苷类化合物在山茱萸的药理作用中发挥着重要作用。
黄酮类化合物也是山茱萸中的重要成分之一,主要包括黄酮醇、黄酮苷等。
这些黄酮类化合物具有抗氧化、抗炎、抗肿瘤等多种生物活性,对心血管疾病、癌症等具有一定的预防和治疗作用。
环烯醚萜类化合物在山茱萸中也有较高的含量,这类化合物具有抗炎、抗菌、抗病毒等药理作用,对于治疗感染性疾病具有一定的潜在应用价值。
木脂素类化合物在山茱萸中也有一定的含量,这类化合物具有抗氧化、抗炎等作用,对于预防和治疗一些慢性疾病如心血管疾病、癌症等具有一定的作用。
除了以上几类主要化学成分外,山茱萸还含有一些微量成分,如挥发油、有机酸、糖类等。
木质素综述

木素是芳香族的高分子化合物,也是一类性质相似的物质的总称。
不同的原料木素分子的化学组成及结构都有差异。
它们是一种无定形结构的物质,存在物的木化组织中,是细胞之间的粘接物,在细胞壁中叶含有,棉花、亚麻等纤维则不含木素。
木素作为具有三维立体结构的天然高分子聚合物,广泛存在于较高等的维管束植物门(被子植物、裸子植物、羊齿植物)中。
特别在目本植物中,木素是木质部细胞壁的主要成分之一,在木材中木素作为一种填充和粘结物质,在木材细胞壁中能以物理或化学的方式是纤维素纤维之间粘结和加固,增加木材的机械强度和抵抗微生物侵蚀的能力,是木化植物直立挺拔和不易腐蚀。
木素在不同植物中的分布见下表:这些木素具有苯基丙烷单位的基本骨架,但其芳香核部分有所不同,大致有如下三种:原始的陆生植物和针叶木的木素主要是愈疮木酚基丙烷(1);进一步进化的阔叶木木素含有(1)和紫丁香基丙烷(2);最进化的稻科,除(1)和(2)之外还有对—羟基苯基丙烷(3)构造单元。
总之与植物进化的同时,木素的构造单元也变得复杂化。
虽然木质素只有三种基本结构,但是不同科植物,其木质素基本结构单元的数量比例差别很大。
阔叶木木质素的结构中存在大量的紫丁香结构单元。
如尾叶桉木质素紫外光降解产物中,w (丁香基型化合物)=58%,w (愈创木基型化合物)=%.与桉木木质素相比,硫酸盐浆木质素降解产物中愈创木酚和紫丁香酚,在硫酸盐浆木质素中,m (紫丁香基):m (愈创木基)=:1,而在桉木木质素中,该比例为:1,针叶木木质素的结构单元与愈创木基型结构单元为主,其余为少量对羟苯基型。
麦草木质素主要由非缩聚愈创木基单元、非缩聚紫丁香基单元组成,其聚合度n 比例为:1:。
竹类木质素中—OCH3基含量与阔叶木质素相近。
木质素的理化性质及其对应的亲电亲核反应化学性质木质素的化学性质包括发生在苯环上卤化、硝化和氧化反应;发生在侧链的苯甲醛基、芳醚键和烷醚键上的反应;木质素的改性和显色反应等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
植物化学物综述
一、植物化学物概念
植物由种类繁多的化学物质组成,根据其代谢产物的产生过程将代谢产物分为初级代谢产物和次级代谢产物。
次级代谢产物是植物的代谢产生的多种低分子量末端产物通过降解或合成长生不再对代谢过程起作用的化合物。
这些产物除个别是维生素的前体物外均为非营养成分,现已将它们统称为植物化学物。
从广义上讲,植物化学物生物进化过程中植物维持其与周围环境互相作用的生物活性分子。
植物次级代谢产物对植物本身而言具有多种功能,如保护其不受杂草、昆虫及微生物侵害,作为植物生长调节剂或形成植物色素,维系植物与其生长环境之间的互相作用等。
从化学结构上讲,这些次级代谢产物种类众多;从数量上讲,与初级代谢产物相比又微乎其微。
然而直到近年来营养科学工作者才开始系统地研究植物中这些生物活性物质对机体健康的促进作用。
植物次级代谢产物对健康具有有益和有害的双重作用。
过去我们认为并一直强调在植物性食品中它们是天然毒物并对人体健康有害,或因限制营养素的利用而被认为是“抗营养”物质。
对植物化学物有益作用的认识食欲对农场动物的观察。
大量的流行病学调查结果证明,在蔬菜和水果中含有一些生物活性物质,它们具保护人图和预防诸如心血管疾病和癌症等慢性病的作用,因此又重新引起了营养科学工作者对植物化学物的兴趣。
二、植物化学物的分类和来源
植物化学物可按照它们的化学结构或者功能特点进行分类。
(一)类胡萝卜素
类胡萝卜素是水果和蔬菜中广泛存在的植物次级代谢产物,它们的主要功能之一是使植物显示出红色或黄色。
通常根据极性基团的存在与否将类胡萝卜素分成无氧和含氧两种类型。
主要有无氧的α-和β-胡萝卜素和番茄红素,有氧的黄体素、玉米黄素和β9-隐黄素。
(二)植物固醇
植物固醇主要存在于植物的种子及其油料中,主要有β-谷固醇豆固醇和菜油固醇。
(三)皂甙
皂甙是一类具有苦味的化合物,它们可与蛋白质和脂类形成复合物,在豆科植物中皂甙特别丰富。
(四)芥子皂甙
戒子皂苷存在于所有十字花科植物中,它们的降解产物具有典型的芥末、辣根和花椰菜的味道。
(五)多酚
多酚是所有酚类衍生物的总称,主要为酚酸(包括羟基肉桂酸)和类黄酮,后者主要存在于水果和蔬菜的外层及整粒的谷物中(木聚素)。
新鲜蔬菜中的多酚可高达0.1%,最常见的类黄酮是槲皮素。
(六)蛋白酶抑制剂
植物蛋白酶抑制剂存在于所有植物中特别是豆类、谷类等种籽中含量更高。
哺乳动物肠道中的蛋白酶抑制剂主要阻碍内源性蛋白酶的活性导致机体加强消化酶的合成反映。
(七)单萜类
调料类植物中所有的植物化学物主要是典型的食物单萜类质,如薄荷中的薄荷醇、香菜种籽中的香芹酮、柑橘油中的柠檬油精。
(八)植物雌激素
植物雌激素是存在于植物中,可结合到哺乳动物体内雌激素受体上并发挥类似于内源性雌激素作用的成分。
异黄酮和木聚素在化学机构上均是多酚类物质,但是也属于植物雌激素。
异黄酮几乎全部存在于大豆和大豆的制品中,木聚素在亚麻种籽和粮食制品中较
高。
(九)硫化物
植物次级代谢产物中的硫化物包括所有存在于大蒜和其他球根状植物中的有机硫化物。
大蒜中的主要活性物质是氧化性使得二丙稀基二硫化物,亦称蒜素,蒜素中的基本物质是蒜苷。
(十)植酸
又称肌醇六磷酸酯,是天然存在于谷类和豆类食物中、富含磷的一种有机化合物。
植酸主要存在于种籽胚层和谷皮中。
除上述各种植物次级代谢产物外,还有一些植物化学物没有归属到上述分类中,例如植物凝血素、葡萄糖二胺、苯酞、叶绿素和生育三稀酚类等。
三、植物化学物的生物学作用
植物化学物具有多种生理作用,主要表现在以下几个方面。
(一)抗癌作用
癌症的发生是一个多阶段过程,植物化学物几乎可以在每一个阶段抑制肿瘤的发生。
从不同的实验系统(离体、动物、人)可获得有关蔬菜、水果以及提取的植物化学物的抗癌作用资料。
在动物试验中,均获得了植物化学物抑制自发性肿瘤和化学物诱导性肿瘤的证据。
但值得指出的是人群研究,特别是流行病学的干预实验或生物标记的相关研究将具有重要的意义。
植物化学物(如芥子油甙、多酚、单萜类、硫化物)均可通过抑制I相酶和诱导Ⅱ相酶来抑制致癌作用;在人体试验中,每日食用300g布鲁塞尔芽甘蓝可增加男性的GST活性,但对女性无作用。
某些酚酸可与活化的致癌剂发生公假结合并掩盖DNA与致癌剂的结合位点,这种作用机制可以抑制由DNA损伤所造成的致癌作用。
现已证实植物雌激素对机体激
素代谢有影响。
已知雌激素对某些肿瘤生长有轻度促进作用,植物性雌激素在人肝脏可诱导性激素结合球蛋白的合成,这样就可增加雌激素与该种转运蛋白的结合,从而降低了雌激素促肿瘤生长的作用。
植物化学物抗癌作用的另一种可能机制是调节细胞生长次级胆汁酸可因具有促进细胞增生的作用有利于促进结肠癌的发生,而植物化学物也能对次级胆汁酸这类代谢产物的内源性形成产生影响。
(二)抗氧化作用
癌症和心血管疾病的发病机制与反应性氧分子及自由基的存在有关。
现已发现的植物化学物,如类胡萝卜素、多酚、植物雌激素、蛋白酶抑制剂和硫化物等具有明显的抗氧化作用。
某些类胡萝卜素(如番茄红素和斑蝥黄)与β-胡萝卜素相比,对单线态氧和氧自由基具有更有效的保护作用。
在植物源性食物的所有抗氧化物中,多酚无论在数量还是在抗氧化作用上都是最高的。
血液中LDL胆固醇浓度是动脉硬化症的主要原因,但LDL胆固醇只有经过氧化后才会引起动脉粥样硬化。
有报道红葡萄酒中的多酚提取物以及黄酮醇(槲皮素)在离体试验条件下与等量的维生素相比,可更有效的保护LDL胆固醇不被氧化。
某些种类的蔬菜对DNA氧化性损伤具有保护作用,每天食用300g布鲁塞尔芽甘蓝共3周的人群与同样时间内每日食用300 g元芥子油甙蔬菜的人群相比可明显降低DNA的氧化性损伤,人体每天摄人的具有抗氧化作用的必需营养素只有100 mg,然而每天摄入的具有抗氧化作用的植物化学物却超过了1 g.这就说明并强调了植物化学物作为抗氧化剂对减少癌症发生危险性的潜在生理作用,以及多吃蔬菜和水果的重要意义。
(三)免疫调节作用
免疫系统主要具有抵御病原体的作用,同时也涉及到在癌症及心血管疾病病理过程中
的保护作用。
迄今为止,已经进行了很多有关多种类胡萝卜素对免疫系统的刺激作用的动物试验和干预性研究,其结果均表明其对免疫功能有调节作用。
但其他植物化学物对免疫系统功能的影响,目前只作了较小范围的研究。
还有多数研究表明类黄酮具有免疫抑制作用;而皂甙、硫化物和质酸具有增强免疫功能的作用。
(四)抗微生物作用
自古以来,某些食用性植物和调料植物就被用来处理感染。
后来由于磺胺及抗生素的发现以及它们成功的抗感染作用,使人们降低了从食物中寻找具有抗感染作用的植物成分的兴趣。
但近年来,考虑到化学合成物的副作用,又重新掀起了从植物食物中寻找具有抗微生物作用成分的热潮。
早期研究已证实球根状植物中的硫化物具有抗微生物作用。
蒜素是大蒜中的硫化物,具有更强的抗微生物作用。
芥子油甙的代谢物异硫氰酸盐和硫氰酸盐同样具有抗微生物活性。
混合食用水芹、金莲花和辣根后,泌尿道中的芥子油甙代谢物能够达到治疗浓度,但单独食用其中一种则不能达到满意的疗效。
在日常生活中可用一些浆果,如酸梅和黑莓来预防和治疗感染性疾病。
一项研究表明,可见经常食用这类水果可能会起到抗微生物作用。
(五)降胆固醇作用
动物实验和临床研究均发现,以皂甙、植物固醇、硫化物和维生素E为代表的一些物质有降低血胆固醇血清水平的作用,血清胆固醇降低的程度与食物中的胆固醇和脂肪含量有关。
植物化学物可以抑制肝中胆固醇代谢的关键酶、其中最重要的是羟甲基戊二酸单酰CoA还原酶,其在动物体内可被生育三稀酚和硫化物所抑制。
植物化学物所具有的其他促进健康的作用还包括调节血压、血糖和血凝以及抑制炎症
等作用。
四、不同类型的植物化学物学功能研究概况
对200多项流行病学研究结果进行分析,证实了大量食用蔬菜和水果可以预防人类多种癌症。
通常蔬菜和水果摄入量高的人群较低摄入量的人群癌症发生率大约低50%。
新鲜(生)蔬菜和沙拉可明显降低癌症发生的危险性,对胃肠道、肺和口腔/喉的上皮肿瘤证据最充实。
对激素相关肿瘤抑制作用的证据较少,但乳腺癌和前列腺癌的第发病率似乎与食用大量蔬菜有关。
根据目前现有的知识,很难区分蔬菜和水果中的每一种成份(如必需营养素、膳食纤维、植物化学物)降低疾病危险性的作用。
因此在流行病学研究中还要进行人群干预实验来进一步证实蔬菜和水果的促健康作用与摄人植物化学物之间是否存在因果关系。
目前已建立了食物和体液中多种植物化学物的检测方法,而且能够对其浓度、生物利用率和生物动力学进行评价。
但对某些植物化学物与特殊疾病发病率之间的关系,尚需进一步的流行病学调查及实验研究对其加以阐述。
此外,还需要识别出一些短期的生物标志物作为人类摄取的植物化学物发挥长期健康保护作用的指示。
根据目前对植物化学物有益健康的理解,还不需要对营养素推荐摄入量进行修改,对某些具有预防或治疗某些疾病作用的植物性食物的RDA还不能及时制定出来。
但根据流行病学得到的植物化学物对人类健康有益有证据,几乎所有营养学家均推荐多吃植物性食物。
