有机化学农科课件3不饱和脂肪烃
第3章 不饱和脂肪烃

马氏规则
H Br
HBr
RCH=CH 2 + H2O
H+
RCHCH 3 OH
由于碳正离子可以和水中杂质作用,副产物多, 由于碳正离子可以和水中杂质作用,副产物多, 另碳正离子可重排,产物复杂,故无工业使用价值, 另碳正离子可重排,产物复杂,故无工业使用价值, 重排 但合成题中也常用。 合成题中也常用。
优
CH O
C O O H
Z-E 命名法规定: 命名法规定: 若一个双键碳原子上连接的较优基团与另 一个双键碳原子上连接的较优基团在双键同侧 ,其构型用Z表示,反之用E表示。 其构型用Z表示,反之用E表示。
H3C C Br C Cl
H
H
H3 C C C
CH3 CH2CH3
(Z)1-氯-2-溴丙烯 氯 溴
乙烯在不同压力下可得到密度不同、用途不同的聚乙烯: 乙烯在不同压力下可得到密度不同、用途不同的聚乙烯:
压力
nCH2=CH2
CH2
CH2
n
齐格勒(德国化学家) 齐格勒(德国化学家)
纳塔(意大利化学家) 纳塔(意大利化学家)
齐格勒1949至1953年发明了 高活性络合催化剂, 齐格勒1949至1953年发明了 高活性络合催化剂,对齐格勒 1949 发明的催化剂加以改进,使其适合于聚丙烯的大规模生产, 发明的催化剂加以改进,使其适合于聚丙烯的大规模生产,产品 广泛用于汽车、化工、包装、建筑、医疗、农业、食品等工业。 广泛用于汽车、化工、包装、建筑、医疗、农业、食品等工业。 他们于1963年共同获得诺贝尔化学奖。 1963年共同获得诺贝尔化学奖 他们于1963年共同获得诺贝尔化学奖。
CH3 CH3 CH3 CH3 C CH3
第3章 不饱和脂肪烃

1.4.1.4 加硫酸
烯烃和浓硫酸很容易加成,加成符合马氏规则: CH2=CH2 + HO-SO2-OH → CH3-CH2-O-SO2-OH 硫酸氢乙酯 CH3-CH=CH2+ HO-SO2-OH → (CH3) 2-CH-O-SO2-OH 硫酸氢异丙酯 这个反应可以用来鉴别烯烃和分离烯烃,因为 烯烃与浓硫酸加成后就溶解了.
反应过程中产生了正碳离子Br-CH2-CH2⊕可 以用实验的方法来证明:当在溴水中加入 NaCl时,如果有正碳离子形成的话,那么下 面的三个反应都是可能的: B r B r C H 2 - C H 2 B r
B r C H 2 - C H 2 +
C l O H
B r C H 2 - C H 2 C l B r C H 2 - C H 2 O H
(Ⅲ)
(Ⅰ)和(Ⅲ),(Ⅱ)和(Ⅲ)的碳链结构不同,是碳链 异构(与丁烷的情况类似),我们在烷烃中已经接 触过了.但是(Ⅰ)和(Ⅱ)的碳链是相同的,它们的 不同仅在于碳碳双键的位置不同,即碳碳双键这一 官能团的位置不同,象这种异构现象叫官能团位置 官能团位置 异构.(Ⅰ)和(Ⅱ)之间互称为位置异构体. 异构
三烷基硼
H2O2 (RCH2CH2O)3B H2O RCH2CH2OH + B(OH)3 OH-
简化: RCH=CH2 + BH3 → (RCH2CH2)3B
H2O2/OHH2O
RCH2CH2OH
1.4.1.8 聚合反应
烯烃在催化剂作用下,可以发生分子之间的相 互加成,生成很大的分子——高分子化合物: n CH2=CH2 → [-CH2-CH2-]n n CH3-CH=CH2 → [-CH(CH3)-CH2-]n 生成的产物聚乙烯,聚丙烯都是工业和日常生 活的重要塑料.因此烯烃的聚合反应是有重要 的工业意义. 返回
第3章不饱和脂肪烃

1.4.1.1 加氢反应(又称之为催化氢化)
催化剂:Pd、Pt、Ni(需高温) 产物:烷烃
RCH=CHR'
催化剂
H2
RCH2CH2R'
反应可以定量进行,因此可以根据所用的H2气的体积 来定量地分析烯烃。
无Cat. E活 E CH2 CH2 E活 H CH3CH3
一个反应能否进行,并不取决于
加Cat. 反应是放热还是吸热,而是取决于
两个甲基在双 键的不同侧, 叫反式异构体
H CH3
H C C
(Ⅳ)
H CH3
CH3 C
(Ⅴ)
CH3
C
H
这种异构现象叫顺反异构或叫几何异构
产生几何异构体的条件:
I.分子中必须具有限制旋转的因素;
II.满足条件I的两个碳原子必须和两个不 同的原子或基团相连。
H2C=CH-CH2-CH3
H2C C CH3 CH 3
C C + A-B C A C B
象这样的反应叫亲电加成反应。
1.4.1 1.4.2 1.4.3
加成反应 氧化反应 聚合反应
1.4.4
a-H的卤代反应
1.4.1 加成反应
1 . 加氢反应 2 . 加卤素(Cl2、Br2、I2)
3 . 加卤化氢HX (HCl、HBr、HI)
4 . 加水 5 . 加硫酸 6 . 加次卤酸 7. 加烯烃 8. 硼氢化反应
子与水加成,最后脱质子。
CH2=CH2 + Cl2 + H2O HOCl
CH3CH=CH2 + Br-OH
ClCH2CH2OH
CH3CHCH2Br OH
1.4.1.7 加烯烃 * 需要酸催化
有机化学不饱和脂肪烃07
Organic Chemistry
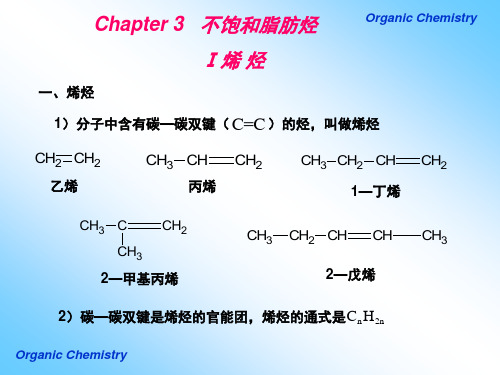
Ⅰ烯 烃
一、烯烃 1)分子中含有碳—碳双键( C=C )的烃,叫做烯烃
CH2 CH2
CH3 CH
丙烯
CH2
CH3 CH2 CH
CH2
乙烯
CH3 C CH3 CH2
1—丁烯
CH3 CH2 CH CH CH3
2—甲基丙烯
2—戊烯
2)碳—碳双键是烯烃的官能团,烯烃的通式是 Cn H2n
H
sp2
H
sp2
sp2
H C C H
H
C C
sp2
sp2
H
H
H
P
键以两瓣分布于分子平面的上下两侧
Organic Chemistry
Chapter 3 不饱和脂肪烃
Organic Chemistry
Organic Chemistry
Chapter 3 不饱和脂肪烃
三、命名
系统命名法:
Organic Chemistry
Br
H 2O
CH2
CH2
CH2
Cl
+
Br
CH2 OH2
-H
+
Br
CH2
CH2
OH
Organic Chemistry
Chapter 3 不饱和脂肪烃
Organic Chemistry
④ 与次卤酸加成
CH3 CH
CH2
+ +
Br
Br (H2O)
CH3 CH OH
CH2 Br
CH3 CH
CH2
HOBr
CH3 CH OH
有机化学第三章不饱和脂肪烃

Br + CH2 CH CH=CH2
+ BrCH2 CH CH=CH2
BrCH2 CH
+ CH CH2
49
2、Diels-Alder反应(双烯合成反应) 共轭二烯与乙烯或取代乙烯反应生成环状化 合物:
CN + CN
D-A反应的特点: *机理:协同反应,没有中间体; *参与反应的取代烯烃双键上有吸电子基时 有利于反应;
第三章
不饱和脂肪烃(6学时)
本章要点 • 不饱和脂肪烃包括烯烃、炔烃等; • 基本反应有加成反应、氧化反应、聚合反应等; • 亲电加成反应机理; • 键上的诱导效应、共轭效应; • 共轭二烯烃的结构特征与加成反应;
1
第一节 烯烃
• 定义:含碳-碳双键的烃;属不饱和烃 • 单烯烃的通式: CnH2n
RCOOH + R/COOH RCOOH + CO2 + H2O
– 中性、碱性介质或较低温度下:控制的氧化条件,只断 开键;
RCH CHR
/
KMnO4
RCH OH
CHR/ OH
26
⑵ 臭氧化
R1 R2
R3 H
O3
R1 R2 O
O O
R3 H
O H2O R1 O R2
+
O R3 O R2
+
OH
Zn/H2O
C
杂化
5
p轨道与p轨道
重叠形成键
键:p-p
键:sp2-sp2 键的特点:1)垂直于分子平面 2)使双键无法自由旋转
6
C
C
双键碳原子绕键轴旋转将破坏键, 因此室温下不能绕键轴旋转
7
二、 命名和异构
《不饱和脂肪烃》课件

2
化学合成
通过化学反应,如氢化、氧化和聚合等,可以合成不饱和脂肪烃。
3
工业生产
工业生产通常采用催化剂和高温高压条件,以实现大规模的不饱和脂肪烃生产。
不饱和脂肪烃的实验室实践和注意事项
1
安全操作
2
实验室设备
3
废弃物处理
在实验室中,对于不饱和脂
实验室中应配备一定的设
废弃物处理应遵循相应的环
肪烃的操作需要遵循安全操
备,如通风橱、防爆柜和灭
境法规,并采取合适的方法
作规程,包括佩戴防护眼镜、
ቤተ መጻሕፍቲ ባይዱ
火器等,以确保实验操作的
进行处置,以保护环境和人
手套和实验室外套等个人防
安全性。
类健康。
护装备。
水和抗生素等。
料。
工业中被广泛运用。
不饱和脂肪烃的危害和风险
尽管不饱和脂肪烃在许多领域有重要应用,但它们也存在危害和风险。例如,
某些不饱和脂肪烃可能对人体健康有害,而高浓度的不饱和脂肪烃可能具有
爆炸风险。
不饱和脂肪烃的生产和合成方法
1
天然来源
不饱和脂肪烃可以从天然的植物油、动物脂肪和石油等来源中提取。
《不饱和脂肪烃》PPT课件
探索不饱和脂肪烃的奇妙世界,从定义、分类到性质和应用,还有危害和生
产方法,一起来了解这个引人入胜的话题。
不饱和脂肪烃的定义
不饱和脂肪烃是一类化学物质,其分子中含有碳和氢原子,同时还存在双键或三键。这些炭化合物的化学结构使它
们具有独特的性质和特性。
不饱和脂肪烃的分类
根据双键的数量和位置,不饱和脂肪烃可以分为单不饱和脂肪烃和多不饱和脂肪烃。例如,乙烯是一种单不饱和脂
不饱和脂肪烃新课件

亲核反应: 亲电反应: 进攻试剂:
二、 烯烃的亲电加成反应历程
在氯化钠溶液中进行溴与乙烯的加成时产物为:
CH2BrCH2Br 和 CH2BrCH2Cl
特点:分步进行
1.同Br2 (非极性试剂)
第一步:
CH2 δ ? δ + Br Br
CH2
CH2 CH2
Br + Br-
CF3CH=CH2 + HBr CH2NO2CH=CH 2
CF3CH2CH2Br CH2NO2CH2CH2Br
§6 烯烃的游离基(自由基)加成反应历程
过氧化物 RCH=CH2 + HBr
RCH2CH2Br
RCH=CH 2 Br
RCHCH2Br (仲自由基)
RCHCH2 (伯自由基) Br
条件:必须是HBr和过氧化物
CH3CH2CH2C CH + HBr
过氧化物 CH3CH2CH2CH2CHBr2
4.加 H2O
HC CH + H2O H2SO4, HgSO4
CH2=CH OH
重排
CH3CHO
RC CH + H2O H2SO4, HgSO 4
㈡ 氧化反应
CH3CH2C CCH2CH3
KMnO4 H+
CH2=CR OH
( E)1-溴-1-氯-丙烯
H3C
C H
CH3 C
CH2CH3
顺-3-甲基-2-戊烯 (E)- 3-甲基-2-戊烯
H3CH2C
C H3C
CH2CH2CH3 C
CH(CH3)2
(E) 3-甲基-4-异丙基-3-庚烯
《有机化学》第3章不饱和脂肪烃

2-环戊烯基
23
10/31/2019
烯烃和炔烃的命名
衍生物命名法
分别以乙烯和乙炔为母体,其它烯烃和炔烃分别 看成乙烯和乙炔的烷基衍生物,取代基按”次序规 则”放在母体化合物之前。
C H 3 C HC H 2
甲基乙烯
(C H 3)2CC H 2
不对称二甲基乙烯
C H 3 C H 2 CC C H 3
20 cis
10/31/2019
trans
常见烯基 47页
乙烯基(Vinyl)
H2C CH
•丙烯基
HC CHCH3
烯丙基(Allyl-)
H2C CHCH2
•异丙烯基
21
H2C CCH3
10/31/2019
常见炔基
乙炔基 •丙炔基 炔丙基
HC C C CCH3
HC CCH2
22
10/31/2019
CH3 C=C
CH3CH2
CH2CH2CH3 CH2CH3
顺-3-甲基-4-乙基-3-庚烯
E-3-甲基-4-乙基-3-庚烯
48页-49页
33
2019/10/31
有多个双键的要逐个标明构型
CH3
Br
C=C
CH3
H
C=C
H
H
2Z,4Z- 3-溴-2,4-己二烯
147
2019/10/31
烷烃、烯烃、炔烃的物理常数
lower F
Cl higher C
H lower
(Z )-1-fluoro-2-chloro-1-bromoethene
32
10/31/2019
H3C
CH2CH2CH3
CH3CH2
第三章不饱和脂肪烃
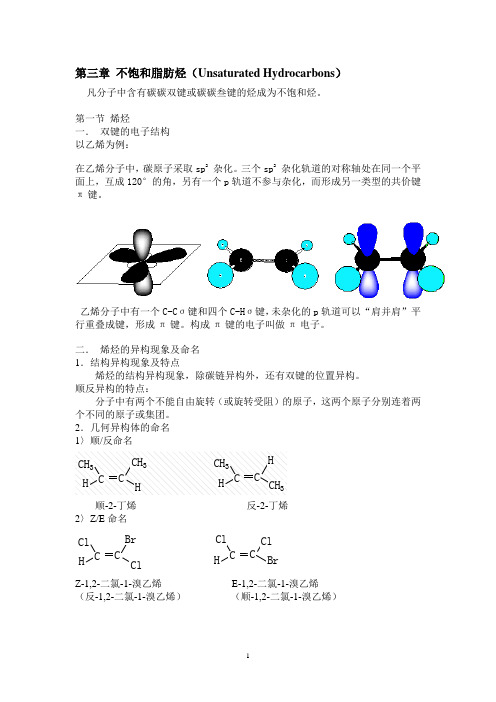
第三章不饱和脂肪烃(Unsaturated Hydrocarbons)凡分子中含有碳碳双键或碳碳叁键的烃成为不饱和烃。
第一节烯烃一.双键的电子结构以乙烯为例:在乙烯分子中,碳原子采取sp2杂化。
三个sp2杂化轨道的对称轴处在同一个平面上,互成120°的角,另有一个p轨道不参与杂化,而形成另一类型的共价键π键。
乙烯分子中有一个C-Cσ键和四个C-Hσ键,未杂化的p轨道可以“肩并肩”平行重叠成键,形成π键。
构成π键的电子叫做π电子。
二.烯烃的异构现象及命名1.结构异构现象及特点烯烃的结构异构现象,除碳链异构外,还有双键的位置异构。
顺反异构的特点:分子中有两个不能自由旋转(或旋转受阻)的原子,这两个原子分别连着两个不同的原子或集团。
2.几何异构体的命名1〉顺/反命名顺-2-丁烯反-2-丁烯2〉Z/E命名Z-1,2-二氯-1-溴乙烯E-1,2-二氯-1-溴乙烯(反-1,2-二氯-1-溴乙烯)(顺-1,2-二氯-1-溴乙烯)思考题:命名下列化合物三.烯烃的化学性质1.加成反应1〉与卤素加成23〉与硫酸加成4〉与水加成5马氏规则:不对称烯烃加成时,氢原子主要加到含氢较多的双键碳原子上。
烯烃加成反应机理——亲电加成2.诱导效应由于某些吸电子基团或斥电子基团的存在,使邻近共价键的极性发生改变,我们说这些基团对该共价键发生了诱导效应。
由吸电子基团引起的诱导效应记作–I;由斥电子基团引起的诱导效应记作+I。
诱导效应的特点:1〉诱导效应的强弱取决于基团的吸电子或斥电子的能力。
2〉诱导效应可以沿共价键传递,但很快消弱,一般间隔三个以上的共价键的影响可忽略不计。
3〉诱导效应有叠加性。
3.马氏规则的解释在不对称烯烃的亲电加成中,亲电试剂总是加到电子密度较高的双键碳原子上。
4.过氧化物效应由于过氧化物(ROOR)的存在,出现反马氏规则现象,这类反应属于自由及加成反应。
5.氧化反应2〉高锰酸钾氧化3〉臭氧氧化由醛酮结构的测定,就可推到原来的结构。
大学有机化学第三章不饱和脂肪烃

01
绿色合成
发展绿色合成方法,减少不饱和脂肪烃 合成过程中的环境污染和资源浪费,是 可持续发展的重要方向。
02
03
循环经济
通过循环利用不饱和脂肪烃,实现资 源的最大化利用,同时降低对环境的 负面影响。
跨学科研究的趋势与展望
化学与其他学科的交叉
不饱和脂肪烃的研究涉及到化学、生物学、医学、材料科学等多个学科领域,跨学科合作将有助于推动不饱和脂肪烃 的深入研究和发展。
烯烃的化学性质主要取决于碳碳双键,可以发生 加成、氧化、聚合等反应。
炔烃
01
炔烃的通式为CnH2n-2,其中含有两个碳碳三键。
02
炔烃的稳定性比烯烃更低,因为碳碳三键更容易受到亲电攻 击。
03
炔烃的化学性质与烯烃相似,但三键的反应活性更高,可以 发生加成、氧化、聚合等反应。
共轭二烯烃
01
02
03
烯烃的合成与转化
烷烃的热裂
在加热条件下,烷烃可以发生热裂反 应,生成烯烃和氢气。
醇的脱水
在酸催化下,醇可以发生脱水反应, 生成烯烃和水。
烯烃的合成与转化
• 炔烃的还原:通过还原炔烃的碳碳三键, 可以得到相应的烯烃。
烯烃的合成与转化
加氢反应
烯烃可以与氢气在催化剂的作用下发生加氢反应,生 成相应的烷烃。
烯烃的1,2-加成反应:在催化剂的作用 下,两个烯烃分子可以发生1,2-加成反 应,生成共轭二烯烃。
共轭二烯烃的转化
04 不饱和脂肪烃在工业和生 活中的应用
工业应用
01 02
塑料和合成橡胶生产
不饱和脂肪烃,如乙烯和丙烯,是塑料和合成橡胶的主要原料。它们通 过聚合反应形成高分子聚合物,广泛应用于包装、建筑材料、汽车部件 等领域。
S03不饱和脂肪烃86页PPT

硫酸氢乙酯
乙醇
C H 3 C H = C H 2 H 1 7 S 0 -℃ 2 O O O-H C3 C HH 3 C H 2 OH C3 C HH 3 C O2 S OO H OH
硫酸氢异丙酯 异丙醇
应用:a. 鉴别、分离;b.间接水合制备醇;
(4)加卤素及水(次卤酸)------生成卤代醇
C H 2 = C H 2+C 2+ lH 2 O
H 3C
C3HH 3C
H
C3C HH=3CHC CH C
CC
2-丁 烯
H
H
顺 -2-丁 烯
H反 -2-丁 烯 C3H
B. Z/E命名法:按次序规则依次对双键碳原子上所 连接基团排序。 比较两个双键碳上的基团大小,大 基团在同侧为Z, 在不同侧为E 。
a
c
CC
a>b
b
d
c>d
a
d
CC
b
c
(Z)-构型
b. 反应取向: Markovnikov(马尔科夫尼可夫)规则
C3 C H 2 C H 2H ② HC X H 3 C H = C H 2H ① X C3 C HH 3 ( 主 C ) H
X
X
Markovnikov规则:H原子加到烯烃含H原子较多 的双键C原子上,卤素加到含H原子较少的双键C 原子上。
(5)加水(遵守马氏规则)
在酸的催化下烯烃可以和水加成生成醇,这个反 应也叫做烯烃的水合反应。是制备醇的方法之一。 对于某些不易直接与水加成的烯烃,则可通过 (3)与硫酸加成再水解得到醇。
CH3 CH=CH2 + H2O
OH
CH3 CH CH3 异丙醇
第三章不饱和脂肪烃

烯键的三个特性 1. 共平面性 2. 双键的不等性 3. σ键、π键 4. 3. 不可旋转性
➢1+1
2. 键和键的比较: (3)电子云的分布:
(1)C=C键的键长:比C—C单键短 电子分布在原子核
(2)重迭程度与键能:
的上下两端,不能
键重迭程度比 键小。键 沿C—C键轴旋转。
易打开,易发生加成反应。 所以有顺反异构体。
CC
+ A-B
象这样的反应叫加成反应。
(1)催化加氢
(2)加卤素——亲电加成反应
CC AB
(3)加卤化氢——马氏规律
(4)加水
(5)加硫酸
(6)加次卤酸
(7)与烯烃加成——烯烃二聚
(8)硼氢化反应
(1)催化加氢
催化剂
HH
C= +H
-C- C-
C
2 Pt或Ni
例:CH2=CH2 + H2 = CH3CH3
C Br Br C
产物有立体选择性
Br C
Br C
象上面Br-Br这种试剂,Brδ+进攻反应物电子云 多的地方,即Br-Br亲近电子云多的地方,这种试 剂叫做亲电试剂,由亲电试剂进攻而发生加成的反 应叫亲电加成反应。
当在溴水中加入NaCl时,发生下面的三个反应都
是可能的:
Br+ CH2 C2H
BrClOH-
§3-1 烯烃
分子中含有碳碳双键C=C的碳氢化合物叫烯烃。
如:
CH2=CH2 CH2=CH-CH3 CH2-
CH=CH2CH3
CnH2n (n≥2)
链状单一烯、烃双的键通的式:结构
二、烯烃的同分异构和命名
三、烯烃的物理性质
有机化学第03章不饱和脂肪烃
H3C C H C Cl H3C CH3 H C C Cl CH3
顺-2-氯-2-丁烯 反-2-氯-2-丁烯 顺式异构体:两个相同原子或基团在双键同一侧的为顺式异构体。 反式异构体:两个相同原子或基团分别在双键两侧的为反式异构体。 顺反异构体产生的条件:⑴ 分子不能自由旋转(否则将变成另外一种分子) ⑵ 双键上同一碳上不能有相同的基团;
CH2 溴嗡离子
反式加成 Nu
-
CH2 + Br CH2 溴嗡离子
Nu
CH2 反式加成产物 CH2 Br
+
Br ,Cl ,H2 O
Nu=Br-,Cl-,H2O
上述反应历程即为亲电加成反应。 亲电加成:亲电试剂进攻引起的加成反应为亲电加成反应。 亲电试剂:缺电子的试剂为亲电试剂。 ⑶ 与卤化氢(HX)加成:
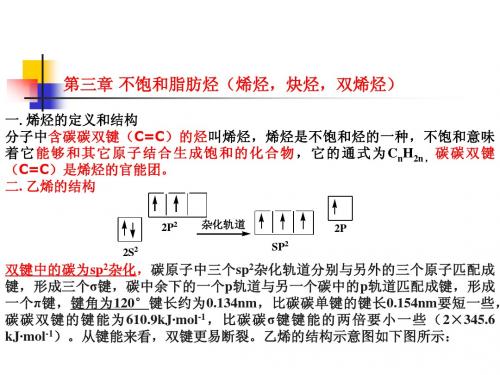
乙烯的结构
乙烯的结构示意图如下图所示:
H C C H H H H C C H H
H
H C H C
H
乙烯的Kekule模型和Stuart模型
H
从上图中可以看出,由于有了π键的存在,碳碳双键就不能象碳碳单键那样 自由旋转。这样含有碳碳双键的化合物就有可能产生顺反异构将在后面介绍。 二、命名 1. 习惯命名法:基本原则同烷烃一样。只要把名称中的“烷”改为“烯”即可。 2. 系统命名法:同烷烃类似。 ⑴ 选主链:选含有双键的碳链作为主链; ⑵ 编号:从距离双键最近的一端开始编号; ⑶ 书写:把双键中碳原子位号较小的编号写在名称“烯”的前面。
一、二烯烃的分类 二烯烃:分子中含两个碳碳双键的烃。通式为CnH2n-2,可分为以下三类: 1.聚集二烯:两个双键连在同一C原子上。例如: H2C C CH2 H2C CH CH CH2 2.共轭二烯:双键与单键间隔。例如: 3.隔离二烯:两碳碳双键被两个以上的单键隔开。例如:H2C CH CH2 CH 二、 命名 与烯烃相同,只是在“烯”前加二。例如下面三个化合物分别命名为: CH CH CH2 H2C CH CH2 CH CH2 H2C C CH2 H2C 丙二烯 1,3-丁二烯 1,4-戊二烯 三、共轭烯烃的结构 上述共轭二烯中C1~C2、C3~C4之间的键长 相同,与单烯烃中的双键键长134pm相近;C2~C3 之间的键长比烷烃中碳碳单键的键长154pm明显要短。 这种现象称为键长的平均化。键长平均化是共轭 二烯烃的共性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Alkenes、Alkynes and Conjugated Dienes
整理ppt
1
第一节 单烯 烃(Alkenes)
一、烯烃的结构特征 二、烯烃的命名 三、烯烃的物理性质 四、烯烃的化学性质 五、烯烃的制备 六、烯烃的来源和用途
整理ppt
2
引言:
烯烃是一类含有碳碳双键( C=C )烃类 化合物,数不饱和化合物。其分子中的氢 原子数比相应碳原子数的烷烃少两个。
a
C=C
b
a
b
a
d
C=C
b
e
a
e
C=C
b
d
a
a
C=C
a
b
a
a
C=C
b
d
a
d
C=C
b
a
a
d
C= C
a
e
整理ppt
15
二 烯烃的命名
主链应含双键 主官能团的位号尽可能小 烯烃存在位置异构,母体名称前
要加官能团位号 > C10称“某碳烯”
整理ppt
16
CH2CH2CH3 CH3 C C CH2
CH3
CH2CH2CH3
5-甲基-2-丙基-1-庚烯
5-Methyl-2-pr整o理ppptyl-1-heptene
18
CH ( C H 3 )2
CH 3 CH 3
3- 异 丙 基 环 己 烯 3 -Iso p ro p y lc y c lo h e x e n e
1,6- 二 甲 基 环 己 烯 1,6-D im ethylcyclohexene
整理ppt
19
使用Z/E标记法时应注意:“Z”虽然有共同、 “E”有相反的意思。但在命名时有时会出现 与“顺反标记法”相矛盾之处。例:
CH3
CH3
C=C
Cl
H
Z/E标记法:E-2-氯-2-丁烯
顺反标记法:顺-2-氯-2-丁烯
I >Br >Cl >S >P >F >O >N >C >D >H
② 多原子基团如果第一个原子相同,则比 较与它相连的其它原子(第二个原子) 的原子序数大小 ,其它依次类推
< C H 2 C H 2 C H 3 C H C H 3
> C H 2 C l C H F 2
C H 3 C ( C 、 H 、 H 、 )C ( C 、 C 、 H ) C ( C l、 H 、 H ) C ( F 、 F 、 H )
bp.0.9℃
整理ppt
8
几何异构(顺反异构)
定义:几何异构是由于(双键的)刚性结构,使 分子中(双键碳原子上所连)的原子或原子团在 空间产生不同的排列方式所引起的异构现象。
这种构造相同、构型不同的异构属立体异构。
两个互为几何异构的物质在组成上相同(分子 是相同),在构造上也相同(原子或原子团的连 接顺序和官能团的位置均相同)。其区别仅在 于原子或基团的空间伸展方向不同。
CH2CH2CH3 3-甲基-3-丙基-1-己烯
3-Methyl-3-propyl-1-hexene
整理ppt
17
CH3(CH2)3CH2
C
H
H
C C
CH3 CHCH2CH2
C
H
H
(4Z,6E)-3-甲基 -4,6 -十二碳二烯
(4Z,6E)-3-Methyl-4,6-dodecadiene
CH3CH2CHCH2CH2C = CH2
H
CH2CH3
Z型
(CH3)2CH
CH3
CC
CH3
CH3
CC
H
CH2CH3 H
CH2CH3
E型
E型
整理ppt
14
存在几何异构的必要条件:构成双键的两个
碳原子上各自连有的原子或原子团必须是不
相同的。即在双键一端的碳上不能连有相同
的两个原子或基团。
a
a
存在几何 C = C
异构的: b
b
a
b
C=C
b
a
不存在几 何异构的:
构型——分子中原子或基团在空间的不同 排列方式。这就产生了空间异构(立体异构) 一种——几何异构(顺反异构)。
整理ppt
7
碳架异构 C-C-C=C;C-C=C
构造异构
C
烯 烃
官能团位
置异构
C-C=C-C
的 异
C
C
C=C
构
H
H
空间异构 几何异构
bp.3.5℃
(立体异构) (顺反异构)
C
H
C=C
H
C
且碳核对π电子的控制较弱,π电子云暴露在分
子平面的上下方,当外界存在一种带有正电荷的
亲电试剂时,很容易受到其攻击。从而打开π键
发生化学反应。
整理ppt
6
烯烃的异构
烯烃和烷烃一样,四个碳以上也存在同分 异构现象。并且其异构现象比烷烃更为复 杂。不仅存在碳架异构,还有由于双键位 置不同而产生的官能团位置异构,统属构 造异构。另外,由于双键的刚性结构,还 存在双键碳原子所连基团在空间不同伸展 方向的排列方式。
整理ppt
11
烯烃的Z, E构型表示法
Z, E异构——根 据次序规则,较 大基团在同侧为 Z–型,不同侧为 E–型
CH 3 CC
H Z型
CH 3 CC
H E型
整理ppt
CH 3 H
H CH 3
12
③ 含双键或叁键的基团, 则作为连有 两个或叁个相同的原子。
(C )(C ) CC H CCH
(C )(C )
C (C H 3 )3
C H 3 CC H 3 C H 3
(C )(C )
C H C H 2 CCH H H
④ 孤对电子最小。 构造相同,R型次序大于S型
次序大的基团称较优基团。
O
O
O
例:-C-OH > -C-R > -C-H > -CH2OH
整理ppt
13
CH3
Br
CC
H Z型
CH3
CH3
Br
CC
H
134pm
CC
110pm
H 121.6
H
116.7
H
烷 烃 : CC154pm CH101 p C C C109.3
整理ppt
5
乙烯的p-键
H
H
HCC H
键 能 :C C 610.9kJ/mol C C 347.3kJ/mol
p键 263.6kJ/mol 碳碳双键具有刚性结构,一般情况不能发生旋转。
整理ppt
9
烯烃的顺反构型表示法
顺反异构—— 相同基团在 双键同侧为 顺式,不同 侧为反式
CH 3 C
CH 3 C
H
H
顺 式 (cis)
CH 3
H
CC
H
CH 3
反 式 (tran s)
整理ppt
10
次序规则的主要内容
① 单原子取代基, 按原子序数大小排列. 原 子序数大, 顺序大;原子序数小, 顺序小; 同位素中质量高的, 顺序大。
烯烃的通式为:CHnH2n。同系差为:CH2。 碳碳双键属烯烃的官能团,是烯烃的反应
中心。
整理ppt3ຫໍສະໝຸດ 一 烯烃的结构特征双键碳的sp2杂化
分子中存在π-键
C=C键长比C — C短
烯烃存在立体异构(顺反异构)
烯烃的分子轨道图形如下:
π2p*
2p
2p
π2p
H
H
C—C
H
H
整理ppt
4
乙烯的键长和键角
